Introducción
El estudio de la fauna silvestre en su medio natural en ocasiones requiere de su captura y manipulación, con el fin de realizar procedimientos que permitan, entre otros, examinar su condición física, determinar su sexo, registrar sus medidas corporales, tomar muestras, trasladar individuos o colocar dispositivos para su identificación y seguimiento. Por ello, es de gran interés, en la investigación, manejo y conservación de especies silvestres, establecer métodos efectivos de inmovilización que faciliten la ejecución de estos y otros procedimientos, que minimicen el estrés que pueda causarle a los animales (1) y reduzcan el riesgo de afectar su supervivencia. A la vez, es importante encontrar métodos de inmovilización que garanticen la seguridad del investigador, de modo que se eviten escapes o mordidas, principalmente cuando los animales manipulados son potencialmente portadores de enfermedades zoonóticas (2).
Algunos animales silvestres pueden ser difíciles de manipular, ya sea por su comportamiento o por sus características físicas. Otros deben ser sometidos a procedimientos que, además de dolor, pueden causar angustia leve o momentánea, por lo cual requieren de una sedación, analgesia o anestesia adecuada. En estos casos la inmovilización química de los individuos puede ser necesaria para un manejo seguro y eficaz (3), por lo que es importante usar drogas anestésicas que provean el efecto apropiado (4). La anestesia debe facilitar la manipulación del animal y la realización de procedimientos dolorosos, con lo que se reduciría al mínimo el sufrimiento asociado a dicha manipulación, se evitarían situaciones dolorosas, de angustia o ansiedad, y, con ello, las consecuencias negativas en la fisiología del animal (5), en beneficio de su bienestar.
En animales de tamaño corporal pequeño, ágiles y con poca actitud colaboradora como en el caso de ratas y ratones, se ha usado preferencialmente la anestesia inhalada para su inmovilización, debido a que la anestesia inyectada puede presentar inconvenientes. Cuando los individuos son muy pequeños, en algunos casos, con la anestesia inyectada vía intramuscular se puede correr el riesgo de afectar accidentalmente el nervio ciático debido a la poca masa muscular (6), mientras que con la anestesia inyectada vía intravenosa se puede correr el riesgo de dañar o perforar la vena (5). La anestesia inhalada también es recomendada en pequeños mamíferos porque generalmente reduce el tiempo de manipulación de los individuos, causa menos estrés en ellos y no existe riesgo de administrar la medicación en un área equivocada (7).
Dentro del grupo de anestésicos inhalados usados en roedores, se encuentran agentes volátiles a base de éter, los cuales pueden ser usados para procedimientos de corta y larga duración, cuyas ventajas y desventajas en la inducción de la anestesia han sido documentadas principalmente en especies criadas en cautiverio o utilizadas en la experimentación en laboratorio (8). Por ejemplo, el éter sulfúrico ha sido recomendado con buenos resultados en ratas (Rattus norvegicus albinus) para procedimientos de corta duración bajo condiciones de laboratorio (9). Asimismo, el éter ha sido recomendado tradicionalmente para anestesiar roedores durante procedimientos cortos, debido a que produce una buena analgesia y relajación muscular (10), además de ser económico, sencillo y fácil de utilizar en pequeñas cantidades (8). Aunque el éter puede producir irritación en la vía aérea, sigue siendo recomendado para procedimientos cortos en roedores, cuando no se cuenta con otros métodos (8).
Por el contrario, la literatura sobre anestesia de roedores en estado silvestre y en condiciones de campo es escasa (11) y poco detallada, principalmente sobre especies pequeñas. Por ejemplo, se conoce el uso de éter etílico en campo para anestesiar individuos silvestres de Oligoryzomys longicaudatus con el fin de tomar muestras sanguíneas (12), aunque no se tienen detalles de su eficacia. También en el estudio de roedores silvestres se tiene registro del uso de otros agentes volátiles más modernos a base de éter. Entre ellos se encuentra el metoxiflurano, el cual ha sido eficaz para tomar muestras en especies como Peromyscus spp., Onychomys leucogaster, Chaetodipus spp., Perognathus flavus, Neotoma spp. y Reithrodontomys megalotis (13,14). De igual forma, el isoflurano se ha usado con buenos resultados en roedores silvestres como Baiomys musculus, Liomys salvini, Oligoryzomys fulvescens, Oryzomys couesi y Sigmodon hispidus (15), y en ratas almizcleras (Ondatra zibethicus) (16). Aunque estos agentes anestésicos modernos son seguros para los animales ya que no producen irritación de la vía aérea, su uso en campo puede estar limitado por el prolongado tiempo de inducción, en el caso del isoflurano (16), o el prolongado tiempo de recuperación, en el caso de metoxiflurano (8), observados en laboratorio.
De otra parte, en Colombia existen 123 especies de roedores silvestres (23 de ellas endémicas) (17), que representan el 25 % de las especies de mamíferos del país. Dentro de este grupo la familia Cricetidae, y en particular la subfamilia Sigmodontinae, es la más diversa y compleja, con miembros que habitan en todos los ambientes terrestres desde el nivel del mar hasta cerca de los 5000 m s. n. m. (18) y con la mayoría de sus géneros (69 de los 86) y especies endémicas de Suramérica (18,19). A pesar de esta diversidad, no existe información detallada sobre el uso de anestésicos en la manipulación de estos roedores silvestres, lo que dificulta, en ocasiones, su estudio bajo condiciones de campo. Debido a que las políticas y normas en los manuales sobre el cuidado y manipulación de animales se basan en procedimientos realizados en laboratorio con animales domesticados (3), su aplicación en animales silvestres puede ser limitada.
En razón de lo anterior, es necesario desarrollar métodos de inmovilización fáciles que permitan la manipulación segura de los individuos cuando se requieran hacer procedimientos en campo o en vida silvestre dentro de investigaciones o programas de monitoreo, manejo y conservación. Por ello, en este estudio se evaluó el uso de la anestesia inhalada con éter diétilico en roedores sigmodontinos bajo condiciones de campo para facilitar su manipulación durante la toma de medidas morfométricas y el marcaje de los individuos con microimplantes dentro de estudios poblacionales (20).
Materiales y métodos
Área de estudio
El estudio se realizó en el Parque Nacional Natural Chingaza, localizado en la cordillera Oriental de los Andes colombianos entre los 4°20’ y 4°51’ N y los 73°30’, y 73°55’ W, en jurisdicción de los departamentos de Cundinamarca y Meta. El parque presenta un amplio rango altitudinal que va desde los 800 hasta los 4020 m s. n. m., aunque la mayoría de su territorio se encuentra sobre los 3300 m s. n. m. (21). La temperatura varía entre 6° y 21 °C, aunque en la mayor parte del parque la temperatura media oscila entre 6,7 y 7,9 °C; por su parte, la humedad relativa sobrepasa el 80 % durante todo el año (22). El parque está conformado por páramos húmedos (71,5 %), bosques andinos (23,1 %), bosques subandinos (4,6 %) y ecosistemas transformados (0,8 %) (23).
Dentro del parque se seleccionaron tres tipos de ambientes: páramo, bosque y mosaico de páramo-bosque. El muestreo en el páramo se realizó en el sector de Laguna Seca (4º41’03,1” N, 73º45’58,9” W) a una altitud de 3345 m s. n. m. Esta zona se caracteriza por ser un ambiente abierto, de pocos estratos, mantillo escaso y suelo poco consolidado, con el predominio de vegetación arbustiva, arbustos dispersos y predominio de frailejonales (Espeletia grandiflora), chusque (Chusquea tessellata) y pajonales (Calamagrostis effusa). El muestreo en el ambiente de bosque se realizó en la porción de bosque de la Reserva Biológica Encenillo (4°35’51,4” N, 73°43’10,7” W), a una altitud de 3182 m s. n. m. Este se caracteriza por ser un ambiente cerrado, pluriestratificado, complejo y con predominio de árboles de Weinmannia rollottii y Miconia cundinamarcensis, arbustos de Cyathea spp., Sessea corymbiflora y Miconia cundinamarcensis, y un estrato grueso de abundante hojarasca y mantillo; así como un suelo bien consolidado.
Por su parte, el muestreo en el ambiente de mosaico (mezcla de la vegetación de páramo y del bosque) se realizó en el sector Las Ciervas (4°37’47,2” N, 73°43’57,9” W), a una altitud de 3171 m s. n. m.; en cuyo estrato arbustivo dominan Escallonia myrtilloides, Pernettya prostrata y Diplostephium floribundum y se presentan algunos sectores de Espeletia grandiflora, Baccharis spp. y Calamagrostis effusa. En el estrato arbóreo dominan Weinmannia rollottii, Miconia ligustrina y Clusia multiflora, entre otras especies (20).
Capturas
Durante doce meses se realizó un muestreo de roedores en los tres tipos de ambientes: bosque, páramo y mosaico de páramo-bosque. En cada uno de los ambientes, se instalaron 81 trampas (37,7 cm x 12,0 cm x 10,5 cm y 7,6 cm x 8,9 cm x 22,9 cm, Sherman® plegables de aluminio) distribuidas cada 10 m, las cuales conformaron parcelas de muestreo de 80 m x 80 m (0,64 ha). Se realizó un esfuerzo de muestreo total 69 984 horas/trampa por parcela, 209 952 horas/trampa totales, 864 horas por parcela y 2592 horas totales. Como cebo se utilizó una mezcla de grasa animal (cerdo y res), maní tostado y molido, avena en hojuelas y esencias de frutas (banano, vainilla, manzana y coco).
Anestesia y manipulación
Para inducir a la anestesia, cada individuo capturado fue llevado directamente desde la trampa Sherman a una bolsa plástica transparente de cierre hermético de 40 cm de alto x 25 cm de ancho, que sirvió como cámara anestésica. Inmediatamente, se introdujo un trozo de algodón impregnado con aproximadamente 1,5 ml de éter dietílico. El volumen del éter fue controlado con el fin de no utilizar cantidades innecesariamente altas y lograr así una anestesia superficial y no quirúrgica. En la inducción, la pérdida del reflejo pedal y pérdida del tono muscular de los individuos se utilizaron como indicador del nivel de anestesia. Se buscó una anestesia superficial que permitiera la manipulación segura de los individuos, de manera que no se presentaran complicaciones, como depresión respiratoria, que llevaran a su muerte.
A todos los individuos se les registró el tiempo de inducción y el tiempo de recuperación de la anestesia. El tiempo de inducción fue considerado como el intervalo de tiempo en segundos, transcurridos desde la colocación de algodón impregnado dentro de la cámara anestésica, hasta el momento en que el animal adquiriera la posición decúbito lateral o postración. El tiempo de recuperación fue medido como el intervalo de tiempo transcurrido hasta que el animal se recuperó de la posición decúbito lateral y se puso en posición erguida y parado en sus cuatro extremidades, con la habilidad para mantenerse nuevamente en una postura erguida y deambular (16).
Los individuos anestesiados se retiraron de la cámara anestésica y se colocaron sobre una mesa de madera construida en campo, cerca al lugar de captura. Allí se midieron las variables morfológicas y el peso corporal y se identificaron preliminarmente las especies con base en claves y descripciones taxonómicas (24,25,26,27,28,29,30,31). Adicionalmente las muestras se compararon con ejemplares de referencia que habían sido recolectados previamente y determinados en la colección de mastozoología del Instituto de Ciencias de la Universidad Nacional de Colombia con el apoyo de los curadores y especialistas.
Cada individuo fue marcado con un microchip (AVID®), implantado subcutáneamente detrás de la escápula izquierda, usando una aguja hipodérmica modificada calibre 12; para su lectura se utilizó un lector portátil (Minitracker AVID®). Durante el procedimiento se evitaron ruidos y otros estímulos que afectaran a los animales anestesiados. Una vez los individuos recuperaron el movimiento fueron liberados en los lugares de su respectiva captura, previa confirmación de su buen estado de salud y de que sus reflejos fueran normales.
Durante la captura, anestesia y manipulación de los individuos, se siguieron los lineamientos de la American Society of Mammalogists referentes al uso de mamíferos silvestres en la investigación y enseñanza, que tiene en cuenta, entre otros, el uso de la inmovilización química para facilitar los procedimientos y proteger de lesiones tanto al animal como al investigador (3). Este estudio se realizó con el permiso de investigación científica en diversidad biológica PIDB DTOR 023-12, de la división de Parques Nacionales Naturales del Ministerio de Ambiente y Desarrollo Sostenible de Colombia.
Análisis de datos
Se probaron los supuestos de normalidad (Kolmogorov-Smirnov) y homogeneidad de varianza (prueba de Bartlett) para el tiempo de inducción y tiempo de recuperación de la anestesia, previa transformación logarítmica de los datos en algunos casos (anexo 1). Se realizaron análisis de varianza trifactorial (Anova modelo I), junto con pruebas a posteriori de los intervalos de mínima diferencia significativa del 95 % (LSD 95 %) para analizar si existían diferencias en el tiempo de inducción de la anestesia entre especies, ambientes y sexos. De igual forma, se realizó un análisis de varianza (Anova modelo I) de dos vías para determinar si existían diferencias en el tiempo de recuperación de la anestesia entre los ambientes y entre los sexos. La comparación del tiempo de recuperación entre especies fue hecha con un análisis de Kruskall-Wallis y gráficos de cajas y bigotes (Box & Wiskers), debido a que los datos no fueron normales ni homocedásticos (anexo 2). En los análisis tanto de los tiempos de inducción como de recuperación se usaron valores medidos a cada uno de los individuos capturados o recapturados de cada especie, de cada sexo o en cada ambiente, y no sus medias (tablas 1 y 2).
Por último, se calculó el porcentaje de mortalidad para todo el estudio, teniendo en cuenta el número de individuos que murieron durante la captura, administración de la anestesia y la manipulación. Estos individuos fueron depositados en la colección mastozoológica del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia.
Resultados
Durante 604 ocasiones se capturaron 289 individuos pertenecientes a seis especies de sigmodontinos: Microryzomys minutus, Neomicroxus bogotensis, Thomasomys laniger, Thomasomys niveipes, Thomasomys aureus y Rhipidomys spp. Los roedores capturados tuvieron pesos que oscilaron entre 7,40 y 130,4 g (M. minutus, 14,58 ± 3,34 g; N. bogotensis, 14,71 ± 2,86 g; T. laniger, 34,64 ± 5,04 g; T. niveipes, 42,91 ± 8,35 g; T. aureus, 109,85 ± 13,99 g; Rhipidomys spp., 47 g). Se realizaron comparaciones del tiempo de inducción y tiempo recuperación de la anestesia únicamente entre cuatro especies (M. minutus, N. bogotensis, T. laniger y T. niveipes), debido a que los datos para T. aureus y Rhipidomys spp. no fueron suficientes para su análisis.
El tiempo promedio de inducción para las cuatro especies de sigmodontinos analizadas fue menor de 63 s, aunque algunos individuos presentaron tiempos de inducción hasta de 167 s después de ser colocados dentro de la cámara anestésica (tabla 1). Por otra parte, el tiempo promedio de recuperación de las especies de sigmodontinos fue inferior a 128 s, aunque algunos individuos tuvieron tiempos de recuperación hasta de 387 s (tabla 2).
Tabla 1 Tiempo de inducción (segundos) de la anestesia para cuatro especies de roedores sigmodontinos anestesiados con éter dietílico en el PNN Chingaza
| Tiempo de inducción (s) | |||||
|---|---|---|---|---|---|
| n | Media ± sd | Min - Max | |||
| Especies | Microryzomys minutus | 87 | 49,33 ± 27,62 | 11 - 134 | F3; 552 = 9,36; p < 0,05 |
| Neomicroxus bogotensis | 54 | 50,63 ± 23,45 | 21 - 119 | ||
| Thomasomys laniger | 192 | 61,55 ± 29,90 | 14 - 167 | ||
| Thomasomys niveipes | 219 | 62,30 ± 26,71 | 10 - 165 | ||
| Ambientes | Bosque | 136 | 58,60 ± 27,65 | 11 - 165 | F2; 551 = 0,51; p = 0,6019 |
| Mosaico | 172 | 58,20 ± 29,74 | 17 - 167 | ||
| Páramo | 243 | 59,60 ± 27,31 | 10 - 165 | ||
| Sexos | Macho | 360 | 59,12 ± 27,61 | 11 - 167 | F1; 550 = 0,02; p = 0,8981 |
| Hembra | 190 | 58,43 ± 29,19 | 10 - 167 | ||
sd = Desviación estándar
** Diferencia significativa
Fuente: elaboración propia.
Tabla 2 Tiempo de recuperación en segundos de la anestesia para cuatro especies de roedores sigmodontinos anestesiados con éter dietílico en el PNN Chingaza
| Tiempo de inducción (s) | |||||
|---|---|---|---|---|---|
| n | Media ± sd | Min - Max | |||
| Especies | Microryzomys minutus | 86 | 85,84 ± 47,97 | 13 - 206 | F = 9,59; p = 0,022 |
| Neomicroxus bogotensis | 53 | 85,68 ± 60,69 | 14 - 260 | ||
| Thomasomys laniger | 194 | 127,03 ± 113,94 | 5 - 387 | ||
| Thomasomys niveipes | 209 | 107,95 ± 77,17 | 6 - 379 | ||
| Ambientes | Bosque | 125 | 118,95 ± 117,73 | 5 - 354 | F2,541 = 0,25; p = 0,7805 |
| Mosaico | 181 | 110,70 ± 83,68 | 8 - 367 | ||
| Páramo | 235 | 102,98 ± 73,41 | 6 - 379 | ||
| Sexos | Macho | 353 | 109,64 ± 92,45 | 5 - 354 | F1; 550 = 0,02; p = 0,8981 |
| Hembra | 188 | 108,18 ± 82,08 | 10 - 387 | ||
sd = desviación estándar
Fuente: elaboración propia.
El tiempo de inducción de la anestesia fue diferente entre M. minutus, N. bogotensis, T. laniger y T. niveipes (F3; 552 = 9,36; p < 0,05), y fue mayor el tiempo de inducción para los individuos de T. niveipes y menor para M. minutus (figura 1a, tabla 1). Por el contrario, el tiempo de inducción de la anestesia en los individuos fue similar entre los ambientes (F2; 551 = 0,51; p = 0,601, figura 1b), así como entre machos y hembras (F1; 550 = 0,02; p = 0,898; figura 1c).
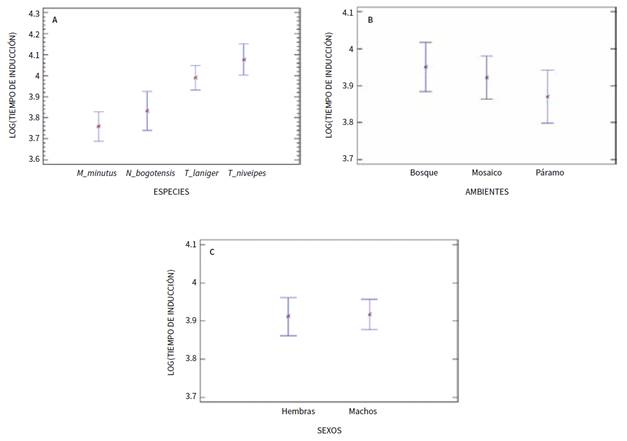
Fuente: elaboración propia
Figura 1 Comparación del tiempo de inducción de la anestesia (segundos) mediante intervalos LSD del 95 % entre A: especies; B: ambientes, y C: sexos en roedores sigmodontinos.
De otra parte, el tiempo de recuperación de la anestesia fue diferente entre especies (H = 9,59; p = 0,022), siendo mayor el tiempo de recuperación en T. laniger y menor en N. bogotensis (figura 2a, tabla 2). Por el contrario, el tiempo de recuperación de los individuos fue similar entre ambientes (F2; 541 = 0,25; p = 0,7805, figura 2b) y entre machos y hembras (F1; 541 = 0,09; p = 0,7662; figura 2c).
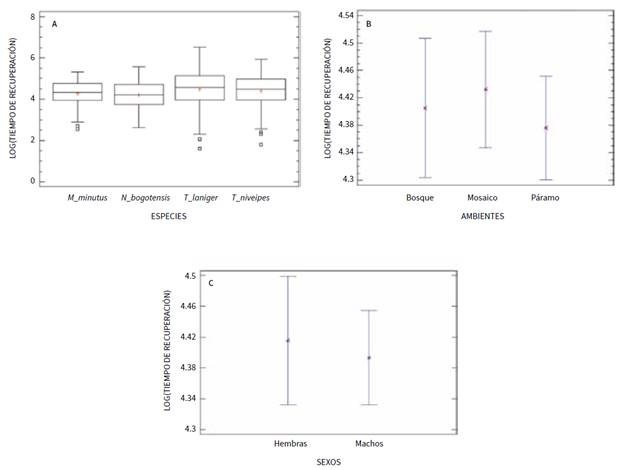
Fuente: elaboración propia
Figura 2 Comparación del tiempo de recuperación de la anestesia (segundos) entre A: especies; B: ambientes, y C: sexos en roedores sigmodontinos.
Trece individuos murieron durante el procedimiento de captura, anestesia y manipulación, a partir de lo cual se obtuvo en todo el estudio una mortalidad del 4,5 %. Los demás individuos se recuperaron de la anestesia satisfactoriamente y sin inconvenientes. Durante todo el procedimiento no se presentaron comportamientos o reacciones negativas en los individuos como secreciones mucosas, vómito, complicaciones respiratorias o cardíacas que indicaran inconvenientes con la anestesia. Ningún animal presentó vómito una vez se recuperó de la anestesia. El tiempo de anestesia fue suficiente para manipular el animal, registrar las medidas corporales y colocar el microimplante en cada individuo.
Un total de 115 individuos de cuatro especies de sigmodontinos (M. minutus, N. bogotensis, T. laniger y T. niveipes) fueron recapturados en varias ocasiones desde uno hasta seis meses después de ser anestesiados por primera vez. Thomasomys niveipes fue la especie que tuvo mayor porcentaje de recapturas (55,55 %), con un mismo individuo recapturado hasta 11 veces (tabla 3). Los individuos recapturados no presentaron alteraciones en su comportamiento o aspecto físico que indicaran una afectación por la anestesia con éter, por la inserción del microimplante o por la manipulación en las capturas anteriores. Todos los individuos recapturados tuvieron comportamientos similares a los observados en la primera captura o en las recapturas posteriores.
Tabla 3 Recapturas de roedores sigmodontinos anestesiados con éter dietílico en el PNN Chingaza
| Especies | Individuos capturados anestesiados | Individuos recapturados | Porcentaje de recapturas | Número máximo de recapturas por individuo |
|---|---|---|---|---|
| Neomicroxus bogotensis | 42 | 11 | 26,19 | 5 |
| Microryzomys minutus | 65 | 20 | 30,77 | 7 |
| Thomasomys laniger | 95 | 39 | 41,05 | 8 |
| Thomasomys niveipes | 81 | 45 | 55,55 | 11 |
| Thomasomys aureus | 4 | 0 | 0 | - |
| Rhipidomys spp. | 2 | 0 | 0 | - |
Fuente: elaboración propia.
Discusión
El tiempo medio de inducción anestésica de roedores sigmondontinos con éter dietílico en campo fue similar al valor que se ha registrado para roedores en laboratorio, cuyo tiempo de inducción anestésica se alcanza entre 60 y 180 s con agentes inhalatorios (5). Las especies de roedores sigmodontinos con menores pesos corporales capturadas en Chingaza fueron las que presentaron un menor tiempo de inducción y se recuperaron más rápido, en comparación con las especies de mayor peso corporal. Esta diferencia posiblemente se debe a que las especies de roedores más pequeñas tienen una menor capacidad pulmonar, por lo que se logra rápidamente una anestesia ligera (8), lo que reduce también su tiempo de recuperación (5). Debido a que el éter es un anestésico inhalado, el organismo requiere de una desintoxicación mínima al ser eliminado a través de la expiración por los pulmones (10) y al no tener un efecto acumulativo se logra un despertar más rápido (32).
En el presente estudio, tanto el tiempo de inducción como de recuperación de ratones sigmodontinos anestesiados con éter dietílico en campo no varió entre los tres tipos de ambientes, por lo que al parecer las características particulares de cada ambiente no afectan la respuesta de los roedores al anestésico. Asimismo, tanto el tiempo de inducción como de recuperación de la anestesia no variaron entre machos y hembras. Un comportamiento distinto se ha encontrado en ratones de laboratorio cuando se utilizan otros anestésicos como el pentobarbital vía intraperitoneal, ya que los ratones machos son menos susceptibles a este anestésico que las hembras y, en algunas cepas, los machos duermen más tiempo que las hembras cuando se usa la misma dosis (8).
Tanto los tiempos de inducción como de recuperación de la anestesia con éter dietílico en sigmodontinos fueron inferiores a los encontrados con otro tipo de agente anestésico inhalatorio en roedores silvestres y de laboratorio. Por ejemplo, en ratas almizcleras silvestres (Ondatra zibethicus) se ha registrado un tiempo aproximado de 1236 s (20,6 ± 2,9 minutos) en la inducción anestésica y de 534 a 684 s (8,9 a 11,4 minutos) en su recuperación al emplear en campo isoflurano (16). En ratas de laboratorio (Rattus norvegicus albinus) se han encontrado tiempos de inducción entre 600 y 5400 s (10 y 90 minutos) y tiempos de recuperación de la anestesia entre 240 y 600 s (4 y 10 minutos) al usar éter sulfúrico (9). Por lo anterior, el uso de éter dietílico podría ser más apropiado en campo cuando solo se requieren hacer procedimientos de corta duración en pequeños mamíferos terrestres.
De otra parte, en el presente estudio la mortalidad de sigmodontinos en campo debida a la captura, manipulación y anestesia con éter dietílico fue baja y comparativamente menor o similar a la registrada en otros roedores. En cobayas (Cavia spp.) anestesiados con éter inhalado, por ejemplo, se ha registrado una mortalidad del 8 % (8), mientras que, en ratas almizcleras (Ondatra zibethicus) anestesiadas con isoflurano en campo, se ha registrado una mortalidad del 3,3 % (16). En varias especies de roedores heterómidos y cricétidos (Neotominae) anestesiados en campo con metoxiflurano se han encontrado mortalidades hasta del 18,2 % (13,14).
Aunque en este estudio no se realizaron necropsias, la mortalidad de los individuos en campo posiblemente estuvo relacionada con el estrés sufrido en la captura, manipulación y anestesia, o con patologías que no fueron evidentes. Solo en unos pocos casos, los animales que murieron mostraron alguna dificultad respiratoria en el momento de la anestesia, debido posiblemente a alguna condición que ya traían en el momento de la captura. En las poblaciones de roedores silvestres, algunos individuos tienen poca tolerancia al estrés físico y fisiológico ocasionado por la captura y la manipulación por parte de humanos, lo cual puede llevar a su muerte (16). Además, algunos individuos son susceptibles a morir en el trampeo porque son viejos o débiles, porque presentan enfermedades y parásitos, o porque son individuos no residentes que pueden estar desnutridos (16). La mortalidad también puede estar relacionada con estados de hipotermia, ya que esta es una complicación frecuente durante la anestesia que posiblemente causa el retraso en la recuperación de algunos individuos (5) y puede llevar a su muerte. En el caso de los roedores, la pérdida del calor es elevada debido a que la superficie corporal es proporcionalmente mayor cuanto menor es el tamaño del animal (8). En un ambiente controlado de laboratorio, una rata anestesiada puede perder en una hora entre 7 y 10 °C (5) y un ratón anestesiado entre 5 y 9 °C (32), por lo que, en campo, donde no se tiene un control de la temperatura, la pérdida de calor puede ser mayor y podría ocasionar la muerte por hipotermia, particularmente cuando las condiciones ambientales son frías y húmedas (2).
La baja mortalidad de individuos en este estudio y el alto número de eventos de recapturas obtenidos en un amplio periodo de tiempo indican que el éter dietílico no afecta significativamente la supervivencia de los roedores sigmodontinos. Asimismo, la recaptura frecuente de un mismo individuo durante diferentes periodos de muestreo, sin evidenciar anomalías en su salud o comportamiento, indica también que la anestesia con éter dietílico no tiene un efecto negativo sobre estos roedores. Por tales razones, el éter dietílico podría ser usado en investigaciones que requieran hacer un seguimiento y monitoreo de pequeños roedores silvestres en campo.
La anestesia inhalada, además de proporcionar bienestar a los animales, evita el riesgo de trasmisión de enfermedades a los investigadores por posibles mordidas ocasionadas por animales nerviosos, como los roedores (14). Por ello, probablemente es la opción más versátil para obtener una anestesia fiable y de rápida recuperación de los individuos durante procedimientos cortos en investigaciones ya sea en laboratorio (5) o en campo (3). A través del tiempo, la anestesia inhalada ha demostrado ser segura y confiable en roedores, porque ofrece más control sobre su duración y profundidad (33).
El éter ha sido un agente utilizado tradicionalmente para inducir la anestesia por inhalación en ratones debido a su bajo costo y fácil uso (8), ya que se vaporiza fácilmente empleando equipos sencillos y baratos (5). Aunque este anestésico ha sido reemplazado por otros agentes inhalatorios más modernos, es usado en algunas ocasiones debido a su bajo costo y a la relativa seguridad para el animal ya que tiene efectos fisiológicos mínimos en algunos parámetros (33). El éter ha sido recomendado como excelente agente anestésico en Rattus norvegicus, por sus efectos cardiovasculares y metabólicos casi nulos y a que produce una adecuada relajación muscular (6), además de una buena analgesia (10).
El éter es seguro para el investigador cuando se usa en bajos volúmenes, ya que el transporte de una pequeña cantidad evita las complicaciones que han sido atribuidas por el carácter explosivo de grandes cantidades. Asimismo, al ser usado en ambientes abiertos que brindan buena ventilación, como en condiciones de campo, se evita la afectación al investigador por su olor.
El éter dietílico puede ser un agente inhalatorio seguro y efectivo para su uso en vida silvestre, ya que, en los roedores sigmodontinos de este estudio, proporcionó niveles de anestesia cortos, pero suficientes para manipular a los individuos, tomar medidas corporales e implantar microchips de forma segura, sin que se tuviera que recurrir a una etapa de mantenimiento adicional de la anestesia, la cual podría llevar a efectos adversos. Al no requerir periodos de mantenimiento de la anestesia se evita la irritación de la vía aérea, que puede llevar una excesiva mucosidad, edema pulmonar y obstrucción de las vías de ventilación (8), lo que causa complicaciones respiratorias o cardíacas durante el procedimiento. La sobredosis de este anestésico es evitada al retirar al individuo de la cámara anestésica una vez se alcance el nivel de anestesia superficial.
De acuerdo con los resultados del presente estudio, el éter dietílico puede ser recomendado para anestesiar roedores sigmodontinos cuando se requiera su manipulación en campo durante procedimientos cortos, ya que no afecta significativamente la supervivencia de los individuos, ni su recaptura. Por ello, este tipo de anestésico inhalado puede ser usado para el monitoreo de los individuos a largo plazo. Sin embargo, no se recomienda el uso de éter para procedimientos largos o con fines quirúrgicos como lo indica la literatura, por los inconvenientes que pueden presentarse al tratar de mantener los tiempos para una anestesia quirúrgica.
Conclusiones
Tanto el tiempo de inducción como el tiempo de recuperación de la anestesia con éter dietílico fueron diferentes para las especies de sigmodontinos. Los tiempos de inducción y de recuperación son mayores para las especies de tamaño corporal más grande en comparación con especies de menor tamaño. Sin embargo, no hay diferencia en los tiempos de inducción y recuperación entre hembras y machos; ni entre los ambientes estudiados.
La anestesia de sigmodontinos con éter dietílico no afectó la sobrevivencia de los individuos ni su recaptura, ya que se obtuvo un porcentaje bajo de mortalidad y los individuos fueron capturados en varias ocasiones durante un largo periodo de tiempo.
Para reducir el dolor o la molestia que puede causar la implantación de marcas como microchips, recomendamos el uso de un anestésico inhalado como el éter dietílico, ya que se obtienen tiempos de inducción y recuperación cortos, por lo que se puede liberar a los individuos rápidamente, con lo que se reduce el estrés causado durante el procedimiento. Además, se reduce el riesgo que los investigadores sean mordidos durante la manipulación de los individuos.
En el presente estudio, el éter dietílico fue seguro y efectivo para la anestesia inhalatoria de roedores sigmodontinos en campo, ya que, además de ser económico y de fácil empleo, proporcionó niveles de anestesia suficientes para manipular a los individuos, tomar medidas corporales e implantar microchips, sin que se necesitara de una etapa de mantenimiento de la anestesia por un largo periodo que pudiera llevar a efectos adversos.
La anestesia inhalatoria puede ser una opción rápida para anestesiar en campo a pequeños roedores como los sigmodontinos y podría ser utilizada en programas de monitoreo de la población, donde se necesite manipular los individuos sin afectar su supervivencia.















