Introducción
Una infección se origina producto del desequilibrio entre la virulencia del patógeno y la resistencia del hospedero, el cual resulta invadido por microorganismos patógenos (1). Estas infecciones pueden ocurrir en cualquier lugar, incluso dentro de un hospital, y son conocidas con el nombre de infecciones nosocomiales (IN) (2). Estas se manifiestan clínicamente 48 a 72 horas luego de la atención hospitalaria o alta médica, incluso el 25-30 % de estos casos pueden aparecer hasta un mes después (3). Se estima que entre el 5 y 10 % de los pacientes ingresados en los hospitales humanos desarrollan una IN (4), mientras que, en un estudio realizado a 38 hospitales docentes veterinarios entre 2003-2008, se denunció al menos un brote de IN en el 82 % de ellos (5).
Las infecciones, según la procedencia del microorganismo, pueden clasificarse en endógenas y exógenas. En las primeras, los microorganismos provienen del propio sujeto, principalmente de la piel, flora orofaríngea y del tracto gastrointestinal (5). La forma exógena, proviene del personal sanitario y del ambiente de la sala, equipamiento y dispositivos médicos (5).
En medicina humana, se encuentra detallada la diferenciación de áreas o materiales en tres zonas: críticas, semicríticas y no críticas (6). Los materiales o zonas críticas son aquellas que presentan un altísimo riesgo de infectar, si se genera la contaminación de los instrumentos (6). Los materiales semicríticos son aquellos que se encuentran en contacto directo con mucosas y piel con soluciones de continuidad, o con mucosas intactas. Por último, los materiales no críticos son los que se encuentran en contacto directo con piel indemne (6).
Está demostrado que la principal fuente de infección corresponde a las manos del personal médico, debido a su inadecuada desinfección durante la manipulación de los pacientes (7). Tanto las manos como las prendas del personal médico durante la atención del paciente, ya sea al administrar medicamentos, por el contacto con las mucosas o al realizar la limpieza del paciente, permiten propagar las bacterias en el hospital y hacia otros pacientes (7).
En medicina veterinaria, las bacterias nosocomiales no difieren mucho de las humanas (8,9,10,11). Las especies habitualmente aisladas corresponden a Staphylococcus aureus, Acinetobacter baumannii, Pseudomona aeruginosa, Enterococcus faecalis y Enterococcus faecium, donde el 70 % es usualmente resistente a un antibiótico (12).
En Chile se cuenta con poca información al respecto; un antecedente es lo publicado por Jara et al. (7). Debido a la escasa información existente, se realizó el presente estudio en una clínica veterinaria de la ciudad de Concepción, con el objetivo de identificar cepas bacterianas presentes en objetos y superficies, además de determinar su grado de resistencia antimicrobiana.
Materiales y métodos
Se tomaron muestras a 20 objetos (n = 40), previas al proceso de desinfección de la clínica y provenientes de diferentes áreas y utensilios, considerando la diferenciación de áreas dentro del hospital. Seis de ellas fueron obtenidas de zonas críticas: 2 de mesón, 2 de bandeja de material quirúrgico y 2 de bandeja para material de curaciones; 18 de la zona semicrítica: 2 de bozal de la sala de procedimientos menores, 2 en manos, 2 de fonendoscopio, 2 de depiladora, 2 de termómetros y 8 de mesón de sala de consulta y procedimientos; y 16 de la zona menos crítica: 4 de jaulas fijas y de transporte, 4 de suelo, 4 de paredes de la zona de hospitalizados y consultas, y 4 de báscula digital.
Para la recolección de muestras, se aplicó el método del hisopado con plantillas de 5 x 5 cm, mediante tórulas estériles humedecidas en 0,5 ml de suero fisiológico. Las muestras fueron transportadas en medio Stuart al Laboratorio de Microbiología de la Universidad Santo Tomás, sede Concepción, donde fueron traspasadas a tubos de ensayo con 5 ml de caldo tripticasa de soya (Merck) e incubadas a 37 ºC, durante 24 horas en condiciones de aerobiosis (13). Para el aislamiento bacteriano, de los tubos que mostraron turbidez, se sembró una alícuota en agar soya tripticasa sangre y MacConkey. Las placas fueron incubadas a 37 °C por 48 horas en aerobiosis. Tras la lectura de las placas se procedió a elegir colonias de interés por su morfología, tamaño, hemolisis, pigmentación, entre otros, y se realizó tinción de Gram. El recuento de bacterias totales se expresó en unidades formadoras de colonias por área (ufc/cm2).
La identificación bacteriana se llevó a cabo según lo propuesto por MacFadin (14), que se basó en las características de las colonias y el resultado de pruebas bioquímicas estandarizadas.
Las cepas aisladas fueron sometidas a la determinación de su perfil de susceptibilidad antimicrobiana, mediante el método difusión en placa (15). Los antibióticos evaluados fueron amikacina, gentamicina, amoxicilina, cloxacilina, amoxicilina + ácido clavulánico, sulfametoxazol, ceftazidima, clindamicina, enrofloxacina y metronidazol. Diámetros de los halos inhibitorios fueron obtenidos de la clasificación del Clinical and Laboratory Standards Institute (16,17). Se consideró como cepa multirresistente a aquella con resistencia a tres o más antibióticos (18). Los resultados se presentaron mediante frecuencias porcentuales.
Resultados
Se obtuvo crecimiento bacteriano en el 85 % (17/20) de los objetos, con cargas bacterianas que fluctuaron entre 0 y 1,89 x 103 ufc/cm2 (tabla 1). Únicamente en dos muestras (10 %), correspondientes a la jaula fija y a la depiladora, se evidenciaron recuentos microbiológicos por sobre 103 ufc/cm2.
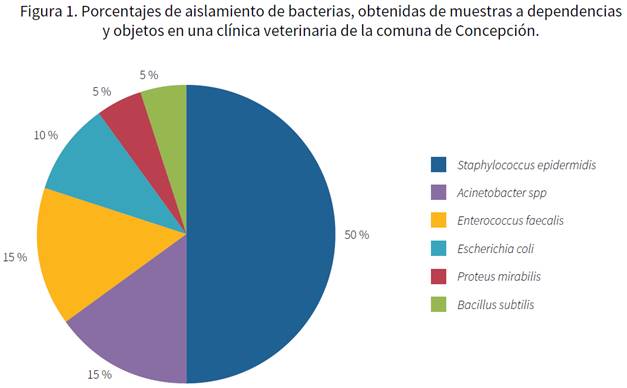
Se aisló un total de 39 cepas bacterianas, que correspondieron un 50 % a Staphylococcus epidermidis, 15 % a Acinetobacter spp., 15 % a Enterococcus faecalis, 10 % a Escherichia coli, 5 % a Proteus mirabilis y un 5 % a Bacillus subtilis (figura 1). Todas las cepas presentaron algún tipo de resistencia a los antibióticos, y el metronidazol representó el mayor nivel de resistencia (100 %) (tabla 2). En el caso de Gram positivos, se observó una resistencia a cloxacilina y cefatzidina, mientras que, para Gram negativos, fue ceftazidina y sulfametoxazol (tabla 2).
Fuente: elaboración propia
Figura 1 Porcentajes de aislamiento de bacterias, obtenidas de muestras a dependencias y objetos en una clínica veterinaria de la comuna de Concepción.
Tabla 1 Origen físico de las muestras, categorización de zona según riesgo, carga bacteriana (unidades formadoras de colonias - ufc/cm2) y aislamiento bacteriano presente en dependencias y objetos de una clínica veterinaria de la comuna de Concepción, Chile
| Origen físico de la muestra | Categorización | ufc/cm2 | Especie bacteriana |
|---|---|---|---|
| Bandeja de material quirúrgico | Crítico | 0 | B. subtilis |
| Mesón de pabellón | Crítico | 1,42 x 102 | S. epidermidis-B. subtilis |
| Mesón de sala consulta (superficie) | Crítico | 0 | E. coli-B. subtilis |
| Mesón de sala consulta (borde) | Semicrítico | 1 | S. epidermidis-B. subtilis |
| Mesón de procedimientos menores (borde) | Semicrítico | 5 | E. faecalis-S. epidermidis - B. subtilis |
| Depiladora | Semicrítico | 1,89 x 103 | E. coli-B. subtilis |
| Fonendoscopio | Semicrítico | 4 | S. epidermidis-B. subtilis |
| Manos | Semicrítico | 3,90 x 101 | S. epidermidis-B. subtilis |
| Bozal | Semicrítico | 1,30 x 101 | S. epidermidis-B. subtilis |
| Termómetro | Semicrítico | 7,90 x 101 | E. faecalis-S. epidermidis - B. subtilis |
| Mesón de procedimientos menores (superficie) | Semicrítico | 0 | E. faecalis-B. subtilis |
| Báscula digital | No crítico | 1 | B. subtilis |
| Jaula fija | No crítico | 1,67 x 103 | Acinetobacter sp.-B. subtilis |
| Jaula de transporte | No crítico | 5,73 x 102 | S. epidermidis - B. subtilis |
| Suelo sala hospitalizados | No crítico | 4 | P. mirabilis - B. subtilis |
| Suelo del pabellón | No crítico | 1,10 x 101 | B. subtilis |
| Suelo de recepción | No crítico | 3,90 x 101 | Acinetobacter sp. - B. subtilis |
| Pared de hospitalizados | No crítico | 2,25 x 102 | S. epidermidis - B. subtilis |
| Pared de consulta | No crítico | 1 | B. subtilis |
| Suelo de procesos menores | No crítico | 8 | Acinetobacter sp. - B. subtilis |
Fuente: elaboración propia.
Tabla 2 Porcentaje de susceptibilidad antimicrobiana a diferentes antibióticos en cepas encontradas en instalaciones, materiales y equipo de una clínica veterinaria en Concepción, Chile
| Antibiótico | Resistente (%) | Sensibilidad intermedia (%) | Sensible (%) |
|---|---|---|---|
| Amikacina | 18 | 65 | 17 |
| Gentamicina | 0 | 0 | 100 |
| Amoxicilina | 12 | 0 | 88 |
| Cloxacilina | 88,2 | 5,8 | 6 |
| Amoxicilina + a. clavulánico | 19 | 0 | 81 |
| Sulfametoxazol | 76.4 | 0 | 23,5 |
| Ceftazidima | 88,0 | 0 | 12 |
| Clindamicina | 70,5 | 17,5 | 12 |
| Enrofloxacina | 53 | 12 | 35 |
| Metronidazol | 100 | 0 | 0 |
Fuente: elabración propia.
Discusión
La mitad de las muestras obtenidas en el presente estudio presentaron un recuento que no superó las 1,89 x 103 ufc/cm2, es decir, se encuentran dentro de los rangos óptimos señalados por el European Standard CEN/TC 243/W G2 de 1993. Según la literatura, la IN principalmente ocurre por la transmisión de microorganismos a través de las manos del personal médico; sin embargo, en este estudio la carga microbiana presente en las manos no superó los 3,90 x 101 ufc/cm2.
En el presente estudio se identificaron seis géneros bacterianos diferentes: 3 bacterias Gram negativas (Acinetobacter spp., E. coli y P. mirabilis) y 3 Gram positivas (E. faecalis, S. epidermidis y B. subtilis). De estos, el más prevalente fue S. epidermidis. Corresponde a un microorganismo comúnmente aislado en superficies y objetos de hospitales; es una bacteria de la microbiota normal de la piel y mucosa humana o animal, que, bajo ciertos factores como la inmunosupresión, inadecuada higiene y heridas bajo procedimientos quirúrgicos, puede provocar infecciones en heridas, implantes de prótesis y septicemias asociadas a catéteres (19).
Si bien el porcentaje de aislamiento de B. subtilis en el presente trabajo es bajo, es sabido que esta bacteria tiene una gran habilidad para formar endospora protectora, lo que le permite tolerar condiciones ambientales extremas. Si bien hasta ahora en el ámbito clínico no presenta mayor relevancia, existen varios informes de infección en pacientes con endocarditis, neumonía y bacteremia (20).
Otro importante género de microorganismo aislado en este estudio fue el Acinetobacter spp., parte de la microbiota de la piel y las membranas mucosas de los animales y seres humanos. Diversos estudios evidencian que ha sido responsable de infecciones oportunistas tales como septicemia, neumonías, endocarditis, meningitis, infecciones a la piel e infecciones al tracto urinario en humanos y algunos animales (11). Si bien en el presente estudio no se logró identificar la especie involucrada, la mayoría de los casos mencionados en la literatura corresponde a A. baumannii, ya que esta especie es uno de los microorganismos más comúnmente asociados a infecciones en perros y gatos (11).
De los elementos en contacto directo con las deposiciones de los pacientes fueron aisladas 3 enterobacterias: E. coli, E. faecalis y P. mirabilis, similar a lo obtenido en el estudio realizado por Jara et al. (7), donde además pudieron aislar Serratia marcescens y Enterobacter cloacae.
La resistencia antibiótica es uno de los temas de gran importancia en medicina veterinaria, ya que reduce las posibilidades de éxito terapéutico. En el presente estudio la totalidad de cepas fueron resistentes a 2 o más antibióticos, lo que supera los niveles de resistencia descritos por ciertos autores (7). Esto reafirma la problemática que puede generar la administración empírica de un grupo determinado antimicrobiano y de tratamientos subóptimos hoy en día
Conclusiones
Se logró aislar seis especies bacterianas de diferentes géneros potencialmente responsables de infecciones nosocomiales a partir de objetos y utensilios de una clínica veterinaria, donde se encontró que S. epidermidis es el agente de mayor frecuencia de asilamiento. Las cepas mostraron un grado variable de resistencia antimicrobiana; sin embargo, el 100 % fue resistente al metronidazol.














