Introducción
El accidente ofídico es un problema grave de salud pública en el mundo que se relaciona con las actividades de campo en regiones tropicales (1). Se estima que ocurren 5.000.000 accidentes ofídicos por año, que ocasionan 125.000 muertes, especialmente en las regiones tropicales y subtropicales, debido a la abundancia de las serpientes de Asia, África y América Latina (2,3,4). En 2017, la Organización Mundial de la Salud (OMS) clasificó el envenenamiento por mordedura de serpientes en la categoría A de las enfermedades tropicales desatendidas (5).
Entre las serpientes venenosas se encuentran las del género Crotalus. En Venezuela se han descrito hasta el presente cinco subespecies: Crotalus durissus cumanensis, C. vegrandis, C. durissus ruruima, C. durissus pifanorum y C. durissus maricelae, que están implicadas en el 30 % de los casos de envenenamiento ofídicos (6,7). La C. durissus cumanensis es la especie más abundante, en especial en zonas bajas y secas, aunque en ocasiones suele encontrarse en bosques y zonas de 2500 m s. n. m. (8). En Venezuela entre 1996-2004, se registraron 53.792 mordeduras de serpientes (9), y para 2010 se presentaron 5.710 accidentes ofídicos, con una mortalidad cercana al 2,3 % (10). El país ocupa el tercer lugar de importancia en cuanto a incidencia de mordeduras de serpientes. Aquí el estado Falcón tiene un lugar preponderante respecto a la mortalidad por estados, ya que se ubica en el tercer puesto (11,12).
Los venenos de las serpientes que pertenecen a la familia Viperidae, subfamilia Crotalinae, están químicamente compuestos por una gran cantidad de constituyentes orgánicos (proteínas y muchos tipos de enzimas) (13). Algunas de estas proteínas tienen actividad enzimática, entre las que se destacan las enzimas proteolíticas y las de tipo fosfolipasas (14). Así mismo, hasta la fecha se han podido aislar y clasificar ciertas enzimas en grupos de miotoxinas de bajo y alto peso molecular, como las de tipo fosfolipasas A2, hemorraginas y, según su actividad enzimática en proteasas, L-amino oxidasa, fosfodiesterasa, fosfolipasas, quinogenasa e hialurodinasas (15). En la especie Crotalus durissus cumanensis (cascabel) se describen dos mecanismos de acción: 1) neurotóxico, debido a la acción de la crotoxina sobre las terminaciones nerviosas motoras que inhiben la liberación de acetilcolina en la placa neuromuscular. Esto conduce a parálisis flácida y, además, tiene un notorio efecto hemolítico; 2) miotóxico, atribuido igualmente a la crotoxina, que junto con la crotamina producen lesiones en el tejido muscular y es responsable de la falla renal por mioglobinuria (16, 17,18,19).
La medida de estas alteraciones in vivo puede realizarse mediante la cuantificación de marcadores característicos, en algunos casos enzimas, cuyas actividades solo se detectan incrementadas en sangre cuando se lesionan las células que las contienen, lo que ocasiona daño tisular (20,21). Entre estas se encuentra la enzima aspartato aminotransferasa (AST), que está presente como isoenzima citosólica y mitocondrial en numerosos tejidos. Es necesario que exista una lesión celular grave para que se libere la isoenzima mitocondrial. La enzima AST no es específica del hígado. Se halla en casi todos los tejidos. El aumento de la actividad de la AST sérica suele estar asociado a daño muscular o hepático, tomando en consideración la ubicación en la célula y la vida media de la enzima, que en este caso es relativamente menor que la alanino aminotransferasa (ALT), considerada específica para determinar daños al tejido hepático, como lesiones hepatocelular subletal o necrosis. La enzima lactato deshidrogenasa (LDH) y sus isoformas son utilizadas como herramientas diagnósticas de daño al tejido cardiaco (22). La enzima creatina fosfocinasa (CK) puede encontrarse en la musculatura estriada, lisa y en el tejido cerebral; sus concentraciones séricas han sido empleadas como indicador sensible en daño en músculo (estriado y cardíaco), y en menor concentración en otros tejidos (21,22). Además, se puede realizar el estudio histopatológico, que es un determinante fundamental en los diagnósticos, en particular en los envenenamientos por animales ponzoñosos (23).
No hay estudios previos en el estado Falcón sobre las alteraciones bioquímicas e histopatológicas causadas por el veneno de estas serpientes. Por eso es necesario estudiar detalladamente los efectos que producen, partiendo del hecho de que la variabilidad de los efectos producidos es consecuencia de su composición química. Existen evidencias de variaciones en la composición, en función de la distribución geográfica de los ofidios (24,25). También se han descrito diferencias en la letalidad, actividades enzimáticas, patrones electroforéticos, efectos locales, respuesta inmunológica, entre otras (26,27,28,29,30,31,32,33). Por todo esto, es vital evaluar la actividad toxicológica del veneno de esta especie presente en el estado Falcón. De acuerdo con esto, el objetivo fue determinar los cambios séricos en la ALT, AST, LDH y CK y establecer los efectos histopatológicos en ratas cepa Wistar (Rattus novergicus), inducidas por el veneno de la serpiente Crotalus durissus cumanensis autóctonas del municipio Falcón, estado Falcón, Venezuela.
Materiales y métodos
Animales y veneno
Se empleó veneno de C. durissus cumanensis en forma cruda obtenido de un ejemplar adulto (macho) capturado en las sabanas de Adicora, municipio Falcón, estado Falcón, Venezuela, y mantenido en cautiverio en el zoocriadero Las Guarichas ubicado en Las Ventosas, municipio Colina, estado Falcón. Para la obtención del veneno se anestesió el espécimen con gas carbónico y luego se extrajo el veneno por compresión de las glándulas venéfilas, colocando la boca de la serpiente sobre un vaso de precipitado (34). Una vez extraído el veneno, se puso en una cava con hielo y se llevó al laboratorio de Análisis Clínico, Programa de Ciencias Veterinarias, Universidad Nacional Experimental “Francisco de Miranda” (UNEFM). Allí se trasvasó a un tubo de ensayo y se procesó en una centrifuga (Clay Adams Dynac Centrifuge), a 1200 revoluciones por minuto (r. p. m.) durante 15 minutos. Finalmente, se colectó el precipitado, con previa remoción y descarte del sobrenadante en tubos de Eppendorf estériles con 0,5 mL del veneno, y luego se congeló a -20 °C (congelador -20 °C Cool-lab) hasta su posterior utilización.
Se emplearon 15 ratas cepa Wistar (Rattus novergicus), de ambos sexos, con un peso aproximado de 180-200 g, todas procedentes del bioterio del Área de Ciencias de la Salud de la UNEFM. Se distribuyeron en cinco grupos experimentales con tres réplicas cada uno (n = 3). El primer grupo (G1, control) fue tratado con 100 µL de solución salina fisiológica estéril (SSFe), suministrada en una dosis única por ruta intraperitoneal (IP). El resto de los animales fueron inoculados también por vía IP con 50 µg del veneno nativo de la serpiente, para evaluación, luego de 1 (G2), 3 (G3), 6 (G4) y 9 (G5) horas de exposición. Los especímenes experimentales se sacrificaron por dislocación cervical, previa anestesia con éter, a los lapsos de tiempo señalados, para colectar sangre por punción cardiaca.
Determinación de los niveles de marcadores bioquímicos
Las muestras de sangre fueron centrifugadas a 2500 r. p. m., para la obtención de la fase sérica sobrenadante. Esta se obtuvo cuidadosamente y se dispuso en tubos Eppendorf de 2,5 mL identificados de forma escrupulosa. Dicho material se usó para realizar las pruebas enzimáticas de ALT, AST, CPK y LDH, las cuales se tomaron en las instalaciones de un laboratorio privado el mismo día de la extracción. Las determinaciones enzimáticas se efectuaron con métodos colorimétricos (Wiener Laboratorios, S. A., Argentina) (34) con lectura en espectrofotómetro UV a 340 nm:
AST: es determinada mediante la actividad de la misma enzima, cuya reacción está desplazada hacia la formación de oxalacetato, que reacciona inmediatamente con la malato deshidrogenasa (MDH), de modo que la velocidad de oxidación de la nicotinamida adenina dinucleótido reducido (NADH) medida a 340 nm es proporcional a la actividad AST de la muestra.
ALT: la reacción de esta enzima está desplazada hacia la formación de piruvato, que reacciona inmediatamente con la LDH, de modo que la velocidad de oxidación del NADH medida a 340 nm es proporcional a la actividad ALT de la muestra.
CK: se determina mediante la reacción colorimétrica de fosfatemia, donde la enzima cataliza la transferencia de un grupo fosfato del ATP a la creatina a pH 9, para formar creatin-monofosfato, siendo el fósforo liberado por hidrólisis proporcional a la actividad enzimática.
LDH: esta enzima cataliza la oxidación del 1-lactato a piruvato, en presencia de NAD como coenzima aceptora de hidrógeno. El método se basa en la determinación del piruvato formado por deshidrogenación del lactato (reacción directa) en presencia de NAD, mediante la reacción con 2,4 dinilhidrazina, lo que forma la correspondiente hidrazona coloreada. Esto se expresa mediante las concentraciones de las enzimas en unidades internacionales sobre litros (UI/L) (35).
Análisis histológicos del daño inducido por el veneno
Luego del sacrificio de los animales, se procedió a realizarles la necropsia para la recuperación de los siguientes órganos: corazón, músculo esquelético, hígado y riñones, los cuales se fijaron con formalina al 10 %, y posteriormente fueron procesados mediante técnicas histopatológicas clásicas (36). Se aplicaron tinciones con hematoxilina y eosina, y luego los cortes se examinaron con un microscopio de luz con aumento 10X y 40X, para la respectiva caracterización histopatológica.
Análisis estadístico
Se realizaron estimaciones de medidas de tendencia central (medias) y de dispersión (error estándar o S. E. M.). Los datos fueron evaluados por análisis de varianza (ANOVA), considerando a cada tratamiento como una variable independiente. Con un nivel de significancia de 95 %, el valor de la tasa de error tipo I fue de ( = 0,05, por lo que el sistema de hipótesis propuesto fue:
Hipótesis principal: si p < 0,05, entonces las diferencias de los promedios entre los grupos experimentales son estadísticamente significativas.
Hipótesis nula: si p ≥ 0,05, se descarta la hipótesis principal y se asume que las diferencias de medias no son estadísticamente significativas entre los grupos experimentales.
Luego de la aplicación del ANOVA (prueba a priori), se seleccionó el test de Bonferroni como prueba a posteriori, y así identificar cuál(es) fue(ron) el(los) grupo(s) con la media significativamente diferente.
Resultados
Marcadores bioquímicos
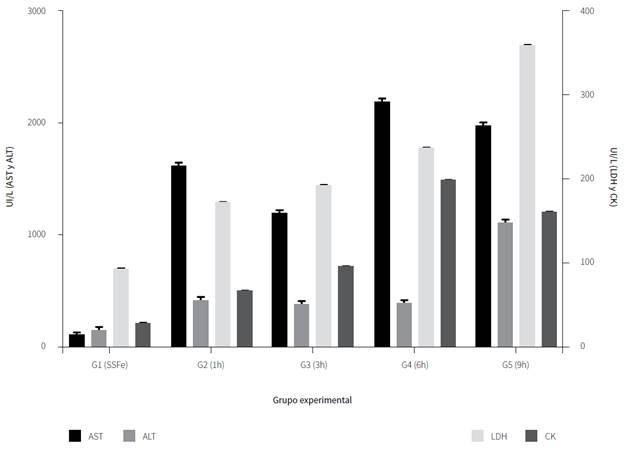
La figura 1 muestra el registro de la actividad de cada enzima en los diferentes tiempos de exposición. Se detectan diferencias significativas (p < 0,05) entre los resultados de AST, LDH y CK de todos los grupos experimentales. En el caso de la ALT, también se registraron estas variaciones (p < 0,05), excepto las comparaciones entre los grupos G2 vs. G3, G2 vs. G4 y G3 vs. G4. En la determinación sérica de la enzima AST se observó un incremento a partir de la primera hora posinoculación del veneno, con una concentración pico a la sexta hora (293 ± 8 UI/L). En la enzima ALT, hubo un aumento de la actividad a partir de la primera hora posinoculación del veneno con una concentración pico a la novena hora (147 ± 8 UI/L); este es altamente significativo p < 0,05 respecto al control y el resto de los grupos. Además, se evidencia una elevación paulatina en la actividad enzimática LDH desde la primera (689,66 ± 8,5 UI/L) hasta la novena hora (2700 ± 8UI/L) posinoculación del veneno, en consideración al grupo control, respectivamente. En el comportamiento CK, hubo un incremento progresivo en la actividad enzimática desde la primera (200,00 ± 8,0 UI/L) hasta la sexta hora (1489,66 ± 8,5UI/L) posinoculación del veneno.
Cambios histológicos inducido por el veneno
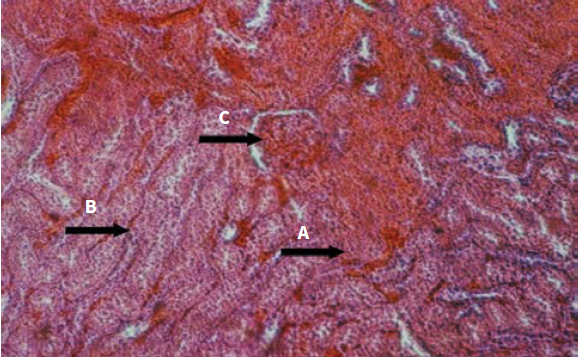
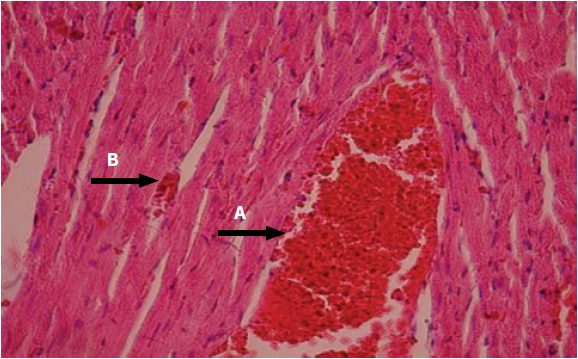
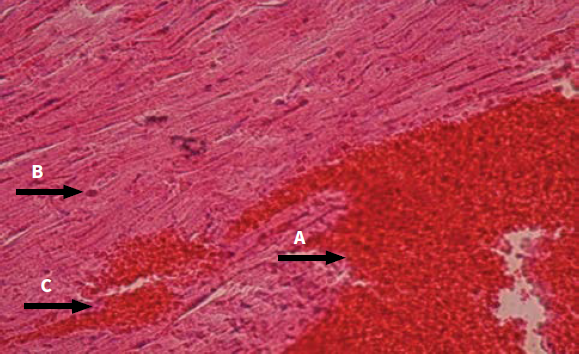
En las ratas inoculadas experimentalmente, vía IP, con 50 µg del veneno de la serpiente Crotalus durissus cumanensis se produjo una serie de alteraciones fisiopatológicas en diversos tejidos. Estos cambios fueron tiempo-dependientes. En el corazón se observó que las lesiones se intensificaban a medida que transcurría el tiempo de inoculación. Presentó áreas hiperémicas y congestión de los vasos sanguíneos, infiltración de células inflamatorias entre las fibras con indicios de necrosis, evidenciada por la pérdida del núcleo de las células miocárdicas hasta llegar a necrosis de Zenker (figuras 2 y 3).
Fuente: elaboración propia
Figura 2 (40X) H. E. Corazón: se observa congestión de vasos sanguíneos (flecha A) y área hiperémica (flecha B); tiempo: 3 h posinoculación del veneno
Fuente: elaboración propia
Figura 3 (40X) H. E. Corazón: se observa hiperemia (flecha A), infiltrado inflamatorio (flecha B) y congestión vascular (flecha C); tiempo: 9 h posinoculación del veneno; tiempo: 9 h posinoculación del veneno
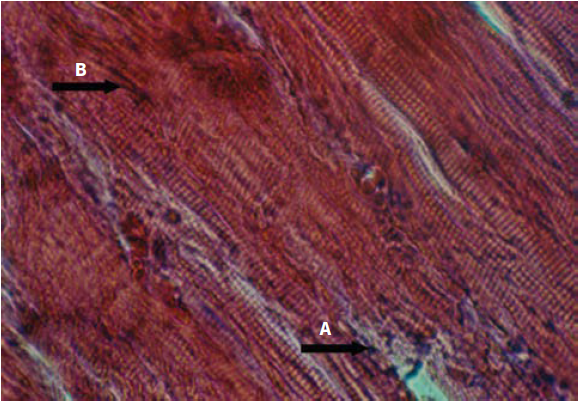
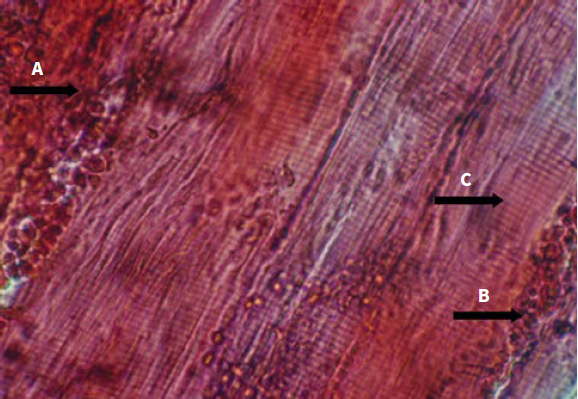
Con respecto a las lesiones encontradas en músculo esquelético, se puede señalar lo siguiente: se evidenciaron extensas áreas de hiperemia e infiltrado inflamatorio para luego progresar con áreas hemorrágicas, células inflamatorias entre las fibras musculares y necrosis de Zenker con ruptura de las fibras musculares y marcada pérdida de las estriaciones (figuras 4 y 5).
Fuente: elaboración propia
Figura 4 (40X) H. E. Músculo gastronemio: se observa infiltrado inflamatorio (flecha A) e hiperemia (flecha B); 1 h posinoculación del veneno
Fuente: elaboración propia
Figura 5 (40X) H. E. Músculo gastronemio: se observa hemorragia (flecha A), células inflamatorias entre las fibras musculares (flecha B) y necrosis de Zenker (flecha C); 3 h posinoculación del veneno
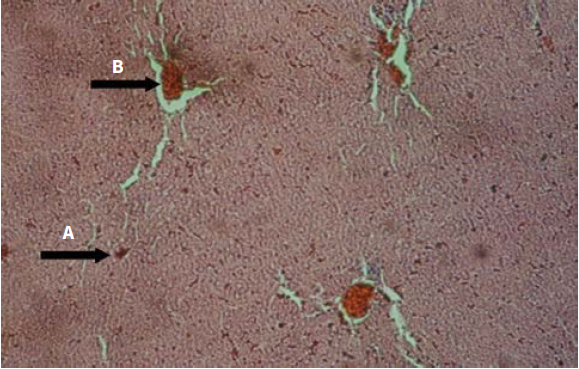
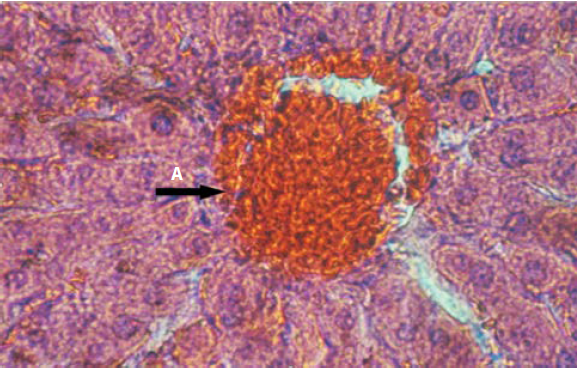
Este veneno aumenta la actividad de las enzimas hepáticas y también produce alteraciones histopatológicas en el tejido hepático, lo que sugiere un posible efecto hepatotóxico. En la evaluación histopatológica del tejido hepático expuesto al veneno, se evidenció extravasación de glóbulos rojos, congestión de los sinusoides hepáticos, hiperemia, infiltrado inflamatorio en vena centrolobulillar y telangiectasia (figura 6 y 7).
Fuente: elaboración propia
Figura 6 (10X) H. E. Hígado: extravasación de glóbulos rojos (flecha A) y congestión vena centrolobulillar (flecha B); 1 h posinoculación del veneno
Fuente: elaboración propia
Figura 7 (40X) H. E. Hígado: infiltrado inflamatorio (flecha A); 6 h posinoculación del veneno
En lo que se refiere a los efectos del veneno de Crotalus sobre el tejido renal, se tiene lo siguiente: hemorragia en la zona de los túbulos contorneados, gran infiltrado inflamatorio, colapso de los túbulos contorneados hasta pérdida de la arquitectura glomerular y del órgano. Estos resultados reflejan una acción nefrotóxica del veneno (figuras 8 y 9).
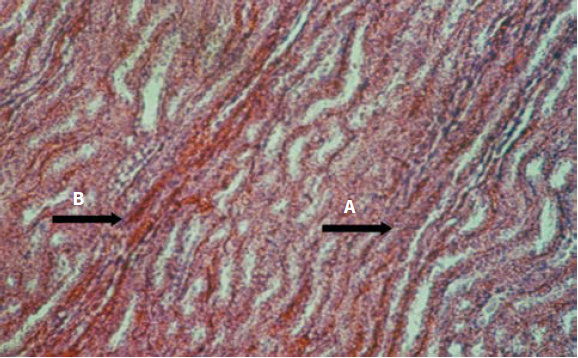
Fuente: elaboración propia
Figura 8 (10X) H. E. Riñón: colapso de los túbulos renales (flecha A) y hemorragia en los túbulos contorneados (flecha B); 1 h posinoculación del veneno
Discusión
En este trabajo se observó que después de la administración intraperitoneal del veneno de C. durissus cumanensis se incrementaron los valores de las enzimas AST. Esta enzima y la ALT aumentada producen daño hepático. Sin embargo, también pueden aumentar en caso de daño muscular severo. El daño es citotóxico, lo cual concuerda con los resultados obtenidos en investigaciones realizadas al administrar el mismo veneno en ratones, y que reportan valores de AST elevados de manera significativa. Esta enzima fue la que más rápidamente aumentó entre 1 y 24 horas, con valores máximos de 2327 UI/L a las 3 horas (33). Igualmente, incrementaron las enzimas CPK, AST y LDH en pacientes mordidos por C. durissus cumanensis (37). También hubo cambios séricos en las enzimas AST, ALT, LDH, FA, CK total, con un incremento en los valores de todas las enzimas. Esto indica un posible daño hepático, muscular y/o cardíaco en las primeras 24 horas después de la exposición al veneno (20,33). Pérez-Urrieta et al., en 2010, determinaron las concentraciones séricas de ALT y AST en ratones (NMRI) inoculados con el veneno de C. durissus cumanensis, con perfiles electroforéticos diferentes en cuanto al número de bandas. No arrojaron diferencias significativas entre los dos venenos, pero sí al comparar los valores de las enzimas con respecto a los controles. En ambos casos se evidenció que el hígado es susceptible a la acción tóxica del veneno (38).
Ahora bien, en investigaciones realizadas con otra subespecie, inocularon ratas Wistar con veneno de C. durissus terrificus con 100, 200, 300 µg/kg para evaluar la hepatotoxicidad. Tras esto, se incrementaron los valores de AST, ALT, FA, GGT y bilirrubina, con lo cual se concluye que el veneno es hepatotóxico, actúa según la dosis y es tiempo-dependiente (32). Así mismo, se evaluó en ratas el efecto del veneno de C. durissus terrificus desecado a una dosis de 120 µg/100 g. Con esto se pudo observar un incremento en los valores de CPK, AST y ALT. Estos, junto a los resultados histopatológicos, inducen a pensar que el veneno posee, además de un efecto hepatóxico, un efecto miolítico y hepato-nefrotóxico (29).
La enzima LDH tiene sus principales fuentes en músculo, hígado y eritrocitos. Cuenta con poca especificidad tisular, y además tiene una vida media más larga que las enzimas CPK y ALT (22). Poco se conoce acerca del efecto del veneno del Crotalus sobre la actividad de la enzima LDH. Así mismo, en dos casos de mordedura de Crotalus durissus terrificus se evidenció rabdomiólisis, con elevadas concentraciones de CPK, LDH y AST (37).
En este orden de ideas, en trabajos realizados con el veneno de C. durissus cumanensis se han descrito alteraciones ultraestructurales del tejido cardiaco en ratones después de seis horas posinyección del veneno. Esto coincide con el aumento de la concentración de CK (39). Así mismo, los venenos de serpientes inducen varias etapas de necrosis con acción significativa sobre las concentraciones de CPK con incrementos de 5 a 10 veces más de lo normal. Posiblemente este efecto se atribuye a la acción de las miotoxinas (40).
En estudios realizados sobre las alteraciones histológicas del cerebro y el cerebelo en ratones adultos inoculados con C. durissus cumanensis y las concentraciones de CKT y su isoforma CK-BB, se registraron lesiones degenerativas y necrosis neuronal, edema, gliosis y desmielinización localizada. Las concentraciones séricas de CKT revelaron un incremento a las 3, 6 y 12 horas posinoculación; mientras que la CK-BB reportó solo a las 3 y 6 horas. Esto sugiere que el veneno causa daño en el músculo esquelético, el corazón y el sistema nervioso central, y produce lesiones histopatológicas asociadas a las altas concentraciones de CK-BB, ya que el veneno es capaz de vencer la barrera hematoencefálica (41).
Así, en estudios clínico-epidemiológicos sobre las alteraciones hemorrágicas y necróticas causadas por el veneno de C. durissus cumanensis realizados en 135 pacientes venezolanos durante 1998-2008, se determinó la actividad de la CK. Aquí se observó mayor alteración a las 24 horas del ingreso respecto a la LDH, con la cual no hubo diferencias significativas. La CK es indicativo de daño muscular, lo que causa trauma, rabdomiólisis, infarto al miocardio, miocarditis (42). Algo semejante ocurre con el efecto que produce el mismo veneno sobre los marcadores enzimáticos de lesiones cardíacas en ratones. A este respecto se obtuvo un incremento en las concentraciones séricas de CKT, CKMB, LDHT, LDH-1 y LDH-2 en cuanto al control. Esto puede ser indicativo de daño en el músculo cardíaco (43). Así mismo, con un pool de 10 venenos de serpientes adultas sobre cultivos celulares de cardiomiocitos de ratones, se observó un incremento en los marcadores enzimáticos de lesiones cardiacas LDH y AST en el sobrenadante, los cuales inducen una cardiotoxicidad dentro de las primeras horas de exposición del veneno. Esto no ocurrió con la CK, cuyo valor fue indetectable en el estudio, lo que no concuerda con los resultados presentados (44).
Por otra parte, en trabajos realizados en ratones con veneno de C. durissus terrificus se detectó en las determinaciones enzimáticas incremento de creatinina, CPK, mioglobina con necrosis tubular aguda, con mioglobina en túbulos proximales (31). Así mismo, se evaluó la actividad biológica de la CTX con una fracción del veneno de C. durissus terrificus, C. durissus collilineatus y C. durissus cascavella. Al parecer, la CTX de C. durissus terrificus provocó un elevado incremento de CPK con fuerte actividad miotóxica, en comparación con otros venenos (30). Además, se realizó una comparación entre dos venenos en ratas Wistar adultas. De aquí resultó un incremento en la ALT, AST, CK, urea y creatinina mayor con C. durissus collilineatus que con C. durissus terrificus. No fue así con los valores de ALP y CKMB, que disminuyeron con la inoculación de este, pero con respecto a C. durissus collilineatus, no a los controles usados; las alteraciones bioquímicas registradas se explican por la acción miotóxica y nefrotóxica de los dos venenos (45).
De la misma manera se determinaron los efectos locales y sistémicos causados por el veneno de las serpientes C. durissus terrificus, C. durissus collilineatus y C. durissus cascavella en ratones suizos. Aquí se observó un incremento en la liberación de CKT, CK-MB y LDH, lo cual indicó miotoxicidad y ALT, AST, GGT y ALP. Esto produjo daño hepatotóxico y provocó un bloqueo neuromuscular (46).
El veneno de la serpiente C. durissus cumanensis induce a una serie de alteraciones fisiopatológicas en diversos tejidos de los animales tratados. Estas fueron tiempo-dependientes. Los cambios histopatológicos han sido extensamente estudiados debido a los componentes del veneno, como enzimas y otros compuestos. Ahora bien, son escasas las investigaciones sobre la fisiopatología inducida por dosis bajas del veneno, y ha sido poco estudiado para la especie C. durissus cumanensis. Los resultados obtenidos en este trabajo coinciden con lo reportado por Hernández et al. (39), quienes indican que el veneno provoca pérdida del sistema contráctil, mitocondrias degeneradas, áreas de necrosis con degradación de la membrana plasmática e infiltrado de macrófagos.
Por otro lado, los mismos autores, en otra investigación (47), señalan que el veneno lleva a la dilatación de los capilares, cardiomiocitos con mitocondrias pleomórficas, terminales de los nervios colinérgicos con depleción de acetilcolina y espacios vacíos en las zonas donde deberían estar los elementos contráctiles. No obstante, en intoxicación experimental con veneno de C. durissus terrificus en bovinos se observaron petequias y equimosis en el epicardio, e histopatológicamente se evidenció necrosis hialina de los miocitos (48). Así mismo, se hallaron pequeños focos de necrosis del miocardio dispersos a través de la base de los ventrículos. Estas lesiones eran predominantemente perivasculares y fueron asociadas a un leve a moderado edema intersticial, así como a infiltración de células mononucleares y a una gran cantidad de células mastoideas. Estos resultados llaman la atención por su localización preferencial en la base del corazón y la asociación de los focos de la necrosis miocitolítica con una gran cantidad de células mastoideas (49). Además, hay lesión miocárdica documentada a través de evidencias clínicas, electrocardiográficas, enzimáticas e histopatológicas.
Los principales hechos patológicos estuvieron representados por vacuolas sarcoplásmicas, miofibrillas densamente agrupadas y masas amorfas acidófilas en las fibras miocárdicas (50). Todo lo referido indica que la posible acción cardiotóxica del veneno sea inducida probablemente por las fosfolipasas A2 o metaloproteinasas presentes en estos venenos, y que sus efectos locales principales son hemorragia, edema con daño a las membranas basales de los tejidos adyacentes y células endoteliales de los capilares (51).
Por el contrario, los resultados no coinciden con lo reportado por Sangiorgio et al. (52), quienes señalan que el veneno de C. durissus terrificus afecta el músculo esquelético, riñón, bazo e hígado, pero no afecta el músculo cardiaco. De igual manera, Posner et al. (53) indican que al parecer el tejido cardiaco es relativamente resistente al efecto del veneno de Crotalus atrox. Es posible que estas especies tengan componentes diferentes del veneno de la serpiente C. durissus cumanensis. Estos factores pueden actuar directamente sobre los tejidos e inducir los efectos sobre el miocardio.
En la investigación, los resultados también concuerdan con estudios en los que el envenenamiento por serpientes del género Crotalus provoca alteraciones graves, como hemorragia sistémica, hepatotoxicidad, miotoxicidad, hipotensión, falla renal aguda y shock. Esto ha sido relacionado con miólisis, hemólisis, hipotensión y/o nefrotoxicidad directa del veneno (17). Así, algunos estudios señalan que este veneno tiene actividad miotóxica, la cual puede conducir al desarrollo de rabdomiólisis, que puede seguir al daño del músculo esquelético, liberando creatinfosfocinasa, lactato deshidrogenasa y mioglobina (37). De igual manera, hay investigadores que sugieren daño del tejido muscular esquelético y necrosis miolítica y coagulativa (29,20).
La necrosis sistémica del músculo esquelético, inducida por la crotoxina, el principal componente del veneno de la serpiente C. durissus terrificus, provoca lesión muscular selectiva y sistémica en regiones compuestas por fibras musculares oxidativas (54). Así, al comparar efectos de la crotoxina se evidencia una fuerte actividad de fosfolipasa A2, determinada con mediciones de CPK (30), además de necrosis hialina de células de músculo esquelético, hemorragia, infiltrado inflamatorio y pérdida de las estriaciones musculares (48,52). Así mismo, con el veneno de C. durissus cumanensis y C. durissus vegrandis, luego de 12 y 24 horas posinoculación, se observaron pequeños grupos de células musculares con edema, degeneración, necrosis de Zenker, infiltrado de células inflamatorias y leve necrosis de tejido adiposo cercano al músculo (23). Aparentemente los componentes del veneno, como las miotoxinas y las metaloproteinasas, son responsables de la mionecrosis y dermonecrosis. Al mismo tiempo, comparando dos venenos en ratas Wistar adultas en el área muscular con C. durissus collilineatus, se observó infiltrado inflamatorio con predominio mononuclear y necrosis de Zenker multifocal moderada, y con C. durissus terrificus, necrosis de Zenker multifocal severa que empeora con el tiempo (45).
Estos resultados coinciden con los análisis histológicos de cortes de hígado de ratas expuestas al veneno de C. durissus terrificus. En estos se halló daño endotelial, infiltración de células inflamatorias, congestión portal y de los sinusoides (32). También se encontró tumefacción celular severa, células de Kuffer activadas y necrosis coagulativa focal, lo cual supone daño hepato-biliar (33), congestión y dilatación de los vasos sanguíneos grandes; los sinusoides periféricos presentaron hemosiderina y vénulas pequeñas con trombosis (29).
En un estudio ultraestructural en ratones inoculados con el veneno de C. vegrandis, se obtuvieron muestras de hígado y se fijaron para estudios de microscopía electrónica. Allí se encontraron hepatocitos con alto contenido de lípidos, vacuolización cerca de los espacios de Disse y eritrocitos adheridos a las células endoteliales; en algunos casos, los sinusoides hepáticos estaban llenos de glóbulos rojos (17). También hay evidencia de veneno C. durissus cumanensis sobre el tejido hepático a las 12 y 24 horas posinoculación, hepatocitos tumefactos, células de Kupffer, pequeños focos de células inflamatorias y linfocitos. Por su parte, en los inoculados con C. durissus vegrandis a las 12 y 24 horas se observó hiperemia, hepatocitos tumefactos, células de Kupffer reactivas y presencia de megalocitos (23). Es probable que este efecto hepatotóxico esté mediado por la acción de la fosfolipasa A2, que es componente de la crotoxina, la principal toxina del veneno de serpientes del género Crotalus. Se recomienda continuar realizando estudios para determinar los efectos histológicos causados por el accidente ofídico en diferentes tejidos.
Los resultados reflejan una acción nefrotóxica del veneno, similares a la serpiente Crotalus durissus terrificus, conocida por sus efectos neurotóxicos, acompañados por daño renal agudo atribuido a la mioglobinuria asociada a rabdomiólisis (55). La crotoxina aislada de este veneno produce nefrotoxicidad directa en los riñones de ratas aislados y mantenidos bajo perfusión (56). La insuficiencia renal aguda es una de las complicaciones sistémicas más frecuentes después de un accidente ofídico. Aquí se observa en la corteza renal congestión y degeneración granulo-hialina de las células epiteliales tubulares, acompañadas de dilatación y cilindros hialinos en la luz tubular (57,58), además de cuadro de insuficiencia renal aguda atribuida a la acción nefrotóxica y hemolítica del veneno (37). Hay, por otra parte, necrosis tubular aguda con mioglobina en los túbulos proximales, lo que muestra que los efectos renales inducidos por este veneno conllevan múltiples factores, entre los cuales la rabdomiólisis es uno de los responsables (31).
También hay evidencia de daño del tejido renal con congestión cortical a partir de la tercera hora posinyección de veneno hasta llegar a la congestión de las zonas yuxtaglomerulares con escasa cantidad de cilindros hialinos (29) y degeneración tubular renal (52). Por otra parte, el daño renal es una causa importante de muerte en los pacientes que sobreviven a los efectos iniciales de los severos envenenamientos crotálicos. Este estudio describe cómo las proteínas del citoesqueleto y los componentes de la membrana basal muestran alteraciones, con la acción del veneno crudo de C. vegrandis y una fracción hemorrágica (urocoina-1) del mismo veneno, ya que la matriz extracelular del tejido es alterada por la actividad de estas toxinas (59).
Conclusiones
El veneno de la serpiente C. durissus cumanensis indujo una serie de alteraciones fisiopatológicas en varios tejidos de los animales inoculados experimentalmente. Las diversas alteraciones fueron tiempo-dependientes. Aumentó la actividad de las enzimas hepáticas aspartato aminotransferasa (AST) y alanino aminotranferasa (ALT), y produjo alteraciones histopatológicas en tejido hepático. Esto sugiere un posible efecto hepatotóxico y el daño al músculo cardíaco y esquelético, aunado al incremento de las concentraciones séricas de creatina fosfocinasa (CK) y lactato deshidrogenasa (LDH). Además, podría conllevar un posible efecto cardiotóxico y/o muscular. Las marcadas lesiones en tejido renal pueden indicar un posible efecto nefrotóxico, quizás por acción citotóxica o por rabdomiólisis.