Introducción
El tití gris (Saguinus leucopus) es una especie de primate endémico de Colombia, catalogado en el apéndice I de la Convención Internacional para el Comercio de Flora y Fauna Silvestre (CITES), y cuyo estado de conservación es en peligro (EN), según la Unión Internacional para la Conservación de la Naturaleza (UICN) (1,2). Vive aproximadamente 15 años en cautiverio con una calidad de vida regular en vista de los requerimientos nutricionales y de manejo tan específicos. Y puesto que su hábitat natural está reducido, corre mayor peligro de extinción (1). Habita en los bosques tropicales colombianos de tipo seco, húmedo premontano y húmedo tropical, aunque su distribución está limitada por la colonización humana y la deforestación, así como por el tráfico ilegal (3).
La reproducción de este primate comprende un sistema de cría principalmente monógamo (una pareja reproductiva), y en ocasiones poliándrico cooperativo, como en otros pequeños primates (4,5). La hembra posee útero simple y presenta gestación gemelar la mayoría de veces, dada la fusión coriónica de la placenta, que es característica en calitrícidos (2,5,6). Puede tener más o menos dos partos al año, que se dan entre mayo y junio, y entre octubre y noviembre (3,7,8). La gestación dura cerca de 145 días, como en otros Saguinus. La reproducción es exclusiva de la pareja dominante y se advierte que las demás hembras suelen mostrar inactividad ovárica; sin embargo, el cuidado de las crías está a cargo de todos los miembros del grupo, como es habitual en especies gregarias, y el contacto más directo se tiene con el padre. Durante el periodo de lactancia no hay supresión de la ovulación, y el estro se da hacia los 10 días posparto, o en los siguientes 12-32 días, lo que permite, de esta manera, una próxima preñez (2,4,5,8,9,10).
El aparato reproductivo de los primates no humanos comparte similitudes anatómicas y fisiológicas con el humano. Bartelmez, citado por Hess et al. (11), caracterizó el endometrio de los macacos Rhesus (Macaca mulatta), mientras que Mayor et al. (12), el de algunos primates neotropicales; sus observaciones reportaron que el tejido estaba formado por cuatro zonas bien definidas histológicamente, descritas también en el endometrio humano: la capa funcionalis (con zonas I y II) que responde cíclicamente a las hormonas esteroides ováricas, es el sitio de implantación y muda en ausencia de implantación; y la capa basalis (con zonas III y IV) que participa en la regeneración del tejido después de la menstruación. Esta última ocurre de forma similar solo en humanos y primates del Viejo Mundo, así como en ciertos murciélagos, aunque existe evidencia de sangrado discreto y reabsorción tisular en algunos primates del Nuevo Mundo (10,11,12).
De igual manera, investigadores citados por Rutherford (5), Ankel-Simons (6) y Benirschke (13) describieron las principales características de placentación, implantación y gestación de calitrícidos como Callithrix jacchus, Saguinus geoffroyi, Leontopithecus chrysomelas y L. rosalia. En estos observaron que la implantación es antimesometrial y superficial, presenta amplias conexiones vasculares y el amnios se forma por cavitación. La implantación suele ocurrir alrededor del día 12 con invasión sincitial, y existe una proliferación trofoblástica temprana marcada. La placenta es de tipo hemocorial y no hay saco alantoideo. Los dos discos de la placenta -uno para cada embrión- son monocoriónicos y generalmente están muy próximos.
Las características más notables de las placentas de estos animales son las conexiones vasculares intergemelares entre los fetos y la hematopoyesis vellosa de la placenta. La superficie vellosa es similar a la de otras especies con sincitio y citotrofoblasto. A pesar de ello contiene poco tejido conectivo. Por su parte, la “zona de unión” con el endometrio es relativamente acelular con una pequeña cantidad fibrinoide como capa de Nitabuch y algunos elementos mononucleares. Otra diferencia reproductiva es que el blastocisto/embrión temprano puede crecer en la luz uterina sin implantarse profundamente en el endometrio, como sí sucedería en humanos. Y la presentación de abortos puede ser común en titíes así como la maceración de alguno de los gemelos (2,13).
Pese a los conocimientos sobre teriogenología en estos primates, el insuficiente reporte de enfermedades del tracto reproductor en monos neotropicales dificulta la detección de sus patologías en la práctica clínica, e interfiere con el propósito mismo de su conservación. De este modo, se hace necesario recurrir a información de otras especies como primates del Viejo Mundo, animales domésticos, o incluso extrapolaciones de medicina humana para entender su patogenia.
Este caso expone una de las afecciones uterinas comunes en animales domésticos, pero menos frecuentes en animales silvestres y con escasos registros en primates. La endometritis se define como la inflamación de la mucosa uterina causada por distintos agentes infecciosos de forma directa, o por acción de sus toxinas u otros factores de virulencia. Puede tener curso clínico o subclínico, según las manifestaciones y el tipo de agente agresor. De acuerdo con los estudios, mientras exista endometritis, la hembra puede presentar celo y la gestación puede realizarse, pero después llega a producir la muerte embrionaria causando repeticiones de celo e infertilidad (14,15).
Normalmente, el útero cuenta con barreras anatómicas como el cérvix, que evita el paso de microrganismos desde la vagina y, además, con barreras inmunológicas locales, como la producción de inmunoglobulinas encargadas, entre otras, de impedir la fijación de bacterias al endometrio al convocar su fagocitosis. Sin embargo, durante algunas fases del ciclo estral, estos mecanismos defensores se ven afectados tanto por cambios en el pH intrauterino como por la actividad hormonal inmediata -como ocurre con la progesterona- sobre las células polimorfonucleares (PMN) y leucocitarias. Así permite una invasión uterina por agentes infecciosos y su consecuente respuesta inflamatoria (14,15).
Hay factores extrínsecos que también interfieren la fisiología reproductiva de animales silvestres en cautiverio, como las condiciones del entorno, los traslados, la calidad de la dieta, el tipo de encierro o la conformación del grupo, ya que ocasionan distrés continuo en el individuo debido al desafío de nuevos escenarios ambientales, carencias nutricionales, limitación del espacio, cercanía de las personas o presencia de congéneres y otros animales. Esto afecta la regulación hormonal del hipotálamo y la hipófisis, que reaccionan al estrés crónico alterando la secreción de las hormonas involucradas en el ciclo reproductivo, lo que repercute, a su vez, en la competitividad del sistema inmunológico (2,16,17).
En algunos mamíferos domésticos como rumiantes, cerdas y yeguas, la respuesta inflamatoria de la endometritis lleva a una mayor secreción de prostaglandinas, como la PGF2α, que induce la luteólisis temprana y consecuente muerte embrionaria. Dicho efecto no ocurre en carnívoros y primates, en los que la gestación es dependiente de otras hormonas, como la gonadotropina coriónica (10,12,14,18,19). No obstante lo anterior, la misma contaminación por bacterias y productos inflamatorios en el útero puede entorpecer la supervivencia de los embriones, ya que genera un ambiente desfavorable (en oxígeno, pH, etc.) y altera el tejido endometrial durante su fase de regeneración y remodelación. De esta manera, puede sufrir reemplazo por tejido fibroso, lo que cambia su estructura y funcionalidad, así como atrofia de glándulas endometriales; incluso lleva a cambios degenerativos irreversibles en casos más crónicos (14,20).
Tal es la importancia de comunicar estos casos de enfermedad reproductiva en primates del Nuevo Mundo, que den pautas para su identificación, manejo y resolución, teniendo en cuenta las secuelas de estas afecciones en la conservación de especies amenazadas.
Materiales y métodos
Anamnesis
La Unidad de Rescate y Rehabilitación de Animales Silvestres (URRAS), ubicada en la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, sede Bogotá, en la capital de Colombia, alberga y rehabilita diversos grupos de animales silvestres, con el fin de regresarlos a su hábitat natural. Después de cumplir con el periodo de cuarentena, los animales son alojados en encierros que semejan su hábitat natural, y donde su dieta se formula de acuerdo con la especie, el peso, el estado de desarrollo biológico y la disponibilidad en el medio.
En el área Cuarentena residían varios ejemplares de tití gris (S. leucopus) que hacía poco habían ingresado a la Unidad decomisados por la autoridad ambiental, con procedencia y antecedentes desconocidos. Entre ellos había una hembra adulta, cuya cuarentena se llevó a cabo en una jaula de 1,5 × 1,5 × 1,5 m con un macho adulto de la misma especie, y en cercanía de otro macho más joven hospedado en otra jaula en el mismo salón, por 90 días. La dieta consistía principalmente en picado de frutas con suplemento de carbonato de calcio, menudencias, huevo, tenebrios y yogurt, así como agua ad libitum.
Hallazgos al examen clínico
Durante el examen clínico de rutina de los primates de la Unidad, en mayo de 2012, se llevó a cabo un chequeo médico general a la hembra de tití gris. La paciente se encontraba alerta, activa, con buen estado de hidratación, condición corporal regular (2,5/5) y pesaba 450 g. A la palpación abdominal presentaba una masa dura y móvil entre mesogastrio e hipogastrio, sin otros hallazgos anormales a la evaluación médica.
Se realizó una ecografía en la Clínica de Reproducción Animal por sospecha de una posible preñez, pero en el examen imagenológico no hubo hallazgos compatibles con esta. Como presuntos diagnósticos diferenciales de la masa se listó un quiste parasitario, por la presentación común del acantocéfalo Prosthenorchis spp. en primates en cautiverio (que causa granulomas y obstrucciones intestinales), y se consideró igualmente una posible organomegalia, un absceso o una neoplasia en abdomen.
Otros paraclínicos
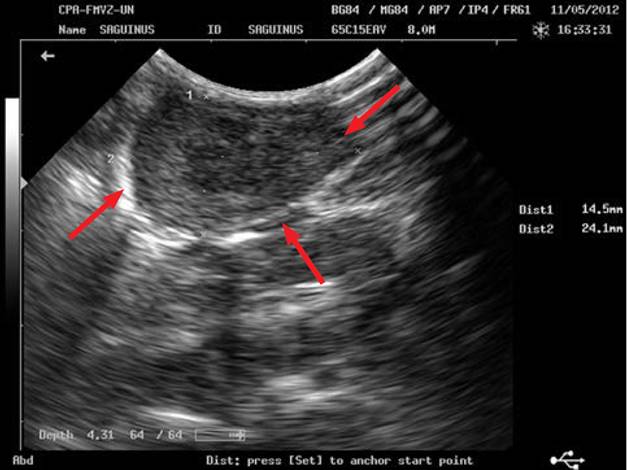
Se realizó una segunda ecografía, ahora en la Clínica para Pequeños Animales, mediante la cual se evaluaron todos los órganos de la cavidad abdominal. Se observó que la estructura posee centro anecogénico, es cavitaria, de paredes gruesas, sin forma precisa y mide 2,53 × 1 cm (figura 1). Parece continuarse con la vejiga o el colon, a los que está más próxima, o incluso tratarse del útero.
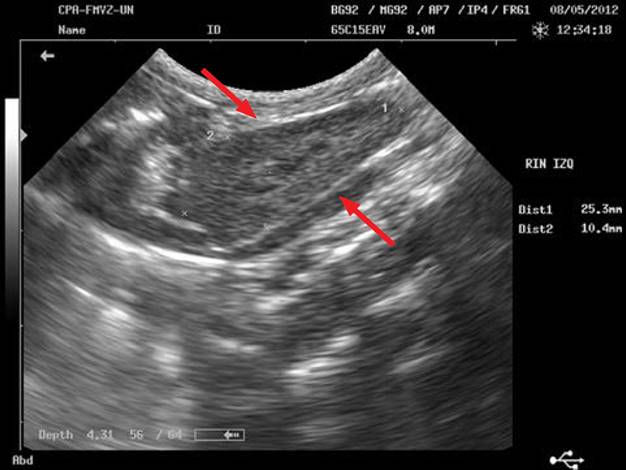
Días después se decidió realizar una citología eco-guiada en la misma clínica. En esta se observó la masa con una forma más definida, de 2,4 × 1,5 cm de larga, y sus paredes con 4 mm de grosor (figura 2).
El resultado de citología entregado por el Laboratorio Clínico reporta un aumento en el recuento de neutrófilos sin más observaciones particulares. Debido a estos hallazgos, se decide llevar a cabo una laparotomía diagnóstica en el Centro de Especialidades Veterinarias.
Fuente: elaboración propia
Figura 1 En la parte superior de la foto se observa la masa con centro anecogénico, cavitaria, de paredes gruesas, de contorno liso, de 2,53 × 1 cm y sin forma precisa
Cirugía
Como exámenes prequirúrgicos se realizaron cuadro hemático (CH) y medición de creatinina, cuyos resultados fueron leucocitosis moderada y leve trombocitopenia. La creatinina estuvo dentro de los valores normales para la especie, cuya referencia fueron los valores citados en el estudio de Fox et al. (21). El día de la cirugía se dejó en semiayuno a la paciente y se le administró ampicilina como tratamiento antibiótico por los resultados del recuento celular de la citología. En la tarde se hizo restricción física, usando nasa y guantes de carnaza, y se trasladó en guacal cubierto hasta el quirófano. En la tabla 1 se consignan los fármacos empleados para la restricción química, la inducción y la anestesia, así como los intraoperatorios. Para la intubación endotraqueal se usó una sonda urinaria núm. 8. El procedimiento quirúrgico se inició a las 3:30 p. m.
Tabla 1 Fármacos utilizados en preanestesia y anestesia para la laparotomía de la S. leucopus
*Fuente: tomado de Carpenter (22)
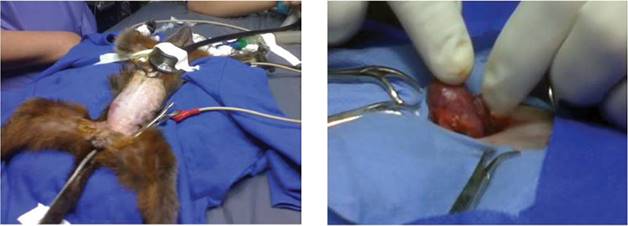
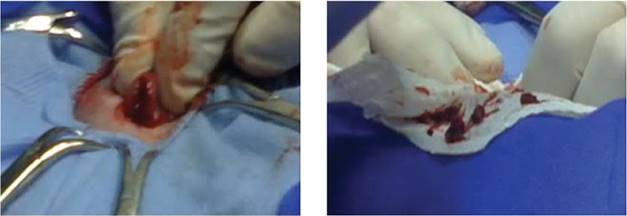
Después de conectar a la paciente al monitor de signos vitales y evaluar las frecuencias cardiaca respiratoria y la temperatura (figura 3, izq.), se hizo la desinfección del abdomen y se ubicaron los campos quirúrgicos delimitando el área que se iba a intervenir. Se administraron líquidos de mantenimiento a razón de 50 ml/kg/día IV en forma de bolos. La laparotomía se inició incidiendo el abdomen por la línea media, examinando cada uno de los órganos con cautela para dilucidar dónde estaba la masa, y se confirmó que se trataba del útero, que tenía las características descritas en las ecografías: duro a la palpación y con abundante contenido en su interior (figura 3, der.). Se incidió la víscera y se extrajo dicho material uterino de color amarillo-rojizo (figura 4); con ello se sospechó una momificación o un caso de piómetra, y se almacenó en un frasco con formol para su posterior envío al Laboratorio de Patología.
Fuente: elaboración propia
Figuras 3 A la izquierda, hembra de Saguinus leucopus preparándose para la cirugía y conectada al monitor de signos vitales; a la derecha, útero expuesto entre el campo de cuello, señalado por el cirujano, de apariencia congestionada, coloración rojiza, duro a la palpación y pletórico
Fuente: elaboración propia
Figuras 4 En medio del campo de cuello se aprecia el útero incidido transversalmente para evaluar y extraer su contenido; se observa cómo el cirujano presiona las paredes gruesas de la víscera para sacar el resto de material de color amarillo-rojizo; a la derecha, sobre la toalla blanca, se observan pequeños fragmentos de color rojo procedentes del útero, sin forma precisa y de textura blanda
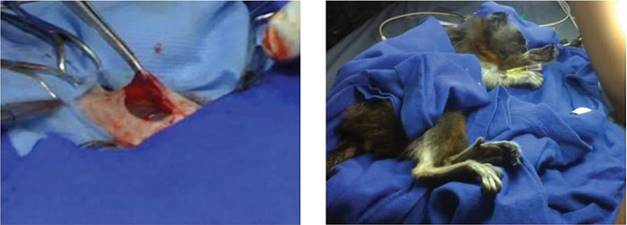
El útero fue suturado y regresado a la cavidad abdominal y luego se prosiguió al cierre de los diferentes planos (figura 5, izq.). El procedimiento terminó a las 5:30 p. m. (figura 5, der.). Se monitoreó a la paciente cada 5 min para evaluar sus condiciones fisiológicas y determinar su posición para la recuperación posquirúrgica. La paciente fue monitoreada durante toda la noche y no presentó reacciones desfavorables.
Fuente: elaboración propia
Figuras 5 A la izquierda, útero suturado devuelto a la cavidad abdominal; a la derecha, está la hembra de S. leucopus finalizada la intervención quirúrgica, la cual es monitoreada mientras despierta de la anestesia
Como plan posquirúrgico se instauraron los medicamentos señalados en la tabla 2 y se proporcionó la dieta en forma de papilla durante una semana. Luego de esta se ofreció alimento entero nuevamente.
Tabla 2 Tratamiento posquirúrgico establecido para la Saguinus
| Medicamento | Dosis*, vía y frecuencia |
|---|---|
| Ampicilina | 10 mg/kg , PO, BID por 8 días |
| Enrofloxacina | 5 mg/kg, PO, SID por 8 días |
| Meloxicam | 0,1 mg/kg, PO, SID por 3 días |
*Fuente: tomado de Carpenter (22)
Resultados
El contenido intrauterino se evaluó en el Laboratorio de Patología de la Facultad, el cual reportó los aspectos que se presentan a continuación (copia textual).
Descripción microscópica
Estructura con cambios autolíticos aparentemente sucedidos in vivo. La estructura está tapizada por un epitelio cilíndrico que en su propia presenta un severo infiltrado supurativo con escasa presencia de estructuras compatibles con colonias bacterianas. El tejido corresponde a útero con severos cambios circulatorios como hemorragia, congestión multifocal y microtrombosis severa bien organizada, que se asocian a una estructura densa, eosinofílica y amorfa con algunos cambios circulatorios y focos difusos de hemorragia. La mayoría de la superficie del tejido está constituida por una capa de células de citoplasma amplio, ligeramente basofílico, núcleos grandes, redondeados a ovalados, cromatina muy clara (eucromatina) y heterocromatina contra la membrana nuclear; se trata de células de la porción materna de la placenta. Estas células se encuentran entremezcladas con otras multinucleadas gigantes que recuerdan a las células del trofoblasto. Hay focos de mineralización difusos.
Discusión
En términos generales, las enfermedades uterinas en primates son menos conocidas y estudiadas de forma natural que en otros grupos animales. Sin embargo, las reportadas principalmente en los primates del Viejo Mundo abarcan: papilomatosis, piómetra, brucelosis, endometriosis, hiperplasia endometrial, endometritis, pólipos cervicales, carcinomas, leiomiomas, disgerminomas, adenomiosis y distocias (10,17,20,23,24).
La enfermedad observada en la hembra de tití gris en URRAS fue endometritis: una inflamación del revestimiento interno del útero producida por la infección con diferentes tipos de microorganismos como bacterias, hongos, virus o parásitos (20). Agentes bacterianos fueron los implicados en este caso. Cuando la patología causa obstrucción del canal cervical produce la distensión del cuerpo uterino, llenándolo de exudados o sangre (25), como se manifestó en esta paciente. A nivel histológico, la endometritis aguda se caracteriza por un infiltrado de leucocitos que llega a ocupar las glándulas, desorganizándolas y vertiendo exudados en su luz, donde en algunas ocasiones es posible ver los gérmenes responsables de la infección; mientras que la endometritis crónica se identifica por la presentación de granulomas inflamatorios inespecíficos, y cuando es posaborto se observan islotes de células trofoblásticas deformadas entre los infiltrados leucocitarios (26).
Regularmente, la endometritis obedece a una contaminación ascendente desde la vagina al momento del coito, la inseminación o durante el parto, aunque es igualmente posible que la infección llegue al útero por vía circulatoria (25,27).
En mamíferos, el útero es naturalmente un entorno estéril en contraste con la vagina que alberga numerosos microorganismos, y que bajo ciertas circunstancias son capaces de alcanzar el útero y desencadenar infecciones (25,27). En las mujeres existe una gran cantidad de lactobacilos en la biota vaginal natural. Estos producen ácido láctico que mantiene el pH bajo y así evitan la supervivencia de otros microbios. No obstante, cuando se presenta vaginitis infecciosa se da un sobrecrecimiento bacteriano que reemplaza los lactobacilos por biota anaerobia, generalmente de Gardnerella vaginalis y/o Mycoplasma hominis, que a la par cursa con aumento en el recuento de bacilos gramnegativos (28,29).
Entre los microorganismos más frecuentes responsables de patologías reproductivas en mujeres están Streptococcus agalactiae, causante de cistitis, amnionitis, endometritis y muerte fetal (30,31,32); Chlamydia (C. trachomatis y C. psittaci), que puede provocar cervicitis, síndrome uretral agudo, corioamnionitis, endometritis posparto y sangrado gestacional en mujeres embarazadas; y Mycoplasma (M. hominis y urealyticum), responsable de complicaciones como corioamnionitis posaborto y fiebre puerperal. Las mujeres con Mycoplasma genital son propensas además a sufrir aborto séptico y retraso intrauterino (28). Otros patógenos asociados a infecciones endometriales son Peptococcus, Peptostreptococcus, Clostridium, Streptococcus B, Staphylococcus aureus, Bacteroides fragilis, Pseudomonas aeruginosa y Escherichia coli (15,32).
En otras especies de primates no humanos, la microbiota normal del tracto genitourinario es algo distinta a la de las mujeres, como en el caso del mono Rhesus (M. mulatta), que está compuesta por Streptococcus viridans, Staphylococcus coagulasa negativos, Mobiluncus curtisii, Corynebacterium renale, Peptostreptococcus anaerobius y microorganismos similares a Gardnerella. En babuinos (Papio sp.) comprende Bacteroides, Corynebacterium, Streptococcus del grupo D, Lactobacillus y Mycoplasma (23). En monos nocturnos (Aotus azarai infulatus) corresponde a Staphylococcus lentus, S. intermedius, Staphylococcus urealyticus, Staphylococcus arlettae, Staphylococcus equorum, Staphylococcus warneri, Aerococcus viridans, Proteus mirabilis, E. coli, Morganella morganii y Pseudomonas aeruginosa (33). Dicha especificidad microbiológica de especie probablemente desempeña un papel importante en la susceptibilidad a determinados agentes infecciosos y en el desarrollo de patologías (23).
Los agentes bacterianos desencadenantes de infecciones reproductivas, abortos y mortinatos en primates incluyen Mycoplasma sp., encontrado en talapoines (Miopithecus talapoin) y en monos patas (Erythrocebus patas); Ureaplasma, como responsable de fallas reproductivas en chimpancés (Pan sp.); Listeria monocytogenes, involucrada en muerte fetal y aborto en una Cercopithecus mona (23,34,35). Algunos cocos grampositivos, como Streptococcus viridans, pueden producir corioamnionitis, mientras Staphylococcus sp. y Streptococcus spp. generan infecciones reproductivas en chimpancés. Bacterias gramnegativas del género Brucella son reconocidas como agentes promotores de aborto en primates y otras especies, y existen reportes de muerte fetal y retención de placenta en una colonia de babuinos (Papio cynocephalus) (23,35). Asimismo, está documentada la participación de E. coli en el aborto de una orangután (Pongo pygmaeus) y de la misma bacteria, junto a Actinomyces sp. y Staphylococcus spp., en casos de piómetra en monos Rhesus (23). La endotoxina de E. coli, causante de colapso circulatorio e incremento en la actividad uterina, también es capaz de generar muerte fetal por hipoxia y acidosis de acuerdo con un estudio hecho en babuinos. Yersinia pseudotuberculosis es epizoótica en monos ardilla (Saimiri sciureus), y causa abortos en monos nocturnos (Aotus trivirgatus). Salmonella spp. también produce aborto y está reportada en gibones de manos blancas (Hylobates lar). Shigella spp. está reportada en monos Rhesus. Leptospira spp. se ha descrito en gran variedad de especies silvestres, siendo además de gran importancia zoonótica, y se conoce que L. icterohemorragica fue el agente causal de aborto en una colonia de monos ardilla (20,23,35). Por su parte, infecciones genitourinarias en monos nocturnos (Aotus azarai infulatus) obedecen especialmente a microbiota natural oportunista, como Staphylococcus aureus, E. coli y Candida albicans, así como a microorganismos procedentes del intestino como Klebsiella spp., Enterobacter spp. o Pseudomonas spp., que contaminan el aparato reproductivo externamente después del contacto con excremento, y llegan a causar vulvovaginitis, cervicitis y endometritis (33).
Igualmente, existen otros agentes infecciosos implicados en patologías reproductivas, como los virus pertenecientes a la familia de los ortomixovirus, que pueden ocasionar aborto en primates de forma directa, o como el sarampión, un paramixovirus, que lo hacen de forma secundaria al generar inmunosupresión (23,35). Por su lado, el virus del papiloma se ha encontrado en monos Rhesus y colobos (Colobus guereza). Su antígeno fue reportado en monos cangrejeros (Macaca fascicularis) y, adicionalmente, se ha demostrado su transmisión venérea (20,23).
Entre los protozoos, Toxoplasma gondii se ha descrito en distintos primates, en los que ocasiona abortos, reabsorción embrionaria o nacimiento de crías débiles (20,36). La enfermedad de Chagas, causada por Trypanosoma cruzi, causa labor prematura, placentitis, abortos o mortinatos (20,35).
No obstante, existe mayor documentación de afecciones uterinas en animales domésticos, donde repercute también la participación del macho en la transmisión de infecciones, ya que microorganismos como Streptococcus γ, β y α hemolíticos se pueden propagar a través del líquido seminal, lo que trae como consecuencia endometritis e inclusive a metritis de curso purulento, al agruparse con otras bacterias o por la alta colonización de estas (27). Además, microorganismos como Pseudomonas spp., mientras tanto, afectan durante la cópula o como consecuencia de la contaminación del ambiente, lo que causa metritis séptica y puede ocurrir retención de membranas fetales (37).
Teniendo en cuenta la morfología de las bacterias y las lesiones del contenido uterino en esta S. leucopus, es posible sugerir que los agentes etiológicos involucrados más probables fueran E. coli, común en la microbiota y agente oportunista, así como Streptococcus spp., con sus diversos factores de virulencia, o Pseudomonas spp.; y pese a no llevarse a cabo otros estudios complementarios específicos como el cultivo, los hallazgos del caso son similares a lo descrito en las investigaciones para estos patógenos (20,23,25,27,31,32,33,37,38,39).
La endometritis supurativa en esta hembra de tití gris podría haber generado también una maceración, es decir: desintegrar el embrión o los embriones como resultado de la contaminación microbiana, siendo causada por las mismas bacterias o por sus toxinas (25,40). El resultado de patología señala productos placentarios en el contenido remitido, aunque no indica la evidencia explícita de tejidos embrionarios que pudieran ser reabsorbidos o evacuados.
Es difícil atribuir el factor desencadenante de la enfermedad en esta paciente de URRAS, y como se ha mencionado antes, podría derivar del estado al momento de la cópula o durante esta, el número de apareamientos, la contaminación fecal, la predisposición o la susceptibilidad individual, etc., aunado a que tanto su compañero como ella provienen del comercio ilegal de fauna, el cual suscita en sí mismo distrés y otras condiciones negativas en la salud de los animales traficados.
Para la S. leucopus (categoría EN) como especie de prioridad máxima de conservación, y en contraste con animales domésticos, la decisión terapéutica frente a estos padecimientos reproductivos no considera el abordaje diario local con lavados e infusiones intrauterinas, debido a criterios de manejo, tamaño del animal, duración del procedimiento y estrés por manipulación continua; tampoco implica la remoción quirúrgica del tracto reproductivo por ovariohisterectomía (OVH) en caso avanzado, sino que, indiscutiblemente, se opta por el plan terapéutico más accesible y que permita recuperar al máximo la integridad y fertilidad de la paciente. Cabe resaltar que a la fecha no hay suficientes estudios que describan epidemiología, diagnóstico o tratamiento de esta enfermedad en pequeños primates, por lo que se recurre a la información disponible para otras especies. Y si bien esta condición no había sido notificada antes en Saguinus, sí hay menciones sobre abortos, muerte intrauterina, momificaciones, eritroblastosis y distocias en otros calitrícidos, aunque en ninguno de esos casos se logró establecer la etiología (2,4,13,20).
Conclusiones
Se requieren estudios que permitan mayor conocimiento veterinario de los pequeños primates en cautiverio, con el fin de optimizar su medicina preventiva en los programas de conservación. Tales investigaciones pueden ir encaminadas a identificar su microbiota genitourinaria; establecer valores hormonales de referencia en sangre, heces y orina; determinar las características morfométricas e imagenológicas de sus órganos internos (según estado de desarrollo biológico, etapa del ciclo estral, preñez, etc.), de modo que se puedan emplear como pruebas diagnósticas para la detección temprana de trastornos reproductivos, también se deben establecer los factores de riesgo que desencadenan dichas patologías, la prevalencia de agentes infecciosos en cautiverio y las herramientas efectivas para su prevención, control o tratamiento, considerando la vulnerabilidad y supervivencia de los individuos afectados.