Introducción
Se entiende por endocarditis infecciosa (EI) al proceso patológico caracterizado por la inflamación de la superficie endocardial secundaria a la invasión de agentes microbianos (principalmente bacterias) a nivel de una o más válvulas cardiacas (1,2,3,4,5).
En primer lugar, la superficie endocardial y valvular en condiciones normales es poco receptiva a la adhesión microbiana (6), por lo cual es necesario el desarrollo de una lesión mecánica e inmunológica que promueva la agregación plaquetaria, y favorezca la invasión y colonización de microorganismos. Para esto último será necesaria la presencia de bacteriemia (1,3,6,7).
Con relación a las lesiones mecánicas, se trata principalmente de insuficiencias valvulares preexistentes y alteraciones congénitas (25 % de los casos) tal como la estenosis subaórtica (1,2,6,7,8,9) que ocasionan un flujo turbulento a través de las válvulas cardiacas.
Por otro lado, la degeneración valvular mixomatosa ha sido citada como un factor predisponente para el desarrollo de la patología (3). Lo anterior se ha demostrado fuertemente en humanos y se sospecha en medicina veterinaria (5); sin embargo, no ha sido confirmado, por lo cual diversos artículos la rechazan como factor predisponente (1,6).
Ahora bien, se ha reportado que las lesiones inmunológicas ocasionadas por el lupus eritematoso sistémico y la artritis reumatoidea ocasionan la formación y depósito de complejos inmunes a nivel endocardial, lo que favorece la aparición de la patología (3).
La disrupción endocardial (DE) ocasionada por lesiones mecánicas e inmunológicas permitirá la exposición del colágeno subendotelial, lo cual promoverá la activación de la cascada de coagulación y la adhesión plaquetaria sobre la superficie endocardial. Gracias a esto, se favorece la formación de vegetaciones, que deberán ser diferenciadas de procesos degenerativos crónicos valvulares a nivel ecocardiográfico (1,2,6,7,10).
Es importante recalcar que la presencia de bacteriemia (transitoria o persistente) será vital para el desarrollo de la EI. Existen reportes de asociación entre prostatitis, neumonía, pioderma, infecciones de tracto urinario y discoespondilitis con EI (1,3,4,5,11). La prevalencia en términos de afectación valvular se presenta principalmente a nivel mitral y aórtico (39 % y 31 %, respectivamente); esto se asocia al mayor gradiente de velocidad de flujo y presión que se presenta en el lado izquierdo del corazón (7,8,12,13,14).
Por su parte, la incidencia de la patología es baja, pues se presenta en un 0,05-0,08 % de los pacientes que acuden a centros veterinarios (12). La mayor incidencia se presenta en perros: 0,04-6,6 % (3,7,9), mientras que en gatos se estima una incidencia menor de 0,006-0,018 % (7,9).
La prevalencia racial de esta patología es mayor en perros de talla mediana a grande (85-90 %), principalmente pastor alemán, bóxer, golden retriever, labrador retriever y rottweiler (1,5,9).
Asimismo, se evidencia una mayor afectación de machos con relación a hembras (2:1) debido a la implicación de la prostatitis como factor de riesgo por considerar (5,7,11). Ahora bien, en gatos no hay prevalencia de genero reportada (7,9).
La etiología de la EI es principalmente bacteriana. Los patógenos principales que se reportan son Staphylococcus sp. (15 %), Streptococcus sp. (37 %) y Bartonella sp. (20 %). Asimismo, existen reportes de Pasteurella sp., Escherichia coli, Corynebacterium sp., Actinomyces sp. y Salmonella sp., entre otros (1,4,6, 8,11,14,15).
Reporte de caso
Un perro de raza pug, macho, castrado, de 5 años y 10 kg de peso acude por control de síndrome vestibular periférico secundario a posible pólipo en oído medio derecho, complicado con otitis media-interna (diagnosticado previamente y no responsivo a manejo médico). Tiene programación de otoscopía con posible ablación total del conducto auditivo derecho, junto con osteotomía de la bulla timpánica.
A la fecha de la consulta, el paciente se encontraba con manejo médico para hipotiroidismo (diagnosticado 6 meses antes). Asimismo, había sido manejado intrahospitalariamente por síndrome vestibular periférico, diagnosticado 22 días antes de la consulta por medio de valoración médica, examen neurológico y resonancia magnética (figura 1). El paciente, según conocimiento de los propietarios y sus médicos veterinarios, no había tenido servicios previos a la castración.
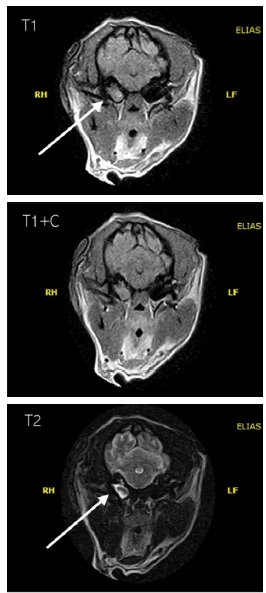
Figura 1 Corte axial de resonancia magnética de cerebro del reporte de caso. La bulla timpánica derecha se aprecia engrosada difusamente (flechas) con contenido que ocupa espacio captador de contraste caracterizado por su isointensidad en T1, incremento ligero y difuso de la intensidad periférica, seguido de la administración del medio de contraste (T1+C) e hiperintensidad en T2, lo cual sugiere otitis media-interna crónica derecha o proceso polipoide.
Cinco días antes de la consulta, el paciente había sido valorado por claudicación intermitente del miembro torácico izquierdo, para lo cual se hicieron placas radiográficas latero-medial y dorso-palmar de dicho miembro y el contralateral. No hubo hallazgos radiográficos significativos, por lo cual se indicó manejo con meloxicam (0,1mg/kg PO SID) durante 3 días, sin evidencia de mejoría clínica.
El día de la consulta se recibió el paciente para valoración clínica-quirúrgica. En ese momento, los propietarios reportaron inapetencia de 48 horas de evolución, estado mental deprimido, claudicación intermitente y renuencia al movimiento. En el examen físico general, se aprecia soplo 5/6 con punto de mayor intensidad mitral y aórtico (no evidenciado cinco días antes en consulta), taquicardia (164 lpm), fiebre (40,1 °C), claudicación 2/5 de miembro pélvico derecho, pulso femoral derecho hipocinético, disnea, respiración abdominal, inapetencia de 48 horas histórica, dolor a la palpación abdominal, déficit propioceptivo, hemiparesia derecha, torneo cefálico hacia la derecha, membranas mucosas pálidas, estado mental deprimido, dolor a la digitopresión toraco-lumbar y lumbo-sacro, posición de lordosis y cerumen en pabellón auricular bilateral aumentado.
Con base al examen físico general se arroja como diagnóstico presuntivo endocarditis infecciosa y se indica realizar cuadro hemático, creatinina, hemocultivo, placas radiográficas de tórax y abdomen, ecocardiograma y manejo medico intrahospitalario.
En el hemograma se apreció anemia normocítica normocrómica regenerativa junto con trombocitopenia. En el leucograma, se evidenció leucocitosis por neutrofilia con presencia de neutrófilos tóxicos, desviación a la izquierda y linfocitosis.
Tabla 1 Resultados de paraclínicos solicitados
| Parámetros | Valores del paciente | Valores de referencia |
|---|---|---|
| Eritrocitos [106/uL] | 3,1 | 5,4-7,8 |
| Hemoglobina [g/dL] | 6,7 | 13-19 |
| Hematocrito [%] | 20,0 | 37-54 |
| VCM [fL] | 66,0 | 62-74 |
| HCM [pg] | 22,1 | 22-27 |
| CMHC [g/dL] | 33,7 | 32-36 |
| Plaquetas [105/dL] | 147 | 160-430 |
| Leucocitos [103/dL] | 63,7 | 6-17 |
| Neutrófilos [103/dL] | 52,2 | 3-11,5 |
| Neutrófilos tóxicos 20 en 100 células | ||
| Bandas [103/dL] | 5,1 | 0-0,3 |
| Linfocitos [103/dL] | 6 | 1-4,8 |
| Monocitos [103/dL] | 0,0 | 0,1-1,4 |
| Eosinófilos [103/dL] | 0,0 | 0,0-0,9 |
| Basófilos [103/dL] | 0,0 | 0,0-0,1 |
| Creatinina [mg/dL] | 1,0 | 0,27-1,07 |
En las placas radiográficas de tórax en sus proyecciones laterolateral izquierda, derecha y dorsoventral se obtuvo un índice cardiovertebral de 12,5 (8,9-12,5). Asimismo, se realizaron placas radiográficas de abdomen en sus proyecciones laterolateral izquierda, derecha y ventrodorsal, sin hallazgos radiográficos patológicos aparentes.
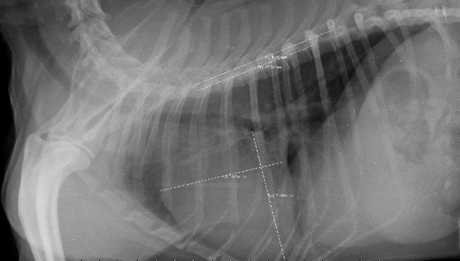
Figura 2 Placa radiográfica de tórax en su proyección laterolateral izquierda, donde se calcula un índice cardiovertebral de 12,5.
En el ecocardiograma se apreció engrosamiento valvular mitral, aórtico y lesiones vegetativas asociadas a una posible EI. Asimismo, se evidenció prolapso de la válvula mitral, hallazgo indicativo de insuficiencia valvular mitral con regurgitación severa.
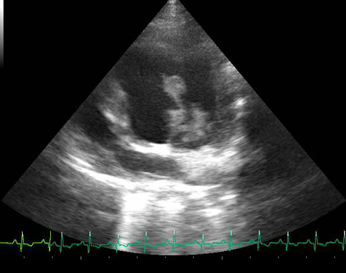
Figura 3 Ecocardiograma en ventana paraesternal izquierda con vista apical de cuatro cámaras en donde se aprecia a nivel de la válvula mitral engrosamiento de las hojas valvulares acompañado de estructuras hiperecoicas en el borde libre de las hojas valvulares.
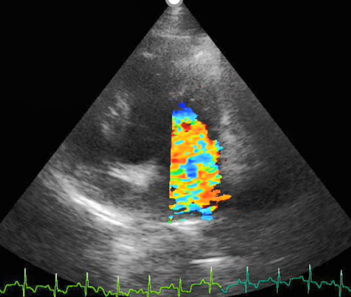
Figura 4 Ecocardiograma en ventana paraesternal izquierda con vista apical de cuatro cámaras en donde se aprecia a nivel de la válvula mitral por medio de Doppler color flujo sanguíneo turbulento con extensión del jet en la aurícula de más del 70 % que indica regurgitación severa.
Se inicia manejo intrahospitalario con ampicilina-sulbactam (30mg/kg IV TID), enrofloxacina (7,5mg/kg IM SID), metronidazol (15mg/kg IV BID), dipirona (2,5mg/kg IV TID), furosemida (1mg/kg IV BID), dexametasona (0,25mg/kg IV SID), flumixin meglumina (0,5mg/kg IV UD), azul de metileno (0,5mg/kg IV UD) y oxigenoterapia permanente. Antes de que se hubieran cumplido las 24 horas de manejo intrahospitalario, el paciente falleció. Finalmente, los propietarios no accedieron a la necropsia.
Discusión
La EI es una patología de baja incidencia. Los signos clínicos comúnmente asociados incluyen letargia (61 %), inapetencia (57 %) y deshidratación (16 %) (1,5,7,12). En la valoración clínica, los principales hallazgos reportados corresponden a la presencia de soplos cardiacos (89-96 %), de los cuales 41 % son de aparición súbita (1,5,7,12). De igual importancia se reporta fiebre (50-90 %) y alteraciones en las características del pulso (6).
Lo anterior coincide con lo evidenciado en el caso clínico, en el cual los signos más significativos incluyeron soplo de aparición súbita, cojeras intermitentes, inapetencia, taquicardia, fiebre, disnea y signos asociados a tromboembolismo (1,6,16).
A nivel del examen ortopédico, se evidencian cojeras intermitentes con alternancia del miembro afectado en el 44-53 % de los casos (asociado a posible tromboembolismo, sin descartar patologías inmunomediadas), edema en miembros (21 %), renuencia al movimiento (13 %) y dolor a la manipulación articular (6 %) (1,16).
En el caso reportado no se descartaron causas inmunológicas tales como lupus eritematoso sistémico o artritis reumatoidea, debido a la evolución del cuadro clínico del paciente; sin embargo, se debe tener en consideración dichos diagnósticos diferenciales cuando se aprecian alteraciones ortopédicas. En caso tal de que la evolución clínica lo permita, se deberán realizar las pruebas de laboratorio respectivas para su diagnóstico.
En el caso clínico el paciente presentaba pulso asimétrico, por lo cual se realizó valoración del flujo arterial aórtico e iliaco por ecografía Doppler, en donde no se evidenciaron hallazgos indicativos de tromboembolismo en dichas regiones. Sin embargo, no se descarta que la causa de las claudicaciones y la alteración del pulso se encontrara asociada con cambios hemodinámicos como es reportado en la literatura (7).
Los autores coinciden en que los principales signos clínicos de alarma en pacientes con sospecha de EI serán la presencia de un soplo de aparición súbita o incremento de un soplo preexistente y aquellos signos asociados con tromboembolismos (sin considerar los hallazgos paraclínicos).
Con relación a los paraclínicos realizados, en el hemograma se evidenció anemia normocítica normocrómica regenerativa, que se asocia a una posible hemólisis secundaria a fragmentación por lesión oxidativa, debido a la probable coagulación intravascular diseminada; vasculitis, y valvulopatía cardiaca. Por otro lado, se evidenció trombocitopenia asociada con el consumo secundario a posible coagulación intravascular diseminada, destrucción inmunomediada y vasculitis (11,12). En el leucograma se presentó leucocitosis por neutrofilia con presencia de neutrófilos tóxicos, desviación a la izquierda y linfocitosis, lo cual es indicativo de una posible respuesta del sistema inmune a proceso infeccioso, probablemente bacteriano agudo, de gravedad significativa. En el caso presentado, no fue realizado uroanálisis ni urocultivo; sin embargo, para futuros casos deberá ser considerado debido a la posibilidad de ingreso de bacterias a nivel sistémico por medio de infecciones del tracto urinario.
En el caso clínico, los hallazgos coinciden con los reportados en la literatura: anemia regenerativa (32 %), no regenerativa (52 %), leucocitosis (80-89 %), monocitosis (90 %), neutrofilia (80 %) y trombocitopenia (56 %) (1,4,5,11,12). En la bioquímica, los pacientes cursan con hipoalbuminemia (secundario al incremento de la permeabilidad capilar: 95 %), incremento de enzimas hepáticas (asociado a injuria hepática y colestasis: 56 %), azotemia (33 %) e hipoglucemia (secundaria a bacteriemia). En el caso clínico únicamente se valoró la creatinina, la cual se encontraba dentro de rangos de referencia (1,5,11).
El diagnóstico se realizó teniendo en consideración los criterios mayores y menores de Duke modificados (17,18). Con relación al criterio mayor de dos o más hemocultivos positivos (1,9,11), nuestro resultado negativo coincide con la incidencia del 61-70 % de casos que reportan hemocultivos negativos (1,3). En el caso que se presenta, el resultado se asoció a errores en la toma de la muestra ya que el paciente había iniciado terapia antimicrobiana antes del muestreo (12,18). Por otro lado, también influyó el hecho de que se tomó únicamente una muestra de sangre de 1 ml, contrario a lo indicado en la literatura -obtener mínimo 3-4 muestras con intervalos de 30-60 minutos, de mínimo 5-10 ml de sangre (1,7)-.
La prueba diagnóstica más importante, con una sensibilidad reportada del 87,5 % (6,19), corresponde al ecocardiograma (segundo criterio mayor). En este se aprecian masas hiperecoicas que oscilan independientemente del movimiento valvular, son de conformación irregular y están adheridas a la superficie valvular (lesiones vegetativas) que se diferencian de la superficie valvular por su ecogenicidad (19,20,21). En el caso las lesiones vegetativas se visualizaron en la válvula mitral y aortica, lo cual coincide con lo reportado (22,23).
El diagnóstico debe ser complementado con electrocardiograma cuando se evidencian alteraciones en la frecuencia y el ritmo cardiaco durante el examen físico o ecocardiograma, con prevalencia de arritmias en el 50-75 % de los casos (1,7). En el caso clínico no se evidenciaron alteraciones a nivel del electrocardiograma.
En las imágenes radiográficas de tórax, 24 % se aprecian sin alteraciones; en los casos restantes, las alteraciones estarán asociadas con cardiomegalia secundaria a insuficiencia cardiaca (1). Con relación al caso, el índice cardiovertebral corregido para la raza no indicaba cardiomegalia.
En el caso de pacientes que presentan alteraciones neuromusculares, se recomienda realizar análisis citológico de líquido intraarticular debido al riesgo de desarrollar poliartritis inmunomediada e inflamación séptica (1); sin embargo, de la literatura consultada, únicamente en el 34 % de los casos se realizó dicho procedimiento (1,11).
Con todo lo anterior, en el caso se obtuvo un diagnóstico definitivo para EI por medio de la sumatoria de los criterios de Duke modificado, es decir, un criterio mayor y 6 criterios menores (presencia de soplo cardiaco, signos de complicaciones vasculares, sospecha de enfermedad inmunológica, administración repetitiva de fármacos por vía intravenosa, temperatura corporal mayor a 39,4 ºC e inmunocompromiso) (1,9,11,17).
Ahora bien, se debe considerar que la literatura reporta como prueba irrefutable el PCR de las válvulas cardiacas post mortem con identificación de bacterias intralesionales, lo cual no fue realizado debido a que la necropsia no fue autorizada (7).
Con relación al manejo médico, específicamente hablando de la terapia antimicrobiana, se indica que se haga con base en el hemocultivo y las pruebas de sensibilidad (12). Sin embargo, debido a la alta incidencia de resultados negativos, el tiempo de procesamiento y la evolución clínica negativa acelerada que tienden a tener dichos casos, se recomienda comenzar el manejo con base en lo reportado en la literatura, teniendo en cuenta el origen primario de la infección y la modificación de la terapia en caso de considerarse pertinente luego de la interpretación de los resultados del hemocultivo y pruebas de sensibilidad (5,24).
En términos generales, se sugiere la administración de una penicilina junto con un potenciador de penicilina o una cefalosporina de primera o segunda generación, junto con metronidazol o clindamicina, y un aminoglucósido o fluoroquinolona durante un mínimo de 8-12 semanas (1,2,3,4,11,12,16). Existen reportes de resistencia frente a enrofloxacina, pradofloxacina y ampicilina, por lo cual no deben ser considerados como primera elección a menos de que sea indicado en las pruebas de sensibilidad (12,25,26).
La elección del manejo antimicrobiano (ampicilina, enrofloxacina), en nuestro caso, se realizó con base en lo reportado por Kittleson y Kienle (2010); sin embargo, como se mencionó previamente, literatura más reciente recomienda otros manejos (12,25,26,27).
Con la terapia antimicrobiana se espera disminuir el tamaño de las lesiones vegetativas, hacerlas menos friables y ligeramente calcificadas, de manera que se disminuya el riesgo de complicaciones tromboembólicas (7).
A la terapia antimicrobiana se le debe sumar el manejo para la insuficiencia cardiaca concomitante y los signos clínicos, así como el manejo para la bacteriemia y la fiebre asociada (1,7).
En caso de pacientes que logren ser estabilizados y dados de alta con manejo médico oral, se indica realizar hemocultivos semanales durante los primeros 30 días desde el inicio de la terapia antimicrobiana, luego de un hemocultivo cada dos semanas hasta finalizada la terapia. Asimismo, se recomienda realizar ecocardiogramas cada dos semanas durante el mismo periodo mencionado (1,6,7,11).
En nuestro caso, se sospechaba que la fuente primaria de infección era el oído medio-interno derecho, debido a los signos clínicos presentados en las consultas previas y los hallazgos de la resonancia magnética. Sin embargo, no hay reportes de literatura en donde se demuestra una relación de EI por otitis, pero sí hay reportes que indican que las infecciones crónicas ocasionadas por pólipos pueden ser un factor predisponente (4).
Por otro lado, en el caso no se consideró la enfermedad periodontal como fuente primaria de infección para el desarrollo de la EI, ya que en el 2009 Peddle, G. et al. reportan que no hay evidencia de asociación entre EI en caninos e infección oral o procedimientos quirúrgicos dentales (28). Asimismo, resultados similares han sido obtenidos múltiples veces en medicina humana; esto se ha discutido en la guía para la prevención de la EI publicada por la Asociación Americana para el Corazón (1,10).
El pronóstico de la patología es malo, pues se reporta una mortalidad del 33 % durante la primera semana posterior al diagnóstico (3,12) y del 92 % los 5 meses siguientes (3). Asimismo, en caso de afección de la válvula mitral se reporta un tiempo de sobrevida de 476 días, versus 3 días cuando se afecta la válvula aorta (1,3,13). Lo anterior coincide con lo reportado en el caso, en donde el paciente tuvo un tiempo de sobrevida menor a 24 horas después la valoración clínica, que se asoció a un posible síndrome de disfunción orgánica múltiple (29,30,31).
Por último, la literatura reporta que la muerte, por lo general, se encuentra asociada a falla cardiaca congestiva, complicaciones asociadas a tromboembolismo o eutanasia electiva (1,3,11).
Conclusiones
La EI es una patología de baja prevalencia en la clínica diaria. Debido a que lo anteriormente expuesto corresponde al reporte de un único caso, se debe tener cautela a la hora de extrapolar los hallazgos a otros casos clínicos. Asimismo, la limitación más grande del reporte es la falta de confirmación histopatológica de la EI. Se recomienda realizar la toma de muestras hematológicas antes de administrar antimicrobianos con el objetivo de utilizar las muestras para hemocultivo y considerar los protocolos pertinentes para el muestreo. Se debe tener presente, dentro de los diagnósticos diferenciales, etiologías inmunomediadas que puedan tener un efecto sistémico tanto a nivel cardiovascular como ortopédico, y considerar alteraciones congénitas cardiovasculares como factor de riesgo para el desarrollo de la patología.















