Introducción
La interacción de las especies está íntimamente ligada a los procesos ecológicos que rigen la vida (1). El cambio climático, la deforestación, las modificaciones en el uso de la tierra y el agua, la contaminación, la globalización, la explosión demográfica de la población humana y la creciente urbanización han alterado el funcionamiento y la capacidad de recuperación de los ecosistemas, actuando como impulsores antropogénicos de la emergencia y reemergencia de enfermedades (2, 3, 4). Al mismo tiempo, en este escenario, la capacidad de algunos agentes de infectar a una amplia gama de hospedadores resulta un factor de riesgo (5). Las modificaciones ambientales generan nuevos entornos de interfaz en los que las tasas de contacto entre especies silvestres, domésticas y humanos podrían incrementarse, favoreciendo la transmisión de ciertos patógenos (6, 7, 8). En ese sentido, en ecosistemas fragmentados, la modificación de las áreas borde genera zonas de transición con condiciones ambientales abruptamente diferentes (9, 10). Bajo determinadas circunstancias, la preservación de los ecosistemas y su biodiversidad contribuye a la salud global, reduciendo la prevalencia de ciertas enfermedades infecciosas, y minimizando los riesgos de que ocurran saltos zoonóticos o spillover (8). En las últimas décadas, la estrategia “Una Salud” ha tenido como objetivo abordar la salud de forma colaborativa y transdisciplinaria, por medio de una visión integradora de los vínculos existentes entre las personas, los animales y los entornos que ellos habitan, contribuyendo a prevenir las enfermedades epidémicas y epizoóticas, en torno a la salud pública y la conservación de la biodiversidad (4).
La Ciudad Autónoma de Buenos Aires (CABA), capital de la República Argentina, está habitada por 2,89 millones de personas (11). En ella existen áreas naturales semiurbanas protegidas, como la Reserva Ecológica Costanera Sur (RECS), ubicada a orillas del Río de la Plata, en el extremo sureste de la ciudad. Esta presenta un estrecho contacto con áreas urbanizadas y particularmente con el barrio Rodrigo Bueno (BRB) (12).
La RECS comprende 353 hectáreas, de las cuales cerca del 40 % está ocupado por humedales. Sus hábitats ribereños están formados por bosques, matorrales, pantanos de agua dulce y praderas inundables. En ese sentido, los diversos cuerpos de agua y los territorios bañados por ellos son los ambientes más representativos y ricos por la diversidad biológica que sustentan (12, 13). Una de las problemáticas actuales de la RECS es la circulación de grupos de perros (Canis lupus familiaris), que aparentemente no tienen tenedor responsable, y que podrían provenir de zonas urbanizadas vecinas (14). Estos representan así una amenaza para la conservación y la salud, la cual está asociada a comportamientos de depredación sobre la fauna silvestre nativa y a la potencial diseminación de patógenos entre ambientes naturales y áreas urbanas (15).
Se debe señalar que la leptospirosis es una zoonosis de distribución mundial (16, 17). Su ciclo implica la compleja interacción entre humanos, reservorios animales, en especial pequeños marsupiales y roedores, y el entorno en el que conviven (18, 19). Roedores del género Rattus, especialmente R. norvegicus y R. rattus son las principales especies que actúan como fuentes de infección (20). Además, se ha determinado que el papel epidemiológico de las diferentes especies se relaciona con su capacidad para convertirse en portadores renales (21, 22). En tanto, factores ambientales y sociodemográficos, como la falta de saneamiento y agua potable, el clima y el uso de la tierra, establecen entornos propicios para la transmisión de la enfermedad asociada a los roedores (19, 21). En ambientes cálidos y húmedos, la supervivencia de Leptospira spp. es mayor (23), pudiendo persistir durante meses en ambientes acuosos pobres en nutrientes (24). En Argentina, la leptospirosis en humanos es endémica, se presenta en forma de brotes (25) y se ha identificado en diversas poblaciones de mamíferos silvestres, como D. albiventris (comadreja overa), y O. flavescens (ratón colilargo), así como en animales domésticos, como Canis lupus familiaris (perro doméstico) (26, 27, 28, 29, 30).
Las características ambientales de la RECS, en la que pastizales, bosques y abundantes cuerpos de agua de régimen variable se encuentran inmersos en una matriz ambiental heterogénea lindante con asentamientos urbanos, podrían condicionar la estructura de las comunidades animales, tanto silvestres como domésticas. Aquello terminaría determinando el rol epidemiológico de los potenciales reservorios de Leptospira spp. en este entorno. En ese entorno, el objetivo de este trabajo fue identificar y analizar variables ambientales y ecológicas asociadas a mamíferos silvestres y perros que circulan en los diferentes ambientes de la RECS, y analizar su rol como potenciales reservorios de Leptospira spp. en el área.
Materiales y métodos
Área de estudio
La Reserva Ecológica Costanera Sur (RECS) está ubicada a orillas del Río de la Plata en el extremo sureste de la ciudad de Buenos Aires (CABA) (34° 36′ 14″ S, 58° 21′ 9″ O), y está incluida en la provincia biogeográfica Pampeana (31). Esta además limita al norte, oeste y sur con la provincia biogeográfica del Espinal.
El área que se ubica sobre la costa del río fue un balneario municipal hasta fines de la década de 1960. Años más tarde, fue rellenada con material de demolición y sedimentos provenientes del dragado del Río de la Plata. Posteriormente, la obra fue abandonada, y con el tiempo el área fue colonizada por diversas comunidades vegetales. Las zonas bajas dieron origen a los cuerpos de agua; por ello, los humedales de la RECS se asientan sobre una estructura física artificial pero las especies de flora y fauna que se sustentan por un régimen hidrológico y ecológico son de origen natural (12, 13). El clima de la región es templado - cálido. La RECS, como humedal urbano, fue declarada sitio Ramsar (Convención de Humedales de Importancia Internacional) en el 2005. En concordancia, los cuerpos de agua y los bañados son los ambientes más representativos del ecosistema ribereño, y los más ricos por su diversidad biológica: más de 200 especies de aves, mamíferos como la comadreja overa (Didelphis albiventris), la comadreja colorada (Lutreolina crassicaudata) y roedores de varias especies (Cavia aperea, Mus musculus, Deltamys kempi, Oligoryzomys flavescens, Scapteromys aquaticus, Rattus rattus y Rattus norvegicus). Sus comunidades vegetales están constituidas por bosques, arbustales, comunidades herbáceas y comunidades acuáticas que conforman las selvas higrófilas que se desarrollan en las riberas de los ríos Paraná, Uruguay y sus afluentes (13). Cabe señalar que una singularidad de la reserva es que presenta un estrecho contacto con áreas urbanizadas. En lo que respecta a eso, el barrio Rodrigo Bueno se ha asentado dentro del territorio sur perteneciente a la RECS y, en el año 2010, estaba habitado por aproximadamente 3600 personas, cuyas precarias viviendas tienen deficiencias en cuanto al suministro de electricidad, agua potable, gas y cloacas (12).
Población en estudio
La población en estudio comprendió la comunidad de mamíferos silvestres pequeños y medianos de la RECS y los perros, con o sin tenedor responsable, que circulaban dentro de la reserva o entre la reserva y el barrio Rodrigo Bueno.
Diseño de muestreo
Para estudiar los mamíferos silvestres, se realizaron muestreos estacionales durante los años 2014 y 2015 en la RECS. Se realizó un diseño por conveniencia (dado por la accesibilidad a la unidad de muestreo) en líneas transectas, estratificado y proporcionado en función del tipo de área. En dicho escenario, los sitios de muestreo estipulados fueron georeferenciados (GPS Garmin E-trex 10), y el trabajo de campo fue llevado a cabo por nuestro equipo con la colaboración del personal del Instituto de Zoonosis Dr. Luis Pasteur del Gobierno de la Ciudad de Buenos Aires. Los perros incluidos en el estudio fueron aquellos que asistieron a las campañas de control poblacional organizadas por la Agencia de Protección Ambiental (APrA) del Gobierno de la Ciudad de Buenos Aires, dentro del área de estudio.
Identificación de variables ecoambientales
Para la recolección de estos datos se confeccionó una planilla transecta de muestreo, que se completó durante cada campaña. Todos los datos se obtuvieron por observación directa, salvo la que correspondía a la variable “daños por incendios”, para la que se utilizaron los registros de la Fundación BioRECS.
Variables de caracterización del tipo de área
Área conservada vs. área degradada: la categorización de área conservada o degradada quedó definida de acuerdo con las siguientes variables: carga de basura, carga de escombros, limitante con áreas de actividad humana, limitante con caminos principales, o si el área dispone de un acceso público.
En cada área se asignó un valor para cada variable. Estas variables fueron dicotomizadas en cada categoría (alta carga/baja carga, limita/no limita, dispone/no dispone) asignándoles un valor de 1 y 0, respectivamente. Los valores de las cinco variables fueron sumados, obteniéndose una puntuación final que definió el estado de la transecta. El rango de valores varió entre 0 y 5, las transectas que sumaron 0 ó 1 quedaron definidas como áreas conservadas y aquellas que sumaron 2, 3, 4 ó 5 quedaron definidas como degradadas. De tal forma, la categorización de un área como “conservada” utilizada en este estudio responde a los criterios previamente descritos y establecidos por nuestro grupo de trabajo, resultantes en un análisis comparativo de los ambientes de la RECS, sin ajustarse necesariamente a la definición de área natural conservada (32, 33).
Variables de caracterización ambiental
Daños por incendios (presencia/ausencia): se define por la ocurrencia de al menos un episodio de incendio durante el periodo comprendido entre enero de 2014 y diciembre de 2015.
Zonas inundables (presencia/ausencia): se define por la ocurrencia de inundaciones dentro de la transecta al menos una vez a lo largo del periodo de estudio (entre 2014 y 2015).
Cuerpos de agua estables (presencia/ausencia): presencia de al menos un cuerpo de agua estable, independientemente de sus dimensiones.
Muestreo de mamíferos silvestres
Se utilizaron trampas tipo Tomahawk y trampas Sherman de captura viva, las cuales fueron instaladas en las transectas previamente definidas, y fueron revisadas diariamente. Como cebo se utilizaron vísceras de pollo y pellets elaborados con avena, mantequilla de maní y esencia de vainilla. Se calculó el esfuerzo de captura considerando el número de trampas colocadas por la cantidad de noches que estuvieron activas, y el índice de esfuerzo de captura como el número de animales capturados sobre el número de trampas colocadas diariamente por 100 (34).
Los mamíferos silvestres capturados fueron inmovilizados utilizando anestesia inhalatoria, mediante una inducción en cámara anestésica con Isoflurano (Richmond®) al 5 %, seguida de un mantenimiento al 3 % durante los primeros 5-10 minutos, y luego al 1,5 % a través de mascarilla o mediante intubación endotraqueal. Una vez recuperados, los mamíferos, a excepción de los microroedores, fueron liberados en el sitio de captura. Los microroedores fueron eutanasiados utilizando una sobredosis de isoflurano de acuerdo a las normas de ética y bioseguridad (35). Posteriormente, fueron necropsiados. Solo se adicionaron a las necropsias aquellos mamíferos medianos hallados muertos, por motivos ajenos a la investigación, al momento de la recorrida. Los especímenes eutanasiados fueron depositados en la colección del Museo de Ciencias Naturales “Bernardino Rivadavia” de la CABA.
Muestreo de perros
Todos los perros fueron evaluados mediante un examen clínico completo, con el fin de establecer su estado sanitario y determinar la ocurrencia de signos de enfermedad que pudieran o no ser compatibles con un cuadro presuntivo de leptospirosis. Luego, se procedió con la toma de muestras.
Toma de muestras
La extracción de sangre se realizó utilizando la vena safena, vena yugular, o la vena o seno coccígeo, según la especie. La extracción de orina se realizó mediante punción o compresión vesical (36, 37). Las muestras de sangre fueron centrifugadas durante 15 minutos a 2000 rpm, y el suero fue conservado en tubos crioviales a -18ºC. Las muestras de orina se colectaron en tubos estériles, diluyendo 1/3 de estas en 2/3 de PBS (solución amortiguadora por fosfatos), con el fin de preservar un pH neutro para la supervivencia de Leptospira spp. Durante las necropsias de los roedores se extrajeron ambos riñones en tubos estériles, destinando uno al cultivo y el otro a técnicas moleculares (PCR). Hasta su llegada al laboratorio, todas las muestras fueron conservadas refrigeradas a 4°C, y trasladadas en el término de doce a dieciocho horas posteriores a la extracción.
Diagnóstico de Leptospirosis
Todos los diagnósticos para Leptospira spp. se realizaron en la Dirección de Laboratorios y Control Técnico del Servicio Nacional de Sanidad y Calidad Agroalimentaria, laboratorio de referencia de Leptospirosis para la Organización Internacional de Sanidad Animal. Se realizó la prueba de aglutinación microscópica (MAT) empleando los serovares más prevalentes en Argentina, tanto en especies domésticas como en especies silvestres, siguiendo los lineamientos de la Comisión Científica de Leptospirosis de la Asociación Argentina de Veterinarios de Laboratorios Diagnósticos (38): Canicola, Castellonis, Copenhageni, Grippotyphosa, Hardjo, Pomona, Pyrogenes, Tarassovi, y Wolffi (tabla 1).
Tabla 1 Serovares de Leptosipra spp utilizados en la prueba de mircroagluinación (MAT)
| Especie | Serogrupo | Serovar | Cepa |
|---|---|---|---|
| L. interrogans | Canicola | Canicola | Hond Utrecht IV |
| L. borgpetersenii | Ballum | Castellonis | Castellon 3 |
| L. interrogans | Icterohaemorrhagiae | Copenhageni | M20 |
| L. kirschneri | Grippotyphosa | Grippotyphosa | Moskva V |
| L. interrogans | Sejroe | Hardjo | Hardjo prajitno |
| L. interrogans | Pomona | Pomona | Pomona |
| L. interrogans | Pyrogenes | Pyrogenes | Salinem |
| L. borgpetersenii | Tarassovi | Tarassovi | Perepelicin |
| L. interrogans | Sejroe | Wolffi | 3705 |
Fuente: elaboración propia
El punto de corte fue 1/50 para especies silvestres y 1/100 para especies domésticas. Para los cultivos se emplearon medios Fletcher y Ellinghausen-McCullough-Johnson-Harris (EMJH) con y sin el agregado de 5-fluorouracilo. Los cultivos se mantuvieron en estufa a 28ºC, siendo examinados una vez por semana durante un periodo total de 6 meses (38, 39). Para la reacción en cadena de polimerasa (PCR) se utilizaron tanto las matrices tisulares (riñón) como las matrices fluidas (orina). El ADN se extrajo mediante el kit comercial de Qiagen N.V. blood and tissue®. Se utilizó en todas las ocasiones un control de extracción negativo. Para comprobar la correcta extracción de ADN, se realizó una PCR con primers genéricos para células eucariotas (40). Se utilizaron dos sets de primers, según Gravekamp et al. (1993) (41) para el diagnóstico en orina (G1/G2, B64-I/B64-11). Para el tejido renal se utilizaron los primers LipL32 Fw/Rv según Boonyod et al. (2005) (42). En todos los casos se utilizaron controles positivos y negativos para cada reacción de PCR. Los productos de PCR se revelaron mediante electroforesis en gel de agarosa al 2 % con el agregado de bromuro de etidio para visualizar el ADN replicado.
Análisis de resultados: Los resultados fueron analizados empleando el test de chi-cuadrado, diferencia de proporciones, OR y razón de razones según correspondiera. Se trabajó con una confianza del 95 % y un nivel de significación de 0,05 (p<0,05), utilizando el programa Epi Info (versión 3.5.4) y el programa Statistix (versión 8.0). El análisis descriptivo de las especies registradas se llevó a cabo considerando todos los individuos capturados en el total de la extensión de la RECS. Para el análisis de las variables ambientales, solo se incluyeron aquellos individuos capturados dentro de las transectas georeferenciadas y caracterizadas en el diseño previamente estipulado.
Resultados
Caracterización climática
Las campañas de muestreo se caracterizaron en función de la temperatura, humedad y precipitaciones. Los resultados se muestran en la tabla 2.
Tabla 2 Datos climáticos ambientales correspondientes a la época de realización de las campañas de captura de animales silvestres en la Reserva Ecológica Costanera Sur en los años 2014 y 2015
| Temporada | Precipitaciones (mm totales) | Temperatura media (°C) | Humedad media (%) |
|---|---|---|---|
| Cálida 2014 | 211 | 20,5° | 76,5 % |
| Fría 2014 | 82,5 | 11,4° | 85 % |
| Cálida 2015 | 204,3 | 20,3° | 81 % |
| Fría 2015 | 13 | 11,7° | 66 % |
Fuente: elaboración propia
Categorización de los ambientes de la RECS
Se muestreó un total de 16 transectas a lo largo de la RECS. El 50 % de las transectas (8/16) presentó zonas inundables, el 62,5 % (10/16) tenía cuerpos de agua estables, y el 18,7 % (3/16) había sufrido daños por incendios. En función de la caracterización del tipo de área, el 31,2 % de las transectas (5/16) fue definido como “conservadas”, y el 68,8% (11/16) como “degradadas” (figura 1).
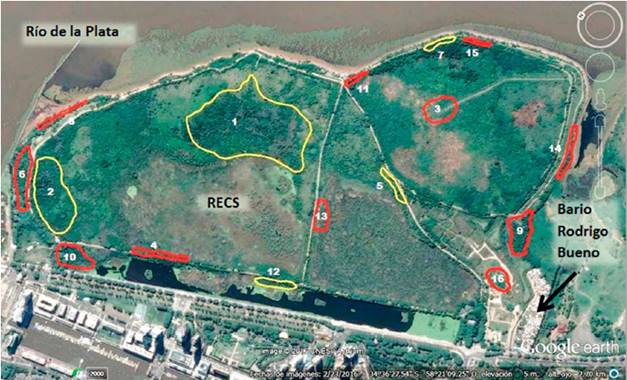
Fuente: Google Earth, modificado por la autora
Figura 1 Ubicación geográfica de las áreas de muestreo y clasificación según tipo de área. Contorno rojo: área degradada, transectas 3, 4, 6, 8, 9, 10, 11, 13, 14, 15, 16. Contorno amarillo: área conservada, transectas 1, 2, 5, 7, 12. Se marca con una flecha la ubicación del barrio Rodrigo Bueno.
Muestreo de mamíferos silvestres
Se capturó un total de 140 mamíferos, pertenecientes a 10 especies diferentes: Oligoryzomys flavescens (65), Didelphis albiventris (27), Deltamys kempi (21), Mus musculus (7), Scapteromys aquaticus (7), Lutreolina crassicaudata (6), Rattus norvegicus (2), Cryptonanus chacoensis (2), Cavia aperea (2) y Chaetophractus villosus (1).
La especie con mayor frecuencia de captura fue O. flavescens (ratón colilargo), con un total de 65 ejemplares, que corresponden al 46,40 % del total de mamíferos silvestres capturados, seguido por D. albiventris (comadreja overa), con 27 ejemplares capturados, representando el 19,30 %, y D. kempi, con 21 ejemplares, que representan un 15 % del total (figura 2).
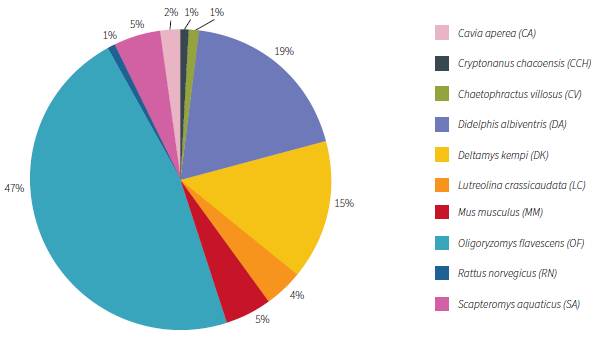
Fuente: elaboración propia
Figura 2 Distribución de las especies silvestres capturadas en la Reserva Ecológica Costanera Sur, entre los años 2014 y 2015
Para las trampas tipo Tomahawk se totalizó un esfuerzo de 897 trampas-noche, y para las trampas Sherman, un total de 1618 trampas-noche. El índice de esfuerzo de captura fue de 5,12 % para las trampas tipo Tomahawk, y de 5,74 % para las trampas Sherman.
Muestreo de perros
Se muestreó un total de 30 perros, 15 machos y 15 hembras. Del total de perros muestreados, 21 (70 %) fueron perros con tenedor responsable cuyo domicilio de residencia era el BRB. Los 9 perros restantes (30 %) circulaban libremente dentro de la RECS.
Variables ambientales y ecológicas asociadas a mamíferos silvestres y domésticos
No se encontraron diferencias significativas entre las variables climáticas, y las variables ambientales y ecológicas determinadas para animales silvestres y domésticos.
Se analizó un total de 127 animales silvestres. Dentro del área definida como conservada se capturaron 64 ejemplares de 5 transectas (64/5) y, dentro del área definida como degradada, se capturaron 63 ejemplares de 11 transectas (63/11) (tabla 3).
Tabla 3 Distribución de las especies según tipo de área donde fueron capturadas. Reserva Ecológica Costanera Sur, años 2014 y 2015
Fuente: elaboración propia
Se calculó la razón o diferencia de razones (Odd Ratio-OR). Para el área conservada se obtuvo un valor de 12,8, y para el área degradada este fue 5,72, lo que resultó en una razón de razones de 2,235 (intervalo de confianza - IC: 1,12 - 3,348). La relación de captura en función de las transectas muestreadas fue 1,235 veces mayor en el área conservada que en el área degradada.
El análisis de la diferencia de proporciones para las variables ambientales en función de cada especie resultó significativo para D. albiventris, cuya proporción de ejemplares capturados fue significativamente mayor en el área definida como conservada que en el área degradada. Coincidentemente, estas resultaron listadas en asociaciones estadísticas significativas para todas las variables ambientales que definen el tipo de área. Para D. kempi la proporción de ejemplares capturados en áreas definidas como conservadas fue mayor que en las degradadas, si bien no resultó significativo al análisis estadístico. Para el resto de las especies, no hubo diferencias significativas.
Tanto para D. albiventris, para O. flavescens y D. kempi la proporción de ejemplares capturados fue significativamente mayor en aquellas transectas no limitantes con áreas de actividad humana, con presencia de cuerpos de agua estables y que no sufrieron daños por incendios. La presencia de zonas inundables resultó significativa para la presencia de ejemplares de D. albiventris y O. flavescens (tabla 4).
Tabla 4 Distribución de las especies D. albiventris, D. kempi y O. flavescens según tipo de área y variables ambientales de las transectas donde fueron capturadas. Reserva Ecológica Costanera Sur, años 2014 y 2015
Los valores marcados con un asterisco (*) son valores significativos para el test estadístico (p<0,05).
Fuente: elaboración propia
Diagnóstico de Leptospirosis
Se obtuvo un total de 62 muestras de suero para MAT y 27 muestras de orina aptas para PCR. En ese escenario, 23 muestras de orina fueron aptas para cultivo, se descartaron 4 muestras de orina por no cumplir las condiciones de esterilidad. Fueron colectados y analizados 107 pares de riñones en total.
Todas las muestras resultaron negativas a Leptospira spp. para cultivo y aislamiento y diagnóstico molecular. Las muestras de suero fueron negativas, a excepción de una muestra perteneciente a un perro macho de 3 años y medio sin tenedor responsable, que fue positivo por aglutinación microscópica (MAT) a Leptospira serovar Canicola, con un título de 1:800 (tabla 5).
Tabla 5 Total de muestras analizadas y sus resultados según método diagnóstico (MAT: prueba de aglutinación microscópica, PCR: reacción en cadena de polimerasa) para Leptospira spp. Se detallan las especies de las cuales fueron obtenidas en la RECS, entre los años 2014 y 2015.
Fuente: elaboración propia
Discusión
En el presente trabajo, fue analizada un área natural de relevancia para la ciudad de Buenos Aires en Argentina, como lo es la RECS. Se compararon factores ambientales y ecológicos, definiendo áreas “conservadas” y “degradadas” y utilizando un modelo de enfermedad zoonótica: la leptospirosis, evaluada en especies que son potencialmente reservorios, tanto silvestres como domésticos, las cuales conviven. Algunas de las especies silvestres estudiadas, como los roedores del género Rattus, pueden tener un rol relevante como reservorios de Leptospira spp. (17, 20, 21, 43, 44, 45, 46, 47, 48) y los distintos grados de perturbación de los ambientes podrían modificar su distribución y las condiciones en las que se presenta el patógeno (27).
Los resultados sugieren diferencias en cuanto a las especies silvestres que habitan los distintos tipos de áreas muestreadas en la RECS, pues se hallan D. albiventris y D. kempi en las áreas definidas como conservadas (en las cuales el impacto antrópico es menor), y se encuentran O. flavescens circulando en ambas áreas, y una baja abundancia de roedores del género Rattus solo en áreas degradadas de la reserva. En este contexto, con un esfuerzo e índices de captura elevados, similares a los reportados por otros investigadores en el área (49, 50), no se ha detectado Leptospira spp. en ninguna de las muestras de los mamíferos silvestres analizados. El perro, que presentó una serología positiva a Leptospira spp., sugiere la posible exposición de la población canina al patógeno, si bien nuestros resultados no permiten determinar que la exposición se haya asociado a reservorios silvestres en la reserva o en las áreas de interfaz. Los datos obtenidos en este estudio aportan nuevas evidencias sobre la ocurrencia de especies que son reservorios potenciales de Leptospira spp., tales como O. flavescens y D. albiventris (27, 28, 51, 52) en la RECS, donde las condiciones ambientales propiciarían su presencia. Por el contrario, la circulación de roedores del género Rattus, el principal reservorio de Leptospira spp. en la región, estaría menos propiciada bajo las condiciones ambientales de la reserva, si bien su presencia en áreas periféricas como el barrio Rodrigo Bueno, sumada a la libre circulación de perros entre los diferentes ambientes, podría significar un riesgo potencial con relación a la leptospirosis.
El ingreso de perros a las áreas naturales protegidas ha sido objeto de numerosos estudios (53, 54, 55, 56), debido al potencial intercambio de agentes infecciosos entre especies domésticas y silvestres (15, 57, 58). En este estudio hemos obtenido un único resultado positivo de Leptospira spp., hallado en un perro sin tenedor responsable que circulaba libremente en la reserva. Este resultado demuestra la posible ocurrencia de exposición a Leptospira spp., si bien se trata de un título serológico y el animal no se pudo relocalizar para la obtención de una segunda muestra que permitiera evaluar la ocurrencia de seroconversión. En este estudio, se incluyeron solamente perros que circulaban en la RECS y/o en el BRB, por lo cual el número de animales muestreados fue bajo en comparación con otros trabajos. Los resultados obtenidos en el ámbito de la ciudad de Buenos Aires, con más de 100 perros, documentaron que en estas poblaciones que habitan otros barrios marginales se obtuvieron valores de seropositividad a Leptospira spp. Valores que se sitúan entre el 20 % y el 42,24 % (59). Sin embargo, los resultados de este estudio fueron integrales en la lectura de una interfase doméstico-silvestre, y reflejaron la situación de ingreso y circulación de perros en la RECS y sus áreas de borde entre 2014 y 2015.
Coincidentemente con lo publicado por Cavia et al. (2008) (49), la frecuencia de captura de roedores del género Rattus dentro de la RECS ha sido muy baja. La especie R. norvegicus, de características sinantrópicas, se destaca por su capacidad para habitar ecosistemas antropizados, adaptándose a las condiciones ambientales creadas o modificadas como resultado de la actividad humana (60, 61). Durante estudios llevados a cabo por Cueto et al. (2008) y Blanco Crivelli et al. (2014, 2018) (62, 63, 64), dentro del barrio Rodrigo Bueno, se han capturado numerosos ejemplares de R. norvegicus, y se han analizado las conductas, actitudes y percepciones de la población humana del área con respecto a estos roedores. Más del 80 % de la población afirmó haber observado R. norvegicus en las cercanías de su barrio (65) y análisis (cultivo y aislamiento) llevados a cabo en el Laboratorio del Servicio Nacional de Sanidad Animal, a partir de muestras de riñón de los ejemplares capturados en 2017, revelaron resultados positivos a Leptospira spp. (66).
La especie Didelphis albiventris ha sido descrita como una hospedadora y potencial reservorio de Leptospira spp. (51, 52, 67, 68), y fue capturada con alta frecuencia en las áreas definidas como conservadas, las que en el contexto de la RECS, serían más propicias para esta especie que las áreas degradadas. La relevancia del estudio de estas poblaciones y su caracterización ambiental se basa en que tanto perros como zarigüeyas podrían cumplir un rol epidemiológicamente relevante como “puente” en áreas de interfaz entre poblaciones silvestres y domésticas (69, 70). La D. albiventris tiene hábitos generalistas y estaría asociada a ambientes con diferentes grados de impacto antrópico (34, 71, 72), mientras que en la RECS parece habitar preferentemente los parches de bosque con mejor estado de conservación, los que permitirían la supervivencia de sus poblaciones en un ambiente modificado, pero con menor impacto antrópico que las zonas caracterizadas como degradadas.
Algo similar ocurre con los roedores de las especies O. flavescens y D. kempi, los que en este estudio fueron capturados con alta frecuencia en las distintas áreas de la reserva, como los pastizales de cortadera señalados como hábitats óptimos para estas especies (49, 73). Cavia et al. (2009) y De Salvo et al. (2020) (49, 50) reportan a estas dos especies estadísticamente asociadas al área natural, en comparación con las áreas urbanas (49). En este estudio, D. kempi ha sido hallada con mayor frecuencia en las áreas menos intervenidas por la actividad humana, y con cuerpos de agua estables de la RECS. La O. flavescens es una especie que puede actuar como hospedador accidental de Leptospira spp. (27, 74), mientras que no existen registros de este patógeno en D. kempi.
Dentro de la RECS se capturaron, en menor número, otras especies silvestres como M. musculus, L. crassicaudata, C. chacoensis, C. aperea, C. villosus y S. aquaticus. La M. musculus se registró mayormente en áreas degradadas de la RECS. Diversos estudios presentan a M. musculus como potencial reservorio de Leptospira spp. en ambientes urbanos (27, 43, 74, 75). Los cambios antropogénicos a los que se expone la RECS podrían beneficiar la expansión especies invasivas como Mus musculus, desplazando especies de roedores nativas (76). Además de D. alvibentris, se han colectado muestras de dos especies de marsupiales de relevancia en la RECS: L. crassicaudata y C. chacoensis, ambas mayormente capturadas en áreas conservadas. No se conoce, hasta el momento, evidencia de infección natural por Leptospira spp. en estas especies. Tanto C. aperea como C. villosus y S. aquaticus han sido identificados como posibles portadores de Leptospira spp. (28, 77, 78, 79, 80, 81). La identificación de estas especies permite la evaluación holística y sistemática de la situación epidemiológica de Leptospira spp., aportando información para la toma de decisiones adecuadas y oportunas.
Analizando las variables ambientales, y la dinámica de captura de las diferentes especies animales, nuestros resultados sugieren que R. norvegicus, uno de los reservorios principales de Leptospira spp., capturado en bajo número en la RECS, pero detectado por los pobladores del barrio Rodrigo Bueno con alta frecuencia dentro del BRB, circularía preferentemente en ambientes mayormente antropizados, donde podría solapar su rango de acción con otras poblaciones de potenciales reservorios como los perros. Dados los resultados obtenidos en este estudio, y reportados por otros grupos de investigación en estas especies, sumado esto a la libre circulación y la capacidad de moverse largas distancias en diferentes tipos de ambientes que tienen los perros (34, 58, 82, 83), cabe señalar que el monitoreo continuo de estas poblaciones y la restricción del ingreso de perros al área protegida es clave para la conservación y la salud pública.
Asimismo, la menor circulación de Rattus en la reserva podría redundar en menores tasas de contacto con otras especies de mamíferos silvestres potencialmente reservorios de Leptospira spp., determinando actualmente una baja carga ambiental de esta, en este ecosistema determinado: la RECS. Sin embargo, la cercanía con el BRB y el creciente impacto antrópico sobre la reserva, a consecuencia de incendios, por ejemplo, podría implicar riesgos a futuro, en especial si los ambientes actualmente utilizados por D. albiventris, D. kempi y O. flavescens se vieran fuertemente alterados.
Es importante mencionar que algunos de los resultados obtenidos en este estudio podrían estar sesgados por el tipo de muestra (orina colectada in vivo) utilizada para el diagnóstico de leptospirosis (18, 39, 84). Dado que se trabajó dentro de un área protegida, no se consideró la eutanasia de mamíferos silvestres medianos, por no estar justificada para fines de investigación y encontrarse actualmente en desuso (85). Dado que en muestras de orina el agente se libera de manera intermitente (39), este factor podría haber reducido las posibilidades de aislar el agente. Considerando las técnicas diagnósticas utilizadas, cabe mencionar que si bien en el diagnóstico serológico por MAT, los serovares que usamos son aquellos que se identificaron como prevalentes en nuestro país luego de muchos años de estudio con base en la reactividad serológica por la comisión de leptospirosis de AAVLD (38), existen más de 200 serovares de Leptospira spp. Por consiguiente, es posible considerar que, en las condiciones ecoambientales particulares de la RECS, circulen serovares diferentes a los utilizados en este estudio.
Las investigaciones enfocadas en ambientes naturales urbanos y en sus áreas de interfaz profundizan el estudio de los potenciales reservorios de patógenos de importancia para la salud global (8, 50, 69, 81, 86, 87). El manejo y la gestión de potenciales reservorios de agentes patógenos que afectan a múltiples hospedadores a menudo desempeñan un papel crucial en el control eficaz de las enfermedades infecciosas, particularmente, aquellas zoonóticas, como la leptospirosis (88). El monitoreo continuo de Leptospira spp. en especies silvestres en ambientes naturales y en perros que circulan libremente, sumado al estudio de factores ambientales relacionados con la dinámica de la transmisión del agente y con estrategias efectivas de conservación de la biodiversidad, resultan herramientas fundamentales para el control y la vigilancia de leptospirosis en áreas protegidas pequeñas que se encuentran sometidas a una alta presión antrópica y en sus áreas de interfaz.
Conclusiones
El presente estudio puede considerarse un aporte al conocimiento de la ecoepidemiología de Leptospira spp. en la Reserva Ecológica Costanera Sur en CABA, considerando a este patógeno un modelo de enfermedad infecciosa zoonótica. El estudio de las variables ambientales en áreas naturales donde conviven especies animales domésticas y silvestres es un aporte a la salud pública por la amenaza que implica la circulación de agentes patógenos entre poblaciones animales y humanas (86). Si bien en este estudio no hemos detectado Leptospira spp. en ninguna de las tres especies silvestres capturadas con mayor frecuencia en la RECS, aportamos las primeras evidencias de exposición a Leptospira spp. en perros sin tenedor responsable y que circulan libremente por el área. Cabe destacar que tanto D. albiventris como O. flavescens pueden funcionar como potenciales reservorios del agente (27, 68, 74, 79, 87), y si bien nuestros resultados sugieren una posible preferencia de estas especies por los ambientes menos degradados dentro de la RECS, las fuertes presiones antrópicas sobre el área podrían redundar en una menor disponibilidad de recursos en un futuro. La cercanía de la reserva a las áreas urbanas, la mayor oferta de recursos potencialmente útiles para ciertas especies en ambientes antropizados, la libre circulación de perros entre diferentes áreas y el hallazgo de leptospirosis en ratas dentro del barrio Rodrigo Bueno alertan sobre la importancia de conservar estas áreas naturales urbanas, en las cuales los potenciales reservorios de Leptospira spp. ocurren con alta frecuencia y las tasas de contacto con perros y roedores del género Rattus, hasta el momento, podrían ser bajas.















