Introducción
La familia Chlamydiaceae corresponde a bacterias Gram negativas intracelulares obligadas que infectan a mamíferos, aves, reptiles y batracios (1). Chlamydia abortus (CA) es el agente etiológico de la enfermedad denominada aborto enzootico ovino (AEO) (1). En México, esta enfermedad se consideraba como exótica hasta mayo del 2016. Actualmente, varios estudios seroepidemiológicos han informado de su presencia en diversos estados de la República Mexicana: los más importantes son Tlaxcala, Sonora, Chihuahua, Hidalgo, Chiapas, Querétaro y el Estado de México con una sero-prevalencia de 13,08 %; 12,45 %; 11,56 %; 11,34 %; 10,15 %; 9,69 % y 7,09 %, respectivamente (2,3,4,5).
En general, se considera que la vía de la infección primaria es oronasal, seguida de la ingestión de la bacteria (6). Es muy probable que la infección inicial ocurra en las tonsilas, donde probablemente la bacteria se disemina por la sangre y la linfa hacia otros órganos (7). Se ha informado que algunas especies de Chlamydia spp. tienen la capacidad de infectar y crecer eficientemente dentro de los macrófagos tanto in vivo como en cultivo celular, lo que podría ser el mecanismo de diseminación de la bacteria (7,8,9,10). Debido a lo anterior, hay una posibilidad de aislar y detectar esta bacteria mediante cultivo celular y amplificación de ácidos nucleicos.
Cabe señalar que el diagnóstico de AEO presuntivo se puede realizar sobre la base de la historia clínica del rebaño y mediante el examen de las membranas placentarias, si estas se han recuperado (10). Sin embargo, si no han mostrado aborto, es muy difícil saber si los animales están infectados con este patógeno. Para la detección de una infección por C. abortus se encuentra disponible una gran variedad de pruebas tanto serológicas, como de detección de antígeno y pruebas moleculares, que pueden confirmar el diagnóstico de aborto debido a la infección por este patógeno (11). Asimismo, la elección de la prueba depende del tipo de muestras que son enviadas al laboratorio de diagnóstico, de la historia clínica del rebaño en cuestión y del tiempo en el que ocurrió el aborto. Esto último puede afectar la viabilidad de la bacteria, por lo que el cultivo celular no podría ser una opción (11).
El análisis serológico ha sido la opción preferida en muchos laboratorios de diagnóstico, en particular la prueba de ELISA (2, 3, 5). Sin embargo, esta prueba tiene baja sensibilidad y especificidad, y tiene la desventaja de indicar una tasa de exposición, más que una infección activa. Las técnicas de amplificación ácidos nucleicos (TAAN) tienen una sensibilidad y especificidad mayores al 95 % (11, 12). Los protocolos de PCR convencional para la detección de ADN de C. abortus se dirigen al ARN ribosomal16S-23S (12) o a los genes de la proteína polimórfica (pmp) (13). Sin embargo, la detección de este patógeno a partir de muestras vaginales y cervicales, no ha tenido el impacto suficiente en la epidemiología de AEO, debido a la presencia de bajos niveles de ADN de C. abortus en ovejas postaborto, durante el aborto o periovulación. También existen reportes en humanos de que la infección por C. trachomatis en muchas de las ocasiones se encuentra localizada en las trompas de Falopio, por lo que una prueba de TAAN en muestras vaginales puede llegar a ser negativa (14). Así, el propósito de esta investigación fue estandarizar el cultivo de C. abortus en células McCoy, empleando como muestra los leucocitos de sangre periférica y detectando el patógeno mediante PCR o tinción de Giemsa.
Materiales y métodos
Población de ovejas. Las muestras de sangre fueron obtenidas en ovejas de una granja del Estado de Hidalgo, de manejo semiestabulado y con un hato de 54 ovejas. La selección de los animales para la obtención de la sangre se dio de manera aleatoria. Un total de 42 muestras sanguíneas fueron obtenidas de 11 machos y 31 hembras, con más de un año de edad. Aproximadamente, la mitad de las hembras (15) había tenido más de un parto, sin referencia a pérdidas reproductivas. Dentro de la explotación, no se observó arco sanitario. Por el contrario, se mostraba pobre limpieza de los corrales donde habitaban los animales. El único procedimiento médico que se había realizado de manera rutinaria era la desparasitación de los animales cada seis meses.
Muestras de sangre. Se obtuvieron 5 mL de sangre en tubos con EDTA a partir de la vena yugular. Las muestras se transportaron al laboratorio donde se realizó el análisis, en un contenedor frio para evitar la hemolisis. Las muestras fueron centrifugadas a 1500 Xg, el plasma fue depositado y dividido en 2 tubos. Un tubo se almacenó a -20°C, y el segundo tubo fue utilizado para el diagnóstico de infección por C. abortus mediante la detección de anticuerpos contra este patógeno según el método de ELISA. Por otro lado, los leucocitos fueron recuperados para realizar el cultivo de Chlamydia abortus en células McCoy.
Prueba de ELISA. Para la detección de anticuerpos anti-Chlamydia abortus se utilizó la prueba comercial ELISA ID Screen Chlamydophila abortus indirect multi-species (rue Luis Pasteur, Grabels France). Esta prueba utiliza un antígeno sintético procedente de una proteína de la membrana externa (MOMP), que es reconocido por los anticuerpos específicos en la muestra, los cuales son revelados con un conjugado acoplado a HRP. El procedimiento se realizó de acuerdo con las instrucciones del fabricante. Brevemente, se colocaron 90 µL de diluyente en cada uno de los pozos de la microplaca. Posteriormente, se depositaron 10 µL del control negativo, 10 µL del control positivo y 10 µL de cada una de las muestras por duplicado. La microplaca se incubó a 21°C por 45 minutos. Pasado ese tiempo, se eliminó el sobrenadante y se realizaron tres lavados con 300 µL de solución de lavado. Una vez terminados los lavados, a cada pozo se le adicionaron 100 µL de conjugado, y se dejó incubar por 30 minutos a 21°C. Finalizado el tiempo de incubación, se realizaron tres lavados a cada pozo con la solución de lavado y se adicionaron 100 µL de solución reveladora. La mezcla se incubó a 21°C por 15 minutos y se adicionaron 100 µL de solución de paro para detener la reacción. Finalmente se leyó la microplaca a 450 nm en un lector de ELISA (Elx808, Biotek, Winooski, VT, USA).
Los valores de absorbancia se expresaron como porcentaje. Los valores por encima de 60 % se consideraron positivos, de acuerdo con las instrucciones del fabricante, utilizando la siguiente fórmula:
Las muestras que presentaron un S/P % se tomaron en cuenta en la siguiente medida:
Cultivo celular. Los leucocitos fueron tratados con una fase de congelación-descongelación, y posteriormente se les adicionó 400 µl de la solución de PBS y perlas de vidrio para la liberación de las partículas de Chlamydia. Para ello, los tubos fueron tratados por agitación en un vortex (MS1 minishaker IKA, Wilmington, USA) durante 2 min. Posteriormente, se recuperó el sobrenadante por centrifugación 300 xg. Cincuenta microlitros del sobrenadante fueron depositados en cada pozo por duplicado en una microplaca de 24 pozos que previamente contenía una monocapa confluente de células McCoy (ATCC CR-1696TM). La microplaca se centrifugó a 500 g por 10 minutos y se incubó a 37° C en atmosfera de CO2 por 2 horas. Pasado ese tiempo, se eliminó el medio de cultivo y se adicionó 1 ml de medio mínimo esencial suplementado con suero fetal de ternera al 10 %, con antibióticos (estreptomicina y gentamicina a una concentración de 1 µg/ml) y con cicloheximida (1 µg/ml). La microplaca se incubó en las mismas condiciones descritas anteriormente por 72 h. Finalmente, la monocapa de células McCoy fue obtenida mediante acción mecánica para extracción de DNA y la identificación de Chlamydia abortus mediante la técnica de amplificación de ácidos nucleicos.
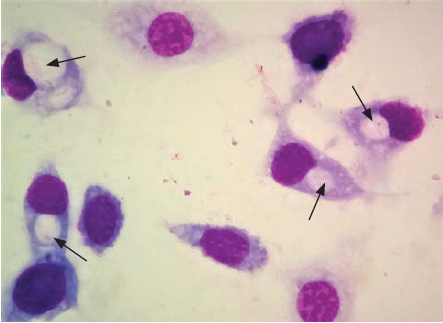
Tinción de Giemsa. Se cultivaron e infectaron las células McCoy como se describió anteriormente en cubreobjetos redondos estériles. Una vez pasado el tiempo de infección, se lavaron con solución salina para eliminar detritos celulares, y se fijaron con metanol durante 15 minutos. Posteriormente, se agregaron de 4 a 5 gotas del reactivo de Giemsa durante 45 minutos. Finalmente, los cubreobjetos se lavaron con agua simple y se montaron en un portaobjetos para ser observados a 40 X y 100 X en un microscopio óptico.
Extracción de ADN. Para la obtención de ADN, las células McCoy infectadas fueron recuperadas mediante raspado con un scraper y centrifugación a 3000 xg durante 15 minutos. El sobrenadante se descartó y el paquete celular se resuspendió en 400 μL de la solución de lisis (Tris 10mM, EDTA 10mM, NACL 50 mM, SDS 0,2 %, proteinasa K 0,2 mg/mL). Posteriormente, el tubo Eppendof se colocó en un baño maría a 55ºC por una hora, con agitación cada 15 minutos. Seguido de eso, se precipitaron las proteínas con la adición de 400 μL de fenol y 400 μL de cloroformo, se centrifugó el tubo 3000 rpm durante 10 minutos, se recuperó la fase acuosa en un tubo nuevo al cual se le adicionaron 400 μL de cloroformo, se agitó el tubo por 1 minuto en vortex, y se centrifugó a 3000 xg durante 10 minutos. Posterior a ello, se recuperó la fase acuosa que se depositó en un tubo nuevo, al cual se le adicionaron 40 μL de NaCl al 5 M, y 1 mL de etanol absoluto. El tubo se incubó por 30 minutos a 4ºC. Pasado ese tiempo, se centrifugó a 3000 xg durante 15 minutos, se eliminó el sobrenadante y el botón ADN fue lavado dos veces por centrifugación con 1 mL de etanol al 70 % frío. Se decantó el sobrenadante y se repitió el lavado. Una vez decantado el último lavado, se dejó secar el botón de ADN y se resuspendió en 30 μL de agua libre de nucleasas. El ADN se almacenó a -20ºC hasta su uso.
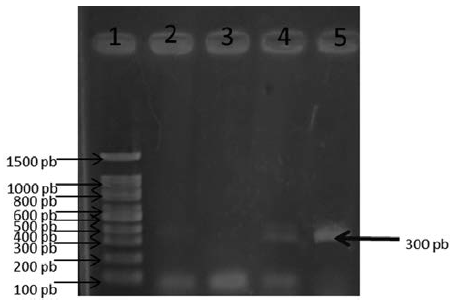
Prueba de PCR. Para la reacción de PCR, se colocaron 12,5 μL de la Mastermix® (AMPLIQON, Odense, Denmark), 0,5 μL de los iniciadores previamente reportados por Laroucau y colaboradores (13), CpsiA (5´ATG AAA CAT CCA GTC TAC TGG3´) y CpsiB (5´TTG TGT AGT ATT ATT ATC AAA 3´), así como 4,5 μL de agua y 7 μL del DNA obtenido, lo cual dio un volumen final de 25 μL. La reacción que se realizó en un termociclador (MULTIGENE MINI LABNET) consta de una temperatura inicial de desnaturalización a 94°C por 5 minutos seguido de 35 ciclos de desnaturalización a 94ºC durante 30 segundos, alineamiento a 50ºC por 60 segundos, y extensión a 72ºC por 120 segundos. Finalmente se realizó una extensión final de 72°C por 5 minutos. El análisis en gel de agarosa al 1,5 % para observar la presencia de fragmentos de amplificación de ADN se realizó en un transiluminador (MultiImagenTM light cabinet, Alpha Innotech Co. USA). Un amplicon de 300 pb se consideró como la presencia de ADN de Chlamydia spp.
Resultados
Detección de Chlamydia spp. en leucocitos
La figura 1 muestra el amplicon de 300 pb que corresponde a la amplificación del gen de la proteína polimórfica de Chlamydia spp., lo que confirmó la infección de esta bacteria en los cultivos celulares. Los resultados moleculares mostraron 21 muestras de leucocitos positivas a la infección por este patógeno y 21 muestras negativas (tabla 1), lo que dio un porcentaje de infección activa del 50 % por Chlamydia spp. en las muestras analizadas. Cabe señalar que solo en 10 muestras positivas por PCR se logró identificar la presencia de Chlamydia spp. mediante la tinción de Giemsa (figura 2).
Seroprevalencia de C. abortus mediante prueba de ELISA
En cuanto a la prueba de ELISA, 22 sueros mostraron anticuerpos IgG anti-C. abortus, lo que sugirió la infección por este patógeno. En tres hubo presencia de anticuerpos IgG anti-C. abortus; sin embargo, mostraron un valor de absorbencia menor a 0,65 por lo que se considera como una infección dudosa por este patógeno. 17 sueros no mostraron anticuerpos IgG anti-C. abortus negativos (tabla 1 y figura 3).
Tabla 1 Porcentaje de ovejas sin reporte previo de aborto infectadas por Chlamydia spp.
| ELISA | Total | |||||
|---|---|---|---|---|---|---|
| Positivo | Dudoso | Negativo | ||||
| PCR | Positivo | Recuento | 14 | 2 | 5 | 21 |
| % | 66,7 % | 9,5 % | 23,8 % | 100,0 % | ||
| Negativo | Recuento | 8 | 1 | 12 | 21 | |
| % | 38,1 % | 4,8 % | 57,1 % | 100,0 % | ||
| Total | Recuento | 22 | 3 | 17 | 42 | |
| % | 52,4 % | 7,1 % | 40,5 % | 100,0 % | ||
Nota: se evaluó la presencia de anticuerpos IgG anti-C. abortus por el método de ELISA (ELISA ID Scree Chlamydophila abortus, Grables, Francia). Mediante PCR se llevó a cabo la detección de Chlamydia spp. a partir de la amplificación de los genes pmp en células McCoy infectadas con leucocitos de sangre periférica de ovinos sin reporte previo de aborto.
Fuente: elaboración propia
Discusión
Los abortos en ovejas por infecciones bacterianas causan pérdidas económicas considerables. Las especies de Brucella sp., Campylobacter fetus subespecies fetus, C. abortus, Salmonella y Listeria monocytogenes son responsables del aborto en pequeños rumiantes (15). En México, la prueba de ELISA para detección de anticuerpos anti-C. abortus es el método más utilizado para el serodiagnóstico de infección por clamidias en los animales; sin embargo, su sensibilidad y especificidad son bajas y solo indica una exposición al patógeno más que una infección activa (2, 3, 5). Debido a lo anterior, un mejor diagnóstico está basado en la detección del ADN, en particular la PCR, que permite la identificación directa a partir de muestras clínicas y la diferenciación de especies (11,12,13).
En este estudio, se utilizaron los iniciadores reportados por Laroucau y colaboradores (13), quienes reportan que estos amplifican los genes de las proteínas polimórficas (pmp) de C. abortus, C. psittaci y C. caviae, y no los genes pmp de C. pecorum, C. felis, C. pneumoniae y C. trachomatis. La ventaja de estos iniciadores es que aumentan 10 veces más la sensibilidad de la prueba de PCR en comparación con el gen de la proteína principal de membrana externa (ompA), al identificar una familia de genes pmp, por lo que estos iniciadores son capaces de identificar no solo a C. abortus, sino a otras especies de Chlamydia (12, 13).
Los resultados obtenidos en este estudio mostraron que los leucocitos de sangre periférica pueden ser útiles para detectar una infección por Chlamydia spp. Diversos estudios han demostrado que los macrófagos son susceptibles a la infección por Chlamydia spp. y que estas células pueden ser empleadas para el cultivo de diversas especies de clamidia (8,9,10). También el uso de sangre directa para la detección de C. trachomatis ha sido empleada como una prueba de diagnóstico de infección por esta bacteria en humanos (16, 17). A pesar de lo anterior, una desventaja de este estudio fue no haber llevado a cabo la búsqueda de Chlamydia en muestras vaginales para comparar qué tipo de muestra es mejor, si la sangre o el raspado vaginal, y así poder determinar la sensibilidad y especificidad de la muestra. Sin embargo, se ha descrito que las muestras vaginales o cervicales de ovejas no son adecuadas para hacer el diagnóstico de infección activa por C. abortus debido a la baja cantidad de ADN de este patógeno que se ha encontrado en este tipo de muestras, por lo que habría una posibilidad de que las muestras de sangre fueran mejores para detectar una infección crónica por esta bacteria (2, 19).
En cuanto al porcentaje de muestras positivas a la infección por C. abortus fue menor al 34 % (14 muestras) cuando fueron analizadas por PCR y serología. Cabe señalar que la serología no fue tan efectiva al no mostrar anticuerpos en cinco muestras que fueron positivas por PCR y a las cuales no se les detectaron anticuerpos anti-C. abortus. Sin embargo, la infección podría obedecer a otras especies de Chlamydia como C. psittaci o C. caviae. En 2011, Osman y colaboradores (18) reportaron que la infección por C. psittaci en ovejas es muy frecuente, llegando hasta un 25,7 %, en cuyos casos una característica particular de estos animales es la frecuente presencia de diarrea. En este estudio no se reportó información sobre la presencia de diarrea en algún animal del rebaño. En cuanto a la infección por C. caviae en ovejas, no existen reportes al respecto; debido a lo anterior, será necesario identificar si estas cinco muestras positivas por PCR y que no mostraron anticuerpos anti-C. abortus obedecen a la presencia de ADN de C. psittaci o de C. caviae.
En cuanto a las muestras negativas por PCR y que mostraron anticuerpos IgG anti-C. abortus, su ocurrencia podría obedecer a una infección pasada o a un estado de latencia de la bacteria. Estudios previos han informado que el diagnóstico serológico de AEO se ve limitado por algunos factores, como es el estado de latencia de la propia infección, por el cual permanece sin ser detectada hasta el día 90 de gestación (19), o por una infección con otra especie de clamidia distinta a C. abortus como C. pecorum, que es frecuente en pequeños rumiantes y que produce artritis (20, 21). En México, la prevalencia de infección por C. pecorum en ovejas no se conoce.
Esta reactividad cruzada de los anticuerpos entre las diferentes especies de clamidia por antígenos como el lipopolisacárido o la proteína principal de membrana externa al parecer no ocurre con la prueba de ELISA ID Screen Chlamydophila abortus que se empleó en este estudio. El antígeno que utiliza esta prueba de ELISA corresponde a péptidos sintéticos de la proteína principal de membrana externa (MOMP). Lo anterior puede reducir la reactividad cruzada, siempre y cuando estos péptidos muestren un epitope específico para los anticuerpos IgG anti C. abortus. A pesar de lo anterior, el proveedor no describe la sensibilidad y la especificidad de la prueba, empleando sueros de animales infectados con otras especies diferentes a C. abortus, por lo que habría la posibilidad de que este antígeno sea reconocido por sueros de animales infectados con otras especies de clamidia.
Los animales muestreados fueron del Estado de Hidalgo, una zona donde se ha descrito serología positiva de C. abortus hasta en el 11,56 % de los animales (2), por lo que la seropositividad obtenida en este estudio (52,38 %) fue alta comparada con lo reportado en este Estado y como ocurre en algunos otros de la República Mexicana, pero menor a lo reportado para el Estado de Querétaro, que se informa de un 67,18 % (2). Por consiguiente, esta diferencia posiblemente radique en el pequeño número de muestras analizadas en este estudio.
También es importante señalar que el productor no reportó la presencia de abortos, dentro de la explotación y el único procedimiento realizado fue la desparasitación. Además, al ser una explotación semitecnificada, existe la posibilidad de una reactividad cruzada entre los anticuerpos dirigidos contra diversas especies de clamidia como lo sugieren los resultados obtenidos en este estudio con la detección de ADN de Chlamydia spp. y los resultados de la serología.
En conclusión, los leucocitos de sangre periférica pueden ser una herramienta útil para identificar una infección crónica por diversas especies de Chlamydia en ovejas que no muestran reporte previo de aborto.