Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.21 no.1 Santa Marta Jan./Dec. 1992
LOS PECES DEL GENERO BATHYGOBIUS (PERCIFORMES: GOBIIDAE) DEL CARIBE COLOMBIANO
Jaime Garzón-Ferreira1 y Arturo Acero P.2
1 Instituto de investigaciones Marinas de Punta de Betín, INVEMAR, A.A. 1016, Santa marta, Colombia.
2 Instituto de Ciencias Naturales, Universidad Nacional de Colombia, cío INVEMAR, A.A. 1016, Santa Marta, Colombia.
RESUMEN
Se presenta información morfológica, ecológica y zoogeográfica de las tres especies de góbidos del género Bathygobius (Pisces: Gobiidae) halladas en el Caribe Colombiano, de las cuales B. soporator es la más común y euritópica pues se le encontró en gran variedad de biotopos costeros desde estuarios hasta áreas coralinas; B. curacao y B. mystacium son especies raras y restringidas a zonas coralinas, la primera de ellas sobre fondos blandos en ecotonos manglares-praderas de pastos y la segunda sobre fondos someros mixtos de arena y piedras. La diferenciación taxonómica de las tres especies es difícil pues sus caracteres diagnósticos se superponen parcialmente.
ABSTRACT
Morphological, ecological and zoogeographical information of three gobiid species of the genus Bathygobius (Pisces: Gobiidae) found in the Colombian Caribbean is presented; B Soporator is the most, common and eurytopic species, being found in a great variety of coastal hábitats from estuaries to coralline areas; B. curacao and B. mystacium are rare and restricted to coralline areas, the former on soft bottoms of mangroves-sea grass beds ecotones, and the later on shallow, mixed sand and rocky bottoms. Taxonomic differentiation of the three species is difficult because of partial overlap in their diagnostic features.
INTRODUCCIÓN
El género de peces Bathygobius (Perciformes: Gobiidae) incluye numerosas especies distribuidas ampliamente en las áreas tropicales de los océanos Atlántico y Pacífico, pero restringidas a áreas costeras poco profundas donde han colonizado todos los ambientes acuáticos protegidos, incluyendo las partes bajas de los ríos (Herré, 1927; Hoese, 1978; Miller, 1981; Winterbotton y Emery, 1986). Ginsburg (1947) revisó el género en ambas costas de América, reconociendo tres especies y seis subespecies para la costa atlántica.
En el caribe colombiano, hasta hace poco se conocía una sola especie de Bathygobius (Dahl, 1971). En un inventario de los góbidos arrecifales de la costa norte de Colombia, Garzón-Ferrerira y Acero (1988a) registraron nominalmente las tres especies del Atlántico. En la presente publicación daremos la información que sustenta dichos registros, incluyendo datos morfológicos, ecológicos y zoogeográficos, así como una clave de identificación.
METODOLOGÍA
Descripciones detalladas de los métodos y las áreas de estudio en el Caribe colombiano se encuentran en Garzón-Ferreira y Acero (1988a y 1990). Los métodos de conteo y medición siguen básicamente las definiciones de Böhlke y Robins (1968). Las hileras transversales de escamas (ES) se contaron desde el extremo superior de la base de la aleta pectoral hasta la base de la aleta caudal. Otras abreviaturas que aparecen al presentar las fórmulas merísticas son: AD, número de elementos en las aletas dorsales (el número romano indica las espinas en la aleta anterior y el arábigo los radios, incluyendo la primera espina, en la posterior); AA, número de radios (incluyendo la primera espina) en la aleta pectoral. Los datos de tamaño se refieren siempre a la longitud estándar (LE) en milímetros, a menos que se indique otra cosa. En las secciones de material examinado se incluye entre paréntesis, luego del número de catálogo en colección, la cantidad de especímenes y su intervalo de tamaño en milímetros; en seguida se señala la localidad y la profundidad en metros donde se colectaron; así como los nombres de los colectores. Los trabajos listados luego de la cita original de la especie son aquellos que sirvieron para su identificación y/o que aportan información descriptiva, biológica, ecológica y de distribución geográfica.
La mayor parte del material se depositó en las colecciones de peces del Instituto de Investigaciones marinas de Punta Betín Santa Marta (INVEMAR)-P y del Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Bogotá (ICNMHN). Se examinaron especímenes adicionales conservados en el Museo del Mar, Universidad Jorge Tadeo Lozano, Bogotá (MM-PEC).
GENERO BATHYGOBIUS BLEEKER
Este género no ha sido reivsado en su totalidad y por lo tanto no se le ha definido convenientemente. Algunas características comunes de las tres especies conocidas del Atlántico occidental son las siguientes: cuerpo cubierto totalmente por escamas principalmente ctenoides, que se extienden incluso sobre la nuca; cabeza deprimida, más ancha que alta; boca terminal, ligeramente oblicua; un solo poro interorbitral anterior y un solo poro adyacente a los nostriales de cada lado; primera aleta dorsal con seis espinas; aleta pectoral con algunos de los radios superiores filamentosos, casi totalmente libres de la membrana; aletas pélvicas unidas, con el margen posterior redondeado y las espinas conectadas entre si por una membrana, formando un disco vantral en forma de copa; aleta caudal redondeada.
CLAVE PARA LAS ESPECIES DE BATHYGOBIUS DEL CARIBE COLOMBIANO
(Modificada de Böhlke y Chaplin, 1968)
- Aleta pectoral con 15-18 radios, casi siempre 16 o 17; con 31-36 hileras transversales de escamas, usualmente menos de 34; longitud del rostro 5.9-7.8% de la LE; Longitud de la mandíbula superior 10.2-11.4% de la LE.............curacao
- Aleta pectoral con 18-20 radios, usualmente 19; con 33-36 hileras transversales de escamas, usualmente 34 o 35 longitud del rostro 4.6-6.2% de la LE; longitud de la mandíbula superior 8.5-10.5% de la LE............mystacium
- Aleta pectoral con 17-22 radios, usualmente 19 o 20; con 37-41 hileras transversales de escamas, usualmente 38 o 39 longitud de rostro 6.5-8.3% de la LE; longitud de la mandíbula superior 9.0-14.0% de la LE..............soporator
Bathygobius curacao (Metzelaar)
Gobius curacao Metzelar, 1919, Rap. Vissch. Kolonie Curaraco, J. Boeke (Ed.), 2:136 (Curacao).
Bathygobius curacao, Ginsburg (1947): 278; Springer y McEarlan (1962): 43; Böhlke y Chaplin (1968): 64; Castro Aguirre y Márquez-Espinosa (1981): 39-40; Cervigón (sin fecha): 63 Robins et al (1986): 242-243; Garzón-Ferreira y Acero (1988a): 60-71.
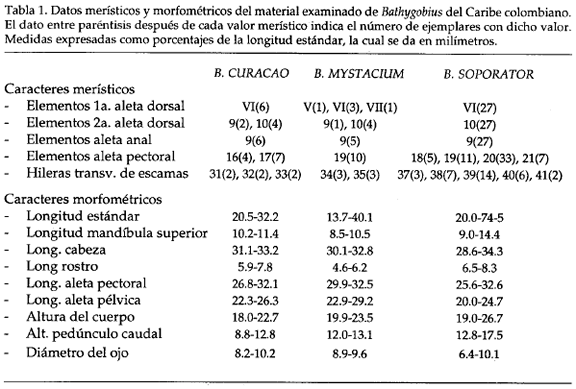
Merística y morfometría. Tabla 1. Sumando muestreos datos a la información recopilada en la literatura, la fórmula merística de B. curacao se resume así: AD VI, 9 o 10 (usualmente 10); AA 9; AP 15-18 (casi siempre 16 o 17); ES 31-36. Las branquiespinas son reducidas y se presentaron 1+9 en un ejemplar. Las aletas pectorales tienen 2 o 3 radios ramificados y separados en el extremo superior. El tamaño máximo registrado para esta especie es de 67 mm.
Coloración. Los ejemplares estudiados muestran en preservativo un color gris a marrón, con manchas irregulares más oscuras a los lados y el abdomen sin melanóforos; las aletas dorsales con lunares oscuros en hileras oblicuas y las demás aletas básicamente incoloras. Una hembra de 22 mm presentaba en fresco un color marrón, con hileras longitudinales de lunares blancos y manchas negruzcas amplias a los lados del cuerpo; aletas dorsales y caudal con lunares blancos y marrones, las dorsales teñidas de amarillo cerca al margen distal; aletas pectorales, pélvicas y anal transparentes, con algo de pigmento blanco.
Ecología. Las colecciones de esta especie en el Caribe colombiano proceden todas de regiones coralinas, pero de sitios de aguas medianamente claras a turbias, en fondos blandos con praderas de pastos marinos cercanas y frente a costas bordeadas por manglares, entre 0.5 y 1.0 m de profundidad. El único ejemplar observado en vivo, que luego se colectó, se encontró sobre el sedimento cerca de objetos duros (palos, rocas) bajo los cuales se ocultaba. La especie fue encontrada en las Bahamas hasta unos 4.5 m de profundidad en condiciones ambientales muy semejantes, aunque en ocasiones frente a costas sin manglar; con frecuencia B. curacao fue colectado junto con B. soporator pero nunca con B. mystacium, lo cual también ocurrió en nuestros muestreos.
Distribución. Desde Bermuda, Bahamas y Florida hasta Venezuela, a través de las Antillas, y desde el suroeste del Golfo de México hasta Colombia a través de la costa centroamericana. En el Caribe colombiano se le conoce ahora de las regiones de Santa Marta e Isla de Providencia.
Material examinado. Seis ejemplares catalogados en colección: Santa Marta: INVEMAR-P 933 (1,22.0), Parque Tayrona, Bahía de Chengue, frente al manglar, 1 m, J. Garzón. Isla de Providencia: INVEMAR-P 934 (2,21.5 y 21.9), extremo sur de Bahía Sta. Catalina, frente al manglar de Pueblo Viejo, 0.5-1.0 m, M.M. Críales; INVEMAR P-935 (3,20.5-32.2) extremo sur de Bahía Sta. Catalina, frente a la Quebrada Barnack, 0.5-1.0 m, M.M. Críales.
Bathygobius mystacium Ginsburg
B. Mystacium Ginsburg, 1947, J. Wash. Acad. Sci., 37(8): 278-279 (Nassau, Bahamas). Böhlke y Chaplin (1968): 605; Starck (1968): 27; RobinseíflI. (1986): 243;Garzón-Ferreira y Acero (1988): 69-71.
Merística y morfometría. Tabla 1. Al adicionar nuestros datos, la fórmula merística de B. mystacium queda: AD VI, 9 o 10 (casi siempre 10); AA 9; AP: 18-20 (usualmente 19); ES 33-36 (usualmente 34 o 35). Los valores de 5 y 7 espinas en la primera aleta dorsal, hallados en ejemplares de Providencia, son anormales. Las branquiespinas, cortas y gruesas, se presentaron en número de 3 + 8 en un ejemplar. La aleta pectoral tiene 3 o 4 radios bifurcados y bien separados de la membrana. Según la literatura, este góbido sobrepasa ligeramente los 70 mm de longitud total.
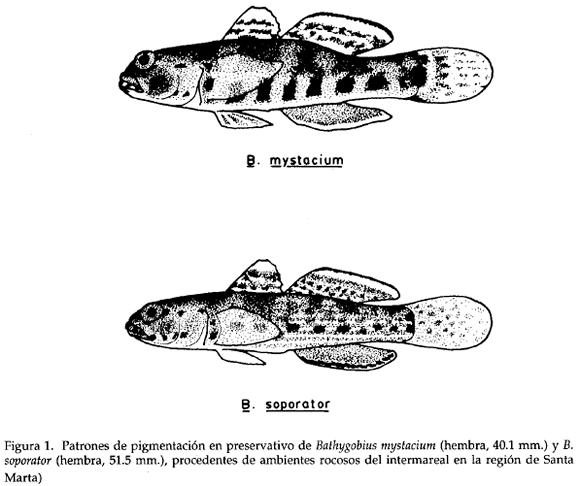
Coloración. En preservativo el pez puede ser de gris a marrón, con manchas pálidas y oscuras, algunos irregularmente moteados, otros con barras negruzcas y anchas, más o menos definidas, a los lados del cuerpo. En algunos ejemplares se destaca una mancha oscura de forma rectangular en la base de la aleta caudal, más intensa que las otras marcas. Un ejemplar examinado en fresco, que en vida se veía marrón claro casi uniforme, igual al color del fondo donde se encontró, al morir se tornó mucho mas oscuro y marcado (Fig. 1): barras y manchas oscuras de color café; región ventral de la cabeza, pecho, abdomen y espacios entre las manchas oscuras de la mitad inferior del cuerpo de color blanco; una serie de bandas amarillas, delgadas y paralelas a los lados, especialmente visibles en la mitad inferior; aletas dorsales y caudal con manchitas oscuras que tienden a formar bandas, las dorsales además con una banda ancha de color amarillo cerca al margen distal; abundantes lunares blancos sobre el cuerpo y en las aletas dorsales, pectorales y caudal; aleta anal teñida con melanóforos, excepto cerca al margen distal.
Ecología. Las colecciones de B. mystacium en el Caribe colombiano fueron hechas frente a costas rocosas protegidas, muy cerca de la orilla (0.1-0.5 m de profundidad), sobre fondos mixtos de arena y piedras, en áreas coralinas de aguas claras medianamente turbias. Al igual que en las Bahamas, esta especie parece ser mucho menos común que B. soporator en Colombia y en ocasiones se las encuentra juntas; allí ha sido colectada hasta unos 2.5 m de profundidad en fondos de características similares a los colombianos, pero principalmente en costas expuestas.
Distribución. Bermuda, Florida, Cuba, Antillas Menores, Isla de Providencia, Panamá y Colombia. Además se le ha colectado en la isla Gran Caimán (G.H. Burgess, Florida State Museun, com. pers.). En el Caribe colombiano se le conoce ahora de las regiones de Santa Marta y Providencia.
Material examinado. Cinco ejemplares catalogados en colección: Santa Marta: INVEMAR-P 936 (1,40.1) y 937 (1,25.9), Parque Tayrona, Bahía de Chengue, costado oriental, 0.1-0.2 m, J. Garzón y L. E. Velásquez. Isla de Providencia: INVEMAR-P 938 (3,13.7-20.0), Bahía Suroeste, frente al extremo norte de la playa, 0.5 m, J. Garzón y A. Acero.
Bathygobius soporator (Valenciennes)
Gobius soporator Valenciennes, 1837, en Cuvier y Valenciennes, Hist. Nat. Poiss., 12: 56 (Martinica).
Bathygobius soporator, Beebe y Tee-Van (1933): 217; Ginsburg (1947): 279-280; Fowler (1950): 82 y 89; Tavolga (1950a): 182-194; Tavolga (1950b): 467-492; Tavolga (1953): 596-597; Tavolga (1954): 427-460; Tavolga (1956): 53-74; Cervigón (1966): 734-735; Bóhlke y Chaplin (1968): 603 Dawson (1969): 23; Dahl (1971): 284; Resendez-Medina (1971): 23; Walls (1976): 323; Miller (1981): 8; Randall (1983): 248; Peters (1983): 137-153 Robins et al (1986): 242; Garzón-Ferreira y Acero (1988a):69-71; Garzón-Ferreira (1989): 158; Santos-Martínez y Acero (1991): 257-258.
Merística y morfometría. Tabla 1. Al adicionar nuestros datos, la fórmula merística de B. soporator queda: AD VI, 10 u 11 (casi siempre 10); AA 8-10 (casi siempre 9); AP 17-22 (usualmente 19 o 20); ES 37-44. Las branquiespinas son cortas y se encontraron 2+9 en tres ejemplares. Aleta pectoral con 4-6 radios superiores filamentosos y separados, que pueden presentar hasta 4 ramificaciones por radio. Según la literatura, este góbido alcanza una longitud total que sobrepasa los 150 mm.
Coloración. Los ejemplares examinados del Caribe colombiano muestran en preservativo básicamente dos patrones de coloración, al parecer en relación con el hábitat: uno es como el del ejemplar ilustrado (fig. 1), con abundantes manchas oscuras intensas, que se presentó en los colectados en fondos principalmente rocosos; el otro es un patrón más pálido, con marcas oscuras poco definidas o ausentes, de modo que el pez se puede ver de una tonalidad casi uniforme, y se encontró en especímenes procedentes de fondos donde domina fango o arena. Una serie de ejemplares (13.6-51.5 mm) colectados en fondos básicamente rocosos de la región de Santa Marta, presentaba la siguiente coloración en fresco: pigmentación de fondo organizada en bandas longitudinales, estrechas y paralelas de color marrón (las de situación más ventral a veces amarillas), alternadas con bandas pálidas similares de manchitas blancas; manchas oscuras de color negruzco, siendo las inferiores las más intensas y evidentes, al igual que las dos marcas basicaudales que a veces se hallan fusionadas; vientre blancuzco, con algunos melanóforos bajo la cabeza y en las aletas pélvicas; aletas dorsales de color marrón con lunares pálidos y oscuros, una banda marginal amarillenta y el borde distal negruzco; aleta anal amarillo verdosa, teñida de marrón cerca al margen y con una banda delgada blanca en el borde distal; aleta caudal amarillenta, con lunares pálidos y marrones; aletas pélvicas blanco verdosas; aletas pectorales transparentes, con melanóforos y manchitas blancas sobre los radios.
Ecología. Esta especie es indudablemente uno de los peces más comunes en las áreas litorales del Atlántico oeste tropical y uno de los pocos góbidos de esta región sobre los cuales existe abundante información biológica y ecológica. Habita en gran variedad de ambientes, desde aguas completamente dulces en fondos fangosos de ríos hasta pozos intermareales de aguas hipersalinas (más de 40 ‰) y calientes (hasta 36°C) de costas rocosas. Se le puede hallar desde aguas turbias en costas bordeadas por manglar hasta las aguas cristalinas de zonas coralinas, pero siempre en fondos someros (por lo regular a menos de 1 m de profundidad).
En el Caribe colombiano se le encontró con frecuencia en fondos rocosos y mixtos de arena y roca, muy cerca de la orilla (menos de 0.5 m de profundidad) y a veces junto con B. mystacium, donde, a pesar de la claridad del agua, es difícil detectarles debido a sus colores crípticos y sus rápidos desplazamientos cortos. También se le encontró, junto con B. curacao, en fondos blandos donde confluyen praderas de pastos marinos y manglares hasta 1 m de profundidad.
Distribución. Es conocido de ambos lados del Atlántico y de la costa pacífica de América; en el Atlántico occidental desde Bermuda y Florida hasta el sureste de Brazil, incluyendo el Golfo de México, Bahamas, las Antillas y prácticamente todo el Caribe. En Colombia ahora se le conoce de las regiones de Bahía Portete, Santa Marta, Ciénaga Grande de Santa Marta e islas del Rosario, San Andrés y Providencia.
Material Examinado. Cuarenta y tres ejemplares, de los cuales los siguientes 34 se hallan depositados en colecciones: Bahía Portete: MM-PEC (2, 30.0 y 67.0), sin catalogar y sin datos, Integral-Intercor. Santa Marta: INVEMAR-P 321 (2,20.0 y 35.7), Bahía de Santa Marta, Punta de Betín, 0.2 m, J. Garzón; INVEMAR-P 939 (8,25.8-51.5), Bahía de Chenge, costado oriental, 0.2 m, J. Garzón; INVEMAR-P 940 (8,13.6-23.2), Bahía Concha, 0.2 m, A. Acero; ICNMHN1053 (4), mismos datos que INVEMAR-P 939. Ciénaga Grande de Santa Marta: INVEMAR-P 1807 (5,44.0-69.5); Boca de la Barra; 1-2 m; A. Santos. Islas del Rosario: INVEMAR-P 941 (3,46.6-74.5), Isla San Martín, 0.1-0.5 m, J. Garzón. Isla de Providencia: INVEMAR-P 942 (2,31.1 y 35.0), extremo sur de Bahía Santa Catalina, frente al manglar de Pueblo Viejo, 0.5-1.0 m, M. M. Críales.
DISCUSIÓN
La diferenciación de las tres especies estudiadas de Bathygobius no es fácil, ya que los caracteres diagnósticos (merísticos y morfométricos) muestran cierto grado de superposición. Por su parte, la pigmentación no es de utilidad taxonómica, a diferencia de otros géneros de góbidos (Garzón- Ferreira y Acero, 1990 y en 1992), debido a su similitud interespecífica y su gran variabilidad intraespécifica. Por ello, para estar seguros en la identificación de una población dada puede requerirse el estudio de varios ejemplares. Aparte de las características señaladas atrás en la clave, son mínimas las diferencias morfológicas evidentes entre las tres especies; no obstante, el aspecto de B. mystacium difiere más, por presentar la cabeza menos deprimida y la frente más pendiente que las otras dos especies, y B. soporator es la única que alcanza tallas superiores a 80 mm (hasta 150 mm) de longitud total.
Ginsburg y (1947) definió dos subespecies de B. curacao y cuatro de B. soporator y propuso que el género se encuentra en un estado temprano de especiación. La caracterización de dichas subespecies es muy pobre y todavía mas complicada que a nivel específico, por lo cual no se consideró apropiado clasificar el material colombiano hasta nivel subespecífico. Otros autores recientes (Böhlke y Chaplin, 1968; Cervigón, sin fecha; Walls, 1976; Robins et al., 1986) tampoco han aceptado las subespecies aunque si las especies reconocidas por Ginsburg.
Aparentemente existe cierto grado de segregación ambiental entre las tres especies, el cual puede representar una ayuda adicional en su identificación. Baihygobius soporator, un pez muy euriptópico, es supremamente común y puede hallarse en casi todo tipo de ambiente litoral, incluyendo aguas dulces. Las otras dos especies, en cambio, son estenotópicas, poco frecuentes y al parecer restringidas a regiones coralinas: B curacao prefiere fondos blandos en ecotonos de manglares-praderas de pastos, en tanto que B. mystacium se encuentra en fondos mixtos de arena y roca. Cervigón (1966:735) afirmó que en Venezuela B. soporator puede encontrarse "sobre los corales", lo cual resulta extraño ya que ningún otro autor menciona una relación tal para esta especie y durante nuestro estudio de los góbidos arrecifales del Caribe colombiano tampoco observamos nunca un pez de este género viviendo directamente sobre o alrededor de corales (Garzón-Ferreira y Acero, 1988b).
AGRADECIMIENTOS
El Instituto Colombiano Para el Desarrollo de la Ciencia y la Tecnología (COLCIENCIAS) ha financiado las investigaciones ictiológicas a los autores (proy. 30003-1-24-80,30003-1-30-81 y 30003-1-55-83 principalmente). El Instituto de Investigaciones Marinas de Punta Betín (INVEMAR) ha proporcionado la infraestructura requerida. Numerosos colegas y compañeros del INVEMAR han contribuido desinteresadamente al éxito de nuestro trabajo. El CIP-INDERENA en Cartagena prestó ayuda para las labores de campo en las Islas del Rosario. La firma INTERCOR autorizó la publicación de información obtenida en el estudio "Diagnóstico actual de las comunidades marinas de la Bahía de Portete".
BIBLIOGRAFÍA
1 Beebe, W. y J. Tee-Van. 1928. The fishes of Port-au-Prince Bay, Haiti. Zoológica, 10(1):1-279. [ Links ]
2 Böhlke, J. E. y C.C.G. Chaplin. 1968. Fishes of the Bahamas and adjacent tropical waters. Livingston Publ. Co., Wynnewood, U.S.A., 771 p. [ Links ]
3 Böhike, J. E. y C. R. Robins. 1968. Western Atlantic seven-spined gobies, with descriptions of ten new species and a new genus, and comments on Pacific relatives. Proc. Acad. Nat. Sci. Phila., 120: 45-174. [ Links ]
4 Castro-Aguirre, J. L. y A. Márquez-Espinosa. 1981. Contribución al conocimiento de la ictiofauna de la Isla Lobos y zonas adyacentes, Veracruz, México. Depto. Pesca México, Serie Cient., 22: 1-85. [ Links ]
5 Cervigón, F. 1966. Los peces marinos de Venezuela. Tomos l y II. Fund. La Salle Cienc. Nat., Monogr. 11 y 12, 951 p. [ Links ]
6 Cervigón, F. Sin Fecha. Los peces marinos de Venezuela. Complemento III. Contrib. Cient. Univ. Oriente, 4:1-70. [ Links ]
7 Dahl, G. 1971. Los peces del norte de Colombia. Inderena, Bogotá, 391 p. [ Links ]
8 Dawson, C. E. 1969. Studies on the gobies of the Mississippi sound and adjacent waters. II. An illustrated key to the gobioid fishes. Publ. Gulf Coast. Res. Lab. Mus., 1: 1-59. [ Links ]
9 Fowler, H. W. 1950. Results of the Catherwood-Chaplin West Indies Expedition, 1948. Part III. The Fishes. Proc. Acad. Nat. Sci. Phila., 52: 69-93. [ Links ]
10 Garzón-Ferreira, J. 1989. Contribución al conocimiento de la ictiofauna de Bahía Portete, departamento de la Guajira, Colombia. Trianea, 3: 149-172. [ Links ]
11 Garzón-Ferreira, J. y A. Acero. 1988a Los peces Gobiidae de los arrecifes del caribe colombiano. I. Especies, distribución, frecuencia y abundancia. An. Inst. Invest. Mar. Punta Betín, 18: 59-81. [ Links ]
12 Garzón-Ferreira, J. y A. Acero. 1988b. Los peces Gobiidae de los arrecifes del Caribe colombiano. II. Habitats, microhábitatsy hábitos alimentarios. Actual. Biológ., 17(64): 115-124. [ Links ]
13 Garzón-Ferreira, J. y A. Acero. 1990. los peces Gobiidae de los arrecifes del Caribe colombiano. III. El género Coryphopterus. An. Inst. Invest. Mar. Punta Betín, 19/20: 59-99. [ Links ]
14 Garzón-Ferreira, J. y A. Acero. 1992. Los peces Gobiidae de los arrecifes del Caribe colombiano. IV. El género Lythrypnus. Caldasia. 17(1): 95-114. [ Links ]
15 Ginsburg, I. 1947. American species and subspecies of Bathygobius, with a demonstration of a suggested modified system of nomenclature. Jour. Wash. Acad. Sci., 37(8): 275-284. [ Links ]
16 Herre, A. W. 1927. Gobies of the Philippines and the China Sea.Monogr. Bureau Sci. Philip., 23: 1 -352. [ Links ]
17 Hoese, D. F. 1978. Gobiidae. En Fischer, W. (ed.): FAO species identification sheets for fishery purposes. Western central Atlantic (fishing area 31). Vol II, FAO, Roma. [ Links ]
18 Miller, P. J. 1981. Gobiidae. En Fischer, W.; G. Bianchi y W. B. Scott (eds.): FAO species identification sheets for fishery purposes, eastern central Atlantic, fishing areas 34, 47 (in part). Depart. Fish. Oceans. Otawa, Canadá, vol. II. [ Links ]
19 Peters, K. M. 1983. Larval and early juvenile development of the frillfin goby, Bathygobius soporator (Perciformes: Gobiidae). Northeast Gulf Sci., 6(2): 137-153. [ Links ]
20 Randall, J. E. 1983. Caribbean reef fishes (2a. ed.). T.H.F. Publ., Hong Kong, 350 p. [ Links ]
21 Resendez-Medina, A. 1971. Peces del arrecife la Blanquilla, Veracruz, México. An. Inst. Biol. Univ. Nac. Auton. México, 42, Ser. Cienc. Mar Limnol.,1: 7-31. [ Links ]
22 Robins, C. R.; G. C. Ray y J. Douglas. 1986. A field guide to the Atlantic coast fishes of North America. Houghton Mifflin Co., Boston, U.S.A., 354 p. [ Links ]
23 Santos-Martínez, A. y A. Acero. 1991. Fish community of the Ciénaga Grande de Santa Marta (Colombia): composition and zoogeography. Ichthyol. Explor. Freshwaters, 2(3): 247-263. [ Links ]
24 Springer, V.C. y A. J. McErlean. 1962. Seasonality of fishes on a south Florida Shore. Bull. Mar. Sci. Gulf and Carib., 12(1): 39-60. [ Links ]
25 Starck, W. A. 1968. A list of fishes of Alligator Reef, Florida, with coments on the nature of the Florida reef fish fauna. Undersea Biol., 1(1): 1-39. [ Links ]
26 Tavolga, W. N. 1950a. Pattern variability among populations of the gobiid fish Bathygobius soporator. Copeia, 1950: 182-194. [ Links ]
27 Tavolga, W. N. 1950b. Development of de gobiid fish, Bathygobius soporator. Jour. Morphol., 87:467-492. [ Links ]
28 Tavolga, W. N. 1953. Spawning and embryonic development in the gobiid fish, bathygobius soporator. Anat. Ree, 117: 569-597. [ Links ]
29 Tavolga, W. N. 1954. Reproductive behavior of the gobiid fish, Bathygobius soporator. Bull Am. Mus. Nat. Hist., 104: 427-460. [ Links ]
30 Tavolga, W. N. 1956. Pre-spawning behavior in the gobiid fish, Bathygobius soporator. Behaviour, 9: 53-74. [ Links ]
31 Walls, J. G. 1976. Fishes of the northern Gulf of México. T.F.H. Publ., Hong Kong, 432 p. [ Links ]
32 Winterbotton, R. y A. R. Emery. 1986. Review of the gobiotd fishes of the Chagos Archipioelago, central Indian Ocean. Royal Ontario Mus. Life Sci. Contrib., 142: 1-82. [ Links ]