Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.21 no.1 Santa Marta Jan./Dec. 1992
SEGUIMIENTO DEL CICLO REPRODUCTIVO EN EL ANFÍPODO MARINO PARHYALE HAWAIENSIS (DANA) (GAMMARIDEA: HYALIDAE)
Herbert Quintero1, Carlos Vanin2 y Patricia Moreno2.
1Apartado Aéreo 6712 Cartagena, Colombia.
2Apartado Aéreo 020220, Cartagena, Colombia.
RESUMEN
En el litoral rocoso de Cartagena (Caribe colombiano) se colectó el anfípodo Parhyale hawaiensis en estado copulatorio y ovado. En el seguimiento de la etología y características del período de fecundación se definieron seis fases. Así mismo, en el seguimiento del desarrollo marsupial se establecieron cinco estados que caracterizaron la evolución de los huevos y embriones. Por último, se estableció el desarrollo post-marsupial para cuatro períodos de vida, los cuales se determinaron por la variación de la longitud total, longitud de la cabeza, número de artejos en las antenas, forma del gamópodo 2 y el incremento en el número de espinas medias marginales del gamópodo 2 y los pereiópodos. El proceso de fecundación y desarrollo embrionario comprendió 16 días, con un promedio de 13 crías por hembra, las cuales se desarrollan simultáneamente; sinembargo la salida de los organismos del marsupio es asincrónica. Durante el desarrollo post-marsupial la diferenciación sexual se alcanzó a las 4 semanas de vida, evidenciada por el mayor tamaño y forma redondeada del gamópodo 2, además del mayor número de artejos en las antenas 1 y 2 del macho.
ABSTRACT
The amphipod Parhyale hawaiensis was collected in copulative and ovate states in the rocky shore of Cartagena (Colombian Caribbean). Six phases were defined during the fecundation period. Five characteristic stages in the evolution of the eggs and embryos were established for the marsupial development. It was defined the post-marsupial development as consisting of four life periods, based on variations in total length, head length, antennal article number, shape of gnathopod two, and the increase in number of medial marginal thorns in the gnathopod two and pereiopods. The fecundation process and the embryologic development lasted sixteen days. Embryos developed simultaneously in number of 13 per female. The release of juveniles was asynchronous. In the male, sexual dimorphism was reached after four weeks as evidenced by the size and shape of the gamopod 2 and the number of articles in antennaes 1 and 2.
INTRODUCCIÓN
El anfípodo Parhyale hawaiensis (Dana, 1853), perteneciente a la familia Hyalidae, se constituye en un nuevo registro en el Caribe colombiano. En esta área se han realizado dos inventarios de anfípodos, por Calero (1982) y Ortiz (1983). La especie se encuentra ampliamente distribuida en el litoral rocoso de Cartagena (10°23-27'N y 75°31-34'W), en las zonas de Crespo, Marbella, Bocagrande, Castillogrande y Bahía Interna. El anfípodo se ubica en el supralitoral inferior y mesolitoral superior en diversas macroalgas, siendo abundante en Cladophora repens, Bryopsis plumosa y Ulva lactuca v. rígida. La especie se reconoce por los grandes saltos que realiza al ser expuesta al aire, así como por la coloración violeta en el cuerpo y roja en la boca (Moreno et ai, 1991). De distribución pantropical (Galán, 1984), P. hawaiensis ha sido registrada en el Golfo de México y en el Mar Caribe.
Aunque los anfípodos desempeñan un papel importante en la cadena trófica por ser un grupo representativo en la fauna litoral bentónica, han sido poco estudiados en Colombia. Así mismo, a pesar de los amplios estudios a nivel internacional respecto al crecimiento y estado de desarrollo de varias especies de anfípodos, P. hawaiensis no ha sido investigada. La información del crecimiento y estados de desarrollo en los anfípodos constituye una gran ayuda en la identificación de las especies y en la obtención de grupos homogéneos de organismos en cualquier período de vida, ya sea para estudios ecológicos de poblaciones, reproducción en laboratorio y elaboración de bioensayos entre otros. Entre los diversos estudios realizados en -anfídopos de la superfamilia Talitroidea (Wildish, 1972; Morino 1978; Page, 1979), se destaca el realizado en Hyale media por Leite y Wakabara (1989), el cual se tomó como base metodológica del presente trabajo. Esta investigación establece la etología y características del período de fecundación, el desarrollo marsupial y post-marsupial de P. hawaiensis.
MATERIALES Y MÉTODOS
Durante el mes de marzo de 1990 en el área de Crespo y Marbella se colectaron organismos maduros en estado copulatorio y hembras ovadas del anfípodo P. hawaiensis. En el laboratorio, los individuos se ubicaron por parejas en beakers de 1000 mi con un volumen de 500 mi de agua de mar y aireación continua, observándose un total de 30 parejas. Se adicionó el alga U. lactuca v. rígida como alimento (además de sustrato) y nauplios de Artemia (1 nauplio/ml).
Diariamente se hicieron observaciones del comportamiento de la pareja y de la posición de los huevos en el marsupio de la madre. A partir de estas observaciones se separaron 30 hembras con huevos característicos de cada una de las fases previamente identificadas, procediéndose luego a extraer y contar los huevos. El desarrollo marsupial se determina a partir de la medición del diámetro en la parte más ancha, así como la coloración y estructuras en cada huevo (5 por hembra). De otra parte, se aislaron crias recién nacidas obtenidas en el laboratorio en beakers de 1000 mi, siendo alimentadas con el alga U. Lactuca v. rígida, a las cuales se les determinó el desarrollo post-marsupial a 0,2,4 y más de 4 semanas de vida; para ello se establecióla longitud total del cuerpo (del rostro al telson), longitud de la cabeza (del rostro al inicio del primer pereión), número de artejos en las antenas, forma del gamópodo 2 y el incremento en el número de espinas medias marginales del gamópodo 2 y los pereiópodos 1 al 5. Se observó un número de 30 organismos por estado. En los beakers donde se ubicaron los organismos maduros y las crías, se mantuvo en promedio una temperatura de 28.8°C± 0.83, salinidad de 30 ‰. ±0.8, oxígeno de 6.73 mg/lt ±0.15 y un pH de 8.08+ 0.05.
Los huevos y organismos a observar se montaron sobre portaobjetos inmersos en glicerina para facilitar su manejo y evitar la desecación. Las observaciones se realizaron en un microscopio Nikon Labophot Tipo 104 y las mediciones se tomaron con un micrómetro ocular y un calibrador Solingen. Los dibujos se efectuaron con ayuda de una cámara lúcida. En el caso de las observaciones externas del marsupio se utilizó un estereoscopio Wild M7A. En la identificación de la especie se usaron los trabajos de Barnard (1969,1971), Galán (1984) y Largade (1987).
RESULTADOS
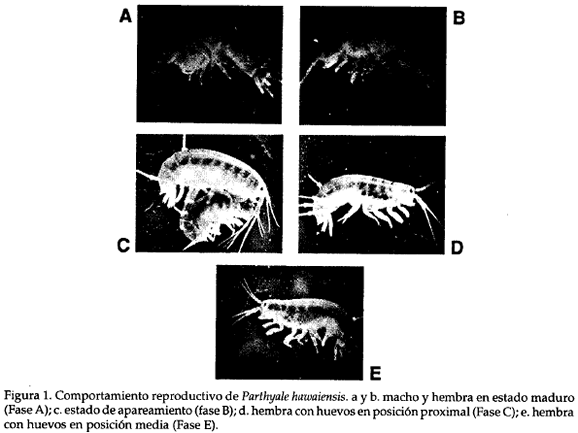
El seguimiento de la etología y características del período de fecundación, de P. hawaiensis se definió en 6 fases (Tabla 1 ), teniendo en cuenta la posición de los huevos respecto a la parte ventral de la hembra. En la fase A el macho y la hembra están sexualmente desarrollados (Fig. 1 a, b) no observándose un comportamiento precopulatorio definido; en la siguiente fase ocurre el apareamiento ubicándose el macho en el dorso de la hembra sujetándola con los gamópodos l y 2 (Fig. l c). Posteriormente ocurren contactos ocasionales (Fase D y F) en forma simultánea al desarrollo de los huevos en el marsupio. Las Figs. 1 d y e ilustran la diferente posición de los huevos en la Fase C y E respectivamente. El tiempo total del proceso de fecundación y desarrollo embrionario comprendió 16 días, luego de lo cual los individuos completamente formados están listos para salir del marsupio de la madre. El promedio de crías por hembra correspondió a 13, valor que puede ser mayor teniendo en cuenta que estas salen asincrónicamente del marsupio.
El desarrollo marsupial se caracterizó en 5 estados (Tabla 2) que comprenden desde la fecundación de los huevos hasta la liberación de las crías. A partir de la aparición de huevos redondeados de coloración oscura (violeta-café) con un diámetro de 0.43 a 0.63 mm, hay un aumento en el diámetro, además de una tendencia a tomar forma oval. Se destaca el estado 3 donde aparece claramente diferenciada la cabeza y el estado 4 donde se aprecian los rudimentos de los apéndices. Por último, el desarrollo culmina con un individuo juvenil de longitud total entre 1.17 y 1.95 mm de coloración blanca. En cada uno de los marsupios observados se encontró huevos con el mismo grado de desarrollo, sin embargo la eclosión de los huevos es asincrónica pues se observaron algunos juveniles con movimiento libre en el marsupio y embriones aún sin eclosionar.
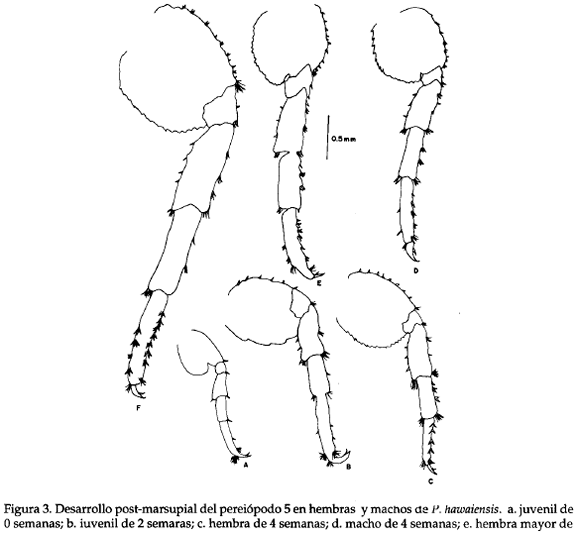
El desarrollo post-marsupial (Tabla 3; Figs. 2 y 3), se inicia a partir de la liberación de (crías) del marsupio, caracterizándose el desarrollo del organismo hasta su diferenciación sexual. A los individuaos recién nacidos, es decir de 0 semanas de vida, se les denomina juveniles y se caracterizan por su color blanco y la no definición de caracteres sexuales. En su tiempo de 2 semanas se pueden encontrar organismos con coloración violeta en el cuerpo, pero aún sin diferenciación sexual, de ahí que se sigan denominando juveniles. Para un período de 4 semanas de vida se encuentran organismos que recién alcanzan su madurez sexual, la coloración del cuerpo es violeta y se puede diferenciar claramente la hembra del macho por el mayor desarrollo y tamaño del gamópodo 2 en éste último. Por último, para un período mayor a 4 semanas de vida, la hembra y el macho presentan un considerable incremento de tamaño, características similares a las presentadas en el período de 4 semanas.
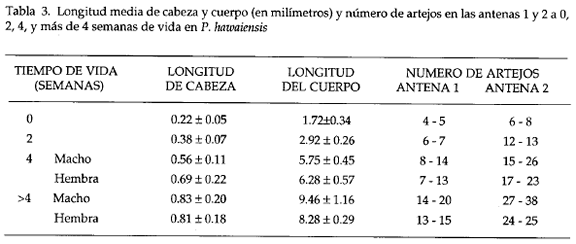
La longitud de cabeza y cuerpo durante el desarrollo post-marsupial (Tabla 3) se vio incrementada a través del tiempo, determinándose en individuos de más de 4 semanas un mayor tamaño en el macho (longitud del cuerpo en machos 9.46 mm y en hembras 8.28 mm en promedio); sin embargo a las 4 semanas de vida la hembra tiene mayor longitud (machos 5.75 mm y hembras 6.28 mm).
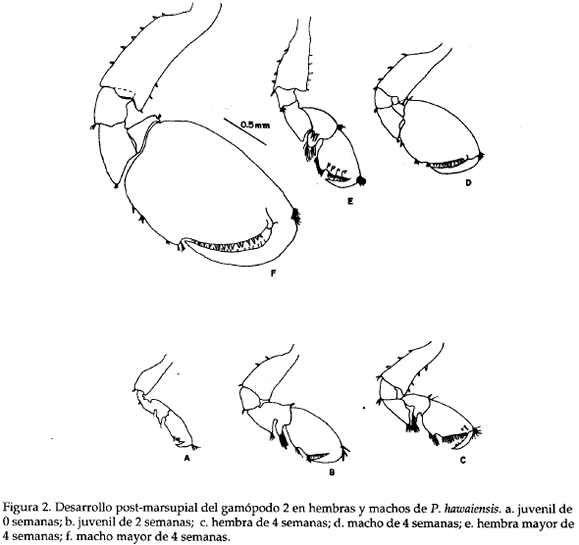
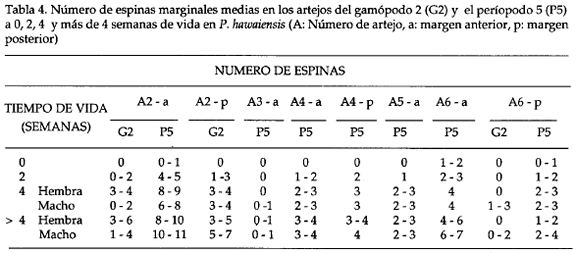
La especie se caracterizó por tener la antena 1 más corta que la 2, y un aumento progresivo en el número de arteios a medida que crecen los individuos, así por ejemplo, a 0 semanas el número de artejos en la antena 2 es de 6 a 8 y en machos de más de 4 semanal de vida de 27 a 38. El número de artejos en ambas antenas es menor en hembras que en machos (Tabla 3). El desarrollo post marsupial del gamópodo 2 (Tabla 4; Fig. 2) muestra un mayor tamaño para los machos, caracterizado además por una menor setación respecto a las hembras juveniles; el artejo 6 (própodo) del macho es de forma redondeada, mientras que en la hembra es de forma triangular. Observando la variación de las espinas marginales medias en el pereiópodo 5 (Tabla 4; Fig 3), se notó un incremento en el número y el tamaño a través del tiempo sin existir una diferenciación clara entre hembra y macho a éste nivel.
DISCUSIÓN
La condición de los padres de presentar contactos ocasionales, luego de ocurrir la fecundación, (Fase B), pueden ser explicada por: un comportamiento intrínseco en la especie; un ahorro de energía para la hembra, ya que el macho en condición de apareamiento es quién realiza y dirige el desplazamiento de la pareja, de manera que la hembra se limitaría exclusivamente a crear una corriente ventilatoria con los pleópodos, aireando así los huevos en el marsupio; una contribución del macho a crear corriente ventilatoria para los huevos; y por último, a la producción constante de feromonas por parte de la hembra durante todo el proceso reproductivo, lo que mantendría cercano al macho. La producción de feromonas en hembras de anfípodos ha sido registrada por Barnes (1985), quien establece que es la forma como la hembra atrae al macho.
El hecho de encontrar huevos en el mismo estado de desarrollo, evidenciado por su similar longitud y forma en el marsupio, define a Parhyale hawaiensis como una especie con fertilización y desarrollo embriológico simultáneo, lo que ha sido observado en otras especies de anfípodos por Leite y Wakabara (1989), Green (1965) y Moore (1981). De otra parte, la variación del diámetro y número de huevos entre y en cada estado de desarrollo es explicado por Margalef (1986), lo que lleva a esperar que hembras de gran tamaño y avanzada madurez sexual generen crías de mayor tamaño y más numerosas. El mayor tamaño alcanzado por las hembras durante las primeras 4 semanas de vida es igualmente observado por Kanneworf (1965) en el anfípodo Ampelisca macrocephala. En general las observaciones a nivel de desarrollo post-marsupial permiten determinar el grado de madurez y la edad de los individuos de la especie, lo cual permite no solo su identificación en cualquier estado de vida sino que además facilita desarrollar prácticas a nivel de obtención de organismos en condiciones de laboratorio.
AGRADECIMIENTOS
Este trabajo hace parte de la tesis de grado de los autores para obtener el título de Biólogo Marino de la Facultad de Biología Marina de la Universidad Jorge Tadeo Lozano (UJTL); agradecemos al Centro de Investigaciones de la UJTL Secc. Caribe, por la financiación del material fotográfico, y al Centro de Investigaciones Oceanográficas e Hidrográficas, (Cartagena), por facilitar las instalaciones del Laboratorio de Bioensayos. Así mismo, nuestro agradecimiento a Manuel Ortíz (Univ de la Habana) por la confirmación de la especie; a Arturo Acero (Univ. Nacional de Colombia) y Oscar Solano (UJTL), por la revisión del manuscrito; por último, a Alvaro Zuluaga "Radar"-por su coloboración en la realización de las fotografías.
BIBLIOGRAFÍA
1 Barnard, J.L. 1969. The families and genera of marine gammaridean amphipoda. U.S. Nat. Mus. Bull., 271:1-173. [ Links ]
2 Barnard, J.L.1971. Keys to the Hawaiian marine Gammaridea, 0-30 m. Smithsonian Contrib. Zool., 58:1-135. [ Links ]
3 Barnes, R. 1985. Zoología de los invertebrados. 4a Ed. Interamericana, México, 1157 p. [ Links ]
4 Calero, L. A. 1982. Anfípodos bentonicos de la Bahía de Cartagena (Caprellidae y Gammaridea). Tesis de Grado, Univ. Jorge Tadeo Lozano, Cartagena, 79 p. [ Links ]
5 Galán, A. 1984. Systematic studies on Amphipoda (Crustacea) of the Venezuelan Caribbean coast. Tesis Doctoral, Imperial Colleqe of Sciences and Technol, Univ. London, no pag. [ Links ]
6 Green, J. 1965. Chemical embriology of the Crustacea. Biol. Rev. 40:580-600. [ Links ]
7 Kanneworff, E. 1965. Life cycle, food, and growth of the amphipod Ampelisca macrocephala Liljeborg from the Oresund. Ophelia, 2(2):305-318. [ Links ]
8 Laqarde, G. 1987. Anfípodos Gammaridea del litoral del Golfo Triste y áreas adyacentes. Carib. J.Sci., 23(2):260-277. [ Links ]
9 Leite, F.P.P. y Y. Wakabara. 1989. Aspects of marsupial and postmarsupial development of Hyale media (Dana), 1853 (Hyalidae, Amphipoda). Bull. Mar. Sci., 45(1):85-97. [ Links ]
10 Margalef, R. 1986. ecología. Omega, Barcelona, 951 p. [ Links ]
11 Moore, P.G. 1981. The life histories of the amphipods Lembos websteri Bate and Corophium bonelli. Milne Edwards in Kelp holdfasts. J. Exp. Mar. Biol. Ecol., 49(1):1-50. [ Links ]
12 Moreno, M. P., H. E. Quintero y C.I. Vanin. 1991. Comportamiento de Parhyale hawaiensis como organismo de prueba y ensayos de toxicidad aguda a 96 horas con Cd ++ y DDT. Tesis de Grado, Univ. Jorge Tadeo Lozano, Cartagena, 107 p. [ Links ]
13 Morino, H. 1978. Studies on the Talitridae (Amphipoda, Crustacea) in Japan III. Life history and breeding activity of Orchestia platensis Kroyer. Publ. Seto Mar. Biol. Lab., 24(4/6):245-267. [ Links ]
14 Ortiz, M. 1983. Los anfípodos (Gammaridea) de las costas del mar Caribe de la República de Colombia. Rev. Inv. Mar. Hab., 4(1):23-31. [ Links ]
15 Page, H. M. 1979. Relationship between growth, size, molting and number of antennal segments in Orchestia traskiana stimpson (Amphipoda, Talidridae). Crustaceana, 37(3):248-267. [ Links ]
16 Wildist, D. J. 1972. Post-embryonic growth and age in some littoral Orchestia (Amphipoda, Talitridae). Crustaceana, (suppl. 3):267-274. [ Links ]