Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.22 no.1 Santa Marta Jan./Dec. 1993
VARIACIONES NICTEMERALES EN LA COMUNIDAD DE ZOOPLANCTON DE LA BAHÍA DE SANTA MARTA, MAR CARIBE COLOMBIANO
Álvaro Ramiro Bernal V.1 y Sven Zea2
1Instituto de investigaciones Marinas de Punta de Betín - INVEMAR, A. A. 10-16, Santa Marta, Colombia (A, R. B.).
2Universidad Nacional de Colombia, Depto de Biología, INVEMAR, A A. 10-16, Santa Marta, Colombia (S. Z.).
RESUMEN
Se analizaron las variaciones día-noche y entre días en la composición del zooplancton superficial y se relacionaron con parámetros ambientales en la bahía de Santa Marta, Caribe colombiano, mediante análisis de componentes principales. Los muestreos se realizaron cada cuatro horas en tres días diferentes entre agosto y octubre de 1989. La mayor variación en abundancia (primer componente principal) se manifestó en un aumento sobre el promedio en casi todos los grupos en el atardecer y las horas de la noche. Esta variación resultó significativamente correlacionada en forma inversa con la intensidad de la luz incidente y se interpretó como un reflejo en superficie del fenómeno de migración vertical. De otro lado, en el segundo y tercer componente principal se evidenciaron las diferencias entre días para los grupos y dentro de los grupos; las que ocurrieron entre el primer día de muestreo y los otros dos fueron resaltadas por el segundo componente, y resultaron correlacionadas negativamente con la temperatura y positivamente con los nitratos disueltos. Estas se interpretaron como resultado de movimientos de masas de agua de características fisicoquímicas y composición zooplanctónica diferente sobre el sitio de muestreo. Sin embargo, no se pudo descartar que hubiera una asociación estrecha entre estos parámetros y cambios en los movimientos migratorios.
ABSTRACT
Day-night and between-day variation in surficial zooplankton composition and its relationship to environmental parameters were analyzed in the Santa Marta Bay, Colombian Caribbean, by Principal Components Analysis. Sampling was carried out every four hours in three different days between August and October 1989. The greatest variation in abundance (first principal component) was due to an increase over the mean in most groups at nightfall and during night hours. This variation was inversely and significantly correlated with incident light intensity, and was interpreted as consequence of the vertical migration out of the surface zone. On the other hand, the second and third principal components showed differences amog days for groups and within groups; those that existed in the first sampling day with respect to the other two were highlighted by the second component, and were negatively correlated with temperature and positively correlated with disolved nitrates. These results were interpreted as a consequence of movements of water masses with different physical-chemical characteristics and zoo-plankton composition over the sampling site. However, a case of close association between these parameters and the changes in migrating movements could not be ruled out.
INTRODUCCIÓN
El zooplancton presenta una amplia distribución en los océanos del mundo, desde la superficie a las grandes profundidades abisales. Factores como la topografía del lugar, las corrientes, las condiciones físico-químicas imperantes, las relaciones interespecíficas, las particularidades de los ciclos de vida de las especies y su dispersión, etc., circunscriben las poblaciones a ambientes determinados (Boltovskoy, 1981a; Castellvi, 1972; Wicstead, 1979). Razones de índole ecológica y/o fisiológica condicionan a la comunidad en su totalidad, a especies en particular o a estadios de éstos, a presentar desplazamientos verticales propios o desplazamientos horizontales con las masas de agua.
Los movimientos verticales ocurren en ritmos nictemerales en un ciclo de 24 horas (Margalef, 1986). Su efecto sobre la superficie del mar se manifiesta como un amontonamiento general en ella durante el período de oscuridad, seguido de un apartamiento durante el día (Margalef, 1986, Wicstead, 1979). Sin embargo, lo que sucede en la superficie no puede considerarse como un reflejo instantáneo de lo que ocurre en la vertical (Banse, 1964). La periodicidad diaria de migración es controlada o influenciada por aspectos ecológicos (tróficos, defensivos y/o reproductivos) o ambientales (ciclos de luz, presión, temperatura, salinidad, nutrientes, oxígeno, etc.) (Ángel, 1981 y 1986: Ángel y Baker, 1982; Buchanan y Hanney, 1980; Banse, 1964; Margalef, 1986; Mathew et al., 1979; Meyers, 1980; Quasim, 1979; Ringelberg, 1980; Wicstead, 1979). Los movimientos horizontales y a veces los verticales también son condicionados por las características hidrológicas de las aguas que habitan (Raymond, 1983).
En referencia a los trabajos zooplantónicos desarrollados en el Caribe colombiano, Mulford (1985) y Castaño (1990) tocan someramente el problema de los cambios diarios. Para la Bahía de Santa Marta se han desarrollado inventarios sistemáticos de copépodos Calanoidea y Ciclopoidea (Alvarado, 1978) y de crustáceos epiplanctónicos (Campos y Plata, 1990), estudios de composición y abundancia del zooplancton superficial (Lozano, 1986), y de la relación ictioplancton-zooplancton (López, 1990), todos ellos basados en muestreos durante el día.
Este trabajo busca relacionar las variaciones en los grupos zooplantónicos frente a los factores ambientales, a partir de muestreos superficiales tomados a lo largo del día y la noche. Así como interpretar dichas variaciones en relación con los movimientos de la comunidad y/o de las masas de agua.
MATERIALES Y MÉTODOS
Trabajo de Campo
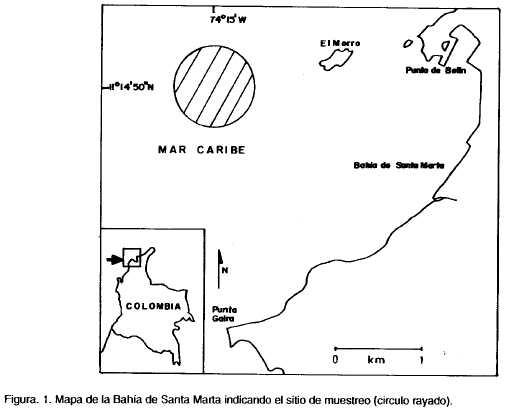
El sitio de muestreo se localizó aguas afuera de la Bahía de Santa Marta, costa Caribe colombiana, Departamento del Magdalena, (11°14'50" N y 74°15' W) (Fig. 1), con una profundidad de 75-145 m. Se efectuaron tres jornadas de muestreo a bordo del Barco de Investigaciones Tortuga II en 1989, así: día 1:9-10 de agosto, fase lunar cuarto creciente; día 2: 16-17 de agosto, luna llena con eclipse total a las 22:15 horas; día 3: 12-13 de octubre, luna llena. En cada día se realizaron arrastres horizontales superficiales a las 10:00 (hora 1), 14:00 (hora 2), 18:30 (hora 3), 22:00 (hora 4), 2:00 (hora 5) y 5:30 (hora 6), empleándose una red cónica simple de 0.25 m de diámetro en la boca y ojo de malla de 250 μm, provista de flujómetro previamente calibrado (Boltovskoy, 1981a.). La red se arrastró a una velocidad promedio de dos nudos, siguiendo un recorrido aproximadamente circular durante 10 minutos. Para el día 2, a causa de la pérdida de la red por el excesivo oleaje durante el eclipse total de luna, no se muestreo a las 22:00 horas, y los arrastres de las 2:00 y 5:30 horas se efectuaron con una red del mismo tamaño pero de ojo de malla de 500 Hm. Las muestras se preservaron inmediatamente en formaldehído al 4% diluido en agua de mar y neutralizado con glicerina.
En los mismos horarios de los arrastres se tomaron muestras de agua superficial para análisis de nutrientes, salinidad, pH y clorofila a. El oxígeno, los días 1 y 2, se determinó inmediatamente después de obtener las muestras de agua utilizando un oxímetro WTW Oxi 92; el día 3 se midió en el laboratorio. La temperatura se determinó con ayuda de un termómetro con precisión de 1°C. Se midió in-situ la intensidad de la luz incidente inmediatamente bajo la superficie del mar con un sensor Quantum/Radiometer/Photometer LI - CO, INC. LI - 185 B, con un espectro de luz 400 - 700 nm, y un plano de dirección de 90° respecto de la vertical.
Las 17 muestras fueron cuantificadas en su totalidad con ayuda de estéreo-microscopio y placa Bogorov para 10 mi. La determinación taxonómica de los ejemplares se realizó hasta el nivel de grandes grupos (14 en total, incluyendo los huevos de peces). Los nutrientes se analizaron dentro de las 24 horas siguientes al muestreo siguiendo los métodos sugeridos por Grasshoff (1976). El oxígeno (día 3) se midió por titulación siguiendo el método volumétrico de Winkler (Strickland y Parsons, 1972). El pH se determinó con un potenciómetro Fischer 620. La salinidad con el salinómetro conductímetro WTW LF 191. La clorofila a según el método de extracción con acetona de Lorensen (Strickland y Parsons, 1972).
En todos los casos el número de individuos se estandarizó a un volumen de 100 m3 de agua, de acuerdo a Smith y Richardson (1979). Para una mejor comprensión del comportamiento del zooplancton a lo largo del día y entre días, se empleó el Análisis de Componentes Principales (Digby y Kempton, 1987). La matriz de conteos por grupo taxonómico y por muestra se estandarizó por grupo para eliminar las diferencias absolutas entre grupos. Se corrió el análisis y se obtuvieron: (1) valores propios ("eigenvalues") o proporción de la varianza explicada por cada componente; (2) coordenadas de los vectores propios ("eigenvectors") o peso de cada grupo zooplanctónico en cada componente, una especie de medida del grado de influencia de cada uno en la variación en las muestras a lo largo de ese componente y (3) coordenadas ("scores") de cada muestra en los componentes principales. Para estudiar la relación de los parámetros ambientales con el comportamiento del zooplancton, estos se correlacionaron con las coordenadas de cada muestra en los tres primeros componentes utilizando el índice de correlación no paramétrica de Sperman (r) (Siegel y Castellan, 1988). Se tomó un nivel de significancia de p<0.05 para considerar una correlación significativa.
RESULTADOS
Comportamiento General
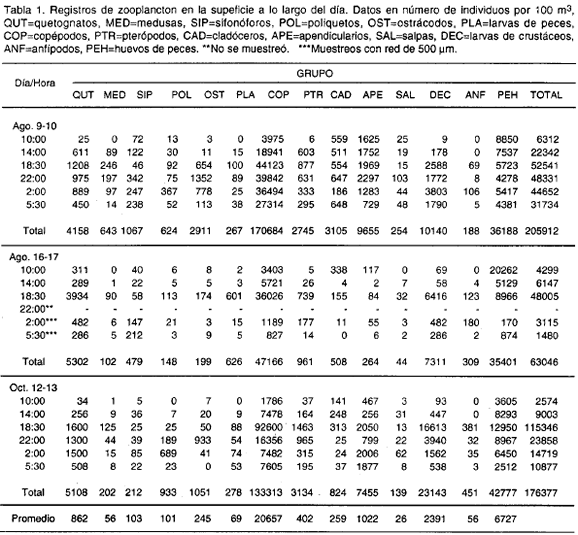
Los grupos más abundantes fueron los copépodos y larvas de decápodos con registros superiores a 47000 y 7000 indiv. (100 m-3) respectivamente. El taxón con menores registros fue salpas con un número inferior a 255 indiv. (100 m-3); los otros grupos presentaron registros intermedios (Tabla 1).
El resultado de los conteos totales en la superficie mostró un aumento progresivo de las 10:00 hasta llegar a un tope máximo, a las 18:30 para los tres días de estudio. A partir de esta hora se presentó para cada uno de los días muestreados una disminución progresiva hacia las 5:30. De igual forma, se presentaron mayores conteos totales para el día 1 frente a los días 2 y 3 para todas las horas de estudio (Fig. 2, Tabla 1), con la excepción del día 3 a las 18:30 que fue marcadamente superior al día 1 y 2.
Los tres primeros componentes principales explicaron un 70.4% de la variación total en la abundancia de los grupos (valores propio: comp. 1=37.1%; comp. 2=20.9%; comp. 3=12.4%) el orden de las muestras a lo largo del primer componente reflejó las diferencias en la composición global del zooplancton entre el día y la noche, mientras que para el segundo y tercer componentes se evidenciaron las diferencias que hubo en los esquemas de variación horaria entre grupos y dentro de los grupos para los diferentes días.
Variaciones Día-Noche
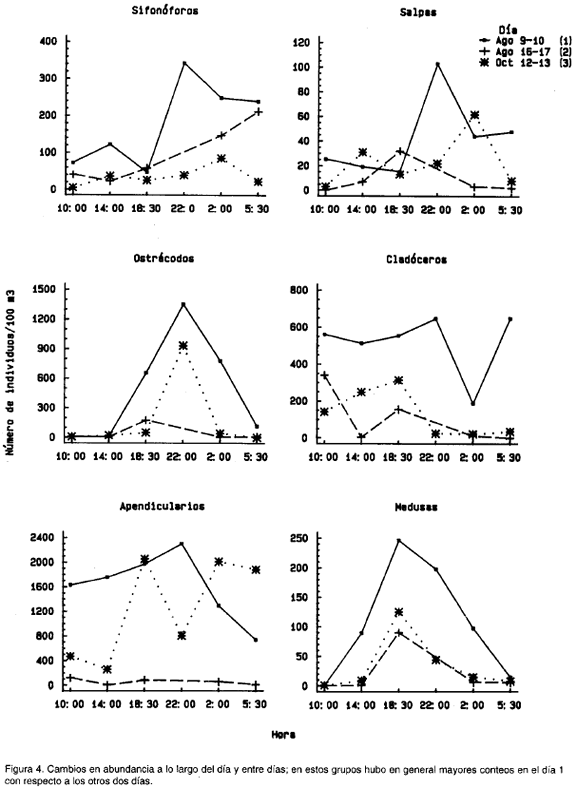
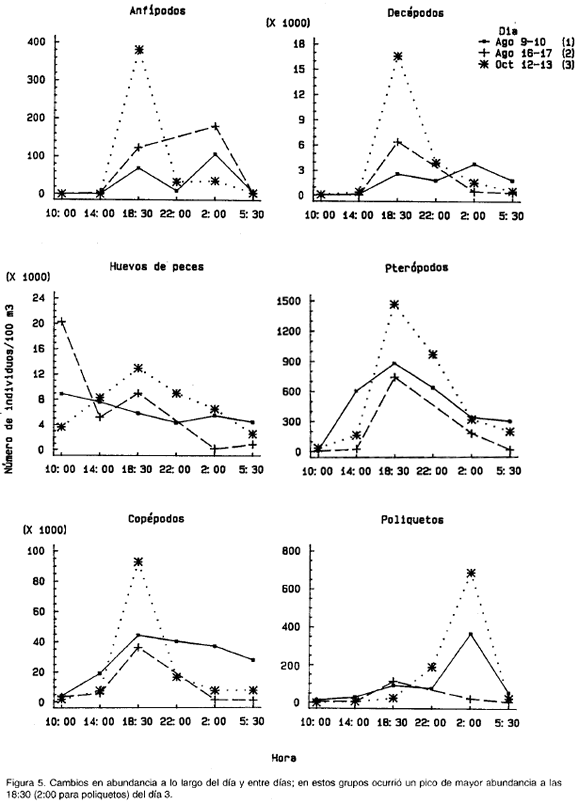
Sobre el eje del componente 1, las muestras diurnas (5:30=hora 6; 10:00=hora 1; 14:00=hora 2) se ubicaron hacia la izquierda, mientras que las nocturnas (18:30=hora 3; 22:00= hora 4) hacia la derecha; las muestras correspondientes a las 2:00 (hora 5), se ubicaron a uno y otro lado según el día (Fig. 3a, 3b). Los vectores propios en este componente mostraron un aumento sobre el promedio en la abundancia en todos los taxa en horas de la noche (hacia la derecha), siendo este en mayor grado de copépodos, pterópodos, medusas y decápodos (Fig. 3d, 3e, 4, 5). En general, con excepción de cladóceros, apedicularios y huevos de peces, todos los grupos mostraron una tendencia al aumento a lo largo del día hasta un valor máximo al atardecer o cerca de la media noche, con disminución progresiva en horas de la madrugada (Fig. 4, 5, 6).
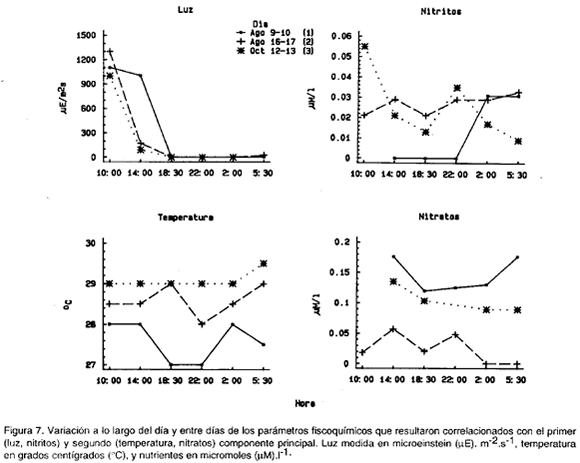
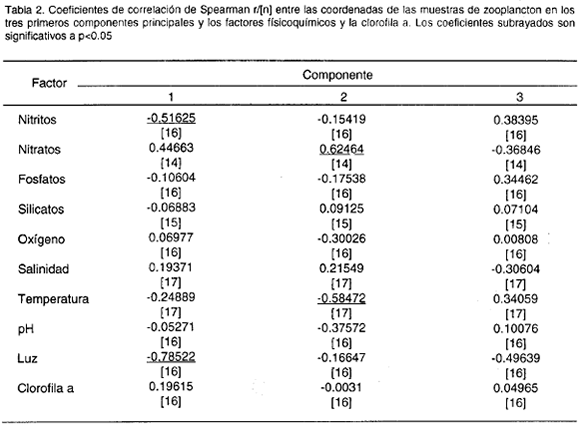
Con el primer componente, como se esperaba, la intensidad de la luz tuvo una correlación inversa altamente significativa (Tabla 2, r=0.79, p=0.003, n=16,14 g. L; Fig 7). Sin embargo la relación entre la abundancia de zooplancton en la superficie y la intensidad de la luz no fue muy ajustada, ya que durante las horas de oscuridad total hubo variaciones en la abundancia total y en la mayoría de los grupos.
Los nitritos también resultaron correlacionados significativamente con el primer componente (Tabla 2, r=-0.52, p=0.04, n=14., 14 g.L). sin embargo, en la variación de este parámetro día-noche (fig. 7), no se ve una relación clara con las del zooplancton; la falta de datos a las 10:00 del día 1 podría haber producido una correlación espuria.
Variaciones Entre y Dentro de los Grupos
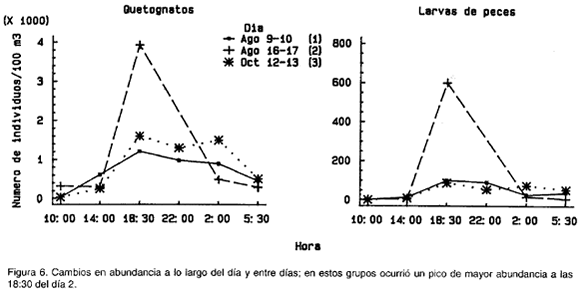
Sobre el segundo componente principal (Fig. 3c, 3f) se pudo evidenciar que sifonóforos, salpas, ostrácodos, cladóceros, apendicularios y medusas (Fig. 4) aumentaron significativamente sobre su promedio total en el día 1 con respecto a los otros dos días, especialmente a las 22:00 (a las 18:30 las medusas). La temperatura resultó negativamente correlacionada (r=-0.58, p=0.01, n=17, 15 g.l.), y los nitratos positivamente correlacionados (r=0.62, p=0.02, n=14, 12 g.l.) con las coordenadas de las muestras a lo largo del componente 2 (Tabla 2). Efectivamente, las temperaturas fueron en general más bajas y los nitratos ligeramente más altos en el día 1 que durante los otros dos días (Fig. 7). Esto podría indicar, que las diferencias arriba descritas se deben al paso por el sitio de muestreo de masas de agua con características fisicoquímicas y composición zooplanctónica diferente. Sobre el tercer componente se observó que (1) anfípodos, decápodos, huevos de peces, pterópods y copépodos (Fig. 5) tuvieron un fuerte pico de aumento sobre su promedio en el día 3 a las 18:30 con respecto a los otros días; (2) quetognatos y larvas de peces (Fig. 6) tuvieron su pico de aumento también a ls 18:30, pero durante el día 2, y (3) poliquetos (Fig. 5), aumentaron significativamente sobre el promedio tanto en el día 1 como en el día 3, pero a las 2:00. Ninguna variable resultó correlacionada con el tercer componente.
DISCUSIÓN
Los copépodos mostraron la mayor abundancia; estos representan en ocasiones para regiones tropicales más del 72% del total de los zooplanctontes (Longhurst, 1985). El segundo lugar en abundancia de las larvas de los decápodos se explica porque en sectores neríticos como el muestreado, se ven incrementados por el aporte al plancton de las larvas de los adultos del infra y supralitoral (Boschi, 1981). El hecho de que las salpas fueran el taxón menos numeroso de este estudio podría explicarse por la poca concentración de clorofila a, que aparentemente sus mayores abundancias están asociadas con los florecimientos de fitoplancton (Esnal, 1981a.; Paffenhofer y Lee, 1987).
Los cambios en abundancia del zooplancton entre el día y la noche pueden ser interpretados como una manifestación del efecto de la migración vertical. En muestreos verticales, entre 0-15,15-30 y 30-45 m con redes Hensen, realizados paralelamente durante parte de esta investigación, se evidenció igualmente un marcado aumento numérico de los organismos, en las tres escalas de profundidad siguiendo el mismo esquema superficial (Bernal, 1990). Buchanan y Hanney (1980), manifiestan que la migración vertical se presenta ante cambios bruscos de luz en las horas del atardecer, especialmente en las próximas a la caída del sol. Lo anterior coincide con el aumento considerable de organismos en superficie a las 18:30 en este estudio. Al final de la noche, el descenso gradual de las abundancias superficiales también coincide con los patrones conocidos de migración vertical (Buchanan y Hanney, 1980; Raymond, 1983).
Es conocido que no todos los organismos ascienden hasta la superficie y algunos no migran, como en cladóceros para el mediterráneo (Ramírez, 1981); en este estudio esto se evidenció en superficie con las mayores abundancias durante el día. La conocida carencia de migración vertical en apendicularios (Esnal, 1981b), también se reflejó en superficie de este estudio por la falta de un patrón claro de variación día-noche. De otra parte, en los huevos de los peces la ausencia de una tendencia numérica día-noche definida, es un reflejo de que no migran (Ciechonski, 1981).
La menor abundancia de Zooplancton el día 2 a las 2:00 y 5:30 horas, respecto a los otros dos días de estudio, podría ser explicada por el efecto que sobre la migración propicia la luna, retardando o inhibiendo la misma (Wicstead, 1979). Sin embargo, no se puede descartar que las diferencias se deban al tipo de malla empleado en estos horarios (Mac Gowan y Fraundorf, 1966).
Se conoce que la temperatura, la salinidad y el oxígeno, son algunos factores que influencian la migración especialmente en sectores neríticos (Alvariño, 1981 y 1985, Banse, 1964; Boltovskoy, 1981b; Buchanan y Hanney, 1980; Mathew et al., 1979; Ramírez y Zamponi, 1981). La relación nutrientes-zooplancton es compleja, estando los nutrientes, relacionados de manera directa o desfasada en el tiempo, con las abundancias del fitoplancton (Margalef, 1986; Odum, 1987), representado en la concentración de clorofila a (Calienes et al., 1985), pudiendo este alternar picos máximos con el zooplancton (Mathew et al., 1979), que a su vez puede reciclar los nutrientes (Parsons et al., 1984).
En este trabajo se encontraron variaciones en el comportamiento del zooplancton asociadas a cambios en los parámetros fisicoquímicos. Dicha asociación pudo deberse a: (1) se trataba de masas con características fisicoquímicas y composición zooplanctónica diferente por movimientos advectivos o convectivos (Banse, 1964) que se pueden presentar en el sector (Ramírez, 1983; Ramírez, 1990; Salwedel y Muller, 1983). (2) Cambios paralelos en las características del agua en la vertical y el comportamiento de la masa zooplanctónica migrante, o ambas. Como indicativo de lo primero (Pineda, 1991), utilizando también la técnica de componentes principales, encontró una relación estrecha independiente de la profundidad (y por tanto de la migración) entre la composición y la abundancia de especies de quetognatos y un gradiente de dilución oriente-occidente dé la descarga continental en el Pacífico oriental entre Panamá y Colombia. Sin embargo, la salinidad, un parámetro indicativo de masas de agua, no resultó correlacionada con las variaciones zooplanctónicas en este estudio.
Desafortunadamente, los muestreos exploratorios en la vertical realizados durante este estudio (Bernal, 1990), no fueron suficientes para determinar si la composición de la masa migrante estuvo relacionada con los cambios en la calidad del agua. Igualmente, los conocidos movimientos erráticos de masas de agua sobre el sitio de muestreo (Salzwedel y Müller, 1983), generan variaciones adicionales. Tampoco hay manera de saber si algunos de los cambios en la composición de la masa migrante son producto de las relaciones interespecíficas como pastoreo y depredación (Parsons et al, 1984; Mathew et al., 1979; Quasim, 1979).
Finalmente, es claro que la visión del efecto de la migración vertical en superficie es parcial, siendo ensombrecida su manifestación por múltiples factores. Los resultados aquí presentados señalan la importancia de no desestimar la varabilidad numérica que presenta el zooplancton en superficie a distintas horas del día durante la rutina de muestreo de un crucero oceanográfico.
AGRADECIMIENTOS
Agradecemos el apoyo institucional y financiero del Instituto Colombiano para la Ciencia y la Tecnología "Francisco José de Caldas" (COLCIENCIAS), del Programa de Ecosistemas Marinos Fase I Proyecto # CO2105-09-008-87 del Instituto de Investigaciones Marinas de Punta Betín "José Benito Vives de Andreis" (INVEMAR) y de la Universidad Nacional de Colombia. A los señores José Polo y Elkir Guillot, Capitán y marinero respectivamente dei B/I Tortuga II del INVEMAR, por su colaboración durante las faenas de muestreo. Al Doctor Juan Manuel Díaz por su interés para posibilitar la investigación. A la Doctora Ángeles Alvariño del Southwest Fisheries Center, NOAA, de La Jolla, California, así como a la Doctora Sulma Carrazco en el IMARPE, Callao, Perú, por sus sugerencias y bibliografía ofrecidas para este estudio. Al químico Gustavo Ramírez y al Ingeniero pesquero Alfredo Pérez, por su colaboración en los análisis fisicoquímicos. Este trabajo formó parte de la tesis de Biólogo presentado por A. R. Bernal V. y aprobada por la Universidad Nacional de Colombia.
BIBLIOGRAFÍA
1 Alvarado, F. 1978. Contribución al conocimiento de los copépodos epiplanctónicos de la bahía de Santa Marta, Colombia. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Bogotá, 82 p. [ Links ]
2 Alvariño, A. 1981. Shiphonophorae. En: Atlas del zooplancton del Atlántico Suroccidental y métodos de trabajo con el zooplancton marino. Ed. D. Boltovskoy. Publ. Esp. INIDEP, Mar del Plata, Argentina: 383-441. [ Links ]
3 Alvariño, A. 1985. Las surgencias en la región de California - Baja California. Relaciones con el zooplancton y poblaciones de Engraulis mordax (pisces). Inv. Mar. CICIMAR 2(1): 81-102. [ Links ]
4 Ángel M. 1981. Ostracoda. En: Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton marino. Ed. D. Boltovskoy. Publ. Espec. INIDEP, Mar del Plata, Argentina: 383-441. [ Links ]
5 Ángel M. 1986. Vertical migrations in the oceanic realm: possible causes and probable effects. En: Migration: Mechanisms and Adaptative Significance, Ed. M. A. Rankin. Contr. Mar. Sci. (suppl.) 24: 45-70. [ Links ]
6 Ángel M. y A. Baker 1982. Vertical distribution of the standing crop of plankton micronekton at three stations in the northeast Atlantic. Biol. Oceanogr., 2: 1-29. [ Links ]
7 Banse K. 1964. On the vertical distribution of zooplankton in the sea. En: Progress in Oceanography. Ed. M. Sears. Pergamon Press, New York. 2: 53-125. [ Links ]
8 Bernal A.R. 1990. Variaciones nictemerales del zooplancton y su relación con factores ambientales en la bahía de Santa Marta - Caribe colombiano -. Tesis Biol., Univ. Nacional, Bogotá, 62 p. [ Links ]
9 Boltovskoy, D. 1981a. Atlas del zooplancton del Atlántico sudoccidental y métodos del trabajo con el zooplancton marino. Publ. Espec. INIDEP. Mar del Plata, Argentina, 936 p. [ Links ]
10 Boltovskoy, D. 1981b. Chaetognatha. En: Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajos con el zooplancton marino. Ed. D. Boltovskoy. Publ. Espec. INIDEP, Mar del Plata, Argentina, 793-808. [ Links ]
11 Boschi, E. 1981. Larvas de Crustácea. En: Atlas del zooplancton del Atlántico suroccidental y métodos de trabajo con zooplancton marino. Ed. D. Boltovskoy. Publ. Espec. INIDEP, Mar del Plata, Argentina, 699-758. [ Links ]
12 Buchanan, C. y J. Hanney. 1980. Vertical migration of zooplankton in the Arctic: a test of the environmental controls. En: Evolution and ecology of zooplankton comunities. Ed. W. C. Kerfoot. Univ. Press. New England, Londres: 69-79. [ Links ]
13 Calienes, R., O. Guillen y N. Lostaunav. 1985. Variabilidad espacio temporal de clorofila, producción primaria y nutrientes frente a la costa peruana. Bol. Ins. Mar del Perú, 10(1): 1-44. [ Links ]
14 Campos, N. H. y J. Plata. 1990. Crustáceos epiplanctónicos de la región de Santa Marta, Caribe colombiano. Mem. VII Sem. Nal. Cienc. Tecnol. Mar., CCO, Bogotá, 255-264. [ Links ]
15 Castaño, J. 1990. Estudio de la composición y abundancia del zooplancton del complejo de ciénagas y caños de Pajaral, delta exterior del río Magdalena. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Bogotá, 185 p. [ Links ]
16 Castellvi, J. 1972. Ecología Marina. Edit. Dossat, Caracas. 711 p. [ Links ]
17 Ciechonsky, J. D. de 1981. Ictioplancton. En: Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton marino. Ed. D. Boltovskoy. Publ. Espec. INEDEP, Mar del Plata, Argentina, 829-860. [ Links ]
18 Digby, P. G. N. y R. A. Kempton. 1987. Multivariate analysis of ecological comunities. Chapman and Hall, Londres, 206 p. [ Links ]
19 Esnal, G. 1981a. Salpidae. En: Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton marino. Ed. D. Boltovskoy. Publ. Espec. INIDEP, Mar del Plata, Argentina, 793-808. [ Links ]
20 Esnal, G. 1981b. Apendicularia. En: Atlas del zooplancton del Atlántico suroccidental y métodos de trabajo con el zooplancton marino. Ed. D. Boltovskoy. Publ. Espec. INEDEP, Mar del Plata, Argentina, 809-827. [ Links ]
21 Grasshoff, K. 1976. Methods of seawater analysis. Verlang Chemi, Nueva York, 317 p. [ Links ]
22 Longhurst, A. R. 1985. The structure and evolution of plankton comunities. Prog. Oceanogr., 15: 1-35. [ Links ]
23 López, R. (1990). Relaciones ictioplancton-zooplancton en la región de Santa Marta, Caribe colombiano. En: Estudio ecológico integrado de la zona costera de Santa Marta y el Parque Nacional Natural Tayrona. Ed. J.M. Díaz. Inf. Prog., INVEMAR, Santa Marta: 164-229. [ Links ]
24 Lozano, F. 1986. Determinación de biomasa y su variación espacio-temporal de la comunidad zooplanctónica nerítica de la Bahía de Santa Marta, Caribe colombiano y contribución a la situación del zooplancton en las instituciones socioeducativas colombianas. Tesis Biol., Univ. Javeriana, Bogotá, 81 p. [ Links ]
25 MacGowan, J y V. Fraundorf. 1986. The relationship between size of net used an estimates of zooplankton diversity. Limnol. Oceanogr., 11(4): 456-469. [ Links ]
26 Margalef, R. 1986. Ecología, 5a. Edic. Omega, Barcelona, 951 p. [ Links ]
27 Mathew, K. J. Gopinathan; A. Rao; A. Regunathan y A. Murty. 1979. Diurnal variations in the distribution of Zooplankton in relation to currents and other ecological parameters of the Mud Bank of Allepe and Kerala. En: Proc. Symp. Warm water Zoopl., UNESCO, India; 251-263. [ Links ]
28 Meyers, D. 1980. Diurnal vertical migration in aquatic microcrustacea: light and oxygen responses of littoral Zooplankton. En: Evolution and ecology of Zooplankton communities. Ed. W. C. Kerfoot. Univ. Press New England, Londres; 80-90. [ Links ]
29 Mulford, A. 1985. Distribución de Chaetognatha en el Archipiélago de San Andrés y providencia y su relación con algunos parámetros físico-químicos. Tesis Biol. Mar. Univ. Jorge Tadeo Lozano, Bogotá, 96 p. [ Links ]
30 Odum, E. 1987. Ecología, 3a. Edic. Nueva Edit. Interamericana, México, 639 p. [ Links ]
31 Paffenhofer, G. A. y T. N. Lee. 1987. Development and persistence of patches of thaliacea. The Benguela and Comparable Ecosystems. Eds. Payne, A., Gulland, J. A. y K. H. Link. S. Afr. Mar. Set. 5: 305-318. [ Links ]
32 Parsons, T.; M. Takahashi y B. Hargrave. 1984. Biological oceanographic processes. 3a. ed. Pergamnon Press, Oxford, 330 p. [ Links ]
33 Pineda, F. 1991. A principal component analisys of the Chaetognaths found during the Acento 2 cruise in the Bight of Panama. Rev. Ciencias, 4: 31-47. [ Links ]
34 Quasim, S. 1979. Contribution of Zooplankton in the food chains of some warm water environments. En: Proc. Symp. Warm Water Zooplankton, UNESCO, India: 700-708. [ Links ]
35 Ramírez, F. 1981. Cladocera. En: Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton marino. Ed. D. Boltovskoy. Publ. Espec. INIDEP, Mar del Plata, Argentina: 533-542. [ Links ]
36 Ramírez, F. y M. Zamponi. 1981. Hydromedusae. En: Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton marino. Ed. D. Boltovskoy. Publ. Espec. INIDEP, Mar del Plata, Argentina: 443-469. [ Links ]
37 Ramírez, G. 1983. Características físico-químicas de la Bahía de Santa Marta (agosto 1980-Julio 1981). An. Inst. Inv. Mar. Punta Betín. 13: 11-121. [ Links ]
38 Ramírez. G. 1990 Variación de parámetros hidrográficos y su relación con el proceso de surgencia en la Bahía de Santa Marta. En: Estudio ecológico integrado de la zona costera de Santa Marta y el Parque Nacional Natural Tayrona. Ed. J. M. Díaz. Inf. Prog., INVEMAR, Santa Marta; 19-78. [ Links ]
39 Raymond, J. 1983. Plankton and productivity in the Oceans. 2 ed. Volume 2. Zooplankton. Pergamon Press. 824 p. [ Links ]
40 Ringeiberg, J. 1980. Causal and teleological aspects of diurnal vertical migration. En: Evolution and ecology of Zooplankton communities. Ed. W. C. Kerfoot. Univ. Press New England, Londres; 69-79. [ Links ]
41 Salzwedel, H. y K Müller. 1983. A summary of meteorological data for the Bay of Santa Marta, Colombian Caribbean. An. Inst. Inv. Mar. Punta Betin 13: 67-83. [ Links ]
42 Siegel, S. y N. J. Castellan, Jr. 1988. Nonparametric statistics for the behavioral sciences, 2a. ed. McGraw Hill Book Company, New York, 399 p. [ Links ]
43 Smith, P. y R. Richardson. 1979. Técnicas modelo para prospecciones de huevos y larvas de peces pelágicos. FAO. Doc. Técn. Pesca. 175: 107 p. [ Links ]
44 Strickland. D. y Parsons, A. 1972. Practical handbook of seawater analysis, 2a. ed. Fish Res. Bd. Canadá, Ottawa, 510 p. [ Links ]
45 Wicstead, J. 1979. Zooplancton marino. Edic. Omega. Barcelona, 70 p. [ Links ]