Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.23 no.1 Santa Marta Jan./Dec. 1994
CORALES, FORMACIONES ARRECIFALES Y BLANQUEAMIENTO DE 1987 EN BAHÍA PORTETE (GUAJIRA, COLOMBIA)
Oscar David Solano P.
Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andreis, Apartado aéreo 1016, Santa Marta, Colombia.
RESUMEN
Para el reconocimiento y caracterización de las formaciones arrecifales de Bahía Portete se visitaron un total de 22 estaciones entre junio de 1987 y enero de 1988. Se registraron por primera vez Acropora cervicornis, Agaricia agaricites, Montastrea cavernosa, Diploria clivosa e Isophyllia sinuosa, elevando a 18 el número de especies de escleractinios de la bahía. El componente principal por su abundancia y diversidad de formas fue el hidrocoral Millepora alcicornis. Las formaciones arrecifales del área se concentran sobre los costados oeste y suroeste, sin llegar a constituirse en verdaderos arrecifes. Estructuralmente se discriminan dos tipos de formaciones: tipo 1 parches arrecifales y tipo 2 praderas de fanerógamas con colonias dispersas de M. alcicornis. Sobre este último tipo de formaciones los valores de densidad fluctuaron entre 6.6 y 35.5 colonias/m2. Adicionalmente se registró en octubre-noviembre de 1987 un extenso fenómeno de blanqueamiento que afectó principalmente a. M. alcicornis, Porites astreoides y P. porites. Por lo menos seis especies de escleractinios y un hidrocoral mostraron blanqueamiento. En formaciones del tipo 2 un 25.9 % de las colonias resultó afectado.. La causa del blanqueamiento no pudo ser determinada con exactitud, pero se cree que el incremento de la temperatura del agua en octubre, unido a las condiciones típicamente turbias de la zona, provocaron la pérdida masiva de zooxantelas simbiontes. Eventos similares fueron registrados en ese año para la mayor parte del mar Caribe.
ABSTRACT
In order to describe and characterize reef formation in Bahia Portete, a survey was conducted between June 1987 and January 1988 in wich a total of 22 stations were visited. Acropora cervicornis, Agaricia agaricites, Montastrea cavernosa, Diploria clivosa and Isophyllia sinuosa, were recorded for the first time amounting to 18 the number of scleractinian species for the bay. The principal component of the coral formations was the hydrocoral Millepora alcicornis due to its abundance and morphological diversity. Reef formations in the area are concentrated on the west and southwest side, not massive enough, however, to be considered real framework reefs. Structuraly two kinds of formations were discriminated: type 1, reef patches, and type 2, seagrass beds with dispersed colonies. Density of colonies was estimated for this latler type, ranging between 6.6 and 35.5 colonies/m2. Additionally, an extensive bleaching phenomenon was observed in October-November 1987, that affected mainly Millepora alcicomis, Porites astreoides and Porites porites. At least six scleractinean species and one hydrocoral showed bleaching. In type 2 formations 25.9 % of colonies was affected. Exact causes for bleaching could not be determined but it is believed that high temperatures in those months together with normal turbid conditions in the area resulted in massive loss of simbionts zooxanthellae. Similar events were registred for most part of the Caribean sea in 1987.
INTRODUCCIÓN
La mayoría de los trabajos descriptivos o cuantitativos de formaciones arrecifales del Caribe colombiano se centran en las principales y más espectaculares áreas de desarrollo tales como Islas del Rosario, Islas de San Bernardo, Parque Nacional Natural Tayrona y San Andrés y Providencia (Prahl y Erhardt, 1985; y Alvarado, 1992). Ha habido pocos o ningún estudio en áreas menos desarrolladas y distantes, como las formaciones del Golfo de Urabá, los bajos e islas de mar abierto tanto continentales como oceánicas, y las formaciones de la península de la Guajira Estás zonas representan en muchos casos, escenarios de gran interés tanto desde el punto de vista biogeográfico como ecológico, al presentar comunidades sometidas a condiciones "subóptimas" como son alta sedimentación, bajas salinidades, altas temperaturas, etc., o bien porque su lejanía de centros urbanos las ha mantenido en mejor estado de conservación.
El presente trabajo presenta una caracterización preliminar de las formaciones arrecifales de Bahía Portete, en la península de la Guajira, hasta ahora solo mencionadas brevemente por Prahl y Erhardt (1985), y estudiadas con algún detalle en informes no publicados (INTEGRAL, 1982; Ecology and Environment, 1983, INVEMAR, 1992). Además se describe un evento de blanqueamiento coralino ocurrido afínales de 1987.
ÁREA DE ESTUDIO
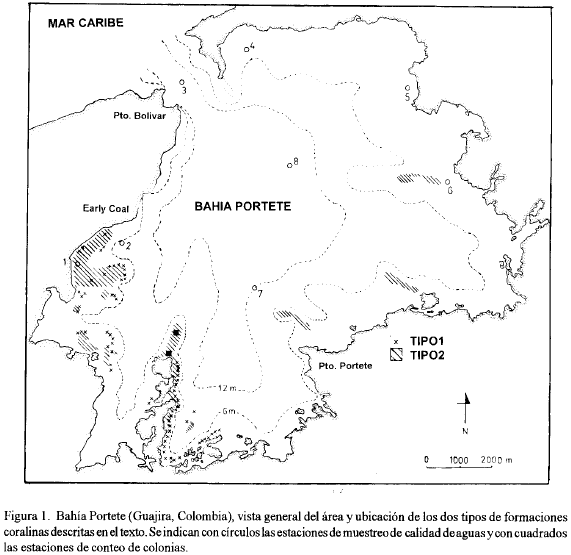
Bahía Portete (figura 1) se encuentra localizada en el Departamento de la Guajira entre el Cabo de la Vela y Punta Gallinas (12° 07' N y 72° 02' W). Cubre una superficie aproximada de 125 km2. Está comunicada con el Mar Caribe mediante una sola boca que abre hacia el norte con un un ancho aproximado de 2 Km. La bahía es muy somera, con una profundidad máxima de 20 m y una extensa zona (al rededor del 60 % del área total) que no excede los 9 m de profundidad (Garzón-Ferreira, 1989).
El fondo está constituido principalmente por sedimentos finos de tipo arcilloso. El litoral está bordeado por manglares en los que dominan Rhizophora mangle Linnaeus y Avicenia germinas (Linnaeus) Stearn, mientras que en la mayor parte del sublitoral costero se desarrollan extensas praderas de fanerógamas marinas, principalmente de Thalassia testudinum (Koenig) Banks y Syringodium filiforme Kuetzing, que se extienden hasta unos 6m de profundidad (Garzón-Ferreira, 1989; Díaz, 1990). Las formaciones coralinas se concentran sobre los costados occidental y sur de la bahía, desarrollándose desde el nivel medio de marea hasta unos 4 m de profundidad.
En líneas generales Bahía Portete muestra condiciones marinas con salinidades elevadas (34 a 37 °/oo), restringiéndose la influencia continental a la escorrentía durante la época de lluvias (mayo a noviembre). Las temperaturas son generalmente altas, muy seguramente como resultado de la alta irradiación y de lo somero de la bahía. La influencia de la surgencia es visible en las costas de la península de la Guajira durante el verano (diciembre a abril), con aguas de temperatura baja (25.5 ° C) y salinidad alta (>36.6 %o) (Fajardo, 1979; Cabrera y Donoso, 1993).
Información más detallada sobre las comunidades marinas del área puede consultarse en los informes de INTEGRAL (1982) e INVEMAR (1988 y 1992).
METODOLOGÍA
La caracterización de los parámetros de calidad de aguas en 8 estaciones (figura 1), se efectuó mensualmente entre junio de 1987 y enero de 1988, en superficie, media agua y fondo, mediante el uso de una botella van Dorn. La profundidad se midió mediante un cable metrado con sondaleza, la transparencia con disco Sechii, la temperatura con termómetro de mercurio, el oxígeno disuelto mediante una sonda YSI y la salinidad con un conductímetro digital marca WTW modelo LF91.
Debido a lo somero de las formaciones coralinas, los reconocimientos y muestreos se efectuaron con buceo a pulmón libre. Se realizaron observaciones en toda la periferia de la bahía (22 estaciones). En cada una se inventariaron las especies presentes, se estimaron los tamaños de las colonias y se hicieron observaciones sobre el estado general de los corales y sus patrones de zonación. La mayoría de estos sitios fueron visitados al menos en tres oportunidades.
La identificación de los corales pétreos se hizo in situ para evitar la extracción innecesaria de ejemplares, sólo algunos pocos fueron colectados, catalogados e incluidos en la colección de referencia del INVEMAR.
Los conteos de las colonias sobre praderas de Thalassia testudinum se efectuaron en una extensa lengua de fanerógamas marinas situada al sur de la bahía (figura 1). Se evaluaron 10 transectos de banda de 10 m2, que fueron ubicados azarosamente en la zona de interés. En cada uno se identificaron y contaron todas las colonias presentes.
Para describir el evento de blanqueamiento, se visitaron al rededor de 10 estaciones tratando de cubrir toda la bahía, incluyendo los dos tipos de formaciones arrecifales existentes. Se estimaron subjetivamente el porcentaje de colonias afectadas y el porcentaje de superficie blanqueado por colonia. Solo se efectuaron recuentos de colonias en una estación (formación del tipo 2, cuadrado inferior en la figura 1), en donde se ubicaron azarosamente cinco transectos en banda de 10 m2 cada uno. Se identificaron y contaron todas las colonias, discriminando normales y afectadas.
RESULTADOS
Calidad de aguas
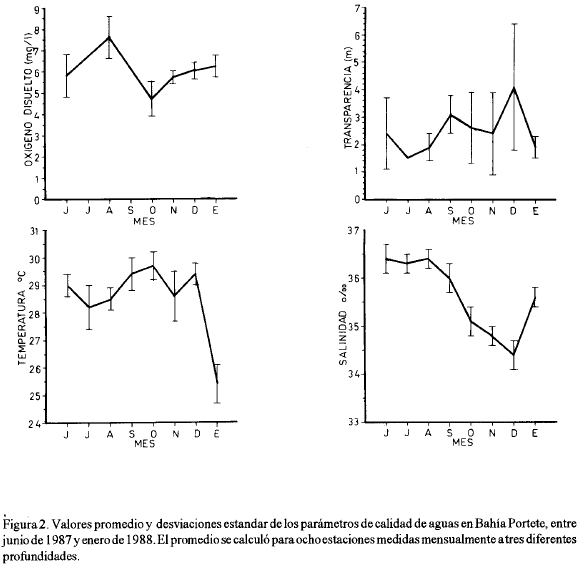
Los valores de temperatura, salinidad y oxígeno disuelto no mostraron variaciones importantes entre niveles (superficie, media agua y fondo), lo que indica que la columna de agua es homogénea. Por tal motivo, para cada estación, se promediaron estos valores.
La temperatura del agua se incrementa paulatinamente durante el período de lluvias, alcanzando el máximo en el mes de octubre (figura 2); el descenso de julio corresponde al llamado veranillo de San Juan. La temperatura más baja en enero coincide con el inicio de la estación seca, caracterizada por la presencia de fuertes vientos Alisios y surgencia de aguas profundas (Fajardo, 1979; Cabrera y Donoso, 1993). La salinidad alcanzó su máximo entre junio y agosto de 1987, durante el veranillo, y el mínimo en diciembre coincidiendo con la finalización de la temporada lluviosa (figura 2). El oxígeno disuelto generalmente tuvo un comportamiento inverso al de la temperatura, mostrando valores bajos en octubre (4.7 mg/l) y altos en agosto (7.6 mg/l). La transparencia fue baja durante todo el período muestreado, presentando como valores extremos 1.5 m en julio y 4.5 m en diciembre (figura 2), sus fluctuaciones están al parecer relacionadas con la intensidad de los vientos locales.
Especies presentes
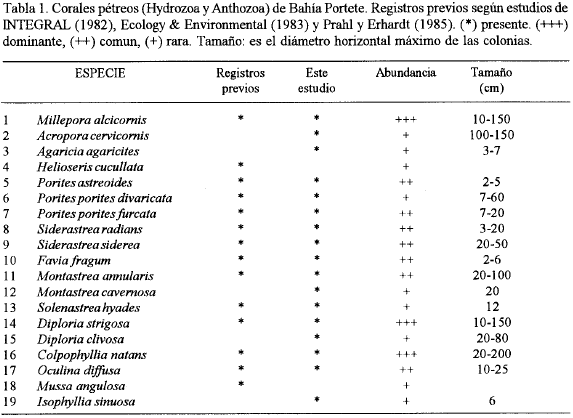
En la tabla 1 se listan las especies de corales registradas hasta ahora en las investigaciones hechas por diferentes entidades y autores. La lista de especies de Prahl y Erhard (1985), se tomó directamente del texto que describe las formaciones y no de la tabla final (paginas 292 a 294), ya que ésta presenta múltiples errores tipográficos en el registro de especies. Con el presente trabajo se eleva el número de especies de corales pétreos de 14 a 19, citándose por primera vez Acropora cervicornis, Agaricia agaricites, Montastrea cavernosa, Diploria clivosa e Isophyllia sinuosa.
Tipos de formaciones y zonación
Si bien en Bahía Portete se encuentran corales hermatípicos principalmente en los costados oeste y sur, y en menor proporción al este, las formaciones existentes están poco desarrolladas y no pueden catalogarse como arrecifes coralinos. En el mejor de los casos, estos llegan a constituir parches arrecifales, generalmente creciendo desde el nivel medio del mar hasta una profundidad máxima de 4 m.
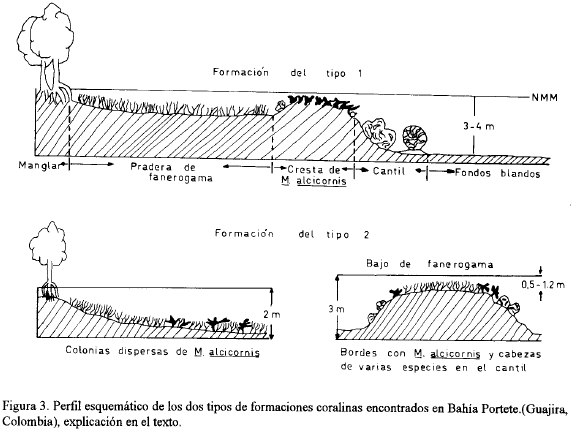
Se detectaron dos tipos de formaciones coralinas, esquematizadas en la figura 3:
-Tipo 1: Parches arrecifales. Representados principalmente al sur de la bahía A la franja de manglar sigue una pradera de fanerógamas marinas conformada por Thalassia testudinum, en ocasiones acompañada por Syringodium filiforme, con un ancho de 20 a 60 m y una profundidad máxima de 3 m. A este cinturón sigue una franja coralina no continua, semejante a una cresta, dominanda por Millepora alcicornis, que crece formando armazones más o menos densos. En esta misma zona pueden presentarse como especies acompañantes Porites astreoides, Porites porites en sus dos formas y Favia fragum; con menor frecuencia aparecen Oculina diffusa, Siderastrea radians y S. siderea. La profundidad varía en esta zona entre de profundidad, siendo característica la presencia de grandes cabezas de Diploria strigosa y Colpophyllia natans. Otras especies que generalmente se encuentran en la parte alta del cantil son Montastrea annularis, A. agaricites, F. fragum y S. radians. Al terminar el cantil se inician los fondos blandos de arena fina o fango. En algunos casos, como ocurre en los alrededores de la estación 17, existe después del cantil un canal arenoso con Thalassia testudinum (profundidad de 3 a 4 m, ancho entre 80 y 100 m), al que sigue una franja de cabezas coralinas muertas, colonizadas por gran variedad de macroalgas, dominando Caulerpa racemosa.
-Tipo 2: Praderas de fanerógamas con corales dispersos. La especie dominante es Millepora alcicornis, cuyo tamaño y densidad es ampliamente variable. Las colonias crecen libres, sin adherirse al fondo, con ramificaciones en todas direcciones En ocasiones aparecen como acompañantes otras especies como Porites astreoides, P. porites forma divaricata y forma furcata y con menor frecuencia D. strigosa. Dentro de este tipo se incluyen los bajos de fanerógamas que presentan en sus bordes cabezas dispersas de Diploria strigosa, Colpophyllia natans y M. alcicornis.
En la figura 1 se indica la ubicación de los dos tipos de formaciones coralinas dentro de la bahía.
Tamaño y densidad de las colonias
En la tabla 1 se presentan los intervalos de tamaño aproximado para los corales presentes en la bahía, expresados como diámetro horizontal máximo de las colonias. Entre las especies de mayor talla están las dominantes Diploria strigosa y Colpophyllia natans.
Los conteos de colonias sobre praderas de fanerógamas marinas dieron, promedios por transecto entre 6.6 ± 5.4 y 35.5 ± 7.9 colonias/m2. Los valores de desviación estándar en varios transectos, fueron altos con respecto a los promedios, indicando que las colonias presentan una distribución agregada. Estos muestreos se llevaron a cabo en un área en donde la densidad se considera intermedia (estaciones 20 y 22). En sitios con alta densidad los conteos son difíciles de realizar, dada la proximidad de las colonias y las dificultades que su crecimiento ramificado ocasiona para la discriminación de las mismas. Un ensayo hecho en el mes de septiembre mostró que los valores de densidad en estos casos pueden alcanzar promedios de 53 colonias/m2.
Los anteriores resultados fueron encontrados en formaciones de tipo 2; para las de tipo 1, esta clase de muestreo no es adecuado, ya que en la zona de los cantiles se encuentran colonias relativamente grandes (0.5 a 1.5 m) y la topografía del terreno dificulta el uso de cuadrantes.
Blanqueamiento coralino
En el mes de noviembre de 1987 se detectó un extenso fenómeno de blanqueamiento en las formaciones coralinas de la bahía. Los corales presentan dentro de sus tejidos algas simbiontes, llamadas zooxantelas, que ayudan a cubrir los requerimientos energéticos del animal y favorecen su proceso de calcificación (Goreau et al., 1979). Distintas causas, como por ejemplo altas temperaturas, sedimentación, contaminantes químicos, etc., producen la expulsión de estas algas, originando el llamado fenómeno de blanqueamiento o pérdida de coloración de las colonias, las que después de algunas semanas pueden morir (Gladfelter, 1988).
El fenómeno se extendió a lo largo de la bahía afectando por los menos a 7 especies (tabla 2). El blanqueamiento total de la colonia se observó en 3 de ellas, siendo especialmente evidente en Millepora alcicornis.
El blanqueamiento parcial (manchas blancas cubriendo áreas particulares de la colonia), fue el más común, presentándose en 4 especies, pero cubriendo zonas más extensas de la colonia en Diploria clivosa y Porites porites. Finalmente, la decoloración, que puede considerarse como el grado de blanqueamiento más leve, fue observado en dos especies, generalmente cubría toda la superficie del coral.
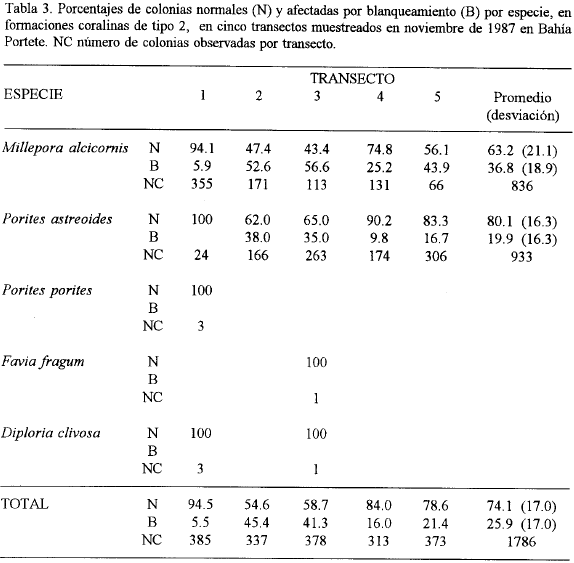
En la tabla 3 se resumen los recuentos de colonias normales y afectadas para el mes de noviembre de 1987, realizado en formaciones de tipo 2. Un 36.8 % de las colonias de M. alcicornis y un 19.8 % de P. astreoides mostraron blanqueamiento parcial o total: además, algunos ejemplares ya estaban muertos y sus esqueletos colonizados por algas filamentosas. Según estos datos el porcentaje de colonias afectadas fue de aproximadamente el 26%. Nótese sin embargo la gran variabilidad de resultados entre transectos.
Durante la última visita a la zona, en enero de 1988, entre el 80 y el 90 % de la población de M. alcicornis afectada había muerto. Las restantes especies mostraban síntomas de recuperación y al parecer sus porcentajes de mortalidad fueron comparativamente más bajos. La causa del blanqueamiento no pudo ser establecida, aunque pudo estar relacionada con el incremento de la temperatura del agua en el mes de octubre de 1987 (promedio en el fondo de la columna de agua de 29.7°C), que junto con las condiciones típicamente turbias de la bahía, pudieron estresar al coral hasta producir en forma directa o indirecta la pérdida de sus algas simbiontes.
DISCUSIÓN
Desarrollo arrecifal
El desarrollo limitado de estas formaciones está relacionado con condiciones desfavorables, como la poca área de sustratos duros, indispensables para la fijación de larvas (Schuhmacher, 1978) y la baja transparencia, que limita la penetración de la luz, necesaria para la fotosíntesis de las zooxantelas simbiontes del coral (Loya, 1976). Esta baja transparencia resulta de la resuspensión de sedimentos por acción de los vientos locales. Así, dominan especies resistentes a dicha condición, como Colpophyllia natans, y están poco representadas o ausentes, especies importantes en la construcción arrecifal, como Acropora palmata y A. cervicornis (Hubbard y Pocock, 1972).
El mayor número de especies encontrado se debe posiblemente a que en este estudio la intensidad del muestreo fue mayor que en los anteriores, y a factores aleatorios, ya que por ejemplo de A. cervicornis, M. cavernosa e I. sinuosa sólo fueron localizados dos o tres ejemplares. Por su parte D. clivosa, solo se encontró hacia el costado occidental de la bahía. A. agaricites parece ser muy abundante en la franja sur, en donde generalmente crece sobre sustratos verticales y zonas sombreadas, presentando tamaños de entre 2 y 6 cm de diámetro.
No se encontraron en los muestreos colonias de Mussa angulosa, que había sido registrada por INTEGRAL (1982), a partir de algunos esqueletos, al parecer de colonias muertas recientemente. Por esto se asume, que esta especie es poco común, o que desapareció desde aquel entonces.
De Helioseris cucullata tampoco se encontró ningún ejemplar; es factible que sea poco abundante. Existe también la posibilidad de que la identificación haya sido errónea y que los ejemplares encontrados por INTEGRAL (1982) fueran en realidad pertenecientes a la especie A. agaricites, de características esqueléticas semejantes.
Millepora
De las seis especies de Millepora descritas para el Atlántico, M. alcicornis es la más ampliamente distribuida tanto geográfica (32°N a 25°S), como batimétricamente (O a 50 m) (Weerdt, 1984; Lewis, 1989). Sin embargo, en la mayoría de los arrecifes su cobertura absoluta es baja, no superando el 1 % (Goodwing et al, 1976; Dodge et al, 1982; Rützler y Macintyre, 1982): en zonas someras de arrecifes colombianos presenta coberturas relativas menores al 3 % (Ramírez, 1986). Llama por tanto la atención la gran cobertura alcanzada por esta especie en Bahía Portete, en la cual se considera la especie dominante en los dos tipos de formaciones arrecifales anteriormente descritos. Una comunidad similar fue registrada para la bahía de Mochima en Venezuela (Pauls 1982 en: Wells, 1988), en donde M. alcicornis alcanza porcentajes de cobertura del 76 al 90 %. Allí es codominante P. porites, hay también un bajo número de especies (16) y las aguas son turbias durante la estación de lluvias. Es posible por lo tanto que bajo condiciones ecológicas similares a las anteriores, M. alcicornis alcance porcentajes inusualmente altos de cobertura Según INVEMAR (1992), las coberturas de coral vivo en cuatro áreas arrecifales por ellos escogidas para monitoreos a largo plazo fluctuaron entre 25.5 % y 34.8 %, con una cobertura relativa de M. alcicornis entre el 28 y el 86 %, valores muy superiores a los arriba mencionados. Tal vez su éxito se deba a sus características de especie reofílica (Weerdt,1981), dominando las colonias no adheridas, delicadamente ramificadas en formaciones de tipo 1, y colonias robustas, de ramas gruesas y firmemente adheridas al sustrato en las formaciones de tipo 2. La ausencia de sustratos duros para la fijación de larvas de escleractinios y su menor resistencia a condiciones turbias, pudieron igualmente llevar paulatinamente a M. alcicornis a dominar en estos ambientes.
También es de extrañar la ausencia de otras especies del género Millepora, las que en teoría están mejor adaptadas a ambientes altamente dinámicos y turbios (Weerdt,1981); es posible que esto se deba al relativo aislamiento de la bahía respecto de zonas arrecifales bien desarrolladas, ya que especies como M. complanata, a diferencia de M. alcicornis, presentan estadios larvales planctónicos de vida corta (Weerdt, 1981).
Blanqueamiento
El evento de blanqueamiento aquí descrito hace parte de uno de los cuatro complejos de blanqueamiento de carácter mundial ocurridos recientemente (Williams y Bunckley-Williams, 1990; Glynn, 1991). Este fue especialmente severo en el Caribe, pero afectó otras cinco regiones arrecifales del globo (Goreau y Hayes, 1994). Para el Atlántico occidental el blanqueamiento fue registrado en múltiples localidades, desde Bermudas y cayos de la Florida, pasando por las Antillas, hasta el Caribe sur (Ogden y Wicklund, 1988; Williams y Bunckley-Williams, 1990).
En Colombia fue registrado inicialmente durante el mes de junio de 1987 en los archipiélagos de San Bernardo e Islas del Rosario (Lang, 1987 y 1988; Gómez y Sánchez, 1987; Bohórquez, 1988); posteriormente fue observado en octubre del mismo año en el área de Santa Marta (Zea y Duque, 1989) y en el mismo mes o en noviembre ocurrió en Bahía Portete.
Una amplia discusión de las posibles causas de este blanqueamiento coralino fue presentada por Williams y Bunckley-Williams (1990), quienes a partir de encuestas enviadas a diversos centros de investigación recolectaron un total de 271 reportes de blanqueamiento provenientes de 48 países. Múltiples causas fueron atribuidas al fenómeno dependiendo de la localidad geográfica, pero una de las más comúnmente mencionadas fue el incremento inusual de la temperatura en muchas zonas arrecifales. Aunque hasta hoy la controversia persiste, se sigue incrementando la evidencia tendiente a relacionar los eventos de blanqueamiento de los años ochentas con las aumentos de la temperatura oceánica (Glynn, 1991). Al parecer existe una buena correlación entre la aparición de los llamados "puntos calientes", sitios con anomalías positivas de 1°C o más en el promedio mensual de temperatura superficial oceánica, y la posterior aparición del blanqueamiento (Goreau y Hayes, 1994). Tales anomalías y sus posibles efectos son en la actualidad objeto de estudio de comités internacionales de monitoreo ambiental (UNEP/AIMS, 1993).
En Colombia, el blanqueamiento coralino de 1987 fue atribuido en las islas del Rosario al efecto combinado de la sedimentación y el calentamiento (Lang, 1987 y 1988; Gómez y Sánchez, 1987; Bohórquez, 1988), en Santa Marta a descargas de aguas turbias y temperaturas altas (Zea y Duque, 1989) y en Bahía Portete sería atribuible a temperaturas altas (valores superiores a 29.5°C), sumadas a la baja transparencia que normalmente se presenta en la bahía. Al menos en una de estas tres regiones, durante 1990, se presentaron nuevamente eventos de blanqueamiento atribuibles a altas temperaturas (Solano et al, 1993).
Una de las especies más ampliamente afectadas por el blanqueamiento en Bahía Portete fue M. alcicornis. En otras localidades del Atlántico occidental como Bermudas (Williams y Bunckley-Williams, 1990) y Venezuela (Losada, 1988), también se vio seriamente afectada (50 a 60% de su población). En Bahía Portete, para enero de 1988, no se observaban síntomas de recuperación en esta especie y por el contrario un gran porcentaje de las colonias afectadas había muerto. Los datos posteriormente colectados por INVEMAR (1992), registraban porcentajes de cobertura promedio de coral muerto de entre el 13 y 27.9 %, con grandes parches de M. alcicornis muerta, como resultado muy seguramente del blanqueamiento de 1987. Es posible que en otras áreas la situación no fuese tan extrema como en la Guajira; así Zea y Duque (1989), siguieron el proceso de recuperación en varias colonias en la región de Santa Marta, entre ellas una de M. alcicornis, la cual inició su recuperación entre 20 y 35 días después de observarse por primera vez, y la completó entre 76 y 111 días después.
La escasez de reportes cuantitativos de blanqueamiento y la ausencia casi total de programas de monitoreo de salud arrecifal en el Caribe colombiano, hacen difícil el establecimiento de las causas y efectos reales de este tipo de eventos en nuestros arrecifes. La importancia de crear programas interinstitucionales en tal sentido, más que una necesidad, debe ser considerada como una obligación si se consideran los impactos que tal deterioro posee sobre el contexto socieconómico de las comunidades costeras.
AGRADECIMIENTOS
El presente trabajo fue realizado dentro del estudio "Diagnóstico actual de las comunidades marinas de Bahía Portete, análisis de efectos reales por la construcción y operación de las instalaciones portuarias", que el INVEMAR realizó para la firma INTERCOR. Esta última autorizó la publicación de la información obtenida y a través de la bióloga Pilar Vásquez facilitó el desarrollo de la presente investigación. En las faenas de campo fue de invaluable valor la colaboración de los biólogos Ricardo Dueñas, Juan M. Díaz, Jaime Garzón y del auxiliar de campo José González. A la bióloga Ángela Guzmán por la elaboración de los mapas y la lectura crítica del manuscrito.
BIBLIOGRAFÍA
1 Alvarado, E. (ed.). 1992. Taller de arrecifes coralinos. Investigación y Manejo. Bol. Ecotropica, supl. 1: 1-85. [ Links ]
2 Bohórquez, C.A. 1988. Coral bleaching in the central Colombian Caribbean. Proc. Assoc. Is. Mar. Lab. Carib. 21:52. [ Links ]
3 Cabrera, E. y M.C Donoso. 1993. Estudio de las características oceanógraficas del Caribe colombiano, Region III zona I PDCTM. Boletín Científico CIOH, 13:19-32. [ Links ]
4 Díaz, J.M. 1990 Malacofauna fósil y reciente de la Bahía Portete, Caribe colombiano, con notas sobre algunos fósiles del Terciario. Boletín Ecotropica, 23:1-22. [ Links ]
5 Dodge, R.E., A. Logan y A. Antonius. 1982. Quantitative reef assement studies in Bermuda: a comparison of methods and preliminary results. Bull. Mar. Sci., 32(3)745-760. [ Links ]
6 Ecology and Environment, Inc. 1983. Environmental reconnaissance study of the Cerrejón Coal Project in Bahía Portete, Colombia, South America. Task 1-4. [ Links ]
7 Fajardo, G.E. 1979. Surgencia costera en las proximidades de la península colombiana de la Guajira. Boletín Científico CIOH, 2:7-19. [ Links ]
8 Garzón-Ferreira, J. 1989. Contribución al conocimiento de la ictiofauna de Bahía Portete, departamento de la Guajira, Colombia. TRIANEA (Act. Cient. Técn. INDERENA), 3:149-172. [ Links ]
9 Gladfelter, E.H. 1988. The physiological basis of coral bleaching. Pags. 15-18. In: Ogden, J.O. and R. Wicklund (eds). Mass bleaching of coral reefs in the Caribbean: a research strategy. Nat. Undersea Res. Progr., Res. Rep. 88-2: 51 p. [ Links ]
9 Glynn, P.W., 1991. Coral reef bleaching in the 1980s and possible connections with global Warming. TREE, 6(6):175-178. [ Links ]
10 Gómez, R.C y L. F. Sánchez. 1987. El fenómeno del blanqueamiento en el parque zona atlántica corales del Rosario su identificación y explicación. Informe INDERENA. Cartagena, 25p. [ Links ]
11 Goodwing, M.H., M.J.C. Cole, W.E. Stewart y B.L. Zimmerman. 1976. Species density and associations in Caribbean reef corals. J. Exp. Mar. Biol. Ecol., 24:19-31. [ Links ]
12 Goreau, T.F., N.I. Goreau y T.J. Goreau. 1979. Corals and coral reefs. Scientific American, August: 124-136. [ Links ]
13 Goreau. T.J. y R.L Hayes. 1994. Coral bleaching and Ocean "Hot Spots". Ambio 23(3):176-180. [ Links ]
14 Hubbard, J.A.B.B. and V.P. Pocock. 1972. Sediment rejection by recent scleractinian corals, a key to paleo-environmental reconstruction. Geol. Rundsch, 61:598-626. [ Links ]
15 INTEGRAL. 1982. Proyecto carbonífero de El Cerrejón. Estudio de Impacto Ambiental. Vols. 1-4. Intercor Barranquilla. Informe Técnico. [ Links ]
16 INVEMAR 1988. Diagnóstico actual de las comunidades marinas de la Bahía Portete, análisis de efectos reales por la construcción y operación de las instalaciones portuarias. Informe Proy. INVEMAR, Santa Marta, 153 p. [ Links ]
17 INVEMAR 1992. Descripción inicial de unidades de monitoreo de ecosistemas marinos en la Bahía Portete. Determinación del área de influencia de Puerto Bolívar afuera de la Bahía Portete. Informe Proy. INVEMAR, Santa Marta. 67 p. [ Links ]
18 Lang, J.C. 1987. The 1987 bleaching event at Islas del Rosario. Informe INDERENA y Universidad de Texas, Austin, 23 p. [ Links ]
19 Lang, J.C. 1988. Apparent differences in bleaching responses by zooxantheliate cnidarians on Colombian and Bahamian reefs. Proc. Assoc. Is. Mar. Lab. Carib., 21:53. [ Links ]
20 Lewis, J.B. 1989. The ecology of Millepora. Coral Reefs, 8:99-107. [ Links ]
21 Losada, F.J. 1988. Report on Coelenterate bleaching in the southern Caribbean, Venezuela. 38-41. En: Ogden, J. y R. Wicklund (Eds): Mass bleaching of coral reefs in the Caribbean: a research strategy. National Undersea Research Program, Research Report 88-2: 51 p. [ Links ]
22 Loya, Y. 1976. Effects of water turbidity and sedimentation on the community structure of Puerto Rican corals. Bull. Mar. Sci, 26(4):450-466. [ Links ]
23 Ogden, J. y R. Wicklund (Eds). 1988. Mass bleaching of coral reefs in the Caribbean: a research strategy. Nat. Undersea Res. Progr, Res. Rep. 88-2: 51 p. [ Links ]
24 Prahl, H. von y H. Erhardt. 1985. Colombia, corales y arrecifes coralinos. FEN. Ed. Presencia Ltda. Bogotá. 295 p. [ Links ]
25 Ramírez, A. 1986. Ecología descriptiva de las llanuras madreporarias del Parque Nacional Submarino Los Corales del Rosario (Mar Caribe Colombia). Boletín Ecotropica, 14:34-63. [ Links ]
26 Rützler y Macintyre. 1982. The habitat distribution and community structure of the Carrie Bow Cay, Belize, Smith. Contrib. Mar. Sci., 12:9-45. [ Links ]
27 Schuhmacher, H. 1978. Arrecifes coralinos. Ediciones Omega S.A. Barcelona. 288 p. [ Links ]
28 Solano, O.D., G. Navas y S.K. Moreno-Forero. 1993. Blanqueamiento coralino de 1990 en el Parque Nacional Natural Corales del Rosario (Caribe, colombiano). An. Inst. Inv. Mar., Punta Betín, 22:97-111. [ Links ]
29 UNEP/AIMS. 1993. Monitoring coral reefs for global change. UNEP Reference Methods for Marine Pollution Studies No. 61, 72 p. [ Links ]
30 Weerdt, W.H. de. 1981. Transplantation experiments with Caribbean Millepora species (Hydrozoa, Coelenterata), including some ecological observations on growth forms. Bijdragen tot de Dierkunde, 51(1):1-19. [ Links ]
31 Weerdt, W.H. de. 1983. Taxonomic characters in Caribbean Millepora species (Hydrozoa, Coelenterata). Bijdragen tot de Dierkunde, 54(2):243-262. [ Links ]
32 Wells, S. (ed). 1988. Coral reefs of the world. Volumen 1: Atlantic and Eastern Pacific. UNEP, IUCN. Nairobi. 373 p. [ Links ]
33 Williams, E.H. Jr. y L. Bunkley-Williams. 1990. The world-wide coral reef bleaching cycle and related sources of coral mortality. Atoll Res. Bull., 335:71 p. [ Links ]
34 Zea, S. y F. Duque. 1989. Bleaching of reef organisms in the Santa Marta region, Colombia: 1987 Caribbean-wide event. Trianea, 3:37-51. [ Links ]