Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.24 no.1 Santa Marta Jan./Dec. 1995
ESTRUCTURA DEL MANGLAR EN EL DELTA EXTERIOR DEL RIO MAGDALENA-CIÉNAGA GRANDE DE SANTA MARTA, UNA ZONA TENSIONADA POR ALTERACIONES DEL EQUILIBRIO HÍDRICO
Liz Adriana Serrano Díaz, Leonor Botero, Pablo Cardona y José Ernesto Mancera-Pineda
Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andreis", INVEMAR, A.A. 1016, Santa Marta, Colombia.
RESUMEN
La estructura de los bosques de manglar del Delta Exterior del Río Magdalena-Ciénaga Grande de Santa Marta (DERM-CGSM) y algunas variables abióticas de sus suelos fueron cuantificadas con el objeto principal de proveer una línea de base para evaluaciones futuras de cambios en el ecosistema, como consecuencia de la reapertura de caños de agua dulce provenientes del Río Magdalena. Se encontró que los bosques que rodean el complejo lagunar exhiben diferentes grados de desarrollo estructural, desde casi ningún desarrollo (completamente muertos) hasta bosques complejos. El mejor desarrollo estructural se encontró en las estaciones localizadas sobre el Caño El Jobo (JOB) y sobre la Ciénaga de la Aguja (AGU) en la zona suroccidental del área de estudio. La primera de éstas presentó solamente dos especies de manglar pero sus individuos mostraron grandes tallas. La estación localizada sobre las Bocas del Río Aracataca (ARA) en el costado oriental de la CGSM, presentó las tres especies de mangle y un desarrollo estructural intermedio con presencia de individuos de gran talla. Estas tres estaciones son las que todavía reciben aportes de agua dulce, ya sea del Río Magdalena o de ríos provenientes de la Sierra Nevada de Santa Marta (SNSM). Las zonas más aisladas de flujos de agua dulce (estaciones sobre la Ciénaga de Pajaral y sobre la parte occidental del Caño Clarín) presentaron los más bajos desarrollos estructurales de la vegetación y gran parte de ésta totalmente muerta. Se concluye que Avicennia germinans es la especie dominante en el DERM-CGSM. En general, Rhizophora mangle se encontró únicamente al borde de los canales o ciénagas; en la zona occidental del DERM-CGSM esta especie se encontró casi toda muerta. Se demostró una correlación inversa entre la salinidad de los suelos y el área basal, la altura y el área foliar de los árboles y directa entre el potencial redox y los mismos atributos. Los bajes valores de área foliar de A. germinans encontrados en las estaciones con mayores salinidades del suelo reflejan parcialmente la "agresividad" del ambiente en el cual habita, y en especial su respuesta a la tensión impuesta por la dificultad de obtener agua del suelo.
ABSTRACT
With the main purpose of providing a baseline for future evaluations of ecosystem changes as a consequence of the reopening of freshwater canals from the Magdalena River, the structure of mangrove forests of the Exterior Delta of the Magdalena River-Ciénaga Grande de Santa Marta (DERM-CGSM land several soil properties were quantified. Mangrove forests surrounding the lagoonal complex exhibit from low and almost null structural development (completely dead) to complex structures. Best structural development was found on Caño El Jobo (JOB) and Ciénaga de la Aguja (AGU) in the southwestern part of the study area. JOB showed only two mangrove species but individual trees exhibited large sizes. In ARA, on the eastern side of Ciénaga Grande, the three species were present and structural development can be considered intermediate with several individuals of large size. These three stations (JOB, AGU, ARA) still receive fresh water flow from either the Magdalena River or from rivers of the Sierra Nevada de Santa Marta. The areas most isolated from freshwater flow (stations on Ciénaga de Pajaral and on the western end of Caño Clarín) showed the lowest structural development of the vegetation and a large part of it completely dead. It is concluded that Avicennia germinans is the dominant species in the study area. In general, Rhizophora mangle was only found on the edges of canals or lagoons and towards the western side this species was almost all dead. An inverse relationship was demonstrated between soil salinity and basal area, height and foliar area and a direct one between redox potentials and the same attributes. The low foliar area values of A. germinans in the stations with highest soil salinities reflect in part the "aggressiveness" of the environment in which the species lives and specially its response to the stress imposed by the difficulty of obtaining water from the soil.
INTRODUCCIÓN
Los manglares, también conocidos como bosques maréales o pantanos de manglar (Odum et al., 1982), son, bajo condiciones óptimas, ecosistemas de muy alta productividad (Heald y Odum, 1970; Lugo y Snedaker, 1974; Day et al, 1987) que desempeñan importantes funciones ecológicas, tanto por sus aportes de materia orgánica y nutrientes a los estuarios y al mar (Hutchings y Saenger, 1987; Jiménez, 1992) como por servir de áreas de refugio y cría a diferentes grupos de organismos, principalmente peces, crustáceos y moluscos de gran importancia comercial (Kuenzler, 1974; Lugo y Snedaker, 1974; Chapman, 1976; Snedaker, 1978 y Prahl et al, 1990). Se desarrollan en las líneas costeras y en zonas generalmente cercanas a las desembocaduras de los ríos y canales de agua dulce (Jiménez y Sauter, 1991).
Diferentes factores ambientales afectan la estructura del manglar. Entre estos, los más importantes son el flujo de la marea, la salinidad del suelo, el clima y la disponibilidad de agua dulce y de nutrientes (Cuatrecasas, 1958). Las características del sustrato son consideradas determinantes de la productividad y diversidad de los manglares (Boto y Wellington, 1984).
El ecosistema lagunar y de bosques de manglar del Delta Exterior del Río Magdalena - Ciénaga Grande de Santa Marta (DERM-CGSM), es uno de los sistemas de mayor interés social y económico en la costa norte colombiana pues cerca de 4000 personas dependen directamente de la extracción de los recursos hidrobiológicos del mismo, en tanto que numerosos núcleos urbanos son abastecidos de productos como ostras, camarones, jaibas, caracoles, lisas y mojarras provenientes de éste (PRO-CIENAGA, 1994).
En 1956, el total del bosque de manglar vivo y sano de la región abarcaba 52000 ha y rodeaba la gran mayoría de las ciénagas y caños del sistema (González, 1991). En los últimos 30 años, este bosque ha experimentado una mortandad progresiva, que en la actualidad ha alcanzado niveles masivos. La causa principal de la muerte del manglar ha sido atribuida a la construcción de la carretera Ciénaga - Barranquilla y al cierre y/o colmatación de los caños provenientes del río Magdalena en la zona occidental del sistema lagunar (Botero y Botero, 1989; Botero, 1990; González, 1991). A partir de la década de los sesenta, después de construida esta carretera y cuando empezó a interrumpirse el paso de agua dulce del río Magdalena al complejo lagunar, comenzó la muerte de los mangles, iniciándose en la zona norte y desplazándose el fenómeno hacia el sur a medida que el sistema (especialmente los suelos del manglar) se fue salinizando (González, 1991). La tasa de mortalidad se ha acelerado con el transcurrir del tiempo (González, 1991) siendo para el lapso de 1987 a 1993 de aproximadamente 886 ha/año (PRO-CIENAGA, información no publicada). En diciembre de 1993 un total de 21778 ha del bosque original estaban muertas.
El proyecto intergubernamental (Colombia-Alemania) para la Rehabilitación de la Ciénaga Grande de Santa Marta "PROCIENAGA", ha comenzado a reabrir los caños que llevan agua dulce del Río Magdalena a los sistemas de ciénagas con el propósito de restablecer el equilibrio hídrico de la zona y así recuperar algunas de las condiciones ambientales originales. Se espera que a finales de 1995, comiencen a entrar al sistema a través del Caño Clarín, 20 m3/seg de agua del río Magdalena. En 1996 y 1997 deberán reabrirse los caños Renegado y Aguas "Negras cada uno de los cuales aportará un caudal máximo de 60 m3/seg de agua dulce al sistema (PRO-CIENAGA, 1994).
El estudio de la estructura actual del bosque de manglar de la zona es un requerimiento importante para aportar al conocimiento cuantitativo de este importante ecosistema y para proveer una referencia (línea de base) a partir de la cual se pueda evaluar el impacto de la reapertura de los canales sobre el manglar. El presente estudio caracteriza cuantitativamente, por primera vez, la estructura del bosque de manglar del Delta Exterior del Río Magdalena (DERM) y la relaciona con algunas de las variables abióticas de los suelos.
ÁREA DE ESTUDIO
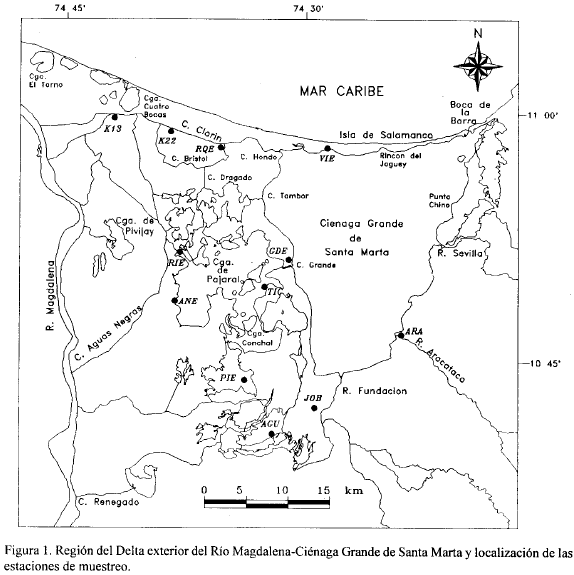
El sistema de lagunas, caños y bosques de manglar que conforman parte del DERM-CGSM, está ubicado entre las latitudes 10° 40' y 10° 59' N y longitudes 74° 15' y 74° 38'W (Figura 1); presenta un área aproximada de 181900 ha y se localiza sobre la costa Caribe de Colombia, colindando por el oriente y suroriente con el piedemonte de la Sierra Nevada de Santa Marta (SNSM), de donde provienen los ríos Frío, Sevilla, Aracataca y Fundación los cuales desembocan en la Ciénaga Grande; por el norte, el sistema está separado del Mar Caribe por una barrera de arena denominada Isla de Salamanca y por el occidente limita con la llanura de inundación del río Magdalena (Wiedemann, 1973); el sistema está conectado directamente al mar Caribe por una boca de aproximadamente 250 m de ancho en el sitio llamado la Barra. El complejo lagunar recibía las aguas del Río Magdalena a través del Caño Clarín y de otros caños (Aguas Negras, Renegado, Salado, Schiller) que se comunicaban con varias ciénagas menores pertenecientes al Complejo de Pajarales y al Santuario de Fauna y Flora (Botero, 1988). El resto de los aportes fluviales provienen de los ríos que nacen en el macizo de la SNSM (Hernández et al, 1980) los cuales irrigan principalmente el costado oriental del complejo lagunar desembocando directamente en la CGSM.
El sistema lagunar de la CGSM se originó gradualmente debido a un ascenso relativo del nivel del mar de cerca de 2 m durante los últimos 2300 años (Wiedemann, 1973). En la última gran transgresión marina, la zona estuvo cubierta por el mar, el cual penetró hasta las inmediaciones de El Banco, Magdalena (Raasveldt y Tomic, 1958). Al inicio del Holoceno se operó una regresión del nivel del mar y debido al aporte fluvial de sedimentos se inició la formación del amplio delta entre el cauce del Magdalena y el Cano Schiller, proceso que aún continúa (Hernández et al, 1980; Wiedemann, 1973).
Las márgenes de gran parte del sistema están ocupadas por manglares que se extienden desde la ciudad de Ciénaga hacia el sur, a lo largo de toda la orilla oriental de la Ciénaga Grande hasta el Río Fundación en una delgada cortina de mangle mixto (González, 1991). A partir de la margen occidental del río Fundación las formaciones de mangle se ensanchan, penetrando a casi toda el área que corresponde al Santuario de Flora y Fauna, al Complejo de Ciénagas de Pajarales y en general a toda la zona occidental de la CGSM (González, 1991)
Climáticamente, la zona es árida, con 6 a 7 meses de sequía al año (HIMAT,1988). Según Espinal y Montenegro (1977), la vegetación de la región corresponde a un bosque muy seco tropical y soporta un déficit hídrico de 1031 mm anuales debido a que la evapotranspiración excede ampliamente la precipitación (IGAC, 1975; CETIH, 1978). Los períodos de lluvia y de sequía están bien definidos presentándose de diciembre a abril la época seca mayor, de mayo a junio la estación lluviosa menor, de julio a agosto la seca menor y de septiembre a noviembre la lluviosa mayor. La zona posee una precipitación anual entre 500 y 1000 mm (Hernández et al., 1980 y Wiedemann, 1973). El régimen de temperaturas corresponde al tipo isomegatérmico con medias anuales entre 27-28°C y amplitudes diarias de 8 a 9°C (Wiedemann, 1973). Los rangos de marea son relativamente angostos (+ 30 cm) (UniAndes, 1990) siendo el Río Magdalena, los ríos de la SNSM y la precipitación, los principales causantes de los cambios en el nivel de la columna de agua de las ciénagas y caños.
MATERIALES Y MÉTODOS
Se escogieron 12 estaciones de muestreo (Fig. 1) en las cuales se cuantificó la estructura y composición de la vegetación así como algunas variables del suelo durante el periodo julio/93 a ene/94. Las coordenadas geográficas de cada estación fueron determinadas con un geoposicionador (GPS) Magellan-Nav 5000D. Para la escogencia de estas 12 estaciones se tuvieron en cuenta los siguientes criterios: 1) Involucrar la mayor área de estudio posible dadas las necesidades de proveer una línea de base para evaluaciones futuras del cambio del bosque. 2) Incluir zonas con diferentes estados de la vegetación: manglar vivo, en proceso de degradación y totalmente muerto. 3) Lograr un conjunto de estaciones representativas de las diferentes condiciones ambientales (influencia cercana del mar, influencia de los ríos de la SNSM, cerramiento/interrupción de los caños del Río Magdalena, cercanía de la CGSM) a que están sometidos los mangles de la zona.
En cada estación se trazaron dos transectos (TI y T2) de 200 m de longitud, separados entre sí 200 m, perpendiculares a la orilla del cuerpo de agua de referencia (canal o ciénaga) y en dirección al interior del bosque para tratar con ello de determinar los cambios en la vegetación con respecto a la distancia del agua. En cada transecto se delimitaron, desde la orilla, 10 parcelas de 100 m2 (0.01 ha) separadas entre sí por una distancia de 10 m. En cada parcela se cuantificaron, una sola vez, los siguientes atributos de la vegetación de acuerdo con los métodos de Schaeffer-Novelli y Cintrón (1986), Matteuci y Colma (1982) y Curtís y Mclntosh (1951) y teniendo en cuenta solamente los árboles vivos con diámetro mayor de 2.5 cm: 1) diámetro al nivel del pecho (DAP); 2) altura; 3) densidad de los árboles; 4) área basal; 5) área foliar; 6) abundancia relativa; 7) dominancia relativa; 8) frecuencia relativa; 9) índice de valor de importancia (IVI). A su vez, en el centro de cada parcela y únicamente una sola vez durante la época seca mayor (diciembre/93 a abril/94), se midieron los siguientes parámetros del suelo: 1) Salinidad del agua intersticial mediante un salinómetro WTW LF191, efectuando diluciones cuando la salinidad excedía de 60 y expresando los valores de acuerdo a la escala de salinidad práctica (UNESCO, 1985); el agua intersticial se obtuvo introduciendo en el suelo un tubo de PVC de 80 cm de longitud cuya base tenía agujeros que permitían la entrada del agua intersticial y succionando la misma. 2) Nitrógeno total (Nt en %) llevando al laboratorio aproximadamente 100 g de suelo de 20 cm de profundidad y analizándolo con el semi micro-método volumétrico de Kjeldahl (Dewis y Freitas, 1984). 3) Fósforo total (Pt en %) utilizando parte del material recolectado para el análisis de nitrógeno total y transformando el fósforo total a ortofosfatos de acuerdo con la metodología de Aspila, et al. (1976) y determinando estos últimos con los Métodos Standard de APHA (1975). 4) Potencial Redox (Eh en mV) utilizando una sonda WTW pH91 con electrodo de platino (Schott Gerate pt 62); las lecturas se tomaron in situ, introduciendo el electrodo directamente en el suelo hasta unos 10 cm de profundidad.
Para relacionar los atributos de la vegetación con las variables abióticas de los suelos medidas durante la época seca y determinar cuales variables físico-químicas son las que ejercen mayor impacto sobre la vegetación, se realizaron análisis de correlación canónica (Gittins, 1985) entre un espacio compuesto por las variables físico-químicas y otro por los atributos de la vegetación. Este tipo de análisis es recomendado para detectar relaciones entre conjuntos de variables cuando todas ellas están interactuando simultáneamente (Gittins, 1985; Hair et al, 1995). Teniendo en cuenta que las oscilaciones temporales de la salinidad en suelos de manglar son función de la altura y duración de las mareas, de la estacionalidad e intensidad de la precipitación y de la cantidad de agua dulce que entra por ríos, canales y escorrentía inundando los suelos, y que el grado de inundación y drenaje determinan también en gran medida el potencial redox de los mismos suelos (Mitsch y Gosselink, 1993), se partió del siguiente supuesto que a su vez se basa en mediciones realizadas por INVEMAR en los últimos 3 años (Base de datos MANGLAR, INVEMAR), en registros de Botero (1990) y Sánchez-Páez (1988), en observaciones puntuales no publicadas de los autores y en el hecho real de que se interrumpieron los flujos de agua dulce del Río Magdalena por lo cual la inundación y lavado periódico de los suelos se han disminuido sustancialmente: desde que se interrumpió el aporte de agua dulce del Río Magdalena y se consolidó el proceso de degradación de los suelos y del bosque, las épocas secas han sido las más determinantes como agentes de tensión. Cada año, durante este periodo, los suelos presentan, para una zona o estación determinada, similares condiciones de salinidad, potencial redox y contenidos de nitrógeno y fósforo total.
RESULTADOS Y DISCUSIÓN
Descripción general de las estaciones de muestreo
- AGU: 10° 40' 05" N y 74° 29' 35" W. Está localizada en estribaciones de la Ciénaga La Aguja en el Santuario de Fauna y Flora. El suelo es aparentemente areno-arcilloso y está cubierto aproximadamente en un 60% por neumatóforos de Avicennia germinans, la cual forma un rodal casi monoespecífico (presenta algunos individuos de Laguncularia racemosa en las parcelas de borde). Unos 180 m a la derecha del primer transecto se presenta un canal de 2 m de ancho aproximadamente, el cual inunda las partes más internas de la estación.
- ARA: 10° 46' 50" N y 74° 21' 48" W. Está ubicada aproximadamente 400 m al Norte de la boca del Río Aracataca, sobre la orilla oriental de la CGSM. El manglar está mezclado con vegetación de río (bejucos, lianas y helechos). Tiene gran cantidad de plántulas de todas las especies presentes (A. germinans, Rhizophora mangle y L. racemosa) y el suelo permanece inundado en su totalidad durante casi todo el año por agua proveniente del río Aracataca y de la CGSM siendo poco consolidado, semifluido y conteniendo gran cantidad de materia orgánica.
- GDE: 10° 51' 39" N y 74° 28' 56" W. Se ubica al Norte de Caño Grande sobre la CGSM. Es muy heterogénea en la cobertura de mangle, presentando en un transecto vegetación solamente al borde y troncos de árboles muertos en el resto del mismo. El otro transecto tiene árboles vivos en el 80% de las parcelas estudiadas. El suelo es en su mayoría arena gruesa, de consistencia firme.
- JOB: 10° 41' 56" N y 74° 28' 25" W. Está localizada sobre las orillas del Caño el Jobo en el Santuario de Fauna y Flora. Presenta abundancia de plántulas de dos especies de mangle (L. racemosa y A. germinans) pero sólo hasta los 30 m aproximadamente del canal. El suelo es firme, aparentemente arcilloso, con gran cantidad de neumatóforos y poca materia orgánica. A 140 m del canal, en ambos transectos, se notó la presencia del helecho de manglar (Acrostichum aureum).
- K13: 10° 59' 42" N y 74° 38' 07" W. Se localiza sobre el costado sur del Caño Clarín aproximadamente en el kilómetro 13 de la vía Barranquilla - Ciénaga. En esta estación solamente se presenta A. germinans a 0 y 180 m del borde del canal. La mayoría del área es un playón salino de consistencia firme, aparentemente areno-arcilloso y desprovista de vegetación a excepción de algunos parches de Batis marítima. En uno de los transectos, a 80 m del canal, había una laguna que se extendía hasta los 200 m.
- K22: 10° 58' 37" N y 74° 34' 39" W. Ubicada sobre el costado norte del Caño Clarín sobre la Isla de Salamanca aproximadamente en el kilómetro 22 de la vía Barranquilla - Ciénaga. En esta estación se encontraron las tres especies de mangle, aunque R. mangle se presentó muy esporádicamente y con desarrollo achaparrado; adicionalmente se presentan parches dispersos de B. marítima. Gran parte de esta estación (aproximadamente el 70%) sólo poseía restos de árboles muertos. El suelo es lodoso y aparentemente con gran cantidad de materia orgánica parcialmente descompuesta.
- ANE: 10° 48' 32" N y 74° 36' 28" W. Ubicada en cercanías del Caño Aguas Negras en el Complejo de Pajarales. De suelo completamente blando (aparentementel fango-lodoso), de color gris-negruzco. La estación presentó muchos árboles muertos y pocos individuos de A. germinans, achaparrados.
- PIE: 10° 45' 50" N y 74° 33' 47" W. Se encuentra bordeando la Ciénaga La Piedra en el Complejo de Pajarales. Presenta similares condiciones de vegetación a la estación ANE. El suelo es firme y aparentemente arenoso. Se observó la entrada de agua por un canal angosto ubicado al lado derecho y el cual llega hasta una distancia de 160 m del canal principal. Bordeando ese canal se encuentran árboles de A. germinans.
- RIE: 10° 51' 27" N y 74° 34' 39" W. Está ubicada en cercanías al Caño los Rieles en el Complejo de Pajarales. Presentó vegetación de A. germinans aproximadamente en un 35% del área, habiendo árboles muertos en el resto del terreno. El suelo es firme, de color gris-negruzco, con una capa delgada de lodo y más hacia el fondo arena, cubierto por restos de troncos.
- RQE: 10° 58' 17" N y 74° 31' 07" W. Se encuentra sobre el Caño la Riqueza en la Isla de Salamanca. De suelo arcilloso, cubierto en su mayoría por neumatóforos de A. germinans y L. racemosa. El bosque en su parte más interna está altamente talado.
- TIG: 10° 48' 49" N y 74° 30' 46" W. Ubicada en las márgenes de la Ciénaga El Tigre en el Complejo de Pajarales. Posee gran cantidad de plántulas de R. mangle y A. germinans, en las parcelas de borde. El suelo del borde es blando (donde domina Rhizophora), de color gris - negruzco, con fuerte olor a H2S. En el interior del bosque el suelo es más compacto debido a la abundancia de neumatóforos.
- VIE: 10° 58' 08" N y 74° 26' 38" W. Ubicada sobre el Caño de Barra Vieja, en la Isla de Salamanca. Presenta suelo blando en el borde (fangoso) y más firme hacia el interior del bosque. Posee las tres especies de mangle y parches dispersos de Sesicvium portulacastrum y B. marítima.
Características de los suelos
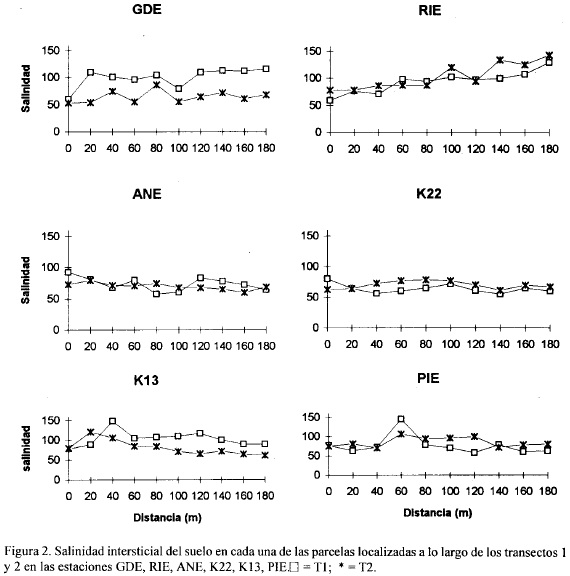
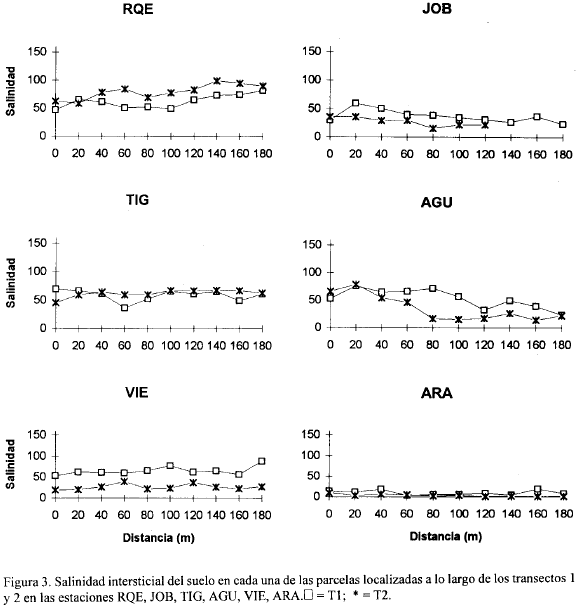
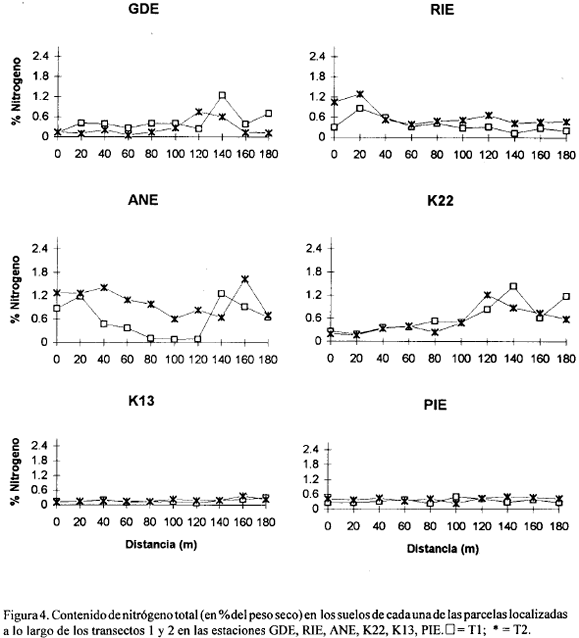
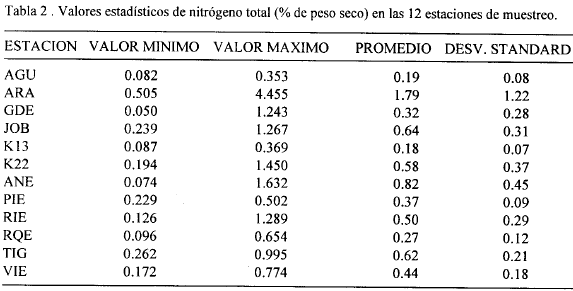
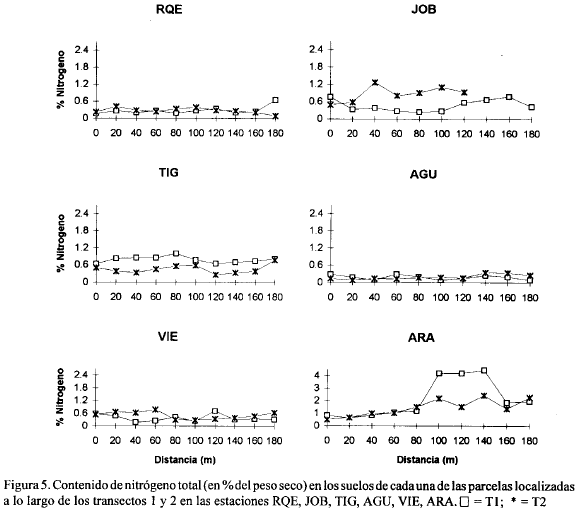
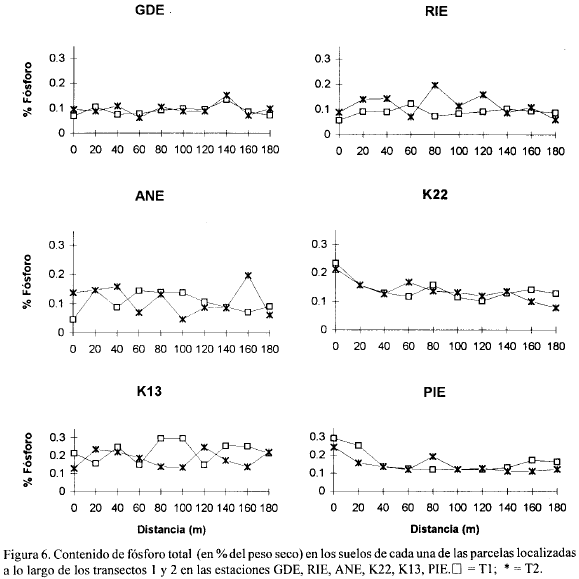
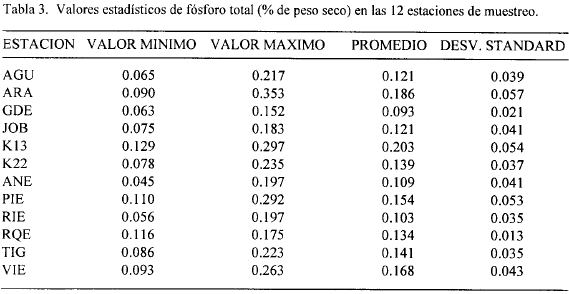
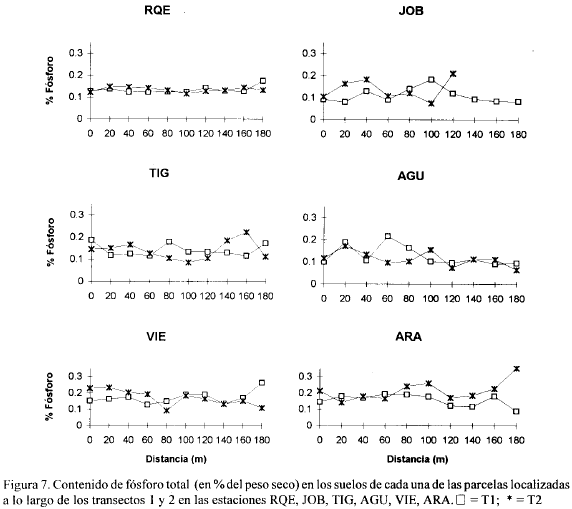
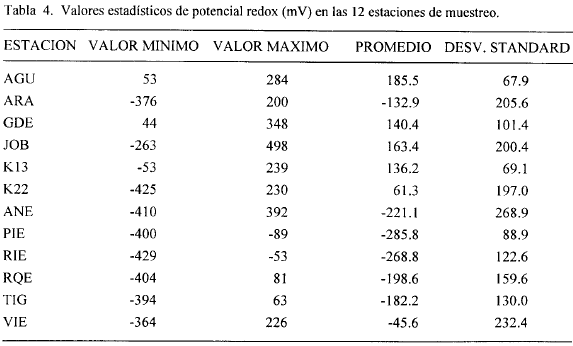
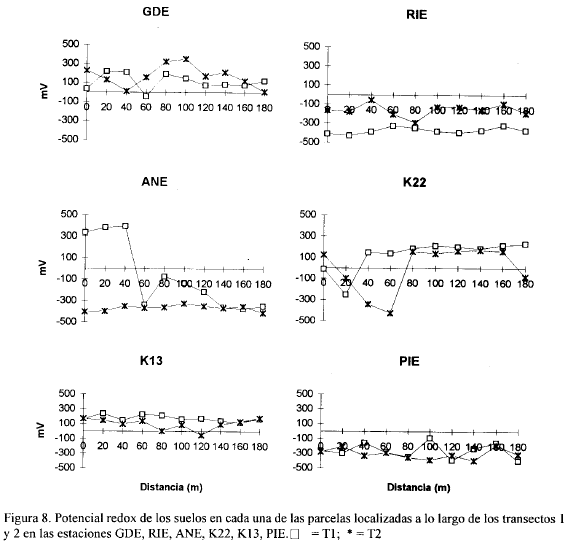
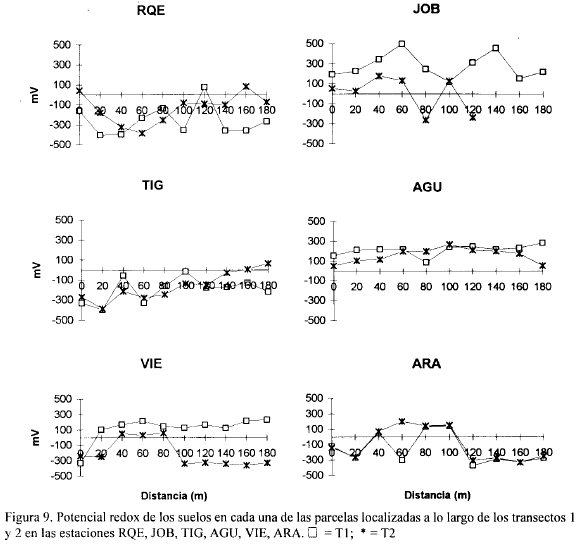
Las figuras 2, 3, 4, 5, 6, 7, 8 y 9 presentan los valores de las variables abióticas de los suelos en cada una de las parcelas de las diferentes estaciones y las tablas 1, 2, 3 y 4 presentan los valores estadísticos de las mismas.
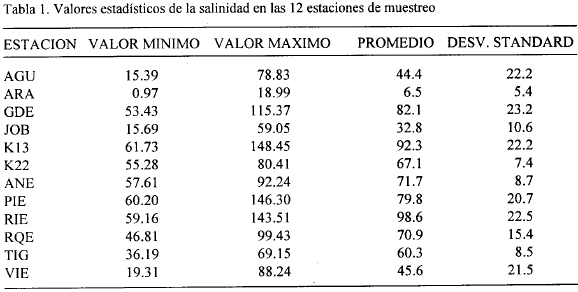
Salinidad. La mayoría de los suelos presentaron salinidades mayores de 60, a excepción de las estaciones JOB y ARA donde los valores máximos fueron 59 y 19 respectivamente y uno de los transectos de VIE que presentó un máximo de 38 (Fig. 3).
En AGU, a partir de los 80 m, uno de los transectos solamente presentó salinidades menores de 25 (Fig. 3). El máximo valor hallado para todas las estaciones fue de 148.5 en la estación K13 a 40 m del canal (Fig. 2) y el mínimo en ARA (0.97) a 120 m del canal (Fig. 3). Las estaciones que presentaron mayores salinidades promedio fueron RIE, K13, GDE, PIE, ANE y RQE con valores de 98.6, 92.3, 82.1, 79.8, 71.7 y 70.9 respectivamente (Tabla 1). ARA presentó una salinidad promedio de 6.5 y las restantes estaciones presentaron valores entre 32 y 67. En las estaciones RIE (Fig. 2) y RQE (Fig. 3) la salinidad tendió a aumentar con la distancia al canal en ambos transectos. En ambos transectos de AGU las salinidades altas solamente se presentaron hasta los 60 - 80 m del canal y posteriormente tuvieron un descenso fuerte (Fig. 3). En términos generales, las diferencias en salinidad entre los dos transectos de una misma estación no fueron muy grandes, a excepción de las estaciones GDE, K13 y VIE, donde la diferencia de salinidad entre parcelas correspondientes de cada transecto fue superior a 30 (Figs. 2, 3). Los bajos valores de salinidad que se presentaron en la estación ARA (Fig. 3), a diferencia de las otras estaciones, se explican por la cercanía de esta estación al Río Aracataca, el cual lava frecuentemente sus suelos, impidiendo con ello la acumulación de sales provenientes del intercambio de agua con la CGSM.
En general, los valores de salinidad encontrados en el presente estudio son más altos (a excepción de ARA) que los reportados por Leal-Puccini (1986) y Sánchez-Páez (1988), para suelos de la Isla Salamanca, quienes encontraron en la época seca mayor rangos entre 29.2-62.3 y un máximo de 120 respectivamente, asociados con manglares en estado atrofiado o con claros síntomas de degradación. Cardona (1991) y Botero (1990) reportaron salinidades similares a las medidas en este trabajo, en localidades de la zona asociadas a bosques con una gran porcentaje de su vegetación muerta. En general no se observó una tendencia a mayores salinidades a mayor distancia del canal. Las diferentes tendencias en las estaciones pueden estar dependiendo de las condiciones particulares (edáficas o topográficas) de cada estación.
La salinidad del agua intersticial ha sido ampliamente reconocida como un factor importante que regula el crecimiento, la altura, la sobrevivencia y la zonación de los manglares (Hutchings y Saenger, 1987). Cintrón et al (1978) registran una reducción en el vigor y desarrollo de los rodales de manglar asociada a incrementos en la salinidad de los suelos en costas donde hay poca escorrentía y las mareas son de poca amplitud (0.3 m aproximadamente). Similar situación ocurre en las estaciones PIE, RIE, K13, K22 y ANE, aún con especies como A. germinans que es la más resistente a altas salinidades.
Varios autores han registrado pobre desarrollo de R. mangle en suelos con salinidades del agua intersticial mayores a 50-55, mientras que se registra formación de bosques de A. germinans a 60-65 (Cintrón y Schaeffer-Novelli, 1983). Similares observaciones fueron hechas en este trabajo. Por ejemplo en RIE, con una salinidad de 78.4 cerca a la orilla del canal, R. mangle crece achaparrado, con muy baja densidad y con visibles señales de estar en vía de muerte, mientras que A. germinans mostró buen desarrollo hasta salinidades de 78.8 en AGU. La salinidad intersticial de las parcelas con R. mangle al borde de los cuerpos de agua promedió 40.4. Situación similar registraron Cintrón et al., (1980) para la costa Sur Oeste de Puerto Rico. En las parcelas más internas, pobladas de Avicennia, las salinidades intersticiales son mayores alcanzando valores hasta de 148.5; a esta salinidad, que es muy superior a los niveles máximos registrados para A. germinans, la presencia de esta especie se ve atrofiada y casi desaparece.
Nitrógeno. En general los suelos presentaron valores de nitrógeno total menores de 1.5% excepto en ARA donde se hallaron los valores más altos de este elemento (4.21, 4.20 y 4.45%) a 100, 120 y 140 m del canal respectivamente (Fig. 5). El más bajo valor (0.05%) se presentó en la estación GDE a 60 m del canal (Fig. 4). La tabla 2 muestra que la estación ARA presentó los promedios más altos así como la mayor variación de nitrógeno total. Los valores promedio más bajos estuvieron en la estación K13 y AGU, con 0.18% y 0.19% respectivamente (Tabla 2). En la mayoría de estaciones ambos transectos presentaron tendencias y valores muy similares en su contenido de Nt exceptuando en ANE, JOB y ARA, aunque en ARA se observaron diferencias solamente a partir de los 100 m (Figs. 4, 5). En general puede decirse que estos valores de nitrógeno total están cercanos o dentro de los rangos registrados en manglares de diferentes partes del mundo (0.02-0.4% del peso seco del sedimento) (Alongi et al., 1992) exceptuando la estación ARA que mostró porcentajes muy altos de este elemento.
Fósforo. Los valores de fósforo total estuvieron en un rango de 0.045 a 0.35% en toda la zona de estudio (Figs. 6, 7). El valor más alto (0.35%) se encontró en la estación ARA y el más bajo en ANE y RIE (0.045 %) al borde del canal. Otros valores altos (0.30 y 0.29%) se presentaron en las estaciones K13 y PIE, respectivamente, hacia los 80 m del transecto (Fig. 6). A diferencia de lo que ocurrió con el nitrógeno total, la mayoría de las estaciones, exceptuando a GDE, K22 y RQE, presentaron tendencias y valores diferentes de Pt en los dos transectos (Figs. 6, 7). La Tabla 3 muestra que los mayores valores promedio de fósforo total se presentaron en K13, ARA y PIE y los menores en GDE. Comparando con valores dados para otros manglares del mundo (Boto and Wellington, 1984; Alongi et al., 1992 ) los de la zona de estudio resultan altos.
Se sale de los objetivos del presente trabajo explicar las razones de los mayores o menores valores de nitrógeno y fósforo total en las diferentes estaciones, cuya distribución y concentración no parece obedecer a ningún patrón definido (exceptuando los mayores valores encontrados en ARA probablemente por ser la estación con mayor cantidad de manglar vivo). Sin embargo, el conocimiento de los mismos provee un punto de partida para que otros estudios profundicen sobre el tema así como para evaluar posibles cambios ocasionados por la reapertura de caños.
Potencial Redox. Los valores de potencial redox en la zona estuvieron entre +500 mV y -430 mV. Entre las estaciones y entre los transectos de cada estación se notaron grandes diferencias; por ejemplo, en la estación JOB a 60 m del canal, el transecto I presentó +498 mV y a la misma distancia el transecto II registró 132 mV (Fig. 9). El máximo valor de potencial redox encontrado para toda la zona de estudio fue de 498 mV en la estación JOB a 60 m del canal, y el mínimo valor hallado fue de -429 mV en RIE a 40 m del canal (Fig. 8). Los bajos valores de potencial redox presentados en la mayoría de las estaciones, posiblemente resultan de procesos microbiológicos que están descomponiendo la materia orgánica presente en los suelos anaeróbicos. Bajos potenciales redox de los suelos pueden afectar las funciones fisiológicas de la vegetación por las implicaciones que el estado reductor tiene sobre la disponibilidad de nutrientes y acumulación de sustancias tóxicas (Delaune et al, 1990).
Características de la vegetación
El desarrollo estructural de los manglares en algunas de las estaciones del DERM-CGSM (K13, K22, PIE, GDE) es el típico de zonas áridas, de acuerdo con las clasificaciones de Cintrón et al. (1980) y Pool et al. (1977). Sin embargo, la mayoría de estas estaciones muestran manglares fuertemente degradados, casi que en vías de desaparición. Otras estaciones (AGU, JOB, ARA, TIG) presentan un desarrollo estructural del bosque típico de manglares ribereños.
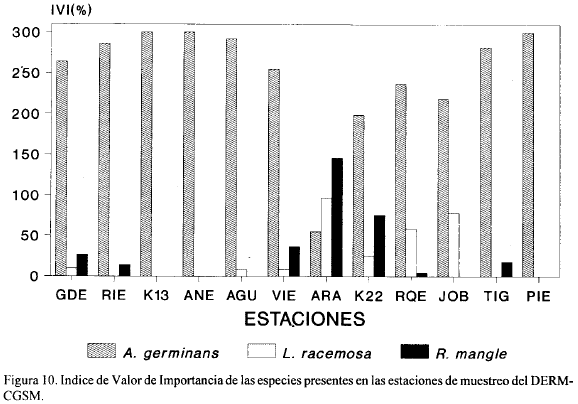
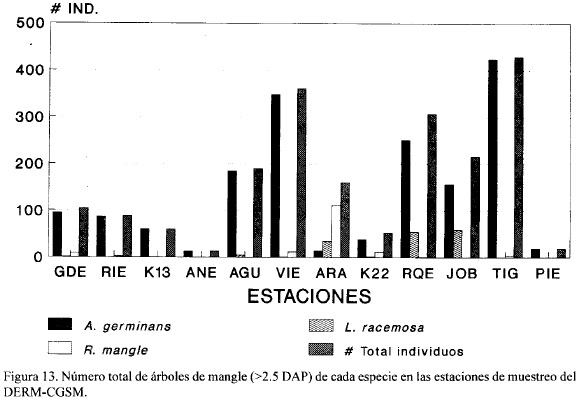
De las 12 estaciones, seis (JOB, ARA, VIE, TIG, AGU y RQE), presentaron vegetación viva en todas las parcelas. La estación PIE presentó el menor número (3) de parcelas con vegetación. Avicennia germinans estuvo presente en todas las estaciones, siendo exclusiva en tres de ellas (ANE, K13, y PIE). La Fig. 10 muestra que A. germinans fue la especie más importante y por lo tanto dominante y más frecuente en todas las estaciones excepto en ARA donde R. mangle fue dominante. Observaciones cualitativas de la vegetación muerta en toda la zona de estudio indican que A. germinans siempre fue dominante en el ecosistema. Esta dominancia es muy probablemente una consecuencia de la alta salinidad de los suelos y de la gran aridez de la zona puesto que esta especie es la más resistente, de las tres existentes en el área, a altas salinidades del suelo. Rhizophora mangle puede decirse que estuvo presente significativamente solamente en ARA, donde se midieron tallas mayores de 25 cm en DAP (Fig. 11). Esta especie estuvo totalmente ausente en las estaciones AGU, ANE, K13, JOB y PIE. Por otro lado, L. racemosa estuvo ausente en las estaciones ANE, K13, RIE, TIG y PIE (Fig. 10). Las estaciones GDE, ARA, VIE, K22 y RQE presentaron las tres especies de mangle a la vez (Fig. 10).
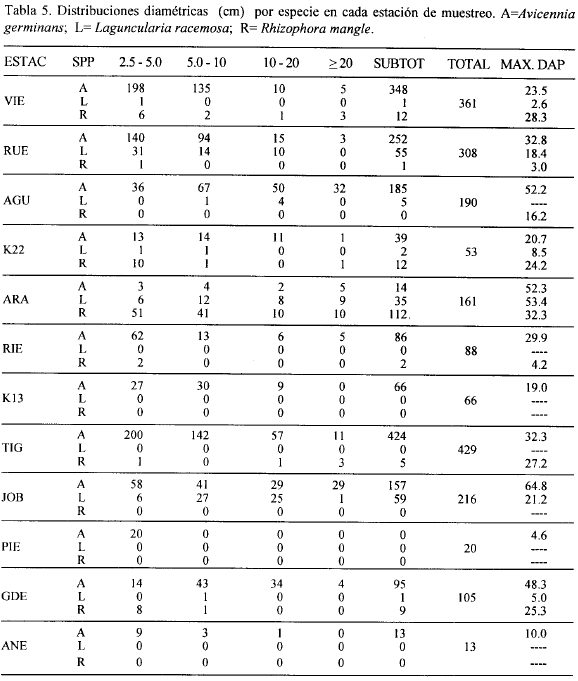
La tabla 5 muestra las distribuciones diamétricas por especie en cada estación de muestreo. En general se observó que los mangles del DERM-CGSM son de baja talla, predominando en todas las estaciones, para las tres especies, individuos con DAP < 5.0 cm, lo cual indica un bajo desarrollo del bosque o un bosque en estado de regeneración.
En los manglares del DERM-CGSM no se observa una verdadera zonación en el sentido de Davis (1940). Existen especies pioneras como R. mangle y bosques mixtos de R. mangle y A. germinans al igual que de A. germinans y L. racemosa. De otro lado, aunque algunas estaciones presentan características ambientales que podrían considerarse como óptimas (ejemplo ARA o JOB) para permitir un alto grado de desarrollo del bosque, éstas tampoco presentaron un patrón definido en cuanto a distribución de sus especies, pero si se observó la presencia de grandes alturas y DAP (Figs. 11, 12). En general, las orillas de ciénagas y canales del DERM-CGSM están dominados por una faja (cuyo grosor varía de 0-10 m) de R. mangle seguido (hasta el final del transecto) de A. germinans, el cual suele encontrarse asociado con la anterior o con algunos individuos de L. racemosa; este patrón también fue encontrado por Calderón et al (1984) en la Ciénaga de Tesca. El hecho de que actualmente R. mangle esté presente solamente en las orillas de los canales y de las ciénagas se debe probablemente a que allí las condiciones de salinidad son menores que hacia el interior de los pantanos. Sin embargo, en algunas zonas se encuentran esqueletos de R. mangle hacia el interior, indicando que en alguna época las condiciones allí no fueron tan extremas como actualmente lo son.
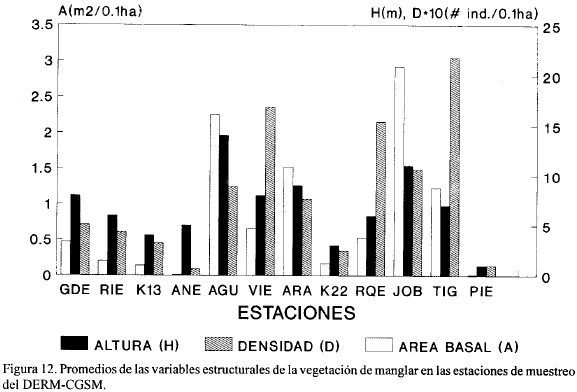
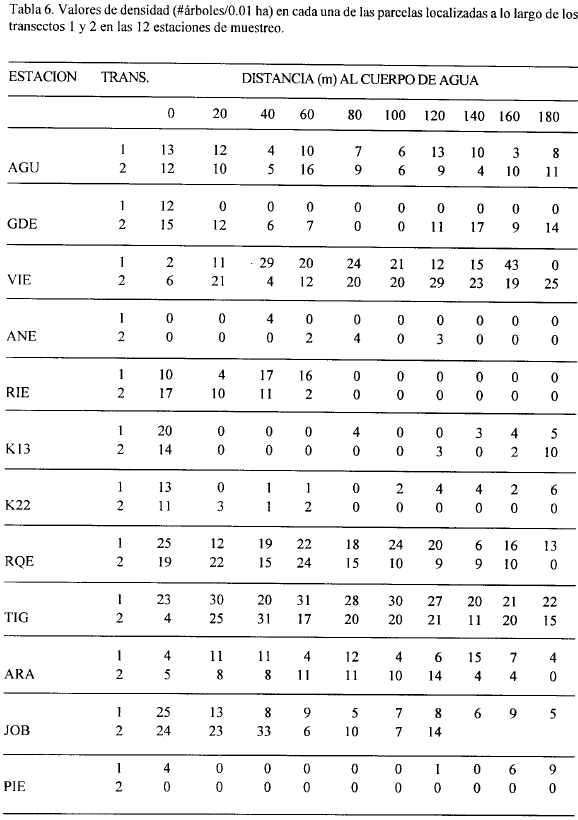
Las Tablas 6 y 7 muestran los valores de densidad y área basal en cada una de las parcelas de las estaciones estudiadas y la Fig. 12 muestra los promedios de estas variables estructurales en cada una de las estaciones. La mayor área basal (tanto por parcela como en promedio) se encontró en JOB seguida de AGU y ARA (Fig. 12) y estas tres estaciones tuvieron una distribución de tallas más equitativa (Tabla 5) lo cual da una idea de un mejor desarrollo de la vegetación. Las menores áreas básales se presentaron en ANE, K22, PIE, K13 y RIE (Fig. 12) en su orden y estas estaciones también presentaron valores muy bajos de ICH (Fig. 12). En la Fig. 13 se observa que el mayor número total de árboles se obtuvo en la estación TIG, seguida por VIE y RQE mientras que el menor número se presentó en ANE y PIE.
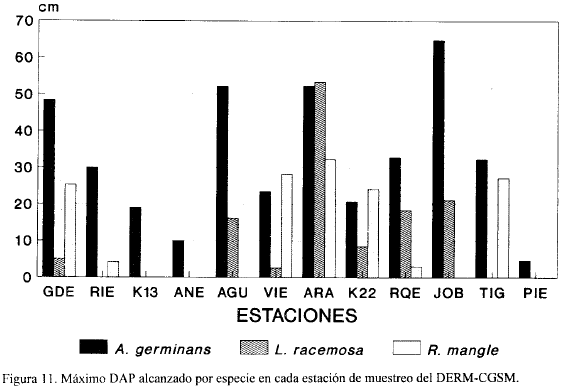
La Fig. 11 muestra el máximo DAP alcanzado por cada especie en cada una de las estaciones. JOB, ARA, AGU, y GDE presentan los árboles de A. germinans con mayor DAP mientras que ARA, VIE, TIG y GDE los de R. mangle. Laguncularia racemosa presenta los mayores DAP en ARA. ANE y PIE presentan los árboles de A. germinans con menor DAP. Los árboles más altos, en promedio, (Figura 12) se encontraron en las estaciones AGU, JOB y ARA (14.6, 11.6 y 9.3 m, respectivamente). Las mayores densidades de A. germinans y L. racemosa se encontraron en TIG, VIE y RQE (Fig. 12); sin embargo, como se ve en la Tabla 5, estas densidades están representadas principalmente por individuos pequeños, menores de 5.0 cm en DAP.
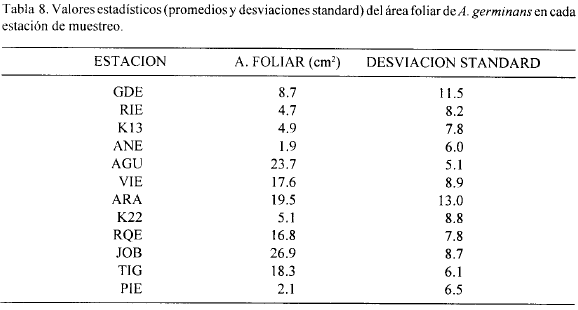
La Tabla 8 presenta los valores estadísticos del área foliar de A. germinans para cada estación. Las hojas más grandes (mayores áreas foliares) se encontraron en su orden en JOB, AGU y ARA. Las estaciones ANE, PIE, RIE, K13, K22 y GDE presentaron, en su orden, las menores áreas foliares y son al mismo tiempo las estaciones con mayor salinidad promedio del suelo. Las estaciones que presentaron mayores valores de área foliar (JOB, AGU y ARA) presentan bosques con las mayores áreas básales y alturas (Fig. 12) y suelos con salinidades bajas (Tabla 1). Según Cintrón et al (1978), Soto y Jiménez (1982) y Soto y Corrales (1987), las hojas pequeñas son parcialmente la solución al problema de difícil obtención de agua del suelo (por las altas salinidades), ya que son más eficientes reirradiadores de calor por convección y obtienen una mayor ganancia fotosíntetica por gramo de agua invertido en el proceso.
Relación vegetación-suelo
Para tratar de establecer algún grado de relación entre la estructura de la vegetación y las condiciones abióticas medidas en los suelos durante la época seca, se asumió que éstas se han mantenido similares por muchos años (desde que se interrumpieron los aportes de agua dulce), por lo menos durante las épocas secas que son las que aparentemente ejercen mayor tensión sobre el manglar debido a la fuerte evapotranspiración y nula llegada de agua dulce del Río Magdalena.
Los coeficientes de correlación entre los dos primeros pares de variables canónicas resultaron significativos (Tabla 9). Por lo tanto, del análisis de correlación canónica se concluye que la densidad no presenta relación muy fuerte de dependencia con respecto a las variables fisicoquímicas estudiadas puesto que el coeficiente de correlación entre esta variable estructural y su respectiva variable canónica no fue significativamente diferente de cero (p ≥ 0) (Tabla 10). El potencial redox presentó correlación directa con la variable canónica del espacio físico-químico mientras que la salinidad presentó correlación inversa con la misma (Tabla 10). De lo anterior se concluye que existe correlación inversa entre los atributos área basal, área foliar y altura con la salinidad y directa con el potencial redox.
En resumen, las estaciones localizadas al costado occidental de la CGSM, se caracterizaron en su mayoría por poseer altas salinidades, bajos potenciales redox, gran cantidad de nitrógeno y fósforo total, bajas áreas básales, bajas áreas foliares y densidades, y poco desarrollo estructural de la vegetación la cual es dominada por una sola especie de manglar (A. germinans). Por otro lado, las estaciones localizadas al sur y oriente de la CGSM presentaron salinidades no muy altas, altos potenciales redox, mayores concentraciones de nitrógeno y fósforo total, altas áreas básales, áreas foliares y densidad, y en general un buen desarrollo estructural de la vegetación con una representación algo más equitativa de las tres especies de manglar imperantes en el ecosistema.
BIBLIOGRAFÍA
1 A.P.H.A. 1975. Standard Methods for Examination of Water and Wastewater. 14 edition. American Public Health Association, American Water Works Assocciation, Water Pollution Control Federation. Washington, D.C., 1193 p. [ Links ]
2 Alongi, D.M., K.G. Boto y A.I. Robertson. 1992. Nitrogen and phosphorus cycles. 251-292. En: A.I. Robertson and D.M. Alongi (eds): Tropical Mangrove Ecosystems. Amer. Geophysical Union, Washington, D.C. [ Links ]
3 Aspila; K.I., H. Agemian y A.S.Y. Chau. 1976. A semi-automated method for the determination of organic, inorganic ando total phosphate in sediments. Analyst, 101:1 87-1 97. [ Links ]
4 Botero, L. 1988. Estudio Ecológico de la Ciénaga Grande de Santa Marta. Informe Proy., INVEMAR. Santa Marta, 200 p. [ Links ]
5 Botero, L. 1990. Massive mangrove mortality on the Caribbean Coast of Colombia. Vida Silv. Neotróp., 2(2):77-78. [ Links ]
6 Botero, J.E. y L. Botero. 1989. Problemática del sistema Ciénaga Grande de Santa Marta-Delta exterior del Río Magdalena. En: Colombia y el agua: tres aspectos. Bogotá. FESCOL 5: 11-28. [ Links ]
7 Boto, K.G. y J.T. Wellington. 1984. Soil characteristics and nutrient status in a northern Australian mangrove forest. Estuaries, 7(1):61 -69. [ Links ]
8 Calderón, E.; L.M. Leytón; J. Polanía y R. Araujo. 1984. Estructura del manglar de la Ciénaga de la Virgen o de Tesca. Rev. Futuro, 1(2): 83-86, Cartagena. [ Links ]
9 Cardona, P. 1991. Características do los suelos de manglar del costado noroccidental de la Ciénaga Grande de Santa Marta (Complejo Pajarales e Isla de Salamanca) y su relación con algunos atributos de la vegetación. Tesis M.Sc, Univ. de Antioquia, Medellín, 110 p. [ Links ]
10 CETIH. 1978. Diagnóstico sobre el comportamiento hídrico de la Ciénaga Grande de Santa Marta. Inf. Proy.Univ. de los Andes, Centre Estud. Técn. Investí. Hidráu.. Bogotá, 120 p. [ Links ]
11 Chapman, V.J.1976. Mangrove Vegetation. Verlaj J. Cramer. Lehre, New York, 600 p. [ Links ]
12 Cintrón, G.; A.C. Lugo; D.J. Pool y G. Morris. 1978. Mangrove of arid environments in Puerto Rico and adyacent islands. Biotropica, 1 0(2):110-121. [ Links ]
13 Cintrón, G., C. Goenaga y A.E. Lugo. 1980. Observaciones sobre el desarrollo del manglar en costas áridas. Memorias del Seminario sobre el Estudio Científico e Impacto Humano en el Ecosistema de Manglares. UNESCO, Montevideo :18-32. [ Links ]
14 Cintrón G. y Y. Schaeffer-Novelli. 1983. Introducción a la ecología del manglar. UNESCO - ROSTLAC, Montevideo, 107 p. [ Links ]
15 Crisci, J.V. y M.F. López. (1983). Introducción a la teoría y práctica de la taxonomía numérica. Secretaría General de la Organización de los Estados Americanos. Programa Regional de Desarrollo Científico y Tecnológico. Monografía No. 26, Serie Biología, 132 pp. [ Links ]
16 Cuatrecasas, J. 1958. Introducción al estudio de los manglares. Bol. Soc. Bot. Méx., 23: 84-98. [ Links ]
17 Curtis, J. y R.P. Mcintosh. 1951. An upland forest continuum in the prairie forest border region of Wisconsin. Ecology, 32: 476-478. [ Links ]
18 Davis, J.H. 1940. The ecology and geologic role of mangroves in Florida. Carnegie Inst. Washington Publications, 517: 303-412. [ Links ]
19 Day, J.W. Jr.; W.H. Conner, F. Ley-Lou; R.H. Day y A. M. Navarro. 1987. The productivity and composition of mangrove forests. Laguna de Términos, México. Aquatic Botany, 27: 267-284. [ Links ]
20 Delaune, R.D.; S. R. Pezeshki y J.H. Pardue. 1990. An oxidation-reduction buffer for evaluating the physiological response of plants to root oxygen stress. Environ, and Exper. Botany, 30(2): 243- 247. [ Links ]
21 Dewis, J. y F. Freitas. 1984. Métodos físicos y químicos de análisis de suelos y aguas. Bol. Suelos FAO, Organización de las Naciones Unidas para la Agricultura y la Alimentación. 10: 71 p. [ Links ]
22 Espinal, L.S. y E. Montenegro. 1977. Zonas de vida y formaciones vegetales de Colombia. Memorias explicativas sobre el mapa geológico de Colombia. Inst. Geogr. Agustín Codazzi. Bogotá, 238 p. [ Links ]
23 Gittins, R. 1985. Canonical analysis. A review with aplications in ecology. Springer - Verlag, Berlin, 350 p. [ Links ]
24 González, A.E. 1991. El Manglar de la Ciénaga Grande de Santa Marta: ecosistema en peligro de extinción. Colombia, sus gentes y sus recursos, IGAC, 21: 2-21. [ Links ]
25 Hair, J.F. Jr.; R. E. Anderson; R.L. Tatham y W.C. Black. 1995. Multivariate data analysis with readings. 4o Edición. Prentice Hall, New Jersey, 745 p. [ Links ]
26 Heald, E.J. y W.E. Odum, 1970. The contribution of mangrove swamps to Florida fisheries. Proc. Gulf Carib. Fish. Inst., 22: 730-735. [ Links ]
27 Hernández -Camacho, J.; P. von Hildebrand, y R. Alvarez. 1980. Problemática del manejo de manglares con especial referencia al sector occidental de la Ciénaga Grande de Santa Marta, Magdalena-Colombia. Mem. Sem. Est. Cient. Impacto Humano Ecosis. Manglares. Cali: 364-386. [ Links ]
28 HIMAT, 1988. Calendario meteorológico. Inst. Colomb.Hidrol, Meteorol. Adec. Tierras. Bogotá. 227 p. [ Links ]
29 Hutchings, P. y P. Saenger. 1987. Ecology of mangroves, Univer. Queensland Press, Queensland, 388 p. [ Links ]
30 IGAC. 1975. Estudio hidroclimático de la región del Caribe. Instituto Geográfico Agustín Codazzi. Bogotá. 77 p. [ Links ]
31 Jiménez, J. A. y K. Sauter. 1991. Structure and dynamics of mangroves forest along a flooding gradient. Estuaries, 14 (1): 49-56. [ Links ]
32 Jiménez, J. A. 1992. Mangrove forests of the Pacific coast of Central America, En: Coastal Plant Communities of Latin America. Academic Press, Barcelona, p: 259-267. [ Links ]
33 Kuenzler, E. J. 1974. Mangrove swamp system: 346-371. En Odum, H. I.; B. J. Copeland y E. A. McMahan (eds): Coastal ecology of the United States, Vol I. The Environment Conservation, U.S.A. [ Links ]
34 Leal-Puccini, E. 1986. Algunos aspectos ecológicos del ecosistema manglárico: parte de los estudios y diseños complementarios para la recuperación de la región deltaico estuarina del Río Magdalena en especial del área del Parque Natural Isla de Salamanca. Inf. Proy. INDERENA. Barranquilla, 30 p. [ Links ]
35 Lugo, A. E. y Snedaker, C. S. 1974. The ecology of mangroves. An. Rev. Ecol. and Syst., 5: 39-64. [ Links ]
36 Matteucci, D. S. y A. Colma. 1982. Metodología para el estudio de la vegetación. Secret, de la OEA, Washington, D. C. Monografía 23, 168 p. [ Links ]
37 Mitsch W.J y J.G. Gosselink. 1993. Wetlands. Van Nostrand Reinhold, 722 p. [ Links ]
38 Odum, W. E.; C. C. Mclvor y T. J. Smith, III. 1982. The ecology of the mangroves of South Florida: a community profile. U.S. Fish Wild. Ser, Washington, D. C, FWS/OBS-8/1 24, 144 p. [ Links ]
39 Prahl Von, H.; J. R. Cantera y R. Contreras. 1990. Manglares y hombres del Pacífico colombiano. Fondo FEN, Bogotá, 193 p. [ Links ]
40 PRO-CIENAGA. 1994. Estudio de impacto ambiental (EIA) de la reapertura de canales en el Delta Exterior Derecho del Río Magdalena. Proy. Coop. Técni. Colombo-Alemán Ciénaga Grande de Santa Marta, Santa Marta, 382 p. [ Links ]
41 Pool, D.J.; S.C. Snedaker y A. E. Lugo. 1977. Structure of mangrove forest in Florida, Puerto Rico, Mexico, and Costa Rica. Biotrópica, 9(3): 195-212. [ Links ]
42 Raasveldt, H.C. y A. Tomic. 1958. Lagunas colombianas: contribución a la geomorfología de la costa del Mar Caribe con algunas observaciones sobre Bocas de Ceniza. Rev. Acad. Col. Cienc. Exac. Fis. Nat., 10(40): 175-198. [ Links ]
43 Sanchez-Paez, H. 1988. Hacia la salvación del Parque Nacional Natural Isla de Salamanca. Trianea (Act. Cient. Tecn. INDERENA), 2:505-527. [ Links ]
44 Schaeffer-Novelli, Y. y G. Cintrón. 1986. Guia para estudo de areas de manguezal: estructura, funcao e flora. Carib. Ecol. Res. Sao Paulo, Brasil. 174 p. [ Links ]
45 Snedaker, S. C. 1978. Los Manglares: su valor y su perpetuación. La Naturaleza y sus Recursos, 14(3): 7-15. [ Links ]
46 Soto, R. y L.F. Corrales. 1987. Variación de algunas características foliares de Avícennia germinans en un gradiente climático y de salinidad. Rev. Biol. Tropical, 35(2): 245-256. [ Links ]
47 Soto, R. y J.A. Jiménez. 1982. Análisis fisonómico estructural del manglar de Puerto Soley-La Cruz, Guanacaste, Costa Rica. Rev. Biol. Tropical, 30 (2): 161-168. [ Links ]
48 UNESCO. 1985. The international system of units (SI) inoceanography. UNESCO Techn. Pap. 45, IAPS0 Pub. Sci. No. 32. [ Links ]
49 UniAndes, 1990. Modelación hidrodinámica de la Ciénaga Grande de Santa Marta. Inf. final Proy., Univ. Andes, Bogotá. [ Links ]
50 Wiedemann, H.U. 1973. Reconnaissance of the Ciénaga Grande de Santa Marta, Colombia: Physical parameters and geological history. Mitt. Inst. Colombo-Alemán. Invest. Cient., 7: 85-120. [ Links ]