Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.26 no.1 Santa Marta Jan./Dec. 1997
OVOGENESIS DE LUTJANUS PURPUREUS POEY, 1867 (PISCES: LUTJANIDAE) DE LA REGION ORIENTAL DE VENEZUELA
OVOGENESIS OF Lutjanus purpureus POEY, 1867 (PISCES: LUTJANIDAE) IN EASTERN VENEZUELA
Leo W. González y Thais Lugo
Area de Biología y Recursos Pesqueros. Instituto de Investigaciones Científicas, Universidad de Oriente, Núcleo de Nueva Esparta, Apartado 147, Boca del Río, Isla de Margarita, Venezuela. E-mail: leonora@telcel.netve (L.W.G.)
RESUMEN
El presente trabajo tiene por objeto el estudio de la ovogénesis del pargo colorado, Lutjanus purpureus de la región oriental de Venezuela. El proceso de maduración de los ovarios comprende dos fases, previtelogénesis de tres estadios determinada por cambios en el núcleo y vitelogónesis de cuatro estadios caracterizada por la acumulación en el citoplasma de sustancias nutritivas representadas por vesículas, gránulos de vitelo y lípidos. El desarrollo ovárico es asincrónico reconociéndose diversos estadios típicos en los peces marinos tropicales.
ABSTRACT
The purpose of this paper is the study of oogenesis in the red snapper, Lutjanus purpureus from the Venezuela eastern region. Bassed on histological descriptions the oogenesis is the egg development in ovaries and have two phases: Previtelogénesis of three stages characterized by changes in nucleus and Vitelogenesis have four stages distinguished by citoplasmatic accumulation of nutritive inclusions per yolk vesicles, oil droppets and yolk granules. The ovarian development is non syncrhonic typical the tropicals marines fishes.
INTRODUCCIÓN
La reproducción, es un proceso que conlleva una serie de cambios somáticos y fisiológicos, lo que se manifiesta entre otros aspectos, por el desarrollo de las gónadas y tiene su momento culminante cuando se produce el desove por medio del cual, las gónadas liberan los productos sexuales, iniciándose luego la primera etapa en la vida de toda una generación de individuos con la formación del huevo o cigote. El conocimiento de los cambios que ocurren en las gónadas a través del tiempo, es importante porque permite comprender la biología reproductiva de una especie que es un aspecto fundamental en el proceso de la evaluación de stocks, base para limitar la pesca de una población explotada a fin de cuidar que el reclutamiento futuro no disminuya a niveles que signifiquen un peligro para la estabilidad de la población (Tresierra y Culquichicón, 1993).
El proceso de maduración en los ovarios de peces se denomina ovogénesis y comprende dos fases o períodos, Previtelogénesis y Vitelogénesis que en conjunto tienen seis y ocho estadios, el número total depende de las especies y el criterio de los científicos. La ovogénesis puede ser sincrónica o asincrónica, en este último caso, pueden reconocerse diversas estadios de desarrollo y es la generalidad en los peces marinos tropicales. La ovogénesis es sincrónica cuando todos los ovocitos tienen el mismo estado de desarrollo y en consecuencia la puesta puede ser total, como es común en especies de aguas templado frías y en algunas especies de aguas dulces tropicales (Gómez, 1995).
En Venezuela, las especies de pargos del género Lutjanus, tienen gran interés comercial porque ocupan un renglón de trascendencia en las pesquerías artesanales costaneras, de media altura y altura (González, 1994). En este sentido es de primordial importancia, para su aprovechamiento óptimo, el conocimiento de su biología reproductiva, por tal motivo, se creyó conveniente llevar a cabo la presente investigación.
MATERIALES Y MÉTODOS
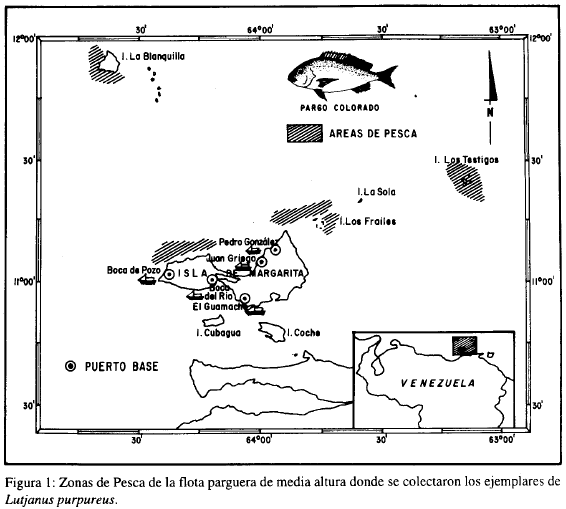
Se estudiaron las gónadas de 60 ejemplares de pargo colorado, cuyas tallas oscilaron entre 24.8 y 87.7 cm de longitud total y de 200 a 9,200 g de peso, respectivamente. Los especímenes fueron obtenidos mensualmente (junio 1984 - mayo 1985) de la pesca comercial que realiza la flota parguera de media altura en el Archipiélagos Los Testigos, Islas Los Frailes, Isla La Blanquilla y el norte de la Península de Macanao, cuyos puertos bases están en la Isla de Margarita (Figura 1).
Se realizaron cortes histológicos en los ovarios, usando gónadas en distintos estados de maduración sexual. La mayor parte del material se fijó en liquido Davidson (alcohol 95%, agua de mar filtrada, formol, glicerina y ácido acético glacial en proporción de 3:3:2:1:1) y el resto en formol salino neutralizado al 5%. Las gónadas muy maduras se deshidrataron con éter monoetílico de etilen glicol, luego fueron colocadas en benceno o cloroformo y por último en parafina histológica Merck a 51°C; el resto de las gónadas se deshidrataron con alcohol n-butílico y luego fueron tratadas con paraplast de la Sherwood Medical Industries a 58°C. Se realizaron tres cortes en la parte media de la gónada con un espesor de 8 mieras, luego fueron teñidas con hematoxilina Harris Acidulada al 0.5% (C. Garvia, com. pers.). Posteriormente, se contrastaron con el colorante V.O.F. (verde luz, orange, fuscina acida), como lo indica Gutiérrez (1967).
RESULTADOS
El análisis microscópico se llevó a cabo siguiendo el criterio de las fases de crecimiento y estadios mencionados por Gómez (1980) y Groman (1982). En las hembras se evidenciaron ovocitos en primera fase de crecimiento (pre-vitelogénesis) y ovocitos en segunda fase de crecimiento (vitelogénesis); sin embargo no se observaron ovocitos en proceso de degeneración (atresia).
Previtelogénesis Ovocitos en primera fase de crecimiento o Previtelogénesis.
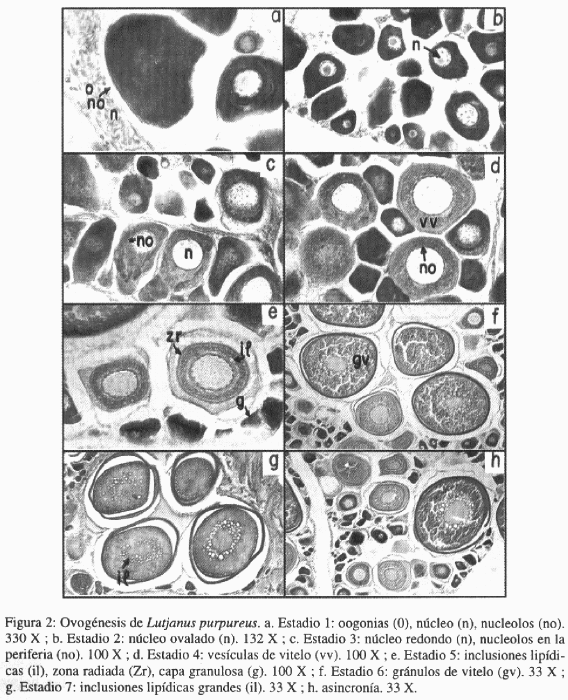
Estadio 1: Las oogonias en el epitelio germinal adquieren una coloración anaranjada. Poseen un núcleo en cuyo interior se observan nucléolos distribuidos irregularmente. Las oogonias se presentan unidas o pueden haber comenzado a aislarse. Sus células, a medida que se individualizan y aumentan de tamaño adquieren una forma alargada u ovalada y se van tornando violáceas. El diámetro varió entre 7.25 y 40.35 μ y su valor promedio fue de 15.38 ± 6.92 μ. Poseen un solo núcleo cuya tonalidad cambia de rojizo a azulado, con un intervalo de 3.22 a 19.24 μ y un diámetro promedio de 8.52 ± 4.19 μ (Figura 2a).Estadio 2: Lámela ovígera con ovocitos aislados de forma irregular, y han aumentado de diámetro, siendo su rango de 28.88 a 59.68 μ y su promedio de 47.11 ± 8.57 μ. El citoplasma es basófilo. El núcleo es ovalado, se sitúa en distintas partes del ooplasma y no presenta afinidad por los colorantes, su diámetro osciló entre 13.48 y 57.75 μ, y su promedio fue de 20.48 ± 3.78 μ. Posee varios nucléolos ovaladas y de coloración anaranjada (Figura 2b).
Estadio 3: Tanto las células como el núcleo aumentan de tamaño. El diámetro de los ovocitos presenta un rango de 57.75 a 94.33 μ y un promedio de 77.13 ± 8.89 μ. El citoplasma es basófilo; el núcleo es redondeado, su diámetro osciló entre 26.95 y 42.35 μ, con un promedio de 32.23 ± 3.81 μ. Los nucléolos migran hacia la periferia del núcleo y la pared folicular comienza hacerse visible (Figura 2c).
Vitelogénesis Ovocitos en segunda fase de crecimiento o Vitelogénesis.
Estadio 4: Los ovocitos comienzan a redondearse y siguen aumentando de tamaño. El rango fue de 78.93 a 113.58 μ, y su promedio de 99.90 ± 8.45 μ. Los nucléolos se ubican en la periferia del núcleo y como características principal del inicio de la vitelogénesis (Gómez, 1980), aparecen las vesículas de vitelo de color azul en todo el citoplasma. Por su parte el núcleo aumenta de tamaño y se sitúa en el centro del ovocito, variando su diámetro entre 38.5 a 67.38 μ y siendo su promedio de 50.78 ± 6.38 μ (Figura 2d).
Estadio 5: Aparecen las inclusiones lipídicas en la periferia del ovocito: a medida que se acercan al núcleo aumentan de tamaño, y adquieren un color claro. Se manifiesta la zona radiada como una franja de color violáceo, siendo su rango de 1.61 a 3.22 μ y su diámetro promedio de 2.20 ± 0.78 μ. La capa de la gránulosa comienza hacerse visible. En algunas células el núcleo ha quedado cubierto por las vesículas y los lípidos. Los ovocitos tuvieron un rango de 90.48 a 171.33 μ y su diámetro promedio fue 115.26 ± 22.71 μ. El núcleo aumentó su diámetro, variando entre 40.43 y 69.3 μ con valor promedio de 54.0 + 7.36 μ (Figura 2e).
Estadio 6: Los ovocitos se redondean completamente y sufren un incremento considerable en tamaño, con un rango de 263.45 a 682.2 μ y un promedio de 509.52 ± 108.12 μ. Los gránulos de vitelo se definen en todo el ooplasma; ovalados y de color anaranjado. Su diámetro osciló entre 3.85 a 11.55 μ con un promedio de 7.04 ± 1.62 μ. Las vesículas de vitelo en la mayoría de los casos, han sido desplazadas a la periferia de la célula manifestándose como una banda de color azul. Las inclusiones lipídicas son de gran tamaño y por lo general se disponen alrededor del núcleo. Su diámetro varió de 3.85 a 23.1 μ y su promedio fue de 20.69 ± 3.01 μ. El núcleo presento un rango de 94.84 a 209.41 μ y su promedio fue de 153.54 ± 34.25 μ; en muchos casos, quedaron ocultos por la proliferación de las tres inclusiones características de la vitelogénesis. Los nucléolos mantienen su posición. La zona es rojiza y aumenta su grosor, variando de 3.85 a 11.55 μ y presentando un promedio de 7.56 ± 2.18 μ. En la misma comienzan a manifestarse estriaciones perpendiculares a la superficie de ovocito. La capa de la gránulosa se hace más evidente y se observa en sus células un núcleo de color azul (Figura 2f).
Estadio 7: Los gránulos de vitelo se han fusionado y su coloración es anaranjada. Las vesículas de vitelo no se observan. Las inclusiones lipídicas se tornan más grandes debido a la fusión de los mismos, pero no se forma un cuerpo de grasa único; alcanzan un rango de 7.7 a 11.55 μ y un diámetro promedio de 26.95 ± 24.42 μ. El grosor de la zona radiada es muy notorio, su rango fue de 7.7 a 15.4 μ y su diámetro promedio de 10.90 ± 2.31 μ. Se apreció además, que la zona radiada se separa del resto de la célula formándose un espacio entre ellas, debido a la disminución del tamaño celular. El diámetro de los ovocitos estuvo comprendido entre 378.28 y 661.99 μ, y su promedio fue de 536.65 ± 76.73 μ (Figura 2g).
Se pudo observar la existencia de ovocitos en diferentes fases de desarrollo en una misma gónada, este hecho es conocido como crecimiento asincrónico (Figura 2h).
DISCUSIÓN
En el ovario menos desarrollado se hallaron cuerpos gonádicos defectuosos en su morfología que según Hastings (1981) son ovocitos sin vitelo que no poseen una capa gránulosa evidente, el núcleo pierde su organización y su contenido se deteriora, mientras que el citoplasma se fragmenta. Por otro lado, Gómez (1995) anota que los cuerpos gonádicos son ovocitos mal formados en los cuales no se observa el núcleo, y que han sido encontrados en especies hermafroditas metagóneos cuando van a cambiar de sexo, en hermafroditas sincrónicos y en algunos casos, en especies de sexo separados con gónadas poco desarrolladas.
Mota - Alves (1971) encontró en ovarios de L. purpureus ovocitos en primera y segunda fase de crecimiento e inclusive ovocitos atrésicos; éstos últimos, no pudieron apreciarse en el presente trabajo. También, es de señalar la presencia de diversos nucléolos dispersos en el núcleo de las oogonias, característica observada en la misma especie en el nordeste de Brasil por Mota -Alves (1971) y en otros peces (Ginzburg, 1972; Treasurer y Holliday, 1981).
Una de las características principales de los ovocitos en primera fase de crecimiento, es la migración de los nucléolos hacia la periferia del núcleo, pudiendo llegar a situarse en estadios más avanzados de manera irregular (Wallace y Selman, 1981). En los ovocitos de L. purpureus los nucléolos se disponen hacia la periferia del núcleo a finales de la primera fase de crecimiento y se mantienen en esta posición durante la segunda fase. Esta fase se inicia con la aparición de las vesículas de vitelo conociendo con lo apuntado por Wallace y Selman (1981).
Durante la ovogénesis el contorno de la célula epitelial (gránulosa) suministra a las células ovígeras en desarrollo, una gran cantidad de material alimentario almacenado en forma de proteína granular y grasa comúnmente en forma de gotitas de aceite (Lagler et al., 1977). Según Isaac - Nahum et al., (1983), en la vitelogénesis el citoplasma acumula dichas sustancias de reserva para la futura alimentación del embrión. En L. purpureus, numerosas células de la gránulosa se presentan alrededor de los ovocitos pertenecientes a los estadios 5, 6 y 7 de la segunda fase de crecimiento, así como también, en el interior de los folículos vacíos de los ovarios desovados.
En la mayoría de los peces, la zona radiada ha sido descrita como una membrana primaria originada por el ooplasma que protege los óvulos de influencias externas. Además, posee estriaciones radiales a través de las cuales penetran sustancias nutritivas para el crecimiento del ovocito (Ginzburg, 1972).
Mota - Alves (1971) encontró ovocitos en estado de atresia en L. purpureus; Isaac - Nahum et al., (1983) mencionaron que la ocurrencia de ovocitos atrésicos es un fenómeno que posee causas diversas tanto exógenas como endógenas. Yamamoto y Yamazaki (1961) apuntaron que la presencia de un gran número de células atrésicas es un rasgo característico de ovarios de peces con desarrollo asincrónico. La primera manifestación de este proceso histológico es la disminución de la turgencia celular, debida probablemente a la pérdida de agua (Isaac - Nahum et al., 1983); el mismo fenómeno se observó en el estadio 7 del presente estudio, disminución del tamaño y falta de consistencia celular.
Desde el punto de vista metodológico, ha de señalarse que la falta de coincidencia en el tamaño del ovocito maduro en los análisis macroscópico y microscópico de los estadios 6 y 7 de la ovogénesis se debe, posiblemente, a que no fueron utilizados los mismos ejemplares; sugiriéndose por lo tanto, emplear las mismas gónadas. Además es conveniente manejar un mayor número de especímenes, para establecer con mejor precisión la madurez sexual en todas sus fases.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento al Consejo Nacional de Investigaciones Científicas y Tecnológicas (CONICIT), por el financiamiento para la realización de esta investigación, como parte integral del Proyecto SI -1483. A los profesores Fernando Cervigón y Alfredo Gómez por la revisión y sugerencias hechas al manuscrito. A los Técnicos del FONIAP - Porlamar y al señor Efigenio Velásquez, por su ayuda en los muestreos de campo y laboratorio. A la memoria del señor Carlos Garvía (Q.E.P.D) por su destacada labor en la histología e inmejorables tomas fotográficas. A la srta. Haydeé Hernández, del CONICIT - Nueva Esparta y a Walter González Jr. por el trabajo mecanográfico. Al señor Pablo Rodríguez, por la diagramación de las figuras.
BIBLIOGRAFÍA
1 Ginzburg, A. S. 1972. In: Fertilization in fishes and the problem of polyspermy. T. A. Detlaf (Ed.). Israel Program for Scientific Translation Jeruzalen, 366 p. [ Links ]
2 Gómez, A. G. 1980. Estudios sobre la reproducción de pámpanos. Ovogénesis y fecundidad de Trachinotus godeei, confinado en estanques. Trabajo de Ascenso. Univ. Oriente, Núcleo de Nueva Esparta, Boca del Río, Venezuela, 35 p. [ Links ]
3 Gómez, A. G. 1995. Desarrollo gonadal y sexualidad de peces teleósteos. Saber, 7(2): 7-17. [ Links ]
4 González L. W. 1994. Análisis de la pesquería del pargo en Venezuela. Trabajo de Ascenso. Univ. Oriente, Núcleo de Nueva Esparta, Boca del Río, Venezuela, 93 p. [ Links ]
5 Groman, B. D. 1982. Histology of the stripped bass. American Fisheries Society, Monograph No 3, Maryland, 116 p. [ Links ]
6 Gutiérrez, M. 1967. Coloración histológica para ovarios de peces, crustáceos y moluscos. Investigación Pesquera, 31(2): 265-271. [ Links ]
7 Hastings, P. A. 1981. Gonad morphology and sex succesion in the protogynous hermaprodite Hemanthias vivanus (Jordan and Swain). J. Fins. Biol., 18: 443-454. [ Links ]
8 Isaac-Nahum, V. J.; A. E. A. de M. Vazzoler y E. M. Zanetti - Prado. 1983. Estudio sobre estructura, ciclo de vida y comportamiento de Sardinella brasilensis (Steindachner, 1879), na area entre 22 SE 285 Brasil. 3. Morfología e histología de ovarios y escala de maturidade. Bol. Inst. Oceanogr., Sao Paulo, 32(1): 1-16. [ Links ]
9 Lagler, K., J. Bardach, R. Miller y D. M, Passino. 1977. Ichthyology. John Wiley e Sons, Edition, New York, 506 p. [ Links ]
10 Mota-Alves, M. L. 1971. Sobre a maturacao sexual do pargo Lutjanus purpureus Poey, do nordeste Brasileiro. Arq. Cien. Mar., 11(2): 153-158. [ Links ]
11 Treasurer, J. W. y F. G. Holliday. 1981. Some aspects of the reproductive biology of Perch, Perca fluviatilis L, A histological description of the reproductive cycle. J. Fish. Biol., 18(3): 359-376. [ Links ]
12 Tresierra, A. y Z. Culquichicón. 1993. Biología Pesquera. Ed. Libertad G.I.R.L, CONCYTEC, Trujillo, Perú, 432 p. [ Links ]
13 Wallace, R. A. y K. Selman. 1981. Cellular and dynamic aspects of oocyte growth in teleost. Amer. Zool., 21(2): 235-343. [ Links ]
14 Yamamoto, K. y F. Yamazaki. 1961. Rhythm of development in the oocyte of the old - fish, Carassius auratus. Bull. Fac. Fish. Hokkaido Univ., 12(2): 93-101. [ Links ]
FECHA DE RECEPCIÓN: 20/07/1996 FECHA DE ACEPTACIÓN: 22/07/1997