Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.30 no.1 Santa Marta Jan./Dec. 2001
EFECTO DE LAS CONDICIONES DE TRANSPORTE, RECEPCIÓN, ACLIMATACIÓN Y SIEMBRA DE NAUPLIOS DE LITOPENAEUS VANNAMEI (BOONE, 1931) SOBRE LA SOBREVIVENCIA EN LARVICULTURA.
EFFECT OF TRANSPORT, RECEPTION, ACLIMATATION AND SOWING OF NAUPLII LITOPENAEUS VANNAMEI (BOONE, 1931) UPON LARVAE CULTURE SURVIVAL.
Jorge A. Suárez1, Alberto García1, Federico Newmark2 y Regis Bador3
1 Corporación Centro de Investigación de la Acuicultura de Colombia, CENIACUA, Calle del Curato No. 38 - 49 , Cartagena, Colombia. E-mail: ceniacua@ctgred.net.co (J.A.S.). Atlantis, Brasil. E-mail: atlantis@atlantis.com.br (A.G.).
2 Instituto de Investigaciones Marinas y Costeras (INVEMAR), A.A. 1016, Santa Marta, Colombia. E-mail: fnewmark@invemar.org.co (F.N.).
3 Instituto de Investigaciones Marinas y Costeras (INVEMAR), A.A. 5098, Cartagena, Colombia. E-mail: rbador@cartagena.cetcol.net.co (R.B.).
RESUMEN
Con el objeto de determinar los factores iniciales que pueden afectar la sobrevivencia de postlarvas de camarón durante el proceso de larvicultura, se muestrearon tres laboratorios ubicados en la costa Atlántica de Colombia, cubriendo 71 lotes de nauplios en un período de 10 meses durante 1996. Para cada lote de nauplios se hizo seguimiento de variables cualitativas (origen, modo de transporte, presencia de bacterias en el agua de transporte) y variables cuantitativas (tiempo y densidad de transporte, características de la calidad del agua, proporciones de cada estadío y deformidad de los nauplios). Las variables calidad del agua y densidad (nauplios/l) se evaluaron durante los procesos de empaque, transporte, recepción, aclimatación y siembra de los nauplios en finca. Para evaluar la relación entre las variables cualitativas y la sobrevivencia en larvicultura, se hizo un análisis de varianza de varios factores, mientras que para las variables cuantitativas se desarrolló un modelo de regresión múltiple. Las variables con influencia significativa (P<0.05) sobre la sobrevivencia en larvicultura fueron el modo de transporte (en avioneta con sobrevivencia promedio de 45%, contra 35% en aeronave comercial presurizada), la presencia de bacterias (crecimiento en medio T.C.B.S.) en el agua de transporte de los nauplios (sobrevivencia sin dichas bacterias del 59% contra 40% con ellas) y el porcentaje de nauplios deformes. Adicionalmente, se observó que la presencia específica de bacterias como Vibrio metschnikovii, Flavobacterium spp. y Alcaligenes spp. en el agua de transporte de los nauplios aumenta la mortalidad en larvicultura.
Palabras claves: L. vannamei, nauplio, calidad, bacteria, transporte.
ABSTRACT
In order to identify initial factors that can affect shrimp postlarvae survival during larval rearing, three larval rearing facilities from the Caribbean coast of Colombia were sampled for 71 nauplii batches during 10 months of 1996. For each batch, qualitative variables (origin, transportation mode, presence of bacteria in transport water) and quantitative variables (transportation time and density, physicochemical parameters of the water, proportion of each nauplii stage and of deformed nauplii) were monitored. Water quality and density (nauplii/l) variables were monitored during the whole process of nauplii packing, transport, reception, acclimatization and stocking. To evaluate the relationship between qualitative variables and larval rearing survival, a multiple factor variance analysis was run, while, for quantitative variables, a stepwise multiple regression model was developed. Variables with significative (P<0.05) influence on larval rearing survival were the transportation mode (with small private aircraft, average survival was 45%, compared to 35% with a pressurized commercial aircraft), the presence of bacteria (growing on T.C.B.S. media) in nauplii transport water (survival without these bacteria in water was 59% compared with 40% when these bacteria were observed) and the percentage of deformed nauplii. Furthermore, the specific presence of bacteria like Vibrio metschnikovii, Flavobacterium spp. and Alcaligenes spp. in nauplii transport water was a worsing factor.
Key words: L. vannamei, nauplii, quality, bacteria, transport.
INTRODUCCION
La cría comercial de camarones comprende tres divisiones productivas: laboratorios de maduración, laboratorios de larvicultura y engorde en fincas. En la maduración, se llevan a cabo los cruces y desoves de reproductores con el fin de producir nauplios. Los nauplios son transportados a Laboratorios de Larvicultura para realizar la cría larvaria desde Nauplio I hasta Postlarva 10 ( PL10 o semilla). Finalmente, las semillas son trasladas a fincas donde se mantienen hasta que alcancen el tamaño comercial (16 g aprox.).
En los laboratorios de larvicultura de camarón, la sobrevivencia de las larvas es un resultado esencial para el éxito de dicha actividad. En general, esta sobrevivencia se calcula a partir del número de nauplios sembrados en los tanques y se considera como normal cuando su valor promedio es del orden del 50 %, entre nauplios y postlarvas de tamaño comercial (Wyban y Sweeney, 1991, Martínez y Torres en Rodríguez et al., 1995).
Sin embargo, se observa siempre una amplia variación en los porcentajes de sobrevivencia entre tanques de un mismo laboratorio y en la misma época del año, así como entre laboratorios diferentes en una misma época o entre diferentes épocas del año. En algunos casos, estas variaciones de la sobrevivencia corresponden a cambios ambientales que se producen estacionalmente y que raramente han sido explicados científicamente (Bray y Laurence, en Fast y Lester; 1992, Liao, en Fast y Lester, 1992).
El medio de cultivo en larvicultura (el agua en los tanques, bombeada desde el mar), la mayoría de los insumos (las microalgas y los nauplios de Artemia) y las propias larvas son fuentes de variación natural, por tratarse de materiales biológicos. A estas posibles variaciones de origen biológico, se suman las rutinas de manejo estandarizadas, comúnmente usadas en los laboratorios de larvicultura a nivel mundial (Bray y Laurence, in Fast y Lester, 1992).
Las causas de mortalidad son muy difíciles de identificar. La escasez de semilla de camarón puede representar pérdidas graves tanto para los laboratorios como para las fincas. Solucionar estos problemas en forma inmediata es casi imposible, pero es fundamental lograr identificar esta(s) causa(s) con el fin de aplicar las medidas preventivas pertinentes. Por lo tanto es importante diferenciar entre la influencia de la calidad de los nauplios y de la calidad de las condiciones de manejo en larvicultura en la sobrevivencia final. En efecto, si el problema proviene de los nauplios, de nada sirve intentar buscar soluciones en el proceso de larvicultura. Estas pueden conducir a modificaciones indiscriminadas de los protocolos de producción, desestabilizando el manejo del sistema de producción. Al contrario, si la calidad de los nauplios no puede explicar ciertos problemas sufridos, la búsqueda de causas y soluciones debe enfocarse de inmediato hacia las condiciones de manejo en la larvicultura.
El presente trabajo se enfocó en tratar de diferenciar la influencia de la calidad de los nauplios y sus condiciones de siembra y cultivo en finca, sobre la sobrevivencia final de las larvas, en tres laboratorios de larvicultura del Caribe colombiano durante 10 meses del año 1996.
MATERIALES Y METODOS
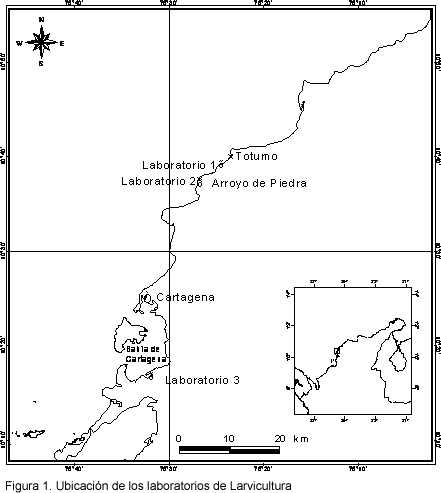
Los muestreos se realizaron en tres laboratorios de larvicultura ubicados en tres sitios suficientemente distantes para tener fuentes de agua a-priori diferentes. Uno se halla ubicado en el corregimiento de Loma Arena a 45 km de Cartagena. El otro, en el corregimiento de Arroyo Hondo, a unos 25 km al norte de Cartagena; y otro en la Isla de Barú a unos 15 km al sur de la ciudad de Cartagena (Figura 1).
Todos los laboratorios comerciales de larvicultura en Colombia trabajan con la especie Litopeneaus vannamei (Boone, 1931). Las larvas son mantenidas por tres meses pasando por doce estadios, desde nauplii hasta PL12, luego son transportadas en bolsas plásticas y lleva
das por vía aérea a las fincas en donde se reciben, aclimatan y siembran.
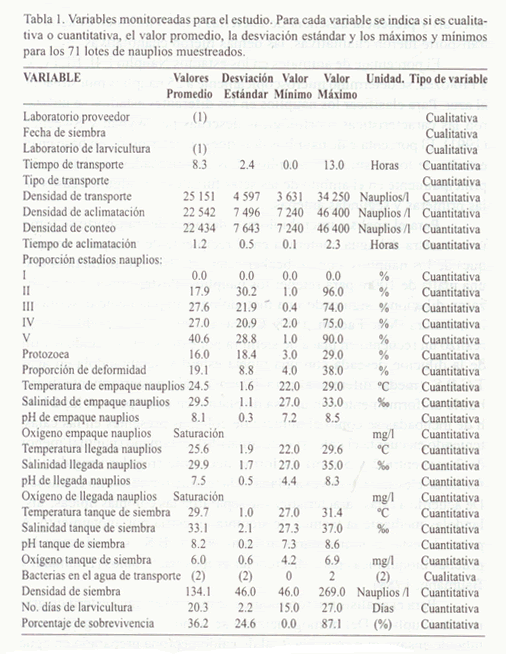
Se realizó un monitoreo de todos estas etapas de enero a octubre de 1996. En total se muestrearon y siguieron 71 lotes de nauplios, 27 se sembraron en el laboratorio 1, 21 en el laboratorio 2 y 23 en el laboratorio 3. De cada lote se evaluaron 30 variables (Tabla 1) para intentar describir: (1) origen (nacidos de reproductores silvestres o de maduración, identificación de la empresa proveedora de los nauplios), condiciones de empaque reportadas por el proveedor (calidad fisicoquímica del agua), (3) condiciones de transporte (modo de transporte (avioneta, areonave comercial), densidad (nauplios/l), tiempo, calidad fisicoquímica y bacteriológica del agua de transporte a su llegada al laboratorio de larvicultura), (4) las condiciones de aclimatación (densidad y tiempo), (5) densidad (nauplios/l) de salida del laboratorio y de llegada a la finca, (6) condiciones de siembra (calidad fisicoquímica y bacteriológica del agua y densidad de nauplios) y (7)
características de los nauplios (proporción de los diferentes estadíos de nauplios, proporción de deformidad y calidad bacteriológica de un macerado de nauplios). Las variables origen (laboratorio proveedor, laboratorio de larvicultura), modo de transporte (avioneta, avión comercial) y presencia/ausencia de bacterias (tipo Vibrio) en el agua de transporte fueron cualitativas, las demás fueron cuantitativas.
El porcentaje de animales en los estadíos Nauplio I, II, III, IV, V y Protozea, se determinó microscópicamente a 25 nauplios muestreados al azar. Para clasificar los nauplios en los diferentes estadíos se utilizaron las características morfológicas descritas por Wyban y Sweeney (1991). El porcentaje de nauplios deformes se determinó con base en el estudio de los mismos 25 nauplios. Las deformidades se observaron principalmente en el ámbito de las setas furcales y en algunos casos en las primeras y segundas antenas.
Para el análisis microbiológico del agua de transporte se tomó una muestra del agua contenida en el recipiente de transporte (empaque) de los nauplios, con un beaker estéril de 100 ml, filtrándola con una malla de 100m para retener los nauplios. Posteriormente se realizaron diluciones siguiendo una metodología ampliamente descrita en la literatura (Mac Faddin, 1988, Carvaca, 1990). De cada dilución se realizó un recuento en placa de siembra por extensión, tomando 0.1 ml de la dilución deseada con una pipeta estéril y sembrándola en agar T.C.B.S. (medio diferencial para Vibrios), para posteriormente distribuirla uniformemente con un asa de platino en cajas petri. A las 24-48 h de incubadas se contó el número de colonias presentes en las cajas, teniendo en cuenta el color (verde/amarillo), el tamaño (puntual/menor de 2 mm/entre 2 y 5 mm), la forma del borde (regular/irregular), la forma de elevación (convexa/plana) y la textura (cremosa/no cremosa). De acuerdo a estas características se separaron las colonias típicas, aislándolas mediante la técnica de siembra en estría por agotamiento. A partir de estas colonias puras aisladas en T.C.B.S., se realizaron las pruebas bioquímicas para diferenciar grupos bacterianos (Baumann y Baumann, 1988).
Para el análisis microbiológico se maceró en agua estéril un gramo de nauplios. Del homogeneizado se tomó 1 ml y se agregó a un tubo de ensayo que contenía 9 ml de caldo peptona preparado en agua de mar. El procedimiento de diluciones, conteo e identificación bacteriana fue el mismo que el descrito anteriormente para el análisis microbiológico del agua de transporte (Mac Faddin, 1988, Carvaca, 1990)
En cuanto a las condiciones de conteo, se tuvo en cuenta la densidad de conteo (nauplios / l) y la diferencia eventual entre la densidad de salida del laboratorio y la densidad de llegada a la finca. El primero mide el grado de confinamiento en el momento del conteo de los nauplios y el segundo permite cuantificar la diferencia en número de nauplios entre lo enviado por el laboratorio (proveedor) y lo registrado por la finca (comprador). Para contribuir a un muestreo y conteo confiable y representativo del número total de nauplios, es importante conocer el volumen exacto de los recipientes utilizados en el sistema de muestreo y conteo, homogenizar el contenido con aireación moderada y tomar al azar, aproximadamente 6 muestras en diferentes sitios del recipiente de conteo con una pipeta de 1 ml; finalmente se calcula el promedio de conteo de las 6 muestras y se multiplica por el volumen de agua del recipiente de conteo para obtener el número de nauplios aproximado que se encuentran en el recipiente.
Todas las actividades relacionadas con la observación y/o medición de las variables fueron realizadas por el mismo personal y con los equipos propios de CENIACUA: un conductímetro para la salinidad y la temperatura, un pHmetro para el pH y un oxímetro para el oxígeno disuelto, todos de marca YSI.
Es importante resaltar que el manejo específico de la larvicultura de cada lote se realizó según las normas de cada laboratorio, ajustadas a la situación del momento por el personal profesional de cada laboratorio en forma independiente.
Para cada uno de los lotes, se tomó como resultado de sobrevivencia la relación entre el número de nauplios sembrados y el número de postlarvas vivas al momento de la cosecha. Este proceso de larvicultura dura aproximadamente 10 días para alcanzar el estado de postlarva. Luego se sigue la cría hasta un estadío de mayor resistencia a los procesos estresantes de cosecha, conteo y empaque en laboratorios y transporte y siembra en piscinas camaroneras. Para nombrar las larvas, se cuentan los días desde la siembra ("PL8" es una postlarva que lleva 8 días como postlarva, es decir 18 días desde su nacimiento). En Colombia generalmente se comercializan las postlarvas entre PL8 y PL12.
Para estudiar la relación entre la sobrevivencia y las variables cualitativas se utilizó el Análisis de Varianza con varios factores, verificando previamente la normalidad de la variable de análisis con una prueba de Simetría y Curvatura. Las relaciones de dependencia entre la sobrevivencia y las variables cuantitativas se analizó a través de un modelo de Regresión Múltiple, construido por selección de modelos con la opción "Stepwise". Para el modelo definitivo se verificó el supuesto de independencia de los residuales con el estadístico de Durbin-Watson. El procesamiento de los datos se hizo a través del programa Statgraphics plus 5.2 ®.
RESULTADOS
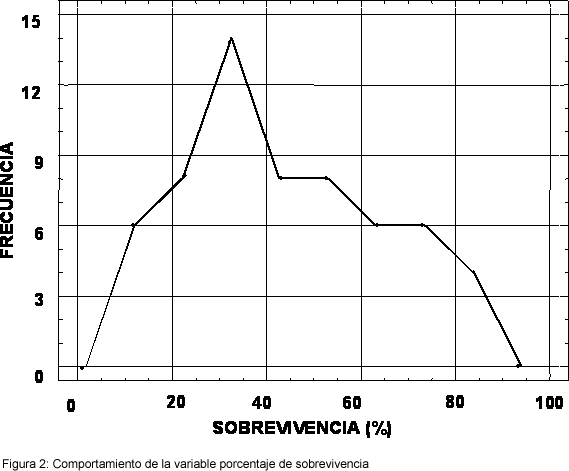
El comportamiento de la variable de análisis de los datos, que se aprecia en la Figura 2, permite suponer la Normalidad. Este supuesto además se verificó por medio de una prueba de Simetría y Curvatura que produjo valores de Y1=0.7047 y Y2=-0.928 para los estadísticos respectivos. Por lo tanto se aceptó la hipótesis de Normalidad con un nivel de significancia del 5%.
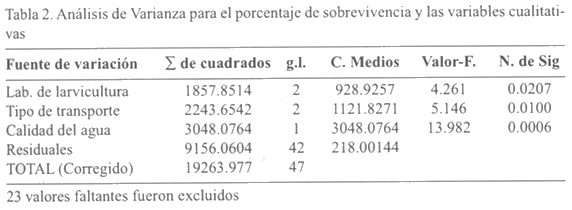
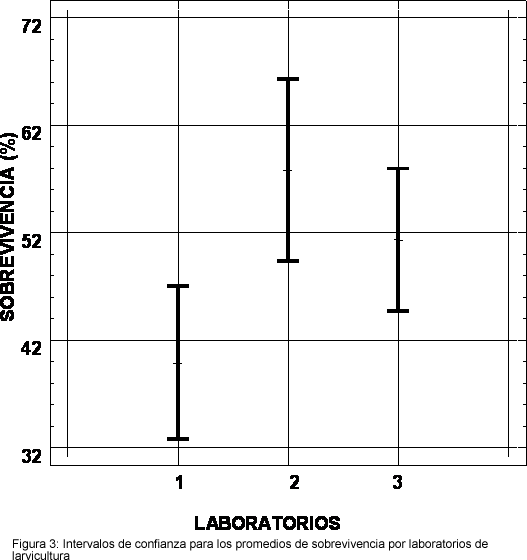
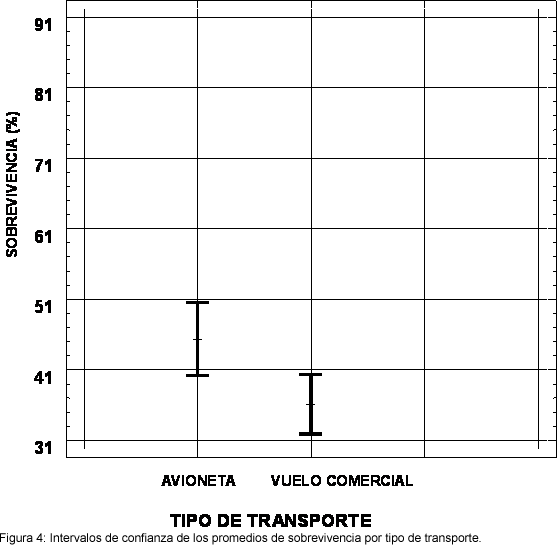
Un resumen descriptivo del comportamiento de las variables para los 71 lotes de nauplios muestreados se consigna en la Tabla 1. Todas las variables cualitativas (el laboratorio de larvicultura de donde proceden las larvas, el tipo de transporte utilizado para los nauplios y la presencia/ausencia de bacterias en el agua de transporte) se comportan como factores que influyen en la sobrevivencia a un nivel de significancia menor del 5%. La cuantificación de la relación de dependencia entre la sobrevivencia y las variables cualitativas se resume en la siguiente tabla de Análisis de Varianza (Tabla 2). Dentro de los laboratorios de larvicultura, las diferencias en sobrevivencia (P<0.05) se dieron significativas entre el laboratorio codificado 1 y los otros dos (Figura 3). En relación con el tipo de transporte, analizando solamente los 65 lotes del mismo origen geográfico, se obtuvo una diferencia significativa favorable (P<0.05) en sobrevivencia con el uso de avioneta en comparación con el uso de una aerolínea comercial (Figura 4).
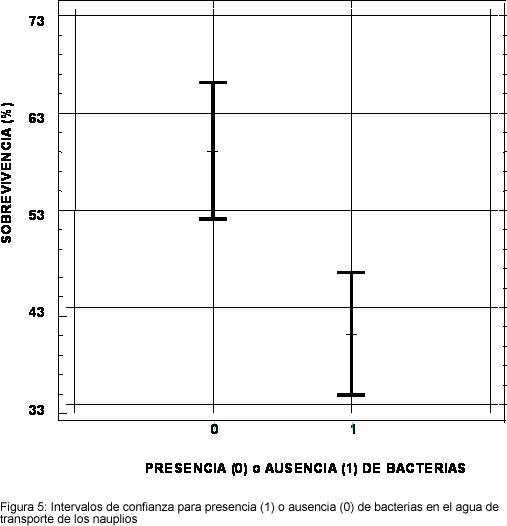
La presencia de bacterias en el agua de transporte de los nauplios a su llegada se mostró también como un elemento que influye en forma negativa (P<0.05) en la sobreviencia de las larvas. La sobrevivencia promedio de los lotes de nauplios transportados en agua sin bacterias (que crecen en T.C.B.S.) fue mayor en un promedio de 19% en comparación con el porcentaje de sobrevivencia de los nauplios transportados en agua con presencia bacteriana (Figura 5). Las bacterias presentes en el agua de transporte de nauplio, cuando se presentaron sobrevivencias por debajo de un 20% fueron identificadas como Vibrio metschnikovii, Flavobacterium spp. y Alcaligenes spp.
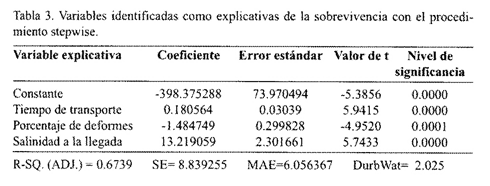
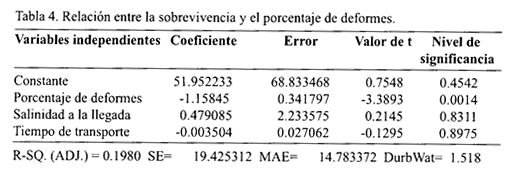
En cuanto a las variables cuantitativas, el procedimiento de selección de modelos, opción "Stepwise", identificó 3 posibles variables explicativas de la sobreviencia: el tiempo de transporte, el porcentaje de deformación y la salinidad del agua de transporte de los nauplios a su llegada (Tabla 3). Sin embargo, el modelo de regresión con las tres variables sugeridas por el procedimiento "Stepwise" mostró que solamente una de las variables cuantitativas, el porcentaje de deformes, tuvo una influencia significativa (P<0.05) en la sobrevivencia de las larvas y explicó el 19.8% de la variación de esta variable (Tabla 4).
DISCUSION
El hecho de que muchas de las variables monitoreadas en el proceso de larvicultura, transporte y siembra de nauplios de camarón no mostraron una contribución significativa a las grandes variaciones de sobrevivencia demuestra que todas estas variables generalmente se manejaron en el intervalo adecuado para evitar malas sobrevivencias (Tabla 1). De la misma manera, la calidad bacteriológica de los macerados de nauplios (que se mostraron colonizados por Vibrio fluvialis, V. parahaemolyticus, V. alginolyticus, V. carchariae, V. damsela, V. mimicus, V. cincinnatiensis, V. vulnificus, V. peligus, V. splendudus II, Beneckea spp., Pseudomonas spp., Plesiomona shigelloide) no mostró influencia. En este mismo sentido, el origen de los reproductores (silvestres o de maduración) no mostró una influencia sistemáticamente desfavorable sobre el resultado de larvicultura.
Por otro lado, el laboratorio donde se reciben los nauplios y se los crían hasta postlarvas mostró que puede influir sobre el resultado de sobrevivencia de la larvicultura. Este resultado indica que algunos laboratorios logran en rutina un promedio de sobrevivencia menor a la obtenida en otros, sin importar el origen de los nauplios. En el caso del laboratorio 1 la sobrevivencia promedio fue del 40%, en comparación con el 58% y el 51% de los laboratorios 2 y 3 respectivamente. Eso puede ser debido a la diferencia en la calidad del agua bombeada y condiciones ambientales del mismo laboratorio. Sin embargo la salinidad no mostró ser un factor determinante.
Adicionalmente, el manejo aplicado a la larvicultura puede influir. Dicho manejo no es la sola decisión de la densidad de siembra, por lo que esta densidad, en el rango de 46 a 290 nauplios/litro no mostró influencia significativa sobre la sobrevivenvia en el presente estudio. En el manejo está un conjunto de factores y decisiones como la frecuencia y la duración de los secados sanitarios, la forma y la frecuencia de los recambios de agua, el modo y los tipos de alimentación, y muchos otros. Por lo anterior, para evaluar un resultado puntual de sobrevivencia en cualquier laboratorio de larvicultura, es recomendable compararlo con el historial del mismo laboratorio.
En cuanto al tipo de transporte, parece sorprendente que el uso de avioneta tenga una influencia tan favorable sobre la sobrevivencia en comparación con los vuelos comerciales: 45% contra 35%. Entre las diferencias notables entre ambos está la no presurización de la cabina de las avionetas que se ha considerado como un factor de riesgo adicional de bolsas reventadas. Sin embargo, es posible que la atención y la manipulación más directa de la cajas por personal involucrado en la camaronicultura contribuya a este buen resultado de las avionetas. Además, las avionetas permiten vuelos directos y trámites de exportación/importación más rápidos. Nuevamente, es probablemente un conjunto de factores que contribuye a favorecer el uso de avionetas. Esta conclusión no se debe generalizar cualquiera que sean las condiciones, pero en Honduras, se ha reportado el mismo resultado.
La influencia de la presencia de bacterias que crecen sobre T.C.B.S. en el agua de transporte de los nauplios es notable: sin estas bacterias, se ha podido obtener una sobrevivencia promedio del 59%, contra 40% con bacterias. Este resultado es una contribución muy importante al éxito de un laboratorio y corresponde a un incremento del 47.5% en su producción. El tiempo del transporte fue identificado como una posible variable explicativa en la primera etapa del análisis estadístico, lo que coincide con la influencia del tipo de transporte, es decir, que las avionetas permiten operaciones más directas, personalizadas y rápidas. Del modelo final de regresión quedó solamente el porcentaje de deformes como variable cuantitativa explicativa de la sobrevivencia en larvicultura.
CONCLUSIONES Y RECOMENDACIONES
A partir de los datos reunidos y analizados en tres laboratorios de larvicultura colombianos durante 10 meses con nauplios de seis orígenes diferentes, se ha podido identificar que, en las condiciones específicas analizadas de transporte y manejo de la siembra de los nauplios, existe una variable muy importante que puede influir sobre la sobrevivencia en larvicultura mientras está bajo la responsabilidad del proveedor: la calidad bacteriológica del agua de transporte de los nauplios. El transporte y la entrega de nauplios en agua libre de bacterias que crecen en T.C.B.S. es una condición importante para obtener buenas sobrevivencias en larvicultura (superiores al 40%). Con base a lo anterior, y a partir de los principios de HACCP (Otwell y Flick, 1995), se recomienda un monitoreo de la calidad bacteriológica del agua de lavado y empaque de los nauplios en las facilidades de los laboratorios de larvicultura proveedores.
Según observaciones precisas, la presencia específica de bacterias como el Vibrio metschnikovii, Flavobacterium spp. y Alcaligenes spp. en el agua de transporte de los nauplios es un factor causante de bajas sobrevivencias. Sin embargo, se debe reconocer que cada laboratorio de larvicultura tiene sus especifidades, de calidad de agua, como de manejo. Por lo tanto, cuando se requiere evaluar un resultado puntual de sobrevivencia en un laboratorio dado, se recomienda compararlo en primer lugar con sus datos históricos.
Adicionalmente, el transporte directo y contratado específicamente para los nauplios contribuye a obtener mejores sobrevivencias. Aunque el nauplio es el estadío de desarrollo del camarón más fácil de transportar, el presente trabajo indica que una mayor atención y agilidad puede contribuir a maximizar su sobrevivencia en larvicultura, principal factor de rentabilidad de un laboratorio de larvicultura.
En cuanto a variables cuantitativas, el presente trabajo confirmó que uno de los criterios más representativos del potencial de sobrevivencia de un lote de nauplios es el porcentaje de deformes. En situaciones de escasez, no se tratará necesariamente de aceptar o rechazar un lote de nauplios a partir de esta información, sino de anticipar y programar cuál nivel de sobrevivencia se podrá obtener, y así facilitar la programación de las ventas de postlarvas.
Estas recomendaciones no pretenden resolver todos los problemas con el solo control de estas variables. Sin embargo, manteniendo las demás variables en los niveles adecuados y dando mayor atención al modo de transporte y a la calidad bacteriológica del agua de transporte se podría generar un mayor éxito de los laboratorios de larvicultura. El porcentaje de deformes y el propio historial del laboratorio podrán contribuir a mejorar la programación de la producción de las postlarvas.
AGRADECIMIENTOS
Los autores quieren agradecer a todas las empresas que permitieron la realización de este trabajo, facilitando el acceso a sus instalaciones y sus datos. Igualmente al Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología (COLCIENCIAS), entidad que hizo un aporte financiero determinante para su culminación. A las Biólogas Myriam Arévalo y María Fernanda Virgües por su colaboración constante y eficaz en el cumplimiento de los objetivos de este estudio. Los autores quieren también agradecer a Hernando Hurtado, Profesor de la Universidad del Quindío, por su participación en el análisis estadístico de los datos del presente trabajo.
BIBLIOGRAFIA
1 Bauman, R.H., y E.D.Scura. Sin fecha. Determining the quality of Penaeus monodon. postlarvae. Aquatic Farm Ltd., Hawaii. [ Links ]
2 Baumann y Baumann., 1988. Manual of Systematic Bacteriology. Vol 1. Baltimore. [ Links ]
3 Bernier, I. 1996. Curso introductorio de microbiología aplicada en laboratorios de larvicultura. Ivonne Bernier Laboratorio, Santafé de Bogotá, Colombia, 55 p. [ Links ]
4 Bray, W.A., y A.L. Laurence. 1992. Reproduction of Peneaus Species in Captivity. in Fast, A.W., y L.J. Lester. Marine shrimp culture: principles and practices. pp: 93-170. [ Links ]
5 Carvaca F., 1990. Manual práctico de bacteriología marina. ESPOL, Guayaquil, Ecuador, 78 p. [ Links ]
6 Fegan, D.F.; A. Nietes; T. Flegel; S. Rojsowan; y M. Waiyakhruttha. 1993. The development of a method for determining the quality of post-larvae of Penaeus monodon (Fabricius). Aquastar Laboratories Ltd., Asian Institute of Technology y. Dept. Biotechnology/Mahidol University, Bangkok, Thailandia. [ Links ]
7 Liao, I.C. 1992. Penaeid Larviculture: Taiwanese method. in: Fast, A.W., y L.J. Lester. Marine shrimp culture: principles and practices, Elsevier, Amsterdam. [ Links ]
8 Mac Faddin, J.F. 1988. Pruebas bioquímicas para la identificación de bacterias de importancia clínica. Editorial Panamericana, Buenos Aires, Argentina, pp: 233-238 [ Links ]
9 Martínez, L. y M. Torres. 1995. Producción de semilla de camarones penaeidos en laboratorio. 21-60. in: Rodríguez H., Polo G. y O. Mora. 1995. Fundamentos de Acuicultura marina. INPA, Santa fe de Bogotá, Colombia, 225 p. [ Links ]
10 Ogle, J.T., K. Beaugez y J.M. Lotz, 1990. Effects of salinity on survival and growth of postlarva Penaeus vannamei. Ocean Springs, Mississippi, 8(4): 415-421. [ Links ]
11 Otwell, W.S. y J.F. Flick, 1995. A HACCP program for raw, cultured penaeid shrimp. In: Browdy. C.W. y J.S. Hopkins (Eds.) Swimming through troubled water. World Aquaculture Society, Baton Rouge, LA, USA, 218-226. [ Links ]
12 Rosenberry, R. 1998. World Shrimp Farming 1998. Una publicación anual de Shrimp News International, San Diego, CA, USA, 328 p. [ Links ]
13 Vallejo, A. 1997. Estudio Epizootiológico de Penaeus vannamei en tres fincas del Caribe Colombiano.Tesis M.Sc. Biol. Mar., Univ. Nal. de Colombia, Santa Marta, Colombia, 39 p. [ Links ]
14 Wyban, J.A. y J.N. Sweeney. 1991.The Oceanic Institute Shrimp Manual. The Oceanic Institute, Honolulu, Hawaii, 158 p. [ Links ]
FECHA DE RECEPCION: 28/04/1998 FECHA DE ACEPTACION: 12/02/2001