Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.30 no.1 Santa Marta Jan./Dec. 2001
INCIDENCIA DE LA DEPREDACIÓN POR PECES EN CORALES PÉTREOS DE CUATRO ATOLONES DEL ARCHIPIÉLAGO DE SAN ANDRÉS Y PROVIDENCIA (CARIBE COLOMBIANO)
INCIDENCE OF FISH PREDATION ON STONY CORALS AT FOUR ATOLIS OF THE ARCHIPELAGO OF SAN ANDRES AND PROVIDENCIA (COLOMBIAN CARIBBEAN)
Jaime Garzón-Ferreira1 y María Catalina Reyes-Nivia 2
1 Instituto de Investigaciones Marinas y Costeras (INVEMAR), A.A. 1016, Santa Marta, Colombia, e-mail: jgarzon@invemar.org.co (J.G.-F.).
2 Cra.32 # 30-87, Edif. Liliana, Apto. 401, Palmira, Colombia, e-mail: macata@terra.com (M.C.R.-N.).
RESUMEN
A partir de datos registrados en 1994 y 1995 durante un estudio de línea de base llevado a cabo en cuatro atolones del archipiélago de San Andrés y Providencia (Albuquerque, Courtown, Roncador y Serrana), se analizó la incidencia de la depredación por peces en coral vivo y su relación con la abundancia de los peces loro Sparisoma viride y Scarus vetula. De las especies de corales depredadas, Montastraea annularis y M. faveolata presentaron la mayor incidencia de depredación, con 25.9% y 18.7% respectivamente. Se encontró que no hay diferencias significativas en la incidencia de depredación entre los atolones (Kruskal-Wallis, p = 0.07). Al comparar entre unidades geomorfológicas, la laguna presentó la mayor incidencia de depredación (14.3%) e igualmente las mayores abundancias de S. viride y S. vetula, sin embargo no se encontró una relación significativa entre ambas variables. Las mayores incidencias de depredación y abundancia de loros en la laguna pueden estar asociadas con la dominancia en este ambiente del complejo Montastraea spp., puesto que dichos corales se han reconocido como los sustratos de pastoreo preferidos por estos peces loro. La depredación por peces, sumada a los demás factores de deterioro presentes en los atolones, probablemente ha contribuido a la degradación reciente de sus arrecifes coralinos.
PALABRAS CLAVE: corales pétreos, depredacion por peces.
ABSTRACT
Based on data recorded in 1994 and 1995 during a baseline study carried out at four western Caribbean atolls (Albuquerque, Courtown, Roncador and Serrana) of the San Andrés and Providencia archipelago, the incidence of hard coral predation by fishes and its relation with the abundance of the parrotfishes Sparisoma viride and Scarus vetula was analyzed. Among affected corals, Montastraea annularis and M. faveolata showed the highest incidence of fish bites (29.5% and 18.7% respectively). There were no significant differences between the atolls on the incidence of coral predation by fishes (Kruskall-Wallis, p = 0.07). When comparing between geomorphologic units the lagoon showed the highest level of predation (14.3%), and also the largest populations of S. viride and S. vetula, but both parameters were not significantly related. Highest predatory incidence and parrotfish abundance in the lagoon could be related to the dominance of the Montastraea spp. complex in this environment, because these coral species have been recognized as the preferred grazing substrates for the two parrotfishes. The predatory activity by the parrotfishes probably has contributed to the general degradation process of the coral reefs in the atolls, when combined with the other agents of stress.KEY WORDS: stony corals, fish predation, San Andrés, southwestern caribbean.
INTRODUCCIÓN
La bioerosión coralina consiste en la remoción y debilitamiento del esqueleto calcáreo de las especies que construyen el arrecife, como consecuencia de diversas actividades llevadas a cabo por otros organismos vivientes (Glynn, 1997). Dentro de los principales agentes biológicos de destrucción de los arrecifes coralinos están los erosionadores epilíticos o raspadores, compuestos por peces, moluscos y erizos (Hutchings, 1986; Bruggemann et al., 1996; Glynn, 1997). El efecto que tienen los peces en los arrecifes coralinos ha sido un tema de muchas controversias y fue revisado por Randall (1974). Los peces pueden ser bioerosionadores activos del coral cuando fragmentan piezas vivas de las colonias mientras se alimentan de ellas, extraen pólipos individuales del esqueleto coralino, extraen otros invertebrados de las colonias de coral o pastorean las algas que crecen sobre el sustrato coralino muerto (Randall, 1974; Hixon, 1997). Los consumidores directos o peces coralívoros están representados por algunas pocas familias como Chaetodontidae (mariposas), Balistidae (ballestas) y Tetraodontidae (globos) y la mayoría consumen sólo partes suaves sin necesidad de alterar el esqueleto coralino (Glynn et al., 1972; Reese, 1977; Hixon, 1997). Aunque algunas especies de la familia Balistidae han sido mencionadas por sus actividades de alimentación en corales, sus antecedentes están restringidos para áreas arrecifales del Pacífico (Glynn et al., 1972; Randall, 1974; Neudecker, 1977). Para el Caribe tan sólo Randall (1967) encontró restos insignificativos de coral (0.6%) en el contenido estomacal de Balistes vetula y Melichthys niger.
Dentro de los organismos que tienen efectos indirectos se han distinguido los peces de las familias Acanthuridae (cirujanos) y Scaridae (loros) como los más frecuentes pastoreadores, los cuales representan un componente ecológico y evolutivo importante de las asociaciones de herbívoros en muchos arrecifes tropicales del Caribe (Ogden y Lobel, 1978; Hay, 1984; Lewis y Wainwright, 1985; Morrison, 1988). Éstos se caracterizan porque remueven grandes cantidades del sustrato inorgánico y ocasionalmente el orgánico, mientras se alimentan de las algas (Ogden y Lobel, 1978; Brock, 1979). Sin embargo, los peces loro no sólo remueven tejido vivo mientras pastorean las algas, sino que algunas especies tanto del Pacífico como del Caribe raspan e ingieren el tejido mediante excavación directa del sustrato coralino vivo (Hutchings, 1986; Bellwood y Choat, 1990; Glynn, 1990). Tal estrategia de alimentación permite desnudar el esqueleto del coral y ocasionar daños en la matriz arrecifal, por lo que podrían ser considerados como un agente biológico importante de destrucción coralina. Los registros de diferentes investigaciones en el Caribe han incluido cuatro especies de peces loro que ocasionalmente muerden tejido de coral vivo (Frydl y Stearn, 1978; Frydl, 1979). Otros estudios han registrado eventos más frecuentes de remoción de coral, pero restringidos a los adultos de Sparisoma viride como principal depredador y a Scarus vetula, (Bruggemann et al., 1994a; Bruckner y Bruckner, 1998; Frydl, 1979).
Es evidente que los peces pastoreadores tienen fuertes efectos sobre los organismos bentónicos dominantes en los arrecifes: los corales y las algas. De hecho los peces herbívoros afectan considerablemente la abundancia y distribución de las algas en el arrecife; sorpresivamente, sin embargo, la evidencia de mayores efectos directos sobre los corales es relativamente escasa (Choat, 1991; Hixon, 1997). Teniendo en cuenta la poca información acerca del tema y el notable deterioro en términos de "salud coralina" presente en las últimas décadas (Ginsburg, 1993; Hubbard, 1997) medir el efecto de la depredación por peces es de interés. Por lo tanto en este estudio se evaluó la incidencia de la depredación y su relación con la abundancia de los peces loro S. viride y S. vetula, como agentes biológicos implicados en la mortalidad de tejido coralino, en varios atolones oceánicos y con bajo grado de influencia antropogénica, en el Caribe occidental.
AREA DE ESTUDIO
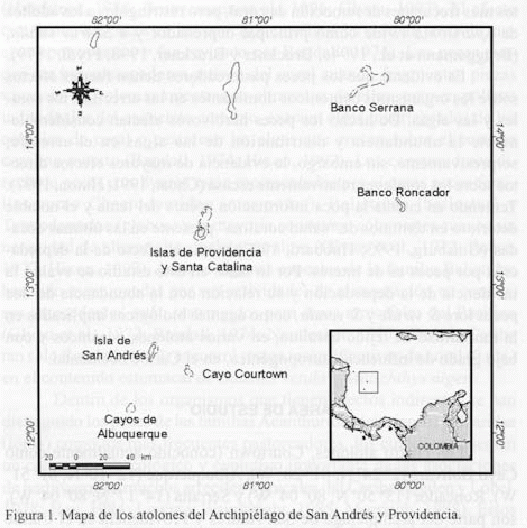
Los cuatro atolones, Courtown (conocido actualmente como Cayo Bolivar: 12o 24' N; 81o 28' W), Albuquerque (12o 10' N; 81o 51' W), Roncador (13o 50' N; 80o 04' W) y Serrana (14o 17' N; 80o 04' W), son parte del archipiélago de San Andrés y Providencia en el Caribe occidental (figura 1) y están localizados a más de 700 km de la costa continental colombiana (Geister y Díaz, 1997). Este sector no presenta influencia directa de sedimentos fluviales, lo que ha permitido el buen desarrollo de los arrecifes coralinos (Prahl y Erhardt, 1985). En el archipiélago predominan los vientos alisios del noreste (NE) y del este noreste (ENE) que generan un fuerte oleaje casi permanentemente. A partir de la segunda mitad del año principalmente, se pueden presentar tormentas esporádicas debido a que el archipiélago está ubicado dentro del cinturón de huracanes del Caribe. Las aguas marinas superficiales de la isla de San Andrés son cálidas y oscilan entre 26.8 y 30.2oC (Díaz et al., 1996a; Geister y Díaz, 1997). Un factor importante que controla
en gran medida las características geomorfológicas, el régimen sedimentológico y la estructura de las comunidades biológicas de este archipiélago es la energía descargada permanentemente por el oleaje sobre los arrecifes. Los cuatro atolones exhiben en general las mismas unidades geomorfológicas básicas y hábitats marinos. Las características particulares de las unidades fueron descritas por Díaz et al. (1996a) y simplificadas en general para los cuatro atolones así:
Arrecife periférico de barlovento: arrecife desarrollado sobre la plataforma insular, expuesto permanentemente al oleaje y a las corrientes. Puede ser una barrera consolidada y continua, o estar formada por segmentos separados que originan un sistema de espolones y canales. Sus crestas están dominadas por Millepora spp., Palythoa y algas coralináceas.
Terraza prearrecifal de barlovento: es un plano suavemente inclinado que se antepone a la barrera y se extiende por lo general hasta 18 - 25 m de profundidad. Tiene poco desarrollo coralino, presenta setos aislados de Acropora palmata y Millepora spp., además colonias costrosas de Diploria spp., Porites astreoides y Agaricia spp.; esta puede formar colonias dispersas. Un elemento conspicuo del paisaje es la dominancia de "jardines" de octocorales gorgonáceos y abanicos de mar. Con el aumento de la profundidad incrementa la cobertura de corales, esponjas y algas.
Laguna: es una cuenca relativamente profunda (6-25 m), encerrada total o parcialmente. Se evidencia por una fuerte pendiente de arena y el cambio brusco en la tonalidad del agua. Su fondo está cubierto por sedimentos y presenta comúnmente algún desarrollo de arrecifes de parche y una densa trama de arrecifes anastomosados y de cinta. Estos son casi exclusivamente del tipo Montastraea spp.; también se presentan Acropora cervicornis y A. palmata.
Terraza prearrecifal de sotavento: es un plano que se inclina suavemente hasta la caída subvertical del cantil exterior. La terraza está salpicada por montículos irregulares del tipo Montastraea spp. En su zona más profunda se incrementa la aparición de corales pétreos, gorgonáceos, esponjas y antipatarios.
En las dos primeras unidades geomorfológicas el fuerte oleaje y las corrientes oceánicas permanentes ejercen una gran influencia en su desarrollo y composición. Sus fondos se caracterizan por la presencia de sedimentos gruesos y la acumulación de escombros coralinos. Las dos últimas unidades se caracterizan por presentar fondos cubiertos por sedimentos finos y aguas tranquilas.
Los atolones del archipiélago están prácticamente deshabitados, excepto en uno de los cayos de cada atolón en los que se encuentra actualmente presencia militar de la Armada de Colombia. A pesar de su lejanía con respecto a la Isla de San Andrés -centro administrativo y comercial densamente poblado- los cayos son visitados regularmente por pescadores artesanales e industriales (Díaz et al., 1996a; Geister y Díaz, 1997).
MATERIALES Y MÉTODOS
Para evaluar la incidencia de la depredación por peces en corales escleractinios se utilizaron datos sobre salud coralina tomados en 1994 y 1995, durante un estudio de línea de base llevado a cabo en cuatro atolones del archipiélago de San Andrés: Albuquerque, Courtown, Roncador y Serrana (Garzón-Ferreira et al., 1996; Díaz et al., 1996b). En dicho estudio se evaluaron 62 estaciones de 1 a 20 m de profundidad, las cuales se escogieron tratando de cubrir los diferentes tipos de unidades geomorfológicas o ambientes arrecifales (arrecife periférico de barlovento, terraza de barlovento, laguna y terraza de sotavento) presentes en los cuatro atolones. El muestreo en cada estación se hizo colocando al azar tres cadenas livianas de 10 m de largo sobre un área homogénea del arrecife. Todas las colonias vivas interceptadas por las cadenas se identificaron con un código hasta especie y un observador las examinó cuidadosamente, registrando la presencia de agentes de deterioro y signos de daño sobre el tejido coralino. Para la identificación del complejo de especies de Montastraea annularis se tuvo en cuenta la propuesta de Weil y Knowlton (1994). Una de las condiciones evaluadas fueron las lesiones frescas dejadas por mordiscos de peces loro (Scaridae) en la superficie viva de las colonias (registradas como DE= depredación); se distinguieron por ser huellas o cicatrices muy evidentes de color blanco o muy pálido, en las cuales no sólo el tejido coralino blando había sido removido sino también una porción de la capa superficial del esqueleto y por lo tanto se apreciaba excavación del mismo. Los datos se hallan recogidos en la base de datos del programa de Biodiversidad y Ecosistemas del Instituto de Investigaciones Marinas y Costeras (Invemar.)
En las mismas estaciones se llevaron a cabo simultáneamente (por parte de otro investigador) estimaciones de la abundancia de peces arrecifales con base en el método de Bohnsack y Bannerot (1986). Estos datos se hallan también disponibles en la base de datos mencionada y han sido procesados y analizados dentro de un estudio sobre las características estructurales de las comunidades de peces de los atolones (Mejía, 1997; Mejía y Garzón-Ferreira, en prensa).
La incidencia de depredación se evaluó en términos de frecuencia de ocurrencia de dicha condición y se expresó como un porcentaje. Inicialmente se estimó para cada estación dividiendo el número de colonias con signos de depredación sobre el número total de colonias examinadas. A partir de lo anterior, la incidencia de depredación se calculó para diferentes niveles: a) para cada atolón, como el promedio de las incidencias (PI) de cada unidad geomorfológica de un atolón, b) por unidad geomorfológica en general, como el PI de las unidades entre atolones, c) por unidades geomorfologícas de cada atolón, como el PI de las estaciones de una unidad geomorfológica en un atolón y d) por especie de coral en general, como el PI entre atolones de cada especie. Con el fin de reconocer si habían diferencias entre las incidencias de la depredación de los cuatro atolones y entre las unidades geomorfológicas, se realizó una prueba de Kruskal-Wallis, debido a que los datos no cumplían con los supuestos para un análisis de varianza paramétrico. Para comprobar si había diferencias en la incidencia promedio entre las lagunas de los atolones, se realizó un ANOVA a una vía a partir de datos transformados (Ö); además se utilizó una prueba de comparación múltiple para conocer entre cuales atolones se presentaban dichas diferencias (Steel y Torrie, 1988). La relación entre la incidencia promedio de la depredación y la abundancia promedio de peces loro se evaluó gráfica y estadísticamente (Spearman) a nivel de cada atolón y de cada unidad geomorfológica (Daniel, 1998; Steel y Torrie, 1988).
RESULTADOS
Incidencia de lesiones por depredación en tejido coralino vivo
De las estaciones muestreadas, el 58% correspondió al ambiente arrecifal de laguna y sólo 4% a la barrera de barlovento debido al fuerte oleaje y a las restricciones de profundidad presentes en esta unidad geomorfológica (Garzón-Ferreira et al., 1996). Las terrazas de barlovento y sotavento estuvieron representadas aproximadamente por un 18% cada una (tabla 1). De las 2110 colonias examinadas de 30 especies de corales duros, sólo nueve especies presentaron signos de depredación por el pastoreo de peces sobre tejido coralino vivo (tabla 2).
Incidencia por atolón . Se encontró que la incidencia promedio más alta de depredación se presentó en Roncador con 9.9% (Error Estándar: EE = 8.8), seguida por Courtown con un 5.6% (EE = 3.2).
Los valores más bajos se hallaron en Albuquerque y Serrana con 3.8% (EE = 3.0) y 2.5% (EE = 1.8) respectivamente. Sin embargo el análisis Kruskal-Wallis demostró que no hay diferencias significativas (p =0.07) en la incidencia de depredación entre atolones.
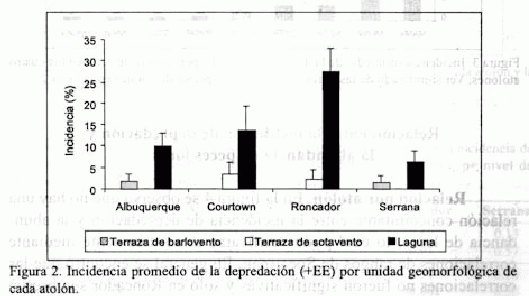
Incidencia por unidad geomorfológica. La incidencia promedio más alta para todos los atolones se halló en la laguna con 14.3% (EE = 4.6), superando marcadamente a las demás unidades; en la terraza de barlovento la incidencia fue de 0.8% (EE = 0.4) y 1.4% (EE = 0.8) para la terraza de sotavento. El análisis Kruskal-Wallis indicó diferencias significativas (p = 0.018) en la incidencia de depredación entre unidades geomorfológicas. El arrecife periférico continuo de barlovento no presentó signos de depredación en ninguna de las estaciones examinadas.
Incidencia por unidad geomorfológica en cada atolón. Al discriminar la información por unidades en cada atolón, se observa que sólo las lagunas presentaron incidencias de depredación en los cuatro atolones y obtuvieron los promedios más altos. La laguna de Roncador fue la más afectada (27.5%; EE = 5.6), seguida por la de Courtown (13.6%; EE = 5.5) y finalmente Albuquerque y Serrana con los valores más bajos (figura 2). Un ANOVA a una vía mostró que hay diferencias significativas (p < 0.01) en la incidencia promedio de depredación entre las lagunas de los atolones y una prueba de comparación múltiple
reveló que tales diferencias significativas se presentan específicamente entre las lagunas de Albuquerque y Roncador y entre las de Roncador y Serrana. Por su parte, la terraza de barlovento solo presentó incidencias bajas (< 2%) en Albuquerque y Serrana y en la terraza de sotavento se observaron únicamente incidencias en Courtown y Roncador con valores inferiores al 3.3% (figura 2). En general, para las terrazas se observó alta variabilidad.
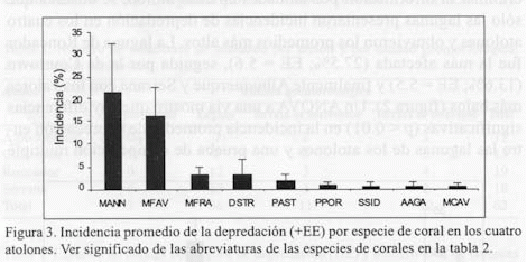
Incidencia por especie de coral. Se encontró que dos especies son las más frecuentemente mordisqueadas por el pastoreo de los peces, Montastraea annularis y M. faveolata, con incidencias promedio de 21.7% (EE = 10.6) y 16.3% (EE = 6.4) respectivamente. Les siguieron M. franksi, D. strigosa y P. astreoides con promedios entre 3.2% y 1.9%. Las demás especies presentaron valores menores al 1% y una alta variabilidad (figura 3).
Relación entre la incidencia de depredación y la abundancia de peces loros
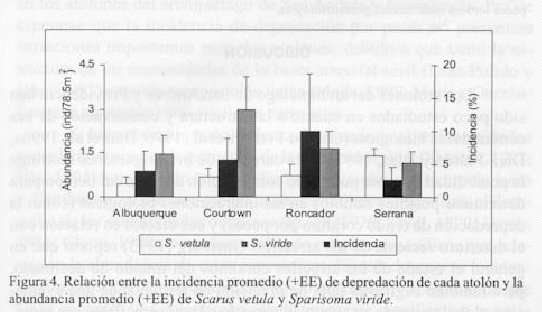
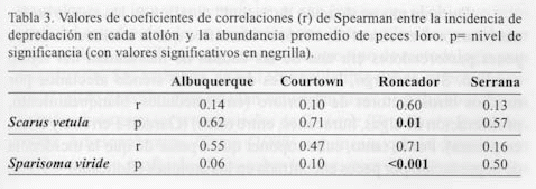
Relación por atolón. En la figura 4 se observa que no hay una relación concomitante entre la incidencia de depredación y la abundancia de loros, lo cual pudo verificarse estadísticamente mediante correlaciones de rangos de Spearman. En general se encontró que las correlaciones no fueron significativas y solo en Roncador se observó una relación positiva (correlaciones significativas) entre la incidencia de depredación y las abundancias de S. vetula (p = 0.60) y S. viride (p = 0 0.71) (tabla 3).
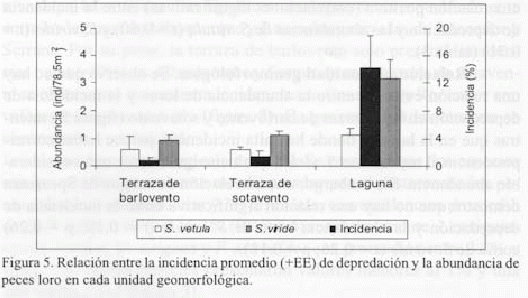
Relación por unidad geomorfológica. Se observa que no hay una relación evidente entre la abundancia de loros y la incidencia de depredación en las terrazas de barlovento y sotavento (figura 5), mientras que en la laguna, donde hay alta incidencia, parece haber correspondencia al menos con S. viride que tiene igualmente una considerable abundancia. Sin embargo, una correlación de rangos de Spearman demostró que no hay una relación significativa entre la incidencia de depredación y la abundancia tanto de S. vetula (r = 0.18; p = 0.26) como de S. viride (r = 0.26; p = 0.11).
DISCUSIÓN
Los atolones del archipiélago de San Andrés y Providencia han sido poco estudiados en cuanto a la estructura y conservación de sus comunidades biológicas (Garzón-Ferreira et al., 1996; Díaz et al., 1996a; Díaz-Pulido y Díaz, 1997). Esta carencia de investigaciones restringe la posibilidad de tener puntos de comparación a través del tiempo para determinar posibles cambios en las interacciones biológicas (como la depredación de tejido coralino por peces) y sus efectos en relación con el deterioro reciente de los arrecifes. Ginsburg (1993) reportó que en general el estado de los arrecifes coralinos del mundo ha declinado, pero también sugirió la falta de precisión en términos de una evaluación global teniendo en cuenta que muchas áreas arrecifales son remotas -como es el caso de los atolones- y por lo tanto es difícil estudiarlas.
Durante una evaluación de "salud" coralina de los cuatro atolones (Garzón-Ferreira et al., 1996) se identificó que la interacción de los peces pastoreadores era una de las causas de mortalidad del tejido coralino. Sin embargo, los corales duros están siendo afectados por muchos otros factores de deterioro (enfermedades, blanqueamiento, proliferación de algas, huracanes, entre otras) (Garzón-Ferreira y Díaz, en prensa). Por lo tanto, cabe suponer que a pesar de que la incidencia de depredación por peces encontrada en los atolones (Roncador = 9.9%, Courtown = 5.6%, Albuquerque = 3.8% y Serrana = 2.5%) y en sus unidades geomorfológicas (Laguna = 14.3%, Terraza de sotavento = 1.4%, Terraza de barlovento = 0.8%) no es alta y por sí misma parecería no estar afectando drásticamente la estructura de las comunidades (en términos de pérdida de tejido vivo), es muy probable que sumada a los demás agentes de deterioro identificados en los cayos, sí esté contribuyendo a la degradación de sus arrecifes coralinos.
Entre los cuatro atolones estudiados no se encontraron diferencias significativas en la incidencia de depredación, que a su vez parece ser baja o al menos estar dentro de límites normales. Dada la carencia de este tipo de información no fue posible establecer comparaciones y determinar realmente el grado de afección causado por la depredación en los atolones del archipiélago de San Andrés y Providencia. Era de esperarse que la incidencia de depredación por peces no presentara variaciones importantes entre los atolones, debido a que tanto la estructura de las comunidades de la biota arrecifal sésil (Díaz-Pulido y Díaz, 1997) como la composición íctica (Mejía, 1997; Mejía y Garzón-Ferreira, en prensa) son similares entre estos.
Si bien diversos trabajos han relacionado la abundancia de los peces herbívoros con la estructura de la comunidad algal (Steneck, 1988; Hay, 1991), por un lado como un factor que condiciona su crecimiento y distribución, y por otro, como un factor indirecto que afecta el desarrollo de las comunidades coralinas (Brock, 1979; Frydl, 1979; Lewis, 1986; Glynn, 1988), no se han realizado estudios específicos que relacionen la abundancia de estos esporádicos depredadores y su incidencia directa sobre la mortalidad del tejido coralino vivo. A pesar de que no se encontró una correlación estadísticamente significativa entre la abundancia de S. viride y S. vetula y la incidencia de depredación en los atolones, es importante mencionar que éste no era el objetivo principal del estudio donde se registraron los datos utilizados para hacer estos análisis y posiblemente se requiera otro tipo de metodología para demostrarlo. Sin embargo, se ha reconocido que daños extensivos sobre el tejido coralino vivo pueden ocurrir en áreas con alta abundancia de individuos grandes y territoriales de S. viride (Bruckner y Bruckner, 1998). Adicionalmente, Glynn (1988) argumenta que la depredación puede tener un profundo efecto sobre la estructura de las comunidades coralinas en ciertas circunstancias como por ejemplo la alta densidad de coralívoros relativa a los tamaños de las poblaciones presa.
Al comparar entre las unidades geomorfológicas de los atolones se encontraron marcadas diferencias en la incidencia de la depredación, la cual es notablemente mayor en los ambientes lagunares. Igualmente, las abundancias de S. viride y S. vetula fueron mayores en dicha unidad geomorfológica; aunque estadísticamente no fue posible establecer una clara relación entre ambas variables es necesario tener en cuenta este aspecto y discutir sus posibles implicaciones.
Por un lado, se ha reconocido a los escáridos como una familia abundante de peces herbívoros en los ambientes arrecifales tropicales (Lewis, 1986; Choat, 1991), de la cual S. viride y S. vetula son consumidores primarios principales por sus actividades de pastoreo en sustratos coralinos muertos (Bruggemann et al., 1994a y 1994c). Estudios realizados por Bruggemann et al. (1994a, 1994b y 1994c) han demostrado que ambas especies muestran un tipo de forrajeo selectivo similar pero que el rendimiento del recurso algal forrajeado por mordisco de S. viride está relacionado con la densidad de los sustratos coralinos muertos. Al comparar la ingestión de alimento por mordisco entre dos especies de corales con marcadas diferencias en sus densidades, comprobaron que S. viride prefiere pastorear sobre sustratos de baja densidad tal como los esqueletos de M. annularis, que a su vez sostienen más biomasa algal.
Por otro lado, el más importante constructor arrecifal de los ambientes lagunares de los atolones es el complejo Montastraea spp., (M. annularis, M. faveolata y M. franksi) (Díaz et al., 1996a y 1996b), del cual precisamente M. annularis y M. faveolata presentaron las mayores incidencias de depredación. Teniendo en cuenta lo anterior, se podría considerar que las altas abundancias de S. vetula y principalmente S. viride en arrecifes lagunares se deba a que precisamente en dicha unidad se encuentran sus sustratos de pastoreo preferidos, los que a su vez son altamente depredados por ambas especies. Probablemente la densidad de los sustratos está condicionando no solo el pastoreo, sino también las actividades de depredación, las cuales fueron mayores en las lagunas de los atolones. Es lógico suponer que si los sustratos de baja densidad son preferidos para pastorear las algas, lo sean también para depredar tejido coralino, ya que lograrían removerlo más eficientemente y por lo tanto más frecuentemente.
De las lagunas de los cuatro atolones, la del banco Roncador presentó la mayor incidencia de la depredación. Cabe resaltar que en dicha laguna se encuentra la mayor densidad de parches coralinos (más del 50% del fondo está ocupado por arrecifes) de todo el archipiélago, dominados por el complejo de especies Montastraea spp., (Díaz et al., 1996a). Si se tiene en cuenta que las especies de este complejo son muy abundantes en Roncador y que a su vez son las más frecuentemente depredas, sería lógico que la más alta incidencia de depredación se presente en dicho banco.
La información discriminada por especies de corales depredadas muestra diferencias marcadas en la incidencia de depredación entre ellas. Como ya se mencionó, las especies de corales más afectadas en los atolones fueron M. annularis y M. faveolata, lo cual está acorde con lo encontrado en otros estudios relacionados con el tema. Frydl (1979) y Bruggemann et al. (1994a y 1994b) reportaron que M. annularis (sensu lato) es la especie de coral más frecuentemente mordida por S. viride y muy esporádicamente por S. vetula. Otros estudios muestran que esta especie de coral presenta pérdidas sustanciales de tejido por la depredación constante de los peces loro (Bythell et al., 1993; Bruckner y Bruckner 1998). Frydl (1979) concluyó que los mordiscos repetidos por S. viride sobre esta especie de coral pueden matar partes extensas de las colonias, lo cual retarda su crecimiento y por lo tanto tiene profundos efectos en la forma de las cabezas coralinas. En las Islas Vírgenes (Bythell et al., 1993) encontraron que la depredación de los peces loro es la causa más seria de pérdidas crónicas de tejido coralino en M. annularis.
Durante un estudio realizado en los atolones, Díaz et al. (1997) encontraron que de la superficie lagunar cubierta por corales escleractinios el 90% corresponde al complejo Montastraea annularis (M. annularis, M. faveolata y M. franksi), del cual M. annularis es siempre dominante y común en aguas someras; y que M. faveolata es la especie dominante en todos los arrecifes lagunares por debajo de 4 m de profundidad. Por su parte, Neudecker (1979) y Glynn (1988) encontraron que los peces coralívoros discriminan entre especies, seleccionando corales dominantes, por lo que sería razonable suponer que la mayor incidencia de depredación sobre M. annularis y M. faveolata en los atolones sea en buena parte una consecuencia de su gran abundancia. Sólo hasta hace poco se reportó M. faveolata como una especie afectada por la depredación de peces loro (Bruckner y Bruckner, 2000), quizás debido a que recientemente fue reconocida como una especie particular (Weil y Knowlton, 1994).
Las demás especies de corales depredadas presentaron incidencias mucho menores y similares entre sí, entre ellas están Porites astreoides, P. porites, D. strigosa, S. siderea, M. cavernosa y Agaricia agaricites, las cuales también han sido mencionadas como especies ocasionalmente depredadas por S. viride (Frydl, 1979; Bythell et al., 1993; Bruckner y Bruckner, 1998). Es importante además resaltar que posiblemente las marcadas diferencias en la incidencia de depredación encontradas entre M. annularis y M. faveolata con las demás especies de corales se deba a que los ambientes lagunares fueron muestreados con mucha mayor intensidad (58.1%) en los atolones y es en estos ambientes donde dichas especies son más abundantes.
AGRADECIMIENTOS
Este trabajo fue realizado gracias al apoyo financiero de COLCIENCIAS-BID (proyectos 2105-09-023-93 y 2105-09-327-97). El Instituto de Investigaciones Marinas y Costeras (Invemar) prestó la mayor parte del apoyo logístico y contribuyó sustancialmente a la financiación. Un agradecimiento muy especial a la tripulación del B/I Ancón y a los compañeros de las expediciones por su gran apoyo y colaboración. A Luz S. Mejía por facilitar información sobre las abundancias de los peces. A Sven Zea por su ayuda en la toma de información en el campo y sus consejos en el análisis de los datos. A Fernando Parra por su colaboración con el manejo de la base de datos.
BIBLIOGRAFÍA
1 Bellwood, D.R. y J.H. Choat. 1990. A functional analysis of grazing in parrotfishes (family: Scaridae): the ecological implications. Env. Biol. Fishes, 28: 189-214. [ Links ]
2 Bohnsack, J.A y S.P. Bannerot. 1986. A stationary visual technique for quantitatively assesing community structure of coral reef fishes. NOAA Tech. Rep. NMFS, 41:1-15. [ Links ]
3 Brock, R.E. 1979. An experimental study on the effects of grazing by parrotfishes and role of refuges on benthic community structure. Mar. Biol., 51: 381-388. [ Links ]
4 Bruckner, A.W. y R.J. Bruckner. 1998. Rapid wasting syndrome or coral predation by Stoplight Parrotfish?. Reef Encounter, 23: 18-22. [ Links ]
5 ________ y________. 2000. Parrotfish predation on live coral: "spot biting" and "focused biting". Coral Reefs, 19: 50. [ Links ]
6 Bruggemann, J.H.; M.J.H. Van oppen y A.M. Breeman. 1994a. Foraging by the stoplight parrotfish Sparisoma viride. I. Food selection in different, socially determined habitats: 29-52. En J.H. Bruggemann (Ed.): Parrotfish grazing on coral reefs: A trophic novelty. Ponsen & Looijen bv, Wageningen. [ Links ]
7 ________; J. Begeman; E.M. Bosma; P. Verburg y A.M. Breeman. 1994b. Foraging by the stoplight parrotfish Sparisoma viride. II. Intake and assimilation of food protein, and energy: 53-78. En J.H. Bruggemann (Ed.): Parrotfish grazing on coral reefs: A trophic novelty. Ponsen & Looijen bv, Wageningen. [ Links ]
8 ________; M. Kuiper y A.M. Breeman. 1994c. Comparative analysis of foraging and habitat use by the sympatric Caribbean parrotfish Scarus vetula and Sparisoma viride (Scaridae): 105-130. En J.H. Bruggemann (Ed.): Parrotfish grazing on coral reefs: A trophic novelty. Ponsen & Looijen bv, Wageningen. [ Links ]
9 ________; A.M. Van Kessel; J.M. Van Roiji y A. M. Breeman. 1996. Bioerosion and sediment ingestion by the caribbean parrotfish Scarus vetula and Sparisoma viride: Implications of fish size, feeding mode and habitat use. Mar. Ecol. Prog. Ser., 134: 59-71. [ Links ]
10 Bythell, J. E., E. H. Gladfelter y M. BythelL. 1993. Chronic and Catastrophic Natural Mortality of the Three Common Caribbean Reef Corals. Coral Reefs, 12: 143-152. [ Links ]
11 Choat, J. H. 1991. The biology of herbivorous fishes on coral reefs: 120-155. En P.F Sale (Ed.): The ecology of fishes on coral reefs. Academic Press, San diego. [ Links ]
12 Daniel, W.W. 1998. Bioestadística. Editorial Limusa, México. [ Links ]
13 Díaz, J.M.; J. M. Sánchez.; S. Zea y J. Garzón-Ferreira. 1996b. Morphology and marine habitats of two southwestern Caribbean atolls: Albuquerque and Courtown. Atoll Resech Bull 435: 1-33. [ Links ]
14 ________, G. Díaz-Pulido; J. Garzón-Ferreira; J. Geister; J.A. Sánchez y S. Zea. 1996a. Atlas de los arrecifes coralinos del Caribe colombiano. I. Complejos arrecifales oceánicos. INVEMAR, Santa Marta, Ser. Publ. Espec., 2: 83 p. [ Links ]
15 Díaz-Pulido, G. y J.M. Díaz. 1997. Algal assemblages in lagoonal reefs of Caribbean oceanic atolls. Proc. 8th Int. Coral Reef Symposium. Panamá. 50 p. [ Links ]
16 Frydl, P. 1979. The effect of parrotfishes (Scaridae) on coral in Barbados. W. I. Int. Rev. Ges. Hydrobiol., 64: 737-748. [ Links ]
17 ________ y C. W. Stearn. 1978. Rate of bioerosion by parrotfish in Barbados reef environments. J. Sedim. Petrol., 48: 1149-1158. [ Links ]
18 Garzón-Ferreira, J. y J.M. Díaz. 2003. The Caribbean coral reefs of Colombia. En Cortés, J. (Ed): Coral Reefs of Latin America. Elsevier Science, Holanda. [ Links ]
19 ________, S. ZEA y J.M. Díaz. 1996. Coral health assessment in four western Caribbean atolls. Abstr. 8th Intern. Coral Reef Symp. Panamá. 68 p. [ Links ]
20 Geister, J y J.M. Díaz. 1997. A field guide to the oceanic barrier reefs and atolls of the southwestern Caribbean (Archipielago of San Andres and Providencia, Colombia). Proc. 8th Int. Coral Reef Symp., 1: 235-262. [ Links ]
21 Ginsburg, R.N. (Compilador). 1993. Proceedings of the Colloquium on Global Aspect of Coral Reefs. Health, Hazards and History. RSMAS. University of Miami, Miami. 420 p. [ Links ]
22 Glynn, P. W. 1988. Predation on coral reefs: some key process, concepts and research directions. Proc. 6th Internat. Coral reef Symp. Townsville, 1: 51-62. [ Links ]
23 ________. 1990. Feeding ecology of selected coral-reef macroconsumers: patterns and effecs on coral community structure: 365-400. En Z. Dubinsky (Ed.): Ecosistems of the world 25: Coral Reef. Elsevier, Amsterdam. [ Links ]
24 ________. 1997. Bioerosion and coral-reef growth: a dynamic balance: 68-95. En C. Birkeland (Ed.): Life and death of coral reefs. Chapman & Hall, New York. [ Links ]
25 ________; R.H. Stewart y J.E. Mccosker. 1972. Pacific coral reefs of Panamá: structure, distribution and predators. Geol. Rundschau, 61(2): 483-519. [ Links ]
26 Hay, M.E. 1984. Patterns of fish and urchin grazing on Caribbean coral reefs: are previus results Typical? Ecology, 65: 446-454. [ Links ]
27 ________. 1991. Fish-Seaweed Interactions on Coral Reefs: Effects of herbivorous fishes and adaptations of the prey: 96-119. En P.F Sale (Ed.): The ecology of fishes on coral reefs. Academic Press, San diego. [ Links ]
28 Hixon, M.A. 1997. Effects of reef fishes on corals and algae: 230-248. En C. Birkeland (Ed.): Life and death of coral reefs. Chapman & Hall, New York. [ Links ]
29 Hubbard, D. K. 1997. Reefs as Dynamic Systems: 43-67 En: C Birkeland (Ed.): Life and death of coral reefs. Chapman & Hall, New York. [ Links ]
30 Hutchings, P.A. 1986. Biological destruction of coral reefs. Coral Reefs, 4: 239-252. [ Links ]
31 Lewis, S.M. 1986. The role of herbivorous fishes in the organization of a Caribbean reef community. Ecol. Monogr., 56: 183-200. [ Links ]
32 ________ y P.C. Wainwright. 1985. Herbivore abundance and grazing intensity on a Caribbean coral reef. J. Exp. Mar. Biol. Ecol., 87: 215-228. [ Links ]
33 Mejía, L.S. 1997. Comunidades ícticas de los cayos colombianos de San Andrés y Providencia y su relación con la estructura y salud arrecifal. Tesis M.Sc. Biol. Mar., Univ. Nacional, Bogotá. 112 p. [ Links ]
34 ________ y J. Garzón-Ferreira. En prensa. Estructura de comunidades de peces arrecifales en cuatro atolones del Archipiélago de San Andrés y Providencia (Caribe sur occidental). Rev. Biol.Trop., 48(3). [ Links ]
35 Morrison, D. 1988. Comparing fish and urchin grazing in shallow and deeper coral reef algal communities. Ecology, 69: 1367-1382. [ Links ]
36 Neudecker, S. 1977. Transplant experiments to test the effect of fish grazing on coral distribution. Proc. 3rd Int. Coral Reef Symp., Miami, 1: 317-323. [ Links ]
37 Ogden, J.C. y P.S. Lobel. 1978. The role of herbivorous fishes and urchins in coral reef communities. Environ. Biol. Fishes, 3:49-63. [ Links ]
38 Prahl, H. von y H. Erhardt. 1985. Colombia: corales y arrecifes coralinos. Fen Colombia, Bogotá. 295 p. [ Links ]
39 Randall, J. E. 1967. Food habits of reef fishes of the West Indies. Stud. Trop. Oceanogr., 5: 665-847. [ Links ]
40 ________. 1974. The effect of fishes on coral reefs. Proc. 2nd Internat. Coral Reef Symp. Australia, 1: 159-166. [ Links ]
41 Reese, E.S. 1977. Coevolution of corals and coral feeding fishes of the family Chaetodontidae. Proc. 3rd Int. Coral Reef Symp., Miami, 1: 267-274. [ Links ]
42 Steel, R.G.D. y J.H. Torrie. 1988. Bioestadística, principios y procedimientos. McGraw Hill, México. [ Links ]
43 Steneck, R.S. 1988. Herbivory on Coral Reefs: A synthesis. Proc. 6th Int. Coral Reef Symposium, Australia, 1: 37-4 9. [ Links ]
44 Weil, E y N. Knowlton. 1994. A multi-character analysis of the Caribbean coral Montastraea annularis (Ellis and Solander, 1786) and its two sibling species, M. faveolata and M. franksi (Gregory, 1895). Bull. Mar. Sci., 55(1): 151-175. [ Links ]
FECHA DE RECEPCION: 18/12/2000 FECHA DE ACEPTACION: 22/08/2001