Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.31 no.1 Santa Marta Jan./Dec. 2002
TERRITORIOS DEL PEZ STEGASTES PLANIFRONS EN FORMACIONES CORALINAS DEL PARQUE NACIONAL NATURAL TAYRONA,CARIBE COLOMBIANO:UN PANORAMA GENERAL
TERRITORIES OF THE POMACENTRID FISH STEGASTES PLANIFRONS IN CORAL REEFS AT THE NATURAL NATIONAL TAYRONA PARK, COLOMBIAN CARIBBEAN: A GENERAL OVERVIEW
Nadiezhda Santodomingo, Alberto Rodríguez-Ramírez y Jaime Garzón-Ferreira
Instituto de Investigaciones Marinas y Costeras (INVEMAR). A.A. 1016, Santa Marta, Colombia. Correo-E: nadiaks@invemar.org.co (N.S.A.), betorod@invemar.org.co (A.R.R.), jgarzon@invemar.org.co (J.G.F.).
RESUMEN
La presencia del pomacéntrido Stegastes planifrons en los arrecifes coralinos es conspicua y constituye un agente importante de mortalidad coralina. Estos peces muerden el coral vivo abriendo espacios para el establecimiento de las algas que utilizan como alimento. Este trabajo buscó evaluar las densidades poblacionales del pez S. planifrons y el área de sus territorios y céspedes algales en formaciones coralinas de las bahías Chengue y Gayraca del Parque Nacional Natural Tayrona (PNNT), como una contribución al entendimiento de los procesos naturales involucrados en el deterioro de los arrecifes. Entre agosto y noviembre de 1999, se realizaron los muestreos en bandas de 20 x 2 m sobre diferentes tipos de hábitat: a. comunidades coralinas dominadas por (1) Colpophyllia natans (COLP) o (2) Montastraea spp. (MONT); y parches monoespecíficos de (3) Acropora palmata (APAL) y (4) Acropora cervicornis muerto en su mayoría (ACER). En total fueron censados 457 peces repartidos por estados de desarrollo y talla así: juveniles 21% (2.6±0.6 cm), intermedios o subadultos 3% (6.6±0.5 cm) y adultos 76% (12.6±0.2 cm). S. planifrons estuvo en mayor densidad en el hábitat ACER (1.52 terr*m-2) a pesar del deterioro generalizado de este hábitat, y en menor densidad en los demás hábitats (~0.5 terr*m-2), indicando que el pez además de seguir utilizando su hábitat principal ACER está haciendo un uso importante de otros hábitats del arrecife antes no cuantificados. El área de céspedes por pez estuvo alrededor de 0.1 m2 y fue significativamente menor en APAL (0.07 m2) que en los otros tipos de hábitat, debido a que las altas tasas de crecimiento y regeneración de A. palmata contrarrestan el mordisqueo continuo de los peces. Las altas densidades de S. planifrons y el tamaño de sus céspedes, vislumbran un papel importante del pez en la mortalidad natural y dinámica de las formaciones arrecifales estudiadas.
PALABRAS CLAVE: Stegastes planifrons, Territorialidad, Parque Tayrona, Arrecifes Coralinos.
ABSTRACT
The pomacentrid Stegastes planifrons is one of the most conspicuous inhabitants of the coral reefs and constitutes an important agent of natural coral mortality. These fishes kill coral directly by removing coral polyps for opening up an space for its algal turfs, which are their main food. The population density, territory and algal turfs areas of Stegastes planifrons were assessed at Chengue and Gayraca bays in Tayrona Natural Park, as a contribution to understand natural processes involved in the coral reef deterioration. During August to November 1999, belt transects (20 x 2 m) were evaluated at four reef habitat types: multispecific coral assemblages dominated by (1) Colpophyllia natans (COLP) or (2) Montastraea spp. (MONT); and monospecific coral stands of (3) Acropora palmata (APAL) or (4) A. cervicornis (ACER). In total 457 fishes were censused: 21% juveniles (2.6±0.6 cm), 3% subadults or intermediates (6.6±0.5 cm) and 76% adults (12.6±0.2 cm). The highest density of S. planifrons was observed in the ACER (1.52 terr*m-2) despite this habitat is very degraded. Lower densities were found in the others habitats (~0.5 terr*m-2), but this indicates that the fish is using also alternative habitats. The algal turf size was around 0.1 m2 and significatively lowest at APAL (0.07 m2), due to the high regeneration and growth rates of A. palmata, which balance the frequent fish biting. The high densities and algal turf size of S. planifrons suggest an important role of this fish in the natural mortality and dynamics of Tayrona coral communities.
KEY WORDS: Stegastes planifrons, territoriality, Tayrona park, coral reef.
INTRODUCCIÓN
Los arrecifes coralinos figuran entre las comunidades biológicas más importantes por su alta productividad, biodiversidad y su atractivo escénico (Birkeland, 1997). Son ecosistemas dinámicos afectados por diferentes agentes de mortalidad natural como los huracanes y el calentamiento global (Brown, 1997), la depredación por invertebrados y por peces loro (Glynn y Colgan, 1988; Carpenter, 1997; Bruckner y Bruckner, 2000; Reyes-Nivia 2000), la proliferación de macroalgas (Garzón-Ferreira et al., 2000), enfermedades (Goreau et al., 1998) y el territorialismo del pez pomacéntrido Stegastes planifrons (Knolwton et al., 1990).
A grandes rasgos, se ha determinado que la instalación del territorio por parte de S. planifrons se inicia con la remoción de coral vivo mediante el mordisqueo de pequeñas porciones, el cual genera espacios libres de competencia donde crecen las algas que utiliza como alimento. El pez defiende su territorio contra otros peces herbívoros (loros y cirujanos) y contra individuos de su misma especie, ocasionando una reducción en la intensidad del pastoreo por exclusión de dichos peces, lo que conlleva al crecimiento pronunciado de un césped de algas en el territorio y por ende la reducción de la capacidad competitiva del coral (Kaufman, 1977; Knowlton et al., 1990; Garzón- Ferreira et al., 1996).
Hasta el momento, los territorios no han sido estudiados como agentes naturales de mortalidad coralina en los arrecifes colombianos y la importancia de su investigación radica en que podrían estar desempeñando un papel significativo en la determinación de la estructura y dinámica de estos sistemas. En los últimos años las poblaciones de S. planifrons parecen haberse vuelto un elemento conspicuo en los arrecifes colombianos, llegando a ocupar parches de coral deteriorados o incluso muertos de San Andrés y Providencia (Garzón-Ferreira et al., 1996), el Parque Nacional Natural Tayrona (PNNT) y Urabá (Garzón-Ferreira, com. pers.) y en general en todo el Caribe colombiano (Barrios, 2001), así como también en otras áreas del mar Caribe según observaciones de Ogden y Ogden (1998) y Precht et al. (2000).
El presente estudio se enmarcó dentro del proyecto "Sistema de Monitoreo para los Ambientes Arrecifales en Colombia y Evaluación de los Agentes de Mortalidad Coralina" y tuvo como propósitos determinar las densidades poblacionales del pez Stegastes planifrons sobre los corales en que han establecido sus territorios en las bahías Chengue y Gayraca del PNNT, así como estimar el tamaño de sus territorios y céspedes.
METODOLOGÍA
Área de estudio
El estudio se llevó a cabo en las bahías de Chengue (74o08' LO, 11o20 LN) y de Gayraca (74o07' LO y 11o 20' LN), ubicadas al nororiente de Santa Marta en el Parque Nacional Natural Tayrona -PNNT- (figura 1). Las formaciones coralinas del PNNT se encuentran asociadas principalmente al cinturón rocoso costero, cuya zonación está determinada por diferentes grados de exposición al oleaje, caracterizándose por tener un menor desarrollo y presencia de algunos de los elementos de un arrecife coralino (Solano, 1987). Sin embargo, las comunidades existentes se distinguen por su diversidad estructural y riqueza de especies (Prahl y Erhardt 1985).
Selección de los tipos de hábitat
Se efectuaron buceos de reconocimiento en las formaciones coralinas de bahías Chengue y Gayraca, con el fin de identificar los diferentes tipos de ensamblajes coralinos con presencia de Stegastes planifrons, bajo la orientación de los trabajos realizados por Solano (1987) y Garzón-Ferreira y Cano (1991). Los tipos de ensamblajes coralinos sobre los cuales viven actualmente las poblaciones de Stegastes planifrons se enmarcaron bajo el concepto de tipos de hábitat, y se definieron con base en la presencia sobresaliente de alguna de las especies coralinas dentro del respectivo ensamblaje coralino: 1. Multiespecífico dominado por Colpophyllia natans (COLP), 2. Multiespecífico dominado por Montastraea spp. (MONT), 3. Monoespecífico dominado por Acropora palmata (APAL) y 4. Monoespecífico dominado por Acropora cervicornis muerto en su mayor parte (ACER); este último se encontró únicamente en bahía Chengue y fue tenido en cuenta pues la población de S. planifrons era muy numerosa.
En cada tipo de hábitat se instalaron cuatro bandas de 20 x 2 m -excepto para ACER con solo dos bandas- cuya área se escogió teniendo en cuenta que: 1. fuera suficiente para el muestreo del hábitat, mediante la utilización de curvas de diversidad (H') acumulada, 2. fuera suficiente para el muestreo de la población de Stegastes planifrons, mediante la utilización de curvas de densidad acumulada y 3. antecedentes en otros estudios tales como el de Sammarco y Williams (1982), donde se utilizaron bandas de 10 x 1 m para el muestreo de los territorios en Jamaica y el de Meekan et al. (1995) quienes usaron bandas de 10 x 4 m para definir el patrón espacial de peces territoriales en el norte de la Gran Barrera de arrecifes coralinos en Australia.
Las bandas se delimitaron en sus cuatro extremos con estacas de hierro galvanizado (75 cm, f 1.9 cm). La toma de datos en cada una de las bandas se efectuó mediante la esquematización de los componentes bentónicos en una tabla acrílica cuadriculada a escala y facilitada por el uso de un cuadrante de 1 m2 con subdivisiones de 10 cm2 (Rogers et al., 1994 ).La localización de las bandas estuvo entre los 6 y 9 m de profundidad en los hábitats COLP, MONT y ACER, mientras que APAL se localizaron entre 2 y 4 m de profundidad. De otro lado, el porcentaje de coral vivo en los hábitats estuvo alrededor del 50% en APAL, COLP y MONT, y del 10% en el hábitat ACER.
Caracterización de los Territorios
Teniendo como referencia el esquema de los componentes bentónicos, para cada territorio se anotaron los atributos que se describen a continuación.
Talla y estado de desarrollo del pez
La talla se estableció visualmente con una tabla acrílica graduada en centímetros (con aproximación a los 0.5 cm) en uno de sus lados. Se consideraron tres estados de desarrollo con base en los criterios de coloración propuestos por Robertson (1984) y Humann (1994): 1. adulto, 2. intermedio o subadulto y 3. juvenil.
Densidad de individuos y territorios
La densidad se consideró como el número de individuos (ind) y/o territorios (terr) por unidad de área (m2) en cada banda; fue preciso hacer esta distinción porque la gran mayoría de peces en estado juvenil no tiene un territorio claramente definido, de modo que la densidad de territorios (terr*m-2) correspondió a la suma del numero de adultos y los subadultos por unidad de área. Cuando los territorios se hallaron parcialmente incluidos dentro del área de la banda y con el fin de no sobreestimar la densidad, se contaron solo los que tuvieron al menos las 3/4 partes (75%) de su área dentro de la banda.
Se realizó un ANOVA para observar si existían diferencias significativas de las densidades (terr*m-2) entre los tipos de hábitat. Los supuestos de normalidad se probaron con el test de Kolmogorov- Smirnov y la homogeneidad de varianza con la prueba de Bartlett (Sokal y Rohlf, 1995).Tamaño de territorios y céspedes
Un territorio de Stegastes planifrons es el espacio defendido por un pez sobre la matriz coralina, en el cual realiza sus funciones vitales y donde se aprecia la formación de parches conspicuos de las algas o "céspedes" que utiliza como alimento (Robertson 1984). Con base en observaciones realizadas durante cinco minutos sobre los recorridos y encuentros territoriales del pez se dibujó y estimó sobre el esquema de componentes bentónicos el área de cada territorio (ATerr) (Tolimieri, 1995). El área total del césped (ACés) mantenida por un pez dentro del territorio se estimo sobre esquema de componentes bentónicos a1 sumar todas las áreas de césped cultivadas por el pez.
El tamaño del territorio se correlacionó con la talla del pez y el área promedio de un territorio en cada banda con su respectiva densidad, a través del coeficiente de correlación de Pearson r (p<0.05). Además, los tamaños promedio de los territorios se compararon entre los tipos de hábitat con un ANOVA a una vía (p<0.05).
RESULTADOS
En total fueron muestreados 320 m2 y 240 m2 de matriz arrecifal en las bahías Chengue y Gayraca, respectivamente. En la tabla 1 se presenta la extensión que cubre cada tipo de hábitat logrados a partir de las mediciones directamente en campo o mediante la cartografía de la base de datos del laboratorio de Sistemas de Información Geográfica y Sensores Remotos (SIG-SR) de Invemar, donde se puede apreciar que el tipo de hábitat ACER es el de menor cobertura (636 m2) en las formaciones arrecifales exploradas.
Caracterización de los territorios
Estado de desarrollo y talla de los peces
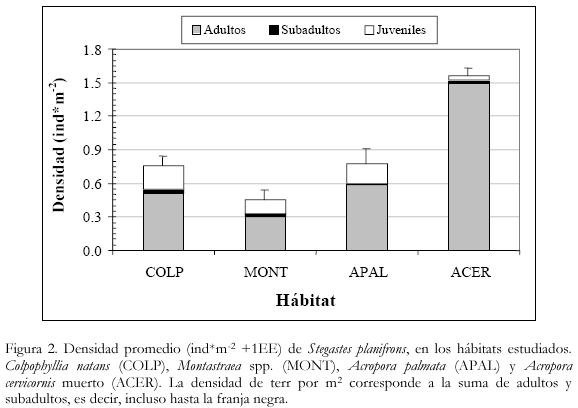
En total fueron censados 453 peces, de los cuales la gran mayoría se encontró en estado adulto (76%), con tallas que variaron entre los 6 cm y los 16 cm; la proporción de los otros estados de desarrollo y sus intervalos de talla se indican en la tabla 2. En los hábitats COLP, MONT y APAL dicho porcentaje se mantiene, mientras que en ACER la proporción es mayor con un 95% de adultos frente a un 5% de individuos subadultos y juveniles.
Densidad de individuos y territorios
Durante el reconocimiento se observó que las poblaciones de Stegastes planifrons tienen una amplia distribución en el área de estudio. Sin embargo, se vieron restringidos a aguas someras y muy pocos peces fueron vistos en zonas de profundidad mayores de los 12 m.
Aunque los peces juveniles también se encuentran fuertemente relacionados con el sustrato, no se observaron en territorios claramente definidos ni tampoco cultivos de céspedes; la mayor parte de ellos (72.3%) se mueve libremente muy cerca o dentro de los espacios defendidos por peces adultos y subadultos, donde continuamente son hostigados, pero gracias a sus diminutos tamaños pueden evadir los ataques resguardándose entre grietas y oquedades del sustrato.
El hábitat con mayores densidades de individuos fue ACER (1.56±0.08 ind*m-2) y el de menores densidades fue MONT (0.45±0.08 ind*m-2) (figura 2). La misma tendencia se encontró en la densidad de territorios pues fue significativamente mayor (ANOVA, p<0.001; Tukey, p<0.05) en el hábitat ACER (1.52±0.08 terr*m-2), seguido de APAL (0.60±0.08 terr*m-2) y COLP (0.55±0.09 terr*m-2), y las menores densidades se hallaron en MONT (0.33±0.05 terr*m-2).
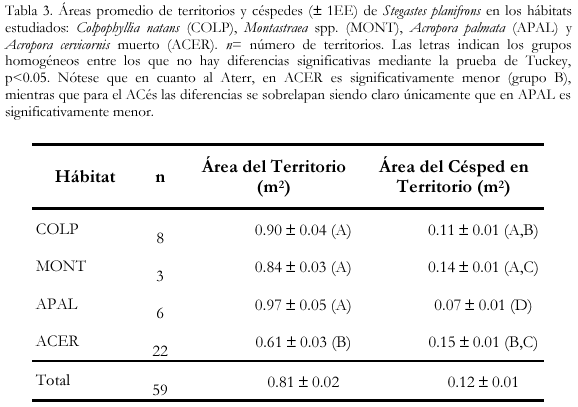
Tamaño de los territorios y los céspedes
En promedio, el área de un territorio de S. planifrons fue de 0.81±0.02 m2 (tabla 3), presentando áreas máximas de 2.45 m2 y áreas mínimas de 0.07 m2; hubo diferencias significativas entre los hábitats (ANOVA, p<0.01), siendo en ACER donde menores áreas pueden ser defendidas (0.61±0.03 m2) en comparación con los otros hábitats. En contraste, las superficies de céspedes más grandes están presentes en territorios sobre ACER (0.15±0.01 m2) y las más pequeñas en territorios sobre APAL (0.07±0.01 m2) (Tukey, p<0.05). También hubo diferencias significativas en cuanto al área promedio de los céspedes entre los cuatro hábitats (n= 14, ANOVA, p<0.01).
Según el coeficiente de correlación de Pearson, el tamaño del territorio (n= 359) y del césped (n= 359) se correlacionaron positivamente con la talla del pez pero presentaron bajos coeficientes (r= 0.26, p= 0.01 y r= 0.23, p<0.001, respectivamente), lo cual sugiere que aunque peces de mayor talla aparentemente poseen territorios y céspedes más amplios, otros factores intervienen en la delimitación de territorios y céspedes. El tamaño promedio del territorio y la densidad en la respectiva banda se relacionaron negativamente (r= -0.64, p= 0.01), mientras que el área del césped y la densidad no presentaron ninguna relación (r= 0.07, p= 0.80).
Por otra parte, el área promedio del césped no estuvo correlacionada significativamente con la densidad de territorios teniendo en cuenta todas las bandas de muestreo (r= 0.07, p= 0.80), y aunque con un bajo coeficiente (r= 0.23, p<0.001), si lo estuvo con la talla del pez. Al igual que para el Aterr, los datos sugieren que gran parte de la variabilidad es debida a otros factores no tenidos en cuenta en este estudio.
DISCUSIÓN
Hábitat
Stegastes planifrons ha sido identificada como una las principales especies que viven en estrecha relación con el sustrato arrecifal y gracias a su acentuada territorialidad es capaz de defender algunas áreas del arrecife (Itzkowitz, 1977; Thresher, 1980; Robertson et al., 1981; DeLoach, 1999). Desde el punto de vista fisiografico, S. planifrons ha sido asociada comúnmente a zonas someras del arrecife y protegidas de la acción del oleaje, y con menor representatividad a zonas expuestas y de mayor profundidad (Robertson et al., 1981; Robin y Williams, 1985; Garzón-Ferreira et al., 1996; Mejía, 1997); las poblaciones evaluadas de S. planifrons en las formaciones coralinas de Chengue y Gayraca se distribuyeron en concordancia con las características previamente mencionadas.
Desde la perspectiva de la composición del sustrato arrecifal, el más importante estudio del que se tiene referencia fue llevado a cabo por Itzkowitz (1977) quien estableció que el hábitat principal de los adultos de Stegastes planifrons son los parches de Acropora cervicornis vivo y muerto, pues allí se concentró la gran mayoría de la población y a su vez hubo exclusión de las otras especies de damiselas; aunque no le asignó la categoría de hábitat principal a los parches de Acropora palmata (vivo y muerto) y a los parches de cascajo (tamaño grande), también encontró que una buena parte de estos peces pueden establecerse en estos lugares, pero bajo condiciones de competencia más acentuada con otras damiselas (Stegastes dorsopunicans y Microspathodon chrysurus). Después del trabajo de Itzkowitz (1977), es notorio que la gran mayoría de investigaciones sobre S. planifrons han sido realizadas solamente sobre dicho hábitat principal (Brawley y Adey, 1977; Kaufman, 1977; Itzkowitz, 1978; Robertson et al., 1981; Robertson, 1984; Knowlton et al., 1990), dejando de lado la presencia del pez en otros sitios del arrecife. Aunque Itzkowitz (1977) estableció que las "cabezas de Montastraea annularis (sensu lato) localizadas en las áreas adyacentes a Acropora cervicornis" son el hábitat secundario de S. planifrons, no hizo claridad de si tales áreas adyacentes constituyen grandes extensiones de M. annularis o son sólo cabezas dispersas de esta especie, inmersas en los parches de A. cervicornis. Fotografías de las áreas de estudio (ver figura 1 en Kaufman, 1977; figura 3 en Scoffin, 1993; figura 15-7 en Brown, 1997) donde se han llevado a cabo estas investigaciones apoyan la idea de que se trata de cabeza dispersas y no de parches de M. annularis como tal (Kaufman, 1977; Itzkowitz, 1978; Williams, 1978; 1980; Sammarco y Williams, 1982). De esta manera, la presente investigación se constituye como el primer intento por explorar cuales son los ambientes, desde el punto de vista estructural, donde se encuentran las poblaciones de S. planifrons.
Retomando lo dicho anteriormente, la presencia de S. planifrons ya había sido registrada claramente para los hábitats ACER y APAL. Ante la incertidumbre de la presencia de los peces en MONT, los resultados de este estudio constituyen un informe importante de la ocurrencia de S. planifrons en este hábitat en las formaciones arrecifales estudiadas. En cuanto al hábitat COLP, esta investigación representa el primer registro de la presencia del pez en un parche de coral dominado por la especie masiva Colpophyllia natans. Cabe mencionar que según el estudio de Robertson et al. (1981) en arrecifes de San Blas (Panamá), parches de Agaricia sp. conforman otro de los hábitats donde se ha observado a S. planifrons, pero en las formaciones coralinas de Chengue y Gayraca esta especie de coral tiene actualmente una baja representatividad; adicionalmente, Solano et al. (1990) reportaron la presencia de S. planifrons en áreas dominadas por Porites porites y Agaricia agaricites en Islas del Rosario.
A pesar de que no se cuantificó el grado de complejidad del sustrato, se observó que los peces aprovecharon los espacios de alta complejidad estructural entre las ramas en APAL o entre las cabezas de corales masivos en los hábitats COLP y MONT, debido a que el pez requiere refugio de los depredadores, además de un sitio adecuado en donde establecer el césped de algas (Itzkowitz, 1977; Ebersole, 1985; Tolimieri, 1995). En el hábitat ACER los peces se distribuyeron sobre la gran mayoría del sustrato, utilizando los lugares existentes entre las ramas muertas de Acropora cervicornis que se encuentran sobre el fondo.
Tallas y estado de desarrollo de los peces
En promedio, las tallas encontradas para adultos (12.6 cm), subadultos (6.6 cm) y juveniles (2.6 cm) de Stegastes planifrons en este estudio coinciden con las registradas en otros sitios del Caribe (Williams 1978, Humann 1994, Lirman 1994); sin embargo, algunas de las tallas de adultos fueron superiores (16 cm) a las máximas tallas encontradas en dichos estudios (15 cm), debido posiblemente a que el método visual empleado en la medición de los peces se presta para sobrevalorar su longitud.
La gran mayoría de juveniles se encontraron dentro de los territorios de los adultos o subadultos donde continuamente fueron perseguidos, pero pudieron evitar ser excluidos de los territorios porque sus pequeños tamaños les permiten ocultarse en las oquedades del sustrato; este fenómeno también fue observado por Lirman (1994). Choat (1991) reconoce que el rápido crecimiento de los peces en las primeras etapas requiere del acceso a grandes cantidades de proteína y que por tanto, los juveniles de algunas especies de herbívoros deben pasar por un periodo de carnívoros consumiendo zooplancton o pequeños invertebrados, antes de adoptar su dieta herbívora definitiva; de esta manera, se podría explicar la presencia de juveniles de S. planifrons entre los territorios de adultos, ya que así lograrían beneficiarse de los recursos defendidos por los adultos, los cuales son ricos en pequeños invertebrados móviles (Sammarco et al., 1986; Zeller, 1988).
Ante esta aparente falta de motivo para morder el coral, cabe suponer que no hay un efecto directo de los juveniles de Stegastes planifrons en la perdida de tejido coralino por acción del mordisqueo sino un efecto potencial, puesto que de su supervivencia en el arrecife dependería el reemplazo de adultos que si muerden el coral. La proporción entre adultos y juveniles encontrada (3:1) garantizaría dicha renovación de las poblaciones del pez en las formaciones coralinas estudiadas y es similar a lo encontrado por Williams (1978) y Clifton y Clifton (1998).
Densidad
Puesto que la mayoría de trabajos realizados con peces arrecifales -a nivel local y regional- se han orientado a comprender la estructura de la comunidad de peces utilizando distintas metodologías (Thresher, 1977; Gladfelter y Gladfelter, 1978; Ogden y Ebersole, 1981; Mejía, 1.997; Clifton y Clifton, 1998) no es posible contrastar ampliamente los resultados de las densidades obtenidas en esta investigación. Dentro de los pocos datos que se pueden confrontar, figuran los registros de densidad de S. planifrons en otros parches de Acropora cervicornis del Mar Caribe, realizados por Itzkowitz (1978) en Jamaica con un valor de 1.6 ind*m-2 y por Robertson et al. (1981) en Panamá con 1.24 ind*m-2, cuyos valores son similares al encontrado en este estudio para el hábitat ACER (1.56 ind*m-2). Con respecto a APAL, la densidad registrada en este estudio (0.6 ind*m-2) es similar a la encontrada recientemente por Lirman (1999) en arrecifes de La Florida (0.5 ind*m-2). En cuanto al hábitat MONT, se encontró una densidad de S. planifrons semejante (0.6 a 0.5 ind*m-2) a la de los censos llevados a cabo en los dos últimos años en arrecifes de Islas del Rosario (Rodríguez-Ramírez y Garzón-Ferreira, 2000). Si bien, se ha reconocido que la especie puede ubicarse sobre una gran variedad de sustratos (Ebersole, 1985; Tolimieri, 1995), no hay datos disponibles de otras áreas del Caribe que permitan comparar las densidades de S. planifrons en el hábitat COLP.
Teniendo en cuenta lo anterior y ante la carencia de trabajos previos en el área de estudio que permitan establecer si las densidades de S. planifrons han cambiado en los últimos años como consecuencia del deterioro generalizado de los arrecifes coralinos en la década de los 80's y en especial de las poblaciones de acropóridos (Garzón-Ferreira y Cano, 1991; Garzón-Ferreira, 1997), la semejanza entre las densidades del pez registradas para otros sitios del Caribe (Itzkowitz, 1978; Robertson et al., 1981) antes de que dichas mortandades se presentaran, puede señalar que a pesar del menoscabo de su hábitat principal (ACER), las densidades de S. planifrons no han variado en este hábitat. Es posible pensar que para un pez que mide en promedio 12.6 cm los restos de Acropora cervicornis sobre el fondo arenoso provean el refugio necesario para vivir y por tanto estar ocupado por los peces en una mayor densidad. Lo anterior estaría relacionado con la presencia de grupos de adultos "sin territorio" (hasta de cinco individuos) que fueron observados en ACER merodeando y sosteniendo encuentros agnósticos con los "propietarios" de los territorios ya constituidos en busca de dichos refugios para establecerse. En consecuencia, se sugiere que la alta densidad poblacional encontrada en ACER se debe a que este hábitat proporciona los refugios más pretendidos por S. planifrons. Es importante anotar que los resultados del presente estudio apoyan la hipótesis planteada recientemente por varios investigadores (Garzón-Ferreira, com. pers.; Precht et al., 2000), en la cual se propone que el deterioro del hábitat principal de S. planifrons (ACER) ha ocasionado un cambio en la distribución de esta damisela y que posiblemente se ha desplazado a otros sitios del arrecife, especialmente al hábitat MONT. Aunque los datos que se tienen acerca de las densidades del pez en APAL y MONT son muy recientes (Lirman, 1999; Rodríguez-Ramírez y Garzón-Ferreira, 2000) y no son suficientes para demostrar que los peces se han "desplazado" a otros lugares del arrecife en busca de sitios más adecuados para la instalación de sus territorios, el hecho de no haber encontrado diferencias significativas entre la densidad de S. planifrons en el hábitat APAL, identificado como uno de los más importantes para S. planifrons por Itzkowitz (1977), y las densidades de los hábitats MONT y COLP apoya la idea de que el pez está utilizando nuevos sitios en el arrecife.
Mientras algunos autores sugieren que la disminución de grandes depredadores de peces debida a la sobrepesca ha estimulado la proliferación de damiselas (Ogden y Ogden, 1998), entre las que podría incluirse a S. planifrons, otros sostienen que este factor no ha sido decisivo en la presencia de la especie en otros hábitats distintos a los conocidos (Precht et al., 2000). Si bien, estos aspectos -depredación y sobrepesca- no fueron evaluados en la presente investigación, cabe anotar que de las cuatro especies de peces identificadas como depredadores de S. planifrons (Randall, 1967) solo dos, Aulostomus maculatus y Caranx ruber, fueron observadas muy ocasionalmente en el área de estudio así como otros depredadores que eventualmente también podrían ser consumidores de las damiselas, entre los que se distinguen los meros y chernas (Serranidae), pargos (Lutjanidae) y roncos (Haemulidae). La falta de refugios disponibles en ACER y APAL puede responder a que la densidad en estos hábitats no haya aumentado, a pesar de que la sobrepesca y consecuente disminución de depredadores ha sido reportada para el área (Garzón-Ferreira y Cano, 1991).
Tamaños de los territorios y los céspedes
El presente estudio aporta datos acerca del área ocupada por S. planifrons sobre distintos tipos de ensamblajes coralinos. El único dato previo sobre el tamaño del territorio, señala que Stegastes planifrons puede defender espacios hasta de 4.5 m de diámetro (~15 m2) (Thresher, 1980), el cual es muy superior en comparación al valor máximo encontrado en el presente estudio (2.45 m2), posiblemente porque dicho autor tuvo en cuenta toda el área que es transitada por el pez durante periodos de tiempo más largos y no restringió dicha área al espacio defendido por el pez.
Las áreas ocupadas fueron diferentes entre los hábitats estudiados y estuvieron relacionadas inversamente con la densidad. Como el tamaño del territorio es la cantidad de espacio sobre el arrecife que un pez puede defender ante otros peces, sean estos de su misma especie o de otras especies (Myrberg y Thresher, 1974; Thresher, 1976), la relación encontrada entre el tamaño del territorio y la densidad de peces puede ser explicada en términos de competencia intraespecifica, de modo que menores áreas pudieron ser mantenidas por S. planifrons en ACER dada la alta concentración de individuos.
En cuanto al área de los céspedes de S. planifrons, se destaca el trabajo realizado por Robertson et al. (1981), quien determinó que el valor promedio de los céspedes es 0.16 m2 en el hábitat ACER. Esta cifra es muy semejante al área de césped estimada aquí para dicho hábitat (0.15 m2). Para los otros hábitats no hay antecedentes.
En general, las áreas de los céspedes cultivados por un pez estuvieron alrededor de 0.1 m2, siendo significativamente menores en el hábitat APAL y semejantes entre los hábitats ACER, COLP y MONT. Teniendo en cuenta que el área donde crece el césped de algas no hace parte de los procesos constructivos del arrecife, entendidos estos como los sitios donde se está dando paso a la acumulación de carbonato de calcio por parte de los corales o algas calcáreas (Birkeland, 1977; Birkeland, 1997), se sugiere que el efecto de S. planifrons es importante y puede tener otras implicaciones en la dinámica de los arrecifes que aún se encuentran escasamente entendidas (Nyström et al., 2000). A continuación se mencionan algunos elementos que en términos generales pueden estar relacionados con el área de los céspedes y en particular cuáles aspectos pueden estar involucrados en las diferencias encontradas entre los hábitats.
Al interior de un territorio, los céspedes estuvieron distribuidos generalmente en varios parches y ocuparon máximo el 25% del área total. Este hecho puede estar relacionado con varios aspectos: 1. los requerimientos nutricionales del pez pueden ser suplidos por estas áreas de césped (Lassuy, 1980; Lobel, 1980; Klumpp et al., 1987), 2. la zona donde no hay césped puede constituirse como una franja de separación entre territorios vecinos (Robertson et al., 1981), 3. las áreas libres de césped serían el sustrato donde el pez expandiría sus céspedes en un futuro cercano (Kaufman, 1977). Adicionalmente, como los territorios de S. planifrons son continuamente asediados por otros peces (loros y cirujanos) y ante cada uno de ellos la exclusión es diferente (Myrberg y Thresher, 1974; Russ, 1987) y no siempre es 100% efectiva (Klumpp y Polunin, 1989), cabe suponer que resulta ventajoso para S. planifrons tener varios céspedes que sirvan como fuente de alimentación y que a su vez contrarresten el pastoreo ocasional de los otros herbívoros.
Se había demostrado que el tamaño de los céspedes aumentaba con la densidad de peces, es decir, que las damiselas son capaces de defender céspedes más grandes cuando están en grupos que cuando están solas (Sammarco y Williams, 1982; Foster, 1985). En nuestro caso se encontró que el área de césped defendida por un pez fue notoriamente mayor cuando las densidades de las damiselas fueron altas solo en las dos bandas del hábitat ACER. Sin embargo, la correlación no significativa entre la densidad de S. planifrons y el área total de céspedes al combinar todas las bandas de muestreo, sugiere que tanto para ACER como para los demás hábitats, otros factores deberían ser considerados: 1. la productividad del césped al ser la fuente principal de alimento del pez (Russ, 1987), 2. las capacidades competitivas de las especies coralinas frente a los céspedes de algas en cuanto a tasas de crecimiento y regeneración de tejido (Birkeland, 1977; Meesters, 1994), 3. la interacción con otros agentes de mortalidad coralina (Brown, 1997), 4. la actividad de S. planifrons y 5. la susceptibilidad del sustrato para ser mordido por el pez.
En cuanto a la productividad de las algas, por ejemplo, se ha establecido que es mayor en las zonas más someras de los arrecifes y a esta razón se atribuye la alta presencia de peces herbívoros allí (Lewis y Wainwright, 1985; Choat, 1991), entre los que se incluyen a las damiselas (Foster, 1985). La alta productividad de las áreas de pastoreo se ha relacionado principalmente con la mayor disponibilidad de luz (Hay, 1991). De acuerdo con lo anterior, es posible exp1icar que las menores áreas de céspedes de Stegastes planifrons fueran encontradas precisamente en el hábitat más somero (APAL), en el cual céspedes pequeños pero muy productivos suplirían los requerimientos nutricionales del pez. Además, las menores áreas del césped en APAL pueden ser debidas a que la especie característica de este hábitat, Acropora palmata, posee altas tasas de crecimiento y regeneración de tejido (Meesters y Bak, 1995) y es capaz de contrarrestar el crecimiento de algas, lo cual puede estar compensando el efecto del pez de manera más eficiente en este hábitat que en los demás. El tamaño del territorio y el área del césped mantenido por un pez está directamente relacionado con su talla, tal y como se ha planteado para otras especies territoriales (Foster, 1985). Los céspedes de algas resultan atractivos para otros herbívoros (Kaufman, 1977), principalmente loros y cirujanos, que llegan a medir hasta dos y tres veces más que un S. planifrons (Humann, 1994), de modo que los S. planifrons de mayor talla serían más efectivos en la defensa de territorios y céspedes.
CONCLUSIONES
Las poblaciones de Stegastes planifrons en las formaciones coralinas estudiadas están aprovechando de manera importante cuatro tipos de hábitat (ACER, APAL, MONT y COLP), en los cuales las densidades del pez fueron significativamente diferentes. La más alta densidad de peces se registró en el hábitat ACER (1.52 terr*m-2), debido a que la complejidad del sustrato es suficiente para que las poblaciones de S. planifrons encuentren refugio, seguida de APAL (0.6 terr*m-2), COLP (0.55 terr*m-2) y por último MONT (0.33 terr*m-2).
El área de territorios por pez fue en promedio de 0.81 m2, siendo significativamente menor en ACER (0.60 m2) dada la alta presencia de conespecíficos. El área de céspedes promedio mantenida por un pez también fue diferente entre los tipos de hábitat siendo significativamente menor en APAL (0.07 m2), gracias a que esta especie posee altas tasas de crecimiento y regeneración de tejido que contrarrestan el crecimiento de los céspedes.
Las altas densidades de S. planifrons y el tamaño de sus céspedes, sugieren que este pez arrecifal puede estar contribuyendo de manera importante con la perdida de tejido coralino y que puede estar desempeñando un papel significativo en la dinámica de las formaciones arrecifales estudiadas.
AGRADECIMIENTOS
Los autores desean expresar sus agradecimientos al apoyo de COLCIENCIAS e INVEMAR por la financiación y el apoyo logístico para el desarrollo del proyecto "Sistema para el Monitoreo para los Ambientes Arrecifales en Colombia y Evaluación de los Agentes de Mortalidad Coralina" (código 2105-09-327-97). Gracias a María Catalina Reyes, Diego Luis Gil y Nazira Mejía por la ayuda y grata compañía en las salidas de campo y demás menesteres. A Sven Zea por sus valiosos comentarios y asesoría. A Luz Stella Mejía y Oscar David Solano porque con sus comentarios y sugerencias contribuyeron en la evaluación y mejoramiento del manuscrito final. Contribución No. 740 del Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" INVEMAR.
BIBLIOGRAFÍA
1 Barrios, L.M. 2001. Evaluación de las principales condiciones de deterioro de corales pétreos en el Caribe Colombiano. Tesis M. Sc. Biol. Mar. Univ. Nacional de Colombia, Santa Marta, 120 p. [ Links ]
2 Birkeland, C. 1977. The importance of rate of biomass accumulation in early succesional stages of benthic communities to the survival of coral recruits. Coral Ref. Symp. 1:15-21 Miami,. [ Links ]
3 Birkeland, C. 1997. Life and death of coral reefs. Chapman y Hall, New York, 536 p. [ Links ]
4 Brawley, S.H. y W.H. Adey. 1977. Territorial behavior of threespot damselfish (Eupomacentrus planifrons) increases reef algal biomass and productivity. Env. Biol. Fish. 2: 45-51. [ Links ]
5 Brown, B.E. 1997. Disturbances to reefs in recent times: 354-379. En C. Birkeland (Ed.). Life and death of coral reefs. Chapman y Hall, New York. [ Links ]
6 Bruckner, A.W. y R.J. Bruckner. 2000. Parrotfish predation on live coral: "spot biting" and "focused biting". Coral Reefs 19: 50. [ Links ]
7 Carpenter, R.C. 1997. Invertebrate predators and grazers: 198-229 en C. Birkeland (Ed.). Life and death of coral reefs. Chapman y Hall, New York. [ Links ]
8 Clifton, K.E. y L.M. Clifton. 1998. A survey of fishes from various coral reef habitats within the Cayos Cochinos Marine Reserve, Honduras. Rev. Biol. Trop., 46 Supl. 4: 109-124. [ Links ]
9 Choat, J.H. 1991. The biology of herbivorous fishes on coral reefs: 120-155. En: P. Sale (Ed.). The ecology of fishes on coral reefs. Academic Press, San diego. [ Links ]
10 DeLoach, N. 1999. Ref. fish behavior: Florida, Caribbean, Bahamas. 1st Edition. New World Publications, Inc., Verona. 359 p. [ Links ]
11 Ebersole, J.P. 1985. Niche separation of two damselfish species by aggression and differential microhabitat utilization. Ecology 66 (1): 14-20. [ Links ]
12 Foster, S. 1985. Size-dependent territory defense by a damselfish: a determinant of resource use by group-foraging surgeonfishes. Oeocologia (Berlin) 67: 499-505. [ Links ]
13 Garzón-Ferreira, J. 1997. Arrecifes coralinos: ¿Un tesoro camino a la extinción?. Colombia. Ciencia y Tecnología 15(1): 11-19. [ Links ]
14 Garzón-Ferreira, J., y M. Cano. 1991. Tipos, distribución, extensión y estado de conservación de los ecosistemas marinos costeros del PNNT. Versión presentada al 7o Concurso Nacional de Ecología "Enrique Pérez Arbeláez", FEN Colombia, Bogotá, 82 p. [ Links ]
15 Garzón-Ferreira, J., J.M. Díaz, y S. Zea. 1996. Coral health assessment in four southwestern Caribbean Atolls. Ponencia presentada en el 8th Int. Coral Reef Symp., Panamá. [ Links ]
16 Garzón-Ferreira, J., J. Cortés, A. Croquer, H. Guzmán, Z. Leao y A. Rodríguez-Ramírez. 2000. Status of coral reefs in the Southern Tropical America: Brazil, Colombia, Costa Rica, Panamá and Venezuela: 331-348. En C. Wilkinson (Ed.) Status of coral reefs of the world: 2000. Australian Institute of Marine Science. Townsville. [ Links ]
17 Gladfelter, W.B. y E.H. Gladfelter. 1978. Fish community structure as a function of habitat structure on West Indian patch reefs. Rev. Biol. Trop. 26 (supl.1): 65-84. [ Links ]
18 Glynn, P.W. y M. Colgan. 1988. Coral defensive and increment of diversity by territorial damselfishes. Coral Reef Symp 2: 157-163 Proc. 6th Int. Australia. [ Links ]
19 Goreau, T.J., J. Cervino, M. Goreau, R. Hayes, M. Hayes, L. Richardson, G. Smith, K. DeMeyer, I. Nagelkerken, J. Garzón-Ferreira, D. Gil, G. Garrison, E. H. Williams, L. Bunkley-Williams, C. Quirolo, K. Patterson, J. W. Porter y K. Porter. 1998. Rapid spread of diseases in Caribbean coral reefs. Rev. Biol. Trop., 46 Supl. 5: 157-171. [ Links ]
20 Hay, M.E. 1991. Fish-seaweed interactions on coral reefs: effects of herbivorous fishes and adaptations of their prey: 96-119. En P. F. Sale (Ed.). The ecology of fishes on coral reefs. Academic Press, San diego. [ Links ]
21 Humann, P. 1994. Reef fish identification. New World Publications, Inc. 2nd Edition, 400 p. [ Links ]
22 Itzkowitz, M. 1977. Spatial organization of the Jamaican damselfish community. J. Exp. Mar. Biol. Ecol. 28: 217-242. [ Links ]
23 Itzkowitz, M. 1978. Group organization of a territorial damselfish Eupomacentrus planifrons. Behaviour 65(1-2): 125-137. [ Links ]
24 Kaufman, L. 1977. The threespot damselfish: effects on benthic biota of Caribbean coral reefs.. Coral Reef Symp., 2: 559-564 Miami Proc. 3rd Int. [ Links ]
25 Klumpp, D.W. y N.V.C. Polunin. 1989. Partitioning among grazers of food resources within damselfish territories on a coral reef. J. Exp. Mar. Biol. Ecol. 125: 145-169. [ Links ]
26 Klumpp, D.W., D. McKinnon y P. Daniel. 1987. Damselfish territories: zones of high productivity on coral reefs. Mar. Ecol. Prog. Ser. 40: 41-51. [ Links ]
27 Knolwton, N., J. Lang, y D. Keller. 1990. Case study of natural population collapse: post-hurricane predation on Jamaican staghorns corals. Smithsonian Institution Press, Washington, 25 p. [ Links ]
28 Lassuy, D.R. 1980. Effects of "farming" behavior by Eupomacentrus lividus y Hemiglyphidodon plagiometopon on algal community structure. Bull. Mar. Sci. 30: 290-303. [ Links ]
29 Lewis, S.M. y P.C. Wainwright. 1985. Hervibore abundance and grazing intensity on a Caribbean coral ref.. J. Exp. Mar. Biol. Ecol. 87: 215-228. [ Links ]
30 Lirman, D. 1994. Ontogenic shifts in habitat preferences in the threespot damselfish, Stegastes planifrons (Cuvier), in Roatan Island, Honduras. J. Exp. Mar. Biol. Ecol. 180: 71-81. [ Links ]
31 Lirman, D. 1999. Reef fish communities associates with Acropora palmata relationships to benthic attributes. Bull. Mar. Sci. 65(1): 235-252. [ Links ]
32 Lobel, P. 1980. Herbivory by damselfishes and their role in coral reef community ecology. Bull. Mar. Sci. 30: 273-289. [ Links ]
33 Meekan, M.G., A.D.L. Steven y M.J. Fortin. 1995. Spatial patterns in the distribution of damselfishes on a fringing coral reef. Coral Reefs 14:151-161. [ Links ]
34 Meesters, E.H. 1994. The function of damage and regeneration in the ecology of reef-building corals (Scleractinia). Proefshrifts Universiteit van Amsterdam, Holanda, 122 p. [ Links ]
35 Meesters, E.H. y R.P.M. Bak. 1995. Age-related deterioration of a physiological function in the branching coral Acropora palmata: 95-103. En E. H. Meesters (Ed.). The function of damage and regeneration in the ecology of reef-building corals (Scleractinia). Proefshrifts Universiteit van Amsterdam, Holanda. [ Links ]
36 Mejía. L.E. 1997. Comunidades ícticas de los cayos colombianos de San Andrés y Providencia y su relación con la estructura y salud arrecifal. Tesis M. Sc. Biol. Mar. Univ. Nacional de Colombia, Bogotá, 112 p. [ Links ]
37 Myrberg, A. y R. Thresher. 1974. Interespecific aggression and its relevance to the concept of territoriality in reef fishes. Amer. Zool. 14: 81-96. [ Links ]
38 Nyström, M., C. Folke y F. Moberg. 2000. Coral reef disturbance and resilience in a human-dominated enviroment. Trends Ecol. Evol. 15(10): 413-417. [ Links ]
39 Ogden, J.C. y J.P. Ebersole. 1981. Scale and community structure of coral reef fishes: a long-term study of a large artificial reef. Mar. Ecol. Progr. Series 4: 97-103. [ Links ]
40 Ogden, J.C. y N.B. Ogden. 1998. Reconnaissance survey of the coral reefs and associated ecosystems of Cayo Cochinos, Honduras. Rev. Biol. Trop. 46 Supl. (4):67-74. [ Links ]
41 Prahl, H. von. y H. Erhardt. 1985. Colombia, corales y arrecifes coralinos. FEN Colombia. Editorial Presencia LTDA, Bogotá, 120 p. [ Links ]
42 Precht, W.E., L.S. Kaufman y R.B. Aronson. 2000. Shifts in microhabitat utilization by the threespot damselfish Stegastes planifrons: implications for algal dynamics on Caribbean coral reefs. Coral Reef Symp.,: 125 Abstracts of 9th Int. Bali. [ Links ]
43 Randall, J.E. 1967. Food habits of reef fishes of the West Indies. Stud. Trop. Oceanogr. 5: 665-847. [ Links ]
44 Reyes-Nivia, M.C. 2000. Evaluación del efecto de la depredación por peces como agente de mortalidad coralina en arrecifes del Caribe colombiano. Tesis Biol., Universidad del Valle, Cali, 153 p. [ Links ]
45 Robertson, D.R. 1984. Cohabitation of competing territorial damselfishes on a Caribbean coral reef. Ecology 65(4): 1121-1135. [ Links ]
46 Robertson, D.R., S.G. Hoffman y J.M. Sheldon. 1981. Availability of space for the territorial Caribbean damselfish Eupomacentrus planifrons. Ecology 62(5): 1162-1169. [ Links ]
47 Robin, C.L. y A.H. Williams. 1985. A comparison between fore-reef and back-reef of the Diadema antillarum and Eupomacentrus planifrons populations in St. Croix Virgin Islands. Coral Reefs Symp Proc. 5th Int. [ Links ]
48 Rodríguez-Ramírez, A. y J. Garzón-Ferreira. 2000. Monitoring and status of coral reefs of Colombia. Coral Reefs Symp.,: 362 Abstr. 9th Int. Bali. [ Links ]
49.Rogers, C., G. Garrison, R. Grober, Z. Hillis, M. Frank. 1994. Coral reef monitoring manual for the Caribbean and Western Atlantic. pag.var Virgin Island National Park. USA. [ Links ]
50 Russ, G.R. 1987. Is rate of removal of algae by grazers reduced inside territories of tropical damselfishes? J. Exp. Mar. Biol. Ecol. 110: 1-17. [ Links ]
51 Salzwedel, H. y K. Müller. 1983. A summary of meteorological and hydrological data from the bay of Santa Marta, Colombian Caribbean. An. Inst. Inv. Mar. Punta de Betín 13: 67-83. [ Links ]
52 Sammarco, P.W. y A.H. Williams. 1982. Damselfish territoriality: influences on Diadema distribution and implications for coral community structure. Mar. Ecol. Prog. Ser. 8: 53-59. [ Links ]
53 Sammarco, P.W., J.H. Carleton y M.J. Risk. 1986. Effects of grazing and damselfish territoriality on bioerosion of dead corals: direct effects. J. Exp. Mar. Biol. Ecol. 98: 1-19. [ Links ]
54 Scoffin, T.P. 1993. The geological effects of hurricanes on coral reefs and the interpretation of storm deposits. Coral Reefs 12: 203-221. [ Links ]
55 Sokal, R. y F.J. Rohlf. 1995. Biometry. 3rd Edition. W. H. Freeman, San Francisco, 887 p. [ Links ]
56 Solano, O.D. 1987. Estructura y diversidad de la comunidad de corales hermatípicos en la bahía de Chengue (Parque Nacional Tayrona). Tesis M. Sc. Biol. Mar., Univ. Nacional, Bogotá, 111 p. [ Links ]
57 Solano, O.D., I. Gómez-Blanco, T. Camargo, J.E. Ortiz, E. Torres. 1992. Peces territoriales de Isla Pavitos, Parque Nacional Natural Islas del Rosario-Cartagena, Colombia. VII Seminario Nacional de Ciencias y Tecnologías del Mar, Cali: 291-203 p. [ Links ]
58 Tolimieri, N. 1995. Effects of microhabitat characteristics on the settlement and recruitment of a coral reef fish at two spatial scales. Oecología 102: 52-63. [ Links ]
59 Thresher, R. 1976. Field analysis of the territoriality of the three-spot damselfish, Eupomacentrus planifrons (Pomacentridae). Copeia 2: 265-276. [ Links ]
60.Thresher, R. 1977. Ecological determinants of social organization of reef fishes. Coral Reef Symp, 2: 551-557 Proc. 3rd Int Miami. [ Links ]
61 Thresher, R. 1980. Reef fish. Behavioral and ecology on the reef and in the aquarium. The Palmmeto Publishing Company. St. Petesburg. USA, 171 p. [ Links ]
62 Williams, A.H. 1978. Ecology of three-spot damselfish: social organization, age structure, and populations stability. J. Exp. Mar. Biol. Ecol. 34: 197-213. [ Links ]
63 Zeller, D. 1988. Short-term of territoriality of a tropical damselfish and experimental exclusion of large fishes on invertebrates in algal turfs. Mar. Ecol. Prog. Ser. 44: 85-93. [ Links ]
FECHA DE RECEPCIÓN: May 11, 2001 FECHA DE ACEPTACIÓN: Jul 10, 2002.