Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.32 no.1 Santa Marta Jan./Dec. 2003
ESQUEMAS DE DISTRIBUCIÓN DE ESPONJAS ARRECIFALES (PORIFERA) DEL NOROCCIDENTE DEL GOLFO DE URABÁ, CARIBE SUR, COLOMBIA
PATTERNS OF REEF SPONGE DISTRIBUTION IN THE NORTH-WEST URABÁ GULF, SOUTHERN CARIBBEAN, COLOMBIA
Diego Valderrama y Sven Zea
Universidad Nacional de Colombia (Departamento de Biología); Instituto de Investigaciones Marinas y Costeros - INVEMAR, Cerro Punta de Betín, A.A. 1016, Santa Marta, szae@invemar.org.co (S.Z.); diego_valderrama@eudoramail.com (D.V.).
RESUMEN
El costado noroccidental del Golfo de Urabá en el sur del Mar Caribe alberga variadas zonas coralinas sometidas a condiciones de alta turbulencia y salinidad y turbidez fluctuantes. Allí se estudió la composición y densidad de esponjas marinas (Porifera) y se analizó su relación con factores físicos y características estructurales de las zonas coralinas. En total, 65 especies de la clase Demospongiae y una especie de la clase Calcarea fueron registradas dentro de transectos de banda (20 m2) dispuestos en 11 estaciones entre 1 y 17 m de profundidad. La densidad de esponjas en el Urabá tendió a ser superior a la encontrada en otras áreas de condiciones óptimas para el desarrollo arrecifal (ej. Atolones remotos como Roncador, Serrana y Quitasueño, Caribe insular colombiano), posiblemente por un mayor volumen material orgánico en suspensión proveniente de los ríos. No obstante, tal efecto no se reflejó en la riqueza de especies del Golfo de Urabá, ya que solo un número limitado de especies (Niphates erecta, Iotrochota birotulata y Mycale laevis) tuvo densidades elevadas. Análisis multivariados permitieron establecer que la composición de la comunidad de esponjas varía a lo largo del gradiente de profundidad y entre hábitats (zonas coralinas y unidades geomorfológicas) de manera similar a otras áreas coralinas del Caribe. Empero, la existencia de diferencias marcadas en composición taxonómica entre zonas someras (<4 m) y más profundas (>6 m), y el aumento brusco de la densidad a sólo 6 m de profundidad, parecen ser características únicas de Urabá. La ausencia de muchas especies y la baja densidad de esponjas en las zonas someras se pueden deber no sólo a las variables asociadas con la baja profundidad, especialmente la turbulencia, periódicamente muy alta en el área, sino también a grandes fluctuaciones de la salinidad en la superficie por descargas del río Atrato y otros ríos locales. En las estaciones someras y profundas en que la riqueza y densidad de esponjas fue baja, se encontraron las mayores densidades de erizos (especialmente Echinometra viridis), por lo que es posible que estos erizos estén jugando un papel controlador adicional sobre las poblaciones de esponjas.
PALABRAS CLAVE: Esponjas, Porifera, distribución, Baja salinidad, Alta turbidez.
ABSTRACT
The North-West of Urabá Gulf in the Southern Caribbean supports a variety of coral reef zones in conditions of high turbulence and fluctuating turbidity and salinity. Sponge composition and density were surveyed and their relationship with physical and structural features of the reef zones were analyzed. In total, 65 demosponges and 1 calcareous sponge species were encountered along belt transects (20 m2) on 11 stations between 1 and 17 m in depth. Sponge density in Urabá tended to be higher than in other areas with water conditions optimal for coral reef development (i.e. Ronacador, Serrana and Quitasueño remote oceanic atolls in the SW Caribbean, Colombia) due possibly to higher concentrations of organic suspended materials discharged from rivers. Nevertheless, this effect was not reflected in the Urabá`s species richness as just a limited number of species (Niphates erecta, Iotrochota birotulata and Mycale laevis) had high densities. Multivariate analyses showed that sponge community composition varies along a depth gradient and across habitats (coral and geomorphological zones), similar to the patterns observed in other Caribbean areas. However, marked taxonomic differences between shallow (<4 m) and deeper (>6 m) zones and the great increase of the sponge density below just 6 m, seem to be a unique feature of Urabá. The absence of many species and the low abundance of sponges in shallow zones (< 6 m) may be due, not only to the variables associated to low depth, like turbulence, which is periodically very b, but also to great fluctuations in surface salinity due to discharges of the Atrato and other local rivers. The shallow and deep stations that had low sponge richness and density, showed the greatest urchin densities (especially Echinometra viridis); therefore, it is possible that these urchins may be playing an additional controlling role on sponge populations.
KEY WORDS: Sponges, Porifera, Distribution, Low salinity, High turbidity.
INTRODUCCIÓN
Las esponjas son uno de los grupos de animales sésiles más abundantes y diversos de los fondos marinos (Zea, 1998). No obstante, las dificultades taxonómicas del grupo han dificultado tradicioanlmente su consideranción en estudios ecológicos (Rützler, 1978). Sólo hasta las últimas décadas, varios estudios cuantitativos de esponjas han logrado llevarse a cabo en diferentes complejos coralinos del Mar Caribe (Alcolado, 1979, 1985; Alvarez et al., 1990; Schmahl, 1990; Zea, 1993, 1994, 2001). Un conjunto de factores, tanto bióticos (ej. reclutamiento) como abióticos (ej. inclinación y tipo del sustrato) y en especial aquellos que varían con la profundidad (ej. turbulencia, intensidad lumínica, competencia con organismos fotosintetizadores de rápido crecimiento), parecen explicar en gran medida los esquemas de distribución de estos organismos en estos hábitats. En general, se ha observado poca variedad de especies y a veces baja densidad de individuos en ambientes someros, expuestos al oleaje, y con alta luminosidad, y un incremento gradual en términos de diversidad y abundancia de las esponjas conforme aumenta la profundidad (Alcolado, 1979; Díaz et al., 1990; Schmahl, 1990; Zea, 1993).
El predominio de las esponjas parece relacionarse con ambientes sujetos a condiciones adversas para el desarrollo arrecifal (Zea, 1994) o empobrecimiento de la cobertura de coral (Schmahl, 1990; Zea, 1993; para el Indo-Pacífico ver Wilkinson y Cheshire, 1989). No obstante, estos esquemas generales no son aplicables en algunas áreas del Caribe (ver discusión en Zea, 1993).
Buscando contribuir al conocimiento ecológico de organismos sésiles de hábitos alimentarios filtradores en regiones de condiciones sub-óptimas para el desarrollo arrecifal, el presente estudio establece los esquemas de distribución espacial y batimétrica de las esponjas marinas (Porifera) en zonas coralinas en el Golfo de Urabá en el Caribe colombiano, sometidas a condiciones de baja salinidad y alta turbidez del agua. Adicionalmente, se explora la relación de estos esquemas con factores físicos del ambiente (profundidad, grado de exposición al oleaje, turbidez) y estructurales de las zonas coralinas (rugosidad, cobertura de los corales y otros grupos sésiles).
ÁREA DE ESTUDIO
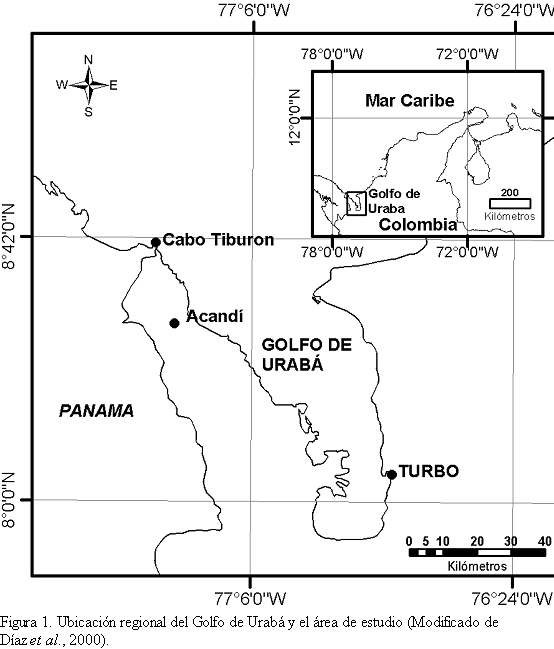
El Golfo de Urabá se encuentra localizado en la parte más meridional del Mar Caribe. Las formaciones coralinas se encuentran restringidas al sector noroccidental del golfo desde 8o 35' de latitud norte cerca a la localidad de Acandí hasta la frontera entre Colombia y Panamá en Cabo Tiburón (8o41'N), abarcando 12 kilómetros de costa (Figura 1). Esta área se encuentra bordeada por una terraza calcárea (principalmente arrecifes fósiles) sobre la cual predominan arrecifes frangeantes y algunos parches aislados (Díaz et al., 2000). La distribución de estas formaciones se encuentra limitada al sur por la influencia de grandes descargas de sedimentos y agua dulce del río Atrato y otros ríos menores (UNEP/IUCN, 1988) que actúan sinérgicamente con la dinámica de los vientos y las corrientes a lo largo del año (ver Zeigler y Athearn, 1971 y Chevillot et al., 1993). Por esta razón, se cree que el desarrollo arrecifal en esta área se ha llevado a cabo desde siempre bajo condiciones del agua sub-óptimas (baja salinidad y alta turbidez) para el crecimiento de organismos hermatípicos (Díaz et al., 2000).
De acuerdo con Díaz et al., (2000) en el área predominan cuatro zonas coralinas (dominadas por corales y algas) entre 1 y 18 m de profundidad, las cuales presentan un aumento gradual, en dirección SE-NW, del desarrollo arrecifal, la diversidad y la cobertura de coral:
Zona de Siderastrea siderea (SSI)
Esta zona se encuentra en aguas someras (1-4 m) sobre terrazas calcáreas (TS). Se caracteriza por la dominancia conspicua de colonias masivas, semiesféricas de Siderastrea siderea, las cuales generalmente se encuentran muy cerca una de las otras, cubriendo cerca de un 50% del fondo. A excepción de las formas algales (tapetes y algas costrosas principalmente), otros componentes bentónicos se encuentran muy dispersos.
Zona de Diploria strigosa-algas costrosas (DST)
Zona encontrada a profundidades de 2 a 9 m, sobre terrazas calcáreas profundas (TP). Se encuentra dominada notablemente por colonias incrustantes dispersas de Diploria strigosa, varias algas costrosas rojas, tapetes algales, algas frondosas y diversos octocorales gorgonáceos. También se encuentran otras especies de corales pétreos y diversas esponjas.
Zona de Agaricia spp. (AAG)
Domos coralinos (DC) y taludes (TA) cubiertos principalmente por los corales lechuga laminares Agaricia agaricites y/o A. tenuifolia (9-10 m de profundidad). Las pendientes profundas y la base de estos domos se encuentran cubiertas predominantemente por colonias masivas de Colpophyllia natans y Montastrea spp, y por colonias foliosas de Mycetophyllia spp.
Zona de corales masivos mezclados (MIX)
Tipo de zona coralina predominante en taludes (TA) y bases (BA) a profundidades mayores de 10 m. Se caracteriza por una cobertura densa de diversos corales escleractínios. Las esponjas, los gorgonáceos y las algas frondosas y costrosas en general se encuentran bien representados en este ambiente.
MATERIALES Y MÉTODOS
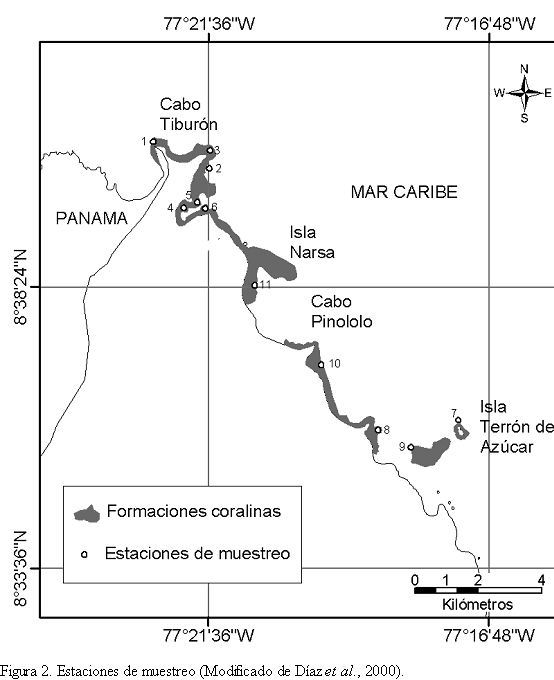
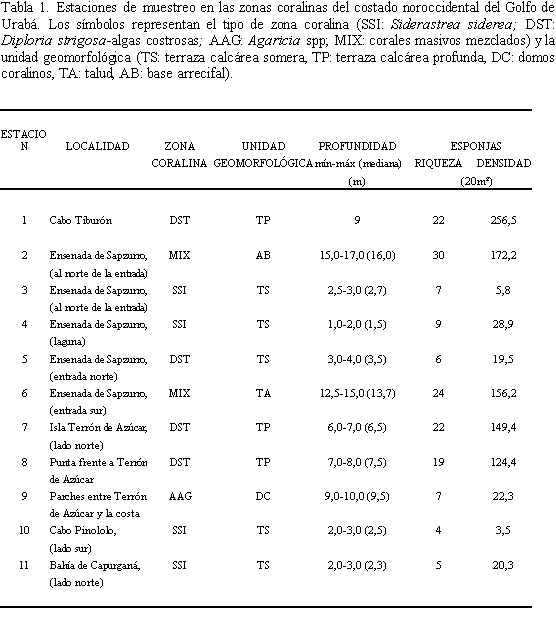
Los muestreos fueron llevados a cabo durante una expedición al Urabá realizada entre el 28 de septiembre y el 2 de octubre de 1995. Un total de 11 estaciones fueron visitadas entre 1 y 17 m de profundidad (Figura 2; Tabla 1). Cada una de las estaciones consistió de una parcela más o menos cuadrada de 400 m2, de cobertura coralina homogénea.
La composición y densidad de esponjas fueron estimadas a partir de censos dentro de corredores de 1 m de ancho a lo largo de tres transectos lineales (cadenas de 10 m de longitud) dispuestos sobre el fondo. La distancia lineal que ocupo cada cadena fue medida para determinar el área muestreada y estimar la rugosidad del sustrato (long. transecto/long. cadena). Los valores de densidad por estación fueron calculados para un área de 20 m2. De igual forma se cuantificó la densidad de erizos.
Mediante un reconocimiento visual de la parcela se estimaron de una manera aproximada características estructurales de las zonas coralinas como la cobertura relativa al total de sustrato duro de coral vivo, coral muerto, roca base, esponjas y grupos funcionales algales. Se midió la profundidad (mín.-máx.) y se estimó aproximadamente la visibilidad (distancia horizontal en m). Aunque en general la visibilidad tiende a disminuir con la profundidad por la disminución de la iluminación, en el intervalo de profundidades de este estudio la visibilidad estuvo gobernada más por la cantidad de materia orgánica en suspensión que por la intensidad de la luz.
Con el fin de establecer los esquemas de similitud en la composición y abundancia de esponjas entre las estaciones, éstas fueron agrupadas, de acuerdo con la densidad de las especies, por medio de un análisis de agrupamiento (clasificación normal). Se utilizó el índice de distancia de Bray-Curtis, con transformación logarítmica [log10(x+1)] de los datos y el método de agrupamiento promedio no ponderado (UPGMA) (Field et al., 1982). La transformación logarítmica produjo los esquemas de similitud entre estaciones más consistentes con el diseño muestral. Los grupos de estaciones fueron definidos a un nivel de afinidad variable (Kluijver, 1991). Los valores de cobertura (mínimo-máximo, promedio) de componentes bentónicos y de condiciones ambientales fueron tabulados de acuerdo a los diferentes grupos definidos por la clasificación para poder relacionarlos con los esquemas de composición y abundancia de las esponjas.
De manera complementaria se llevo a cabo una ordenación de las estaciones con datos transformados logarítmicamente [log10(x+1)] mediante el análisis de correspondencia de Hill (DRA) con la opción de disminuir el peso de las especies raras (Hill, 1979). Las coordenadas de las estaciones de los cuatro primeros ejes DRA se correlacionaron con la densidad de las esponjas y las variables ambientales buscando identificar las especies de esponjas o variables asociadas con los esquemas de distribución. Fue utilizado el índice no paramétrico de correlación de rangos de Spearman (ver Fowler y Dunlap, 1986).
Para detectar las especies características de cada uno de los grupos de estaciones obtenidos mediante la clasificación normal, se realizó un análisis inverso siguiendo las metodologías de Kaandorp (1986) y Kluijver (1991). Las densidades por grupo y la frecuencia de ocurrencia fueron recalculadas para cada una de las especies. Las especies fueron identificadas como características en aquellos grupos en los que cayó el 70% de su densidad acumulada (de la mayor a la menor). Finalmente, se reordenó la tabla de densidad de cada grupo y de los conjuntos de grupos según los resultados del dendograma normal.
RESULTADOS
Riqueza y densidad
Se encontraron 66 especies de esponjas en los transectos de banda. El número de especies por estación varió entre 4 y 30. La densidad por estación varió entre 3,5 y 266,5 ind./20 m2 (Tabla 1).
Las especies que presentaron las mayores densidades (número de individuos mínimo, promedio (en cursiva) y máximo respecto a las 11 estaciones cuantificadas) fueron Niphates erecta (0,8-16,9-71,74 ind./20 m2), Iotrochota birotulata (0,7-12,9-37,9 ind./20 m2), Mycale laevis (0,8-9,7-32,0 ind./20 m2), Agelas sventres (1,3-4,0-19,6 ind./20 m2), Pseudaxinella(?) zeai (5,6-3,5-32,9 ind./20 m2), Ircinia felix (0,7-3,0-13,5 ind./20 m2), Aplysina archeri (1,5-2,7-17,7 ind./20 m2), Scopalina ruetzleri (0,7-2,6-10,2 ind./ 20 m2), Ircinia sp. (posiblemente Ircinia felix) (0,7-2,4-5,5 ind./20 m2) y Cliona varians (0,7-2,2-8,7 ind./20 m2).
Clasificación
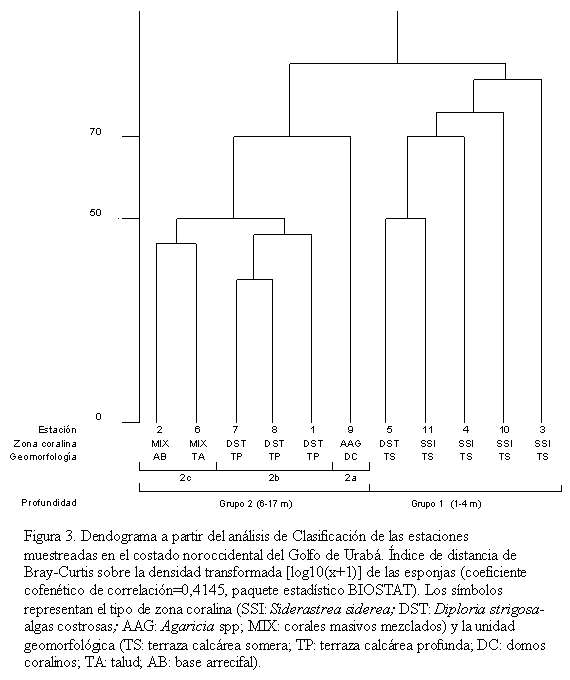
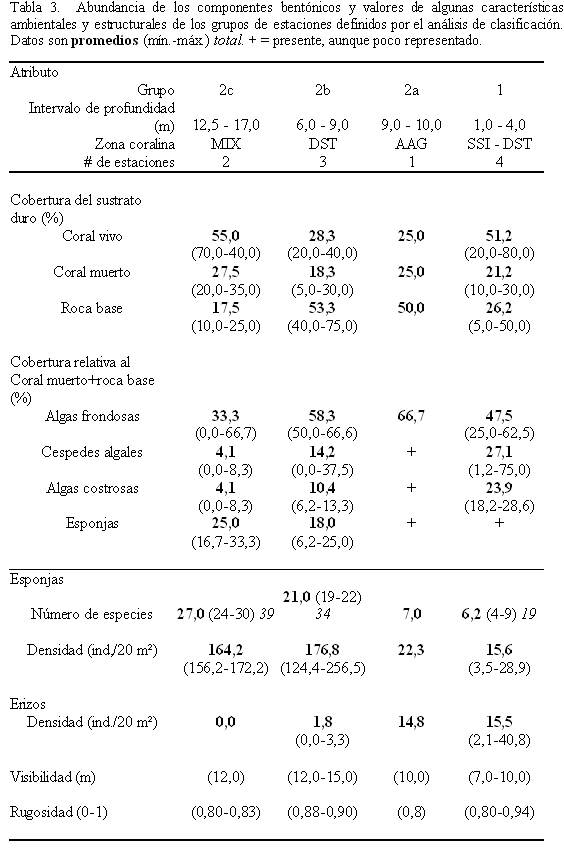
El análisis de clasificación normal segregó las estaciones en dos grandes grupos (Figura 3). El primero (Grupo 1) comprendió las estaciones someras (1-4 m prof.) de zonas coralinas del tipo Siderastrea siderea (SSI) y Diploria strigosa-algas costrosas (DST) desarrolladas sobre terrazas calcáreas someras (TS). El segundo (Grupo 2) incluyó estaciones de profundidades de 6 a 17 m, divididas en 2 subgrupos (Grupo 2b: 6-9 m prof. y Grupo 2c: 12,5-17 m prof.) y una estación aislada (Grupo 2a: 9-10 m prof.), cada uno caracterizado por un tipo de zona coralina y por una geomorfología particular.
De acuerdo con lo anterior, el análisis de clasificación evidencia diferencias consistentes de la comunidad de esponjas con la profundidad con el Grupo 1 conformado por las estaciones más someras, los Grupos 2a y 2b por estaciones de profundidad media y el Grupo 2c por estaciones de mayor profundidad. Adicionalmente, la composición de esponjas en las estaciones someras (Grupo 1) se relaciona estrechamente con la geomorfología, mientras que en las estaciones profundas (Grupo 2) se relaciona con el efecto combinado de la geomorfología y la zona coralina. El análisis también revela baha cohesividad dentro de los grupos. Las estaciones someras (Grupo 1) se mostraron porcentajes de similitud relativamente bajos y las estaciones de profundidad media, Grupos 2a y 2b, resultaron ser bastante disímiles entre si.
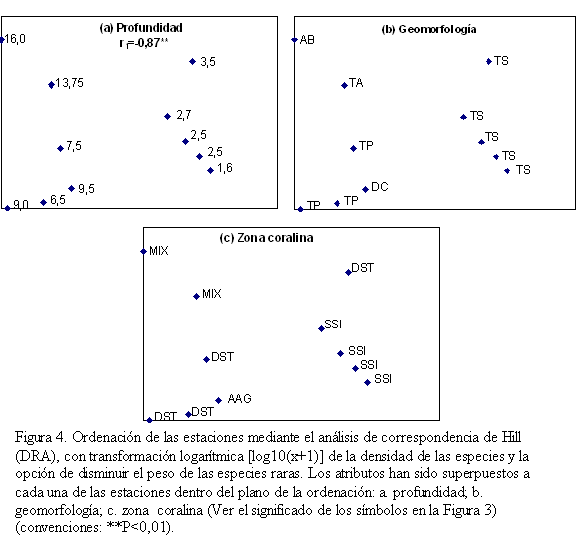
Ordenación
La ordenación de las estaciones produjo esquemas similares a los obtenidos con la clasificación normal (Figura 4). Los tres primeros ejes DRA explicaron un 94% de la variación (eje 1: 53,6%, eje 2: 31,6%, eje 3: 8,8%). La profundidad se correlacionó significativamente en forma negativa con el eje 1 DRA (r1=-0,87, p=0,007, n=11) (Figura 4a) por que las estaciones más someras (1-4 m) se aglutinaron al lado derecho del plano mientras que las estaciones de mayor profundidad (6-17 m) se ubicaron al lado izquierdo. Las estaciones de mediana profundidad (6-10 m; lado izquierdo abajo) se encuentran levemente separadas de las de mayor profundidad (12,5-17 m; lado izquierdo arriba); no obstante, la profundidad no se correlacionó significativamente con el eje 2 DRA. De forma similar, las estaciones tendieron a segregarse de acuerdo con la geomorfología (Figura 4b) y la zona coralina (Figura 4c).
Análisis inverso
Mediante el análisis de clasificación inverso se identificaron únicamente tres especies euritópicas, una de las cuales (Ircinia sp) se encontró en todas las estaciones mientras que las demás (Scopalina ruetzleri y Pseudaxinella reticulata) ocurrieron en grupos diversos o de condiciones extremas (Tabla 2).
El Grupo 1 presentó 12 especies características. De éstas, 11 se encontraron en forma exclusiva, por lo que el grupo es taxonómicamente muy distinto de los otros grupos de estaciones; tan sólo compartió un 42% de las especies con estaciones de profundidades mayores (> 6 m prof.). De otro lado, las especies características presentaron densidades muy bajas, registradas para cada caso en sólo una estación de las cinco que conforman el grupo (excepto Haliclona caerulea en dos estaciones). Este fenómeno es el causante de la alta variabilidad intragrupo evidenciada con el análisis de clasificación y refleja el azar predominante en la distribución de las especies dentro de este hábitat en particular.
Los grupos 2b y 2c fueron los más similares entre si y los mejor representados en cuanto a la composición y abundancia de las especies. Diez especies fueron características para ambos grupos, muchas de las cuales presentaron frecuencias de ocurrencia intragrupo superiores al 60%. Entre estas especies, Niphates erecta, Iotrochota birotulata y Mycale laevis, se encontraron en todos los grupos de estaciones y su densidad representó un 45% del número total de individuos registrados durante este estudio, por lo que fueron las especies más comunes en las zonas coralinas del Golfo de Urabá.
Además, los Grupos 2b y 2c se identificaron por un número alto de especies características de cada uno de los grupos (16 en el Grupo 2b y 24 en el Grupo 2c), algunas con alta frecuencia de ocurrencia. Las especies exclusivas (12 en el Grupo 2b y 19 en el Grupo 2c) fueron en cambio poco frecuentes; no obstante, en algunos casos sus densidades contribuyen de manera importante en la densidad total de las estaciones (ej. Topsentia ophiraphidites y Lissodendorix bylata en el grupo 2b y Pseudaxinella(?) zeai y Aplysina cauliformis en el grupo 2c), llegando a ser el componente dominante de las estaciones (ej. Pseudaxinella(?) zeai).
Lo observado en el grupo 2a contrasta respecto a lo que se esperaría de su fauna espongícola de acuerdo con su profundidad (comparar con el grupo 2b, leer los dos párrafos anteriores) ya que presento un número de especies y una densidad similar al Grupo 1, por lo cual los grupos de estaciones de profundidad media resultaron altamente disímiles en el dendograma producido por la clasificación normal.
Relación con otros factores físicos y estructurales de las zonas coralinas
Al analizar los valores promedio, máximos y mínimos de los atributos físicos y biológicos de los grupos arrojados por el análisis de clasificación (Tabla 3), se observa un leve aumento del número de especies en los grupos 2b y 2c respecto a los grupos 1 y 2a (19-30 vs. 4-9 especies./20 m2). El mismo esquema se observa con la densidad de esponjas (124,4-256,5 vs. 3,5-28,9 ind./20 m2). En cambio, los erizos fueron raros o ausentes en las estaciones de los grupos 2b y 2c, mientras que se tornaron conspicuos en los grupos 1 y 2a (0-3,3 vs. 2,1-40,8 ind./20 m2).
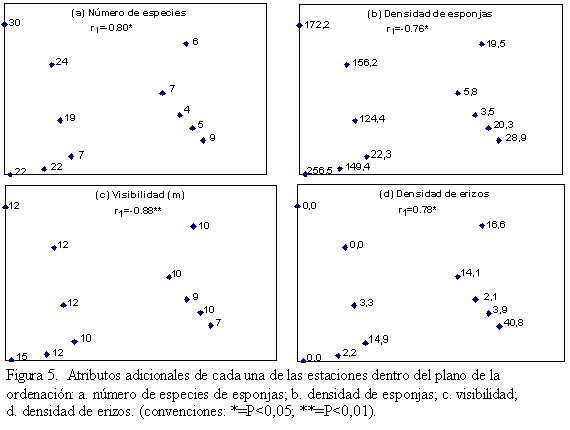
Con la correlación entre las coordenadas de las estaciones en el espacio de ordenación y las diferentes variables físicas y biológicas del entorno se obtuvieron resultados similares. El eje 1 DRA resultó significativamente correlacionado en forma negativa con el número de especies de esponjas (r1= -0,80, p=0,01, n=11) (Figura 5a), la densidad total de esponjas (r1=-0,76, p=0,01, n=11) (Figura 5b) y la visibilidad (r1=-0,88, p=0,005, n=11) (Figura 5c), mientras que en forma positiva se correlacionó con la densidad de erizos (r1=0,78, p=0,01) (Figura 5d). Lo anterior quiere decir que a lo largo de este eje a medida que disminuyen la profundidad (Figura 4a) y la visibilidad, disminuye el número de especies y la densidad de esponjas, mientras que aumenta la densidad de erizos.
Atributos de las estaciones como la cobertura de coral vivo y muerto, la cobertura de grupos funcionales algales, la rugosidad y la distancia relativa a las descargas de agua dulce del río Atrato, no resultaron correlacionados significativamente con los dos primeros ejes DRA.
DISCUSIÓN
Riqueza y densidad de esponjas
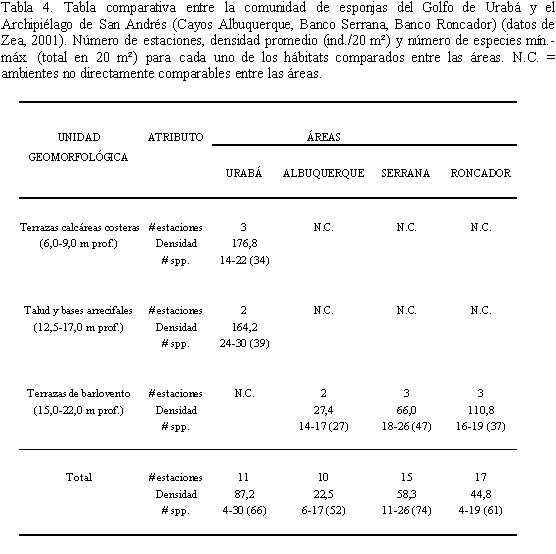
Al comparar la comunidad de esponjas del Golfo de Urabá con la de los arrecifes oceánicos remotos del Archipiélago de San Andrés, Colombia, en el Caribe suroccidental (Zea, 2001), es notable la existencia de densidades altas de esponjas en las zonas coralinas del Golfo (Tabla 4). Esto sugiere que la densidad de esponjas del Golfo de Urabá es superior a las encontradas en zonas de condiciones óptimas para el desarrollo arrecifal, posiblemente a causa de grandes volúmenes en el primero de material orgánico en suspensión, provenientes de influencias terrestres a través de los ríos (Wilkinson, 1988; Zea, 1994), los cuales parecen beneficiar a las poblaciones de organismos de hábitos alimentarios filtradores (Wilkinson y Cheshire, 1990) (ver también Valderrama y Zea, 2001).
En parte, este esquema se repite al comparar la densidad de esponjas del Golfo de Urabá con la de áreas de condiciones aparentemente intermedias para el desarrollo arrecifal, como es el Archipiélago de los Roques (Venezuela; Díaz et al., 1990). En esta área, las densidades de esponjas a 12 m de profundidad, alcanzan valores de tan sólo 5 ind./m2 en comparación con 12,8 ind./m2 en el Urabá. No obstante, a partir de esta profundidad, en los Roques la cobertura coralina disminuye considerablemente mientras que la densidad de esponjas aumenta progresivamente, llegando a ser superior a la de Urabá. Este esquema era predecible, ya que a lo largo del gradiente de profundidad se ha observado un cambio en el predominio de las comunidades sésiles, constituyendo las esponjas el componente dominante a las mayores profundidades (Zea, 1993), donde los efectos del oleaje, la radiación solar y las aguas dulces es menor, y la oferta de espacio es aprovechada por poblaciones de animales no dependientes en su nutrición de endosimbiontes fotosintetizadores. En forma similar a lo registrado en el Archipiélago de los Roques, en los arrecifes de los cayos de la Florida, las densidades de esponjas tienden a ser elevadas y a aumentar con la profundidad (3,3-12,1 y 6,0-17,5 ind./m2 a profundidades de 7-11 y 12-21 m respectivamente), pero allí parecen relacionarse con una cobertura baja de coral debida a temperaturas bajas del agua (Schmahl, 1990).
Lo observado en Cuba contrasta respecto al esquema anteriormente discutido, debido a la alta variabilidad en la densidad de esponjas en áreas relativamente cercanas a la ciudad de la Habana en el sur de la Isla (Alcolado, 1979, 1999). Las densidades más bajas han sido registradas en el lado opuesto de la isla, en áreas coralinas presumiblemente menos expuestas a influencias terrígenas (3,5 y 3,3 ind./m2 a 6 y 15 m de prof. respectivamente). No obstante, la pobreza de esponjas en el área ha sido atribuida al régimen hidrodinámico producido por los vientos (Alcolado, 1985) y al paso de ciclones (Alcolado, 1999).
Respecto a la riqueza de especies, no hubo un esquema consistente entre Urabá y el Archipielago de San Andrés (Tabla 4). En cambio, en la Bahía de Santa Marta (plataforma continental colombiana) se han registrado los valores más altos tanto de cobertura de esponjas como del número de especies en las zonas coralinas más cercanas a las fuentes de descaraga contintental y de influencia portuaria (Zea, 1994). Este hecho indica que una mayor densidad de esponjas en regiones de condiciones sub-óptimas para el desarrollo arrecifal no necesariamente implica un mayor número de especies involucradas.
Apoyando lo discutido anteriormente, la representación respecto al número total de individuos de las cuatro especies dominantes de Urabá (50%) fue superior a la del Archipiélago de San Andrés (25%) y a la de los cayos de la Florida (32%, Schmahl, 1990) aunque no para el de Los Roques (61%, Alvarez et al., 1990), el cual se encuentra sujeto a corrientes de aguas turbias provenientes de la laguna interna de éste pseudoatolón (Díaz et al., 1990). Con base en estas observaciones, es posible pensar que el efecto del ambiente sobre las esponjas en áreas de condiciones sub-óptimas para el desarrollo arrecifal es muy variable entre las especies, y en general sólo algunas pocas especies se ven ampliamente beneficiadas.
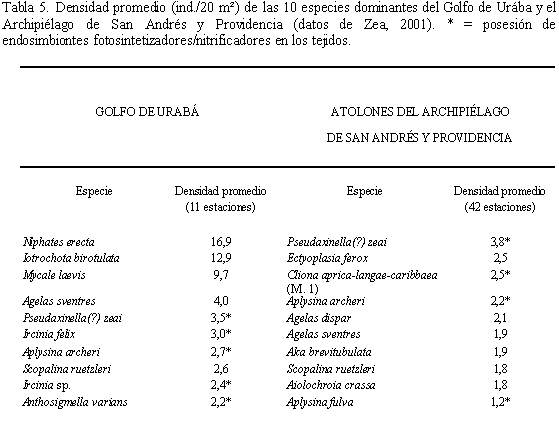
En concordancia con lo postulado por Wilkinson (1987) para las esponjas del Caribe, las comparaciones entre las esponjas del Golfo de Urabá y las del Archipiélago de San Andrés sugieren que las esponjas en estas áreas utilizan estrategias no dependientes de endosimbiontes fotosintetizadores/nitrificadores para suplir sus requerimientos energéticos. Entre las diez especies dominantes del Golfo de Urabá, un número similar e incluso superior a las del Archipiélago de San Andrés poseen endosimbiotes en sus tejidos (al menos registrados en la literatura, ver Rützler, 1990; Vicente, 1990; Díaz, 1997; Díaz y Ward, 1997; Tabla 5). Además, algunas de las especies dominantes del Archipiélago que poseen endosimbiontes (ej. Pseudaxinella(?) zeai y Aplysina archeri) se encuentran bien representadas en el Golfo de Urabá. Estas similitudes apoyan las conclusiones de Wilkinson (1987) al comparar comunidades de esponjas de arrecifes oceánicos del Caribe con las de Australia, ya que sugieren que en el Caribe, en zonas aparentemente pobres en nutrientes, de aguas cristalinas, las esponjas no compensan su nutrición con productos derivados de la fotosíntesis. En cambio refleja un posible carácter mixotrófico en las esponjas del Caribe. Por otro lado, debido a que las tres especies dominantes del Golfo de Urabá (Niphates erecta, Iotrochota birotulata y Mycale laevis), que constituyen el 45% del número total de individuos encontrados en los transectos, no poseen endosimbiontes en sus tejidos, y su densidad no es significativa en el archipiélago de San Andrés (Zea, 2001), es posible pensar que estas especies son enteramente heterotróficas [que no poseen endosimbiontes fotosintetizadores y obtienen energía del ambiente (Wilkinson, 1986)]. Lo anterior sustenta la conclusión anteriormente comentada de que estas especies se ven ampliamente favorecidas en el Golfo de Urabá por nutrientes derivados de influencias terrígenas (ver también Valderrama y Zea, 2001).
Niphates erecta fue la especie dominante tanto en las zonas coralinas del Golfo de Urabá como en los fondos rocoso-arenosos de la Isla Nelson (Trinidad y Tobago; Hubbard, 1990). Estas dos localidades presentan en común condiciones de alta turbidez y pulsos de baja salinidad, por lo que es posible que esta especie se encuentre muy bien adaptada a estas condiciones en particular.
Esquemas de distribución
El esquema general de distribución de las esponjas del Golfo de Urabá es similar al observado en otras áreas del Caribe (ver Alcolado, 1979; Díaz et al., 1990; Schmahl, 1990; Zea, 1993). Sin embargo, a diferencia de otros estudios, en Urabá la densidad de las especies no presenta una tendencia muy clara a aumentar gradualmente con la profundidad, sino que a partir de tan solo 6 m aumenta bruscamente y permanece relativamente alta hasta los 17 m (ver Tabla 3). Esto indica que los factores responsables tienen un efecto fuerte y restringido a los primeros metros de la columna de agua.
De Laubenfels (1932) demostró experimentalmente los efectos nocivos (hasta la muerte) que pueden causar salinidades por debajo de 20 sobre la esponja Iotrochota birotulata. En el área estuárica de la Ciénaga Grande de Santa Marta, donde la mayor parte del fondo esta formado por fango y algunas áreas pequeñas están constituidas de arena y sustrato duro, que sirven de asiento para la formación de bancos de ostras, Palacios (1978) llevo a cabo inventarios de organismos invertebrados, encontrando únicamente tres especies de esponjas, dos de las cuales desaparecían a salinidades inferiores a 28 y una a salinidades inferiores a 32. Además, Fell et al. (1989) han detectado experimentalmente periodos de adormecimiento en la esponja estuárica Microciona prolifera bajo condiciones fluctuantes de la salinidad (ej. cambios en la salinidad de 5 en dos pasos cada 9 días).
El costado noroccidental del Golfo de Urabá se encuentre esporádicamente expuesto a las aguas provenientes de los ríos del sur, especialmente de las que provienen de la desembocadura del río Acandí (8o 32' N) y otros ríos locales. Aunque no se midió la salinidad durante este estudio, se evidenció en el campo la presencia de una capa de agua salobre de 20-30 cm de espesor en la superficie del agua que por ser de diferente densidad que el agua subyacente, distorsiona característicamente la visión del buzo en la interfase de mezcla (también Werding y Manjarres, 1978, registraron capas de hasta 12 m de espesor). Por ello se podría postular de manera preliminar que la ausencia de muchas especies y las bajas densidades a poca profundidades se deban no sólo a los factores de estrés asociados con la baja profundidad (ej. turbulencia, abrasión, luz ultravioleta, competencia con organismos fotosintetizadores de rápido crecimiento) sino también a grandes fluctuaciones de la salinidad en la superficie.
Concomitantemente, en ninguna otra área del Caribe, parecen encontrarse tantas especies restringidas a los primeros seis metros de profundidad (58% de las especies encontradas en hábitats de aguas someras; comparar con Alcolado, 1979, 1985; Alvarez et al., 1990; Schmahl, 1990). No obstante, debido a que en el presente estudio las especies identificadas en estas zonas poseen densidades muy bajas y se encuentran muy dispersas, no resulta evidente una adaptación de estas especies a este hábitat en particular.
Las fluctuaciones marcadas en la densidad y la riqueza de especies detectadas entre zonas coralinas de profundidades similares (ej. Grupos 2a y 2b a profundidad media: 6-10 m), podrían ser explicadas por su aparente relación inversa con la densidad de erizos. Alcolado (1979) relacionó, en parte, la baja densidad de esponjas en un sustrato rocoso de Cuba, con el efecto de la actividad pastoreadora del erizo Diadema antillarum sobre las larvas de esponjas recién fijadas. Estudios en Echinometra viridis, el erizo dominante en el Golfo de Urabá, han evidenciado la existencia de una fracción significativa de sedimento calcáreo en el contenido intestinal de estos erizos (McPherson, 1969), al igual que su capacidad de generar parches libres de algas en comunidades coralinas cuando alcanzan altas densidades (Sammarco, 1982). Maldonado y Uriz (1998) demostraron experimentalmente que los desplazamiento diários de los erizos (incluso de los herbívoros) causan bajas significativas entre las esponjas jóvenes. Es posible entonces que estos erizos estén jugando un papel controlador adicional sobre las poblaciones de esponjas en el Golfo de Urabá. Aunque la cobertura de componentes bentónicos no presentó una correlación significativa con la densidad y riqueza de esponjas, no se descarta que la baja disponibilidad del sustrato, debida a la alta cobertura de coral y/o formas algales en las zonas coralinas someras y del tipo Agaricia agaricites a mediana profundidad, pueda ser otro factor que limite una mayor representación de las esponjas en estos hábitats.
AGRADECIMIENTOS
Los autores quieren expresar sus más sinceros agradecimientos al Instituto de Investigaciones Marinas y costeras-INVEMAR, por el apoyo prestado a lo largo de esta investigación a través del proyecto Evaluación Bioecológica y Ambiental de Áreas Arrecifales del Caribe colombiano, Fases I y II, y la línea de inventarios del programa Biodiversidad y Ecosistemas Marinos-BEM (Financiado por COLCIENCIAS, proyecto CO-2105-09-023-93). Los investigadores de INVEMAR, Juan M. Díaz, Jaime Garzón-Ferreira, Guillermo Díaz y Juan A. Sánchez participaron activamente en la colecta de la información en el campo. Este artículo forma parte del trabajo de grado de D.V. para optar el título de Biólogo Marino (Universidad de Bogotá Jorge Tadeo Lozano), bajo la dirección de S.Z. y la asesoría del profesor Arturo Acero (Universidad Nacional de Colombia).
BIBLIOGRAFÍA
1 Alcolado, P. M. 1979. Estructura ecológica de la comunidad de esponjas en un perfil costero de Cuba. Cienc. Biológicas, 3: 105-127. [ Links ]
2 __________. 1985. Estructura ecológica de las comunidades de esponjas en Punta del Este, Cuba. Academia de ciencias de Cuba, Reporte de Investigación del Instituto de Oceanología 38: 1-65. [ Links ]
3 __________. 1999. Comunidades de esponjas de los arrecifes del archipiélago Sabana-Camagüey, Cuba. Bol. Invest. Mar Cost., 28: 95-124. [ Links ]
4 Alvarez, B., Díaz, M. C y R. Laughlin. 1990. The sponge fauna on a fringing coral reef in Venezuela, I. Composition, distribution, and abundance. En K. Rützler (ed.): New perspectives in sponge biology. Smithsonian Institution Press, Washington, D.C.: 358-366. [ Links ]
5 Chevillot, P., Molina, A., Giraldo, L. y C. Molina. 1993. Estudio geológico e hidrológico del Golfo de Urabá. Bol. Cient. CIOH. (14): 79-89. [ Links ]
6 Díaz, M. C. 1997. Molecular detection and characterization of specific bacterial groups associated with tropical sponges. Proc. 8th Int. Coral Ref. Sym., 2: 1399-1402. [ Links ]
7 __________. y B. B. Ward. 1997. Sponge-mediated nitrification in tropical benthic communities. Mar. Ecol. Prog. Ser., 156: 97-107. [ Links ]
8 __________., Alvarez, B. y R. Laughlin. 1990. The sponge fauna on a fringing coral reef in Venezuela, II. Community Structure En K. Rützler (ed.): New perspectives in sponge biology. Smithsonian Institution Press, Washington, D.C.: 367-375. [ Links ]
9 Díaz, J. M., Díaz-Pulido, G. y J. A. Sánchez. 2000. Distribution and structure of the southermost Caribbean coral reefs: Golfo de Urabá, Colombia. Sci. Mar., 64 (3): 327-336. [ Links ]
10 Fell, P. E., Knight, P-A. y W. Rieders. 1989. Low salinity tolerance of and salinity-induced dormancy in the estuarine sponge Microciona prolifera (Ellis & Solander) under long-term laboratory culture. J. Exp. Mar. Biol. Ecol., 133: 195-211. [ Links ]
11 Field, J. G., Clarke, K. R. y R. M. Warwick. 1982. A practical strategy for analysing multispecies distribution patterns. Mar. Ecol. Prog. Ser., 8: 37-52. [ Links ]
12 Fowler, N. L. y D. W. Dunlap. 1986. Grassland vegetation of the eastern Edawards plateau. Amer. Midl. Nat., 115 (1): 146-155. [ Links ]
13 Hill, M.O. 1979. DECORANA. A Fortran program for detrended correspondance analysis and reciprocal averaging. Section of Ecology and Systematics, Cornell university, Ithaca, Nueva York, 52 p. [ Links ]
14 Hubbard, R. H. 1990. A sessile shallow-water community dominated by sponges and algae at Nelson Island, Trinidad and Tobago. Caribb. Mar. Stud., 1 (2): 152-158. [ Links ]
15 Kaandorp, J. A. 1986. Rocky substrate communities of the infralittoral fringe of Boulonnais coast, NW France: a quantitative survey. Mar. Biol., 92: 255-265. [ Links ]
16 Kluijver, M. J. 1991. Sublittoral hard substrate communities of Helgoland. Helgolander Meeresunters., 45: 317-344. [ Links ]
17 Laubenfels, M. W. de. 1932. Physiology and morphology of Porifera exemplified by Iotrochota birotulata Higgin. Carnegie Institute of Washington Publ., 435: 37-66. [ Links ]
18 Maldonado, M. y M.J. Uriz. 1998. Microrefure exploitation by subtidal encrusting sponges: patterns of settlement and post-settlement survival, Mar. Ecol. Prog. Ser., 174: 141-150. [ Links ]
19 Mcpherson, B. F. 1969. Studies on the biology of the tropical sea urchins, Echinometra lucunter and Echinometra virides. Bull. Mar. Sci., 69: 194-213. [ Links ]
20 Palacios, J. 1978. Variación de la fauna de invertebrados del área estuárica de la Ciénaga Grande de Santa Marta en relación con los cambios de salinidad. An. Inst. Inv. Mar. Punta Betín, 10: 111-126. [ Links ]
21 Rützler, K. 1978. Sponges in Coral reefs. En Stoddard, D.R. y R.E. Johannes (eds.): Coral Reefs: research methods. Monographs in oceanographic methodology 5, UNESCO, Paris: 299-313. [ Links ]
22 __________. 1990. Associations between Caribbean sponges and photosynthetic organisms. En K. Rützler (ed.): New perspectives in sponge biology. Smithsonian Institution Press, Washington, D.C.: 455-466. [ Links ]
23 Sammarco, P. W. 1982. Echinoid grazing as a structuring force in coral communities: whole reef manipulations. J. Exp. Mar. Biol. Ecol., 65: 83-105. [ Links ]
24 Schmahl, G. P. 1990. Community structure and ecology of sponges associated with four southern Florida coral reefs. En K. Rützler (ed.): New perspectives in sponge biology. Smithsonian Institution Press, Washington, D.C.: 376-383. [ Links ]
25 UNEP/IUCN. 1988. Coral reefs of the world. Volume 1: Atlantic and eastern Pacific. UNEP Regional seas Directories and Bibliographies, IUCN, Gland, Switzerland y Cambridge, U.K./UNEP, Nairobi, Kenya, 373 p. [ Links ]
26 Valderrama, D. y S. Zea. 2001. Riqueza y abundancia de esponjas (Porifera) en ambientes del Caribe óptimos y sub-óptimos para el desarrollo arrecifal. Memorias IX Congreso Latinoamericano sobre Ciencias del Mar, San Andrés Isla, Colombia: 160 (En disco compacto Resumen 461, 4 p.). [ Links ]
27 Vicente, V. P. 1990. Response of sponges with autothrophic endosymbionts during the coral-bleaching episode in Puerto Rico. Coral Reefs, 8: 199-202. [ Links ]
28 Werding, B. y G. Manjarrés. 1978. Informe sobre las estructuras litorales y la flora y fauna marina en el noroeste del Golfo de Urabá. Informe de proyecto, INVEMAR, Santa Marta: 1-86. [ Links ]
29 Wilkinson, C. R. 1986. The nutritional spectrum of coral reef benthos or sponging off one another for dinner. Oceanus, 29 (2): 68-75. [ Links ]
30 __________. 1987. Interocean differences in size and nutrition of coral reef sponge populations. Science, 236: 1654-1657. [ Links ]
31 __________. 1988. Foliose dictyoceratid of the Australian Great Barrier Reef. II. Distribution of these prevalent sponges. P.S.Z.N.I.: Mar. Ecol., 9: 321-327. [ Links ]
32 __________. y A. C. Cheshire. 1989. Patterns in the distribution of sponges populations across the central Great Barrier Reef. Coral Reefs, 8: 127-134. [ Links ]
33 __________. y __________. 1990. Comparisons of sponge populations across the barrier reef of Australia and Belize: evidence for higher productivity in the Caribbean. Mar. Ecol. Prog. Ser., 67: 285-294. [ Links ]
34 Zea, S. 1993 Cover of sponges and other sessile organisms in rocky and coral reef habitats of Santa Marta, Colombian Caribbean Sea. Caribb. J. Sci., 29 (1-2): 75-88. [ Links ]
35 __________. 1994. Patterns of coral and sponge abundance in stressed coral reefs at Santa Marta, Colombian Caribbean. En: Soest, R.W.M. van, T.M.G. van Kempen y J.C. Braekman (eds.). Sponges in Time and Space. Ed. A.A Balkema, Rotterdam.: 257-264. [ Links ]
36 __________. 1996. Random patterns of sponge distribution in remote, oceanic reef complexes of the southwestern Caribbean. Abstr. 8th. Int. Coral Reef Symp., Panamá: 215. [ Links ]
37 __________. 1998. Estado actual del conocimiento en sistemática de esponjas marinas (Porifera) del Caribe Colombiano. Boletín Eotrópica: Ecosistemas Tropicales, 33: 45-59. [ Links ]
38__________. 2001. Patterns of sponge (Porifera, Demospongiae) distribution in remote, oceanic reef complexes of the Southwestern Caribbean. Rev. Acad. Colomb. Cienc., 25 (97): 579-592. [ Links ]
39 Zeigler, J.M. & W.D. Athearn. 1971. The hydrography and sediments of the Gulf of Darién. Mem. 4th. Carib. Geol. Conf., Trinidad (1965): 335-341. [ Links ]
FECHA DE RECEPCIÓN:30/01/02 FECHA DE ACEPTACIÓN:20/11/02