Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.32 no.1 Santa Marta Jan./Dec. 2003
FORAMINÍFEROS BENTÓNICOS RECIENTES EN SEDIMENTOS DE FONDO DE LA CUENCA DE PANAMÁ (PACÍFICO COLOMBIANO), COMO INDICADORES DE PRODUCTIVIDAD Y OXIGENACIÓN
RECENT BENTHONIC FORAMINIFERA IN DEEP-SEA SEDIMENTS OF THE PANAMA BASIN (COLOMBIAN PACIFIC), AS INDICATORS OF PRODUCTIVITY AND OXYGENATION
Maria Julliet Betancur e Ignacio Martínez
Area de Ciencias del Mar, Departamento de Geología, Universidad EAFIT, A.A. 3300, Medellín. (MJB) verdeazules@hotmail.com (IM) jimartin@eafit.edu.co
RESUMEN
Se analizaron 13 muestras superficiales ("core-tops") de sedimentos de la Cuenca de Panamá, Pacífico Colombiano, de las que se extrajeron los foraminíferos bentónicos de la fracción >150mm. A partir del contenido microfaunal de las muestras superficiales se divide la Cuenca de Panamá en tres zonas: (1) región eutrófica norte (~8o y 5,5oN), caracterizada por una alta concentración del flujo de carbono orgánico al fondo oceánico, sedimentos oxigenados, e influencia de las surgencias de la Cuenca de Panamá y Domo de Costa Rica, (2) región mesotrófica media (~5,5 y 2oN), caracterizada por bajos valores en el flujo de carbono orgánico al fondo oceánico, sedimentos oxigenados, influencia terrígena y fluctuaciones de los sistemas de surgencia presentes en la cuenca, y (3) región eutrófica sur (al sur de ~2oN), caracterizada por la mayor concentración de flujo de carbono orgánico al fondo oceánico, con contenidos de oxígeno bajos pero sin alcanzar condiciones anóxicas, e influencia de la Divergencia Ecuatorial.
PALABRAS CLAVE: Foraminíferos bentónicos, Océano Pacifico Oriental, Cuenca de Panamá, Sedimentos de aguas profundas, Micropaleontologia, Oxigenación.
ABSTRACT
Thirteen deep-sea samples (core-tops) from the Panama Basin, Colombian Pacific, were analysed for benthonic foraminifera in the >150mm size fraction. Based on the microfaunal content, three zones are recognised in the Panama Basin: (1) northern euphrophic region (~8o to 5,5oN), characterized by a high concentration of organic matter flux to the seafloor, oxygenated sediments, and influence of the Panama Bight and the Costa Rica Dome upwelling systems, (2) mesotrophic region (~5,5 to 2oN), characterized by low fluxes of organic carbon to the seafloor, oxygenated sediments, terrigenous influence and fluctuations of the upwelling systems of the basin, and (3) southern euphotic region (south of ~2oN), characterized by a larger organic carbon flux to the seafloor, low oxygen content (disoxia) and influence of the Equatorial Divergence.
KEY WORDS: Benthonic foraminifera, Eastern Equatorial Pacific, Panama Basin, Deep-sea sediments, Micropaleontology, Oxygenation.
INTRODUCCIÓN
El entendimiento del ciclo del carbono a escala global requiere del conocimiento de la productividad biológica tanto en el presente como en el pasado reciente, en diversas regiones del océano. Para el Cuaternario tardío, las reconstrucciones de la productividad basadas en métodos geoquímicos en la Cuenca de Panamá son contradictorias (e.g. Pedersen et al., 1988; Loubere, 1996; Herguera, 2000). Como modelo alternativo, el estudio de la distribución y de los controles ambientales de los foraminíferos bentónicos, así como su morfología y diversidad, podrían contribuir a la reconstrucción precisa de condiciones de oxigenación y flujo de carbono orgánico al fondo marino. La aplicación de este enfoque la presentamos en otro artículo (Betancur y Martínez, 2001). Esta investigación intenta contribuir al conocimiento paleoceanográfico (Martínez, 2002a), proveyendo el primer mapa de la distribución de los foraminíferos bentónicos en la Cuenca de Panamá y explorando los controles ambientales (productividad y condiciones de oxígeno en sedimentos de fondo) sobre esta distribución. Adicionalmente, el inventario taxonómico de los foraminíferos bentónicos recientes contribuye al conocimiento de la diversidad biológica de los fondos marinos colombianos. Se estudian aquí los foraminíferos bentónicos de 13 muestras superficiales ("core tops") de la Cuenca de Panamá. La distribución de los foraminíferos planctónicos en la Cuenca fueron publicados previamente (Martínez y Bedoya, 2001) y la distribución de radiolarios y cocolitoforidos se encuentran en preparación.
Aspectos oceanográficos del Pacifico Oriental
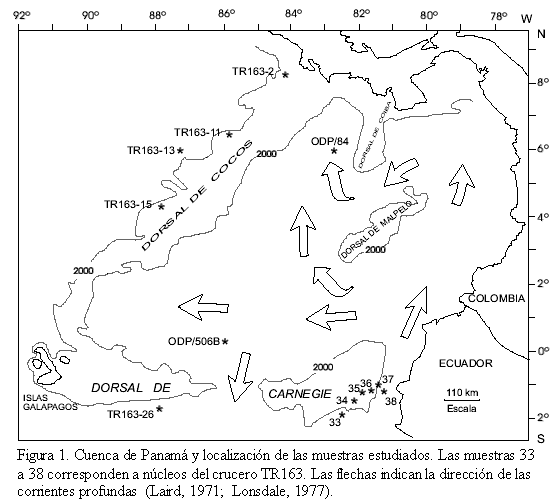
La Cuenca de Panamá está limitada por la Dorsal de Cocos y la Dorsal de Carnegie, y surcada por las Dorsales de Coiba y Malpelo que se levantan en la parte central dividiendo la cuenca en oriental más profunda y occidental más somera (Figura 1; Moore et al., 1973). Las Dorsales de Cocos y Carnegie se levantan 1000 m por encima del piso oceánico y aislan la cuenca de las aguas antárticas de fondo. El agua profunda fluye a través de la fosa del Ecuador hacia el norte, para luego alcanzar la parte occidental a través de la depresión sur de la Dorsal de Malpelo, o a través de las Dorsales de Malpelo y Coiba. El agua sale posteriormente de la cuenca, por la parte media de la Dorsal de Carnegie (Laird, 1971; Moore et al., 1973; Lonsdale, 1977).
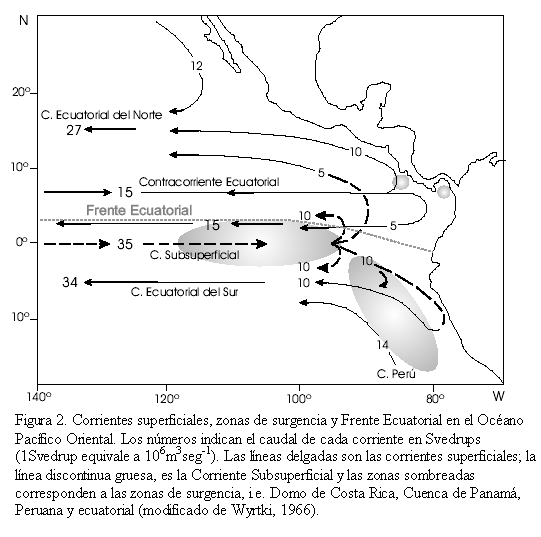
Las corrientes que intervienen en la dinámica superficial del Pacífico Oriental son: (1) la Corriente Ecuatorial del Norte que viaja en sentido este-oeste entre los 10 y 25oN y está alimentada por la Corriente de California, la Contracorriente Ecuatorial y la Corriente Subsuperficial, (2) la Corriente Ecuatorial del Sur que fluye hacia el oeste entre los 4oN y los 10oS y resulta de la desviación hacia el oeste de la Corriente del Perú, la Contracorriente Ecuatorial y la Corriente Subsuperficial, (3) la Contracorriente Ecuatorial del Norte que se origina en el Pacífico Occidental y viaja al este alimentando las Corrientes Ecuatorial del Norte y Sur, (4) la Corriente Subsuperficial (o de Cromwell) que se extiende desde los 140oW hasta las islas Galápagos donde se divide para alimentar las Corrientes Ecuatorial del Norte y Sur, fluyendo bajo esta última de forma simétrica con respecto al ecuador y, (5) la Corriente del Perú que es la rama anticiclónica del Pacífico sur y se desvía a ~10oS alimentando la Corriente Ecuatorial del Sur (Figura 2, Knauss, 1960; Wyrtki, 1965; 1966). Este modelo de corrientes muestra importantes variaciones estacionales en correspondencia con las migraciones latitudinales de los campos de vientos a lo largo de la Zona de Convergencia Intertropical (ZCIT) y variaciones anuales relacionadas con el fenómeno ENSO (Emery y Meincke, 1986; Gross y Gross, 1996). La interacción entre la Corriente del Perú (aguas frías entre 28 a 15oC, y saladas >36 entre los 0 y los 150 m) y la Contracorriente Ecuatorial del Norte (aguas cálidas >25oC, y más frescas <34) se conoce como Frente Ecuatorial (Figura 2) y es el lugar de la intensa productividad biológica responsable de la abundante pesca frente al Ecuador (Pak y Zaneveld, 1974).
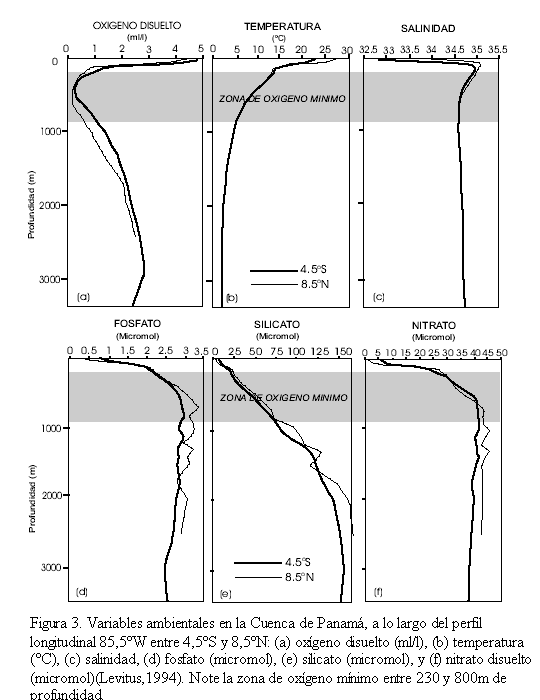
La figura 3 muestra un perfil longitudinal a 85,5oW entre los 4,5oS y 8,5oN, para las variables ambientales oxígeno disuelto (O2), salinidad, temperatura, fosfato disuelto (PO4), nitrato disuelto (NO3) y silicato disuelto (SiO2). En la Cuenca de Panamá el O2 disminuye de sur a norte y el espesor de la zona de oxígeno mínimo (<0,5ml/l) aumenta desde ~300m al sur, hasta ~570m al norte (Figura 3a). La temperatura es constante de sur a norte y disminuye con la profundidad hasta alcanzar el equilibrio (~2oC) a ~2000 m (Figura 3b). La curva de salinidad es similar en toda el área alcanzando un equilibrio de ~34,5 en aguas profundas (Figura 3c). Los nutrientes, fosfato, nitrato y silicato disueltos aumentan de sur a norte (Figuras. 3d, e, f). En aguas profundas el fosfato y el nitrato son constantes bajo la zona de oxígeno mínimo, en contraste con el silicato que aumenta con la profundidad.
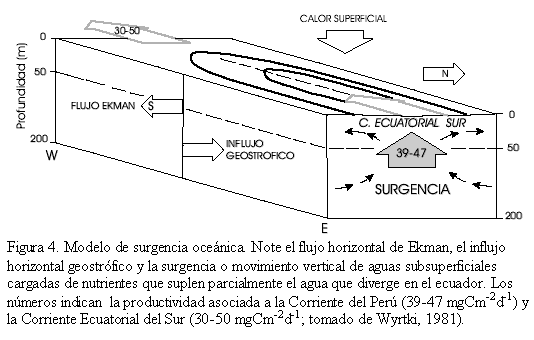
La surgencia de aguas subsuperficiales ricas en nutrientes, en el Océano Pacífico Oriental, se manifiesta por una lengua de agua fría que se extiende desde la costa peruana (Corriente del Perú) y fluye hacia el oeste como la Corriente Ecuatorial del Sur. La lengua de agua fría es producida principalmente por advección horizontal y parcialmente por surgencia. La surgencia también es debida a la divergencia del flujo Ekman en el Ecuador, contrarrestada parcialmente por la convergencia del flujo geostrófico (balance entre la fuerza de Coriolis y el gradiente de presión, Figura 4). La dinámica de la surgencia está controlada por la dirección e intensidad de los vientos Alisios. El transporte Ekman hacia el norte es mayor en febrero cuando los vientos Alisios del noreste son fuertes y hacia el sur, de julio a agosto cuando son mayores los vientos Alisios del sureste. La convergencia geostrófica puede variar mucho menos, guiada por el gradiente este-oeste de la termoclina (Wyrtki, 1981).
En el Océano Pacífico Oriental existen cuatro zonas de surgencia: (1) Divergencia ecuatorial, (2) Peruana, (3) Domo de Costa Rica (diciembre a mayo) y, (4) Cuenca de Panamá (enero a abril; Figura 2). Al sur de la Cuenca de Panamá se presenta una banda longitudinal de alta productividad desde los 4oS a 2oN asociado a la surgencia del Perú (39 a 47mgCm-2d-1) y a la divergencia ecuatorial (30 y 50 mgCm-2d-1; Fiedler et al., 1991). La Dorsal de Carnegie está localizada casi directamente bajo esta banda. La productividad es mayor en la parte oriental de la Cuenca de Panamá, asociada a las áreas costeras y a la surgencia oceánica. Sobre la Dorsal de Cocos y la mayor parte de la cuenca occidental, la productividad es baja, pero más alta que en la mayoría de las áreas templadas y tropicales (Moore et al., 1973). La distribución de los foraminíferos bentónicos en el fondo marino está regulada en buena medida por la dinámica de los sistemas de surgencia como se mostrará más adelante.
Sedimentos de la Cuenca de Panamá
La Cuenca de Panamá está dominada casi exclusivamente por sedimentos biogénicos controlados estacionalmente por la productividad primaria, excepto para las márgenes norte y este que consisten esencialmente de sedimentos terrígenos (Tjeerd, 1973).
La distribución de sedimentos pelágicos y terrígenos en la Cuenca de Panamá son el resultado de la interacción de por lo menos 5 factores: (1) alto suministro de componentes biogénicos desde la superficie, (2) influjo de materiales terrígenos derivados del continente, (3) transporte por corrientes de fondo y posiblemente por corrientes intermedias, (4) disolución selectiva de carbonato y sílice y, (5) erosión de las elevaciones topográficas y depositación pendiente abajo del material erosionado (Moore et al., 1973; Tjeerd, 1973; Swift, 1977; Martinez, 2002b).
Los mecanismos de transporte por medio de los cuales el material sedimentario es transferido al fondo oceánico de la Cuenca de Panamá, son la "nieve marina" y los peloides fecales (Honjo, 1982; Lampitt, 1996). Las tasas de precipitación de estos mecanismos de transporte, que varían entre pocos m/día hasta de cientos de m/día, hacen que el material biogénico alcance el fondo de la cuenca más rápido y mejor preservados (Lampitt, 1996).
La "nieve marina" es un conjunto de agregados macroscópicos que consiste de cantidades variables de organismos vivos (e.g. bacterias, fitoplancton, zooplancton), materia inorgánica (e.g. arcilla), materia orgánica (e.g. polímeros), peloides fecales, etc, unidos por un exopolímero transparente (polisacarido) excretado por el fitoplancton y bacterias marinas. Estos agregados se consideran mini-ecosistemas o microhabits, ya que contienen ricas comunidades microbiales y alta concentración de nutrientes dentro de los cuales se realizan procesos de fotosíntesis, descomposición y regeneración de nutrientes (Brown et al., 1989; Holloway y Cowen, 1997).
Los peloides fecales son productos residuales tanto de zooplancton como de meiobentos. En el primer caso, a medida que la materia orgánica particulada cae a través de la columna de agua, provee alimento a poblaciones sucesivas de organismos filtradores y otros animales, así que puede ser reempacada muchas veces en forma de peloides fecales, llevando consigo su propia comunidad de organismos microbiales descomponedores (Brown et al., 1989).
Foraminíferos bentónicos como indicadores de productividad y oxigenación del fondo marino
Los foraminíferos han sido estudiados más que cualquier otro grupo de microfósiles marinos y representan el 2,5% de todas las especies animales conocidas desde el Cámbrico (Kennett, 1982). Estos organismos habitan amplios rangos de profundidad, desde 5 hasta 5000m (Boersma, 1978), pueden moverse libremente sobre el piso oceánico (epifaunales) o en los primeros centímetros de los sedimentos (infaunales), o pueden utilizar filamentos del protoplasma o secreciones calcáreas para fijarse en las rocas, conchas, etc. (Bignot, 1985). Normalmente varían de tamaño entre 20 a 400 µm (Kennett, 1982), aunque algunos alcanzan hasta 16mm o más (Douglas, 1979).
La mayoría de los foraminíferos bentónicos prefieren la interfase agua-sedimento ya que la mayoría de los recursos están disponibles allí (e.g. bacterias, materia orgánica particulada o disuelta). El alimento y el contenido de oxígeno (en aguas de fondo y aguas intersticiales) controla los microambientes preferenciales de las especies, las cuales se reflejan en la abundancia, distribución y morfología de las conchillas (e.g. Ingle et al., 1980; McCorkle y Emerson, 1988; Corliss y Chen, 1988; Gooday, 1994; Loubere, 1996).
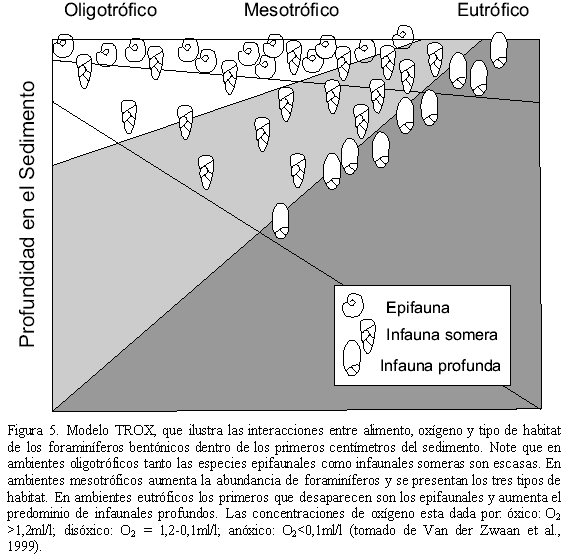
El flujo de materia orgánica al fondo marino y su posterior oxidación bacterial conduce al agotamiento del oxígeno en los sedimentos superficiales, lo que hace que el oxígeno sea la variable que limita la aparición de ciertos taxones. Por el contrario en sitios donde el flujo de materia orgánica es bajo, el oxígeno no se utiliza en su totalidad y es el flujo de alimento el factor limitante que controla la abundancia de los foraminíferos bentónicos (Van der Zwaan et al., 1999). Los grupos epifaunales son los primeros afectados, mientras que los infaunales profundos son los más tolerantes y están más tiempo presentes en la asociación. Lo anterior se resume en el modelo TROX, que representa la interacción del flujo de materia orgánica y el oxígeno en la distribución de los foraminíferos bentónicos en los sedimentos (Figura 5; Van der Zwaan et al., 1999).
La morfología de las conchas varía de acuerdo con las condiciones de vida, así: en habitats epifaunales bien oxigenados las conchillas tienden a ser redondeadas, plano convexas o biconvexas con enrollamiento trocoespiral, con grandes poros que pueden estar ausentes o restringidos a un lado de la conchilla; mientras que en habitats infaunales, las conchillas son generalmente redondeadas planiespirales, cilíndricas globulares u ovaladas, ovoides aplanadas y con enrollamiento uniserial, triserial o planiespiral y con poros distribuídos en toda la superficie de la conchilla (Corliss y Chen, 1988).
Con lo anterior es posible identificar asociaciones de foraminíferos relacionados con: (1) sedimentos sobreyacidos por aguas de fondo bien oxigenados y morfologías epifaunales, (2) áreas con alta producción de materia orgánica, baja concentración de oxígeno y morfologías infaunales y (3) áreas con alta producción de materia orgánica, independiente de la concentración de oxígeno y morfologías infaunales. Las asociaciones epifaunales bien oxigenadas se hallan en océanos abiertos y pueden a su vez dividirse en: (1) regiones eutróficas, donde la producción de materia orgánica es alta y la concentración de O2 es baja en los sedimentos superficiales, y donde los fitodetritos se depositan estacionalmente en grandes proporciones y (2) regiones oligotróficas, donde la producción de materia orgánica es baja y la concentración de O2 es alta en los sedimentos superficiales (Gooday, 1994). Las asociaciones de foraminíferos con alto contenido de materia orgánica y baja concentración de oxígeno, han sido utilizadas para inferir la extensión y evolución de zonas de surgencia en océanos marginales y zonas de oxígeno mínimo durante el Cuaternario (Mullins et al., 1985).
MATERIALES Y MÉTODOS
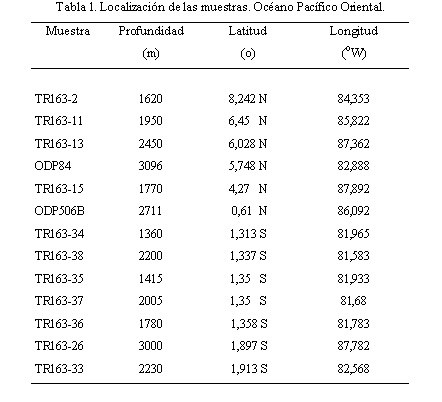
Se analizaron muestras superficiales (0-1cm) de 13 núcleos localizados en el extremo noroccidental y suroriental de la Cuenca de Panamá (Figura 1; Tabla 1). De las 13 muestras analizadas, 2 se encuentran en la zona batial media superior (500-1500 m), 4 en la zona batial media inferior (1500-2000 m) y 7 en la zona batial inferior (2000-4000 m). Las muestras (en gr) se secaron, previo al tratamiento con agua oxigenada al 1% durante 24 horas; posteriormente se lavaron y tamizaron a través de mallas de 63 y 150mm y se secaron a 40oC. La fracción >150mm fue utilizada para análisis faunísticos y la fracción 63-150mm se almacenó para estudios posteriores. Los foraminíferos bentónicos de la fracción >150mm se extrajeron para conteo e identificación. Se utilizó el microcuarteador en los casos de mayor abundancia hasta obtener una fracción de 300 individuos; en algunas ocasiones se aceptaron conteos de 200 individuos cuando se observaron tendencias similares en el predominio de las especies con respecto a muestras contiguas. Los peloides fecales se contaron directamente de la muestra sin separación previa. El conteo tanto de las especies como de los peloides se llevó a porcentaje para su posterior tratamiento estadístico.
Para la clasificación genérica de especímenes pertenecientes a las familias Bolivinitidae, Anomalinidae, Alabaminidae y Gavelinellidae se siguió a Revets (1996) y para los demás géneros se siguió inicialmente a Loeblich y Tappan (1964). La identificación de las especies se confirmo, en lo posible, por medio de literatura actualizada (e.g. Sprovieri y Hasegawa, 1986; Bornmalm, 1997; Kawagata, 1999). Se ilustran por medio del microscopio electrónico de barrido (SEM) las especies más importantes (Laminas 1 y 2 y Anexo 1). Adicionalmente los foraminíferos bentónicos se clasificaron en epifaunales o infaunales (Corliss y Chen, 1988). El índice de diversidad de Shannon se calculó, por medio del paquete Biodiversity Pro, disponible en internet.
Se realizaron análisis multivariados (cluster y componentes principales) usando el programa MVSP (Multivariate Statistical Package). El análisis cluster se aplicó como técnica de ordenación para obtener grupos discretos de muestras relacionados entre sí (bioprovincias), utilizandola distancia euclidiana (20) como medida de similaridad y dando el mismo peso a cada uno de los datos en cada agrupamiento (UPGMA). El análisis de componentes principales (PCA, Principal Component Analysis) se calculó con la matriz de abundancias relativas para los foraminíferos bentónicos. Se asume que existe linealidad en los datos ya que no se observa el efecto de herradura característico de los datos no lineales cuando sé grafican sus respectivos componentes entre sí. Cabe mencionar que los resultados obtenidos son relativos al igual que los datos originales, debido a que no se tiene otro tipo de estandarización para este caso.
Se compararon las especies encontradas con las variables ambientales de oxígeno disuelto, nitrato, fosfato, temperatura y salinidad, utilizando el World Ocean Atlas (Levitus, 1994), disponible a través del internet. El World Ocean Atlas presenta el promedio desde 1900 a 1992 de las variables ambientales (e.g. oxígeno, nitrato, fosfato, etc) cada 0.5 grados de longitud.
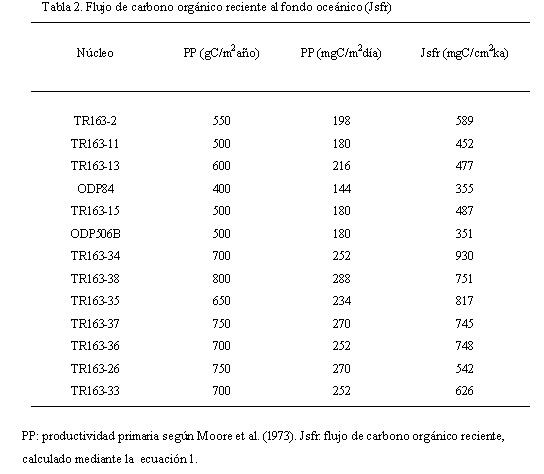
El flujo de carbono orgánico reciente al fondo oceánico (Jsfr) se calculó mediante la ecuación (1), para los foraminíferos bentónicos (Tabla 2) siguiendo a Herguera (2000).
(1) Jsfr = K (PP/Z) + r (PP/Z0,5)
Donde: K = 2PP0,5; PP = productividad primaria (Tabla 2), Z = profundidad de la muestra (m) y r = 0,5.
RESULTADOS
Abundancia de los foraminíferos bentónicos predominantes y peloides fecales recientes
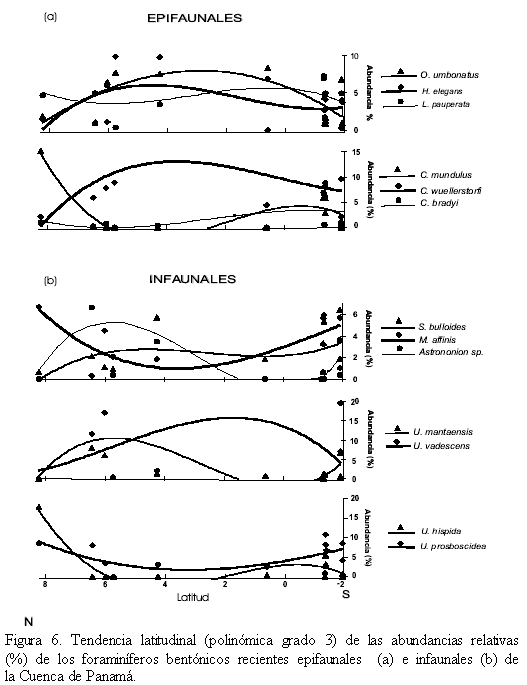
Se encontraron 3 subordenes; Texturalina con 13 especies, Miliolina con 12 especies y Rotaliina con 131 especies. La tabla completa del contenido porcentual de cada especie en las 13 muestras está disponible a través de internet (Microfossil: www.geocities.com/microfosil). Las especies con abundancias ≥6% en por lo menos dos muestras se graficaron, al igual que sus tendencias (polinómica de grado 3), con respecto a la latitud (Figura 6).
Para las especies predominantes recientes se observan 4 tendencias en sentido latitudinal, así: (1) Uvigerina prosboscidea y Melonis affinis aumentan al norte (8oN a 6oN) y nuevamente al sur de 2oN, mientras que en la parte media permanecen constantes con bajos porcentajes de abundancia. Uvigerina hispida y Cibicidoides mundulus presentan el mismo comportamiento de las especies anteriores, pero están ausentes en la parte media de la cuenca, (2) Uvigerina mantaensis y Astrononion sp. aumentan entre los 8oN y 2oN y al sur de ~1oS, (3) Uvigerina vadescens y Cibicidoides bradyi son mayores en la parte media de la cuenca entre ~4oN y 2oS, (4) Sphaeroidina bulloides, Cibicidoides wuellerstorfi, Oridorsalis umbonatus, Hoeglundina elegans y Laticaririna pauperata son constantes en toda la cuenca, con disminuciones de algunas de estas especies al norte y sur de la cuenca (Figura 6).
Las anteriores especies se agrupan arealmente así: (1) al norte de la cuenca (8-5oN) donde predominan (≥5%) Uvigerina hispida, Uvigerina mantaensis, Uvigerina prosboscidea, Astrononion sp., Melonis affinis, Cibicidoides mundulus, y Hoeglundina elegans, (2) en la parte media de la cuenca (5-1oN) donde predominan (≥5%) Uvigerina mantaensis, Hoeglundina elegans y Laticaririna pauperata, (3) en la parte sur de la cuenca (1oN-2oS) donde predominan (≥5%) Uvigerina prosboscidea y Laticaririna pauperata. Uvigerina vadescens, Cibicidoides wuellerstorfi y Oridorsalis umbonatus, ocurren en toda la cuenca con abundancias ≥5%. (Figura 6).
Se encontraron peloides fecales solo en las muestras TR163-2 y ODP84, donde se midieron 1482peloides/gr y 6600peloides/gr respectivamente. En estas muestras predominan Uvigerina hispida y Uvigerina mantaensis respectivamente.
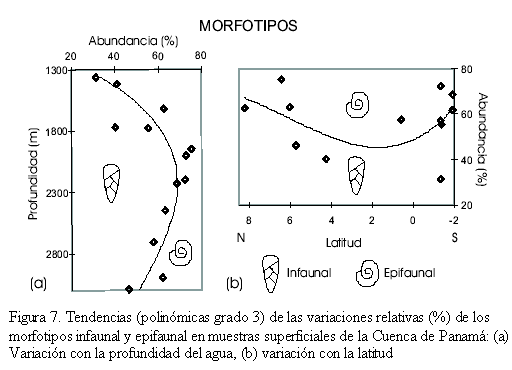
Morfotipos de los foraminíferos bentónicos recientes
Las tendencias (polinómica grado 3) de los morfotipos (infaunales y epifaunales) de cada muestra sé grafican con la profundidad del agua (1360 a 3010m, Figura 7a) y con la latitud en la Cuenca de Panamá (Figura 7b). Con la profundidad sé observa un incremento de los morfotipos epifaunales hasta ~1350m (≥50%); a partir de esa profundidad, predominan los morfotipos infaunales (≥50%; Figura 7a). Latitudinalmente (Figura 7b) las morfologías infaunales predominan en la parte norte (8-4oN) y sur (0-2oS) de la cuenca con abundancias ≥47%; las morfologías epifaunales son importantes en la parte media de la cuenca (4oN-0o) con abundancias ~50%. Se observa por lo tanto una preferencia de los morfotipos infaunales entre 1800 y 2800 m de profundidad y en la parte norte y sur de la Cuenca de Panamá.
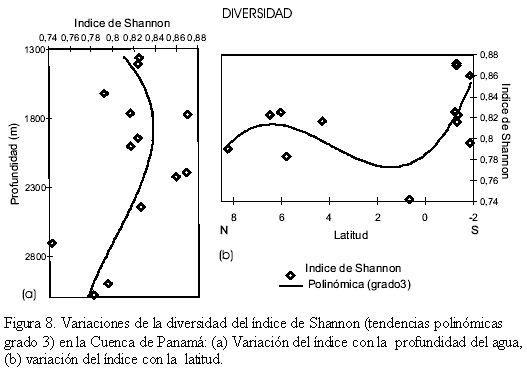
Diversidad de los foraminíferos bentónicos recientes
El índice de diversidad de Shannon sé graficó (tendencia polinómica grado 3) tanto con la profundidad del agua (Figura 8a) como latitudinalmente (Figura 8b). La tendencia (polinómica grado 3) muestra que la diversidad se incrementa hasta ~2300m con valores ≥0,81; a partir de esa profundidad decrece hasta ~0,77 (Figura 8a). El índice de Shannon es latitudinalmente mayor (≥0,79) al norte (8-4oN) y sur (0-2oS) de la cuenca y disminuye en el centro (4oN-0) hasta ~0,77 (Figura 8b). En síntesis el índice de Shannon disminuye con la profundidad del agua y aumenta latitudinalmente al norte y sur de la Cuenca de Panamá.
Variables ambientales y foraminíferos bentónicos recientes
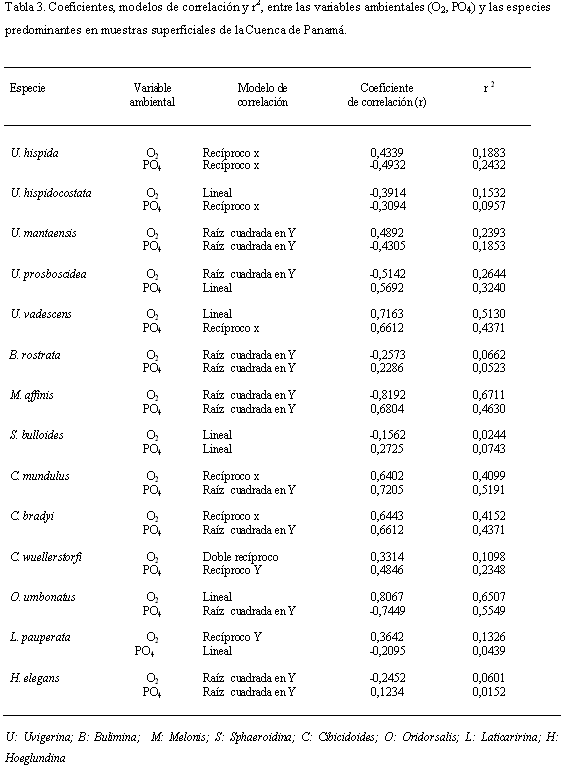
Las variables ambientales medidas en el fondo marino (Levitus, 1994; Figura 3) se correlacionaron con las especies de las muestras superficiales colectadas en la Cuenca de Panamá, que presentaron abundancias ≥ 5% en por lo menos 2 muestras. Para todas las especies dominantes, la correlación múltiple con las variables ambientales muestra coeficientes de correlación (r) altos con el O2 (0,9277) y el PO4 (0,9835); para las demás variables los coeficientes son < 0,3497. Adicionalmente para el O2 y el PO4 se realizaron regresiones simples con cada una de las especies dominantes, siguiendo el modelo que presentó mejor correlación para cada caso (Tabla 3). Los coeficientes de correlación y el r2 para la mayoría de las especies presenta valores bajos para las dos variables (O2, PO4), a diferencia de los resultados con las regresiones múltiples, indicando que las variables ambientales están estrechamente relacionadas y que no son independientes entre sí (Tabla 3).
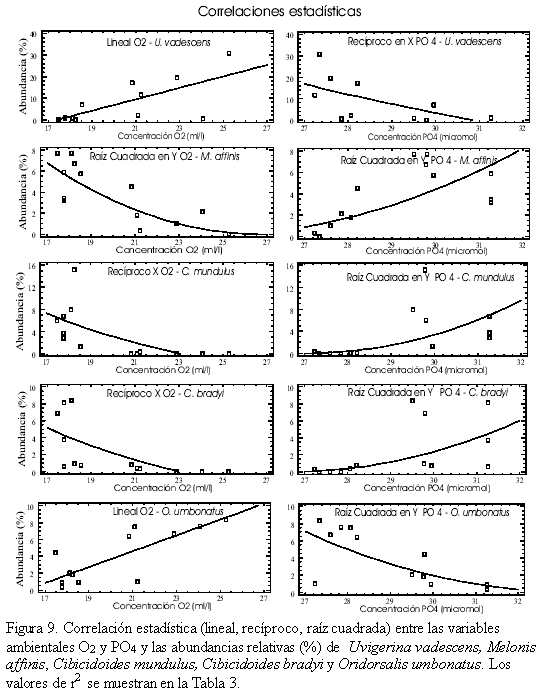
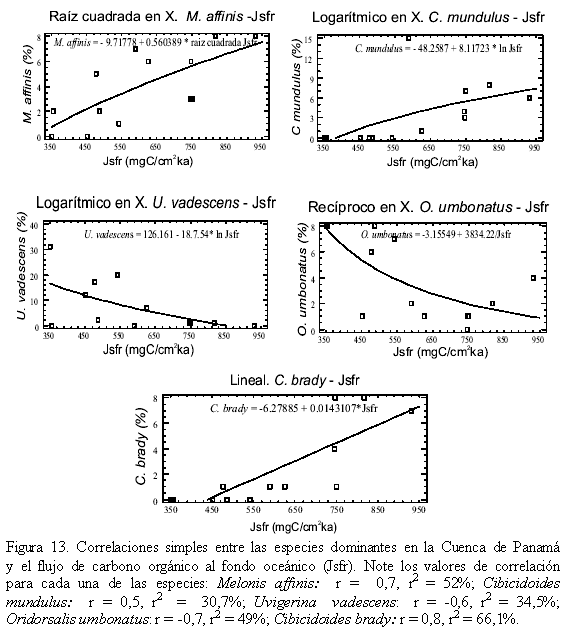
La excepción a lo anterior se observa en la figura 9, donde se muestra los r2 y su relación con las variables ambientales O2 y PO4. Uvigerina vadescens y Oridorsalis umbonatus muestran una relación directa con el O2 e inversa con el PO4. Melonis affinis, Cibicidoides mundulus y Cibicidoides brady presentan una relación inversa con el O2 y directa con el PO4.
Flujo de carbono orgánico al fondo oceánico
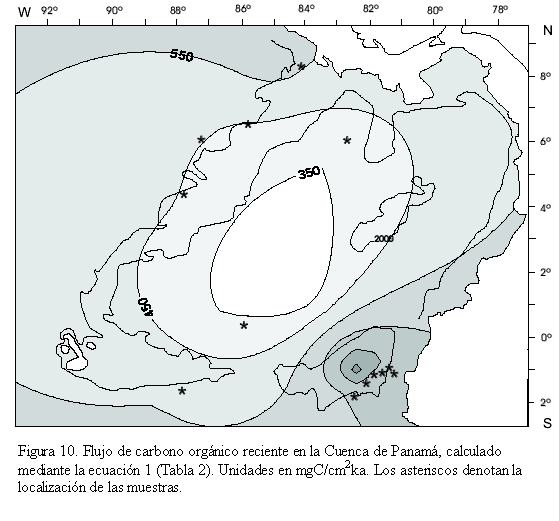
El flujo de carbono orgánico al fondo oceánico (Jsfr) calculado mediante la ecuación (1), se gráfica en la figura 10. Los mayores valores para el flujo de carbono orgánico (Jsfr >550mgC/cm2ka) se observan en (1) el sureste asociados con el sistema de surgencia del Perú y la zona costera de Colombia y, (2) el noroeste asociado con el Domo de Costa Rica. Como se mostró anteriormente, en estas regiones predominan los morfotipos infaunales entre los que se destacan Uvigerina hispida, Uvigerina prosboscidea, Uvigerina mantaensis y Melonis affinis.
Análisis multivariados de los foraminíferos bentónicos recientes
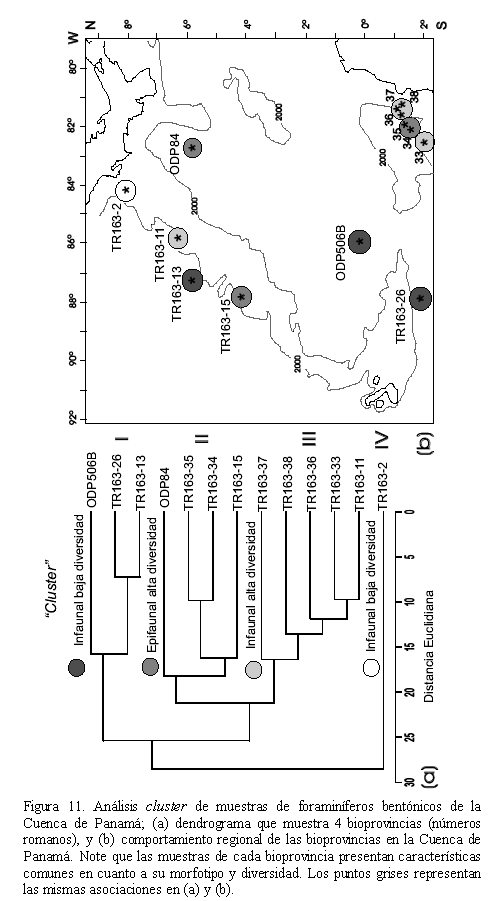
Mediante el análisis cluster (distancia euclidiana y UPGMA) sedeterminaron 4 bioprovincias cuya distribución regional se presenta en la figura 11, así: (I) las muestras ODP506B, TR163-26 y TR163-13 se caracterizan por un predominio en las morfologías infaunales con diversidad media (0,742-0,826), (II) las muestras ODP84, TR163-35, TR163-34 y TR163-15 se caracterizan por un predominio en las morfologías epifaunales con diversidad media (0,782-0,825), (III) las muestras TR163-37, TR163-38, TR163-36, TR163-33 y TR163-11 se caracterizan por presentar morfologías infaunales con diversidad alta (0,817-0,87) y (IV) la muestra TR163-2 se caracteriza por presentar morfologías infaunales con diversidad media (0,791) sin una relación aparente con la bioprovincia I.
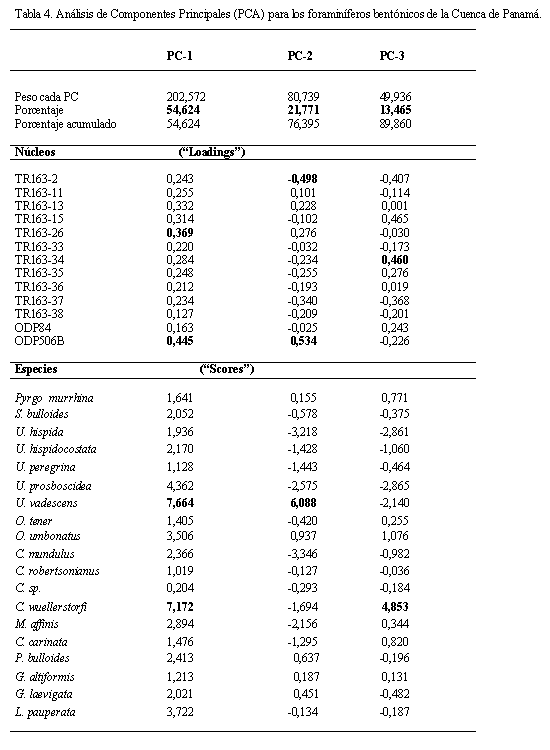
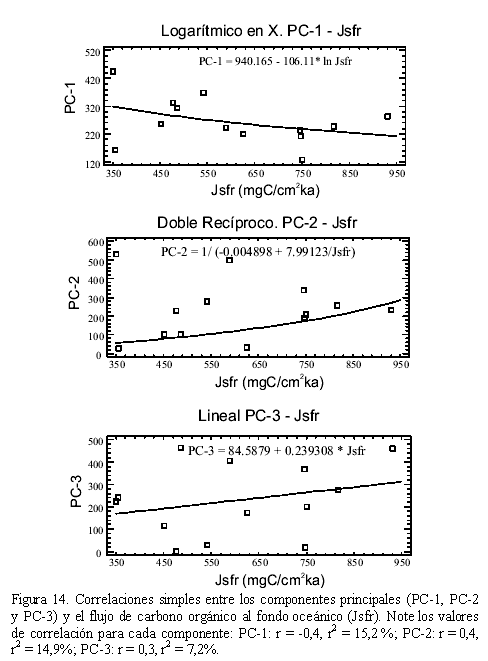
Mediante el análisis de PCA se determinaron 3 componentes (PC-1, PC-2, PC-3) que explican el 89,86% de la variabilidad total de los datos, con el 54,624% de la variabilidad para el PC-1, de 21,771% para el PC-2 y de 13,465% para el PC-3 (Tabla 4). Las especies representativas para los 3 componentes muestran preferencias de morfología tanto infaunales como epifaunales (Tabla 4). La mayoría de las muestras presentan el mayor peso en el PC-1, siendo los más importantes las muestras ODP506B (0,445) y el TR163-26 (0,369), con las especies Uvigerina vadescens (7,664) y Cibicidoides wuellerstorfi (7,172). Para el PC-2 las muestras más importantes que definen su variabilidad son, la muestra ODP506B (0,534) e inversamente la muestra TR163-2 (-0,498), con la especie Uvigerina vadescens (6,088); finalmente para el PC-3 las muestras más importante son, la muestra TR163-15 (0,465) y la muestra TR163-34 (0,460), con la especie Cibicidoides wuellerstorfi (4,853; Tabla 4).
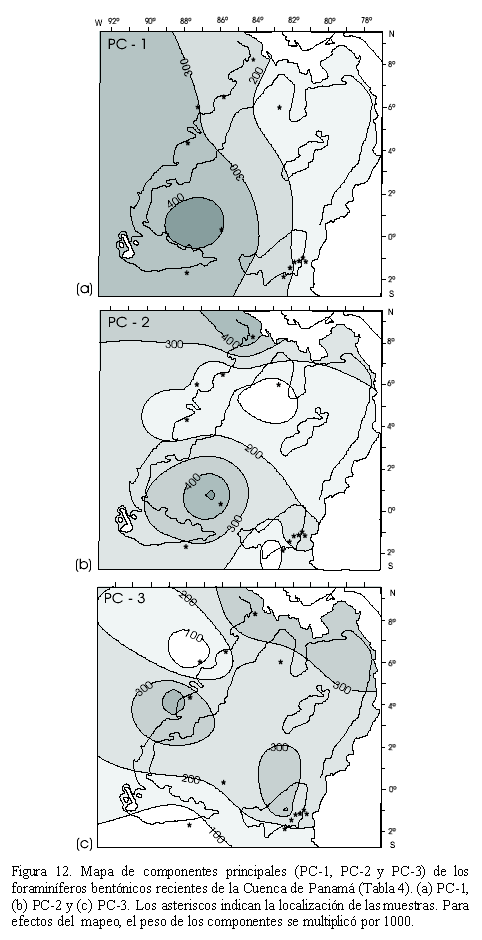
Los valores PC-1, PC-2 y PC-3 sé grafican regionalmente en la Cuenca de Panamá (Figura 12). El PC-1 presenta los valores máximos en la parte occidental de la Cuenca de Panamá. El PC-2 presenta los valores máximos al oeste de la Dorsal de Carnegie y al norte de la Cuenca de Panamá, con los valores mínimos en la parte media de la cuenca. El PC-3 presenta los mayores valores en la parte media occidental, en la parte norte y en la parte suroriental de la Cuenca de Panamá (Figura 12).
DISCUSIÓN
Con base en el análisis de los foraminíferos bentónicos recientes se divide la Cuenca de Panamá en tres regiones así: (1) eutrófica norte, entre los 8o y 5,5oN, caracterizada por la alta concentración del flujo de carbono orgánico al fondo oceánico (Jsfr; Figura 10) y sedimentos oxigenados, (2) mesotrófica media, entre los 5,5o y 2oN, caracterizada por bajos valores en el flujo de carbono orgánico al fondo oceánico (Jsfr; Figura 10) y sedimentos oxigenados, y (3) eutrófica sur, a partir de los 2oN hacia el sur, caracterizada por la mayor concentración del flujo de carbono orgánico al fondo oceánico (Jsfr; Figura 10) y con limitaciones de oxígeno sin alcanzar condiciones anóxicas.
La región eutrófica norte corresponde con el aumento en el contenido porcentual de las especies Melonis affinis, Cibicidoides mundulus y Uvigerina hispida (Figura 6). Melonis affinis, debido a su relación inversa con el O2 y directa con el PO4 (Figura 9), así como su correlación alta y positiva con el flujo de carbono orgánico al fondo oceánico (Jsfr; Figura 13), apoya la interpretación de una región eutrófica. Melonis affinis en otras regiones, por ejemplo en la zona de surgencia del noroccidente africano, se ha encontrado en abundancia y en correspondencia con una alta concentración de materia orgánica en sedimentos oxigenados (Gooday, 1994). Cibicidoides mundulus, debido a su alta correlación con el flujo de carbono orgánico (Jsfr; Figura 13), y Uvigerina hispida, especie que se ha reportado en el Océano Pacífico Oriental, zona de alta productividad y baja estacionalidad, apoyando la interpretación de una región eutrófica (Loubere, 1996; Loubere y Fariduddin, 1999).
Adicionalmente, en las muestras TR163-2 y ODP84, se encontraron peloides de forma ovoide, tamaño uniforme y compuestos de sedimentos finos compactados (Lámina 2), que aparentemente son restos fecales de nematodos (Pedersen et al., 1988). Los nematodos junto con los foraminíferos bentónicos dominan el meiobentos del mar profundo. Por lo tanto su ocurrencia en las muestras indican un flujo alto de carbono orgánico suficiente para sostener su actividad metabólica. El dominio de las morfologías infaunales (Figura. 7) y una alta diversidad de los foraminíferos bentónicos (Figura 8) apoyan esta interpretación. La alta diversidad coincide con la observada en la zona de surgencia peruana donde el O2 está presente (Ingle et al., 1980; Malmgren y Funnell, 1991; Wollenburg y Mackensen, 1998).
La región mesotrófica media se caracteriza por el aumento de Uvigerina vadescens, Oridorsalis umbonatus y Cibicidoides wuellerstorfi (Figura 6). Las dos primeras presentan relaciones directas con el O2 e inversas con el PO4 (Figura 9), y una correlación alta e inversa con el flujo de carbono orgánico (Jsfr; Figura 13). Adicionalmente la especie Uvigerina vadescens no presenta ornamentación (espinas), debido posiblemente al decrecimiento en la habilidad de secretar carbonato como consecuencia de las bajas tasas de metabolismo en un ambiente bajo en alimento (Gooday, 1994). Cibicidoides wuellerstorfi no presenta una relación clara con ninguna variable ambiental, pero ha sido encontrada en zonas con bajas proporciones de carbono orgánico y en sedimentos oxigenados en el Atlántico Norte, Mar Caribe y Océano Pacífico Ecuatorial y en zonas de estacionalidad alta (intermitencia en la productividad; Frances et al., 1990; Gooday, 1994; Bornmalm, 1997; Loubere y Fariduddin, 1999; Ohkushi et al., 2000). Adicionalmente predominan las morfologías epifaunales (Figura 7) y no se observan peloides fecales debido posiblemente a la falta de un flujo continuo de alimento. Se observa a cambio una disminución en la diversidad (Figura 8). Según Wollenburg y Mackensen (1998) y Loubere y Fariduddin (1999), en las zonas de baja productividad y estacionalidad alta disminuye la diversidad de los foraminíferos bentónicos.
La región eutrófica sur se diferencia de la norte, en que en la región sur el contenido de O2 en el fondo es limitado ya que las especies presentes en la región eutrófica norte disminuyen aquí. A pesar de esto continúan predominando sobre las demás especies (Figura 6). Adicionalmente Cibicidoides brady (Figura 6) aumenta hacia el sur y es la que presenta la mayor correlación con el flujo de carbono orgánico al fondo oceánico (Jsfr; Figura 13). Al sur los peloides fecales no están presentes y la diversidad es la mayor en toda la cuenca, debido posiblemente a que el número de foraminíferos bentónicos aumenta por la disminución de la macrofauna bentónica, que es la primera afectada en condiciones limitantes de O2, como ocurre en las cuencas de Santa Mónica, San Pedro y Santa Bárbara en el margen continental de California (Douglas, 1979) y Cuenca de Panamá (Pedersen et al., 1988). La división de la Cuenca de Panamá en tres regiones coincide con la distribución superficial de la concentración de clorofila según Fiedler et al. (1991).
En el análisis de componentes principales (Figura 12), el PC-1 muestra los mayores valores en la región eutrófica sur (suroeste de la Cuenca de Panamá) y parcialmente en la parte occidental de la región eutrófica norte, relacionada posiblemente con la divergencia ecuatorial, que corresponde a la provincia I del análisis cluster (Figura 11). El PC-2 es dominante en la región eutrófica norte y eutrófica sur (bioprovincias II y IV del análisis cluster, Figura 11). Por lo tanto el PC-2 está relacionado con los sistemas de surgencia: costera de la Cuenca de Panamá, Domo de Costa Rica y nuevamente la divergencia ecuatorial. El PC-3 es dominante en la parte oriental y media de la Cuenca de Panamá como resultado de la interacción del sistema de surgencias que existe en la Cuenca, junto con el aporte de nutrientes desde el continente, lo que hace que la región sea la más afectada por fluctuaciones en el flujo de carbono orgánico al fondo oceánico. De los tres componentes el que presenta la mayor correlación con el flujo de carbono orgánico al fondo oceánico (Jsfr) es el PC-1, seguido por el PC-2 y el PC-3 (Figura 14). Debido a que el flujo de carbono orgánico al fondo oceánico (o la llamada bomba biológica) y las presión parcial de dióxido de carbono muestran una relación directa en el Oceáno Pacifico ecuatorial en el presente (e.g. Chavez et al., 1999), la reconstrucción del flujo en el pasado provería claves sobre la relación clima-CO2 en el periodo Cuaternario (Martínez, 2001).
CONCLUSIONES
La Cuenca de Panamá está dividida en tres zonas: (1) región eutrófica norte (~8o y 5.5oN), caracterizada por una alta concentración del flujo de carbono orgánico al fondo oceánico (Jsfr) y sedimentos oxigenados, (2) región mesotrófica media (~5.5 y 2oN), caracterizada por bajos valores en el flujo de carbono orgánico (Jsfr) y sedimentos oxigenados, y (3) región eutrófica sur (~2oN hacia el sur), caracterizada por la mayor concentración en el flujo de carbono orgánico (Jsfr), con limitaciones de oxígeno sin alcanzar condiciones anóxicas.
La región eutrófica norte está influenciada por los sistemas de surgencia de la Cuenca de Panamá y el Domo de Costa Rica. La mesotrófica media por el aporte terrígeno y las fluctuaciones de los sistemas de surgencia presentes en la cuenca, y la región eutrófica sur por la Divergencia Ecuatorial.
AGRADECIMIENTOS
Este artículo se enmarca dentro del proyecto de investigación Universidad EAFIT-COLCIENCIAS "Paleoceanografía del Cuaternario de la Cuenca de Panamá, Pacífico Colombiano: Implicaciones en el Cambio Climático Global". Este artículo resume apartes de la tesis de Maestría en Ciencias de la Tierra (Universidad EAFIT) del primer autor. Los autores agradecen a COLCIENCIAS-Universidad EAFIT por el apoyo financiero y logístico para la realización de este trabajo, así como al Ocean Drilling Program y a la University of Rhode Island (NSF grant OCE-9102410) por facilitar las muestras. Agradecemos a los revisores del artículo, Oscar Ruiz y un anónimo, al igual que a Geovany Bedoya, Maria Isabel Acevedo y Wilton Echavarria por su apoyo logístico.
BIBLIOGRAFÍA
1 Akimoto, K. 1990a. Distribution of recent benthic foraminiferal faunas in the Pacific off Southwest Japan and around Hachijojima Island. Science Reports of the Tohoku University, Sendai (Geology), second series, 60(2):288-291. [ Links ]
2 Akimoto, K. 1990b. Cenozoic benthic foraminiferal biostratigraphy, paleobathymetry, paleoenvironments and paleoceanography of the New Hebrides Island Arc and North D`entre Casteaux Ridge Area. Proceedings of the Ocean Drilling Program. Scientific Results, 134:265-291. [ Links ]
3 Betancur, M. A., Martínez, J. I., 2001. Productividad y oxigenación de la Cuenca de Panamá, Pacífico Colombiano, durante el Pleistoceno tardío - Holoceno: el registro de los Foraminíferos Bentónicos. Geología Colombiana, 26:123-151. [ Links ]
4 Bignot, G. 1985. Elements of Micropalaeontology. Graham & Trotman. Londres, p.217. [ Links ]
5 Boersma, A. 1978. Foraminifera. En: Introduction to Marine Micropaleontology (B. U. Haq, ed.). Elsevier Biomedical. Londres, p.376. [ Links ]
6 Bornmalm, L. 1997. Taxonomy and paleoecology of Late Neogene benthic foraminifera from the Caribbean Sea and Eastern Equatorial Pacific Ocean. Fossils and Strata, 41:1-96. [ Links ]
7 Brown, J., A. Colling, D. Park, J. Phillips, D. Rothery, J. Wright. 1989. Ocean Chemistry and Deep-Sea Sediments. The Open University, Pergamon Press. Exeter (U.K.), p.134. [ Links ]
8 Chavez, F. P., P. G. Strutton, G. E. Friederich, R. A. Feely, G. C. Feldman, D. G. Foley, and M. J. McPhaden, Biological and chemical response of the Equatorial Pacific Ocean to the 1997-98 El Niño. Science, 286:2126-2131, 1999. [ Links ]
9 Corliss, B. H., C. Chen. 1988. Morphotype patterns of Norwegian Sea deep-sea benthic foraminifera and ecological implications. Geology, 16:716-719. [ Links ]
10 Douglas, R. G. 1973. Benthonic foraminiferal biostratigraphy in the Central North Pacific, Leg 17. Deep Sea Drilling Project. Initial Reports, 17:607-672. [ Links ]
11 Douglas, R. G. 1979. Benthic Foraminiferal Ecology and Paleoecology. En: Foraminiferal Ecology and Paleoecology (J. H. Lipps, ed.), SEPM, Society of Economic Paleontologists and Mineralogists. Short Course, 6:21-53. [ Links ]
12 Emery, W. J., J. Meincke. 1986. Global water masses: summary and review. Oceanologica Acta, 9(4):383-391. [ Links ]
13 Fiedler, P. C., V. Philbrick, F. P. Chavez. 1991. Oceanic upwelling and productivity in the Eastern Tropical Pacific. Limnology and Oceanography, 36(8):1834-1850. [ Links ]
14 Frances, G., F. J. Sierra, J. Civis, J. A. Flores. 1990. Variación de las asociaciones de foraminíferos bentónicos abisales en el DSDP Site 135 durante el Pleistoceno Superior. Revista Sociedad Geologica España, 3(1-2):127-135. [ Links ]
15 Gooday, A. J. 1994. The biology of deep sea foraminifera: a review of some advances and their applications in paleoceanography. Palaios, 9:14-31. [ Links ]
16 Gross, M. G., E. Gross. 1996. Oceanography: a View of Earth. Prentice Hall. New Jersey, p.472. [ Links ]
17 Hasegawa, S., R. Sprovieri, A. Poluzzi. 1986. Quantitative analysis of benthic foraminiferal assemblages from Plio-Pleistocene sequences in the Tyrrhenian Sea, ODP Leg 107. Proceeding of the Ocean Drilling Program. Scientific Results, 107:461-478. [ Links ]
18 Herguera, J. C., 2000. Last glacial paleoproductivity patterns in the Eastern Equatorial Pacific: benthic foraminifera records. Marine Micropaleontology, 40:259-275. [ Links ]
19 Holloway, C. F., J. P. Cowen. 1997. Development of a scannig confocal laser microscopic technique to examine the structure and composition of marine snow. Limnology and Oceanography, 42(6):1340-1352. [ Links ]
20 Honjo, S. 1982. Seasonality and interaction of biogenic and lithogenic particulate flux at the Panama Basin. Science, 218:883-884. [ Links ]
21 Ingle, J. C., G. Keller, R. L. Kolpack. 1980. Benthic foraminiferal biofacies, sediments and water masses of the Southern Perú-Chile Trench Area, Southeastern Pacific Ocean. Micropaleontology, 26(2):113-150. [ Links ]
22 Kaiho, K. 1989. Eocene to Quaternary benthic foraminifers and paleobathymetry of the Izu - Bonin Arc, Legs 125 and 126. Proceeding of the Ocean Drilling Program. Scientific Results, 126:285-310. [ Links ]
23 Kaiho, K., A. Nishimura. 1989. Distribution of Holocene benthic foraminifers in the Izu - Bonin Arc. Proceeding of the Ocean Drilling Program. Scientific Results, 126:311-320. [ Links ]
24 Katz, M. E., K. G. Miller. 1983. Neogene benthic foraminiferal biofacies of the New Jersey transect. Initial Reports of the Deep Sea Drilling Project, 95:299-311. [ Links ]
25 Kawagata, S. 1999. Late Quaternary bathyal benthic foraminifera from three Tasman Sea cores, Southwest Pacific Ocean. Science Reprint, Institute Geoscience, University Tsukuba, Sec. B, 20:1-46. [ Links ]
26 Kennett, J. P. 1982. Marine Geology. Prentice Hall. New Jersey, p.813. [ Links ]
27 Knauss, J. A. 1960. Measurements of the Cromwell Current. Deep Sea Research, 6:265-286. [ Links ]
28 Laird, N. P. 1971. Panama Basin deep water properties and circulation. Journal of Marine Research, 29(3):226-234. [ Links ]
29 Lampitt, R. S. 1996. Snow falls in the open ocean, En: Oceanography (C. P. Summerhayes and S. A. Thorpe, eds.), 96-112. [ Links ]
30 Levitus, 1994. World Ocean Atlas. NOAA, U.S Dept. Commerce, Washington D. C. Homepage: http://ingrid.ldgo.columbia.edu/SOURCES/.LEVITUS/ [ Links ]
31 Loeblich, A. R., H. Jr., Tappan. 1964. Sarcodina and Foraminifera. En: Treatise on Invertebrate Paleontology (R. C. Moore, ed.), Part C, Protista, 2. Lawrence, Kansas University & Geological Society of America. p. 900. [ Links ]
32 Lonsdale, P. 1977. Inflow of bottom water to the Panama Basin. Deep Sea Research, 24:1065-1101. [ Links ]
33 Loubere, P. 1996. The surface ocean productivity and bottom water oxygen signals in deep water benthic foraminiferal assemblages. Marine Micropaleontology, 28:247-261. [ Links ]
34 Loubere, P., M. Fariduddin. 1999. Quantitative estimation of gobal patterns of surface ocean biological productivity and its seasonal variation on timescales from centuries to millennia. Global Biogeochemical Cycles, 13(1):115-133. [ Links ]
35 Lutze, G. F. 1979. Benthic foraminifers at Site 397: faunal fluctuations and ranges in the Quaternary. Initial Reports of the Deep Sea Drilling Project, 47, part 1:419-431. [ Links ]
36 Malmgren, K. A., B. M. Funnell. 1991. Benthic foraminifera from Middle to Late Pleistocene, coastal upwelling sediments of ODP Hole 686B. Pacific Ocean off Perú. Micropaleontology, 9(2):153-158. [ Links ]
37 Martínez, J. I., 2001. Reconstrucción de las presiones parciales de CO2 y Nitrato en el Pacifico Oriental para los últimos 150.000 años. Dyna, 131:33-39. [ Links ]
38 Martínez, J. I., 2002a. El Pacifico ecuatorial durante el ultimo glacial y el Cambio Climático Global. Innovación y Ciencia, 10(1):18-21. [ Links ]
39 Martínez, J. I., 2002b. Sedimentación Reciente de la Cuenca de Panamá y el márgen Pacífico Colombiano. En (I. Correa & J. Restrepo, eds.): Geologia y Oceanografia del Delta del Rio San Juan. Vol. especial Universidad EAFIT - COLCIENCIAS: 190-221. [ Links ]
40 Martínez, J. I., Bedoya, G., 2001. Recent planktonic foraminifera from the Panama Basin in deep sea sediments: proxies of the Equatorial Front in the Late Quaternary. Boletin de Investigaciones Marinas y Costeras, 30:151-176. [ Links ]
41 Matoba, Y., A. Yamaguchi. 1982. Late Pliocene to Holocene benthic foraminifers of the Guaymas Basin, Gulf of California: Sites 477 through 481. Initial Reports of the Deep Sea Drilling Project, 64, part 2:1027-1052. [ Links ]
42 McCorkle, D. C., S. R. Emerson. 1988. The relationship between pore water carbon isotopic composition and bottom water oxygen concentration. Geochimica et Cosmochimica Acta, 52:1169-1178. [ Links ]
43 McDougall, K. 1985. Miocene to Pleistocene benthic foraminifers and paleoceanography of the Middle America Slope, Deep Sea Drilling Project Leg 84. Initial Reports of the Deep Sea Drilling Project, 84:363-418. [ Links ]
44 Moore, J. R., G. R. Heath, R. O. Kowsmam. 1973. Biogenic sediments of the Panamá Basin. Journal of Geology, 81:458-473. [ Links ]
45 Mullins, H. T., J. B. Thompson, K. McDougall, T. L. Vercoutere. 1985. Oxygen - minimum zone edge effects: evidence from Central California coastal upwelling system. Geology, 13:49-494. [ Links ]
46 Nomura, R. 1988. Paleoceanography of Upper Maestrichian to Eocene benthic foraminiferal assemblages at Sites 752, 753, y 754, Eastern Indian Ocean. Proceeding of the Ocean Drilling Program. Scientific Results, 121:3-75. [ Links ]
47 Ohkushi, K, E. Thomas, H. Kawagata. 2000. Abyssal benthic foraminifera from Northwestern Pacific (Shatsky Rise) during the last 298 kyr. Marine Micropalentology, 38:119-147. [ Links ]
48 Pak, P., Jr. V. Zaneveld, J. R. 1974. Equatorial Front in the Eastern Pacific Ocean. Journal of Physical Oceanography, 4:570-578. [ Links ]
49 Pedersen, T. F., M. Pickering, J. S. Vogel, J. N. Southon, D. E. Nelson. 1988. The Response of benthic foraminifera to productivity cycles in the Eastern Equatorial Pacific: faunal and geochemical constraints on glacial bottom water - oxygen levels. Paleoceanography, 3(2):157-168. [ Links ]
50 Resig, J. M. 1981. Biogeography of benthic foraminifera of the northern Nazca Plate and adjacent continental margin. Geological Society of America, Memoir 154:619-665. [ Links ]
51 Resig, J. M. 1990. Benthic foraminiferal stratigraphy and paleoenvironments off Perú, Leg 112. Proceeding of the Ocean Drilling Program. Scientific Results, 112:263-296. [ Links ]
52 Revets, S. A. 1996. The generic revision of five families of Rotaliine foraminifera. Cushman Foundation for Foraminiferal Research. Special Publication, 34:1-113. [ Links ]
53 Scott, D. B., G. Vilks. 1991. Benthonic foraminifera in the surface sediments of the deep-sea Arctic Ocean. Journal of Foraminiferal Research, 21(1):20-38. [ Links ]
54 Sprovieri, R., S. Hasegawa. 1986. Plio - Pleistocene benthic foraminifer stratigraphic distribution in the deep - sea record of the Tyrrhenian Sea (ODP Leg 107). Proceedings of the Ocean Drilling Program. Scientific Results, 107:429-459. [ Links ]
55 Swift, S. A. 1977. Holocene rates of sediment accumulation in the Panama Basin, Eastern Equatorial Pacific: pelagic sedimentation and lateral transport. The Journal of Geology, 85(3):301-319. [ Links ]
56 Thomas, F. C., F. S. Medioli, D. B. Scott. 1990. Holocene and latest Wisconsian benthic foraminiferal assemblajes and paleocirculation history, Lower Scottian Slope and Rise. Journal of Foraminiferal Research, 20(3):212-245. [ Links ]
57 Tjeerd, H. V. 1973. Texture and dispersal of sediments in the Panamá Basin. The Journal of Geology, 81:434-457. [ Links ]
58 Van der Zwaan, G. J., I. A. P. Duijnstee, M. Dulk, S. R Ernst, N. T. Jannink, T. J. Kouwenhoven. 1999. Benthic foraminifers: proxies or problems? A review of paleocological concepts. Earth Science Reviews, 16:213-236. [ Links ]
59 Wollenburg, J. E., A. Mackensen. 1998. Living benthic foraminifers from the Central Artic Ocean: faunal composition, standing stock and diversity. Marine Micropaleontology, 34:153-185. [ Links ]
60 Wyrtki, K. 1965. Corrientes superficiales del Océano Pacífico Oriental Tropical. Comisión Interamericana del Atún Tropical, 9(5):295-304. [ Links ]
61 Wyrtki, K. 1966. Oceanography of the Eastern Equatorial Pacific Ocean. Marine Biology Annual Review, 4:33-68. [ Links ]
62 Wyrtki, K. 1981. An estimate of equatorial upwelling in the Pacific. Journal of Physical Oceanography, 11:1205-1214. [ Links ]
FECHA DE RECEPCIÓN: 24/06/01 FECHA DE ACEPTACIÓN: 24/02/03
Notas taxonómicas
Cassidulina carinata: Ohkushi et al. (2000), pag. 140, pl. 2, Figs. 1a-b; Kawagata (1999), pag. 15, Figs. 4, 7a-b; Bornmalm (1997), pag. 61, Fig. 22, I; Akimoto (1990a), pl. 17, Fig. 3; Kaiho (1989), pag. 305, pl. 3, Fig. 4; Hasegawa et al. (1986), pag 477, pl. 4, Figs. 1-2.
Cibicidoides brady: Ohkushi et al. (2000), pag. 142, pl. 4, Figs. 6a-b-c; Akimoto (1990a), pl. 20, Figs. 2a-b; Kaiho (1989), pag. 308, pl. 6, Figs. 3a-b-c, 4a-b-c, 6a-b-c, 7a-b-c; Katz y Miller (1983), pag. 311, pl. 5, Figs. 3a-c.
Cibicidoides mundulus: Bornmalm (1997), pag. 75, Figs. 26, G-I; Akimoto (1990b), pag. 290, pl. 3, Figs. 11a-b-c; Kaiho (1989), pag. 308, pl. 6, Figs. 5a-b-c; Kaiho y Nishimura (1989), pag. 319, pl. 4, Figs. 11a-b-c; Nomura (1988), pag. 72, pl. 2, Figs. 2a-c, 3a-c, 4a-c; Katz y Miller (1983), pag. 311, pl. 5, Figs. 2 A-C.
Cibicidoides robertsonianus: Bornmalm (1997), pag. 75, Figs. 26, J-L; Thomas et al. (1990), pag. 236, pl. 5, Fig. 6, pag. 239, pl. 8, Fig. 5; Kaiho y Nishimura (1989), pag. 319, pl. 4, Figs. 10a-bc; Nomura (1988), pag. 72, pl. 2, Figs. 5a-c; Ingle et al. (1980), pag. 149, pl. 9, Fig. 10; Parrelloides robertsonianus para Sprovieri y Hasegawa (1986), pag. 459, pl. 5, Figs. 1-3.
Cibicidoides wuellerstorfi: Thomas et al. (1990), pag. 236, pl. 5, Figs. 4-5; pag. 239, pl. 8, Fig. 3; Kaiho (1989), pag. 308, pl. 6, Figs. 11a-b, Kaiho y Nishimura (1989), pag. 319, pl. 4, Figs. 14a-bc; Cibicides wuellerstorfi para Akimoto (1990a), pl. 23, Figs. 10a-b-c; Akimoto (1990b), pag. 290, pl. 3, Figs. 10a-b-c; Sprovieri y Hasegawa (1986), pag. 459, pl. 5, Figs. 10-12; Planulina wuellerstorfi para Scott y Vilks (1991), pag. 34, pl. 4, Figs. 14-15.
Gyroidina altiformis: Bornmalm (1997), pag. 70, Figs. 24, D-F; Akimoto (1990a), pag. 290, pl. 3, Figs. 1a-b-c; Hansenisca zealandica para Resig (1990), pag. 295, pl. 4, Figs. 19-20; Gyroidinoides altiformis para Hasegawa et al. (1986), pag. 478, pl. 5, Figs. 1-3.
Gyroidina laevigata: Hasegawa et al. (1986), pag. 478, pl. 5, Figs. 7-9.
Hoeglundina elegans: Kawagata (1999), pag. 15, Figs. 4, 1a-b-c; Bornmalm (1997), pag. 45, Figs.
18, C-D; Akimoto (1990a), pl. 21, Figs. 7a-b; Akimoto (1990b), pag. 290, pl. 3, Figs. 8a-b-c; Thomas et al. (1990), pag. 236, pl. 5, Fig. 12; Kaiho (1989), pag. 304, pl. 2, Figs. 18a-b-c; Kaiho y Nishimura (1989), pag. 318, pl. 3, Figs. 14a-b-c.
Laticarinina pauperata: Bornmalm (1997), pag. 58, Figs. 21a-c; Kaiho (1989), pag. 309, pl. 7, Figs. 6a-b-c; Nomura (1988), pag. 71, pl. 1, Fig. 6; Hasegawa et al. (1986), pag. 475, pl. 2, Fig. 19; McDougall (1985), pag. 416, pl. 4, Fig. 13; Ingle et al. (1980), pag. 149, pl. 9, Fig. 12.
Melonis affinis: Bornmalm (1997), pag. 78, Fig. 27, D-F; Sprovieri y Hasegawa (1986), pag. 457, pl. 3, Figs. 11-12; Resig (1981), pag. 653, pl. 4, Figs. 8-9; Ingle et al. (1980), pag. 141, pl. 5, Fig. 1-2.
Oridorsalis tener: Akimoto (1990a), pl. 21, Figs. 5a-b-c; Akimoto (1990b), pag. 290, pl. 3, Figs. 6ab- c; Wollenburg y Mackensen (1998), pag. 181, pl. V, Figs. 6-8; Ingle et al. (1980), pag. 141, pl. 5, Figs. 5-6.
Oridorsalis umbonatus: Ohkushi et al. (2000), pag. 143, pl. 5, Figs. 1a-b-c; Scott y Vilks (1991), pag. 34, pl. 4, Figs. 4-5; Akimoto (1990a), pl. 24, Figs. 4a-b-c; Akimoto (1990b), pag. 290, pl. 3, 123 Figs. 5a-b-c; Resig (1990), pag. 294, pl. 3, Fig. 3; Kaiho (1989), pag. 310, pl. 8, Figs. 7a-b-c; Kaiho y Nishimura (1989), pag. 320, pl. 5, Figs. 9a-b-c; Nomura (1988), pag. 73, pl. 3, Figs. 1a-c a 3ac; Sprovieri y Hasegawa (1986), pag. 456, pl. 2, Figs. 4-6; Matoba y Yamaguchi (1982), pag. 1056, pl. 4, Fig. 11a-b-c.
Pullenia bulloides: Ohkushi et al. (2000), pag. 143, pl. 5, Fig. 9a-b; Wollenburg y Mackensen (1998), pag. 181, pl. V, Figs. 9-10; Akimoto (1990a), pl. 17, Figs. 11a-b; 12a-b; Resig (1990), pag. 294, pl. 3, Fig. 5; Kaiho (1989), pag. 310, pl. 8, Figs. 1a-b, 2a-b; Kaiho y Nishimura (1989), pag. 320, pl. 5, Figs. 2a-b; Nomura (1988), pag. 73, pl. 3, Figs. 9a-b.
Pyrgo murrhyna: Ohkushi et al. (2000), pag. 139, pl. 1, Figs. 5a-b-c, Bornmalm (1997), pag. 27, Fig. 14, B; Thomas et al. (1990), pag. 237, pl. 6, Fig. 3; Kaiho (1989), pag. 304, pl. 2, Fig. 5; Kaiho y Nishimura (1989), pag. 318, pl. 3, Figs. 2a-b; Resig (1981), pag. 655, pl. 5, Fig. 9.
Sphaeroidina bulloides: Kaiho (1989), pag. 309, pl. 7, Figs. 2a-b-c; Kaiho y Nishimura (1989), pag. 319, pl. 4, Figs. 7a-b-c; Nomura (1988), pag. 75, pl. 5, Fig. 3; Hasegawa et al. (1986), pag. 477, pl. 4, Figs. 10-11; McDougall (1985), pag. 415, pl. 3, Fig. 2; Ingle et al. (1980), pag. 149, pl. 9, Fig. 16; Lutze (1979), pag. 430, pl. 3, Fig. 2.
Uvigerina hispida: Akimoto (1990a), pl. 16, Fig. 11; Akimoto (1990b), pag. 289, pl. 2, Figs. 17a-b; Kaiho (1989), pag. 306, pl. 4, Fig. 9; Nomura (1988), pag. 71, pl. 1, Fig. 10; McDougall (1985), pag. 416, pl. 4, Fig. 5; Ingle et al. (1980), pag. 147, pl. 8, Fig. 8.
Uvigerina hispidocostata: Akimoto (1990a), pl. 16, Fig. 10; Akimoto (1990b), pag. 289, pl. 2, Figs. 18a-b, 19a-b, 20; Kaiho (1989), pag. 306, pl. 4, Figs. 10-11; Kaiho y Nishimura (1989), pag. 319, pl. 4, Fig. 4.
Uvigerina mantaensis: Bornmalm (1997), pag. 50, Fig. 19, K; Resig (1990), pag. 295, pl. 4, Fig. 7.
Uvigerina peregrina: Ohkushi et al. (2000), pag. 140, pl. 2, Fig. 4; Kawagata (1999), pag. 21, pl. 5, Figs. 8a-b; Malmgren y Funnell (1991), pag. 157, pl. 1, Fig. 5; Thomas et al. (1990), pag. 235, pl. 4, Figs. 5-6; Ingle et al. (1980), pag. 137, pl. 3, Fig. 6; pag. 141, pl. 5, Figs. 14-15.
Uvigerina prosboscidea: Kawagata (1999), pag. 21, pl. 5, Figs. 10a-b; Akimoto (1990a), pl. 16, Fig. 12; Akimoto (1990b), pag. 289, pl. 2, Fig. 21a-b; Kaiho y Nishimura (1989), pag. 319, pl. 4, Fig. 5; Nomura (1988), pag. 71, pl. 1, Fig. 7; Ingle et al. (1980), pag. 143, pl. 6, Fig. 1; Uvigerina auberiana para Bornmalm (1997), pag. 50, Fig. 19, F; Uvigerina senticosa para Resig (1990), pag. 294, pl. 3, Fig. 1; Kaiho (1989), pag. 306, pl. 4, Fig. 12.
Uvigerina vadescens: Douglas (1973), pl. 8, Fig. 7.