Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.33 no.1 Santa Marta Jan./Dec. 2004
ESPONJAS Y OTROS MICROHÁBITATS DE OFIUROS (OPHIUROIDEA: ECHINODERMATA) EN AMBIENTES ARRECIFALES DEL ARCHIPIÉLAGO DE SAN BERNARDO (CARIBE COLOMBIANO)
Sponges and other ophiuroid microhabitats (Ophiuroidea: Echinodermata) at reef environments
of San Bernardo Archipelago (Colombian Caribbean).
Sonia Bejarano Chavarro, Sven Zea y Juan Manuel Díaz
RESUMEN
Los ofiuroideos son habitantes conspicuos de microhábitats expuestos y crípticos en arrecifes coralinos. Esta investigación pretendió conocer la composición de la comunidad de ofiuroideos encontrada en microhábitats ofrecidos por esponjas y por otros componentes arrecifales de diferente naturaleza (biótica vs. abiótica) y posición sobre el sustrato (elevada vs. no elevada) en los arrecifes de la zona Montastraea spp. en el archipiélago de Islas de San Bernardo (Caribe colombiano). Evaluando la abundancia de organismos en relación con la disponibilidad los diferentes microhábitats, se determinaron esquemas de ocupación exclusiva o preferencial de algún componente vertical particular, como insumo inicial de la existencia de relaciones ecológicas benéficas. Se realizaron muestreos en tres estaciones, en cada una se censaron tres transectos de 20 m de longitud recorridos durante el día y uno durante la noche, cuantificando visualmente la presencia y abundancia de ofiuroideos y la oferta (área o volumen) de todos los microhábitats. Se encontró un total de 11 tipos de microhábitats, siendo las estructuras de crecimiento vertical (entre ellas las esponjas y octocorales), los componentes más frecuentes en la totalidad del área de estudio. La comunidad ofiuroidea estuvo compuesta por 22 morfotipos. Solo Ophiopsila sp. 1 (de hábitos excavadores) se restringió a un solo tipo de sustrato en particular, en tanto que varias de las restantes se restringieron al uso de estructuras o espacios proporcionados por éstas, según condiciones particulares ofrecidas (elevación, naturaleza, cripticidad) y no según su identidad. La ocupación de superficies inferiores de componentes no elevados, estuvo determinada por la necesidad de ocupar espacios crípticos. Esta necesidad estuvo vinculada con especies fotosensibles, vulnerables a la depredación y a su inherente búsqueda de protección. Los componentes elevados y entre ellos 13 especies de esponjas fueron ocupados de manera característica por el complejo Ophiothrix angulata – O. orstedii y por O. suensonii. Se discuten los atributos de las esponjas (con diferentes morfologías) que proporcionan distintas ventajas para cada una de las especies ofiuroideas encontradas allí. Se sugiere la existencia de una probable relación ecológica no obligada entre estas especies de ofiuroideos y algunas de las esponjas más frecuentemente ocupadas, cuya existencia y naturaleza deben ser sometidas a comprobación experimental.
PALABRAS CLAVE: Ofiuros, Preferencia de microhábitats, Epibiosis, Esponjas.
ABSTRACT
Ophiuroids are conspicuous dwellers of exposed and cryptic microhabitats available in coral reefs. This investigation pretended to discern ophiuroid community composition at microhabitats available in sponges and other reef components of different character (biotic vs. abiotic) or position over the substrate (elevated vs. non-elevated), at shallow reefs within the Montastraea spp. zone at San Bernardo Archipelago (Colombian Caribbean). Evaluating the abundance of organisms related to availability of different microhabitats, schemes of exclusive or preferential occupation of a particular elevated component were determined. These schemes, are discussed as initial cues that suggest the existence of benefic ecological relations. Samplings were performed at three stations. Four 20 meter transects were surveyed on each station, three during daytime and one during night. Presence and abundance of ophiuroids and microhabitat availability (area or volume) were quantified visually. Eleven types of microhabitats were identified. Vertical microhabitats and specially sponges and octocorals, were the most common substrate components at the study area. The ophiuroid community was composed by 22 morphotypes. Only Ophiopsila sp. 1 (with excavating habits) was restricted to one particular kind of substrate. Many other species did not use restrictedly any particular type of microhabitat, but used exclusively structures of particular characteristics (elevation, character or cripticity). The occupation of inferior surfaces of non-elevated components was determined by ophiuroid’s necessity of reaching cryptic conditions, and this necessity was linked to photosensitive species, or those especially vulnerable to predators, and to its consequent seek of protection. Elevated components and particularly 13 sponge species were characteristically occupied by Ophiothrix angulata – O. orstedii complex and by O. suensonii. Sponges with different morphologies are discussed to bring differential advantages to dwelling ophiuroid species. It is suggested that a probable benefic ecologic relationship (not obligated) exists between these brittle-star species and some of the most frequently occupied sponge species. Nevertheless this must be appropriately tested by experimental work.
KEY WORDS: Ophiuroids, Microhabitat preference, Epibiosis, Sponges.
INTRODUCCIÓN
Los ofiuroideos del Atlántico occidental tropical, son taxonómica y ecológicamente diversos (Kissling y Taylor, 1977) y, aunque poco conspicuos, la abundancia de organismos y la riqueza de especies, exceden considerablemente a aquellas de los demás equinodermos en muchos arrecifes tropicales (Barnes, 1995); llegando incluso a ser el grupo más abundante y característico después de los escleractinios y octocorales, en algunas localidades del Caribe (Kissling y Taylor, 1977). Aunque se reconoce que los ofiuroideos desempeñan una función ecológica importante en las comunidades marinas y se han registrado como componentes importantes en la dieta de invertebrados y peces (Randall, 1967; Hendler et al., 1995), rara vez se ha probado la significancia de esta función y con algunas excepciones (ver Boffi, 1972; Hendler, 1984; Schoppe y Werding, 1996; Turon et al., 2000), sus interacciones con otros organismos han sido solo esporádicamente documentadas (Ambrose, 1993). Aunque su asociación con varias especies de esponjas arrecifales se ha reconocido ampliamente (Mac Ginitie y Mac Ginitie, 1949; Pearse, 1950; Hyman, 1955; Bacescu, 1971; Rützler, 1975, Duarte y Nalesso, 1994; Villamizar y Laughlin, 1991), registrándose a menudo su dominancia en la comunidad que habita sobre y dentro de ellas (Duarte y Nalesso, 1994; Villamizar y Laughlin, 1991), en pocas ocasiones (p. ej. Hendler, 1984; Turon et al., 2000) se ha abordado la ecología de esta interacción, con el detalle suficiente para caracterizar su naturaleza. Por otro lado, se conocen aspectos ecológicos involucrados en el uso de diferentes hábitats arrecifales por parte de los ofiuros. Hendler et al. (1995) señalaron que uno de ellos es la presencia de estructuras adecuadas del sustrato como esponjas hidrocorales u octocorales; en tanto que Boffi (1972) detectó que algunas especies ofiuroideas se distribuyen preferencialmente en varias especies de algas, según la disposición de éstas en las diferentes zonas del litoral. Sin embargo, los estudios tanto de tipo observacional como experimental, esencialmente dirigidos a detectar claramente las preferencias de microhábitat y los factores que las determinan, son aún escasos.
El conocimiento de los equinodermos de aguas someras en Colombia es limitado, existiendo sólo algunos estudios taxonómicos (p. ej. Álvarez –Larrauri, 1980; Gallo 1985, 1988a, 1988b; González, 2001). Los ofiuroideos en particular han sido pobremente estudiados, contándose hasta el momento con algunos listados de especies y solo breves descripciones del hábitat de cada una de ellas. En Colombia, al igual que en otros países, su ecología ha sido relativamente ignorada desde hace mucho tiempo, debido tal vez a sus reconocidos hábitos crípticos y a la escasez de literatura taxonómica adecuada (Kissling y Taylor, 1977). El presente trabajo buscó determinar si existen tendencias observables que sugieran uso preferencial o exclusivo de estructuras vivas de crecimiento erguido (esponjas, hidrocorales u octocorales).
MATERIALES Y MÉTODOS
El Archipiélago de San Bernardo (9°39’ y 9°52’N; 75°41’ y 75° 57’W), localizado en la región central de la plataforma continental del Caribe colombiano, presenta las condiciones climáticas típicas de esta región (Díaz et al., 2000). Está compuesto por nueve islas de origen coralino (Boquerón, Cabruna, Palma, Ceycén, Panda, Maravilla, Tintipán, Múcura y Mangle) y un islote artificial (Figura 1). Constituye una extensa área coralina (250 km2), en la que se presentan distintos tipos de formaciones de coral, praderas de pastos marinos y fondos mixtos (López- Victoria y Díaz, 2000).

Los muestreos se llevaron a cabo durante las primeras semanas de los meses de abril, mayo y junio de 2000 en las estaciones 1, 2 y 3 señaladas en la figura 1, ubicadas entre los 5 y 9 m de profundidad en la unidad de paisaje denominada Montastraea spp. Una primera fase consistió en el reconocimiento del área y la determinación de estructuras del sustrato arrecifal consideradas como potenciales microhábitats de ofiuroideos. Se estableció a priori (con base en información bibliográfica y en el reconocimiento del área de estudio) una serie de posibles componentes del sustrato en los cuales fuese habitual encontrar ofiuroideos.
En cada una de las estaciones visitadas se aplicó el procedimiento de recolección de información utilizando una cinta métrica de 20 m de longitud. Se demarcaron cuatro transectos lineales por estación, tres de los cuales fueron censados durante el día y uno durante la noche. Cada transecto se recorrió en busca de todos los puntos bajo la línea ocupados por microhábitats establecidos a priori y se registró la identidad y oferta (área o volumen) de cada uno. Casi siempre las esponjas se identificaron a nivel específico en campo. Cuando esto no fue posible se colectó un trozo y se preservó en etanol al 70% para su identificación en laboratorio, con base en observación de preparaciones rápidas de espículas (Zea, 1987). Por medio de observación y conteo directo se determinaron las especies y morfotipos de ofiuros en cada microhábitat y sus abundancias. Un par de ejemplares de cada morfotipo fueron colectados y transportados con hielo al laboratorio para su identificación y registro fotográfico. La identificación se llevó a cabo mediante las claves taxonómicas de Clark (1933), Fell (1960, 1962), Tomassi (1970), Paterson (1985) y Hendler et al. (1995).
Análisis de la información
Para determinar si la comunidad o alguna de sus especies ocupa de manera preferencial alguno de los tipos de microhábitat definidos: a) Estructuras de naturaleza biótica vs. abiótica, b) Estructuras elevadas vs. no elevadas y c) Esponjas vs. otros componentes elevados, se determinó cuales de ellas ocurrieron representativamente (en tres o más transectos) y exclusivamente (únicamente en determinada categoría) en cada microhábitat y categoría mayor. Se calcularon valores medios de dos indicadores de preferencia: a) Densidad (De) (entre nueve transectos) (Boffi, 1972; Kissling y Taylor, 1977) y b) Porcentaje de ocupación (Po%) (Boffi, 1972) (entre 12 transectos) a partir de abundancias totales de ofiuroideos y de cada especie. Evidencias de preferencia por una u otra categoría fueron sugeridas cuando se probó la existencia de diferencias significativas entre los valores medios de estos indicadores (totales y por especie) en cada una de ellas. Estas diferencias se determinaron entre pares de categorías (elevados vs. no elevados) mediante análisis de varianza (ANOVA a una vía y a dos colas) previa prueba de homogeneidad de varianzas (test de homocedasticidad de Levene) empleando el paquete estadístico SPSS 10.0. Comparaciones múltiples (entre más de dos microhábitats) se llevaron a cabo mediante la prueba de Tukey. Cuando las varianzas no fueron homogéneas, se transformaron los datos utilizando Log10 (n + 1). En caso de no lograr homogeneidad, se utilizaron comparaciones no paramétricas de Mann-Whitney y Kruskall-Wallis.
RESULTADOS Y DISCUSIÓN
Microhábitats de ofiuroideos en la zona Montastraea annularis – M. faveolata
En total 11 componentes del sustrato proporcionaron varios espacios habitables para los ofiuroideos siendo los componentes elevados del sustrato y entre ellos las esponjas y octocorales, los más frecuentes en el área de estudio. Cabe esperar la existencia de tal diversidad de microhábitats considerando la compleja y heterogénea topografía que adquieren los arrecifes coralinos por procesos de deposición acumulativa de material calcáreo que concentran volúmenes masivos de cascajo no consolidado y arena (Hendler et al., 1995). En la tabla 1 se señalan todos los microhábitats junto con atributos propios relevantes referentes a su naturaleza, posición sobre el sustrato y particularidades de sus espacios habitables. Al respecto cabe aclarar que aunque el microhábitat denominado ROC-MON es constituido por grandes colonias vivas de Montastraea spp., es clasificado como un microhábitat abiótico debido a que los ofiuros encontrados allí habitan comisuras presentes en sus partes de roca calcárea desprovistas de tejido vivo.
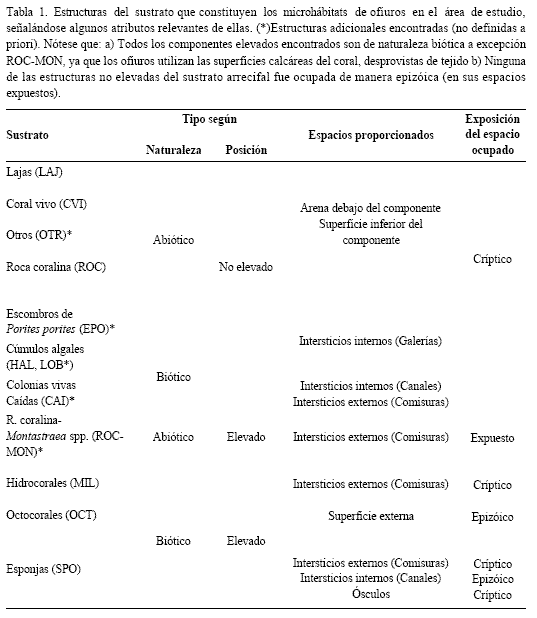
Composición de la comunidad de ofiuroideos
Se encontró un total de 404 individuos pertenecientes a 22 morfotipos de ofiuroideos. Once de ellos se identificaron a nivel de especie, tres a nivel genérico, uno a nivel de familia (Especie 1) y siete más se agruparon en tres complejos debido a su difícil reconocimiento visual en campo. Todas las especies habían sido registradas comúnmente en otras localidades como el complejo arrecifal de Belice (Hendler y Pawson, 2000), Looe Key (Florida) (Kissling y Taylor, 1977) e Islas del Rosario (Caycedo, 1979). El total de especies se distribuyó en once géneros y ocho familias: Ophiomyxidae, Ophiuridae, Ophiocomidae, Ophionereididae, Ophiodermatidae, Ophiactidae, Amphiuridae y Ophiotrichidae (Tabla 2).

Fue evidente que el complejo Ophiothrix angulata - O. orstedii (OANG –OORS), conformado por especies que han sido registradas entre las más conspicuas de todas las zonas arrecifales en varias localidades del Caribe (Hendler et al., 1995), fue el más abundante (207 individuos en total), seguido por los juveniles del género Ophiocoma y las especies Ophioderma cinereum y Ophiothrix suensonii. En contraste se encontraron tan solo uno o dos individuos de Especie 1, Ophiomyxa flaccida, Ophiactis sp. 1, Ophiocoma pumila, Amphiura palmeri, A. stimpsonii y Amphioplus thrombodes durante la totalidad del muestreo.
Aunque los tres arrecifes correspondientes a las estaciones de muestreo se ubicaron dentro del mismo tipo de unidad de paisaje (López- Victoria y Díaz, 2000), estos fueron diferentes en cuanto a la disponibilidad de los distintos componentes del sustrato. Tales diferencias se deben a su propia fisionomía y a la zona del arrecife en que se encuentran ya que los arrecifes cercanos a Ceycén y Maravilla se localizaron en sotavento y el arrecife de Tintipán en barlovento. La alta cobertura coralina y ondulada topografía de este último constituyó un ambiente al parecer poco propicio para el desarrollo de esponjas de gran tamaño y de crecimiento vertical. La composición de especies ofiuroideas y su representatividad también varió entre estaciones.
En los arrecifes cercanos a Ceycén y Maravilla, donde las esponjas y los octocorales fueron los componentes elevados más frecuentes durante la totalidad del muestreo, el complejo OANG-OORS y O. suensonii fueron los más representativos. En contraste sólo se encontraron escasos ejemplares de estas especies en el arrecife de Tintipán, que estuvo completamente desprovisto de esponjas de crecimiento erguido. Este hecho está de acuerdo con lo mencionado por Kissling y Taylor (1977) y Hendler et al. (1995), quienes afirman que la presencia de algunas especies ofiuroideas está regulada en gran parte por la presencia de sitios elevados para la alimentación. Sin embargo, al considerar que el complejo OANG - OORS y O. suensonii ocurrieron de manera poco abundante en Tintipán a pesar de la conspicua presencia de octocorales allí, hace pensar que entre los componentes elevados las esponjas influyen particularmente en su presencia. Acorde con lo mencionado por Hendler (1984), esta influencia es considerada como el primer indicio de una relación ecológica entre ellos.
Se presenta en la tabla 3 el esquema de ocupación de los diferentes componentes del sustrato y sus espacios habitables, por parte de todas las especies ofiuroideas encontradas en el área. Por otra parte, en la figura 2 se muestran solo aquellas especies que fueron suficientemente representativas durante el día para calcular su densidad en cada microhábitat (valor indicado por las barras), señalando mediante símbolos su ocupación nocturna. Complementariamente en la tabla 4 se muestra la densidad y porcentaje de ocupación de cada microhábitat por parte de las especies más representativas, incluyendo aquellas que ocurrieron de manera poco representativa durante el día.

Un 39% del total de puntos muestreales correspondientes a microhábitats examinados durante el muestreo cuantitativo, estuvieron ocupados por uno o más ofiuroideos. Aunque los ejemplares ofiuroideos se distribuyeron a través de todos los espacios proporcionados por las diferentes estructuras del sustrato exploradas y ninguna de las especies (a excepción de Ophiopsila sp. 1) se restringió a algún componente particular del sustrato, tal como se evidencia en registros previos (p. ej. Boffi, 1972; Kissling y Taylor, 1977; Hendler et al., 1995), el presente trabajo coincide en señalar que la mayoría de especies se agruparon exclusivamente en estructuras que ofrecían distintos tipos de espacios y la posibilidad de utilizar atributos característicos tales como su cripticidad, naturaleza o posición sobre el sustrato. Esta información está de acuerdo con previos registros que demuestran que la especificidad por un sustrato de determinada identidad ha sido probada solo en algunas especies ofiuroideas como Sigsbeia confiera que habita exclusivamente sobre los hidrocorales Stylaster roseus o S. filograneus (Koehler, 1914).
Especies restringidas a diferentes componentes del arrecife o a espacios disponibles
Ocupación exclusiva y permanente de microhábitats crípticos en estructuras no elevadas. Siete de las especies encontradas en tres o más transectos utilizaron exclusivamente espacios crípticos proporcionados por varias estructuras no elevadas del sustrato. Ophionereis reticulata, el complejo Ophiocoma spp., Ophioderma phoenium, O. rubicundum, O. cinereum, Ophiostigma isocanthum y Ophiolepis impressa. Dos de estas ocuparon de manera exclusiva microhábitats proporcionados por estructuras abióticas del arrecife. Tal es el caso de los adultos del complejo Ophiocoma spp. y O. reticulata. Entre estas, O. reticulata, tal como ha sido registrada por otros autores (Hendler et al., 1995; Kissling y Taylor, 1977), se encontró exclusivamente sobre la arena bajo los componentes. Los individuos del complejo Ophiocoma spp. (que siempre fueron de gran tamaño), que previamente han sido registrados como componentes destacables de la fauna encontrada entre cascajo coralino, bajo lajas y rocas coralinas (Hendler et al., 1995), habitaron sobre la superficie inferior de varias estructuras abióticas encontrándose siempre sobre el sustrato duro disponible bajo estas, así como también en las amplias galerías de los escombros del coral P. porites. Esto es consistente con información disponible de las tres especies agrupadas en el complejo, pues según Hendler et al. (1995) sólo los juveniles de estas se han registrado en componentes bióticos como cúmulos algales.
Ophioderma phoenium, O. rubicundum y O. isocanthum, especies que se han registrado ocupando varios sustratos de diferente naturaleza (Hendler et al., 1995), se encontraron en sustratos duros disponibles bajo estructuras abióticas o la superficie inferior de las mismas. Particularmente, los individuos más pequeños de estas especies se encontraron en intersticios de Halimeda spp. y Lobophora variegata y entre escombros de P. porites. Por otra parte, los individuos de mayor tamaño de O. impressa y O. cinereum siempre se ubicaron en la arena disponible bajo componentes abióticos, mientras varios ejemplares pequeños de ambas especies emplearon intersticios de Halimeda spp., patrones que previamente se habían reconocido en estas especies (Hendler et al., 1995).
Ocupación exclusiva y permanente de microhábitats en estructuras elevadas. Solo Ophiopsila sp. 1. y O. suensonii ocuparon exclusivamente estructuras de posición elevada sobre el sustrato. Ophiopsila sp. 1 en particular habitó exclusivamente en las comisuras de grandes columnas de roca coralina que en su parte superior soportaban porciones vivas del coral Montastraea spp. Este microhábitat no fue ocupado por ninguna otra especie de ofiuroideo. Los brazos (bioluminiscentes al tacto) de Ophiopsila sp. 1 eran evidentes allí durante la noche, mientras que su disco permanecía oculto dentro de la comisura Es probable que este morfotipo corresponda a O. riseii, cuyo característico hábito nocturno y uso particular de este tipo de espacios, han sido descritos en detalle por Hendler et al. (1995). La bioluminiscencia producida por sus brazos al tacto ha sido registrada previamente en otras especies del género y reconocida como repelente de la depredación por parte de camarones y cangrejos. (Emson y Herring, 1985; Grober 1988). Además, Grober (1989) ha señalado que esta bioluminiscencia permite a especies suspensívoras maximizar el tiempo de su actividad alimentaria minimizando la mortalidad y el daño subletal causado por depredadores. Este hecho parece favorecer en el caso particular, la presencia conspicua de estos individuos en un microhábitat elevado del sustrato con un comportamiento alimentario marcadamente activo.
Ophiothrix suensonii, comúnmente documentada habitando conspicuamente varios componentes elevados del arrecife junto con otras de su género (Kissling y Taylor, 1977; Caycedo, 1979; Boffi, 1982; Hendler et al., 1995; Turon et al., 2000), ocupó la superficie externa de esponjas, octocorales y Millepora. Allí, individuos de tamaños variables se observaron expuestos tanto durante el día como durante la noche y solo algunos ejemplares se observaron en condiciones crípticas, también durante el día y la noche, al ubicarse en los ósculos de algunas esponjas tubulares o las bases y ejes de octocorales profusamente ramificados.
Especies distribuidas en amplios intervalos de estructuras y espacios.
Los juveniles del complejo Ophiocoma spp. y el complejo OANG-OORS, cuyas especies se han registrado previamente en un gran intervalo de espacios disponibles en estructuras de distinta naturaleza (bióticas y abióticas) y posición sobre el sustrato (elevadas y no elevadas) (Boffi, 1972; Kissling y Taylor, 1977; Hendler et al., 1995), ocuparon un intervalo más amplio de estructuras. El complejo OANG-OORS se destacó por abarcar el mayor número de microhábitats diferentes (8 de 11) y por estar presente en los tres tipos de estructuras elevadas y en la mayoría de estructuras no elevadas, tanto bióticas como abióticas. Entre este amplio intervalo de estructuras, ambos complejos habitaron en varios tipos de espacios disponibles tales como: intersticios, comisuras, superficies externas e inferiores. Ello concuerda con el hábito generalista, oportunista y "fugitivo", señalado por Hendler et al. (1995) para varias de las especies que conforman estos complejos. Por otra parte, los juveniles de ofiuroideos se encontraron en seis tipos de microhábitats diferentes correspondientes a estructuras de naturaleza abiótica así como también a estructuras bióticas elevadas y no elevadas del sustrato, siempre distintos de aquellos utilizados por los adultos respectivos.
Preferencia de estructuras elevadas y no elevadas. Aunque se presentó una densidad promedio de individuos y de especies significativamente mayor en los componentes no elevados del sustrato (p=0.006, 39.3±11.3 vs 7.6±2.7; p=0.001, 1.2±0.3 vs. 0.1±0.02 respectivamente), los porcentajes de ocupación entre estos dos tipos de microhábitat no fueron significativamente diferentes (p=0.09, 50.7±7.2% vs. 30.9±8.5%) (Tablas 5 y 6). Lo anterior indica, que si bien inicialmente se percibió una conspicua presencia de ofiuros sobre esponjas y otros componentes elevados del sustrato arrecifal, la comunidad utilizó de manera similar las estructuras no elevadas del sustrato arrecifal. Sin embargo, fue evidente un menor número de especies ofiuroideas encontraron condiciones favorables en la ocupación de estructuras elevadas, mientras que un mayor numero de ellas aprovechan los espacios crípticos ofrecidos por componentes no elevados.

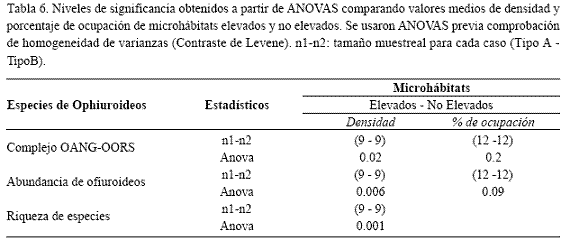
Por otra parte, aunque los individuos del complejo OANG-OORS ocuparon homogéneamente tanto las estructuras elevadas como las no elevadas del sustrato arrecifal utilizando proporciones similares del total de puntos disponibles de cada uno (p=0.2, 26.3±7.8% vs. 15.3±5.0%), se presentó una densidad media de individuos significativamente mayor en los microhábitats proporcionados por estructuras no elevadas del sustrato arrecifal (p=0.02, 32.0±10.3 ind/m2 vs. 3.7±1.8 ind/m2) (Tablas 5 y 6). Esto indica que este complejo no evidenció preferencia por alguno de los tipos de microhábitat en particular y que aunque la elevación con respecto al sustrato no constituye un elemento influyente en la selección de un sustrato específico, los microhábitats crípticos ofrecidos por componentes no elevados brindan condiciones favorables para su agregación.
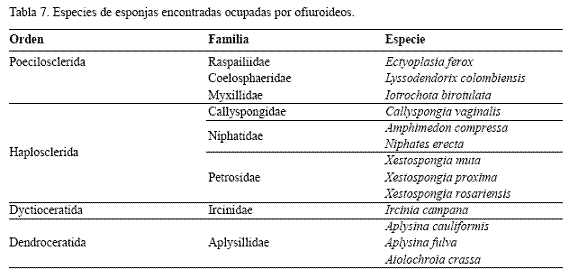
Preferencia de las diferentes estructuras elevadas. Aunque los octocorales no fueron identificados en campo a nivel específico, se reconoce que varios ejemplares del género Ophiothrix se registraron sobre colonias de Pseudoplexaura sp., Gorgonia ventalina, Briareum asbestinum y Pseudopterogorgia spp. Además se registró un total de 16 especies de esponjas, 13 de las cuales (incluyendo algunas registradas puntualmente) estuvieron ocupadas por ofiuroideos (Tabla 7). Entre estos componentes elevados del sustrato, las esponjas fueron ocupadas con una mayor frecuencia por ofiuroideos (43 % del total de esponjas exploradas vs. 32% del total de colonias de Millepora spp. y 10% de los octocorales examinados).
Sobre los tres tipos de estructuras con crecimiento elevado sobre el sustrato, se registró de manera característica la ocurrencia de O. suensonii y del complejo OANG-OORS, y solamente sobre las esponjas se registraron, en escasas ocasiones, individuos pertenecientes a especies diferentes a éstas, como algunos juveniles del complejo Ophiocoma spp. y Ophiopsila spp. y el morfotipo Ophiactis sp. 1. Por tal motivo, para la resolución del problema de investigación se tuvieron en cuenta únicamente la especies Ophiothrix suensonii y el complejo OANG-OORS., que, además de haber sido comúnmente registrados de manera epizóica sobre los componentes elevados examinados, han sido encontrados asociados a otros organismos sésiles, como briozoarios, poliquetos tubícolas, penatuláceos, crinoideos y corales negros (Fell, 1966; Hendler et al., 1995). En la tabla 8 se presentan los niveles de significancia obtenidos de las comparaciones realizadas para determinar diferencias entre los valores medios de densidad y porcentaje de ocupación de cada tipo de estructura elevada por parte de estas especies.

Los resultados del análisis de Kruskall-Wallis muestran que no hubo diferencias significativas entre las medianas de las densidades del complejo OANG-OORS sobre ninguno de los componentes elevados del sustrato arrecifal (p=0.148, SPO: 18.7±10.2 ind/m3 vs. MIL: 1851.8±1851.8 ind/m3 vs. OCT: 4.5±3.7 ind/m3). Este mismo tipo de análisis indica que hubo diferencias estadísticamente significativas (p=0.015) entre las medianas de sus porcentajes de ocupación (Tabla 8). Esto último indica que aunque este complejo encontró un amplio intervalo de espacios crípticos en estructuras no elevadas (distribuyéndose a través de estas sin importar su naturaleza), también las esponjas le proporcionan espacios crípticos que ocupó preferentemente entre otros componentes de crecimiento vertical (25.6±6.5% de esponjas vs. 4.5±3.0% de octocorales). Este complejo también ocupó en algunas ocasiones, las colonias del hidrocoral Millepora spp. Sin embargo, como lo evidencia el error estándar respectivo, sus porcentajes de ocupación allí fueron extremadamente variables (fluctuando entre el 0 y 100% de los puntos disponibles en un transecto). Por otra parte, aunque el análisis de varianza no señaló diferencias significativas entre las densidades ni porcentajes medios de ocupación de ninguna de las estructuras elevadas por parte de O. suensonii (p=0.390 y p=0.146 respectivamente), esta especie ocupó en total una mayor proporción de aquellos puntos disponibles que correspondieron a las esponjas (18.8%) con relación a las demás estructuras disponibles.
Los esquemas de ocupación que evidenciaron el complejo y O. suensonii sobre componentes verticales y en especial la preferencia por esponjas, parecen estar vinculados a particularidades de estas que representan beneficios comunes para su fauna asociada, así como también a características aprovechables por las especies ofiuroideas dependiendo de su tamaño, morfología y coloración. En primer lugar, se han documentado frecuentemente algunas particularidades de las esponjas que son benéficas para su fauna asociada, y son incluso responsables en gran medida, del establecimiento de relaciones ecológicas estrechas (Hendler, 1984; Turon et al., 2000). Entre ellas figuran su constitución porosa y múltiples morfologías de crecimiento que proporcionan una gran variedad de espacios habitables. Estas particularidades, junto con algunas sustancias ictiotóxicas, confieren protección contra la depredación (Westinga y Hoetjes, 1981; Hendler, 1984; Dunlap y Pawlik, 1998). Además, su actividad inhalante permanente crea una fuente constante de alimento constituido por plancton y partículas orgánicas (Westinga y Hoetjes, 1981).
Preferencia de las especies de esponjas. Por otra parte, particularmente las pequeñas especies del complejo OANG-OORS, que se han registrado en el contenido estomacal de más de veinte especies de peces (Randall, 1967), encontraron provechosa la ocupación de pequeños ósculos y comisuras donde probablemente no son percibidas ni alcanzadas por sus depredadores. Además, estas especies detritívoras encontraron favorable el uso epizóico de superficies expuestas de esponjas, donde permanecen crípticas gracias a su coloración matizada para el mimetismo (ver Hendler et al., 1995). La frecuente aparición sobre algunas especies como Iotrochota birotulata y Xestospongia rosariensis por parte de este complejo (Tabla 9) se atribuye a que éstas poseen una coloración favorable para lograr la cripticidad mediante mimetismo, en tanto que la presencia frecuente en otras esponjas como Ectyoplasia ferox, Lyssodendoryx colombiensis y Aplysina fulva, parece estar vinculada con la disponibilidad de refugios físicos.
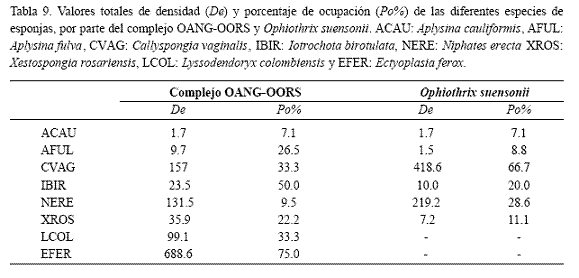
En contraste, aunque O. suensonii se encontró equipada para ocupar visible y epizoicamente esponjas y otros componentes elevados del sustrato, mostró preferencia por algunas especies de esponjas, atribuible a la disponibilidad de diferentes ventajas conferidas según sus formas de crecimiento. La presencia en Niphates erecta, por ejemplo (cuya morfología no proporcionó refugios crípticos para especies de gran tamaño), responde seguramente a la necesidad de ocupar una posición favorable para su actividad alimentaria suspensívora y para conformar agregaciones de individuos como mecanismo de protección. El uso frecuente de esponjas columnares y de grandes ósculos (como Callyspongia vaginalis, X. rosariensis y L. colombiensis), por parte de O. suensonii puede ser preferiblemente una respuesta a la búsqueda de protección al menos temporal, probablemente regulada por ciclos de actividad de sus depredadores.
AGRADECIMIENTOS
Este trabajo fue posible gracias al apoyo financiero del Programa de Biodiversidad y Ecosistemas Marinos (BEM) del Instituto de Investigaciones Marinas y Costeras (INVEMAR). Un agradecimiento especial al Profesor Carlos Barreto su valiosa ayuda en el tratamiento estadístico de la información y a Milena Benavides, Guiomar Borrero y Dunia González por su ayuda en la identificación de los ofiuroideos.
BIBLIOGRAFÍA
Álvarez –Larrauri, L. R. 1980. Listado preliminar de los equinodermos de la costa Atlántica colombiana. Bol. Mus. Mar., 10: 24-39. [ Links ]
Ambrose, W. G., Jr. 1993. Effects of predation and disturbance by ophiuroids on sof-bottom community structure on Oslofjord: Results of a mesocosm study. Mar. Ecol. Prog. Ser., 97: 225-236. [ Links ]
Bacescu, M. 1971. Les Spongiaires; un des plus intéressants biotopes benthiques marins. Rapport et procésverbaux des reunions. Conseil permanent international pour l’ exploration scientifique de la Mer Méditerrané 20: 239-241. [ Links ]
Barnes, R. D. 1995. Zoología de los invertebrados. Sexta Edición. Ed. MacGraw-hill Interamericana. Madrid, 1114 p. [ Links ]
Boffi, E. 1972. Ecological aspects of ophiuroids from the phytal of S. W. Atlantic Ocean warm waters. Mar. Biol., 15: 316-328. [ Links ]
Caycedo, I. E. 1979. Observaciones de los equinodermos en las Islas del Rosario. An. Inst. Inv. Mar. Punta Betín, 11: 39-47. [ Links ]
Clark, H. L. 1933. A handbook of the littoral echinoderms of Porto Rico and the other West Indian Islands. Scientific Survey of Porto Rico and the Virgin Islands. New York Academy of Sciences, 16: 1-147. [ Links ]
Díaz, J. M.; L. M. Barrios; M. H. Cendales; J. Garzón –Ferreira; J. Geister; M. López –Victoria; G. H. Ospina; F. Parra-Velandia; J. Pinzón; B. Vargas-Ángel, F. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Publ. Esp. INVEMAR. 5. 176 p. [ Links ]
Duarte, L. y R. C. Nalesso, 1994. The sponge Zygomycale parishii (Bowerbank) and its endobiotic fauna. Est. Coast. Shelf Sci., 42: 139-151. [ Links ]
Dunlap, M y J. Pawlik, 1998. Spongivory by parrotfish in Florida mangrove and reef habitats. Mar. Ecol., 19 (4): 325-337. [ Links ]
Emson, R. H. y J. Herring. 1985. Bioluminescence in deep and shallow water brittlestars. Echinodermata: 656-662. En B. F. Keegan y B. D. S. O´Connor (Eds.) Proceedings of the Fifth International Echinoderm Conference, Galway, 24-29 September 1984. Balkema. Rotterdam. [ Links ]
Fell, H. B. 1960. Synoptic keys to the genera of Ophiuroidea. Zool. Publ. Victoria Univ. of Wellington, 26: 1-44. [ Links ]
_____. 1962. A revision of the major genera of amphiurid. Ophiuroidea. Transactions of the Royal Society of New Zealand, 2(1): 1-26. [ Links ]
______ 1966. The ecology of Ophiuroids. En R. A. Boolotian (Ed.) Physiology of Echinodermata. Londres: Interscience Publ.: 129-144. [ Links ]
Gallo, N. J. 1985. Contribución al estudio de los equinodermos del Parque Nacional Natural Tayrona: III Asteroidea. Programa de Ecosistemas Marinos: Informes técnicos subproyectos INDERENA-INVEMAR, 40 p. [ Links ]
______. 1988a. Contribución al conocimiento de los equinodermos del Parque Nacional Natural Tayrona: I Echinoidea. Trianea (Act. Cient. Tecn. INDERENA). INDERENA, 1: 99-118. [ Links ]
______. 1988b. Contribución al conocimiento de los equinodermos del Parque Nacional Natural Tayrona: II Ophiuroidea. Trianea (Act. Cient. Tecn. INDERENA). INDERENA, 2: 383-402. [ Links ]
González, D. N. 2001. Equinodermos colectados por la expedición CIOH-INVEMAR-SMITHSONIAN desde Cartagena hasta el Golfo de Urabá, Caribe colombiano. Tesis Biól. Mar. U. Jorge Tadeo Lozano. Santa Marta. 245 p. [ Links ]
Grober, M. S. 1988 a. Responses of tropical reef fauna to brittle-star luminescence (Echinodermata: Ophiuroidea). Jour. Exp. Mar. Ecol. Biol.: 157-168. [ Links ]
______. 1988b. Brittle-star bioluminescence functions as aposematic signal to deter crustacean predators. Animal Behavior, 36: 493-501. [ Links ]
______. 1989. The physiological, behavioral and ecological responses of nocturnal marine fauna to invertebrate bioluminescence. Tesis Ph. D. California Univ., Los Angeles. (EE.UU). 234 p. [ Links ]
Hendler, G. 1984. The association of Ophiothrix lineata and Callyspongia vaginalis: a brittlestar-sponge cleaning symbiosis? Mar. Ecol., 5(1): 9-27. [ Links ]
Hendler, G.; J. E. Miller; D. Pawson y P. Kier. 1995. Sea stars, sea urchins and allies. Echinoderms of Florida and the Caribbean. Smithsonian Institution. Washington: 1-195. [ Links ]
Hendler, G. y D. Pawson. 2000. Echinoderms of the Rhomboidal Cays, Belize: biodiversity, distribution and ecology. Atoll Res Bull. 479: 275-299. [ Links ]
Hyman, L. H. 1955. The invertebrates: Echinodermata. The Coelomate Bilateralia. Mc Graw Hill, Nueva York. 763 p. [ Links ]
Kissling, D. y G. T. Taylor. 1977. Habitat factors for reef dwelling ophiuroids. Proc. 3rd Int. Coral Reef Symp., Miami 2: 225-231. [ Links ]
Koehler, R. 1914. A contribution to the study of ophiurans of the United States National Museum. United States National Museum Bulletin 84: 1-18. [ Links ]
López –Victoria, M. y J. M. Díaz. 2000. Morfología y estructura de las formaciones coralinas del Archipiélago de San Bernardo, Caribe colombiano. Rev. Acad. Col. Cien. 24(91): 219-230. [ Links ]
Mac Ginitie G. E. y N. Mac Ginitie. 1949. Natural History of Marine Animals. McGraw-Hill, Nueva York: 80-84. [ Links ]
Paterson, G. L. J. 1985. The deep-sea Ophiuroidea of the north Atlantic Ocean. Bull. Brit. Mus. (Nat. Hist.). Zool. series, 49 (28): 152 p. [ Links ]
Pearse, A. S. 1950. Notes on the inhabitants of certain sponges at Bimini. Ecology, 31 (1): 150-151. [ Links ]
Randall, J. E. 1967. Food habits of reef fishes of the West Indies. Institute of Marine Sciences. University of Miami. Stud. Trop. Ocean., 5: 665-847. [ Links ]
Rützler, K. 1975. Ecology of Tunisian commercial sponges. Tethys, 7: 249-264. [ Links ]
Schoppe, S. y B. Werding. 1996. The boreholes of the sea urchin genus Echinometra (Echinodermata: Echinoidea: Echinometridae) as a microhabitat in tropical South America. P. S. Z. N. I. Marine Ecology, 17 (1-3): 181-186. [ Links ]
Tomassi, L. R. 1970. Os ofiuroides recentes do Brasil e de regiöes vizinhas. Contrçöes. Inst. Oceanogr. Univ. S. Paulo, ser. Ocean. Biol., 20: 1-146. [ Links ]
Turon, X., M. Codina, I. Tarjuelo, M. J. Uriz y M. Becerro. 2000. Mass recruitment of Ophiothrix fragilis (Ophiuroidea) on sponges: settlement patterns and post-settlement dynamics. Mar. Ecol. Prog. Ser., 200: 201-212. [ Links ]
Villamizar, E. Y R. A. Laughlin. 1991. Fauna associated with the sponges Aplysina archeri and Aplysina lacunosa in a coral reef of the Archipiélago de Los Roques, National Park, Venezuela: 522-542. En J. Reitner y H. Keupp (Eds.) Fossil and Recent Sponges. [ Links ]
Westinga, E. y P. Hoetjes. 1981. The intrasponge fauna of Spheciospongia vesparia (Porifera, Demospongiae) at Curaçao and Bonaire. Mar. Biol., 62: 139-150. [ Links ]
Zea, S. 1987. Esponjas del Caribe colombiano. Catalogo Científico. Santa Marta. 286 p. [ Links ]
FECHA DE RECEPCIÓN: 01/10/01 FECHA DE ACEPTACIÓN: 01/04/04
DIRECCIÓN DE LOS AUTORES
Instituto de Investigaciones Marinas y Costeras (INVEMAR), AA 1016, Zona Portuaria, Santa Marta, Colombia, E-mail: sbejarano@invemar.org.co (S. B. C), y szea@invemar.org.co (S. Z. S).
Instituto de Investigacion de Recursos Biológicos Alexander Von Humboldt, Carrera 7 #35-20, Bogotá D.C., Colombia, E-mail: jmdiaz@humboldt.org.co (J.M.D.)













