Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.33 no.1 Santa Marta Jan./Dec. 2004
CARACTERIZACIÓN DE PLAYAS DE ANIDACIÓN Y ZONAS DE ALIMENTACIÓN DE TORTUGAS MARINAS EN EL ARCHIPIÉLAGO DE SAN BERNARDO, CARIBE COLOMBIANO
Characterization of nesting beaches and feeding areas of marine turtles at the San Bernardo Archipelago, Colombian Caribbean.
Martha Patricia Rincón-Díaz y Clara Jimena Rodríguez-Zárate
RESUMEN
El archipiélago de San Bernardo ha sido reconocido como un hábitat de anidación esporádica y alimentación de las tortugas verde, carey y caguamo. Teniendo en cuenta estos antecedentes y debido a que el archipiélago presenta áreas coralinas, praderas de pastos marinos y playas arenosas relevantes en el Caribe colombiano, cuya oferta ambiental no ha sido descrita para el recurso tortugas marinas, se realizó este estudio entre julio y octubre de 2002, cuyos objetivos fueron describir las playas de anidación y zonas de alimentación en función de su geomorfología, aspectos bióticos y, para las últimas áreas, algunos oceanográficos. Fueron evaluadas siete playas potenciales de anidación y 20 bajos de alimentación para identificar las amenazas naturales y antrópicas para las tortugas y los hábitats. La carey es la única especie que aún anida en la zona, pero sus áreas de desove se han reducido por la erosión del mar y la construcción existente (blindaje). Los únicos lugares de anidación encontrados fueron el costado sureste de isla Palma y el norte de isla Tintipán. En áreas de alimentación, la mayoría de las estaciones (n=14) presentaron pastos marinos con predominio de fondo blando. A partir de la caracterización de estas áreas se describieron como objeto de alimentación de la carey nueve especies de esponjas y tres de algas. Con el objeto de documentar los componentes de la dieta de las tortugas en el archipiélago, cinco contenidos estomacales de carey y seis de verde fueron analizados. Los ítems más abundantes para la carey fueron las esponjas Eicionemia sp. y Geodia sp. (96% en peso seco) y en la tortuga verde los pastos Thalassia testudinum y Syringodium filiforme (98% en peso seco), observados comúnmente en campo. En áreas de forrajeo la captura directa de tortugas juveniles y adultas fue la amenaza principal, por lo que se deben dirigir esfuerzos para reducir el número de individuos capturados, determinar el grado de intervención y las posibles soluciones.
PALABRAS CLAVE: Archipiélago de San Bernardo, Tortugas marinas, Áreas de alimentación, Playas de anidación.
ABSTRACT
The San Bernardo Archipelago, in the Colombian Caribbean zone, is well recognized for being a sporadic nesting and feeding area for the green, hawksbill and loggerhead turtles. Due to the fact that the San Bernardo Archipelago has outstanding coral areas, marine grasses and sandy beaches and their environmental offers for the marine turtles have not been described yet, it was opportune to carry out this study between July and October of 2002. Thus, this research tends to fill this gap by describing the nesting beaches and feeding areas according to their geomorphologic and biotic aspects and, for the later areas, some oceanographic aspects too. Seven potential nesting beaches and 20 stations on feeding areas were evaluated to identify natural and anthropogenic threats that could affect sea turtles and their habitats. The only species that still nests on these islands is the hawksbill turtle, but its nesting areas are being reduced because of erosion and constructions on the beach. The remaining nesting places observed during the 2002 season were on the southeastern side of Palma island and on the northern side of Tintipán island. In the feeding areas, the majority of stations (n=14) have marine grass with predominance of soft bottom. From these characterizations in the feeding areas, nine sponges and two seaweeds species were described as index species hawksbill turtles feed on. In order to gather information about the marine turtles diet components, five stomach contents of hawskbill turtle and six of green turtle were analyzed. They showed that the sponges Eicionemia sp. and Geodia sp. are the principal diet components (96% dry weight) in the hawksbill turtle diet. In the case of the green turtle, Thalassia testudinum and Syringodium filiforme grasses were identified as index species (98% dry weight); they were the most common during the field observations. The principal threat for sea turtles was the direct capture of adults and juveniles in feeding areas, for what efforts should be directed to reduce the number of poached individuals, to determine the intervention degree and the possible solutions.
KEY WORDS: San Bernardo archipelago, Sea turtles, Feeding grounds, Nesting beaches.
INTRODUCCIÓN
Las poblaciones de tortugas marinas han sido diezmadas por una combinación de factores dentro de los cuales se incluyen la pesca comercial y artesanal, la captura incidental y la degradación y pérdida de los hábitats de alimentación y anidación (Boulon, 2000; Gibson y Smith, 2000; Marcovaldi y Thomé, 2000; Mortimer, 2000; Oravetz, 2000; Witherington, 2000). En el Caribe colombiano están presentes las tortugas caguamo (Caretta caretta), verde (Chelonia mydas), golfina (Lepidochelys olivacea), carey (Eretmochelys imbricata) y canal (Dermochelys coriacea) (Rueda, 2001; Castaño-Mora, 2002). Las tres primeras especies se encuentran catalogadas en peligro y las dos últimas en peligro crítico según la Unión Mundial para la Naturaleza (UICN, 1994). A nivel nacional las tortugas marinas se encuentran señaladas en el libro rojo de reptiles de Colombia bajo diferentes categorías, en peligro crítico están la tortuga carey, caguamo y canal, y como especies en peligro la tortuga verde y golfina (Castaño-Mora, 2002).
En Colombia los estudios en tortugas marinas se han desarrollado especialmente en la costa Caribe, enfocándose en la conservación de playas de anidación. Sin embargo, el conocimiento sobre el estado de conservación de estas especies, su dinámica poblacional, historia de vida y amenazas es mínimo, sin mencionar la carencia de estudios en áreas de alimentación que resultan más costosos. Los trabajos en playas de anidación en el Atlántico colombiano han sido realizados en los departamentos de Magdalena y La Guajira (Medem, 1962, 1965; Kaufmann, 1973, 1975a, 1975b; Tufts, 1973; Pinzón y Saldaña, 1998; Rincón et al., 2001; Arcos et al., 2002), en el Golfo de Urabá por el INDERENA, la Fundación Costas y la Universidad Jorge Tadeo Lozano, y de 1986 a 1992 y en los últimos años la Fundación Darién con la colaboración de CODECHOCÓ y las universidades de Antioquia y Tecnológica del Chocó (Rueda, 2001). En el archipiélago de San Andrés y Providencia por Córdoba y López (1997) y McCormick (1997, 1998), quién además trabajó en áreas de forrajeo de tortuga verde y carey.
En el archipiélago del Rosario se conocen los trabajos del Centro de Investigación, Educación y Recreación (CEINER) desde 1992, basados en la protección de nidadas in situ, y la Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales (UAESPNN) que apoya esta labor desde 1997. En el área de estudio, el archipiélago de San Bernardo, En el área de estudio, el archipiélago de San Bernardo, sólo son conocidos los registros de Carr et al. (1982) y Ogren (1983), quienes citan anidaciones esporádicas de la tortuga carey. Rueda (1987) señala a isla Palma como sitio de anidación de tortuga carey y los bajos de pesca Blanco y Nuevo como áreas típicas de pastoreo de las tortuga verde, carey y caguamo.
La disponibilidad relativa de hábitats está definida por la presencia y abundancia de los recursos asociados a los lugares preferidos y a la proporción de cada uno de estos (Guseman y Ehrhart, 1990). Para el caso de las tortugas marinas, los arrecifes coralinos, pastos marinos y playas arenosas existentes en el archipiélago de San Bernardo, constituyen una oferta de alimentación y anidación, que no ha sido estudiada en detalle. El objetivo principal de este estudio fue la caracterización de las playas de anidación y áreas de alimentación para las tortugas marinas, así como la confirmación de las especies presentes en la zona, actividades que desarrollan, factores de riesgo y aprovechamiento por parte de la población humana. Adicionalmente se realizaron análisis de contenidos estomacales de tortugas verde y carey capturadas por la comunidad, con el fin de identificar las especies índice de alimentación. La información generada también permitió la identificación de acciones de conservación a implementar en esta área protegida del Parque Nacional Natural los Corales del Rosario y de San Bernardo (PNNCRSB), contribuyendo a los esfuerzos nacionales de conservación de especies amenazadas.
ÁREA DE ESTUDIO
El archipiélago de San Bernardo está ubicado en la región central de la costa continental del Caribe colombiano (Figura 1). Administrativamente estas islas hacen parte del departamento de Bolívar y dependen del Distrito de Cartagena de Indias. Actualmente el archipiélago cuenta con un área emergida de 4.2 km2 aproximadamente, conformado por nueve islas de origen coralino (Boquerón, Cabruna, Palma, Ceycén, Panda, Múcura, Mangle, Maravilla y Tintipán) y un islote artificial llamado Santa Cruz (Díaz et al., 2000). El archipiélago hace parte del PNNCRSB creado por la Resolución 1425, diciembre de 1996, del Ministerio del Medio Ambiente. La infraestructura y el personal administrativo del parque tienen sede en el municipio de Tolú y realizan visitas con alguna frecuencia al archipiélago de San Bernardo.

El área de estudio presenta 213.3 km2 de áreas coralinas correspondientes a la octava parte del total de las áreas coralinas colombianas y 134.5 km2 de fondos con cobertura coralina viva relevante equivalentes al 12% de estos en el país. Estas cifras sitúan a San Bernardo en el segundo lugar de importancia en áreas coralinas después del archipiélago de San Andrés y Providencia (Díaz et al., 2000). De los 250 km2 del área ocupada por los arrecifes, bajos coralinos, islas y planicies sedimentarias del complejo, aproximadamente un 60% corresponde a formaciones arrecifales con alguna cobertura de coral vivo, el 30% a fondos arenosos con cobertura de pastos marinos y el 10% restante ocupado por islas y depresiones kársticas (López-Victoria y Díaz, 2000).
Los pastos marinos en el archipiélago tienen un área de 24.4 km2 que equivale al 5.56% del Caribe colombiano (Invemar, 2002b). La plataforma somera que rodea las islas, que conforma extensos bajos, está dominada por praderas de pastos, principalmente Thalassia testudinum y Syringodium filiforme, alternadas con parches coralinos y corales masivos dispersos.
MATERIALES Y MÉTODOS
Información anecdótica
Inicialmente se hizo una recopilación de información a través de 50 entrevistas abiertas (Tambiah, 2000) a hombres (92%) y mujeres (8%) residentes en isla Múcura (70%), el islote de Santa Cruz (10%), Tolú (8%), isla Boquerón (4%), Mangle (2%), Ceycén (2%), Tintipán (2%) y el Canal del Dique (2%), quienes se desempeñan como pescadores, tenderos y amas de casa. Las entrevistas se realizaron con el fin de obtener información acerca de las especies de tortugas marinas en las playas de anidación y zonas de alimentación del archipiélago, sexo, tallas, época del año en que se observan, métodos de captura y utilización. Los datos fueron consignados en ausencia del entrevistado en formatos previamente diseñados para facilitar la recolección sistemática de información sin perturbación del canal de comunicación entre el investigador y el entrevistado (Pritchard et al., 1983; Tambiah, 2000). Los resultados de las entrevistas fueron tabulados y a partir a la información recolectada se seleccionaron las playas y zonas de alimentación de tortugas que fueron visitadas entre julio y octubre de 2002.
Caracterización de playas de anidación
Siete playas potenciales para la anidación fueron geoposicionadas con un GPS Magellan 310 de 15 m de error y se caracterizaron aspectos morfológicos y bióticos (Figura 2). El área de la playa se estimó midiendo el largo y ancho promedio cada 30 m a lo largo de ésta, desde la línea de marea alta hasta el comienzo de la vegetación arbórea, donde no es factible la anidación, empleando un decámetro de 1 mm de precisión. Otra variable fue la inclinación medida con un inclinómetro de 1 grado de precisión y categorizada bajo los rangos de pendiente establecidos por Díaz et al. (2000). Una muestra de arena fue extraída de la zona media de la playa mediante un corazonador de PVC a 30 cm de profundidad y se almacenó en bolsas plásticas selladas y rotuladas para su análisis en laboratorio donde fueron secadas en un horno durante 12 horas a 60ºC, hasta obtener un peso constante. Luego se desecaron durante seis horas empleando una campana de desecación para evitar su rehidratación. Cien gramos de sedimento fueron tamizados en una columna con tamices de 4 mm a 0.063 mm para determinar el tamaño del grano del sedimento y con este último identificar el tipo de grano de acuerdo con la escala de Udden-Wentworth (Wentworth, 1922). Frente a cada playa se registró la presencia de obstáculos, lagunas costeras y procesos erosivos que dificultan el acceso a la misma.

La vegetación predominante y la fauna asociada a las playas fueron identificadas a partir de observaciones directas. Adicionalmente se hicieron registros de la actividad de anidación teniendo en cuenta las especies de tortugas, número de huellas y nidos.
Las playas fueron clasificadas como tipo índice y tipo uno, según su densidad de anidación (número de nidos por km2). Las playas tipo índice son aquellas donde se presenta el mayor número de nidos por km2 y allí deben concentrarse los esfuerzos de conservación. Las tipo uno son aquellas que presentan una densidad de anidación menor a las tipo índice y debe hacerse monitoreo en próximas temporadas para establecer si la densidad alcanzada en esta temporada se mantiene, disminuye o incrementa respecto a las anteriores (Sánchez, 2001). Las actividades humanas directas o indirectas que impactan las playas y tortugas fueron identificadas y valoradas mediante una escala discreta de cero a tres grados de amenaza (ninguno, bajo, medio y alto) adaptada de Schroeder (1999), Witherington (2000), Witherington y Martin (2000) e Invemar (2002a). Cada playa obtuvo un valor general de grado de amenaza por la sumatoria de los valores asignados a los riesgos que se identificaron en ella, y el grado de amenaza general para las áreas de anidación del archipiélago fue estimado dividiendo el valor general más alto de las playas en tres para obtener los ámbitos de los grados de intervención propuestos.
Avistamientos de tortugas marinas y caracterización de áreas de alimentación
Un total de 20 lugares frecuentes de captura y avistamiento de tortugas marinas en actividad de forraje fueron seleccionados como estaciones de muestreo en las áreas de alimentación; ésta elección se hizo a partir de la información suministrada por los pescadores locales durante las entrevistas. Las estaciones fueron geoposicionadas y caracterizadas mediante cinco muestreos obteniendo un total de 100 transectos (Figura 3). Cada transecto abarcó un recorrido de 300 m de longitud y 4 m de ancho (1200 m2) sin importar la profundidad, con equipo de buceo libre siguiendo la técnica de transectos lineales para el avistamiento de tortugas marinas (Diez y Ottenwalder, 2000; Gerrodette, 2000). Las especies se identificaron siguiendo los criterios de Pritchard y Mortimer (2000) teniendo en cuenta la forma y coloración del caparazón, la forma del pico y, cuando fue posible la captura manual, el número de escudos costales y vertebrales. Al capturar las tortugas se midió el largo curvo del caparazón nucal-supracaudal (LCCn-s) y el ancho curvo del caparazón (ACC) con una cinta métrica flexible. LCCn-s se tomó desde el punto medio anterior del escudo nucal al extremo posterior de los escudos supracaudales, y ACC en el punto más amplio del caparazón (Bolten, 2000). La identificación del sexo en los individuos se determinó por la característica secundaria sexual más obvia en adultos y juveniles machos cercanos a la madurez sexual, la larga y musculosa cola prensil, que se extiende fuera del caparazón, y en hembras la cola, corta y poco extendida, más allá de los escudos marginales (Wibbels, 2000). Se registró la cantidad individuos observados o capturados, el estadio de vida: pequeños juveniles, juveniles, subadultos y adultos (Zug y Glor, 1998; van Dam y Diez, 1999; Laugeux, 1999; Castillo et al., 2001), y la actividad que desarrollaban durante la observación (forrajeo, apareamiento u otros: desplazamiento y reposo). La captura por unidad de esfuerzo (CPUE) fue determinada para cada especie de tortuga marina, sumando el número total de tortugas (vistas y capturadas) y dividiendo este en el total de tiempo empleado (horas) en los muestreos (Diez et al., 2002).

Durante los recorridos se realizó la caracterización de las estaciones registrando las especies de flora y fauna presentes. Aquellas especies no identificadas en campo fueron colectadas y preservadas en formalina al 10% con agua de mar para ser analizadas en laboratorio con el apoyo de guías de identificación (Zea, 1987; Wynne, 1998; Littler y Littler, 2000; Hooper y Van Soest, 2002). La profundidad de la columna de agua fue medida por medio de un cabo metrado con lastre en el punto inicial y final de los transectos, categorizando las profundidades en bajas (0-9 m), medias (10-20 m) y altas (>21 m). Se hicieron observaciones de las estructuras geológicas visibles (formaciones rocosas y hendiduras) y se determinó el tipo de fondo en dos categorías: sustrato duro o blando (Huertas, 2000). Los aspectos geomorfológicos y bióticos de las áreas de alimentación caracterizadas fueron analizados descriptivamente.
Las amenazas naturales y antropogénicas se identificaron en cada estación caracterizada. Para cada riesgo se propusieron cuatro categorías cualitativas de grado de amenaza (ninguna, baja, media y alta) cuyos criterios fueron adaptados de Horrocks (1999) y Gibson y Smith (2000) para hábitats de alimentación. Cada estación obtuvo un valor general de grado de intervención por la sumatoria de los valores asignados a los riesgos que se identificaron en la estación; el grado de amenaza general para las áreas de alimentación del archipiélago fue estimado dividiendo el valor general más alto de las estaciones en tres para obtener los ámbitos de los grados de amenaza propuestos.
Componentes dietarios
Un total de 11 estómagos de tortugas marinas (seis de C. mydas y cinco de E. imbricata) fueron recibidos como donación por parte de los pescadores locales luego de capturar y sacrificar estos animales. Las tallas de los ejemplares de tortuga verde sacrificados (n = 6) se encontraban entre 57.9 a 92.7 cm de LCCn-s y de 52.0 a 87.5 cm de ACC. En el caso de la carey (n = 3) las medidas oscilaron entre 54.2 a 69 cm de LCCn-s y de 44.2 a 59 cm de ACC; los dos individuos restantes no fueron medidos debido a que sólo se tuvo acceso a los tractos digestivos y no a los ejemplares.
Cada tracto fue cortado desde el inicio del esófago hasta la región pilórica en el extremo distal del estómago. El contenido fue preservado en formalina al 10% en envases plásticos de boca ancha rotulados para ser analizados en laboratorio. Se identificaron los ítems alimentarios de cada contenido y se pesaron en una balanza analítica de precisión 0.01 g para obtener el peso húmedo. Luego se llevaron a una estufa por 48 horas a 65°C hasta peso constante o seco (Forbes, 2000). Las especies de flora y fauna encontradas en los sitios de alimentación durante las caracterizaciones, las registradas en información bibliográfica y los resultados del análisis de componentes dietarios se catalogaron como especies índice las cuales son utilizadas como fuente alimenticia directa por las tortugas marinas (Diez y Ottenwalder, 2000).
RESULTADOS
Playas de anidación
La única especie anidante en el archipiélago de San Bernardo es la tortuga carey, cuyos nidos fueron observados durante las caracterizaciones de playas, además esta afirmación concuerda con la información recopilada a través de las entrevistas con los pobladores locales. El tipo de grano predominante de las playas fue la arena media con tamaños de grano de 0.25 a 0.50 mm y el grano fino de 0.125 a 0.250 mm. La pendiente suave se presentó en todas las playas y el ancho promedio de ellas fue de 13.40 m, siendo las de mayor ancho Punta Mate y La Puntica en isla Tintipán (Tabla 1).

Las playas más extensas fueron el costado norte de isla Tintipán (657 m) y el costado sureste de isla Palma (540 m), donde se presentaron seis desoves durante el período de estudio y cuyos huevos fueron extraídos. La composición en vegetación fue similar para todas las playas, destacándose los mangles bobo (Laguncularia racemosa), rojo (Rhizophora mangle) y zaragoza (Conocarpus erectus), así como el uvo de playa (Coccoloba uvifera), la palmera común (Cocos nucifera), gramíneas y algunas rastreras como el musgo de playa (Batis maritima). Entre la fauna observada se encontró el cangrejo de manglar (Aratus pisonii), hormigas, lagartijas, tijeretas (Fregata magnificens), gallinazo común (Coragyps atratus), pelícanos (Pelecanus occidentalis) y el pato buceador (Phalacrocorax brasilianus).
Las amenazas más altas en las playas de anidación fueron la erosión natural, la causada por actividades antrópicas, la extracción de arena para construcciones y la obstaculización por desechos orgánicos (material de deriva) (Tabla 2). Las amenazas de grado moderado fueron el blindaje de playas y la obstaculización de tortugas adultas y neonatos por desechos inorgánicos. Entre las amenazas de menor grado se observó la iluminación artificial y la saturación de playas con arenas trasladadas de otras partes de la isla, de fuentes externas y con materiales como piedras, conchas de caracoles y restos coralinos. Adicionalmente, se observaron actividades de saturación en el costado norte de Tintipán y sureste de isla Palma y una alta amenaza por erosión.
Áreas de alimentación
Las estaciones de muestreo se encontraron ubicadas en su mayoría en cordones de praderas de pastos marinos (n = 14) y algunas en zonas coralinas (n = 6) del archipiélago. Las profundidades registradas variaron entre 1.8 m (estación 18) y 27 m (estación 1), por lo cual fueron caracterizadas once estaciones de profundidades someras, cinco entre someras a medias y cuatro con los tres rangos batimétricos. Los dos tipos de sustratos, blando y duro, se presentaron en 14 estaciones predominando el fondo blando. En términos de estructuras geológicas visibles sólo en nueve estaciones se registraron hendiduras que forman canales a lo largo de algunas elevaciones de coral, en especial de los géneros Porites, Agaricia y Acropora. Los sitios de muestreo restantes no presentaron terrazas coralinas.
Un total de 146 especies de fauna y flora fueron identificadas en la totalidad de las estaciones. Entre ellas el grupo mejor representado fue el de peces óseos con un total de 59 especies, seguido por 30 de corales verdaderos, 18 de esponjas y 17 de macroalgas. Los grupos menos representados fueron los corales falsos con seis especies y equinodermos con cinco, los peces cartilaginosos con cuatro, pastos marinos, poliquetos y moluscos con dos y crustáceos con una especie.
Los corales Acropora cervicornis, A. palmata, Colpophyllia natans, Diploria labyrinthiformis, Montastrea cavernosa, M. annularis, Porites astreoides, P. Porites forma furcata y Siderastrea radians fueron las especies observadas con mayor frecuencia en los parches arrecifales. El alga Dictyota sp. fue observada en todas las estaciones.
La actividad de mayor riesgo encontrada en las zonas de alimentación fue el anclaje de embarcaciones que potencialmente puede degradar las praderas de pastos marinos y corales en las estaciones de los bajos Tiosolda (estación 3), Chara (16) y Maravilla (20) (Tabla 3). Las técnicas dañinas de pesca (dinamita) se considerarán una amenaza de gran intervención que degrada las zonas de alimentación. Sin embargo esta actividad se catalogó con un grado bajo de riesgo, pues sólo se presentó en las estaciones cercanas a las islas Mangle (18) y Maravilla (20), donde fue frecuente. La contaminación por desechos sólidos fue una actividad de bajo riesgo.
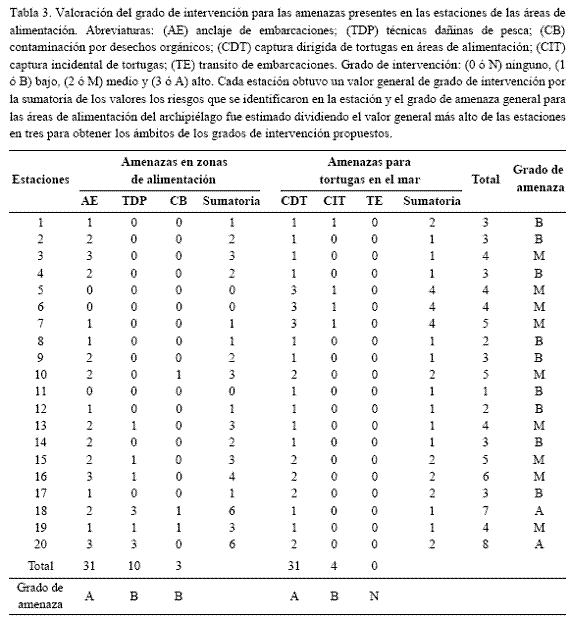
La captura directa se presentó como la actividad de mayor riesgo para las tortugas marinas en el área de estudio, principalmente en el bajo Minalta (estaciones 5, 6 y 7), debido a que más del 30% de las capturas durante el tiempo de muestreo se registraron allí. La captura incidental no se evidenció en la mayoría de estaciones, salvo en los bajos Nubes (estación 2) y Minalta.
Avistamientos de tortugas marinas en el mar
Un total de 46 horas fueron empleadas en los avistamientos de tortugas en las áreas de alimentación durante el periodo de muestreo. Únicamente ocho tortugas verdes fueron registradas en los bajos en actividad de desplazamiento (n = 3) y reposo en superficie y sobre fondos de T. testudinium y S. filiforme (n = 5). Sólo un pequeño juvenil capturado fue medido y presentó 30 cm de LCCn-s y 25 cm de ACC; se observó otro individuo con 80 cm de LCCn-s aproximadamente, posiblemente un subadulto. No fue posible identificar el sexo de los individuos debido a que sus características sexuales no claras. En el caso de la carey, cinco individuos fueron registrados en los avistamientos. Las actividades observadas fueron alimentación de esponjas (n = 3) y reposo sobre fondo coralino y pastos marinos (n = 2). Las medidas corporales de cuatro individuos de tortuga carey capturados oscilaron entre 20.5 a 73.5 cm de LCCn-s y 18 a 60 cm de ACC, dos individuos fueron sexados, uno era macho y el otro hembra; en los dos restantes no fue posible reconocer el sexo. Se encontraron desde pequeños juveniles hasta grandes subadultos y adultos entre las careyes medidas. La mayoría de los avistamientos (n = 9) ocurrieron en el mes de septiembre, seguidos por el mes de octubre (n = 3). La CPUE para la tortuga verde fue 0.17 individuos por hora y en el caso de la tortuga carey fue 0.10 individuos por hora. Ambas especies fueron observadas compartiendo el mismo nicho en tiempo y espacio. Los bajos de alimentación donde se observaron con mayor frecuencia fueron fondos blandos con presencia de pastos marinos y en algunas ocasiones se observaron fondos duros con presencia de P. Porites. Todas las estaciones de avistamiento corresponden a zonas someras del norte del archipiélago.
Componentes dietarios
En los contenidos estomacales de tortuga verde un total de 17 ítems alimentarios fueron encontrados, predominando el pasto T. testudinum (189.3g o 92.9%) seguido por S. filiforme (10.4g o 5.1%). Por otra parte fueron identificadas cuatro especies de algas chlorophytas: Udotea sp., U. luna, Penicillus capitatus y Caulerpa mexicana y tres rhodophytas: Galaxaura sp., Laurencia sp. y Gracilaria sp., además de invertebrados como esponjas, briozoarios y moluscos.
Para la tortuga carey se encontraron 15 ítems en su mayoría compuestos por esponjas, principalmente Eicionemia sp. (94.6g o 76.09%) y Geodia sp. (24.4g o 19.61%), seguidas por Melophus sp. y Agelas dispar. Sólo en un individuo de 58 cm de LCCn-s se hallaron en menor proporción otros ítems, como restos de cnidarios, bivalvos, decápodos, pasto T. testudinum, restos vegetales y algas rhodophytas (Lobophora variegata, Dictyota mestrualis) y una Phaeophyta (Hydropuntia sp.).
Aprovechamiento
Los métodos de extracción más empleados para tortuga carey fueron la captura manual, el arpón y el trasmallo de pesca, en el cual son capturadas indirectamente individuos de ésta especie; de tortuga verde fueron el arpón, la red tortuguera y la captura manual. La red tortuguera es un método utilizado desde finales del siglo XIX por pescadores del área para la captura directa de tortugas marinas; ésta red es hecha artesanalmente con nylon y tiene aproximadamente 10 m de largo y 7 m de alto con un ojo de malla de 20 x 20 cm. Los sitios de mayor captura de tortugas fueron los bajos Minalta, Nubes, Picuas, Tiosolda, Chara, Maravilla, Blanco, Piedras y zonas aledañas a isla Boquerón.
Se registró la captura de 11 tortugas verde (cinco hembras y seis machos) y 11 tortugas carey (tres hembras, dos machos y seis individuos en los cuales no fue posible reconocer el sexo). El número total de capturas aumentó gradualmente durante el período de observación, registrando al mes de octubre como el de mayor actividad (n = 10). Los ámbitos de tallas encontradas en las tortugas verde medidas (n = 11) fueron 57.9 a 94.0 cm de LCCn-s y 52.0 a 89.5 cm de ACC, correspondiendo a individuos juveniles, subadultos y adultos. En el caso de la tortuga carey (n = 7), las tallas estuvieron entre 23.2 a 73.5 cm de LCCn-s y 21 a 60 cm de ACC, encontrando desde pequeños juveniles hasta subadultos y adultos; este último un macho.
El comercio de productos y subproductos derivados de la carne, intestinos, hígado, corazón y pulmones de tortuga carey y verde se da en un nivel local dentro del archipiélago y regional abarcando los mercados de Sucre y Bolívar. La carne es mezclada con las vísceras y se vende a un costo de Col $4000 o US $ 1.50 la libra de tortuga verde y cuando es de carey su costo es más bajo (col $1500 o US $ 0.50). Su comercio obedece principalmente a creencias populares, como la cura de problemas de vías respiratorias utilizando al aceite de tortuga y el aumento de la potencia sexual de la población humana masculina mediante el consumo del pene y los huevos; además de tradiciones gastronómicas durante las festividades de semana santa. El caparazón del carey no es muy comercializado, pero sus escamas son ocasionalmente vendidas a artesanos de Cartagena por col $100000 o US $ 37, quienes la procesan para obtener artículos de venta.
DISCUSIÓN
Las especies de tortugas marinas observadas en el archipiélago de San Bernardo fueron carey y verde, sin embargo se conoce la presencia de la tortuga caguamo y el llamado cabezote, que posiblemente corresponda a individuos de la especie Lepidochelys olivacea, como lo señala Rueda (1987, 2001). De ellas, la carey es la única especie que desova en el archipiélago, probablemente porque en él se encuentran playas angostas con barreras de arrecifes bloqueando la vía de acceso desde el mar, que son de su preferencia (Pritchard y Mortimer, 2000).
Las playas de anidación de tortuga carey correspondieron a aquellas con mayor área disponible para el desove, lo cual depende de factores como obstáculos encontrados sobre éstas y la erosión, que probablemente dificultan el acceso de las hembras. Debido a la disminución de áreas de anidación, se considera que el archipiélago posee poca oferta de playas arenosas para la carey. El costado sureste de isla Palma puede ser considerado como una playa índice por su mayor número de anidaciones donde se deben concentrar los esfuerzos de conservación. El costado norte de isla Tintipán se consideró playa tipo uno, donde es necesario realizar monitoreos en próximas temporadas de anidación. De igual forma se recomienda llevar acabo monitoreos en las demás playas del archipiélago para determinar la ocurrencia de desoves en otras temporadas.
El proceso de anidación de una especie en peligro critico como la tortuga carey, convierte al archipiélago de San Bernardo en un área prioritaria a conservar, aunque sólo seis nidos fueron registrados durante la temporada del 2002. Esta abundancia de 3 nidos/km/año es baja para el Caribe colombiano, si se compara con el archipiélago de San Andrés y Providencia, catalogado por Rueda (2001) como el área de mayor anidación de carey en Colombia. La anidación en los cayos Roncador, Serrana, Serranilla y Albuquerque de San Andrés y Providencia es de 5 nidos de carey/km/año determinada a partir de 18 nidos encontrados por McCormick (1998) en 3.32 km de extensión de estos cayos (McCormick, 1997). El total de huevos para la temporada del 2002 fue extraído para consumo de la comunidad local, lo cual agrava aún más el estado de conservación de las tortugas carey que pueden anidar en el archipiélago, debido a que se disminuye o anula la reproducción y por tanto la producción de huevos.
La mayoría de tortugas capturadas en el archipiélago corresponden a individuos inmaduros de carey extraídos mediante la técnica de captura manual, posiblemente por su comportamiento sedentario (Witzell, 1983) que la hace vulnerable cuando busca refugio o alimento en los arrecifes coralinos donde normalmente habitan especies comerciales como langostas, caracoles y cangrejos que tienen alta demanda entre los pescadores del área. La pesca artesanal en las islas es realizada por personas de bajos recursos y con necesidades básicas insatisfechas. Su actividad productiva, la pesca, tiene un incipiente nivel tecnológico y una escasa diversificación de artes y métodos que ocasiona un alto grado de uso de los caladeros, conllevando al agotamiento del recurso pesquero (Barreto et al., 1999). Esta situación es el problema central que se debe abordar en el archipiélago para disminuir o evitar el consumo de tortugas, aunque la captura de ellas por parte de pescadores locales fue ocasional, con un promedio de cinco tortugas por mes durante el muestreo. De acuerdo con los pescadores del área el dinero recibido por la venta de una tortuga capturada en cuatro horas promedio (Col $120000 o US $40) es cuatro veces el que se obtendría después de ocho horas de trabajo de pesca común (Col $30000 o US $10). Por esta razón, es necesario un mayor acercamiento de las autoridades ambientales a la comunidad local para identificar sus necesidades, la problemática ambiental existente y elaborar un plan de trabajo concertado.
La captura de 22 ejemplares de tortugas marinas durante el período de estudio muestra un grado bajo de extracción al compararlo con otras zonas del Caribe colombiano; por ejemplo, con la Guajira donde se capturaron 531 tortugas entre mayo y agosto de 2002 (Instituto Humboldt-Corpoguajira, 2003) y el archipiélago de San Andrés con un estimativo mayor a 1000 tortugas al año (Córdoba y López, 1997). Dado que los pobladores indican que la pesca incidental de tortuga con trasmallo existe, un estudio sobre la captura incidental y dirigida y la aplicación de medidas de control y metodologías nuevas que disminuyan esta extracción son necesarias. El valor de CPUE encontrado para la tortuga carey (0.10 individuos/h) en áreas de alimentación es bajo comparado con otras áreas del Caribe, como el suroeste de República Dominicana e Isla Mona, Puerto Rico, con promedios de CPUE igual a 3.43 y 4.7 careyes por hora respectivamente (León y Diez, 1999; Diez y van Dam, 2001). Sin embargo, no está distante de 0.14 careyes por hora que es la CPUE en el archipiélago Kuna Yala o San Blas, en la parte este de la costa Caribe panameña, donde las careyes no son encontradas en abundancia debido a la sobreexplotación de la especie que ha contribuido en un aparente bajo nivel de reclutamiento de juveniles en el área (Diez et al., 2002). Aunque no existen datos exactos de extracción de tortugas marinas en San Bernardo, es posible que una de las causas para estos valores bajos de CPUE encontrados actualmente se deban a la explotación de tortugas desde la fundación de Santa Cruz del Islote, a principios del siglo XIX, de acuerdo a la información suministrada por pescadores de la zona.
Los lugares de avistamiento y captura de tortuga carey al norte de San Bernardo coinciden con una de las áreas de mayor desarrollo coralino del archipiélago (López-Victoria, 1999), proporcionándole una buena oferta de alimentación y refugio. La acentuada abundancia de algas frondosas, octocorales y esponjas en la comunidad arrecifal de San Bernardo (López-Victoria y Díaz, 2000), hace que las estaciones muestreadas presenten las características típicas de un área de forrajeo para la especie. Según Witzell (1983) y Diez y Ottenwalder (2000) estas áreas poseen una gran diversidad de esponjas, invertebrados y corales, además de especies como los peces esponjívoros de los géneros Pomacanthus y Holocanthus, que frecuentemente están asociados con la presencia de la carey, y que fueron observadas en campo. Aunque la extensión de pastos es pequeña y menor a la de áreas coralinas (López-Victoria, 1999), éstos ofrecen un hábitat de alimentación adecuado a las tortugas verdes, donde sus principales componentes dietarios están presentes y cuyo estado de deterioro de acuerdo al grado de intervención antrópica establecido por Castillo (2002) es bajo. Además, la observación de individuos de carey con largos de caparazón inferiores a las tallas de adultos registrados en Isla Mona y Monito, Puerto Rico (>60 cm) y Doce Leguas, Cuba (promedio 83.5 cm) (van Dam y Diez, 1999; Castillo et al., 2001), y la observación de ejemplares de tortuga verde con largos de caparazón inferiores a 95 o 120 cm registrado para adultos (Lagueux, 1999), y alrededor de 60 a 75 cm que son las tallas en las cuales individuos de ésta especie parten hacia las áreas de alimentación de subadultos-adultos en el Caribe (Zug y Glor, 1998), indica que el archipiélago también es utilizado como zona de crecimiento hasta que los individuos alcanzan la edad reproductiva. Por lo anterior, se deben enfocar esfuerzos de protección hacia estas zonas, como la aplicación de medidas de control sobre actividades dañinas que deterioran paulatinamente los hábitats de alimentación de tortugas y disminuyen su capacidad de carga como el anclaje de embarcaciones, pesca con dinamita y vertimiento de desechos sólidos en algunos sectores.
Teniendo en cuenta los resultados obtenidos en los contenidos estomacales para tortuga carey, la mayoría de su dieta estuvo compuesta por esponjas (95.7%), de las cuales las especies Eicionemia sp. y Geodia sp. predominaron, considerándolas especies índice de alimentación para esta tortuga. Estas dos especies fueron catalogadas como la tercera y séptima esponja más consumida por la carey en la región del Gran Caribe (Meylan, 1984). Aunque esas esponjas no han sido registradas en el área, ni fueron observadas en campo, el buen estado de conservación de estos ítems en la región esofágica y estomacal de los individuos sugiere que habían sido ingeridos recientemente, probablemente en el archipiélago de San Bernardo. Comparando las especies observadas en campo, las registradas en el área (Zea, 1987) y las especies de consumo para la tortuga carey en otros lugares de alimentación (van Dam y Diez, 1997; Bjorndal, 1997), las esponjas Iotrochota birotulata y Ectoplasia ferox también son oferta alimenticia para esta especie (van Dam y Diez, 1997). El mismo caso sucede con Amphimedon caycedoi, A. erina, Cinachyrella sp., Erylus formosus, Placospongia metobesiodes, Suberites aurantiaca y Tethya sp., cuyos géneros han sido registrados en los análisis de dietas de carey en el Caribe (Bjorndal, 1997). El alga Halimeda incrassata, observada en campo, es registrada por Meylan (1984) en hembras grávidas, que la ingieren como fuente de calcio para la producción de la cáscara en los huevos. Las algas Stypopodium zonale y Dictyota sp., encontradas en el área, son registradas en la dieta de juveniles de las islas Salvage en el Atlántico (Hargtong, 1980).
En el caso de la tortuga verde, las especies índice son los pastos T. testudinum y S. filiforme, por su alto porcentaje en peso seco encontrado en los contenidos estomacales examinados; reafirmando a T. testudinum como el principal componente alimentario de esta tortuga en el Caribe (Thayer et al., 1982). Dada la oferta de pastos en el archipiélago, el aprovechamiento de estos por parte de las tortugas verdes y la existencia de registros de avistamientos de tortugas marcadas en otros países, San Bernardo puede ser una zona importante de alimentación para diferentes poblaciones de tortuga verde en el Caribe. Tales son los casos de nueve hembras marcadas en Tortuguero (Costa Rica) y recapturadas en los alrededores de isla Maravilla, el islote de Santa Cruz, los bajos Sotavento y Salamanquilla entre 1968 y 1991 (Troëng com. pers. 2003) y otra capturada en un bajo de pesca del archipiélago marcada previamente en Zapatillas, Bocas del Toro (Panamá) (Meylan com. pers. 2003).
Para concluir, el archipiélago de San Bernardo es un área importante de alimentación cuya protección debe hacerse para la conservación de las especies de tortugas marinas presentes, acompañado de una profundización en el conocimiento biológico de la población o poblaciones existentes. Estos procesos se deberían facilitan debido a que la conservación de tortugas marinas es prioritaria a nivel nacional e internacional y es obligación en áreas protegidas como el PNNCRSB.
AGRADECIMIENTOS
A los habitantes del archipiélago de San Bernardo, al Instituto de Investigaciones Marinas y Costeras INVEMAR y el proyecto “Tortugas marinas del Caribe colombiano”. A Juan Manuel Díaz, Claudia Ceballos, Carlos Diez, Jeffrey Seminoff, Aminta Jáuregui y Adolfo San Juan por sus aportes en la metodología y discusión. A Sven Zea y Fernando Parra por su ayuda en la identificación de esponjas. A Anne Meylan, Sebastián Troëng, Joaquín Buitrago y Vicente Vera por compartir información de sus programas de monitoreo de tortugas marinas. A la UAESPNN sede Cartagena y Clara Sierra por permitirnos el trabajo en el archipiélago de San Bernardo. Finalmente a nuestras familias y amigos.
BIBLIOGRAFÍA
Arcos, M., A. Barrero, G. Guarín y P. Quintero. 2002. Establecimiento y comparaciones de características estructurales de puntos focales de anidación de tortugas marinas ya establecidos en el sector de Arrecifes Parque Nacional Natural Tayrona, Caribe colombiano. Seminario de investigación. Universidad Jorge Tadeo Lozano. Santa Marta. 54 p. [ Links ]
Barreto, M., R. Barrera., J. Benavides, E. Cardozo, H. Hernández, L. Marín, B. Posada, C. Salvatierra, P. Sierra y A. Villa. 1999. Diagnóstico ambiental del Golfo de Morrosquillo (Punta Rada - Tolú). Una aplicación de sensores remotos y SIG como contribución al manejo integrado de zonas costeras. MMA, Invemar, Ingeominas, CIOH, IGAC, Pontificia Universidad Javeriana, Universidad EAFIT, NUFFIC y ITC. Bogotá. 190 p. [ Links ]
Bjorndal, K. 1997. Foraging ecology and nutrition of sea turtles: 199-231. En: P. Lutz y J. Musick. (Eds.). The biology of sea turtles. Boca Ratón y New York. 448 p. [ Links ]
Bolten, A.B. 2000. Técnicas para la medición de tortugas marinas: 126-131. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278 p. [ Links ]
Boulon, R. 2000. Reducción de las amenazas a los huevos y a las crías: protección in situ: 192-198. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278 p. [ Links ]
Carr A., K. Bjorndal, T. Carr, J. Mortimer y A. Meylan. 1982. Surveys of the sea turtle population and habitats in the western Atlantic. NOAA. Tech. Memor., NMFS-SEFC-91. Ciudad de Panamá, Panamá. 91 p. [ Links ]
Castaño-Mora, O.V. 2002. Libro rojo de reptiles de Colombia. Libros rojos de especies amenazadas de Colombia. Instituto de Ciencias Naturales–Universidad Nacional de Colombia, Ministerio del Medio Ambiente, Conservación Internacional–Colombia. Bogota. 160 p. [ Links ]
Castillo D., M. De Arazoza, M. De León, R. Díaz-Fernández, G. Espinosa, R. Gómez, M. Hernández, C. Manolis, F. Moncada, E. Morales, G. Nordase, E. Peregrin, A. Prieto, R. Puga, D. Salabarria y G. Webb. 2001. Aspectos biológicos y ecológicos relacionados con la población de tortuga carey en aguas cubanas. Informe de la República de Cuba. Primera reunión de diálogo CITES sobre la tortuga carey del Gran Caribe, Ciudad de México: mayo 2001. 42 p. [ Links ]
Castillo, P.A. 2002. Caracterización estructural y evaluación del estado ambiental de las praderas de pastos marinos del Caribe colombiano. Tesis de Biólogo Marino. Universidad Jorge Tadeo Lozano. Facultad de Biología Marina. Santa Marta. 65 p. [ Links ]
Córdoba, A. y C. López. 1997. Diagnóstico actual de las poblaciones de tortugas marinas, en el archipiélago de San Andrés, Providencia y Santa Catalina. Tesis de Biólogo Marino y Biólogo. Facultad de Biología Marina, Universidad Jorge Tadeo Lozano. Facultad de Ciencias, Universidad del Valle. 207 p. [ Links ]
Díaz, J.M., L.M. Barrios, M.H. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G.H. Ospina, F. Parra-Velandia, J. Pinzón, F. Vargas-Ángel y S. Zea. 2000. Áreas coralinas de Colombia. Invemar, Serie publicaciones especiales No 5. Santa Marta. 176 p. [ Links ]
Diez, C. y J. Ottenwalder. 2000. Estudios de hábitat: 45-49. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Diez, C. y R. van Dam. 2001. Mona and Monito island hawksbill research project: Report for 2000. Technical Report to U.S. National Marine Fisheries Service and Puerto Rico Department of Natural Resources. San Juan, Puerto Rico. 21 p. [ Links ]
Diez, C., R. van Dam y G. Archibold. 2002. In-water survey of Hawksbill turtles at Kuna Yala, Panamá. MTN. 96:11-13. [ Links ]
Forbes, G.A. 2000. Muestreo y análisis de los componentes de la dieta: 187-191. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Gerrodette, T. 2000. Estimating abundance with transect: 10-15. En: K.A. Bjorndal y A.B. Bolten (Eds.). Proceedings of a workshop on assessing abundance and trends for in-water sea turtle populations. U.S. Department of Commerce. National Oceanic and Atmospheric Administration. National Marine Fisheries Service. Southeast Fisheries Science Center Miami, Florida. NOAA Tech. Memor. NMFS-SEFSC- 445. 83 p. [ Links ]
Gibson, J. y G. Smith. 2000. Reducción de las amenazas a los hábitats de alimentación: 211-216. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Guseman, L. y L. Ehrhart. 1990. Green turtles of sabellariid worm reefs: initial results for the studies of the Florida Atlantic Coast. En: Richardson T.H., J.I. Richardson y M. Donnelly (Comp.). Proc. 10th Ann. Work. Sea Turtle Biol. Conserv. NOAA Tech. Memor. NMFS-SEFSC-278. 125-128. [ Links ]
Hargtong, J. 1980. Notes on the food of sea turtles: Eretmochelys imbricata (Linnaeus) and Dermochelys coriacea (Linnaeus). Netherlands. J. Zool., 30(4):595-610. [ Links ]
Hooper, J.A. y R.W.M. Van Soest. 2002. Systema Porifera. A guide to the classification of sponges. Vol. 1 y 2. Kluwer Academic / Plenum Publishers. Nueva York. 1101 p. [ Links ]
Horrocks, J. 1999. Mitigación de las amenazas en sitios de alimentación: 132-138. En: Declaración de Santo Domingo. Conservación de tortugas marinas en la Región del Gran Caribe – Un diálogo para el manejo regional efectivo. Resolución de la reunión. Santo Domingo, República Dominicana. 170p. [ Links ]
Huertas, J. 2000. Caracterización estructural, composición y estado de salud de las formaciones coralinas de Isla Fuerte, Bajo Burbujas y Bajo Bushnell, Caribe colombiano. Trabajo de grado. Universidad de Antioquia. Departamento de Biología. Medellín. 96 p. [ Links ]
Instituto Humboldt-Corpoguajira. 2003. Generación de alternativas productivas para el uso sostenible de la fauna silvestre como estrategia para disminuir el tráfico ilegal del recurso faunístico. Sistema de aprovechamiento sostenible de tortugas marinas en el departamento de La Guajira. Bogotá. 96 p. [ Links ]
Invemar. 2002a. Determinación de la distribución y del estado de conservación de las tortugas marinas en el Caribe colombiano. Informe final. Santa Marta. 138 p. [ Links ]
________. 2002b. Distribución, estructura y clasificación de las praderas de pastos marinos en el Caribe colombiano. Proyecto INVEMAR-COLCIENCIAS. Programa de Biodiversidad y Ecosistemas Marinos. Informe final. Santa Marta. 16 p. [ Links ]
Kaufmann, R. 1973. Biología de tortugas marinas de la costa Atlántica colombiana, Caretta caretta caretta y Dermochelys coriacea. Rev. Acad. Col. Cienc., 14 (54):67-80. [ Links ]
________.1975a. Observaciones sobre el crecimiento de tortugas marinas en cautividad. Caldasia, 11(53):139-150. [ Links ]
________.1975b. Studies on the loggerhead sea turtle, Caretta caretta caretta (Linné) in Colombia, South America. Herpetol., 31(3):323-326. [ Links ]
Lagueux, C. 1999. Estado de conservación y distribución de la tortuga verde, Chelonia mydas, en la Región del Gran Caribe: 34-37. En: Declaración de Santo Domingo. Conservación de tortugas marinas en la Región del Gran Caribe – Un diálogo para el manejo regional efectivo. Resolución de la reunión. Santo Domingo, República Dominicana. 170p. [ Links ]
León, Y. y C. Diez. 1999. Population structure of hawksbill turtles on a foraging ground in the Dominican Republic. Chelonian Cons. Biol., 3(2):230-236. [ Links ]
Littler, D.S. y M.M. Littler. 2000. Caribbean reef plants: an identification guide to the reef plants of the Caribbean, Bahamas, Florida and Gulf of Mexico. Offshore Graphics Inc. Washington D.C. 542 p. [ Links ]
López-Victoria, M. 1999. Estado actual de las áreas coralinas del archipiélago de San Bernardo: distribución, estructura, composición y estado de salud con notas sobre su origen y desarrollo geológico. Trabajo de Biólogo. Departamento de Biología, Universidad del Valle. Cali. 134p. [ Links ]
López-Victoria, M y J. Díaz. 2000. Morfología y estructura de las formaciones coralinas del archipiélago de San Bernardo, Caribe colombiano. Rev. Acad. Col. Cienc., 24(91):219-230. [ Links ]
Marcovaldi, M. y J. Thomé. 2000. Reducción de las amenazas a las tortugas: 187-191. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
McCormick, A. C. 1997. Porque ellas también tienen derecho a seguir dejando huella. Diagnóstico actual de las tortugas marinas del archipiélago de San Andrés, Providencia y Santa Catalina. Fase II. Corporación para el desarrollo sostenible del archipiélago de San Andrés, Providencia y Santa Catalina, CORALINA. San Andrés, Colombia, 67 p. [ Links ]
________. 1998. Diagnóstico actual de las tortugas marinas del archipiélago de San Andrés, Providencia y Santa Catalina. Corporación para el desarrollo sostenible del archipiélago de San Andrés, Providencia y Santa Catalina, CORALINA. San Andrés, Colombia, 41 p. [ Links ]
Medem, F. 1962. Estudio sobre las tortugas marinas. Informe sobre la comisión real en la costa Atlántica. Informe técnico 1. Corporación Autónoma Regional de los Valles del Magdalena y del Sinú. Bogotá. 12 p. [ Links ]
________. 1965. Informe sobre migración, reproducción y comportamiento de la tortuga marina “gogó” o “caguamo” (Caretta caretta caretta). Informe técnico 2. Corporación Autónoma Regional de los Valles del Magdalena y del Sinú. Bogotá. 12 p. [ Links ]
Meylan, A. 1984. Feeding ecology of the hawksbill turtle (Eretmochelys imbricata): Spongivory as a feeding niche in the coral reef community. Ph.D. Dissertation. University of Florida. Gainesville. 118 p. [ Links ]
________.1999. Status of the hawksbill turtle (Eretmochelys imbricata) in the Caribbean region. Chelonian Cons. Biol., 3(2):177-184. [ Links ]
Mortimer, J. 2000. Reducción de las amenazas a los huevos y a las crías: los viveros: 199-203. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Ogren, L. 1983. The draft national report for the country Colombia. Western Atlantic Turtle Symposium. Western Atlantic Turtle Symposium. WATS-STAO. San José, Costa Rica. 123–130. [ Links ]
Oravetz, C. 2000. Reducción de la captura incidental en pesquerías: 217-222. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Pinzón, C. y P. Saldaña. 1998. Cría de la tortuga marina para el repoblamiento de Buritaca (Magdalena) y Palomino (Guajira). Taller internacional sobre conservación y biología de tortugas marinas en Colombia. Palomino, Colombia. 100 p. [ Links ]
Pritchard, P. y J. Mortimer. 2000. Taxonomía e identificación de especies: 23-41. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Pritchard, P, P. Bacon, F. Berry, A. Carr, J. Fletmeyer, R. Gallagher, S. Hopkins, R. Lankford, R. Márquez, L. Ogren, W. Pringle, H. Reichart y R. Witham. 1983. Manual sobre técnicas de investigación y conservación de las tortugas marinas. K.A. Bjorndal y G.H. Balazs (Eds.). Segunda edición. Center for Environmental Education. Washington, D.C. 134 p. [ Links ]
Rincón, M.P., D.F. Rivera, C.J. Rodríguez y J.P. Tello. 2001. Establecimiento y caracterización estructural de puntos focales de anidación en el sector de Arrecifes, Parque Nacional Natural Tayrona, Caribe colombiano. Seminario de investigación. Universidad Jorge Tadeo Lozano. Santa Marta. 67 p. [ Links ]
Rueda, J.V. 1987. Informe sobre la situación actual de las poblaciones de tortugas marinas en el Caribe colombiano. II Simposio sobre las tortugas marinas del Atlántico Occidental STAO. Mayagüez, Puerto Rico. 28 p. [ Links ]
________. 2001. Programa nacional para la conservación de las tortugas marinas y continentales de Colombia (Propuesta para concertar plan estratégico para la recuperación de las especies Colombianas de fauna silvestre amenazadas y en vías de extinción). Ministerio del Medio Ambiente-Corpoguajira. Dirección General de Ecosistemas. Bogotá. 63 p. [ Links ]
Sánchez, F. 2001. Contribución al conocimiento del estado actual de las tortugas marinas y sus hábitats de anidación en los Parques Nacionales Naturales de la Costa Atlántica. Convenio Asociación Widecast - Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales de Colombia. Parque Nacional Natural Tayrona (sectores Cañaveral, Arrecifes y Naranjos). Popayán, Colombia. 85 p. [ Links ]
Schroeder, B.A. 1999. Mitigación de las amenazas en playas de anidación. 126-131. En: Declaración de Santo Domingo. Resolución de la reunión. Conservación de tortugas marinas en la Región del Gran Caribe – Un diálogo para el manejo regional efectivo. Santo Domingo, República Dominicana. 170p. [ Links ]
Tambiah, C. 2000. Entrevistas y encuestas en mercados: 178-186. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Thayer, G.W., D.W. Engel, y K. Bjorndal. 1982. Evidence for short–circuiting of the detritus cycle of sea grass beds by the green turtle, Chelonia mydas. Mar. Biol. Ecol., 62:73-183. [ Links ]
Tufts, C. 1973. Operación tortuga. Informe técnico (2). Cuerpos de Paz-INDERENA. Bogotá. 40 p. [ Links ]
UICN (Unión Mundial para la Naturaleza). 1994. Estrategia mundial para la conservación de las tortugas marinas. Comisión de supervivencia de especies UICN. Grupo especial de tortugas marinas UICN/SCE. Arlington, Virginia. 24 p. [ Links ]
van Dam, R. y C. Diez. 1997. Predation by hawksbill turtles on sponges at Mona island, Puerto Rico. Proc. 8ht Int. Coral Reef Sym. Panamá, 2:1421-1426. [ Links ]
_______1999. Differential tag retention in Caribbean hawksbill turtles. Chelonian Cons. Biol., 3(2):225-229. [ Links ]
Wentworth, C.K. 1922. A scale of grade and class term for clastic sediments. J. Geol., 30:337-392. [ Links ]
Wibbels, T. 2000. Determinación del sexo de tortugas marinas en hábitats de alimentación: 160-164. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Witherington, B. 2000. Reducción de las amenazas al hábitat de anidación: 204-210. En: K. Eckert; K. Bjorndal; F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (traducción en español). Grupo especialistas en tortugas marinas UICN/SCE. Publicación No 4. Pennsylvania, Estados Unidos. 278p. [ Links ]
Witherington, B y E.R. Martin. 2000. Understanding, assessing and resolving light-pollution problems on sea turtle nesting beaches. Second edition. Florida Fish Wild. Cons. Com. FMRI Tech. Rep. TR-2. 73 p. [ Links ]
Witzell, W.N. 1983. Synopsis of biological data on the hawksbill turtle, Eretmochelys imbricata (Linnaeus, 1766). FAO Fish. Synop, 137. Roma. 78 p. [ Links ]
Wynne, M.J. 1998. A checklist of benthic marine algae of the tropical and subtropical western Atlantic: first version. Nova Hedwigia. Berlín. 116(3):155 p. [ Links ]
Zea, S. 1987. Esponjas del Caribe colombiano. Catálogo Científico. Bogotá. 286 p. [ Links ]
Zug G.R. y R.E. Glor. 1998. Skeletochronological age estimates of green sea turtles living in a Florida developmental habitat. Proc. 18th Intern. Symp. Sea Turtle Biol. Conserv. Mazatlán, México. 3-7 March, 1998. p 36. [ Links ]
FECHA DE RECEPCIÓN: 09/10/03 FECHA DE ACEPTACIÓN: 28/07/04
DIRECCIÓN DE LOS AUTORES
Carrera 104C No. 133ª-54 Bogotá, princon_7@hotmail.com (MPRD). Diagonal 83 No. 24-4 Apto. 411 Bogotá, jimezarate@hotmail.com (CJRZ).













