Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.33 no.1 Santa Marta Jan./Dec. 2004
DINÁMICA DEL FITOPLANCTON DE LA CIÉNAGA GRANDE DE SANTA MARTA, CARIBE COLOMBIANO
Phytoplankton dynamics in the Ciénaga Grande de Santa Marta, Colombian Caribbean.
María Virginia De La Hoz Aristizábal
RESUMEN
Con el propósito de evaluar la dinámica del fitoplancton de la Ciénaga Grande de Santa Marta, se realizaron muestreos quincenales en seis estaciones entre marzo de 1996 y febrero de 1997. Se determinó la existencia de cuatro temporadas con base en las amplias variaciones de salinidad. Salinidades mayores coincidieron con densidades de fitoplancton más altas, y con salinidades menores ocurrió lo contrario, aunque con mayor riqueza de especies. Se registraron 224 taxa, pocas dominantes y la mayoría raras, mostrando tendencia hacia una diversidad baja. Las cianofitas (también conocidas como cianobacterias) presentaron las mayores abundancias todo el año. Las variables ambientales mejor relacionadas con los datos biológicos fueron salinidad, turbidez y ortofosfatos. Se discuten cambios temporales del fitoplancton en relación con condiciones meteorológicas, aportes fluviales y marinos a la Ciénaga y el dragado del caño Clarín.
PALABRAS CLAVE: Dinámica del fitoplancton, Especies dominantes, Especies raras, Ciénaga Grande de Santa Marta, Riqueza de especies.
ABSTRACT
In order to assess phytoplankton dynamics in the Ciénaga Grande de Santa Marta, bimonthly sampling was done at six stations from March 1996 to February 1997. Salinity showed wide ranges so the year could be divided in four seasons. Higher salinities were related to higher phytoplankton density, while lower salinities were related to lower phytoplankton densities and increased species richness. 224 taxa were recorded, and the general trend was towards a low diversity with a few dominant species, and most of them rare. Cyanophytes showed the highest abundances all year. Salinity, turbidity and orthophosphates were the environmental factors best related to the biotic data. Seasonal changes in phytoplankton concerning to meteorological conditions, fresh and tidal floods and dredging of Clarín canal are discussed.
KEY WORDS: Phytoplankton dynamics, Dominant species, Rare species, Ciénaga Grande de Santa Marta, Species richness.
INTRODUCCIÓN
La Ciénaga Grande de Santa Marta (CGSM) es una amplia laguna costera de 450 km², con alta producción primaria (alrededor de 1000 g C/m2/año) dada principalmente por el fitoplancton (Hernández, 1986). Sin embargo, el deterioro de la calidad del agua la afecta seriamente, a causa del desarrollo poblacional, agrícola y de la construcción de la carretera Ciénaga-Barranquilla que produjo interrupción del intercambio hídrico entre el mar y las ciénagas, originando hipersalinización del sistema, muerte de manglar y reducción del recurso pesquero (PROCIÉNAGA, 1995). Para restaurar el equilibrio ecológico de la región, se llevó a cabo la limpieza y dragado de canales, entre ellos el caño Clarín, que conecta a la CGSM con el río Magdalena. Son varios los trabajos sobre fitoplancton realizados en esta laguna (Carmona, 1979; Bula-Meyer, 1985; Mancera y Vidal, 1994; Vidal, 1995). El presente estudio pretende dar un nuevo aporte al tema evaluando los cambios cualitativos y cuantitativos del fitoplancton de la CGSM, luego de la reapertura del caño Clarín (enero de 1996), teniendo en cuenta posibles efectos de este evento.
ÁREA DE ESTUDIO
La CGSM pertenece al delta exterior del río Magdalena (PROCIÉNAGA, 1995) (Figura 1) y se localiza entre 10° 44’, 11° 00’ N y 74° 19’, 74° 31’ W (IGAC, 1974). Limita al N con la isla de Salamanca y el mar Caribe al E y S-E con la Sierra Nevada de Santa Marta (SNSM), al W con el complejo Pajarales, y al S-W con la reserva natural ”Santuario de Flora y Fauna Ciénaga Grande de Santa Marta”. Al N-W y a través del caño Clarín la CGSM se comunica con el sistema de ciénagas de la Isla de Salamanca (PROCIÉNAGA, 1995).
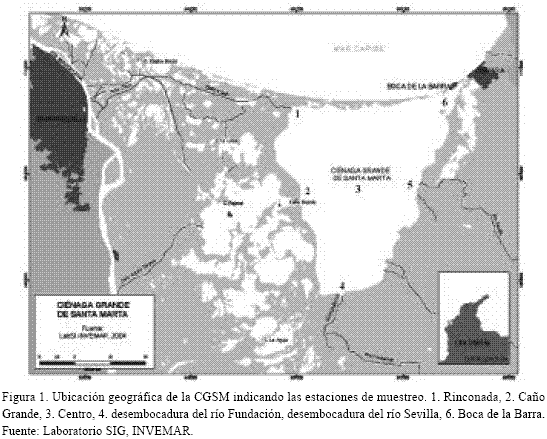
Recibe aguas del mar Caribe por la boca de la Barra y presenta algún intercambio con el mar a través de la isla de Salamanca por flujos subterráneos (PROCIÉNAGA, 1995; Bernal y Betancur, 1996). Recibe agua dulce del río Magdalena a través del caño Clarín y de los ríos de la SNSM (Ochoa, 1988). El clima es seco, con elevada evapotranspiración (600-1400 mm/año) y escasa precipitación (400-1200 mm), dándose un déficit hídrico (PROCIÉNAGA, 1995). El fondo consiste de arenas, limos, arcillas y cascajo sobre el que se fija la ostra Crassostrea rhizophorae (Bernal y Betancur, 1996). Las estaciones de muestreo escogidas (Figura 1) fueron:
E1. Rinconada: Se comunica con la ciénaga La Redonda por el caño Clarín, recibe todo el año aguas de esta laguna, que es la única comunicación permanente del río Magdalena con la CGSM (Wiedeman, 1973).
E2. Caño Grande: Conecta la CGSM con el Complejo Pajarales.
E3. Centro: Sitio de mezcla de diferentes fuentes de agua, determina el agua típica de la Ciénaga (Vidal, com pers, 1996).
E4. Desembocadura del río Fundación: Recibe agua dulce de dicho río, se encuentra al otro extremo de la comunicación con el mar.
E5. Desembocadura del río Sevilla: Recibe agua dulce de dicho río, y por su cercanía a la Barra puede presentar cierta influencia marina (Vidal, com pers.).
E6. Boca de la Barra: Única vía de intercambio de agua entre el mar y la CGSM
MATERIALES Y MÉTODOS
Se tomaron muestras con frecuencia quincenal, desde marzo de 1996 hasta febrero de 1997 en seis estaciones (Figura 1). Para el análisis cualitativo se efectuaron arrastres con una red cónica simple de 55 µm de diámetro de poro; para el análisis cuantitativo se tomaron muestras de agua superficial con una botella Ruttner de un litro, recomendada para sistemas costeros o estuarinos ricos en fitoplancton (Sournia, 1978). El fijador contenía agua destilada, alcohol al 70% y formol al 40% en proporción de 6:3:1 (APHA-AWWA-WEF, 1992).
Las muestras sedimentadas por una semana se concentraban mediante sifoneo del sobrenadante al volumen necesario según el sedimento observado en la muestra, se homogenizaban y se analizaba una alícuota de 2 ml en placa Uthermohl en un microscopio invertido LEICA DMIL. El conteo de los organismos se hizo con base en Sournia (1978), González (1988) y Vidal (1995), en aumentos de 10x y 40x, contando un mínimo de 300 individuos y hasta número constante de especies. El conteo de las especies en 10x no se repetía en 40x. Para obtener las concentraciones de cada especie se utilizaba la fórmula:

Se establecieron cuatro temporadas climáticas (T1 – T4) de acuerdo con Vidal (1995), con base en los ámbitos de salinidad según puntos de inflexión pronunciados de la curva de ésta variable en el tiempo. Su duración fue: T1 de marzo a la primera quincena de mayo de 1996, T2 de la segunda quincena de mayo a la primera quincena de septiembre, T3 de la segunda quincena de septiembre a diciembre y T4 de enero a febrero de 1997.
Para determinar afinidad entre muestras se llevaron a cabo análisis de clasificación CLUSTER y ordenación NMDS, con las abundancias de las especies transformadas a raíz cuarta utilizando la opción de agrupamiento promedio partiendo de la matriz de similaridad de Bray-Curtis. Para definir grupos de especies similares en su comportamiento se hicieron análisis inversos (Clarke y Warwick, 1994), reduciendo primero el número de especies a las que aportaran desde el 0.001% de la abundancia total. Esto se recomienda para evitar que se formen grupos de especies raras que pueden llegar a ser arbitrarios (Williams y Stephenson, 1973; Field et al., 1982; Marshall y Alden, 1990).
Se analizaron los índices de diversidad de Shannon-Wiener (H’), riqueza de Margalef (d), uniformidad de Pielou (J’) y predominio de Simpson (1-?) con logaritmos en base 10. Se efectuó un análisis de similaridad (ANOSIM) a dos vías y sin réplicas, donde el rango de similaridad R varía de 0 a 1, para establecer diferencias significativas entre las muestras de fitoplancton a nivel espacial o temporal (Clarke y Warwick, 1994). Por último, se realizó un BIOENV para determinar qué combinaciones de variables ambientales muestran mejor acoplamiento entre el componente biótico y abiótico, expresado por el coeficiente de correlación de Spearman. Para esto se relacionó el fitoplancton con las variables fisicoquímicas, a partir de las similaridades de Bray-Curtis para las muestras de fitoplancton y de las distancias euclidianas con los datos fisicoquímicos transformados a raíz cuadrada, empleando el método de correlación de Spearman (??) entre las matrices de similaridad biótica y abiótica (Clarke y Warwick, 1994). Todos estos análisis se llevaron a cabo con el programa PRIMER 5 versión 5.2.2.
RESULTADOS
Densidad y composición global del fitoplancton
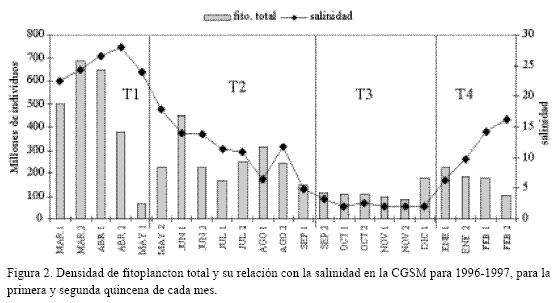
La mayor densidad de fitoplancton total se presentó entre marzo y mayo y la menor entre septiembre y diciembre, observándose relación directa con la salinidad, que mostró rangos de variación para las cuatro temporadas (Figura 2). La mayor densidad fitoplanctónica total se obtuvo en E2 (1119 x 106 individuos) y la menor en E4 (750 x 106 individuos) (Tabla 1).
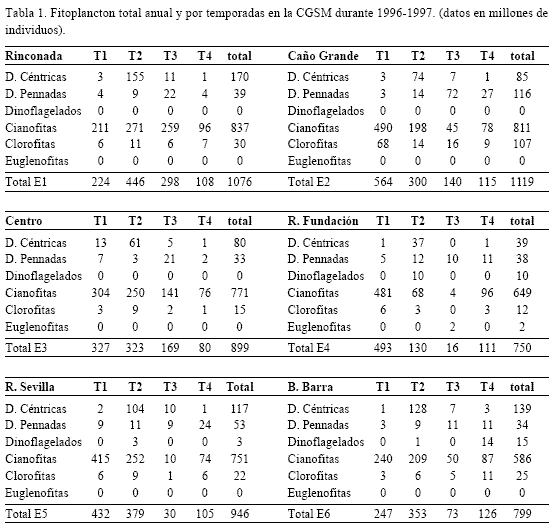
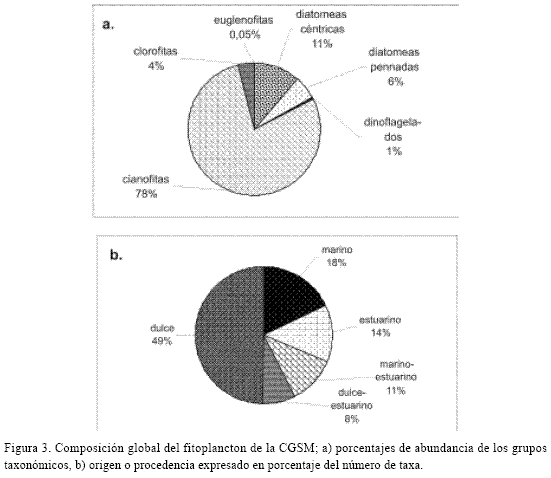
Se encontraron 224 taxa: 93 de diatomeas, 44 céntricas (DC) y 49 pennadas (DP), 18 de dinoflagelados, 29 de cianofitas, 56 de clorofitas, 25 de euglenofitas y tres de otros grupos. Predominó el nanoplancton (2–50 µm) (ej. Cianofitas), seguido por el microplancton (20–200 µm) (ej. diatomeas). En la figura 3 se observan los porcentajes de abundancia por grupo taxonómico y la proporción de las taxa según su origen, la mayor parte estuarino y dulceacuícola. La tabla 2 muestra el número de taxa para los años 1987 y 1996 –1997.

Comportamiento de los grupos taxonómicos
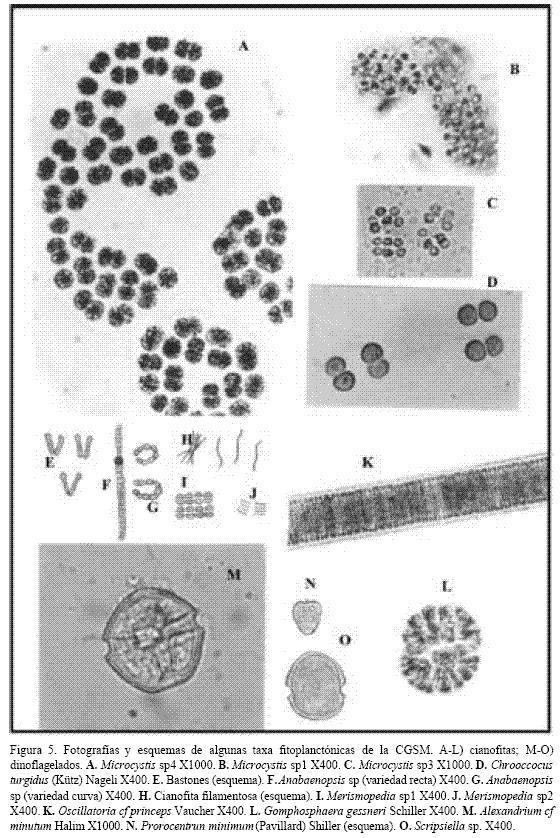
La tabla 1 muestra las abundancias totales y por temporadas y la figura 4 la variación temporal de las taxa más representativas en la CGSM, que a su vez indica la tendencia del grupo taxonómico correspondiente. Entre las cianofitas, grupo más abundante, sobresalió la “cianofita filamentosa” (CF), semejante al género Oscillatoria, observándose como filamentos cortos y finos, de 3 µm de ancho, sueltos o formando haces (Figura 5). También fueron abundantes los “bastones”, cianofitas de aproximadamente 6 x 4 µm, que aparecían en parejas unidas por uno de sus extremos (Figura 5). Se destacaron aunque en menor densidad Chrooccocus turgidus, Gomphosphaera gessneri, Merismopedia venezuelica, Merismopedia spp, Microcystis spp y Anabaenopsis sp (Figura 5).
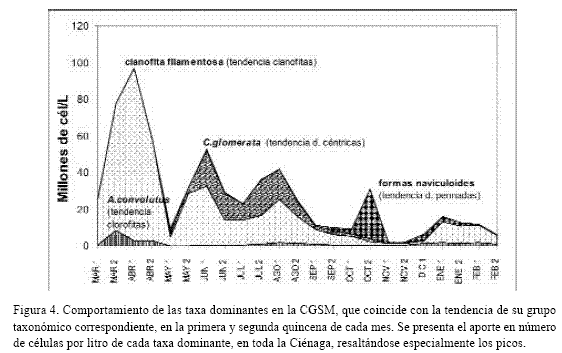
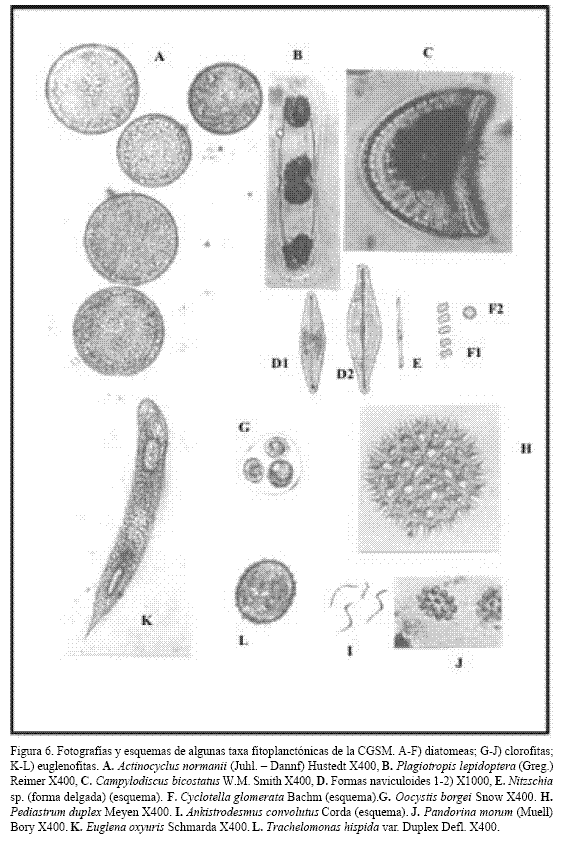
Las DC fueron más abundantes que las DP, por lo general. Cyclotella glomerata fue la DC más abundante y Actinocyclus normanii (Figura 6) apareció en todas las muestras de red, aunque en menor densidad. Otras DC frecuentes, pero no abundantes, fueron Chaetoceros tennuissimus, Coscinodiscus granii, Cyclotella meneghiniana y Paralia sulcata. Dentro de las DP, las "formas naviculoides" (Figura 6) fueron las más abundantes. Por su amplia distribución se destacaron Nitzschia sp y Plagiotropis lepidoptera (Figura 6), además de N. closterium, Fragilariopsis sp., Neodelphineis pelagica y Entomoneis alata. Los picos de DC (mayo–agosto), coincidieron con la salinidad descendente y los picos de DP (octubre y enero), ocurrieron con las salinidades más bajas.
Los dinoflagelados (DI) fueron escasos. Prorocentrum minimum y Scripsiella trochoidea (Figura 5) fueron los más representativos. Alexandrium cf minutum (Figura 5) fue relativamente frecuente pero no abundante. Los picos algo visibles ocurrieron entre mayo y agosto, época en que los vientos disminuyen. Las densidades mínimas ocurrieron entre T3 y T4, épocas de baja salinidad.
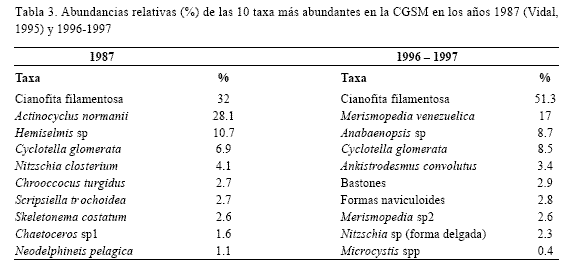
Las clorofitas presentaron la mayor riqueza pero abundancias bajas. Fueron más frecuentes en época de lluvias y en las desembocaduras de los ríos (Ej: Closterium spp., Cosmarium spp. y Staurastrum spp.). No obstante, Ankistrodesmus convolutus (Figura 6), fue abundante y ocupó un amplio rango de salinidad. Oocystis spp. fueron frecuentes y con concentraciones a veces apreciables, destacándose O. borgei (Figura 6). La abundancia de clorofitas fue mayor entre marzo y abril, descendiendo en T3 y aumentando su riqueza. Las euglenofitas, grupo más escaso, aumentaron ligeramente en época menor salinidad (T3). En la tabla 3 se comparan las diez taxa de fitoplancton más abundantes en la Ciénaga antes (1987) y después de la reapertura del caño Clarín (1996-97).
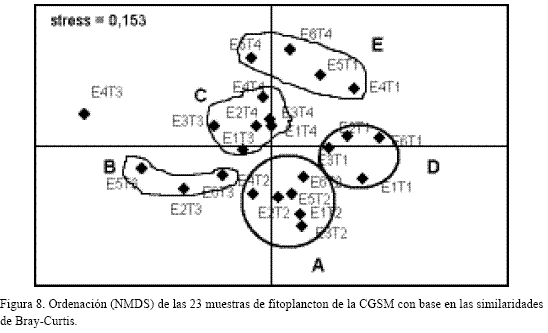
Análisis de clasificación (CLUSTER) y ordenación (NMDS)
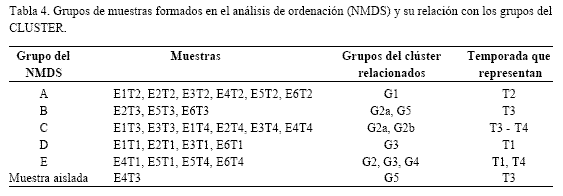
El dendograma (Figura 7) muestra cinco grupos (G1-G5) a un nivel de similaridad del 55%, reflejando similitudes principalmente a nivel temporal (temporadas T1-T4).
G1: estaciones 1–6 en T2. Aumento notable de DC, las mayores abundancias en DI.
G2: temporadas 3 y 4. Dividido en dos subgrupos: G2a: aumento de DP en T3, E1 a E3 y E6; disminución de otros grupos fitoplanctónicos; G2b: disminución de DC en las estaciones E1 a E5 en T4 y aumento de las mismas en E6, coincidiendo con las mayores salinidades de la temporada.
G3: tendencia a menor riqueza y menor diversidad en todas las estaciones en T1, excepto en E5, máximas abundancias de cianofitas en T1, DI más abundantes que en otras temporadas, picos de clorofitas.
G4: E5T1 y E6T4. En T1 E5 es la única que presenta una diversidad alta y, a diferencia de G3, los picos de cianofitas y de clorofitas no ocurren en T1 sino en T2. E6 en T4 se diferencia de las demás estaciones por un pico extra de DP en enero y por una floración de DI no identificados ocurrida en febrero.
G5: E4 y E5 en T3. Las desembocaduras de los ríos presentaron mayor riqueza de especies de agua dulce (clorofitas y euglenofitas) en época lluviosa.
Los cinco grupos del NMDS (Figura 8) indican tendencia a un agrupamiento por temporadas. La tabla 4 señala las muestras contenidas en cada grupo del NMDS y su relación con los grupos del CLUSTER.
Análisis inverso
Debido a la complejidad de los esquemas por el elevado número de taxa representado (95), a pesar de la reducción en el número de especies, a continuación se explican los ocho grupos (GI1–GI8) obtenidos del CLUSTER, a un nivel de similaridad de 30% y su relación con el NMDS (estrés=0.21).
GI1: DC y DI de origen marino en T1 pero no abundantes.
GI2: taxa estuarinas y dulceacuícolas muy escasas sin relación taxonómica estrecha.
GI3: tres formas dulceacuícolas esporádicas en la Ciénaga.
GI4: clorofitas y euglenofitas de agua dulce, frecuentes en T3.
GI5: especies esporádicas sin similitud entre sí, que quedaron agrupadas al azar.
GI6: DP en su mayoría estuarinas y dulceacuícolas, abundantes entre T3 y T4.
GI7: formas raras de aguas de baja salinidad y sin similitud entre sí. Igual que en GI5 esto puede ser más producto del azar.
GI8: el más grande, se divide en dos grupos bien diferenciados:
GI8a: especies más comunes de DI, DC y DP, pero no abundantes, cianofitas y la clorofita Oocystis sp.
GI8b: incluye las 10 taxa más abundantes que se muestran en la tabla 3.
La tabla 5 muestra las taxa pertenecientes a los grupos formados en el CLUSTER inverso. En el NMDS correspondiente GI8 es el mejor representado, diferenciándose claramente de otros. También se destaca GI1 (taxa de origen marino frecuentes en T1). GI4 (formas de agua dulce) no aparece claramente definido en el NMDS. Los grupos GI2, GI3 y GI7 del cluster no se diferencian en el NMDS inverso, debido a que se trata de formas de agua dulce, escasas y sin relación ecológica clara entre ellas, por lo que su agrupación puede considerarse azarosa.

Diversidad
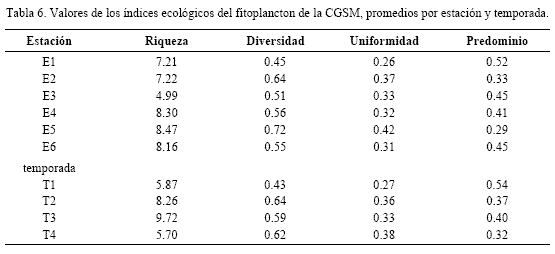
La diversidad más baja se observó en T1 y aumentó en T2, T3 y T4; como excepción E5 en T1 fue la más diversa y por eso en el dendograma aparece en un grupo aislado (G4). El predominio disminuyó en las muestras con más especies raras, principalmente clorofitas y euglenofitas de agua dulce, como Pandorina morum, Pediastrum duplex, Euglena oxyuris y Trachelomonas hispida (Figura 6), aunque también se presentaron especies raras de cianofitas (ej. Oscillatoria princeps) (Figura 5) y de diatomeas (ej. Campylodiscus bicostatus) (Figura 6); esto aumentó la diversidad en T3 y T4 en la mayoría de las estaciones. La estación menos diversa en promedio fue E1 (Rinconada), mientras que la más diversa fue E5 (desembocadura del río Sevilla), que por lo tanto mostró mayor uniformidad y menor predominio (Tabla 6).
Análisis de similaridad entre temporadas y estaciones (ANOSIM)
Para diferencias entre estaciones, se obtuvo un R=0.16 con un ρ=12.6%, por lo tanto con R cercano a cero y ρ mayor de 0.05 no se rechaza la hipótesis nula de no diferencias entre las estaciones. Para diferencias entre temporadas se obtuvo un R=0.31 con un ρ= 1%, por lo que tampoco se rechaza la hipótesis nula de no diferencias entre temporadas.
Relación entre el componente biótico y abiótico (BIOENV)
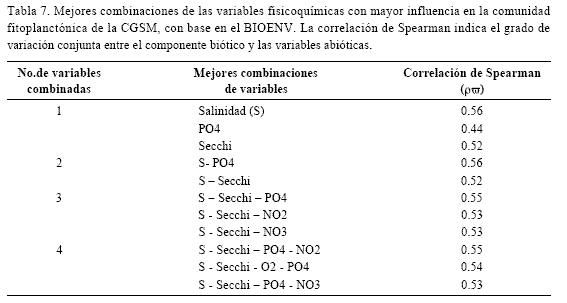
La tabla 7 muestra las combinaciones de las variables ambientales que explican mejor el comportamiento del fitoplancton. Salinidad, ortofosfatos y disco Secchi son las variables abióticas que encajan de mejor manera con el patrón biológico, alcanzando la salinidad individualmente el máximo valor de correlación ρω=0.56.
DISCUSIÓN
El predominio de nanoplancton en la CGSM concuerda con lo encontrado por Kuklick (1987), quien determinó que más del 60% de la biomasa fitoplanctónica de la Ciénaga correspondía a especies pequeñas (2 a 20µm), con tasa de crecimiento alta. La dominancia de las cianofitas, observada en este trabajo, se conoce en estuarios de diferentes latitudes (Day et al., 1989). Diversas cianofitas han sido reconocidas como tóxicas, especialmente los géneros Microcystis y Anabaena (González, 1988), registrados en este estudio. Mancera y Vidal (1994) y Botero et al. (1995) asocian a altas densidades de cianofitas la hipoxia y anoxia en la Ciénaga, causante de mortandades de peces, citando a Anabaenopsis sp., una de las más abundantes en este estudio.
Dentro de las diatomeas, segundo grupo más abundante, la densidad de DC fue más alta entre T1 y T2 por ser más típicamente marinas; las DP, al ser principalmente de agua dulce, aumentaron en T3 con el descenso de salinidad. Los aumentos en las DP también pueden deberse a la resuspensión del fondo por mezclas de la columna de agua (Vidal, 1995).
Los DI fueron muy escasos. Éstos prefieren masas de agua calmadas con pocos nutrientes, pudiendo alimentarse de compuestos orgánicos producidos por otras algas (Smayda, 1997). En la Ciénaga la mezcla continua de agua no permite mayor abundancia de los mismos (Hernández, 1986), además se sabe que prefieren aguas de salinidad más bien alta (Vidal, 1995), por eso estuvieron mejor representados en 1987 que en 1996. Se destaca la toxicidad atribuida a muchos de ellos, por ejemplo al género Alexandrium; pero a pesar de la relativa frecuencia de A. cf. minutum en la Ciénaga, no se ha comprobado su toxicidad y no fue tan abundante. También se menciona a P. minimum, dinoflagelado más abundante de la Ciénaga, como potencialmente tóxico (Smayda, 1997).
Las clorofitas y euglenofitas, escasas por ser típicas de agua dulce en su mayoría, tuvieron una riqueza mucho mayor en este estudio que en 1987 (Vidal, 1995) debido a la menor salinidad del agua; por la misma razón especies marinas frecuentes en 1987, como varios dinoflagelados (ej. Ceratium spp., Gonyaulax spp.) (Vidal, 1995), fueron esporádicas o ausentes en 1996. Las clorofitas del grupo de los desmidiáceos (géneros Closterium, Cosmarium, Staurastrum), citadas por González (1988) como típicas de ambiente oligotrófico, aparecieron ocasionalmente favorecidas por las bajas salinidades.
La CF ocupó el primer lugar en abundancia, tanto en 1996 como en 1987 (Tabla 3), pero, mientras en 1987 aportó 32% al total del fitoplancton (Vidal, 1995), en 1996 aportó 51%. Otras cianofitas comunes a ambos años también fueron más abundantes en 1996. Vidal (1995) explica que las mezclas de la columna de agua contribuyen a que la CF se resuspenda del fondo, ya que posiblemente es bentónica.
La diatomea A. normanii, segunda en abundancia en 1987, no fue tan abundante en 1996, a pesar de su frecuencia del 100%. En bioensayos se ha visto aumento en el crecimiento de esta especie al elevar la relación sílice-fósforo (Vidal y Galán, 1999), aunque ésta fue alta en 1996, posiblemente ocurrió un aumento relativo del fósforo que contribuyó a la baja densidad de esta microalga; de todos modos, su presencia en todas las muestras de red, la hace representativa del sistema. Por otro lado, la persistencia de C. glomerata, con el cuarto lugar en abundancia en ambos años, posiblemente se debió a su tasa de crecimiento alta, a su estrategia de formar colonias y a su tolerancia a cambios de salinidad y a sistemas ricos en fósforo (Kucklick, 1987; Hernandez, 1988a, b).
En la temporada lluviosa (T3) la concentración de fitoplancton disminuyó notablemente, a excepción de las DP y euglenofitas. Tanto fitoplancton como nutrientes, disminuyen usualmente en ésta época debido al efecto de dilución por los mayores volúmenes de agua presentes (Ramírez y Viña, 1998). Por el contrario en T1 y T2 mayores salinidades parecen favorecer mayores densidades de fitoplancton. Otros estudios muestran la misma tendencia en estuarios de la India (Hecky y Kling, 1981; Jegadeesan y Ayyakkannu, 1986 y Devassy y Goes, 1988), que al ser tropicales, se parecen a las de la Ciénaga.
El dendograma de similaridad mostró que los factores climáticos ejercen mayor influencia en los cambios de la comunidad en el año; sin embargo, la mayoría de taxa se encontraron en todas las estaciones y temporadas. Esto puede darse cuando las diferencias están más marcadas por variaciones en patrones de abundancia (Clarke y Warwick, 1994), así en la Ciénaga, las abundancias de grupos taxonómicos varían más a nivel temporal y son más homogéneas a nivel espacial. El NMDS de las 23 muestras tiene un nivel de estrés moderadamente alto (0.153), por el alto número de datos, indicando dificultad de representación en dos dimensiones; no obstante, CLUSTER y NMDS son complementarios (Clarke y Warwick, 1994), así ambos muestran que las variaciones temporales son más fuertes que las espaciales.
En los análisis inversos, a pesar de la fuerte reducción en el número de taxa (de 224 a 95), las formas raras dominan sobre las abundantes. El nivel de estrés algo elevado (0.21) del NMDS, indica dificultad en la representación de muchas variables en dos dimensiones y que varias taxa pueden estar agrupadas al azar, en especial las más raras (Clarke y Warwick, 1994). Por esto los grupos constituidos por aquellas taxa dominantes en el sistema, es decir, las eurihalinas, cosmopolitas y abundantes se observan más claramente.
La diversidad (H’) del fitoplancton osciló entre 0.1 y 0.8 bits/individuo, encontrándose dentro del ámbito de ambientes muy polutos o contaminados. Según Murgel (1984), valores inferiores a 1 son propios de ambientes muy polutos, de 1 a 3 moderadamente polutos y mayor de 3 no polutos. Se entiende este término la introducción de nutrientes alóctonos que alteran la dinámica del ecosistema y elevan su productividad. La CGSM es una laguna muy productiva y con alta oferta de nutrientes (Hernández, 1986, 1988 a, b; Vidal, 1995). La tendencia a la diversidad baja y predominio alto se debe a las elevadas concentraciones de pocas formas dominantes y a la escasez de formas típicas marinas y dulceacuícolas. Por eso las Figuras 2 y 4 son similares, ya que el comportamiento de especies dominantes explica el comportamiento del fitoplancton total.
Margalef (1983) afirma que H’ da importancia a las especies raras, y en muestras biológicas existe la tendencia a presentarse pocas especies comunes y la mayoría raras (Clarke y Warwick, 1994). En la CGSM debe resaltarse la importancia de las mismas, pues fueron la mayoría e indicaron diferencias en factores ambientales en el tiempo y en el espacio. Por eso H’ aumentó ligeramente en época húmeda, al aparecer especies típicamente dulceacuícolas.
En el ANOSIM, los valores cercanos a cero en el R estadístico, indican que no existen diferencias significativas entre las estaciones ni entre las temporadas y que los grupos formados en los análisis de clasificación y ordenación no son estadísticamente diferentes. Es posible que las pocas especies dominantes en la Ciénaga hayan llevado a obtener este resultado; la formación de grupos en el cluster, que marcan diferencias principalmente temporales, puede deberse a las numerosas especies raras, cuya presencia se veía muy afectada por los cambios en condiciones climáticas y salinidad. El alto grado de similaridad entre las muestras denota que el grueso de la comunidad es constante a lo largo del año, lo que refleja la buena adaptación de las especies dominantes a las condiciones ambientales, y puede ser la causa de que no se distingan grupos claros en un análisis de ordenación (Santos-Martínez y Bateman, 1997). Sin embargo, los resultados estadísticos no indican la importancia ecológica de las especies raras. La CGSM se considera un cuerpo de agua formado por subsistemas de características definidas (Hernández y Gocke, 1990) y la pluviosidad y escorrentías determinan diferencias entre estaciones debido a las diferencias de salinidad que se producen (Mallin et al., 1990).
La variable abiótica que mejor explicó el comportamiento del fitoplancton en el BIOENV, fue la salinidad, cuyo gradiente determina la distribución y variabilidad de las especies en el año y respecto a otros años (Vidal, 1995). El ortofosfato ocupó el segundo lugar, posiblemente por su gran influencia en la eutroficación del sistema (Hernández, 1986). La profundidad del disco Secchi ocupó el tercer lugar; de acuerdo con Vidal (1995), las formas marinas se ven ampliamente afectadas por los cambios en la transparencia de la masa de agua, mientras que las estuarinas y de agua dulce se ven afectadas por los cambios de salinidad.
Las correlaciones de Spearman (ρωde alrededor de 0.50, con un máximo de 0.56 para la salinidad, indican que el componente abiótico determina el comportamiento del fitoplancton en un 50% aproximadamente. Vidal (1995), mediante Análisis de Correlación Canónica, encontró una tendencia similar: El espacio abiótico determinaba al biótico en un 52% y el espacio biótico determinaba al abiótico en un 51%. El poder explicativo no muy alto del BIOENV se debió a que por la complejidad de esta comunidad, una sola variable difícilmente influye en gran medida y otras no tenidas en cuenta completarían la explicación del comportamiento del componente biológico (Santos-Martínez y Bateman, 1997). Las variables físicas tuvieron más peso que los nutrientes (excepto PO4) debido a que en estuarios la salinidad y la transparencia son más limitantes (Devassy y Goes, 1988). Otras razones posibles para la falta de correlación entre nutrientes inorgánicos y fitoplancton pueden ser el rezago temporal entre la asimilación de nutrientes y el reflejo en incrementos en la producción, la sucesión de tipos de fitoplancton adaptados a diferentes concentraciones de nutrientes y el control de la concentración de fitoplancton por el consumo de herbívoros (Zea et al, 1998).
Densidades fitoplanctónicas elevadas determinan eutroficación a nivel biológico (Ramírez y Viña, 1998), es el caso de las cianofitas como Anabaena, Anabaenopsis y Microcystis (Esteves, 1988; Hernández, 1988a). Altas densidades de A. convolutus (Margalef, 1983) y de C. glomerata (Vidal, 1995) también se asocian a éste fenómeno. También se señala el predominio de Chlorococcales con respecto a Desmidiaceae (Roldán, 1992) y a A. normanii como indicadores de eutroficación (Vidal y Galán, 1999). A. convolutus fue la clorofita más abundante en 1996, posiblemente por ser indicadora de alta eutroficación, a pesar de no registrarse en 1987.
La Ciénaga recibe grandes aportes de fósforo, principalmente de las actividades antropogénicas (Hernández, 1988b). Las cianofitas aprovechan esta condición extrema, por lo que en la CGSM son el grupo más exitoso (Hernández, 1986; Kucklick, 1987; Vidal, 1995) a pesar de los cambios en condiciones ambientales. De ahí que en el BIOENV el ortofosfato sea el nutriente más influyente en las características de la comunidad fitoplanctónica. Muchas cianofitas son tóxicas y han causado mortandades masivas de peces: una en julio-agosto de 1994, otra en junio de 1995, otras aisladas en 1996 y otra, de gran proporción, en agosto de 1997 (Mancera y Vidal, 1994; Botero et al., 1995).
En cuanto a la relación con la reapertura del caño Clarín, de acuerdo con Almanza (1994) y Botero et al. (1995), el lavado de los suelos de manglar por la nueva entrada de agua dulce después del dragado, traería nutrientes que incrementarían la eutroficación existente, la salinidad disminuiría debido al ingreso de un caudal de agua dulce mayor y las poblaciones de especies que soportan grandes disturbios se verían beneficiadas, como el caso de las cianofitas.
El fitoplancton varió notablemente debido a las condiciones meteorológicas, 1996 fue más lluvioso que 1987 y las salinidades más bajas, teniendo un efecto muy importante en su composición. Aunque 1995 fue aún más lluvioso, presentó mayores salinidades por lo que puede pensarse que sí existió influencia del canal. Las fuertes lluvias locales en T3 en 1996 produjeron cambios en el fitoplancton durante los muestreos (disminución de abundancia y aumento en riqueza de especies); además, 1996 fue muy lluvioso en el interior del pais (IDEAM, 1999).
Santos-Martínez y Bateman (1997) exponen que el efecto del caño Clarín sobre la Ciénaga sólo podría asegurarse si se conociera el área exacta que abarca su influencia, entonces, la mayor densidad de cianofitas y de DC, presente en Rinconada (E1), no puede asociarse sólo a la cercanía al caño. Como 1996 fue atípicamente lluvioso, el río Magdalena inundó zonas aledañas a la CGSM, anteriormente secas, así que no puede establecerse una relación de causalidad directa entre la reapertura de dicho caño y los cambios del fitoplancton, pues también los ríos de la SNSM y las precipitaciones locales pudieron condicionar su estructura.
AGRADECIMIENTOS
Al personal del programa Calidad Ambiental Marina del INVEMAR, que prestó el apoyo logístico en la realización de esta investigación dentro del proyecto “Monitoreo del efecto ambiental de la construcción y funcionamiento de canales en el delta exterior derecho del río Magdalena”. De manera especial al Director del Instituto de Investigaciones Marinas y Costeras INVEMAR, Capitán Francisco Arias Isaza, por su apoyo y al Biólogo Marino Adolfo San Juan por sus sugerencias y asesorías.
BIBLIOGRAFÍA
Almanza, L. 1994. Plan de manejo ambiental. Medidas de mitigación en el dragado del caño Clarín. Univ. Magdalena. Centro de Estudios Ambientales. Santa Marta. 104p. [ Links ]
APHA-AWWA-WEF. 1992. Standard methods for the examination of water and waste water. 18 edición. American Public Health Association. Washington D.C. 1220 p. [ Links ]
Bernal, G. y J. Betancur. 1996. Sedimentología de la Ciénaga Grande de Santa Marta y Ciénaga Pajarales. Bol. Invest. Mar. Cost., 25: 49-76. [ Links ]
Botero, L., J.E. Mancera-Pineda, L.A. Vidal, A. Santos-Martínez, G. Ramírez, M.L. Fontalvo, L.F. Espinosa, W. Troncoso, E. Viloria y J.G. Salazar. 1995. Informe sobre la mortandad masiva de peces ocurrida en el complejo lagunar Ciénaga Grande de Santa Marta - Caribe colombiano, en junio de 1995. Progr. Lagunas Costeras, INVEMAR, Santa Marta, 13 p. [ Links ]
Bula-Meyer, G. 1985. Florecimientos nocivos de algas verde-azules en dos lagunas del Departamento del Magdalena. Rev. Ing. Pesq., 5 (1-2): 89-99. [ Links ]
Carmona, G.E. 1979. Contribución al conocimiento de la ecología del plancton de la Ciénaga Grande de Santa Marta. Tesis (Biología). Univ. Antioquia, Medellín, 74 p. [ Links ]
Clarke, K.R y R.M. Warwick. 1994. Change in Marine Communities. An approach to statistical analysis and interpretation. Plymouth Marine Laboratory. Inglaterra. [ Links ]
Day, J.W., W.M. Kem y A. Yánez-Arancibia. 1989. Estuarine Ecology. John Wiley & Sons. New York. 558 p. [ Links ]
Devassy, V.P. y J.I. Goes. 1988. Phytoplankton community structure and succession in a tropical estuarine complex (Central West Coast of India). Estuarine, Coastal and Shelf Science. 27 (6): 671-685. [ Links ]
Esteves, F. 1988. Fundamentos de limnología. Editora Interciencia/Finep. Rio de Janeiro. 575 p. [ Links ]
Field, J.G., K.R. Clarke y R.M. Warwick. 1982. A practical strategy for analyzing multispecies distribution patterns. Mar. Ecol. Prog. Ser. 8: 37 – 52. [ Links ]
González, A. 1988. El plancton de las aguas continentales. Monografía No. 33. Ser. Biol. Secretaría General de la OEA. Caracas. 130 p. [ Links ]
Hecky, R.E y H.J Kling. 1981. The phytoplankton and the protozooplankton of the euphotic zone of Lake Tanganyka: Species composition, biomass, chlorophyll content, and spatio-temporal distribution. Limnol. Oceanogr., 26(3), 548 – 564. [ Links ]
Hernández, C. 1986. Producción primaria y dinámica del fitoplancton en la Ciénaga Grande de Santa Marta, Colombia. Tesis (Msc.) Universidad Nacional de Colombia. Bogotá. 177p. [ Links ]
_____. 1988 a. Características físicas, químicas y biológicas de la Ciénaga Grande de Santa Marta, Colombia. (Informe segunda parte). INVEMAR-COLCIENCIAS. Santa Marta, Colombia. 17 p. [ Links ]
_____. 1988 b. Producción primaria del fitoplancton en la Ciénaga Grande de Santa Marta, Colombia. (Informe primera parte). INVEMAR-COLCIENCIAS. Santa Marta. 35 p. [ Links ]
Hernández, C y K. Gocke. 1990. Productividad primaria en la Ciénaga Grande de Santa Marta, Colombia. An. Inst. Invest. Mar. Punta Betín. 19 – 20:101 – 119. [ Links ]
IDEAM. 1999. Registros anuales de datos meteorológicos. Bogotá. [ Links ]
IGAC. 1974. Monografía del Departamento del Magdalena. Instituto Geográfico Agustín Codazzi. Bogotá. 163 p. [ Links ]
Jegadeesan, P. y K. Ayyakkannu. 1986. Estudios de fitoplancton en el brazo de mar del Estero Vettar (Complejo Estuarino Coleroon) en la costa sureste de la India. Ciencias Marinas: 12 (1): 33 – 49. [ Links ]
Kucklick, M. 1987. Biomasa del fitoplancton y contenido del seston en un estuario de manglar (Ciénaga Grande de Santa Marta). Tesis (Ph.D) Universitat Stuttgart – Hohenheim. Botanishes institut. Stuttgart, Alemania. 262 p. [ Links ]
Mallin, M., H. Paerl y J. Rudeck. 1990. Seasonal phytoplankton composition, productivity and biomass in the Neuse River estuary, North Carolina. Estuarine, Coastal and Shelf Science., 32(2): 609-623. [ Links ]
Mancera, J.E. y L.A. Vidal. 1994. Florecimiento de microalgas relacionado con mortandad masiva de peces en el complejo lagunar Ciénaga Grande de Santa Marta. Caribe colombiano. An. Inst. Inv. Mar. Punta Betin. 23: 103-117. [ Links ]
Margalef, R. 1983. Limnología. Editorial Omega. Barcelona. 1010 p. [ Links ]
Marshall, H.G. y R.W. Alden. 1990. A comparison of phytoplankton assembleges and environmental relationships in three estuarine rivers of the Lower Chesapeake Bay. Estuaries, 13(3): 287 – 300. [ Links ]
Murgel, S. 1984. Limnología sanitaria. Estudios de la polución de aguas continentales. Monografía 28. Secretaría General de la OEA. Washington D.C. 107 p. [ Links ]
Ochoa, C. 1988. Algunas características funcionales del manglar de la Ciénaga Grande de Santa Marta, con énfasis en Rhizophora mangle y Avicennia germinans. Tesis (Biología). Universidad del Valle. Cali. 143 p. [ Links ]
PROCIÉNAGA, 1995. Proyecto de rehabilitación de la Ciénaga Grande de Santa Marta. Plan de manejo ambiental de la Subregión Ciénaga Grande de Santa Marta 1995 – 1998. Santa Marta. [ Links ]
Ramírez, A. y G. Viña. 1998. Limnología Colombiana. Aportes a su conocimiento y estadísticas de análisis. Primera edición. Formas e Impresos S.A. Bogotá. 293 p. [ Links ]
Roldán, G. 1992. Fundamentos de limnología tropical. Editorial Universidad de Antioquia. Medellín. 529 p. [ Links ]
Santos-Martínez, A. y N. Bateman. 1997. Evaluación de los principales recursos pesqueros de la Ciénaga Grande de Santa Marta. Informe programa Calidad Ambiental Marina. Proyecto DELTA. INVEMAR. 34 p. [ Links ]
Smayda, T.J. 1997. Harmful algal blooms: Their ecophysiology and general relevance to phyto plankton blooms in the sea. Limnol.Oceanog, 42(5, part 2): 1137-1153. [ Links ]
Sournia, A. 1978. Phytoplankton manual. UNESCO. Paris. 337 p. [ Links ]
Vidal, L.A. 1995. Estudio del fitoplancton en el sistema lagunar estuarino tropical Ciénaga Grande de Santa Marta, Colombia, durante el año 1987. Tesis (Msc.) Universidad Nacional de Colombia, Bogotá 207 p. [ Links ]
Vidal, L.A. y A. Galán. 1999. Bioensayos con Actinocyclus normanii (BACILLARIOPHYTA) para determinar condiciones de su mantenimiento en laboratorio. Preproyecto. Programa Calidad Ambiental Marina. INVEMAR. 25 p. [ Links ]
Wiedeman, H. 1973. Reconnaissance of the Ciénaga Grande de Santa Marta, Colombia: Physical parameters and geological history. Mitt. Inst. Colombo-Alemán. Invest. Cient. INVEMAR. No. 7. Santa Marta. 85-119. [ Links ]
Williams, W.T. y W. Stephenson. 1973. The analysis of threedimensional data (sites x species x times) in marine ecology. J. exp. mar. Biol. Ecol., Vol. 11: 207 – 227. [ Links ]
Zea, S., R. Giraldo, J.E. Mancera y J. Martinez. 1998. Relaciones contemporáneas y rezagadas entre variables fisicoquímicas y biológicas en la Ciénaga Grande de Santa Marta, Caribe colombiano. Bol. Invest. Mar. Cost. 27: 67-85. [ Links ]
FECHA DE RECEPCIÓN: 5/04/03 FECHA DE ACEPTACIÓN: 13/08/04
DIRECCIÓN DEL AUTOR
Instituto de Investigaciones Marinas y Costeras INVEMAR, A.A. 1016, Santa Marta, Colombia E-mail: mvdelahoz@hotmail.com (M.V.H.)













