Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.33 no.1 Santa Marta Jan./Dec. 2004
CARACTERÍSTICAS ESTRUCTURALES Y FUNCIONALES DEL MANGLAR DE AVICENIA GERMINAS EN LA BAHÍA DE CHENGUE (CARIBE COLOMBIANO)
Structural and functional characteristics of Avicennia germinans mangrove formation of Chengue bay (Colombian Caribbean).
Alberto Rodríguez-Ramírez, Jaime Nivia-Ruíz y Jaime Garzón-Ferreira
RESUMEN
En el marco del programa de monitoreo CARICOMP (Caribbean Coastal Marine Productivity), se estudió la formación de manglar de Avicennia germinans de la Bahía de Chengue (Parque Nacional Natural Tayrona, Colombia), a partir de la determinación de atributos estructurales y funcionales en tres parcelas de monitoreo (10 x 10 m) entre junio de 1995 y julio de 1996. Estructuralmente esta formación coincide con las características generales de bosques de borde de la región Caribe, es decir, árboles pequeños (en términos de DAP=11.3 cm y altura total=6.3 m) y en altas densidades (16.3 troncos/0.01 ha). Durante el periodo monitoreado se encontró una baja tasa de mortalidad por parcela (0.7 árboles/año) y se registró un aumento significativo entre los promedios de la medición inicial y final de la circunferencia a la altura del pecho (y las variables que se originan de esta medida). Las tasas promedio de crecimiento de altura total, DAP y área basal por árbol fueron de 26.7 cm/año, 0.17 cm/año y 2.9 cm2/año respectivamente. La hojarasca estuvo conformada principalmente por hojas (66.1%) y su tasa promedio de producción fue de 43.1 g/m2/mes (5.2 t/ha/año). Se detectó un patrón temporal de producción de hojarasca y sus componentes asociados a las épocas climáticas del área, según el cual durante la estación lluviosa son mayores las contribuciones de hojarasca total, hojas y propágulos, mientras que en la época seca disminuyen los aportes de todos éstos y se incrementa la producción de flores y ramas. De esta manera los periodos de fructificación y floración se ajustan a un ciclo anual reproductivo. En general la información obtenida es un nuevo aporte al conocimiento de los manglares de Chengue y permite concluir que los individuos monitoreados de A. germinans en Chengue contaron con las condiciones que les permitieron crecer y desarrollarse durante el periodo evaluado
PALABRAS CLAVE: Avicennia germinans, Estructura, Crecimiento, Hojarasca, Bahía de Chengue.
ABSTRACT
Within the framework of the CARICOMP (Caribbean Coastal Marine Productivity) monitoring program, a study of the Avicennia germinans mangrove formation of Chengue bay (Tayrona Natural Park, Colombia) was performed between June 1995 and July 1996, based on the evaluation of structural and functional characteristics at three monitoring plots (10 x 10 m). The structure of the studied formation is coincident with that of fringing forests of the Caribbean region in having small trees (dbh=11.3 cm, total height=6.3 m) and high densities (16.3 trunks/0.01 ha). During the monitored period there was a low mortality rate (0.7 trees/year) and there were significant increases of the circumferences at breast height (as well as of the variables derived from this measure). Average tree growth rates expressed in height, dbh and basal area were 26.7 cm/year, 0.17 cm/year and 2.9 cm2/year respectively. Litterfall was composed principally by leaves (66.1%) and represented a mean production rate of 43.1 g/m2/month (5.2 t/ha/year). There was a temporal pattern of litterfall production associated with the climatic seasons in the area: during rainy months the production of total litterfall, leaves and fruits was higher, while during the dry season there was a reduction of these components and an increase of flowers and wood/twigs. Therefore, flowering and fruit production periods are fitted to an annual reproductive cycle. In general, the information gathered during this study is a new contribution to the knowledge of mangrove ecology in Chengue, and showed that the monitored trees had the conditions to grow and develop during the evaluated period.
KEY WORDS: Avicennia germinans, Structure, Growth, Litterfall, Chengue Bay.
INTRODUCCIÓN
Avicennia germinans (L.) Stearn. es una especie de manglar de amplia distribución principalmente en las costas americanas (Cintrón-Molero y Schaeffer-Novelli, 1992; Duke, 1992), la cual tolera un gran espectro de condiciones climáticas y edáficas que le permiten ser dominante o exclusiva de ambientes marginales en los límites latitudinales o en áreas donde los suelos tienen altas concentraciones de sal (Cintrón y Schaeffer-Novelli, 1983), alcanzando a soportar salinidades hasta de 90 (cf. Twilley et al., 1986). Los bosques más desarrollados de esta especie están en las costas de Surinam, Guyana Francesa y norte del Brasil, con árboles hasta de 30 m de altura, 70 cm de DAP y biomasas de 200 t/ha (cf. Lacerda et al., 2001). En Colombia es conocida como mangle negro, salado, sietecueros, de humo o prieto (Prahl, 1990; Sánchez-Páez et al., 1997) y se encuentra en ambas costas, siendo más representativa en el Caribe sobre manglares de cuenca en ambientes áridos o con aporte estacional de agua dulce, como en la Guajira o la Ciénaga Grande de Santa Marta (Pinto-Nolla, 1999).
En el Parque Nacional Natural Tayrona se encuentran pequeñas formaciones aisladas de manglares de borde en las bahías de Chengue, Cinto y Nenguange (Prahl, 1990), presentando desarrollos estructurales de acuerdo con la influencia de aguas marinas o dulces (Sánchez-Páez et al., 1997). Los bosques más representativos están al interior de la Bahía de Chengue (Márquez y Guillot, 1983; Garzón-Ferreira y Cano, 1991) y son dominados por Rhizophora mangle L., aunque también se pueden encontrar otras especies de manglares como Conocarpus erectus L., Laguncularia racemosa (L.) Gaertn. f. y A. germinans. De estas últimas A. germinans es la única que puede constituir arboledas monoespecíficas de tamaño considerable detrás de la franja de R. mangle (Garzón-Ferreira, 1998).
En general el manglar de Chengue es uno de los ecosistemas con menos estudios de la bahía (Rodríguez-Ramírez y Garzón-Ferreira, 2003) y en particular la información del bosque de Avicennia germinans se restringe a unos pocos trabajos (Garzón-Ferreira y Cano, 1991; Álvarez-León et al., 1995; Sánchez-Páez et al., 1997; Garzón-Ferreira, 1998) en donde básicamente se describe fisiográfica y estructuralmente esta formación. Sin embargo, aspectos funcionales como la fenología de A. germinans sólo se han tratado por Gil Torres (1998) o el crecimiento, mortalidad y producción de hojarasca se han estudiado en detalle pero para Rhizophora mangle por Rodríguez-Ramírez y Garzón Ferreira (2003).
Gracias a la participación del Instituto de Investigaciones Marinas y Costeras (INVEMAR) dentro del marco del programa de monitoreo internacional del Gran Caribe CARICOMP (Caribbean Coastal Marine Productivity), se ha recopilado información (desde 1992) para la Bahía de Chengue en cada uno de sus principales ecosistemas que ha permitido llenar vacíos existentes como los mencionados anteriormente. Este trabajo congrega parte del nuevo conocimiento obtenido para el manglar de A. germinans de esta bahía en términos de sus principales atributos estructurales (DAP, altura total, longitud y volumen del tronco, área basal) y funcionales (mortalidad, crecimiento, producción de hojarasca y fenología), con el propósito de brindar información básica de referencia para futuras evaluaciones.
ÁREA DE ESTUDIO
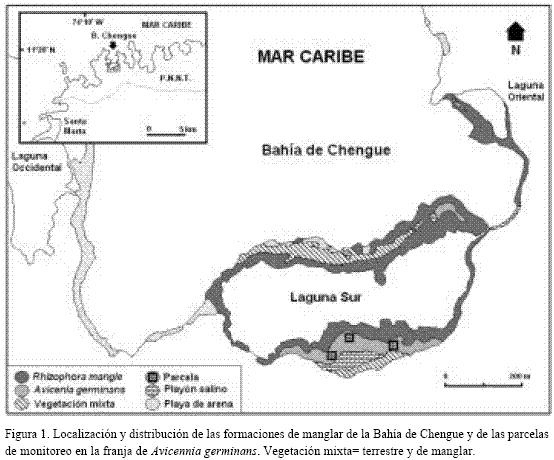
El trabajo de campo se realizó en Chengue (11º20´N – 74º08´W), una pequeña bahía (3,3 km2 de superficie) localizada dentro del Parque Nacional Natural Tayrona (PNNT) a unos 14 km al nororiente de la ciudad de Santa Marta (Figura 1), en la costa Caribe de Colombia (Garzón-Ferreira, 1998). No existen datos meteorológicos de Chengue, sin embargo, allí el clima general está determinado en gran medida por la influencia de los vientos Alisios del nororiente y puede calificarse como seco y cálido (Rodríguez-Ramírez y Garzón-Ferreira, 2003). En Punta Betín (Santa Marta) entre 1993 y 2002 el promedio anual de precipitación registrado fue 383.3 mm y los promedios anuales de máximos y mínimos de temperatura ambiental fueron 31.3ºC y 27.1ºC respectivamente (base de datos INVEMAR). Chengue alberga las formaciones de manglar más sobresalientes de todo el parque Tayrona (Márquez y Guillot, 1983; Garzón-Ferreira y Cano, 1991), las cuales se concentran principalmente alrededor de la laguna sur (Figura 1), donde en contacto directo con el agua domina una franja del mangle rojo (R. mangle), mientras que en las zonas menos pantanosas lo hace A. germinans (Garzón-Ferreira, 1998). En la laguna adyacente a los bosques de manglar, las condiciones del agua están influenciadas por la permanente comunicación con las aguas de la bahía y por el régimen de mareas (Ávarez-León et al., 1995), presentando un comportamiento estacional relacionado con las épocas climáticas (Rodríguez-Ramírez y Garzón-Ferreira, 2003). En general los máximos promedios mensuales de temperatura se han observado en la estación lluviosa (mayo a noviembre) y los mínimos en la estación seca (diciembre a abril), mientras que la salinidad ha tenido un comportamiento inverso. El promedio de temperatura del agua en la laguna durante el periodo de 1993-1999 fue de 28.7ºC (máximo valor=34.0ºC; mínimo=23.6ºC), en tanto que para la salinidad fue de 37.5 (máximo=43.0; mínimo=29.0) (Rodríguez-Ramírez y Garzón-Ferreira, 2003). En la laguna durante la época seca se ha registrado una estratificación salina, según la cual la salinidad tiende a ser menor hacia la boca que en las zonas interiores (Boca 38; interior 42), y en los meses lluviosos se invierte el gradiente, pero las diferencias son menores entre la boca y el interior (Boca=33-34, interior=32-33) (Ávarez-León et al., 1995). Estas variaciones son atribuidas al aporte de dos quebradas estacionales (localizadas en el margen sur de la laguna) y a las aguas de escorrentía (Ávarez-León et al., 1995), no obstante, también puede influir la dilución directa por la lluvia, que puede presentarse dada la poca profundidad de la laguna (< 1 m) (Rodríguez-Ramírez y Garzón-Ferreira, 2003). En cuanto al régimen y amplitud de mareas, no hay información particular para la Bahía de Chengue o su laguna sur, no obstante, analizando los pronósticos de pleamares y bajamares de los años 1995 y 1996 del área de Santa Marta (IDEAM, 1995 y 1996), se aprecia que son características las mareas semidiurnas y rara vez la amplitud excede los 30 cm. Observaciones de campo permitieron identificar que en los lugares dominados por A. germinans, los suelos son inundados pocas veces al año. Se registraron dos picos de inundación: uno máximo de 8.1 cm, en octubre (1995) y un mínimo de 2.2 cm en enero (1996). En consecuencia, los terrenos donde crece A. germinans son cubiertos muy eventualmente por mareas extremas, mientras que durante la temporada húmeda, es común la inundación, lo cual se puede atribuir a un aumento en el nivel del agua en la laguna por acción de las lluvias. Información más detallada sobre las condiciones oceanográficas y los ecosistemas presentes en Chengue se puede encontrar en Garzón-Ferreira y Cano (1991), Ávarez-León et al. (1995) y Rodríguez-Ramírez y Garzón-Ferreira (2003).
MATERIALES Y MÉTODOS
Toma de datos en campo
Mediante visitas previas se reconoció el área de estudio, se realizaron anotaciones generales y se escogieron los sitios para al muestreo. En junio de 1995 se realizó la primera medición de los atributos estructurales del bosque A. germinans de la laguna Sur de Chengue según la metodología sugerida por CARICOMP (2001) y se repitió en julio de 1996. Se delimitaron 3 parcelas de 10 x 10 m (0.01 ha) con una cuerda sintética y en cada una se marcaron con pintura los árboles con un número consecutivo y se ubicaron en un mapa de coordenadas “x” y “y” para facilitar su reubicación al año siguiente. Se tuvieron en cuenta exclusivamente los árboles con diámetro mayor a 2.5 cm y una vez establecidas las parcelas, se tomó la siguiente información: 1) Diámetro: con una cinta métrica flexible se midió la circunferencia del tronco a la altura del pecho (1.3 m) y con este dato se estimó para cada árbol el DAP (diámetro a la altura del pecho). En el punto de la medición se pintó una banda alrededor del tronco para minimizar el posible error de las determinaciones entre muestreos. 2) Altura: usando una vara graduada se tomó para cada árbol a) altura total o distancia vertical desde el suelo hasta la parte más alta de la copa del árbol y b) longitud del tronco o distancia vertical desde el suelo hasta la primera ramificación principal.
La productividad se estimó con base en la caída de hojarasca entre julio de 1995 y junio de 1996. En las mismas parcelas utilizadas para las mediciones estructurales se instalaron diez canastas (rotuladas) colectoras de hojarasca de 50 x 50 cm (0.25 m²). Mensualmente la hojarasca de cada canasta fue recogida por separado en bolsas plásticas rotuladas para ser transportadas al laboratorio.
Mensualmente en cada parcela se tomaron muestras para determinar la salinidad del agua intersticial. Para esto se introdujo un tubo de PVC (60 cm longitud x 11 cm de diámetro) en el suelo, dejando la parte superior del tubo por encima del nivel del agua (si había inundación) y se extrajo todo el sedimento y el agua del interior del tubo. Luego se esperó hasta que subió el agua a su nivel máximo (nivel freático) y se tomó la muestra (ver detalles en CARICOMP, 2001). También fue determinada la temperatura (ºC) del suelo en la vecindad de las parcelas durante todo el periodo evaluado mediante un termómetro electrónico de registro continuo (HOBO). Para complementar la información ambiental, se realizaron mediciones diarias de precipitación en la sede de INVEMAR en la ciudad de Santa Marta (Punta de Betín), y se utilizaron los promedios mensuales multianuales de velocidad del viento obtenidos en la estación meteorológica del IDEAM en el Aeropuerto Simón Bolívar de Santa Marta.
Determinaciones en laboratorio
Mediante el análisis de fotografías aéreas de la bahía (vuelos IGAC R-602 de 1967, esc. 1: 20.000; C-1506A de 1974, esc. 1: 15.000 y C-2315 de 1987, esc. 1: 37.000), se elaboró un mapa de la vegetación de manglar (Figura 1), con base en diferencias de las tonalidades y texturas (FAO, 1994) y se estimó el área ocupada por el bosque de A. germinans .
Las muestras de hojarasca de cada canasta fueron tratadas como lo sugiere CARICOMP (2001): se secaron (70ºC por 48 horas), se separaron los componentes –hojas, flores, madera/ramas y misceláneos (material fecal)- y se pesaron.
Las muestras para salinidad del agua intersticial tomadas en el campo se midieron en el laboratorio con un conductímetro y fueron expresadas en unidades prácticas de salinidad según UNESCO (1985).
Análisis de datos
Para cada árbol se realizaron los siguientes cálculos según las ecuaciones que se encuentran en el manual de métodos de CARICOMP (2001): a) diámetro a la altura del pecho (cm), b) área basal (cm2) y c) volumen del tronco (m3),. Con base en estas determinaciones se obtuvo: a) área basal (m2/ha) y b) volumen del tronco (m3/ha) y c). De otro lado se halló para cada parcela la densidad (troncos/0.01 ha), tasa de mortalidad (árboles muertos/año) y la tasa de crecimiento en términos de a) altura total (cm/año) b) circunferencia (cm/año) c) diámetro a la altura del pecho (cm/año) y d) área basal (cm2/año). Para estas tasas se utilizaron los datos de árboles que presentaron aumento o no cambiaron de un año a otro.
Para evaluar el crecimiento de los árboles se determinó el porcentaje de los que crecieron, decrecieron o no cambiaron en términos de altura y circunferencia a la altura del pecho. Adicionalmente se efectuó una prueba t Student (muestras dependientes) para comparar entre el muestreo inicial y el final los promedios de cada parcela de: a) circunferencia a la altura del pecho, b) DAP y c) área basal y análisis de varianza (ANOVA a una vía) para determinar diferencias entre parcelas en las tasas de crecimiento promedio en términos de los mismos atributos mencionados antes. En los datos de circunferencia a la altura del pecho se registraron dos árboles con decrecimiento, lo cual indica que se incurrió en algún error en las mediciones -ya que no es lógico que los troncos disminuyan en su contorno-, por lo tanto estos datos se excluyeron de los análisis estadísticos. Pese a que lo anterior sugiere la posibilidad de cometer Errores de tipo I, es importante mencionar que: a) las mediciones se realizaron con una cinta métrica cuya precisión es de 1 mm y se realizaron en el mismo lugar del tronco (marcación de una banda con pintura), b) el número de datos por tratamiento fue al menos de 13 y c) α=0.05.
Con la información de la caída de hojarasca se realizaron los siguientes cálculos: a) promedios mensuales del total de caída de hojarasca y de cada uno de sus componentes (g/m2) y b) tasa total mensual de caída de hojarasca y tasa promedio mensual de caída de sus componentes (g/m2/mes). Con el propósito de determinar el comportamiento temporal (jul/95-jun/96) de la caída de hojarasca y sus componentes, se graficaron las tasas promedio mensuales y se efectuó un análisis clasificación, para el cual se utilizaron las valores de las tasas mensuales (transformados con raíz cuadrada) de cada ítem (componentes de la hojarasca) y así construir la matriz de similaridad (Bray-Curtis). El dendrograma resultante se obtuvo con la técnica de ligamiento promedio no ponderado -los fundamentos del análisis de clasificación fueron consultados en Clarke y Warwick (2001)-. Finalmente, para explorar posibles relaciones de causalidad para las tendencias temporales en la caída de hojarasca, se correlacionaron de manera simple (Pearson) las tasas mensuales (total y de cada componente) junto con algunas variables abióticas: acumulados mensuales de precipitación (medidos en INVEMAR), promedios mensuales de salinidad intersticial y temperatura del suelo (Chengue) y promedios mensuales multianuales de velocidad del viento (estación meteorológica del IDEAM ubicada en el aeropuerto Simón Bolívar de Santa Marta). Para estas correlaciones se presume autocorrelación, por consiguiente la significancia de los coeficientes no fueron tenidas en cuenta. Para los análisis y discusiones, los coeficientes altos (>0.60; negativos o positivos) se asumieron sólo como “indicativos” de relación entre las variables consideradas. Las medias generales para todas las variables del bosque fueron obtenidas al promediar las tres parcelas, después de promediar al interior de cada parcela todos los árboles presentes (para estructura) o las diez canastas (para caída de hojarasca).
RESULTADOS Y DISCUSIÓN
Características estructurales
Descripción y fisiografía del manglar: de acuerdo con la clasificación estructural y funcional de los manglares (cf. Cintrón-Molero y Schaeffer-Novelli, 1992; Woodroffe, 1992), las formaciones de Chengue son consideradas como manglar de borde (Prahl, 1990) o en franja (Sánchez-Páez et al., 1997; Pinto-Nolla, 1999). Como se aprecia en la figura 1, en Chengue el manglar está compuesto en un 80% por un rodal monoespecífico de R. mangle que crece sobre suelos bajos e inestables que rodean toda la laguna sur y gran parte de la oriental (Figura 1), ocupando un área aproximada de 6.9 ha. Esta franja puede ser de ancho variable a partir del borde mismo del espejo de agua y, según la topografía, puede ir desde unos pocos metros -sobre la barra, en la boca y final de la laguna-, hasta un máximo de 50 m -en la zona media- (Figuras 1 y 2), donde los árboles alcanzan su mayor talla. Detrás del mangle rojo del sector sur de la laguna se encuentra una formación monoespecífica de A. germinans, también de ancho variable (con un máximo transversal de 50 m), que concluye en un playón hipersalino libre de vegetación (Figuras 1 y 2). A. germinans se desarrolla sobre suelos más altos y consolidados, extendiéndose hasta el límite marcado por las pleamares, en un área de 1.7 ha aproximadamente. Cerca al playón el porte de los árboles es bajo y el paisaje se torna más despejado debido a la disminución de la densidad de individuos, además de encontrarse la presencia de troncos de árboles muertos, que aumenta a medida que se avanza hacia el salitral. En general la formación de A. germinans presenta una alta densidad de neumatóforos que cubren el sustrato varios metros alrededor de cada árbol. El playón salino se extiende sobre una hondonada del terreno y muy eventualmente es cubierto por mareas extremas. Allí se observaron troncos muertos de A. germinans que indican que el playón se ha extendido (por pérdida de cobertura vegetal), hecho que se pudo ratificar en el cambio progresivo que se apreció en las fotografías aéreas del lugar (IGAC, años 1967, 1974 y 1987). En varios puntos del playón se pueden observar capas superficiales formadas por la acumulación de sales. La fisiografía descrita concuerda con el perfil típico (1-franja externa R. mangle, 2-franja interna A. germinans, 3- árboles muertos, 4-salitral) de manglares en costas áridas y se ha observado en muchos lugares de Puerto Rico y las Islas Vírgenes, donde la topografía, el gradiente de salinidad y el flujo de la marea contribuyen a determinar el patrón de distribución de las franjas de R. mangle y A. germinans y su grosor (Cintrón et al., 1980).
Estructura: de acuerdo con los resultados obtenidos la formación estudiada de A. germinans en Chengue presentó en promedio los siguientes atributos estructurales: 1) diámetro a la altura del pecho (DAP) 11.3 cm, 2) altura total 6.3 m, 3) longitud del tronco 3.2 m, 4) área basal 17.3 m2/ha, 5) volumen del tronco 140.8 m3/ha, y 6) densidad 16.3 troncos/0.01 ha (Tabla 1). Teniendo en cuenta las categorías diamétricas (cf. Sánchez-Páez et al., 1997), la mayoría de los individuos (63.3%) estuvieron en la categoría de latizales (entre 5.1 y 15.0 cm de diámetro), seguidos por los brinzales o juveniles (entre 1.0 y 5.0 cm) con un 22.4% y los menor representados fueron los fustales o árboles (>15.0 cm) con un 14.3%. En términos de altura total se encontró que un 50% de los individuos midieron entre 6 y 9 m, un 39.6% fueron menores a 6 m, 8.3% entre los 9 y 12 m y que un solo individuo (2.1%) fue mayor a 12 m (13.9 m). El contraste de estos resultados con los registrados en el único antecedente para Chengue (Sánchez-Páez et al., 1997), reveló en general diferencias sustanciales (Tabla 2); la densidad y la altura promedio encontradas en esta investigación son notablemente mayores (10 y 2 veces respectivamente, Tabla 2). No obstante, son justificables porque las determinaciones estructurales se realizaron en sitios diferentes. Según las descripciones de Sánchez-Páez et al. (1997), es claro que ellos trabajaron en una franja que va desde la línea de costa hacia la laguna, mientras que en esta investigación las parcelas se ubicaron en la franja más interna de A. germinans que colinda con el salitral (Figura 1). Por consiguiente se sugiere que hay variaciones estructurales en la población de A. germinans en Chengue y que los datos de este trabajo son nuevo aporte al conocimiento de los manglares de esta bahía del Parque Tayrona.
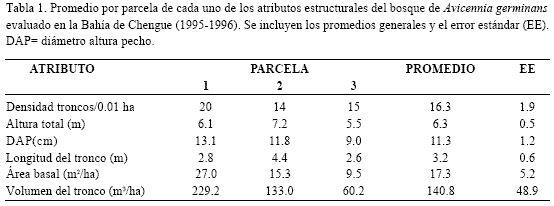
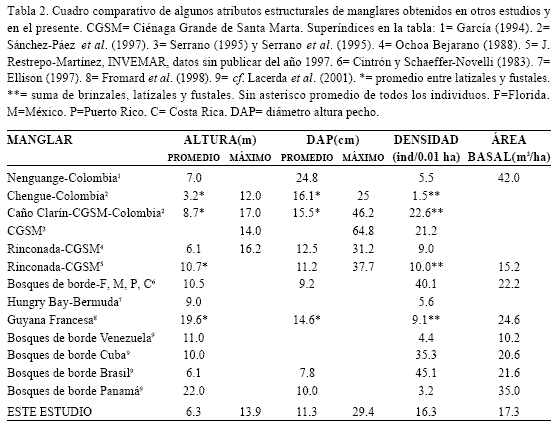
En cuanto a la comparación con otros bosques de borde de A. geminans del Tayrona se encontró que también existen diferencias (Tabla 2). Es así como en términos de DAP y altura promedio y área basal, las estimaciones en Chengue son menores a las encontradas en la Bahía de Nenguange, lo cual significa que en este manglar los árboles son más robustos. Por su parte la densidad de árboles es mucho mayor en Chengue, como consecuencia de la alta proporción de latizales y brinzales (85.7%) y pocos árboles de gran envergadura. Todo lo anterior sugiere que el rodal estudiado de A. germinans de Chengue es menos maduro que el de Nenguange, considerando que una baja densidad y mayor área basal son indicativos de madurez (Cintrón y Schaeffer-Novelli, 1984). Una tendencia similar para las formaciones de R. mangle entre Chengue y Nenguange fue descrita por Rodríguez-Ramírez y Garzón-Ferreira (2003). Se aduce entonces que las diferencias entre los manglares de estas dos bahías se derivan de la disponibilidad de agua dulce; si bien en ambas bahías los mayores aportes dependen de la lluvia, en el manglar de Nenguange desemboca un riachuelo cuya boca se cierra parte del año formándose una pequeña laguna (Garzón-Ferreira y Cano, 1991), la cual ha permitido el desarrollo de sus manglares (García, 1994). Es reconocido que los manglares con aportes de agua dulce y por ende, de nutrientes, tienen un mayor grado de desarrollo (Cintrón et al., 1980; Cintrón y Schaeffer-Novelli, 1983; Prahl., 1990; Cintrón-Molero y Schaeffer-Novelli, 1992; Smith, 1992; Woodroffe, 1992; Cardona y Botero, 1998). En relación con esto, igualmente se pueden explicar los menores valores de algunas características estructurales del bosque de A. germinans de Chengue en comparación con los de Ciénaga Grande de Santa Marta –CGSM- (Tabla 2), ya que el desarrollo de estos manglares ha dependido en gran medida de la contribución de varias fuentes de aguas fluviales (Botero, 1990; Cardona y Botero, 1998). En la CGSM es posible encontrar un amplio rango de atributos para formaciones monoespecíficas de A. germinans, con densidades desde 9.0 a 22.6 individuos/0.01 ha y grandes ejemplares de hasta 17 m de altura o 64.8 cm de DAP (Tabla 2).
Al procurar hacer un contraste en un marco regional, tan solo se pueden realizar paralelos a nivel de bosques de borde, debido a que es difícil hallar información discriminada por especie. Con relación a este tipo de manglares (en Florida, México, Puerto Rico, Costa Rica, Bermuda, Guyana Francesa), los promedios de altura, densidad y área basal de Chengue tienden a ser menores (Tabla 2). No obstante, concuerdan con las características generales de bosques de borde de costas áridas en la región Caribe, es decir, árboles pequeños (en términos de DAP y altura) y altas densidades (cf. Pool et al., 1975; Cintrón et al., 1980).
Aunque estructuralmente el mangle salado de la laguna Sur de Chengue presentó diferencias a escala local, departamental y regional, se consideran razonables, porque se ha registrado que en el gran Caribe los manglares varían ampliamente en sus atributos como respuesta a un amplio espectro de condiciones ambientales y de tensores (CARICOMP, 1997).
Características funcionales
Mortalidad y crecimiento: del total de árboles censados (50) con vida en junio 1995 en las tres parcelas, sólo dos murieron hasta julio de 1996, lo cual corresponde a una baja tasa de mortalidad promedio por parcela de 0.7 árboles/año (Tabla 3). Aunque no se exploró particularmente la causa de la muerte de estos árboles, según observaciones de campo, podría estar relacionada con el ataque por parte de insectos xilófagos, como hormigas y termitas halladas en los troncos.
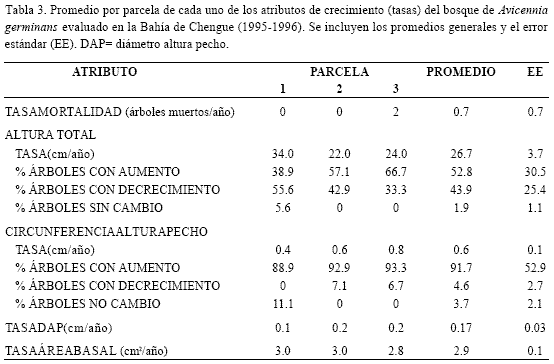
Para interpretar convenientemente los resultados del crecimiento del bosque en términos de altura total, es necesario considerar las observaciones realizadas por Rodríguez-Ramírez y Garzón-Ferreira (2003) acerca de la metodología utilizada (vara graduada). Según éstas el método tiene precisión de varios centímetros y por lo tanto no es lo suficientemente sensible para detectar cambios reales en la altura de unos pocos centímetros entre un año y otro. De otra parte, en A. germinans las ramas de la copa o superiores a menudo se quiebran (Fromard et al., 1998), en consecuencia, las inferencias sobre cambios temporales en la altura no son prudentes. Teniendo en cuenta que el rodal estudiado está conformado principalmente de latizales, es razonable que se presentaran incrementos durante el periodo evaluado en términos de altura. De acuerdo con la información tomada, la tasa de crecimiento promedio por árbol de A. germinans sería de 26.7 cm/año, dado por un porcentaje medio (entre 38.9 y 66.7%) de árboles que aparentemente crecieron en cada parcela (Tabla 3). Sin embargo, se enfatiza que este es un dato que se debe asumir con cautela.
Por su parte la tasa de crecimiento de la circunferencia a la altura del pecho fue de 0.6 cm/año, dada por un alto porcentaje de árboles que presentaron aumento en cada parcela (entre el 88.9% y el 93.3%) y por los bajos porcentajes de troncos que no aumentaron (Tabla 3). A pesar de esto último, se produjo efectivamente un incremento en el perímetro de los fustes de acuerdo con lo revelado por pruebas t Student. Como se aprecia en la tabla 4, en todas las parcelas se presentaron aumentos significativos (P<0.01) en la circunferencia a la altura del pecho entre la evaluación inicial (1995) y la final (1996), no obstante, la tasa entre parcelas no fue significativamente diferente (ANOVA, P=0.09). Teniendo en cuenta que el DAP y el área basal son atributos derivados de la circunferencia, se encontró la misma tendencia que para ésta, es decir, aumentos significativos entre los años de estudio en cada parcela (t Student P<0.01), pero con tasas similares entre ellas (Tabla 4). Las tasas promedio de crecimiento de DAP y área basal por árbol fueron de 0.17 cm/año y 2.9 cm2/año respectivamente (Tabla 3).

Al intentar contextualizar los resultados de las tasas, no se hallaron publicaciones en particular para bosques de A. germinans -incluso a nivel regional-, por consiguiente los datos aquí presentados se constituyen en una información novedosa y en un importante marco de referencia para rodales con características y condiciones similares al evaluado en Chengue. Además, mientras muchos trabajos han estudiado temporalmente aspectos funcionales como la caída de hojarasca en el continente americano, el crecimiento natural de los bosque ha sido raramente monitoreado (Lacerda et al., 2001). La única información disponible se encontró en la base de datos del INVEMAR para tasas de aumento de DAP de los manglares de la Ciénaga Grande de Santa Marta (J. Restrepo-Martínez, com. pers.), donde para bosques de referencia con buen estado de desarrollo de A. germinans se han registrado tasas promedio de 0.36 cm/año (rango 0-1.5 cm/año; Estación Rinconada) y 0.9 cm/año (0-4.1 cm/año; Estación Km 22 del caño Clarín). A la luz de estos datos las tasas de Chengue se pueden asumir como bajas y más si se tiene en cuenta que la mayor proporción de los individuos en Chengue son susceptibles de incrementar su diámetro por su carácter de latizales y brinzales. No obstante, la diferencia se puede explicar por la poca disponibilidad de agua dulce en Chengue, la cual es un factor clave -que se ha discutido anteriormente y que se amplia más adelante- para la estructura y los procesos funcionales de sus manglares.
Aun cuando la información sobre el crecimiento en términos de la altura total y sus atributos relacionados se debe asumir con mesura, lo registrado para la circunferencia a la altura del pecho (y las variables que se originan de esta medida), permiten concluir que los individuos monitoreados de A. germinans en Chengue contaron con las condiciones que les permitieron crecer y desarrollarse durante el periodo evaluado. De todas formas se recomienda para realizar inferencias temporales a partir de mediciones repetidas sobre las mismas unidades (árboles), que en los formatos de campo se incluyan los datos del muestro anterior.
Producción de hojarasca, fenología vegetativa y reproductiva: durante el periodo evaluado la hojarasca estuvo conformada principalmente de hojas, que constituyeron el 66.1% (del peso seco total), seguidas por las ramas y residuos de madera con 14.6%, los propágulos con un 7.9% y las flores con un 5.3%. El restante 6.2% correspondió con los misceláneos (principalmente material fecal). Este patrón fue similar al encontrado por Rodríguez-Ramírez y Garzón Ferreira (2003) para el rodal de R. mangle que colinda con el de A. germinans de esta caracterización. Además, la alta proporción de hojas coincide con el esquema general de caída de hojarasca para los manglares descrito por Cintrón y Schaeffer-Novelli (1983) y Lacerda et al. (2001), según el cual las hojas son el principal componente con porcentajes entre el 70-80% del peso seco total. Así mismo, es semejante a la proporción hallada para bosques de la CGSM donde las hojas pueden constituir cerca del 60% (Ochoa et al., 1988) y está dentro del rango (53-78%) registrado para manglares en la Florida-USA (Twilley et al., 1986).
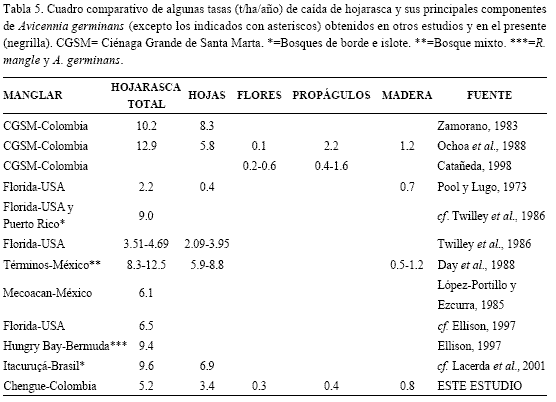
La tasa promedio de producción de hojarasca fue de 43.1g/m2/mes (EE= 3.3) o de 517.1 g/m2/año. Al convertir esta tasa a una base anual en toneladas por hectárea y compararla con las cifras promedio en otros estudios a nivel regional (Caribe-México-Florida, Tabla 5), la tasa de 5.2 t/ha/año del bosque de A. germinans estudiado en Chengue está dentro del rango de variación (2.2 Florida y 12.9 t/ha/año CGSM) y se puede considerar como media a baja. Esta misma tendencia se mantiene cuando se hace un contraste con la revisión global realizada por Saenger y Snedaker (1993) para bosques de Avicennia spp., donde la menor tasa presentada fue de 1.94 t/ha/año (Australia) y la mayor de 14 t/ha/año (Malaysia y Australia). Si bien las tasas (t/ha/año) de los diferentes componentes de la hojarasca (hojas, flores, frutos, madera) en Chengue presentaron valores dentro del rango de variación con respecto al paralelo efectuado, la mayoría tendieron a ubicarse entre las más bajas (Tabla 5). Esta condición de baja producción del rodal de A. germinans de Chengue en el contexto de la comparación hecha es admisible, teniendo en cuenta que la producción de hojarasca de los manglares varía de acuerdo con diversos factores, tales como la amplitud y penetración de la marea, estructura del bosque, niveles de salinidad en el suelo, subsidios de agua dulce, condiciones climáticas imperantes, latitud, entre otros (Cintrón y Schaeffer-Novelli, 1983; Twilley et al., 1986; Prahl, 1990; Saenger y Snedaker, 1993; Lacerda et al., 2001). Además, las bajas tasas halladas se ajustan al concepto tradicional de que la producción de hojarasca es función del intercambio e intensidad de los aportes de agua dulce (cf. Cintrón y Schaeffer-Novelli. 1983 y Twilley et al., 1986), considerando que en Chengue los manglares se desarrollan con pocas contribuciones de agua dulce (Rodríguez-Ramírez y Garzón-Ferreira, 2003).
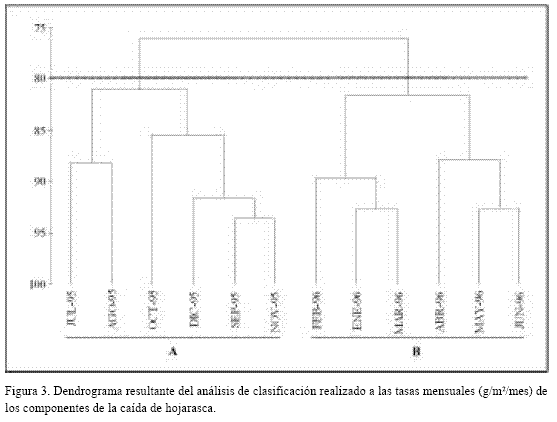
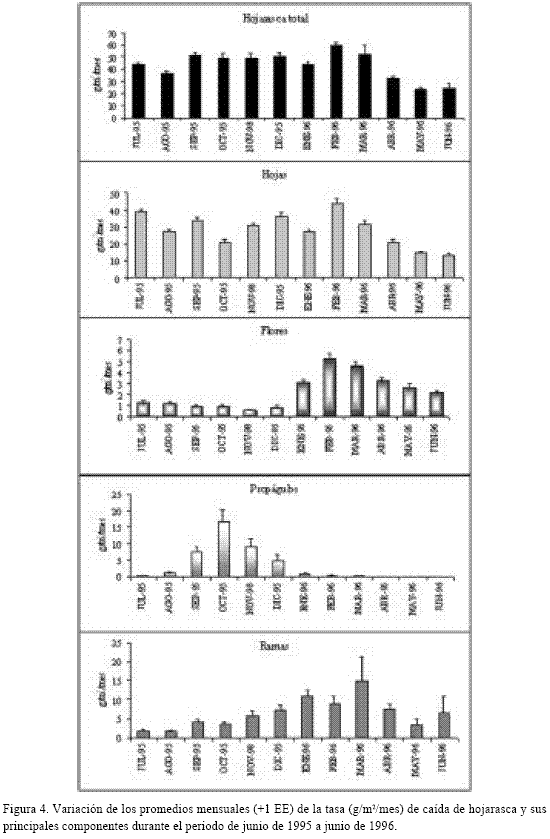
El análisis de clasificación con un nivel de corte del 80% de similaridad reveló que los componentes de la caída de hojarasca se segregan en dos grupos (Figura 3) de meses muy semejantes entre sí. El primero (grupo A) incluyó los meses de mayor precipitación (julio a diciembre de 1995) y el segundo (grupo B) congregó meses característicos de la época seca (enero a junio de 1996). En consecuencia, se sugiere un patrón temporal de producción para los componentes de la caída de hojarasca asociado a las épocas climáticas del área. Al recalcular los promedios de la caída de hojarasca y sus componentes conforme con los grupos propuestos por el análisis de clasificación, el esquema en un período anual sería el siguiente: durante la estación lluviosa son mayores las contribuciones de hojarasca total, hojas y propágulos, mientras que en la época seca disminuyen los aportes de todos éstos y se incrementa la producción de flores y ramas (Tabla 6).
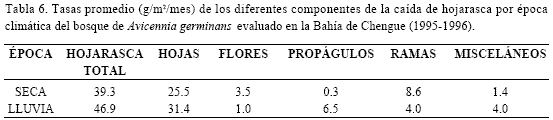
Al analizar por separado los comportamientos de los principales componentes de la hojarasca durante el año evaluado, se encuentran algunas características adicionales y ciertos patrones relacionados con los factores ambientales, y se pueden explicar algunas tendencias particulares. Las tasas mensuales de caída de total de hojarasca (TH) y de hojas (H) se caracterizaron por presentar picos de mínima (TH=23.4; H=13.6 g/m2/mes en mayo/96) y máxima producción (TH=59.4; H=44.1 g/m2/mes en febrero/96), por no ser estables a lo largo del año y por registrar un notorio descenso durante los tres últimos meses de muestreo (abril a junio de 1996; Figura 4). Patrones temporales en la caída de hojarasca y hojas para A. germinans han sido observados en otros estudios, con una tendencia general que indica que la mayor producción se relaciona con la estación lluviosa (Twilley et al., 1986; Day et al., 1988; Ochoa et al., 1988). Aunque en Chengue el patrón de variación anual para la hojarasca y hojas no se asoció claramente con la temporada de lluvias (ver correlaciones Tabla 7), sí lo hizo con salinidad del suelo, debido a que los máximos valores mensuales de esta variable coincidieron en general con las más bajas tasas de producción (Tabla 8; Figura 4). Adicionalmente, se halló un alto coeficiente negativo entre producción de hojarasca y salinidad intersticial (-0.74 Tabla 7), lo cual es una muestra de la asociación entre el régimen hídrico (temporada de lluvias) y la producción de hojarasca y hojas.

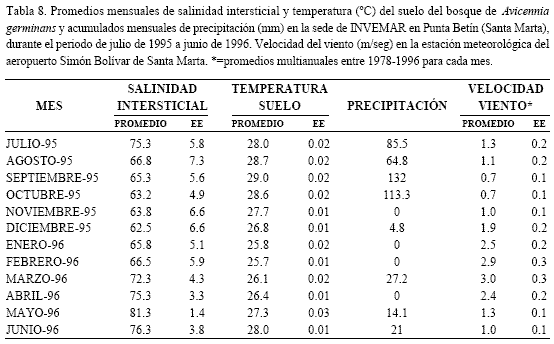
En contraste las tasas de madera, flores, y propágulos tuvieron un comportamiento claramente estacional (Figura 4) y además estos dos últimos definieron los periodos reproductivos para el bosque de A. germinans de Chengue como se describe a continuación. La floración comprende los meses de enero a junio, con un pico máximo en febrero (5.3 g/m2/mes), cuando es predominante la estación seca; en los demás meses del año la producción de flores exhibió valores bajos, con un mínimo de 0.6 g/m2/mes en noviembre (Figura 4). El periodo de fructificación (abscisión de propágulos) abarca la estación lluviosa, desde agosto hasta un poco más allá del final de la misma, en el mes de diciembre, con una tasa máxima de producción de 16.4 g/m2/mes en octubre; en general durante el resto del año la producción de propágulos fue exigua y en algunos meses nula (Figura 4). Los periodos de floración y fructificación hallados son acordes con los resultados para otros estudios en el Caribe colombiano (Castañeda, 1998; Gil Torres, 1998; Lema Vélez et al., 2003) y con bosques de Avicennia spp. en México y Costa Rica (López-Portillo y Ezcurra, 1985; Jiménez, 1990). Las épocas de fructificación de Avicennia germinas en la estación lluviosa y de floración en la seca se ajustan claramente a un ciclo reproductivo, de manera que el éxito de los procesos de germinación, desarrollo de los propágulos y su posterior caída del árbol progenitor (A. germinans es vivípara) pueda llevarse a cabo precisamente durante la temporada de lluvias; esto último como una estrategia de los manglares para aprovechar las condiciones favorables de esta época (bajas salinidades, disponibilidad de nutrientes) y así aumentar las probabilidades de sobrevivencia de las semillas (McMillan, 1971; Jiménez, 1990). Un indicativo de esto es la correlación negativa hallada entre caída de propágulos y la salinidad intersticial (-0.64 Tabla 7) en Chengue. Por su parte, el importante coeficiente de correlación (0.85 Tabla7) entre la tasa de caída de flores y la velocidad del viento pone de manifiesto la influencia de este factor en la producción de flores, seguramente como un agente mecánico que facilita la abscisión.
De otro lado, la caída de ramas (madera) tuvo su mayor aporte durante la estación seca, entre diciembre y abril, con un pico en el mes de marzo -14.8 g/m2/mes-; los mínimos valores se presentaron en julio y agosto -1.7 g/m2/mes- (Figura 4). Un patrón similar fue determinado para el bosque de R. mangle de Chengue, el cual se relacionó con los fuertes vientos de esta estación climática, que por acción mecánica, facilitan el desprendimiento de ramas y el consecuente incremento en la hojarasca (Rodríguez-Ramírez y Garzón-Ferreira, 2003). Como se aprecia en la tabla 8, los meses de enero a abril son tradicionalmente los de mayor intensidad de vientos en la región, y en particular, se ha registrado que marzo ha sido el de mayor velocidad de vientos, mes en el cual se encontró la mayor tasa de producción de ramas (Figura 4). En concordancia con esto, los análisis señalaron una alta correlación entre estas dos variables (0.82 Tabla 7).
Aunque también se encontraron altos coeficientes de correlación (Tabla 7) entre la temperatura del suelo y las tasas de aporte de flores (-0.80) y caída de ramas (-0.80), no se halló información que mencionara algo al respecto. Se presume entonces que no hay ningún tipo de relación de causalidad entre estas variables. La interpretación sugerida simplemente sería que la variación de la temperatura del suelo indica de manera indirecta la conexión entre el comportamiento del aporte de estos dos componentes y el régimen climático.
Pese a que toda la información suministrada en cuanto a la producción de hojarasca y aspectos fenológicos, permitió caracterizar este rodal de Avicennia germinans en un ciclo anual y además, ampliar su conocimiento, se recomienda realizar evaluaciones adicionales para determinar posibles variaciones interanuales, debido a que para la formación de Rhizophora mangle que colinda con ella se han establecido algunas fluctuaciones de este tipo (Rodríguez-Ramírez y Garzón-Ferreira, 2003). En este sentido, y teniendo en cuenta que es una de las pocas formaciones de borde sometidas a condiciones de baja pluviosidad en el Caribe colombiano y de las más representativas del parque Tayrona, sería conveniente implementar una estación de monitoreo de algunos atributos estructurales y funcionales.
AGRADECIMIENTOS
Este trabajo fue posible gracias al apoyo logístico y financiero del Instituto de Investigaciones Marinas y Costeras (INVEMAR) y el programa internacional Caribbean Coastal Marine Productivity (CARICOMP). Un agradecimiento especial a nuestros colegas de INVEMAR Jorge Restrepo y Laura Perdomo por la bibliografía y la información proporcionada de la base de datos de los manglares de la CGSM. A Jaime Polanía (Universidad Nacional de Colombia, sede San Andrés) por sus comentarios y material bibliográfico.
BLIBLIOGRAFÍA
Álvarez-León, R., G. Ramírez-Triana y E. Wedler. 1995. Registro de las condiciones ambientales de la Laguna Sur (Bahía de Chengue, Caribe colombiano) entre 1981-1984. Rev. Acad. Colomb. Cienc., 19(74): 509-525. [ Links ]
Botero, L. 1990. Massive mangrove mortality on the Caribbean coast of Colombia. Vida Silvestre Neotropical, 2(2):77-78. [ Links ]
Cardona , P. y L. Botero. 1998. Soil characteristics and vegetation structure in a heavily deteriored mangrove forest in the Caribbean Coast of Colombia. Biotropica, 30(1):24-34. [ Links ]
CARICOMP. 1997. Structure and productivity of mangrove forests in the greater Caribbean region. Proc. 8th Int. Coral Reef Symp., 1:669-672. [ Links ]
______.2001. CARICOMP methods manual, levels 1 and 2. Centre for Marine Sciences, Univ. West Indies, Kingston, 91 p. [ Links ]
Castañeda, E. 1998. Fenología reproductiva de Avicenia germinans y Rhizophora mangle en el delta exterior del Río Magdalena- Ciénaga Grande de Santa Marta, Caribe colombiano. Tesis de Biología Marina, Universidad Jorge Tadeo Lozano, Santa Marta, 118 p. [ Links ]
Cintrón, G. y Y. Schaeffer-Novelli. 1983. Introducción a la ecología del manglar. UNESCO, Montevideo, 109 p. [ Links ]
______.1984. Methods for studying mangrove structure: 91-113. En Snedaker S.C. y J.G. Snedaker (Eds.). The mangrove ecosystem: research methods. UNESCO. Monographs on Oceanographic Methodology N° 8. UNESCO, Paris, 251 p. [ Links ]
______.1992. Ecology and management of new world mangroves: 233-258. En Seeliger U. (Ed.). Coastal plant communities of Latin America. Academic Press, Inc. San Diego, 392 p. [ Links ]
Cintrón, G., C. Goenaga y A.E. Lugo. 1980. Observaciones sobre el desarrollo del manglar en costas áridas. Memorias del seminario estudio científico e impacto humano en el ecosistema de manglares. UNESCO, Montevideo: 18-32. [ Links ]
Clarke K.R. y R.M. Warwick. 2001. Change in marine communities: an approach to statistical analysis and interpretation. 2nd edition. PRIMER-E: Plymouth, UK. [ Links ]
Day, J.W. Jr., W.H. Conner, R.H. Day, F. Ley-Lou y A. Machado. 1988. Productivity and composition of mangrove forest at Boca Chica and Estero Pargo: 237-257. En Yáñez-Arancibia, A. y J.W. Day Jr. (Eds.). Ecología de los ecosistemas costeros en el sur del Golfo de México: La región de la Laguna de Términos. Universidad Autónoma de México, México, 518 p. [ Links ]
Duke, N.C. 1992. Mangrove floristics and biogeography: 63-100. En Robertson, A.I. y D.M. Alongi (Eds.): Tropical mangrove ecosystems. Coastal and estuarine studies, 41. American Geophysical Union, Washington, D.C., 329 p. [ Links ]
Ellison, J. 1997. Mangrove community characteristics and litter production in Bermuda: 8-17. En Kjerfve B., L. D. de Lacerda y E. H.S. Diop (Eds.): Mangrove ecosystem studies in Latin America and Africa. UNESCO, Francia, 349 p. [ Links ]
FAO. 1994. Directrices para la ordenación de los manglares. Estudio FAO Montes, No. 117. Forest Service, U.S. Department of Agriculture/FAO, Santiago de Chile, 345 p. [ Links ]
Fromard, F., H. Puig, E. Mougin, G. Marty, J.L. Betoulle y L. Cadamuro. 1998. Structure, above-ground biomass and dynamics of mangrove ecosystems: new data from French Guiana. Oecologia, 115:39-53. [ Links ]
García, C. 1994. Quantitative data on the forest structure of a small mangrove formation in the bay of Nenguange, Colombian Caribbean. An. Inst. Mar. Punta Betín, 23:183-187. [ Links ]
Garzón-Ferreira, J. 1998. Bahía de Chengue, Parque Natural Tayrona, Colombia: 115-126. En Kjerfve, B. (Ed.). CARICOMP-Caribbean coral reef, seagrass and mangrove sites. Coastal region and small island papers 3, UNESCO, Paris, 345 p. [ Links ]
Garzón-Ferreira, J. y M. Cano. 1991. Tipos, distribución, extensión y estado de conservación de los ecosistemas marinos costeros del Parque Nacional Natural Tayrona. Informe Técnico, INVEMAR, Santa Marta, 82 p. [ Links ]
Gil Torres, W.O. 1998. Fenología y regeneración natural de los manglares del Caribe continental de Colombia:1996-1998. Ministerio del Medio Ambiente. OCOFORE-OIMT. Informe Técnico No. 25, 89 p. [ Links ]
IDEAM, 1995. Pronóstico de pleamares y bajamares. Costa Caribe Colombiana 1995. Instituto de Hidrología, Meteorología y Estudios Ambientales. Bogotá, 91 p. [ Links ]
______.1996. Pronóstico de pleamares y bajamares. Costa Caribe Colombiana 1996. Instituto de Hidrología, Meteorología y Estudios Ambientales. Bogotá, 95 p. [ Links ]
Jiménez, J.A. 1990. The structure and function of dry weather mangroves on the Pacific coast of Central America, with emphasis on Avicennia bicolor forests. Estuaries, 13(2):182-192. [ Links ]
Lacerda, L.D., J.E. Conde, B. Kjerfve, R. Álvarez-León y J. Polanía. 2001. American mangroves: 1-62. En Lacerda, L.D (Ed.). Mangrove Ecosystems. Function and management. Springer-Verlag, Berlin, Heidelberg, New York, Barcelona, Hong Kong, London, Milan, Paris, Tokyo, 292 p. [ Links ]
Lema Vélez, L.F.; J. Polanía y L.E. Urrego Giraldo. 2003. Dispersión y establecimiento de las especies de mangle del Río Ranchería en el período de máxima fructificación. Rev. Acad. Colomb. Cienc., 27(102):93-103. [ Links ]
López-Portillo, J. y E. Ezcurra. 1985. Litter fall of Avicennia germinans L. in a one-year cycle in a mudflat at the Laguna de Mecoacan, Tabasco, Mexico. Biotropica, 17:186-190. [ Links ]
Márquez, G.E. y G. Guillot. 1983. La vegetación marina del Parque Nacional Tayrona, costa Caribe colombiana, II: Tipos de vegetación. An. Inst. Inv. Mar. Punta Betín, 13:17-51. [ Links ]
McMillan, C. 1971. Environmental factors affecting seedling establishment of the black mangrove on the central Texas coast. Ecology, 52(5): 927-930. [ Links ]
Ochoa Bejarano, G. 1988. Algunas características funcionales del manglar de la Ciénaga Grande de Santa Marta, con énfasis en Rhizophora mangle y Avicennia germinans. Tesis de Biología, Universidad del Valle, Cali, 143 p. [ Links ]
Ochoa, G., H. von Prahl y G. Manjares. 1988. Algunas características funcionales del manglar de la Ciénaga Grande de Santa Marta, con énfasis en Rhizophora mangle y Avicennia germinans. Memorias del VI Seminario Nacional de Ciencias del Mar, CCO, Bogotá: 488-499. [ Links ]
Pinto-Nolla, F. 1999. Sucesión y fisionomía de los manglares de Colombia. Rev. Acad. Colomb. Cienc., 23 Supl. Esp.:141-161. [ Links ]
Pool, D.J. y A.E. Lugo. 1973. Litter production in mangrove: G1-G35. En Pool, D.J., S.C. Snedaker y A.E. Lugo (Eds.). The role of mangrove ecosystem in the maintenance of environmental quality and a high productivity of desirable fisheries. Final Report. Centre for Aquiatic Sciences, USA. [ Links ]
Pool, D.J., S.C. Snedaker y A.E. Lugo. 1975. Structure of mangrove forests in Florida, Puerto Rico, México and Costa Rica. Memorias del II Simposio Latinoamericano sobre Oceanografía Biológica, Universidad de Oriente, Venezuela, 1:49-77. [ Links ]
Prahl, H. von. 1990. Manglares. Villegas Editores, Bogotá, 203 p. [ Links ]
Rodríguez-Ramírez, A. y J. Garzón-Ferreira. 2003. Monitoreo de arrecifes coralinos, pastos marinos y manglares en la Bahía de Chengue (Caribe colombiano). INVEMAR, Serie de Publicaciones Especiales No. 8, Santa Marta, 170 p. [ Links ]
Saenger, P. y S.C. Snedaker. 1993. Pantropical trends in mangrove above-ground biomass and annual litterfall. Oecologia, 93:293-299. [ Links ]
Sánchez-Páez, H., R. Álvarez-León, F. Pinto-Nolla, A.S. Sánchez-Alférerz, J.C. Pino-Renjifo, I. García-Hansen y M.T. Acosta-Peñaloza. 1997. Diagnóstico y zonificación preliminar de los manglares del Caribe de Colombia. Ministerio del Medio Ambiente, Bogotá, 511 p. [ Links ]
Serrano, L.A. 1995. Evaluación de la estructura del manglar en zonas sometidas a tensión por la alteración del equilibrio hídrico en el delta exterior del Río Magdalena -Ciénaga Grande de Santa Marta- Caribe colombiano. Tesis de Biología, Universidad del Valle, Cali, 81 p. [ Links ]
Serrano, L.A, L. Botero, P. Cardona y J.E. Mancera-Pineda. 1995. Estructura del manglar en el delta exterior del Río Magdalena –Ciénaga Grande de Santa Marta- una zona tensionada por alteraciones del equilibrio hídrico. An. Inst. Invest. Mar. Punta Betín, 24:135-164. [ Links ]
Smith, T.J. 1992. Forest structure: 101-136. En Robertson, A.I. y D.M: Alongi (Eds.). Tropical mangrove ecosystems. Coastal and estuarine studies, 41. American Geophysical Union, Washington, D.C., 329 p. [ Links ]
Twilley, R.R., A.E. Lugo y C. Patterson-Zucca. 1986. Litter production and turnover in basin mangrove forests in Southwest Florida. Ecology, 67(3):670-683. [ Links ]
UNESCO. 1985. The International system of units (SI) in oceanography. UNESCO Technical Papers No. 45, IAPSO Pub. Sci. No. 32. Paris, France. [ Links ]
Woodroffe, C. 1992. Mangrove sediments and geomorphology: 7-41. En Robertson, A.I. y D.M: Alongi (Eds.). Tropical mangrove ecosystems. Coastal and estuarine studies, 41. American Geophysical Union, Washington, D.C., 329 p. [ Links ]
Zamorano, D. 1983. Productividad del manglar y su importancia para el pelagial de la Ciénaga Grande de Santa Marta. Tesis M.Sc. Biología Marina, Universidad Nacional de Colombia. Santa Marta, 124 p. [ Links ]
FECHA DE RECEPCIÓN: 16/12/03 FECHA DE APROBACIÓN:01/10/04
DIRECCIÓN DE LOS AUTORES:
Instituto de Investigaciones Marinas y Costeras (INVEMAR). A.A. 1016, Santa Marta, Colombia. E-mail: betorod@invemar.org.co (A.R.R.), jniviar@yahoo.com (J.N.R.), jgarzon@invemar.org.co (J.G.F.).













