Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.34 no.1 Santa Marta Dec. 2005
INDUCCIÓN DE LA MADUREZ GONADAL DEL PARGO PALMERO LUTJANUS ANALIS (PISCES: LUTJANIDAE) MEDIANTE LA APLICACIÓN DE UN FOTOTERMOPERIODO ARTIFICIAL DE ACONDICIONAMIENTO
Induction of gonadal maturity in the mutton snapper Lutjanus analis (Pisces:Lutjanidae) by the application of an artificial phototermal conditioning cycle.
Julián Botero-Arango 1Fabio Castaño-Rivera2
1 Corporación Centro de Investigación de la Acuicultura de Colombia CENIACUA). Laboratorio de Punta Canoa, A.A. 2877, Cartagena, Colombia.
E-mail:jbotero@terra.com.co
2 Corporación Centro de Investigación de la Acuicultura de Colombia CENIACUA). Laboratorio de Punta Canoa, A.A. 2877, Cartagena, Colombia.
E-mail:ceniacua@ctgred.net.co
RESUMEN
Un grupo experimental (N=7) de tres hembras y cuatro machos adultos de pargo palmero Lutjanus analis capturados en el medio natural, cuyo desarrollo gonadal había entrado en estado de latencia debido a su confinamiento en el laboratorio, fue sometido a un ciclo de fototermoperiodo artificial de 10 meses entre octubre de 2001 y julio de 2002 para desbloquear y estimular nuevamente su maduración sexual. Como control se utilizó un grupo de igual número de peces, los cuales fueron mantenidos durante el mismo tiempo sin manipulación de los parámetros de temperatura y fotoperiodo. Después de ocho meses las tres hembras del grupo experimental mostraron signos positivos de desarrollo gonadal, alcanzando sus oocitos diámetros medios (Ø) de 122 ± 76; 86 ± 40; y 122 ± 87 µm respectivamente. Durante el décimo mes una hembra del mismo grupo alcanzó el estado III de desarrollo gonadal (Ø = 327 ± 67 µm) y fue inducida a la maduración final y desove mediante una única inyección de 1.000 UI/kg de GCH. El desove ocurrió 64 h después de la inyección con aproximadamente 25.000 huevos (Ø = 713 ± 56 µm) que alcanzaron el estado de gástrula temprana 4:35 h después de la fertilización. El ciclo de fototermoperiodo artificial aplicado mostró ser efectivo para desbloquear y estimular el desarrollo gonadal de los peces cautivos, resultado preliminar que debe ser confirmado con próximas investigaciones, y que podría constituirse en un importante paso en el desarrollo de una tecnología para la reproducción artificial del pargo palmero.
PALABRAS CLAVE: Pargo palmero, Lutjanus analis, Fototermoperiodo artificial, Maduración sexual.
ABSTRACT
An experimental group (N=7) of three females and four males of mutton snapper Lutjanus analis captured in the wild, whose gonadal development entered in a state of latency because of its confinement in the lab, was maintained under an artificial photothermal cycle of 10 months between October 2001 and Bol. Invest. Mar. Cost. 34 69-79 ISSN 0122-9761 Santa Marta, Colombia, 2005 July 2002 in order to unblock and estimulate again their sexual maturation. Another group of equal number of fish was used as a control, being maintained during the same time without manipulation of temperature and photoperiod parameters. After eight months the three females of the experimental group showed positive gonadal development signs, their oocyte mean diameters (Ø) reaching 122 ± 76; 86 ± 40; and 122 ± 87 µm respectively. During the tenth month one female reached the state III of gonadal development (Ø = 327 ± 67 µm) and was induced to final maturation and spawning by a single injection of 1,000 IU/kg of HCG. The spawning occurred 64 h after the injection with approximately 25,000 eggs (Ø = 713 ± 56 µm) which reached the early gastrula stage 4:35 h after fertilization. The artificial photothermal cycle applied showed to be effective to unblock and stimulate gonadal development of the captive fish, preliminary result that must be confirmed by further research and which could constitute an important step in the development of a technology for the artificial reproduction of the mutton snapper.
KEY WORDS: Mutton snapper, Lutjanus analis, Artificial photothermal cycle, Sexual maturation.
INTRODUCCIÓN
El pargo palmero Lutjanus analis Cüvier, 1828 se encuentra en el Atlántico Occidental tropical, desde el noreste de los Estados Unidos (Massachusetts) hasta el sureste del Brasil, incluyendo aguas afuera de sur de Florida, Bahamas, el Mar Caribe y el Golfo de México (Cervigón, 1993). Está ampliamente distribuido en el Caribe colombiano, donde presenta gran importancia comercial a nivel regional y posibilidades de exportación, así como condiciones favorables para su cultivo (Wedler et al., 1980; Cervigón, 1983; Acero y Garzón, 1985; Thouard et al., 1989). En la actualidad el pargo palmero ha sido introducido dentro del Libro Rojo de Peces Marinos de Colombia bajo la categoría de NT (Near Threatened o "Casi Amenazado") y a nivel mundial esta categorizado como "Vulnerable" dentro de la Lista Roja de Especies Amenazadas de la IUCN (Acero et al., 2002).
En marzo de 1999 se inició en la "Corporación Centro de Investigación de la Acuicultura de Colombia (CENIACUA)" un programa de investigaciones para lograr la reproducción artificial del pargo palmero. Sin embargo, la aparición del virus de la mancha blanca o WSSV (White Spot Syndrome Virus) hizo imposible introducir directamente al laboratorio los reproductores maduros de pargo capturados en el medio natural, ya que estos podrían llevar adheridos a sus cuerpos parásitos vectores del virus que podrían afectar los programas de selección genética de camarón que allí se desarrollan. Por esta razón los peces fueron sometidos previamente a una estricta cuarentena en instalaciones independientes, lo cual produjo en ellos una latencia de su maduración sexual, fenómeno que se ha explicado y descrito en detalle para otros casos en trabajos como los de Cleary y Pankhurst (2000), Kubokawa et al. (1999), Tucker (1998), Bromage (1995) y Campbell et al. (1994).
Mediante el presente trabajo se diseñó y se puso en práctica un ciclo o "fototermoperiodo" artificial de acondicionamiento en el laboratorio, manipulando el fotoperíodo y la temperatura en los tanques de mantenimiento y desove, con el cual fue posible desbloquear y restablecer el proceso de maduración gonadal de los reproductores que se encontraba en latencia por las condiciones de estrés sufridas durante su captura y cautiverio.
METODOLOGÍA
Captura y mantenimiento de los reproductores
Los reproductores de pargo palmero fueron capturados en el Bajo de Canceco y en las Islas del Rosario (Bolívar, Caribe colombiano) mediante el uso de líneas de mano con anzuelos y palangre. Después de su captura fueron llevados a un recinto aislado donde fueron sometidos individualmente a cuarentena de 30 días en tanques plásticos de 2.000 L. La aireación fue suministrada mediante un compresor portátil y el agua fue recirculada constantemente a través de un biofiltro de arena fluidizada y recambiada cada tres días. Finalizada la cuarentena los reproductores fueron introducidos al laboratorio en un tanque de fibra de vidrio con 40 T de agua marina para acostumbrarlos a las condiciones normales (no manipuladas) de temperatura y fotoperiodo. Se alimentaron diariamente a saciedad con calamar, pescado y camarón congelados, dieta que contenía un 47 % de proteína bruta. Cada tercer día se suministró adicionalmente un suplemento vitamínico y mineral elaborado en el laboratorio.
Conformación de los grupos de reproductores
Los reproductores capturados, cuya longitud sobrepasaba en todos los casos las Tallas Medias de Madurez (TMM) reportadas por Claro (1981) y Allen (1987), fueron divididos en dos grupos, uno experimental y otro control, en dos tanques de fibra de vidrio de 40 T de capacidad. Cada grupo estuvo compuesto por tres hembras y cuatro machos cuyos pesos variaron entre 1.953 y 2.737 g. El grupo control recibió agua en flujo directo y el del fototermoperiodo artificial con recirculación y biofiltración.
Fototermoperiodos artificial y control
Para el diseño del fototermoperiodo artificial se tuvieron en cuenta algunas técnicas ya ensayadas con éxito en la maduración artificial de la especie (Benetti et al., 2002 y 2003) y en otras especies de lutjánidos (Arnold et al., 1978), como son el comprimir un año calendario en 10 meses de acondicionamiento, simulando durante los últimos tres meses del ciclo condiciones crecientes de luminosidad y temperatura para obtener así la maduración final y desove. Como las temperaturas utilizadas en los casos anteriores pertenecían a zonas más templadas, los valores utilizados para esta experiencia fueron ajustados tomado como referencia la información presentada por Sandoval (1999) para el Golfo de Salamanca (Caribe colombiano), donde se reportó la abundante presencia de reproductores de esta especie. El grupo control fue mantenido bajo el mismo régimen de luz del grupo del fototermoperiodo artificial pero sin manipulación de la temperatura (Tabla 1). Para la manipulación de la temperatura en el ciclo de fototermoperiodo artificial se utilizó un enfriador de agua marina de 120.000 BTU y para el manejo del fotoperiodo, igual para los dos grupos, se utilizaron lámparas fluorescentes de 20 W, colocadas a 50 cm sobre la superficie de los tanques.
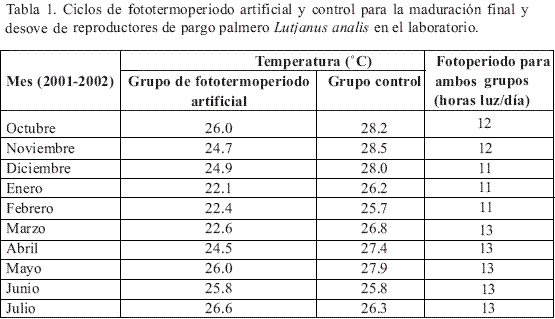
Monitoreo de la maduración
Se realizaron tres muestreos para monitorear la maduración, durante los cuales, los peces fueron anestesiados con 2-fenoxi-etanol a una concentración de 150–200. La madurez gonadal de las hembras fue monitoreada mediante biopsia ovárica, introduciendo una cánula de polietileno de 0.86 mm de diámetro interno y 1.2 mm de diámetro externo por el conducto urogenital y succionando suavemente, según la metodología descrita por Watanabe et al. (1998). Los oocitos se fijaban en formalina al 10% en agua de mar filtrada y se observaban en el estereoscopio. Como hasta la fecha no existía ninguna referencia publicada con una escala de maduración específica para Lutjanus analis, la observación de los diferentes estados se hizo con la guía de la escala propuesta por González y Lugo (1997), la cual consiste en la descripción histológica de cortes transversales de gónadas de Lutjanus purpureus en diferentes estados de madurez gonadal. De cada biopsia se midieron 50 oocitos utilizando un micrómetro ocular con precisión de 50 μm. Los machos se consideraban maduros cuando mediante masaje abdominal expulsaban semen fluido.
Inducción de la maduración final y desove
A las hembras que presentaron oocitos con diámetro mayor a 320 µm se les inyectó una dosis única de gonadotropina coriónica humana (GCH) en concentración de 1.000 UI/kg en la base de la aleta pectoral. Los machos también fueron inducidos con 500 UI/kg, de acuerdo con lo descrito por Clarke et al. (1997). Una vez obtenido el desove, los huevos fertilizados (flotantes) fueron recolectados por rebosamiento en un recipiente con malla de 500 µm. La cuantificación de los huevos se llevó a cabo por el método volumétrico.
Análisis de los datos.
Con la información de peso y talla recolectada durante los muestreos se analizó el Factor de Condición (K = W/L3), el cual sirvió como índice del estado de bienestar y del grado de adaptabilidad de los peces al sistema de confinamiento. Por medio del programa STATGRAPHICS PLUS® se evaluó la normalidad y la homogeneidad de las varianzas de los datos obtenidos a partir de las pruebas de Kolmogorov-Smirnov y Variante Check, fundamentales para realizar las pruebas de regresión lineal entre las variables ambientales y el factor de condición K. Las variables que no se comportaron normalmente fueron transformadas con el logaritmo natural (Ln). Para comparar los cambios del factor de condición entre el grupo experimental y el control se realizó ANOVA de una vía. Los grupos fueron analizados por separado y la significancia estadística de las pruebas fue de P< 0.05, de acuerdo con lo recomendado por Persson et al. (1998).
RESULTADOS
Maduración gonadal de los peces
Durante los meses de octubre de 2001 a febrero de 2002 las hembras de ambos grupos no experimentaron evolución en su madurez gonadal, según el diámetro medio de sus oocitos (Tabla 2). Sólo hasta el mes de mayo de 2002 las tres hembras sometidas al fototermoperiodo artificial mostraron un avance en su madurez (Ø = 86 ± 40 µm a 122 ± 87 µm), a diferencia de las hembras del grupo control. Hacia el final de julio, después de llevar 3 meses incrementando la temperatura y el fotoperiodo hasta valores de 26.6 °C y 13 horas de luz respectivamente, una hembra del fototermoperiodo artificial alcanzó la madurez sexual (Ø = 327 ± 67 µm) y las otras dos tuvieron incremento moderado en el diámetro medio de sus oocitos, aunque no lograron una madurez avanzada.
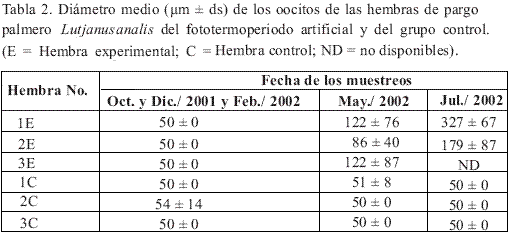
Inducción al desove
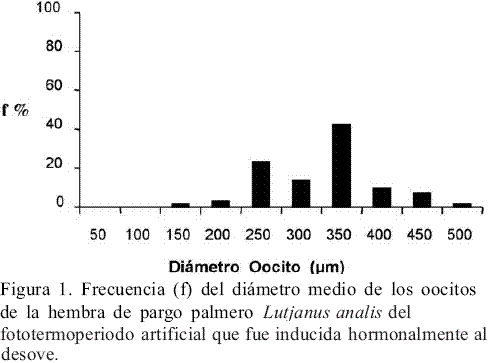
A finales de julio la hembra madura del fototermoperiodo artificial, con peso de 2.318 gr, presentó oocitos en estado de vitelogénesis avanzada con una moda de 350 µm (Figura 1), estando apta para ser inducida hormonalmente al desove. El desove se presentó 64 horas después de la inyección y se recolectaron aproximadamente 25.000 huevos (Ø = 713 ± 56 µm) con un porcentaje de fertilización estimado del 70%. Mediante la observación de los huevos al estereoscopio se determinó que estos alcanzaron el estado de gástrula temprana 4:35 horas después de la fertilización, coincidiendo con la descripción presentada en el trabajo de Borrero et al. (1978).
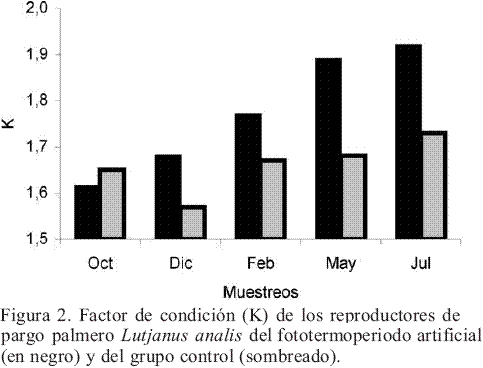
Evolución del Factor de Condición (K)
Durante los primeros meses de acondicionamiento se observó que los peces de ambos grupos no presentaban diferencias significativas en el Factor de Condición (K). Sin embargo, a partir de sexto mes en los peces sometidos a fototermoperiodo artificial se evidenció un incremento significativo (P<0.05) del factor K, el cual se mantuvo hasta el final de la investigación. Los peces del grupo control no presentaron cambios significativos en el K durante todo el proceso (Figura 2).
DISCUSIÓN
Durante los primeros meses de fototermoperiodo artificial, cuando la temperatura y el fotoperiodo se ajustaron con un descenso progresivo, las hembras de este ciclo no experimentaron variación en el diámetro de susoocitos. De acuerdo con Lam (1983), los valores bajos en estos dos parámetros mantienen en estado de "latencia" la maduración gonadal de los peces, preparándolos para un futuro recrudecimiento gonadal, preparación que se caracteriza por una acumulación de reservas de grasa (energía) en la cavidad abdominal. Sólo hasta que se aumentaron la temperatura y el fotoperiodo seobservó un incremento significativo en el diámetro de los oocitos de las tres hembras, lo cual concuerda con lo reportado por Benetti et al. (2002) para la misma especie, Turano et al. (2000) para Ocyurus chrysurus y Arnold et al. (1978) para Lutjanus campechanus, con lo cual puede verse que al menos en estas especies es indispensable un incremento en la temperatura y el fotoperiodo para estimular el desarrollo gonadal y obtener el desove.
Aunque no se tiene hasta la fecha ninguna referencia sobre la estandarización de una escala de madurez sexual para reproductores de Lutjanus analis, de los resultados de esta experiencia puede concluirse que para los oocitos de esta especie obtenidos por vía intraovárica un diámetro medio de 327 ± 67 µm representa un estado de madurez sexual suficiente como para inducir las hembras hormonalmente a la maduración final y desove.
En las hembras del grupo control, donde la temperatura se mantuvo siempre en valores elevados, no se observó variación en el diámetro de los oocitos ni indicios de maduración durante toda la investigación. Pankhurst y Thomas (1998) indican que en los peces las temperaturas elevadas y sostenidas en el tiempo pueden generar una incapacidad del folículo para sintetizar la 17, 20ßP, hormona fundamental para la maduración de la gónada, lo cual explicaría que este parámetro puede constituirse en limitante para la maduración de los reproductores cuando se mantiene en niveles más elevados que en el medio natural.
Del anterior análisis puede concluirse: a) para estimular la madurez gonadal de los reproductores de pargo palmero Lutjanus analis en cautiverio es necesario someterlos primero a un ciclo artificial de acondicionamiento con temperaturas bajas, seguido por un incremento paulatino en la temperatura y el fotoperiodo; b) las magnitudes utilizadas en los valores del fototermoperiodo artificial fueron apropiadas para desbloquear y permitir el proceso de desarrollo gonadal de los reproductores; c) la exposición a temperaturas elevadas durante un prolongado periodo no estimula la maduración gonadal en el pargo palmero, tal como se observó en los reproductores del grupo control.
El desove en la hembra inducida tuvo lugar 64 horas después de aplicada la inyección hormonal, tiempo mucho más largo que el de 33 horas reportado por Watanabe et al. (1998) para Lutjanus analis y 27 y 56 horas reportado para otros peces de la familia como Lutjanus argentimaculatus y L. campechanus respectivamente (Emata et al., 1994; Vernon et al., 1983).Aunque en los dos últimos casos los peces fueron también inducidos con una sola inyección de 1.000 UI/kg. de GCH respectivamente, el diámetro medio de los oocitos en el momento de la inducción era de 400 y 365 µm respectivamente, bastante mayores que el de 327 µm de la hembra inducida enla presente investigación.
Los valores significativamente más elevados del Factor de Condición K en los peces del fototermoperiodo artificial indican que las condiciones ambientales aplicadas en este ciclo produjeron mayor bienestar a los mismos, lo cual se vio reflejado en su recrudecimiento gonadal. El incremento de K en los peces de este grupo se atribuye por tanto a la formación de gónadas, tal como lo describe Oasim (1957) (citado por Rangarajan, 1971), donde explica que las variaciones en el factor de condición son producto del consumo o construcción de las reservas de grasa para la maduración gonadal.
Si bien en este trabajo no se encontraron evidencias estadísticas que relacionen las variables ambientales con el K, no se puede descartar la influencia de éstas sobre el bienestar de los peces, como lo sugiere Rangarajan 1971), quien encontró que las variaciones en el K de Lutjanus kasmira no estaban únicamente influenciadas por el recrudecimiento gonadal sino por otros factores ambientales, ya que los mayores índices se encontraron en animales inmaduros en época de desove. De lo anterior se desprende la hipótesis de que las variables ambientales utilizadas en el fototermoperiodo artificial jugaron un doble papel en la condición de los peces cautivos; por un lado generaron las condiciones necesarias para estimular la maduración gonadal y adicionalmente redujeron los niveles de estrés generados por la captura y el confinamiento, mejorando su bienestar.
AGRADECIMIENTOS
Para la realización de la presente investigación se contó con la colaboración desinteresada y oportuna de investigadores y estudiantes de la Corporación Universitaria de Ciencias Aplicadas y Ambientales (UDCA), así como del personal científico y administrativo de la Corporación Centro deInvestigación de la Acuicultura de Colombia (CENIACUA). Se agradece a la Doctora Marcela Salazar Vallejo por la revisión del manuscrito. La financiación del trabajo fue otorgada por el Instituto Colombiano de Investigaciones Científicas Francisco José de Caldas (COLCIENCIAS) y por la UDCA.
BIBLIOGRAFÍA
1. Acero, A. y J. Garzón. 1985. Los pargos (Pisces: Perciformes: Lutjanidae) del Caribe Colombiano. Actualidades Biológicas, (14): 89-99. [ Links ]
2. Acero, A., L.S. Mejía y M. Santos-Acevedo. 2002. Lutjanus analis: 123-126. En Mejía, L. S. y A. Acero (Eds.): Libro rojo de peces marinos de Colombia. La serie Libros Rojos de Especies Amenazadas de Colombia. Ministerio de Medio Ambiente, Bogotá. [ Links ]
3. Allen, G.R. 1987. Synopsis of the circumtropical fish genus Lutjanus (Lutjanidae): 33-87. En Polovina, J.J. y S. Ralston (Eds.): Tropical snappers and groupers: biology and fisheries management. Westview Press, Boulder,. [ Links ]
4. Arnold, C.R., J.M. Wakeman, T.D. Williams y G.D. Treece. Spawning of red snapper (Lutjanus campechanus) in captivity. 1978. Aquaculture, 15: 301-302. [ Links ]
5. Benetti, D.D., J.A. Matera, O.M. Stevens, J.F. Alarcón, M.W. Feeley, F.J. Rotman, Y. Minemoto, G. Banner-Stevens, J. Fanke, S. Zimmerman y L. Eldridge. Growth, survival and feed conversion rates of hatchery-reared mutton snapper Lutjanus analis cultured in floating net cages.2002. J. Word Aquac. Soc., 33 (3): 349-357. [ Links ]
6. Benetti, D.D., J.F. Alarcón, O.M. Stevens, B. O´Hanlon, J.A. Rivera, G. Banner-Stevens y F.J. Rotman. Advances in hatchery and growout technology of marine finfish candidate species for offshore aquaculture in the Caribbean. 2003. Proceedings of the 54th Annual Meeting, GCFI:54, 473-487. [ Links ]
7. Borrero, M., E. González, N. Millares y T. Damas. Desarrollo embrionario y prelarval de la Biajaiba (Lutjanus synagris Linné, 1758).1978. Rev. Cub. Inv. Pesq., 3(3): 1–28. [ Links ]
8. Bromage, N.R. Broodstock management and seed quality – general considerations: 1995. 1-24. En Bromage, N.R. y R.J. Roberts (Eds.): Broodstock management and egg and larval quality. Blackwell, Oxford, 424 p. [ Links ]
9. Campbell, P.M., T.G. Pottinger and J.P. Sumpter. Preliminary evidence that chronic confinement stress reduces the quality of gametes produced by brown and rainbow trout. 1994.Aquaculture, 120: 151-169. [ Links ]
10. Cervigón, F (Ed.). La acuicultura en Venezuela: estado actual y perspectivas. 1983. Editorial Arte, Caracas, 121 p. [ Links ]
11. ________. Los peces marinos de Venezuela. Segunda edición. Fundación Científica Los Roques,1993. Caracas, Vol. 2, 497 p. [ Links ]
12. Clarke, M.E., M.L. Domeier y W.A. Laroche. Development of larvae and juveniles of the Mutton Snapper (Lutjanus analis), Lane Snapper (Lutjanus synagris) and Yellowtail Snapper (Lutjanus chrysurus).1997. Bull. Mar. Sci., 61(3): 511-537. [ Links ]
13. Claro, R. Ecología y ciclo de vida del pargo criollo Lutjanus analis (Cuvier, 1828) en la plataforma cubana.1981. Acad. Cienc. Instit. Ocean., Inf. Cient. Tec. Cuba, 186, 83 p. [ Links ]
14. Cleary, J.J. y N.W. Pankhurst. The effect of capture and handling stress on plasma steroid levels and gonadal condition in wild and farmer snapper Pagrus auratus (Sparidae).2000.J. Word Aquac. Soc., 31(4): 558-569. [ Links ]
15. Emata, A.C., B. Eullaran y T.U. Bagarinao. Induced spawing and early life description of the mangrove red snapper, Lutjanus argentimaculatus. 1994. Aquaculture, 121: 381-387. [ Links ]
16. González, L.W. y T. Lugo. Ovogénesis de Lutjanus purpureus (Poey, 1867; Pisces: Lutjanidae) de la región oriental de Venezuela.1997. Bol. Inv. Mar. Cost., 26: 53–60. [ Links ]
17. Kubokawa, K., T. Watanabe, M. Yoshioks y M. Iwata. Effects of acute stress on plasma cortisol, sex steroid hormone and glucose levels in male and female sockeye salmon during breeding season. 1999. Aquaculture, 172: 335-349. [ Links ]
18. Lam, T.J. Environmental influences on gonadal activity in fish: 1983.65-116. En Hoar, W.S., D.J Randall and E.M. Donalson (Eds.): Fish Physiology, Vol 9, Reproduction, Part B, Behavior and Fertility Control. Academic Press, New York, 477 p. [ Links ]
19. Pankhurst, N.W. y P.M. Thomas. Maintenance at elevated temperature delays the sterodogenic and ovulatory responsiveness of the rainbow trout Oncorhynchus mykiss to luteinizing hormone releasing hormone analog.1998. Aquaculture, 166: 163-177.
20. Persson, P., K. Sundell, B. Bjornssonö y H. Lundqvist. Calcium metabolism and osmoregulation during sexual maturation of river running Atlantic salmon. 1998. J. Fish. Biol., 52: 334-349. [ Links ]
21. Rangarajan, K. Maturity and spawning of the snapper Lutjanus kasmira from the Andaman Sea. 1971. Indian J. Fish., 18(1-2): 114-125. [ Links ]
22. Sandoval, N. Análisis reproductivo y de fecundidad de dos especies demersales Lutjanus synagris y Lutjanus analis en el Golfo de Salamanca, Caribe colombiano. 1999. Trabajo de grado, Facultad de Ingeniería Pesquera, Universidad del Magdalena, Santa Marta, 89 p. [ Links ]
23. Thouard, E., P. Soletchnik y J.P. Marion. Selection of finfish species for aquaculture development in Martinique (F.W.I.): 499-510.1989. En Fuchs, J., G. Nedelec y E. Gasset (Eds.): Advances in tropical aquaculture, AQUACOP, IFREMER, Tahiti, Actes Colloq. 9. [ Links ]
24. Tucker, J.W. Jr. Marine fish culture. Kluwer Academic Publishers, 1998. London, 750 p. [ Links ]
25. Turano, M.A.J., D.A. Davis y .R. Arnold. Observations and techniques for maturation, spawning, and larval rearing of the yellowtail Ocyurus chrysurus. 2000. J. World Aquac. Soc., 31(1): 59-68. [ Links ]
26. Vernon-Minton, R., J.P. Hawke y V.M. Tatum. Hormone induced spawing of red snapper Lutjanus campechanus. 1983.Aquaculture, 30: 363-368. [ Links ]
27. Watanabe, W.O., E.P. Ellis, S.C. Ellis, J. Chaves, C. Manfredi, R.W. Hagood, M. Sparsis y S. Arneson. Artificial propagation of Mutton Snapper Lutjanus analis, a new candidate marine fish for aquaculture. 1998.J. World Aquac. Soc., 29: 176–187. [ Links ]
28. Wedler, E., J. Palacio, L. Pérez y R. Álvarez. Experiencias preliminares sobre el cultivo de pargos en jaulas flotantes. Memorias del III Simposio Latinoamericano de Acuicultura, IV Seminario Nacional de Acuicultura. ALA/ACUICOL/INDERENA, Cartagena,1980. 11p.













