Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.34 no.1 Santa Marta Dec. 2005
Alida García-Cagide1, Aida Hernández-Zanuy2 y Antonio Cárdenas3
1Instituto de Oceanología, Ministerio de Ciencia Tecnología y Medio Ambiente de Cuba. Ave. 1era y 186 No.18406, Playa, La Habana, Cuba. E-mail:alidagc2003@yahoo.com
2Instituto de Oceanología, Ministerio de Ciencia Tecnología y Medio Ambiente de Cuba. Ave. 1era y 186 No.18406, Playa, La Habana, Cuba. E-mail: aidah@oceano.inf.cu
3Acuario Nacional de Cuba, Ministerio de Ciencia Tecnología y Medio Ambiente de Cuba. Ave. 3ra y calle 62, Miramar, La Habana, Cuba. E-mail: pedroc@acuarionacional.cu
RESUMEN
Se presentan los valores de la fecundidad de los zooides (sumatoria de la cantidad de ovocitos, embriones y larvas en zooides en fase de liberación larval), la fecundidad de la colonia (producto de la fecundidad promedio de los zooides por la cantidad de zooides maduros, liberando larvas y en reabsorción, en colonias en fase de liberación larval) y las características y duración de las primeras fases del desarrollo de la larva de la ascidia, Ecteinascidia turbinata (Ascidiacea: Perophoridae). Las colonias de ascidia fueron colectadas en manglares no estuarinos de la región noroccidental de Cuba. En 200 zooides con 17 mm a 31 mm de longitud, provenientes de 20 colonias colectadas en diferentes meses y lugares, se contaron como promedio 41 ± 12 ovocitos, embriones y larvas. Las colonias que tenían como promedio 163 mm de longitud y 252 zooides, produjeron, en promedio por colonia, 10590 larvas durante cada ciclo de generación-degeneración que dura aproximadamente 40 días. Tanto la fecundidad de los zooides como la de las colonias fueron muy variables en zooides y colonias con estadio reproductivo semejante, pero fue alta la correlación (r=0.84) entre la fecundidad de la colonia y la cantidad de zooides por colonia. Se realizaron dos experimentos, en septiembre y noviembre de 2000, colocándose colonias en fase de liberación larval en acuarios de 10 l de capacidad. La temperatura del agua en los acuarios varió entre 23 y 30 ºC. La mayor liberación de larvas se produjo entre las 10:00 y las 14:00 horas. La larva al salir del zooide progenitor midió, como promedio, 2.7 mm de longitud total (LT). La etapa planctónica de la larva duró de cuatro a ocho horas, alcanzando 3.1 mm LT. El proceso de metamorfosis y fijación de la larva duró de ocho a doce horas. A las 19 horas la larva comienza la alimentación exógena. El zooide juvenil midió entre 1.3 mm y 2.05 mm. Un 9 % de las larvas completaron la metamorfosis.
PALABRAS CLAVE: Ascidia, Ecteinascidia turbinata, Fecundidad, Desarrollo larval, Cuba.
ABSTRACT
Zooids (the total amount of ovocytes, embryos, andlarvae in larval release stage zooids), colonial (zooids mean fecundity per number of mature zooids on resorption or releasing larvae colonies) fecundity and the characteristics and duration of the early larval stages of the ascidian Ecteinascidia turbinata (Ascidiacea: Perophoridae) are given. The ascidian colonies were collected from non-estuarine mangroves in the NW region of Cuba. An average of 41 ± 12 ovocytes, embryos, and larvae were counted in 200 zooids of 17- 31 mm length from 20 colonies gathered during different months and sites. Ascidian colonies of 163 mm length and 252 zooids average produced 10590 larvae as average per colony during each generation-degeneration cycle that lasts about 40 days. Zooids and colonial fecundity were very variable in zooids and colonies with similar reproductive stage, but a high correlation (r = 0.84) between colonial fecundity and number of zooids per colony was found. Ascidian colonies prior to larvae release stage were placed in 10-liter glass aquaria. The experiments were carried out on September and November, 2000. Water temperature ranged between 23 and 30 ºC. The biggest larval release took place between 10:00 and 14:00 h. Average total length (TL) of larvae leaving the parental zooid was 2.7 mm. The larvae planktonic stage lasted 4 to 8 hours, attaining 3.1 mm (TL). Metamorphosis and larvae settlement lasted 8 to 12 hrs, and exogenous feeding began at 19 hrs. The juvenile zooid measured between 1.3 and 2.05 mm, and 9 % of the larvae completed the metamorphosis.
KEY WORDS: Ascidian, Ecteinascidia turbinata, Fecundity, Larval development, Cuba.
INTRODUCCIÓN
Ecteinascidia turbinata Herdman, 1880 es una ascidia colonial, hermafrodita simultánea, ovovivípara, que se reproduce simultáneamente de forma asexual y sexual y tiene una larva lecitotrófica de corta vida y dispersión localizada (Simkins, 1924; Berrill, 1975; Cloney, 1987; Svane y Young, 1989; Bingham y Young, 1991). En Cuba esta especie habita preferentemente asociada a la raíz del mangle rojo (Rhizophora mangle) y se reproduce durante todo el año (Hernández- Zanuy et al., 2000), siendo muy abundante en los manglares de cayos, donde se han estimado densidades cercanas a una colonia por metro lineal de manglar (Hernández-Zanuy, 2004; Hernández-Zanuy et al., en prensa).
En la tesis doctoral de Iglesias (2000) se estudian aspectos de la biología y ecología de esta especie. Se describen las características del desarrollo y la conducta de la larva en condiciones controladas de laboratorio, con agua de mar preparada y control de temperatura, y la fecundidad en el medio natural, en aguas del Mediterráneo (Iglesias, 2000). Con anterioridad otros autores habían aportado datos sobre la anatomía y tamaño de los ovocitos, los embriones y las larvas (Simkins, 1924; Berrill, 1935; Van Name, 1945; Cloney, 1990; Hernández-Zanuy et al., 2000), la conducta larvaria (Young, 1986) y el efecto de bajas salinidades sobre la metamorfosis de larva (Vázquez y Young, 2000). Morgan (1977) describió aspectos del ciclo de vida y aportó datos sobre la fecundidad de E. turbinata en aguas del Caribe y Carballo (2000) estimó el potencial reproductivo (larvas/m2) de la especie en un área semicerrada en la Isla de Formentera (Mar Mediterráneo), planteando que las poblaciones se autorreclutan, lo cual mantiene altas densidades de poblaciones en los lugares apropiados para el desarrollo de la especie.
El objetivo del trabajo es conocer la duración y características de las primeras fases del desarrollo de la larva con vista a completar un aspecto importante del ciclo de vida de esta especie en Cuba, y calcular la fecundidad de los zooides y las colonias de E. turbinata en manglares de cayos de la región noroccidental de Cuba, lo cual proporcionaría información básica para estimar el potencial reproductivo de la especie.
MATERIALES Y MÉTODOS
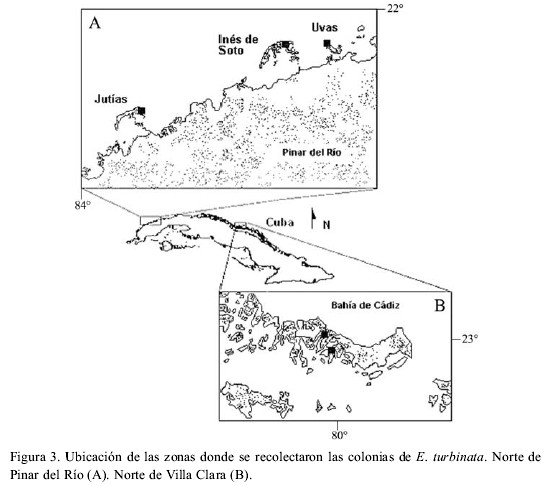
En este trabajo se define como fecundidad de los zooides a la sumatoria del número de ovocitos, embriones y larvas en zooides en estadio de liberación larval (Figura 1), y fecundidad de las colonias al producto de la fecundidad promedio de diez zooides por la cantidad de zooides maduros, liberando larvas y en reabsorción (Figura 2), que se encuentran en las colonias de E. turbinata en fase de liberación larval, considerando que son éstos zooides los que producen larvas en un ciclo de generación-degeneración de la colonia (Hernández-Zanuy et al., 2000). Para calcular la fecundidad de los zooides se analizaron 200 zooides procedentes de 20 colonias (diez zooides seleccionados al azar por colonia) recolectadas durante los meses de junio, octubre y noviembre del año 2000 y febrero de 2001, en los manglares de los cayos Inés de Soto, Uvas y Jutías, en la costa NW de Cuba (Figura 3A). A cada colonia, antes de extraerla de su medio natural, se le estimó el porcentaje de cubrimiento sobre la raíz de mangle y se le midió la longitud (todo el tramo de la raíz de mangle con zooides) con una cinta graduada en milímetros (relacionándose estos dos valores para calcular la longitud real de la colonia). Las colonias fueron transportadas en bolsas de polietileno con agua de mar hasta el bote, donde inmediatamente se colocaron en frascos de cristal y se preservaron en formaldehído al 4% preparado con agua de mar y neutralizado con tetraborato de sodio.
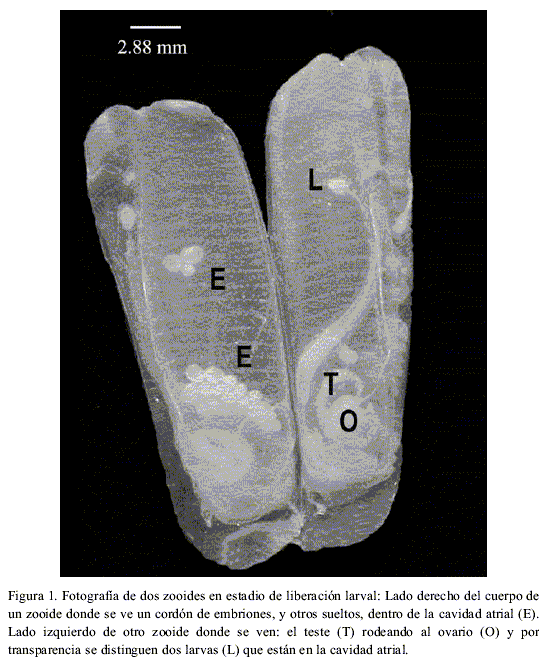
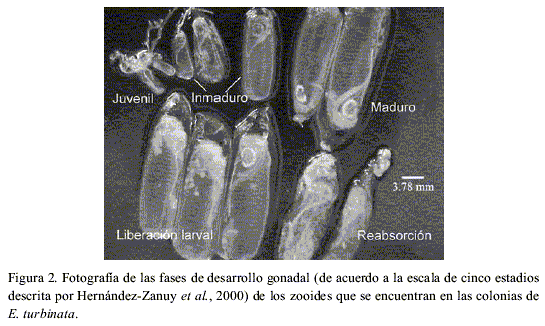
En el laboratorio a diez zooides en estadio de liberación larval por colonia se les midió la longitud, desde la unión del pedúnculo y la base de la túnica hasta la escotadura entre los dos sifones, con un microscopio estereoscópico con lente objetivo 1.6 y oculares 10X con escala micrométrica. Para contar los embriones y larvas se utilizó un lente objetivo de 2 y para los ovocitos un lente objetivo de 4, en ambos casos con oculares de 10X.
Para tener una muestra más representativa del tamaño de las colonias, el número de zooides por colonia y la cantidad de embriones y larvas por zooide, se procesaron los datos de 159 colonias en diferentes fases de desarrollo recolectadas mensualmente, de mayo a noviembre de 1998, en dos estaciones al norte de Pinar del Río (Canal del Inglés en el Cayo Inés de Soto y Punta Lavandera en Cayo Uvas), y 147 colonias colectadas en dos puntos del Canal de Ranchería, Cayo Bahía de Cádiz, al norte de Villa Clara (Figura 3B).
En este caso se seleccionaron al azar 15 zooides por colonias, a los cuales se les midió la longitud con una regla milimetrada y visualmente se les contó el número de embriones y larvas.
Se determinaron las relaciones porcentuales del número de ovocitos, embriones y larvas por zooide, y la cantidad de zooides en diferentes estadios de desarrollo gonadal por colonia. Se estimó el potencial reproductivo de la población (larvas/m de costa de manglar) con base en la densidad promedio de colonias por metro de costa de manglar, por la fecundidad promedio de los zooides y por el promedio de zooides en las colonias reproductoras. Este valor se multiplicó por nueve teniendo en cuenta los ciclos de generacióndegeneración de la colonia que se producen en un año.
La normalidad de los datos se verificó con la prueba Kolmogorov- Smirnov y la homogeneidad de varianza con la prueba de Bartlett, aplicándose una transformación de escala (log x) a los datos. Las correlaciones se calcularon mediante el coeficiente de correlación (r) por rangos de Spearman para una probabilidad de 0.05. La fecundidad promedio de los zooides procedentes de colonias recolectadas en una o diferentes localidades y fechas se comparó mediante la prueba de Kruskal-Wallis (Sigarroa, 1985). Para el procesamiento de los datos se utilizaron los programas Microsoft Excel 2000 y Statistica versión 6.
Para conocer el desarrollo de la larva se colectaron cuatro colonias de E. turbinata en estadio de liberación larval en el área de manglar del cayo Inés de Soto, en septiembre de 2000. Cada colonia, con el pedazo de raíz de mangle al que estaba adherida, se introdujo en una bolsa de polietileno con suficiente agua, y se colocaron en recipientes plásticos para su traslado a un local cercano a la zona de colecta donde se crearon condiciones de laboratorio. Ya en este local, las colonias se depositaron en acuarios de diez litros de capacidad, con agua de mar del lugar donde se colectaron las colonias, sin aireación y con luz artificial constante. La temperatura del agua en los acuarios y del ambiente en el local de trabajo se midió tres veces al día, con un termómetro de laboratorio (± 1°C).
Las larvas que estaban nadando en los acuarios se extrajeron con una pipeta y se colocaron en cápsulas de Petri, lo cual facilitó observaciones continuas del desarrollo y la metamorfosis larval bajo un microscopio estereoscópico. Cada 12 horas se limpió el fondo de los acuarios con un sifón para eliminar los desechos fecales de las colonias y se cuantificaron las larvas muertas. Transcurridas 24 horas se cambiaron las dos terceras partes del agua de cada acuario y pasadas 48 horas se sacaron las colonias de los acuarios. De acuerdo con la cantidad de larvas por cápsula de Petri, se extrajo un número de ejemplares cada 30 minutos y se fijaron en etanol al 50% con glicerina.
Este experimento se repitió en el mes de noviembre, realizándose el mismo procedimiento, pero en esta ocasión las colonias se taparon con polietileno negro durante el traslado para el laboratorio y en los acuarios, desde el oscurecer hasta el amanecer, para evitar la penetración de la luz artificial. La colonia progenitora fue traspasada para otro acuario inmediatamente después de que ocurría una liberación de larvas, con el objetivo de garantizar que no se unieran en un mismo recipiente larvas provenientes de diferentes eclosiones.
Para determinar el inicio de la alimentación exógena, teniendo en cuenta que el cuerpo de la larva es transparente y se puede ver el aparato digestivo, a partir de fijadas las larvas en las cápsulas de Petri se añadió a éstas varias gotas de un cultivo de microalga (Chlorella sp.), sin cuantificar la concentración de la misma. La descripción y las fotos de las fases de desarrollo larval se hicieron en un microscopio biológico con cámara digital acoplada. Con un micrómetro ocular se midió la longitud total de la larva (desde la base de las papilas hasta la punta de la cola no flexionada), y la longitud del tronco (desde la base de las papilas hasta la scotadura que se forma entre los sifones) y la cola por separado. La longitud de la larva fijada y la del zooide juvenil se midió de la escotadura entre los sifones hasta la base de los órganos ampulares. En zooides preservados en formol al 4% se midió el diámetro de los ovocitos y embriones, colocando la escala del micrómetro ocular al azar, sin tener en cuenta el mayor o menor diámetro de éstos.
RESULTADOS Y DISCUSIÓN
Fecundidad de los zooides y las colonias
El análisis de 200 zooides en estadio de liberación larval que tenían entre 17 mm y 30.5 mm de longitud (Tabla 1), muestra una fecundidad promedio de 41 ± 12 ovocitos, embriones y larvas por zooide. Los zooides tenían, proporcionalmente, 61 % de ovocitos, 34% de embriones y 5% de larvas, siendo muy baja la correlación (r = 0.17, p<0.05) entre la longitud de los zooides y la fecundidad.

Teniendo en cuenta sólo el promedio de embriones y larvas (16) por zooide, este valor resultó superior a los registrados por Carballo (2000) e Iglesias (2000) para poblaciones del Mediterráneo, en el mes de mayor promedio de embriones por zooide en esa zona (9.9 y 9 respectivamente). El número máximo de embriones y larvas en un zooide fue 40, mientras que otros autores han registrado, 20, 48, 11 y 36 (Simkins, 1924; Morgan, 1977; Luján, 1995; Iglesias, 2000, respectivamente). No obstante, si incluimos la cantidad de ovocitos en el ovario, la fecundidad máxima del zooide fue de 75 ovocitos, embriones y larvas.
Las diferencias de la fecundidad de los zooides, con igual estadio de desarrollo gonadal, provenientes de siete colonias recolectadas en el Cayo Inés de Soto en octubre del 2000 (Figura 4), fueron significativas (H(6, N=70) = 42.83, p<0.01). Igual resultado se obtuvo al analizar la muestra de 200 zooides provenientes de diferentes localidades (H(2, N=200) = 41.59, p<0.01) y fechas (H(3, N= 200) = 67.70, p<0.01).
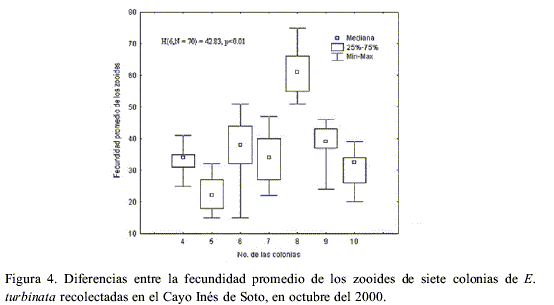
Esto parece estar determinado por el desarrollo por porciones de los ovocitos y embriones, y la liberación de un número de larvas cada 24 horas durante los días que los zooides se reproducen sexualmente hasta reabsorberse, lo cual hace que se obtengan valores muy diversos al calcular la fecundidad de una forma puntual. Iglesias (2000) también observó gran variación en la fecundidad de los zooides de talla semejante y estado de desarrollo y no encontró correlación entre el número de embriones y la longitud de los zooides.
Aunque por su aspecto externo la colonia puede clasificarse en avanzada fase de maduración, los zooides que la componen no siempre tienen igual grado de desarrollo gonadal, observándose diferencias en la composición porcentual de los zooides en diferentes estadios de desarrollo gonadal por colonia (Figura 5). En las 20 colonias en fase de liberación larval, como promedio, el 78% de los zooides estaban maduros, liberando larvas y en reabsorción, mientras que sólo el 22% de los zooides eran juveniles e inmaduros. Al parecer los zooides en la colonia van madurando por grupos, produciéndose la expulsión paulatina de las larvas durante los 15 días en que aproximadamente la colonia se reproduce sexualmente, dentro de cada ciclo asexual (40 días) de generación-degeneración de la colonia (Hernández-Zanuy et al., 2000).
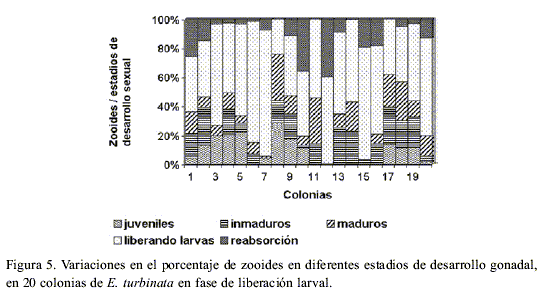
Según Carballo (2000), el crecimiento asexual de la colonia a partir de los estolones produce una gran variación en el número de zooides por colonia. La forma muy compacta en que van surgiendo los zooides de los estolones, unido a las nuevas colonias que se forman sobre el mismo sustrato a partir de la fijación de larvas, y las diferencias en la talla de los zooides según su grado de desarrollo y edad de la colonia, influyen en las variaciones individuales que observamos en la longitud de las colonias y la cantidad de zooides en colonias en igual estadio de desarrollo.
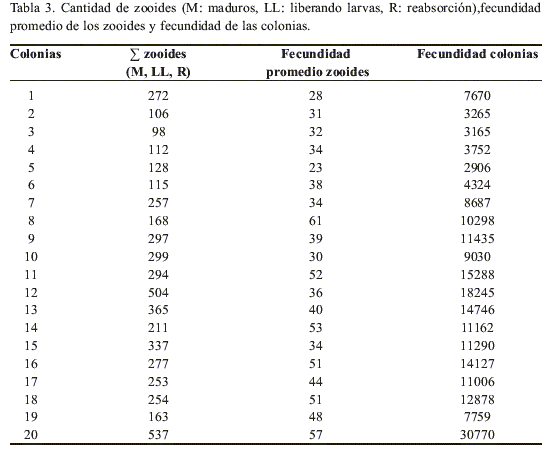
La fecundidad promedio de las colonias fue 10590 ovocitos, embriones y larvas (Tabla 2). Este valor varía principalmente de acuerdo a la cantidad de zooides maduros, liberando larvas y en reabsorción (Tabla 3), siendo alta la correlación del número de zooides con la fecundidad (r = 0.84, p<0.05) y con el largo de las colonias (r = 0.71, p<0.05). También están correlacionadas la fecundidad de la colonia con el largo de la colonia (r = 0.61, p<0.05) y con la fecundidad promedio de los zooides (r = 0.65, p<0.05).

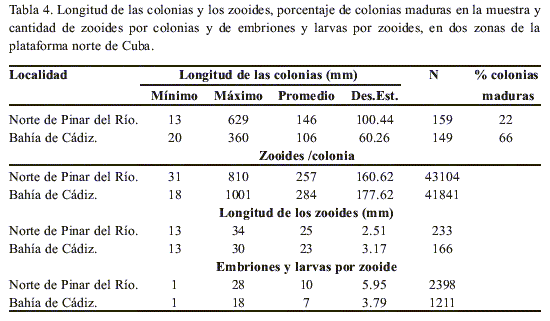
La tabla 4 presenta el promedio de la longitud de las colonias, la cantidad de zooides por colonias y el número de embriones y larvas por zooide en muestreos realizados en el año 1998 al Norte de Pinar del Río (estas colonias proceden de los mismos cayos y a algunos de los mismos lugares donde se extrajeron las 20 colonias que se utilizaron para calcular la fecundidad), y en el Canal de Ranchería, Bahía de Cádiz. En esta muestra de un número mayor de zooides y colonias, tampoco hubo correlación entre el largo de los zooides y el número de embriones y larvas por zooides (r = 0.44, p<0.05, N = 399).
En la Isla de Formentera (Mar Mediterráneo), E. turbinata se reproduce sexualmente sólo durante unas pocas semanas en los meses de verano, junio-septiembre (Carballo et al., 1997; Iglesias, 2000) y las colonias tienen 157 zooides como promedio calculándose un potencial reproductivo en dos periodos de asentamiento de las larvas de 616 y 288 larvas/m2, respectivamente (Carballo, 2000). En Cuba, donde las densidades promedio en las zonas en que la especie es abundante son de una colonia por metro lineal de manglar y las colonias reproductoras tienen como promedio 302 zooides (Hernández-Zanuy, 2004; Hernández-Zanuy et al., en prensa), reproduciéndose durante todo el año (Hernández-Zanuy et al., 2000), podemos estimar que se liberen alrededor de 111438 larvas anuales por metro de costa de manglar, por lo cual el potencial reproductivo de la especie (larvas/m) parece ser superior al calculado en Formentera.
No se pudo determinar cuántas larvas puede expulsar un zooide cada 24 horas, pero por lo general en un zooide sólo se encontraban dos larvas ya con las colas sueltas, listas para ser expulsadas y, como promedio, 13 embriones en diferente grado de desarrollo. Morgan (1977) observó que el desarrollo larval de E. turbinata en Puerto Rico se producía en menos de 24 horas y cada zooide podía liberar entre 30 y 50 larvas. En nuestro caso, con temperatura del agua entre 23.5ºC y 30ºC, considerando los dos experimentos, el desarrollo de la larva duró entre 16 y 19 horas, y es posible que cada zooide libere más de 50 larvas. En los zooides en fase de reabsorción no había ovocitos en el ovario, lo que reafirma el criterio que cuando el zooide termina de reproducirse sexualmente, se reabsorbe (Morgan, 1977; Luján, 1995; Carballo et al., 1997; Iglesias, 2000).
Desarrollo larval
En el experimento realizado en septiembre la primera liberación de larvas se produjo a las 13:00 horas, en el momento en que las colonias se colocaron en los recipientes plásticos para trasladarlas al laboratorio. A las 17:00 horas, pocos minutos después de colocar las colonias en los acuarios, se produjo una segunda liberación masiva de larvas y al parecer, debido a la exposición de las colonias a una iluminación constante, los zooides estuvieron expulsando algunas larvas de forma continua durante las 48 horas que duró el experimento, pero alrededor de las 10:00 horas del siguiente día las colonias liberaron un grupo mayor de larvas. Durante este experimento la temperatura del agua en las peceras varió entre 26°C y 30°C y la del ambiente entre 25°C y 31.5°C.
En el mes de noviembre las colonias se colectaron a las 10:00 horas y la expulsión de las larvas, inmediatamente después de la colecta, fue mucho
más masiva que la observada en septiembre, aunque en este experimento no se cuantificó la cantidad de larvas liberadas por las colonias. En esta ocasión, al estar las colonias tapadas, no se produjo ninguna liberación de larvas en el traslado para los acuarios, lo cual se hizo cinco horas después de la colecta, ni en las siguientes 16 horas que las colonias permanecieron tapadas. A las 10:00 de la mañana del siguiente día (ya destapados los acuarios) ocurrió un segundo desove masivo de larvas, las cuales se concentraban en las paredes del acuario que estaba más cercana a una ventana por la cual entraban los rayos del sol. Durante este segundo experimento la temperatura del agua en los acuarios varió entre 23.5°C y 26.5 °C y la del ambiente entre 21°C y 29 °C.
Se plantea que la luz y la temperatura son dos factores determinantes en la liberación de las larvas de las ascidias (Van Duyl et al., 1981; Svane y Young, 1989). En particular la liberación de las larvas de E. turbinata se produce entre las 9:30 y las 18:00 horas (Vázquez y Young, 1996) lo cual coincidió con lo observado.
La tabla 5 muestra los valores promedio y extremos del tamaño de los ovocitos, embriones y larvas, en diferentes fases de desarrollo, de muestras obtenidas en los dos experimentos. Los ovocitos que ya contenían vitelo, fueron considerados maduros y son opacos; tenían entre 0.45 mm y 0.75 mm de diámetro. Dentro de esta fase se pueden distinguir dos grupos de ovocitos, uno compuesto por alrededor de siete ovocitos de color amarillo-naranja que tienen un diámetro de 0.6 mm a 0.75 mm y otro grupo con igual cantidad pero amarillo más pálido y diámetro entre 0.4 mm y 0.6 mm. Los restantes ovocitos son transparentes, se consideran inmaduros, son el grupo más numeroso (alrededor de 20) pero debido a sus pequeños diámetros sólo es factible contar los mayores de 0.1 mm.
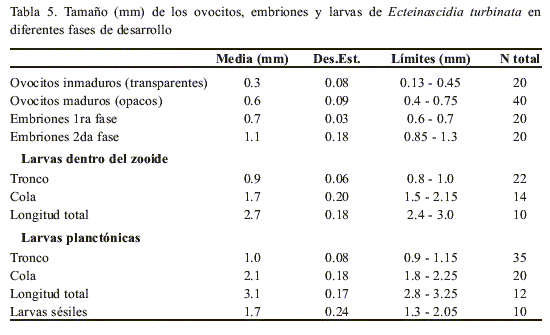
Los huevos fecundados, en diferentes fases de embriogénesis, se diferenciaron como embriones en dos fases de desarrollo y tenían entre 0.6 mm y 1.3 mm de diámetro. En la primera fase el huevo fecundado sufre las diferentes divisiones de la segmentación, es de color amarillo opaco y tiene igual tamaño (0.6 mm - 0.7 mm) que el ovocito en fase más avanzada de maduración. En la segunda fase ya se ve el embrión formado y el diámetro alcanza más de 0.85 mm.
Iglesias (2000) clasificó los ovocitos en tres estadios de desarrollo, diferenciándoles por su coloración y diámetros en: I - ovocitos blancos (0.26 mm), II - amarillos (0.47 mm) y III - anaranjados (0.57 mm). Esta autora no encontró más de dos o tres ovocitos en estadio III en los ovarios, y plantea que el tamaño de los huevos maduros (entre 0.7 mm y 0.75 mm) registrado por Simkins (1924), Berrill (1935) y Cloney (1990), corresponde con el diámetro de los embriones. En este trabajo, como promedio, se contaron siete ovocitos en la fase más avanzada de maduración (estadio III) y estos tenían un diámetro semejante a los embriones que estaban en la primera fase de desarrollo, lo cual podría aclarar las diferencias en el diámetro de los huevos maduros y los ya fecundados encontradas por los autores antes mencionados.
La larva o renacuajo, llamada así por su morfología, momentos antes de ser expulsada del zooide midió como promedio 2.7 mm de longitud total, teniendo el tronco entre 0.85 mm y 1 mm de longitud y la cola de 1.5 mm a 2.15 mm. Como ha sido descrita por otros autores (Iglesias, 2000), tiene un color naranja muy llamativo, se distingue bien un punto negro (el ocelo), la cutícula que la cubre y tres papilas adhesivas (Figura 6A). En la parte inferior del lado derecho del cuerpo está situado el corazón y en muchas larvas es posible apreciar un esbozo de lo que será el tracto digestivo hacia la parte inferior del lado izquierdo del cuerpo (Figura 6B).
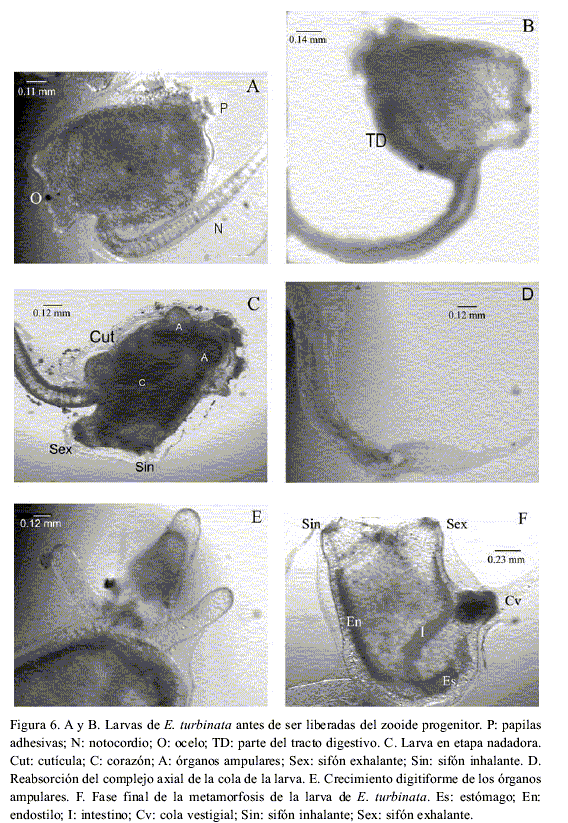
La fase planctónica de la larva duró de cuatro a ocho horas. Las larvas primero nadaban de forma vigorosa y después con mayor lentitud hasta quedarse inmóviles. Durante esta etapa la longitud total promedio de la larva fue 3.1 mm (Tabla 5). En las primeras dos horas de la etapa planctónica la larva va cambiando la forma del cuerpo (Figura 6C). En ella se distinguen el ocelo, como un punto negro ubicado entre los dos sifones, tres papilas adhesivas debajo de las cuales se ven esbozados cuatro abultamientos epidérmicos, que son los órganos ampulares, los cuales darán origen a los estolones y la cola en donde se observa la musculatura y un cordón notocordal muy visible.
En una segunda etapa de esta fase planctónica ocurre la reabsorción del complejo axial de la cola (Figura 6D), la retracción de las papilas y el alargamiento digitiforme de los órganos ampulares (Figura 6E). Al finalizar esta fase la mayoría de las larvas se fijaron en el fondo de las cápsulas Petri, las cuales estaban colocadas sobre una superficie oscura. El análisis de 127 larvas que tenían seis horas de vida planctónica como máximo, mostró que el 79% estaban en la primera fase de desarrollo, el 16% ya habían alcanzado las etapas finales de la fase planctónica y el 5% estaban en fase de metamorfosis, por lo cual ya se habían fijado.
Las larvas al fijarse sufren una serie de movimientos morfogenéticos y cambios fisiológicos que comienzan con la rotación de los sifones 90° (Satoh, 1994). Al inicio de esta fase la cola ya presentaba gran parte del notocordio reabsorbido y casi siempre estaba doblada. Los cuatro órganos ampulares tenían entre 0.25 mm y 0.75 mm de longitud, siendo por lo general dos más cortos. El proceso de metamorfosis duró aproximadamente de ocho a doce horas.
En esta etapa la larva fue tomando la figura del oozooide (zooide surgido directamente del huevo). El cuerpo se alarga, se forman completamente todas las partes del aparato digestivo y los estigmas del saco branquial. Con gran nitidez se pudo apreciar a través de los órganos ampulares como los latidos del corazón impulsan la sangre en un sentido durante dos minutos y 18 segundos, se detiene dos segundos y comienza un flujo en sentido contrario.
Al final de esta fase se pierde la cutícula externa en la región de los sifones, ya se reabsorbió totalmente el sistema axial de la cola y ésta aparece transparente, pegada a la región ventral del cuerpo por debajo del sifón exhalante (Figura 6F). La metamorfosis se completó en menos de 19 horas, cuando el oozooide comenzó a ingerir alimento. El oozooide juvenil tiene aproximadamente 2.0 mm de longitud y los órganos ampulares miden alrededor de 1.5 mm. Durante los diez días que se mantuvieron vivos los siete oozooides juveniles, a todos se les veía la cola vestigial pequeña y transparente.
Nuestras observaciones sobre el tamaño y las características principales de los ovocitos, embriones y las larvas durante las diferentes etapas de vida planctónica y el proceso de metamorfosis coinciden con los resultados de varios autores (Simkins, 1924; Berrill, 1935; Van Name, 1945; Cloney, 1990; Iglesias, 2000), aunque en particular las medidas del tronco de la larva y del zooide juvenil, pueden tener pequeñas variaciones por la forma en que fueron tomadas. Según Iglesias (2000), la longitud total de las larvas es mayor en el Atlántico Occidental (4.5 mm y 5 mm, Florida y Golfo de México) que en el Mediterráneo (3.4 mm), pero en este caso la longitud de las larvas y del oozoide juvenil fueron semejantes a las registradas para el Mediterráneo. Esta autora determinó que, de acuerdo a la temperatura y el recipiente que se utilice, el tiempo transcurrido desde la liberación de la larva hasta el inicio de la alimentación exógena podría variar entre 9 y 46 horas.
La mortalidad de las larvas en las primeras seis a ocho horas fue entre un 54 y un 80%. Solo 9% de las larvas completaron la metamorfosis y de ellas siete zooides juveniles se mantuvieron vivos diez días. Iglesias (2000) también observó una mortalidad larval elevada en condiciones controladas. En este caso entre 42 y 70% de acuerdo al tipo de recipiente empleado; Carballo (2000) calculó teóricamente que sólo 1.3 % de las larvas producidas forman colonias.
Resultados similares sobre la alta mortalidad de las ascidias durante las primeras fases del desarrollo larval han sido obtenidos para otras especies de ascidias en el medio natural (Van Duyl et al., 1981; Davis, 1988; Svane y Young, 1989) y algunos factores externos como la temperatura, la luz, la turbidez, el pH, las sustancias químicas provenientes de otros organismos, la existencia de una capa bacteriana sobre el sustrato, la cantidad de nutrientes en el agua, la disponibilidad de sustrato, la competencia y la depredación han sido mencionadas como causantes de esta alta mortalidad (Montes y Grimaldi de Jiménez, 1975; Yamaguchi, 1975; Van Duyl et al., 1981; Svane y Young, 1989; Bingham y Young, 1991; Hurlbut, 1992; Lindquist, 1996; Degman y Johnson, 1999).
CONCLUSIONES
La fecundidad de E. turbinata en los manglares del NW de Cuba es alta (como promedio 10.590 larvas por colonia cada 40 días aproximadamente).
La fecundidad de los zooides en semejante estadio de maduración es independiente de la longitud de los mismos, y la fecundidad de la colonia varía principalmente de acuerdo con el número de zooides que están en fase avanzada de maduración en la colonia. Al parecer las variaciones en la fecundidad están determinadas por el desarrollo por porciones de los ovocitos, embriones y larvas, y la maduración por grupos de los zooides en las colonias.
Las larvas de E. turbinata completaron su desarrollo antes de 19 horas con temperaturas del agua entre 23°C y 30°C. La etapa planctónica de la larva duró aproximadamente de cuatro a ocho horas y el proceso de metamorfosis entre ocho y doce horas.
La mortalidad de las larvas fue alta (54 - 80%) en las primeras ocho horas de vida, completando la metamorfosisis el 9% de las larvas.
AGRADECIMIENTOS
Los autores agradecen a las personas de la comunidad de Puerto Esperanza y a Macario Esquivel por la valiosa ayuda en la realización del trabajo de campo. Gracias a María del Carmen Prieto por su colaboración en la presentación final de las ilustraciones.
BIBLIOGRAFÍA
1. Berrill, N.J. 1935. Cell division and differentiation in asexual and sexual development. J. Morphol., 57(2):353-427. [ Links ]
2. ________.1975. Chordata: Tunicate. En: A. C. Giese y J. S. Pearle (Eds.). Reproduction in marine invertebrates, pp.241-82. Nueva York, Academy Press. [ Links ]
3. Bingham, B.L. y C.M. Young. 1991. Influence of sponges on invertebrate recruitment: a field test of allelopaty. Mar. Biol., 109: 19-26. [ Links ]
4. Carballo, J.L. 2000. Larval ecology of an ascidian tropical population in a Mediterranean enclosed ecosystem. Mar. Ecol. Progr. Ser., 195:159-167. [ Links ]
5. Carballo, J.L, S. Naranjo, B. Kukurtzu y A. Hernández 1997. Estudio de la población de Ecteinascidia turbinata Herdman 1880 (Ascideacea: Perophoridae) en la isla de Formentera (Mar Mediterráneo, España): distribución, densidad y crecimiento. Ciencias del Mar, UAS, 15:7-15. [ Links ]
6. Cloney, R.A. 1987. Phylum Urochordata, Class Ascidiacea. En: M.F. Strathmann (Ed.). Reproduction and Development of Marine Invertebrates of the Northern Pacific Coast. Univ. of Washington Press. Seattle, pp: 607-639. [ Links ]
7. ________.1990. Larval tunic and the function of the test cells in ascidians. Acta Zool., 71(3): 151-159. [ Links ]
8. Davis, A.R. 1988. Variation in recruitment of the subtidal colonial ascidian Podoclavella moluccensis. J.Exp. Mar. Biol. Ecol.,106:57-71. [ Links ]
9. Degman, B.M. y C.R. Johnson. 1999. Inhibitions of settlement and metamorphosis of the ascidian Herdmania curvata by non- geniculate coraline algal. Biol. Bull.,197(3):332-340. [ Links ]
10. Hernández-Zanuy, A. 2004. Biología y ecología de Ecteinascidia turbinata Herdman 1889 (Ascidiacea) en Cuba. Tesis en opción al grado de Doctor en Ciencias Biológicas. Universidad de la Habana, 96 p. [ Links ]
11. Hernández-Zanuy, A., J.L. Carballo, A. García-Cagide, S. Naranjo y M. Esquivel (en prensa). Distribución y abundancia de Ecteinascidia turbinata Herdman (Ascidiacea: Perophoridae) en Cuba. Rev. Biol. Trop., (53). [ Links ]
12. Hernández-Zanuy, A., A. García, M. Esquivel y A. Blanco 2000. Reproducción y desarrollo de Ecteinascidia turbinata (Ascideacea:Perophoridae) en Cuba. Rev. Biol. Trop.(48):193- 99. [ Links ]
13. Hurlbut, C.J. 1992. Larval release and supply predict temporal variation in settlement of a colonial ascidian. Mar. Ecol. Prog. Ser., 80:215-219. [ Links ]
14. Iglesias, C. 2000. Biología de Ecteinascidia turbinata Herdman, 1880 (Tunicata, Ascidiacea) en condiciones controladas y en el medio natural. PhD tesis, Univ.Autónoma de Madrid, 367 p. [ Links ]
15. Lindquist, N. 1996. Paleatability of invertebrate larval to coral and sea anemones. Mar. Biol., 126(4):745-755. [ Links ]
16. Luján, I. 1995. Biología y autoecología de Ecteinascidia turbinata Herdman, 1880 (Tunicata, Ascidiacea) en una zona templado cálida (SE Península Iberica). Tesis de Licenciatura. Universidad de Alicante, 92 p. [ Links ]
17. Montes, M.A. y G. Grimaldi de Jiménez. 1975. Embriogénesis de Ascidia nigra. Lagena, 36:21-30. [ Links ]
18. Morgan, T.O. 1977. Grow rate, age at sexual maturity, longevity and seasonality in three West Indian colonial ascidians. M. Sc. Thesis, University of Puerto Rico, Mayagüez, 95 p. [ Links ]
19. Satoh, N. 1994. Developmental biology of ascidian. Cambridge University Press, Londres, 234 p. [ Links ]
20. Sigarroa, A. 1985. Biometría y Diseño Experimental. Tomos I y II. Editorial Pueblo y Educación, Habana.793 p. [ Links ]
21. Simkins, C.S. 1924. Origin in the germ cells in Ecteinascidia. Cont.Bermuda Biol. Sta. Res., 144:295-317. [ Links ]
22. Svane, I. y C.M. Young. 1989. The ecology and behaviour of ascidian larvae. Oceanogr. Mar. Biol. Annu. Rev., 39(2):279-89. [ Links ]
23. Van Duyl, F.C., R.M. Bak y J. Sibesma. 1981. The ecology of the tropical compound ascidian Trididemnum solidum .I. Reproductive strategy and larval behaviour. Mar. Ecol. Prog. Ser., 6:35-42. [ Links ]
24. Van Name, W.G. 1945. The North and South American ascidians. Bull. Am. Mus. Natl. Hist., 81:1-476. [ Links ]
25. Vázquez, E. y C. M. Young 1996. Responses of compound ascidian larvae to haloclines. Mar. Ecol. Prog. Ser., 133:179-190. [ Links ]
26. ________.2000. Effects of low salinity on metamorphosis in estuarine colonial ascidians. Invert Biol. 119(4):433-444. [ Links ]
27. Yamaguchi, M. 1975. Growth and reproductive cycles in the marine fouling ascidian Ciona intestinalis, Styela plicata, Botrylloides violaceus and Leptoclinum mitsukurii at Aburatsubo Moroiso Inlet (Central Japan).Mar. Biol., 29: 253-59. [ Links ]
28. Young, C.M. 1986. Direct observations of field swimming behavior in larvae of the colonial ascidians Ecteinascidia turbinata. Bull. Mar. Sci., 39(2):279-289. [ Links ]













