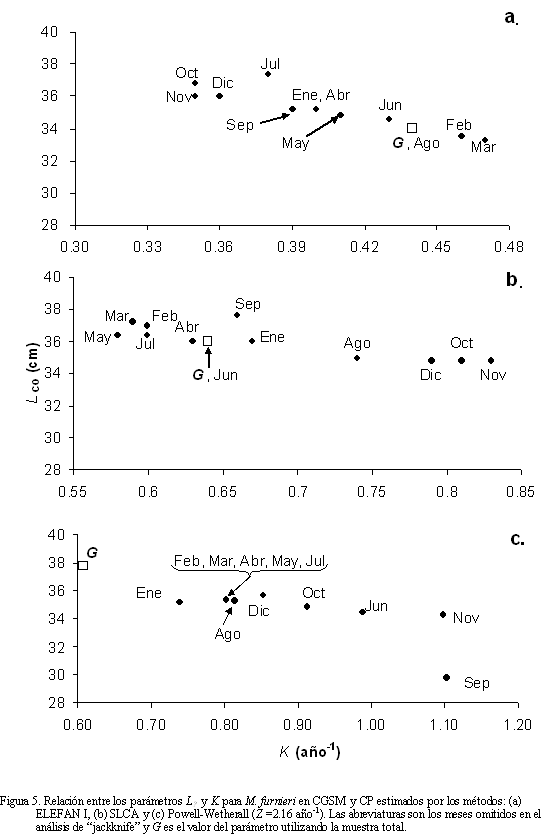Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.35 no.1 Santa Marta Jan./Dec. 2006
DINÁMICA POBLACIONAL DEL CORONCORO MICROPOGONIAS FURNIERI (PISCES: SCIAENIDAE)EN LA CIÉNAGA GRANDE DE SANTA MARTA, CARIBE COLOMBIANO
POPULATION DYNAMICS OF THE "CORONCORO" FISH MICROPOGONIAS FURNIERI (PISCES: SCIAENIDAE) FROM THE CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIAN CARIBBEAN
Elaine Cancio Mozo, Juan Carlos Narváez Barandica y Jacobo Blanco Racedo
Grupo de Ecología Pesquera, Programa de Valoración y Aprovechamiento de Recursos Marinos, Instituto de Investigaciones Marinas y Costeras (INVEMAR), Cerro Punta Betín, Santa Marta, Colombia. E-mail: elacamo@yahoo.com (ECM); jnarvaez@invemar.org.co (JCNB); jblanco@invemar.org.co (JBR)
RESUMEN
El Coroncoro Micropogonias furnieri ha sido tradicionalmente uno de los recursos ícticos más importantes en la pesquería artesanal de la Ciénaga Grande de Santa Marta (CGSM) y el Complejo de Pajarales (CP). Con el propósito de conocer el estado de explotación de su población, se estudiaron los aspectos relacionados con su biología y se determinaron los parámetros poblacionales. La talla media de madurez (TMM) se estimó en 20.7 cm de longitud total, mientras la proporción sexual fue de 2.39 hembras por cada macho. Se presentaron individuos maduros durante todo el año, con un pico de maduración y desove en la época de lluvias (noviembre). La relación Longitud-Peso no presentó diferencia entre sexos, estimándose una ecuación común: W = 0.0064LT3.2 con un crecimiento alométrico. Los parámetros de crecimiento de la función de von Bertalanffy fueron: L∞ = 34 cm, K = 0.44 año-1, to= 0.3601 año y C = 0.5; con un índice de desempeño que se encontró entre 2.67 y 2.73. Las tasas de mortalidad total (Z), natural (M) y por pesca (F) fueron estimadas en 2.16, 0.84 y 1.32 año-1, respectivamente. La tasa de explotación estimada (E = 0.61), indicó que M. furnieri está siendo sobreexplotada, por lo que es recomendable adoptar medidas de manejo que permitan garantizar la sostenibilidad del recurso.
PALABRAS CLAVE: Micropogonias furnieri, Ciénaga Grande de Santa Marta, Dinámica poblacional, Pesquería artesanal, Manejo pesquero.
ABSTRACT
The "Coroncoro" fish Micropogonias furnieri has been one of the most important traditional fish resources in CGSM and CP. In order to determine exploitation status of its stock, aspects related to its biology and population parameters have been assessed. Mean maturity size was estimated in 20.7 cm at total length; whereas sex ratio was 2.39 females per male. Ripe individuals occurred throughout the whole year, with a maturation and spawning peak in the rainy season (november). Length-weight relationship showed no difference between sexes and a common equation with allometric growth W = 0.0064LT3.2 was estimated. The estimated parameters of von Bertalanffy growth function were L∞ = 34.0 cm, K = 0.44 yr-1, to = 0.301 yr and C = 0.5; with a growth index ranging between 2.67 and 2.73. Total (Z), natural (M) and fishing (F) mortality rates were estimated as 2.16, 0.84 and 1.32 yr-1, respectively. The estimated exploitation rate (E = 0.61) indicated that M. furnieri is being overexploited and thus it is recommended to adopt management actions to ensure resource sustainability.
KEY WORDS: Micropogonias furnieri, Ciénaga Grande de Santa Marta, Population dynamics, Small-scale fisheries, Fishery management.
INTRODUCCIÓN
Uno de los componentes ícticos de mayor interés en el ámbito mundial lo constituye la familia Sciaenidae, que se encuentra bien representada en la costa Atlántica de América del Sur tanto en número de especies, como en biomasa, representando más del 80% de las capturas desembarcadas en puertos del sur de Brasil, Argentina y Uruguay (Cervigón, 1985). Aunque existe una gran diversidad de especies de esta familia, los desembarques están constituidos principalmente por cuatro especies: Umbrina canosai, Micropogonias furnieri, Cynoscion striatus y Macrodon ancylodon (Cervigón, 1985; Isaac, 1988; Vazzoler, 1991).
M. furnieri, se caracteriza por ser una especie de la plataforma continental. Habita sobre fondos blandos de aguas neríticas, generalmente a profundidades que oscilan entre 30 y 40 m, llegándose a encontrar individuos a 60 m de profundidad (Cervigón, 1993; Acha et al., 1999; Macchi et al., 2003). Sin embargo, los juveniles de esta especie suelen vivir sobre fondos muy someros en áreas estuarinas e incluso en aguas dulces. Se distribuye ampliamente en la costa Atlántica americana, desde Costa Rica hasta el norte de Argentina, encontrándose además, en las Antillas (Fisher, 1978) y Cuba (Aguilar et al., 1992).
Es una especie que posee gran importancia comercial dentro de la pesquería de la ecorregión Ciénaga Grande de Santa Marta (CGSM) (Álvarez-León y Blanco, 1985; Escobar, 1994; Santos-Martínez et al., 1998). Su biología quizás está siendo afectada con los cambios que se han dado en el ecosistema por todas las perturbaciones antrópicas y naturales reflejadas en: (i) la realización de obras hidráulicas, que pretendieron regenerar el equilibrio hídrico del ecosistema (Botero y Salzwedel, 1999); (ii) la intensa actividad pesquera, realizada por diversas flotas con diferente poder de pesca (Rueda y Defeo, 2003); y (iii) la variabilidad ambiental reflejada en el régimen hidrológico y climático (Kaufmann y Hevert, 1973; Wiedemann, 1973; Blanco et al., 2006). Con el propósito de conocer la dinámica poblacional de M. furnieri, en este trabajo se investigan algunos aspectos sobre su reproducción, parámetros de crecimiento y las tasas de mortalidad y de explotación para determinar el estado de su aprovechamiento en la ecorregión CGSM y fundamentar las bases científicas para el manejo de su pesquería.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
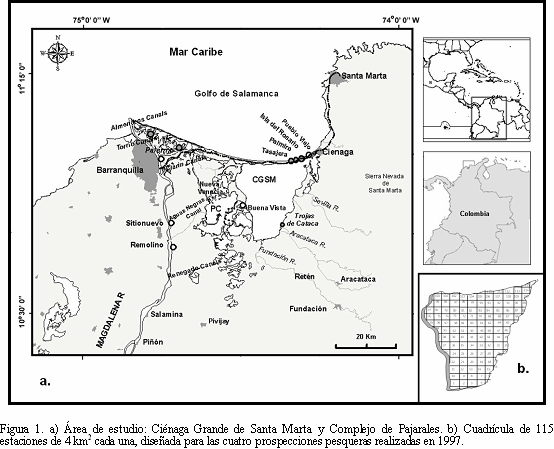
La ecorregión Ciénaga Grande de Santa Marta (CGSM) es el ecosistema delta-lagunar más extenso en el Caribe Colombiano (10o43' - 11o00' N y 74o15'-74o35' O) (Figura1) (IGAC, 1973; Santos-Martínez y Acero, 1991). Posee una profundidad promedio de 1.5 m aproximadamente, registrando una temperatura promedio anual en la columna de agua de 30o C y un promedio de salinidad de 24. Presenta un régimen anual de lluvias que no varía de 401 a 1321 mm (Blanco et al., 2006) con un promedio anual de 807 mm • año-1 (INVEMAR-LOUISIANA, 2001; Blanco et al., 2006), la cual está distribuida en dos épocas climáticas: una seca (diciembre - mayo) y una lluviosa (junio - noviembre), indicando un clima tropical árido (Blanco et al., 2006). Su gran productividad biológica se origina en los aportes de nutrientes de los ríos que bajan de la Sierra Nevada, del Río Magdalena, del Mar Caribe y del bosque de manglar que constituye gran parte de su área, ofreciendo alimento, hábitat y protección a juveniles y adultos de muchas especies. La actividad pesquera es artesanal, multiespecífica y multiartes, de la cual dependen cerca de 20000 personas (Santos-Martínez et al., 1998), que habitan en siete poblaciones, cuatro de ellas ubicadas sobre la costa de Mar Caribe (Pueblo Viejo, Isla del Rosario, Palmira y Tasajera) y las otras tres al interior como pueblos palafíticos (Bocas de Aracataca, Buenavista y Nueva Venecia) (Figura 1a). La ecorregión CGSM ha sido ampliamente descrita a través de una evolución de cambios ambientales y para mejores detalles remitirse a Wiedemann (1973), Botero y Mancera (1996) y Botero y Salzwedel (1999).
BIOLOGÍA PESQUERA
ReproducciónPara estimar la proporción de sexos, estadios de madurez, talla media de madurez sexual y factor de condición de M. furnieri, se utilizaron datos independientes de la pesquería obtenidos mediante cuatro muestreos de prospección pesquera efectuados en febrero, junio, agosto y noviembre de 1997. Estos muestreos fueron realizados empleando el método de pesca "Bolicheo" (Rueda y Santos-Martínez, 1997), que consiste en una red de enmalle operada en forma de cerco. Los boliches usados tuvieron tamaños de malla entre 7 y 8.9 cm, una longitud promedio de 230 m y una altura de 2 m. Los lances fueron realizados con ocho canoas en 115 estaciones (cada estación con un área de 4 km2) ubicadas en el área de estudio con la ayuda de un GPS NAV 5000D (Figura 1b). Todos los peces capturados en cada lance fueron rotulados y preservados en bolsas plásticas. Al mismo tiempo que se realizaron los lances, se tomaron datos de salinidad y temperatura.
Crecimiento y mortalidad
Para determinar los parámetros de crecimiento, mortalidad y talla media de captura se usaron datos dependientes de la pesquería, almacenados en el Sistema de Información Pesquera del INVEMAR - SIPEIN (Narváez et al., 2005), los cuales fueron obtenidos a partir de muestreos mensuales de los desembarcos de capturas comerciales entre enero y diciembre de 1995. La actividad consistió en un muestreo aleatorio simple dentro de cada uno de los siete sitios de desembarque pesquero, en el que fueron seleccionadas al azar embarcaciones de cada arte de pesca (atarraya, trasmallo y boliche) para colectar datos de frecuencias de longitud total de los peces.
ANÁLISIS DE INFORMACIÓN
Reproducción
A los peces analizados en laboratorio se les determinó el sexo y fueron medidos a longitud total (al medio centímetro inferior) y pesados en balanzas con 0.1 g de precisión. Con esta información se determinó la relación Longitud-Peso por sexos mediante la ecuación potencial W = aLTb, donde W es el peso total, LT es la longitud total, a y b son las constantes de la regresión. Con la prueba t-Student se determinó el tipo de crecimiento de la especie tomando en cuenta el valor de la constante b ó coeficiente de alometría (Pauly, 1984; Zar, 1996). Los datos fueron transformados mediante logaritmos para evaluar diferencias en la relación Longitud-Peso entre sexos mediante un análisis de covarianza (ANCOVA), donde la variable dependiente fue el peso y la covariable la longitud. Previo al ANCOVA se evaluaron los supuestos de normalidad de los residuos (prueba de Kolmogorov-Smirnov), homogeneidad de varianzas (prueba de Bartlett), relación lineal entre la variable dependiente y la covariable (análisis de correlación), y homogeneidad de las pendientes de la relación entre la variable dependiente y la covariable (García-Berthou y Moreno-Amich, 1993). Se calculó el factor de condición (k)para cada individuo en cada muestreo mediante la siguiente expresión:
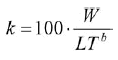 (1)
(1)
Las diferencias del factor de condición se evaluaron aplicando análisis de varianza (ANOVA) a dos vías, usando como factores los sexos y muestreos. Los datos fueron transformados logaritmicamente con el propósito de evaluar los supuestos del ANOVA.
Se determinaron los estadios de madurez sexual a partir de observación macroscópica del material gonadal, usando la escala de Holden y Raitt (1975) modificada por Santos-Martínez (1989). Esta escala consta de cinco estados: indiferenciados; inmaduros (I); madurando (II); maduros (III); y desovados (IV). Con esta información se determinó la proporción de cada uno de los estados de madurez en cada mes de muestreo y se identificó la época de actividad reproductiva de la especie. La información de ejemplares maduros y desovados se usó para estimar la talla media de madurez sexual de la población a partir del modelo logístico que relaciona la proporción de individuos maduros con la longitud total (Sparre y Venema, 1995). La diferencia en la proporción de sexos se evaluó por medio del estadístico Chi-Cuadrado (X2).
Crecimiento y mortalidad
Se midieron un total de 4501 individuos procedentes de las capturas comerciales realizadas con el método de pesca Bolicheo durante enero-diciembre de 2005.Los datos de longitud fueron agrupados mensualmente en marcas de clase de 1 cm. Los parámetros de crecimiento se estimaron mediante tres rutinas contenidas en el paquete computacional FISAT versión 1.1 (Gayanilo et al., 1993): el Análisis de Frecuencia Electrónica (ELEFAN I), el Análisis de Composición de Longitudes de Shepherd (SLCA) y el método gráfico de Powell-Wetherall.
La rutina ELEFAN I trabaja con la ecuación de crecimiento estacionalizada de von Bertalanffy (VBGF), siendo expresada la talla en función a la edad (Sparre y Venema, 1995):
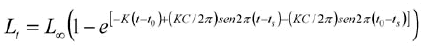 (2)
(2)
donde, L(t) es la longitud a la edad t; L∞ la longitud asintótica; K es la constante de crecimiento, to es la edad hipotética a la que comienza a crecer el animal; C es el parámetro de amplitud de la oscilación del crecimiento y ts es la parte del año en que la tasa de crecimiento es máxima.
La rutina SLCA estima el crecimiento independiente del número y posición de las modas en la muestra, basado en el ajuste de la función coseno y se expresa como:
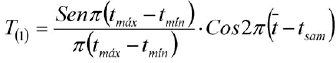 (3)
(3)
donde: tmáx y tmin son las edades correspondientes a los límites superior e inferior de un determinado intervalo de clase; 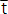 es la edad promedio y tsam es la fracción del año en la que fue tomada la muestra (Rueda y Santos-Martínez, 1999).
es la edad promedio y tsam es la fracción del año en la que fue tomada la muestra (Rueda y Santos-Martínez, 1999).
El método gráfico de Powell-Wetherall permite estimar L∞ y la relación Z/K en una muestra que representa una población en equilibrio y que puede aproximarse reuniendo series de tiempo de frecuencias de tallas (Sparre y Venema, 1995). Se identifica gráficamente la menor talla totalmente reclutada por el arte (L'), la cual se utiliza en una regresión lineal de la siguiente forma:
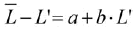 (4)
(4)
donde a y b son las constantes de la regresión y 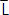 la talla media de captura. Por lo tanto, L∞ será igual a -a/b y la relación Z/K se estimará a partir de -(1+b)/b (Sparre y Venema, 1995).
la talla media de captura. Por lo tanto, L∞ será igual a -a/b y la relación Z/K se estimará a partir de -(1+b)/b (Sparre y Venema, 1995).
Con el fin de evaluar la influencia de cada muestra mensual en la estimación de los parámetros de crecimiento y cuantificar variabilidad de los mismos, se aplicó la técnica de remuestreo "jackknife" de la misma forma como la aplicó Rueda y Santos-Martínez (1999). Para ello, se retiró secuencialmente cada una de las muestras (por mes) generando 12 grupos de 11 datos, obteniéndose así 12 diferentes combinaciones de los parámetros de crecimiento. La variabilidad de los parámetros de crecimiento se calculó con el error porcentual (EP) y el coeficiente de variación porcentual (CV):
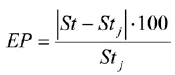 (5)
(5)
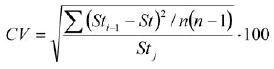 (6)
(6)
donde St es el parámetro de crecimiento estimado usando la base de datos anual completa (12 meses) y Stj es el estimador promedio derivado de las estimaciones sucesivas de "jackknife". EP es óptimo cuando es igual a cero (es decir, cuando St = Stj). Con relación al CV, Sti - 1 es el parámetro estimado al omitir el mes i, y n es el tamaño de la muestra anual (n = 12).
Para comparar las estimaciones de crecimiento entre métodos, se utilizó el índice de desempeño de crecimiento Ø' (Pauly y Munro, 1984). Adicionalmente, los valores de Ø' fueron comparados con las estimaciones de otras poblaciones de M. furnieri documentados en la literatura. El índice Ø' se estimó a partir de la expresión:
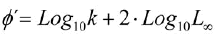 (7)
(7)
A partir de las frecuencias de tallas obtenidas de las capturas comerciales, se estimaron los parámetros de mortalidad usando el paquete computacional FISAT. La tasa de mortalidad total por año (Z) se estimó a partir de la curva de captura linealizada convertida a tallas (Sparre y Venema, 1995), teniendo en cuenta la siguiente ecuación:
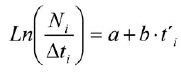 (8)
(8)
donde Ni es el número de individuos capturados pertenecientes a la clase de longitud i; t'i es la edad relativa de la clase i y Δti es el tiempo medio requerido por individuo para su crecimiento a través de la clase i.
Con el propósito de evaluar el efecto de diferentes estimaciones de L∞ y K productos del análisis de "jackknife" en la estimación de Z, se estimaron 12 curvas de capturas que permitieron estimar 12 valores de Z.
La tasa de mortalidad natural (M) se estimó a partir de dos métodos:
1) la ecuación empírica de Pauly (1980):
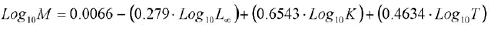 (9)
(9)
donde L∞ y K son los parámetros de la ecuación de VBGF; mientras que T es la temperatura media anual del área de estudio.
2) La ecuación de Rikhter y Efanov (Sparre y Venema, 1995):
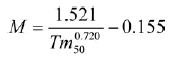 (10)
(10)
donde Tm50 es la edad en la que el 50% de la población está madura.
La mortalidad por pesca (F) fue calculada mediante la diferencia entre la mortalidad total y la mortalidad natural (F = Z-M); mientras que la tasa de explotación se calculó como E = F/Z. Adicionalmente, para cuantificar el grado de explotación del recurso M. furnieri se estimó la talla media de captura (TMC) global y para los tres principales artes de pesca usados en CGSM-CP.
RESULTADOS
Reproducción
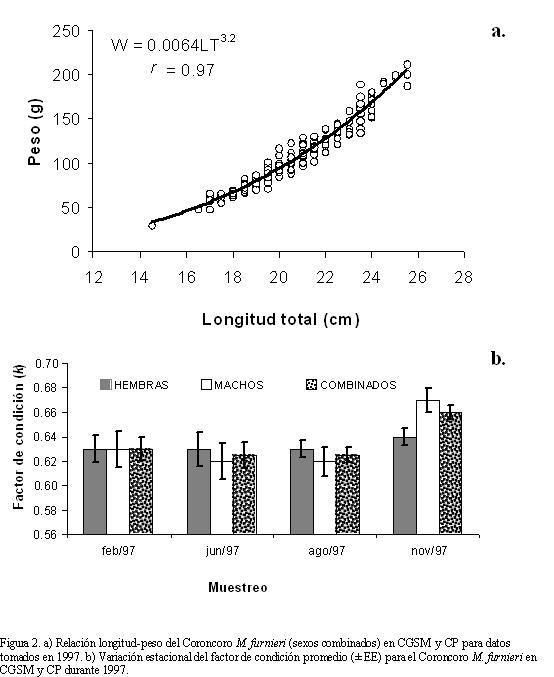
Para analizar la relación L-W de M. furnieri se midieron 193 individuos, de los cuales 136 fueron hembras y 57 machos, el resto se consideraron indiferenciados. El rango de tallas osciló entre 14.5 y 25.5 cm de LT y el de peso individual entre 29.8 y 212.3 g. El ANCOVA indicó que entre sexos no hubo diferencias significativas en el peso a una misma longitud (ANCOVA: F1,2 = 0.44; p>0.05), permitiendo establecer una ecuación común para ambos sexos (a = 0.0064 ± 0.06; b = 3.2 ± 0.05; r = 0.97, p<<0.001 para ambas constantes; Figura 2a).
Consistente con el resultado anterior, el factor de condición k no varió entre sexos (ANOVA: F1,188 = 0.23; p>0.05), pero si entre muestreos (ANOVA: F3,188 = 4.23; p<0.05), registrándose valores relativamente similares entre febrero, junio y agosto (0.62 para hembras), y mayores en noviembre (0.67 para machos) (Figura 2b). Así mismo, se determinó que el factor de condición para machos y hembras depende de los muestreos implicando un efecto estacional (ANOVA: F3,185 = 2.72; p<0.05).
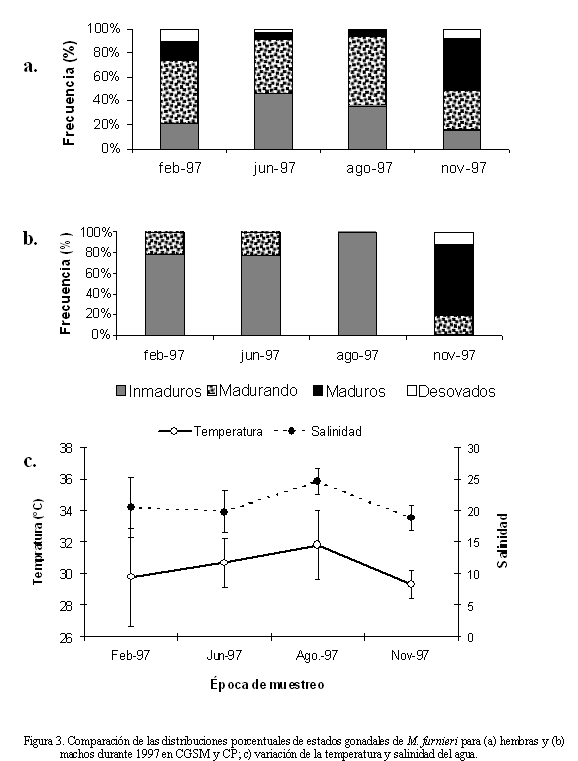
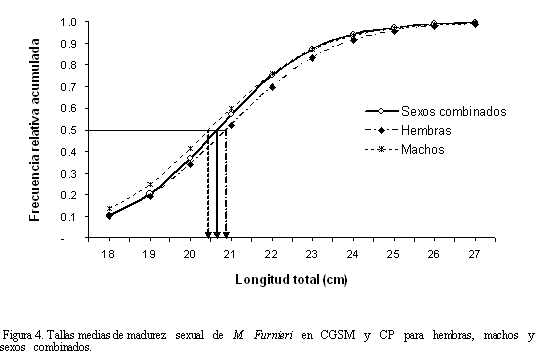
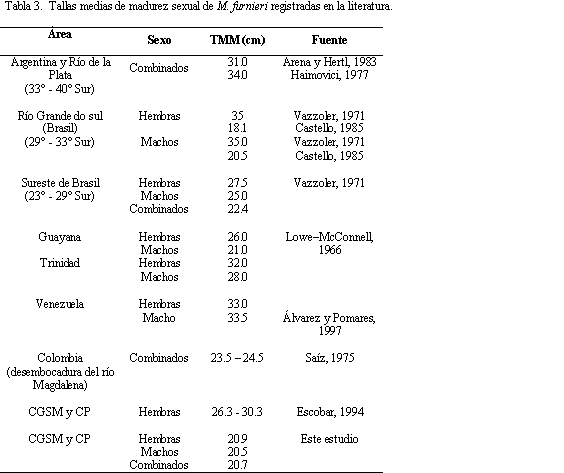
El número de hembras fue mayor que el de machos durante todo el periodo de muestreo, con una proporción machos:hembras global de 1:2.4 (X2 = 32.34, p<<0.05). El mismo patrón se observó en todas las prospecciones, excepto en febrero (Tabla 1). La variación temporal de los estadios de madurez señaló la predominancia de ejemplares juveniles durante las prospecciones pesqueras (Figura 3), excepto en noviembre, época en la que se observó el mayor porcentaje de individuos maduros para ambos sexos. En la figura 3a se observa que más del 50% de las hembras están maduras o en proceso de maduración durante todas las cuatro prospecciones. Por el contrario, más del 75% de los machos estuvieron inmaduros a lo largo del año, excepto en el mes de noviembre (Figura 3b). Valores bajos de salinidad y temperatura mostraron estar asociados al mayor porcentaje de individuos maduros (Figura 3c). En el umbral de los 18 cm, tanto hembras como machos se encontraron en proceso de maduración (Figura 4). La talla media de madurez sexual (TMM) para las hembras se estimó en 20.9±1.4 cm y para los machos en 20.5±1.5 cm. La curva de sexos combinados indicó una TMM de 20.7±1.3 cm.
Crecimiento y mortalidad
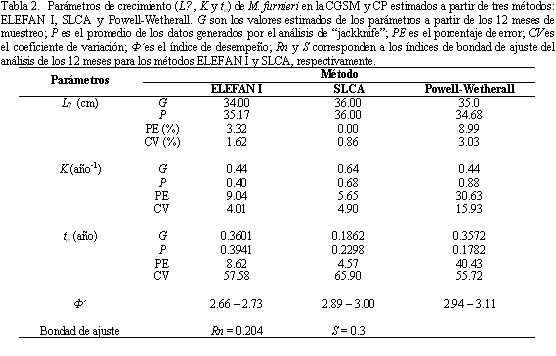
Las estimaciones de K y L∞ obtenidas con los métodos ELEFAN I y Powell-Wetherall presentaron valores similares, pero difirieron de las estimaciones del método SLCA, el cual tendió a presentar valores mayores de los parámetros (Tabla 2). Con relación a t0, el método de SLCA presentó el menor valor, mientras que los otros dos métodos presentaron valores similares entre sí. El análisis de "jackknife" mostró diferentes efectos de los datos sobre los parámetros de crecimiento (Figura 5). Para el caso del método ELEFAN I (Figura 5a), L∞ varió entre 33.3 y 37.4 cm, mientras que K entre 0.35 y 0.47 año-1, ambos
parámetros correlacionados significativamente (r = -0.89; p<< 0.01). El mejor valor de Rn (bondad del ajuste) se presentó utilizando todos los 12 datos (Rn = 0.204) y a pesar de ser relativamente bajo, se consideró aceptable para las condiciones de trabajo presentes. Con respecto al método SLCA (Figura 5b), L∞ varió menos que en el método anterior, presentándose un rango entre 34.8 y 37.6 cm; mientras que los valores de K fueron más altos, oscilando entre 0.58 y 0.83 año-1. La relación entre estos dos parámetros también fue inversa y significativa (r = -0.83; p<<0.01). La bondad del ajuste para este método (S) tuvo un valor de 0.30. El método de Powell-Wetherall (Figura 5c), mostró valores de L∞ menores
que en los métodos anteriores, presentándose un rango entre 29.7 y 35.67 cm, mientras que los valores de K fueron mayores (0.74 - 1.10 año-1). La correlación de estos dos parámetros con este método, aunque menor, fue significativa (r = -0.73; p<0.05). A pesar de lo anterior, no se encontraron diferencias significativas entre los valores de L∞ estimados con los tres métodos (Kruskal-Wallis H' = 4.75; p>0.05). Caso contrario sucedió con el análisis de K y t0, donde hubo diferencias significativas entre los métodos (K: Kruskal-Wallis H' = 28.31, p<<0.01; t0: Kruskal-Wallis H' = 29.75, p<<0.01). El ciclo anual del crecimiento de M. furnieri mostró una pseudocorte entre 10 y 28 cm, con inflexión del crecimiento durante agosto (Figura 6). Así mismo, la curva de crecimiento indicó un nacimiento para mediados de noviembre. Para mayor seguridad, las fechas de "aniversarios" y las tallas a esos tiempos se determinaron sobre la distribución de longitudes en el mes de diciembre, permitiendo la estimación de siete "aniversarios" (Figura 6).
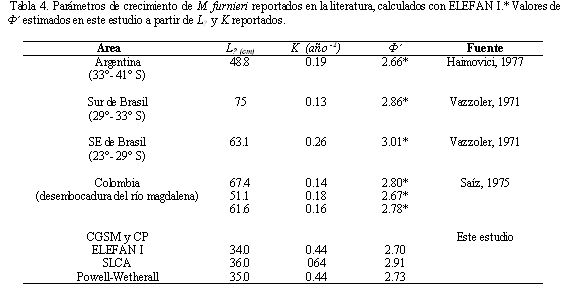
La estimación del índice de desempeño del crecimiento (Ø') arrojó resultados muy similares entre SLCA (2.89-3.00) y Powell-Wetherall (2.94-3.11), a diferencia de ELEFAN I que presentó valores inferiores a los anteriores (2.66-2.73). En efecto, el ANOVA no paramétrico mostró diferencias en los rangos de Ø' entre métodos (Kruskal-Wallis H '= 30.81; p<<0.01). Teniendo en cuenta los valores mínimos en los estimadores de precisión (CV y PE), los mejores resultados fueron obtenidos por el método de SLCA, seguidos por el ELEFAN I y Powell-Wetherall.
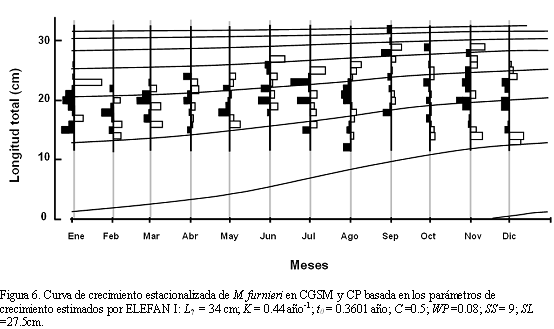
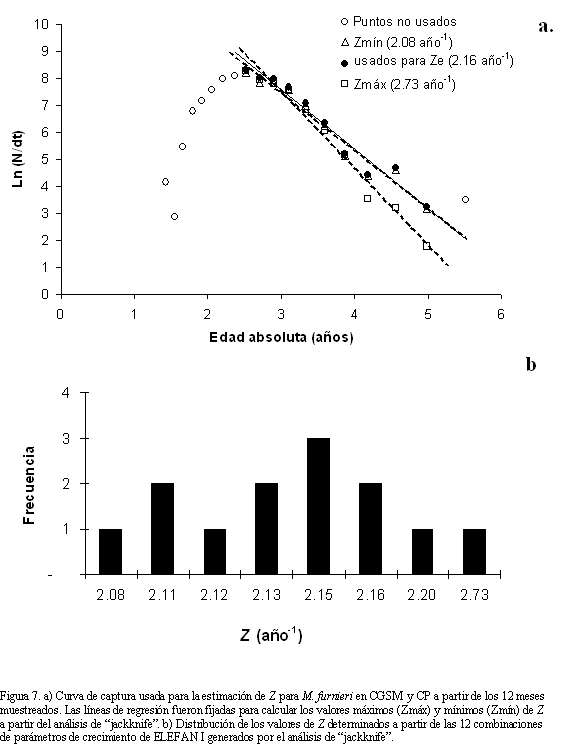
Todas las estimaciones de mortalidad fueron basadas en los parámetros de crecimiento obtenidos por ELEFAN I (Tabla 2), debido a mayor consistencia de las estimaciones con la literatura (ver discusión). La mortalidad total (z) se estimó en 2.16 año-1 (Figura 7a). Este valor se encontró entre los estimados a partir del análisis de "jackknife", en donde se aprecia un rango de variación de Z entre 2.08 y 2.73 año-1 (Figura 7b). La mortalidad natural (M) a partir de la ecuación empírica de Pauly (Mp) arrojó un valor de 1.04 año-1, usándose para este estimado una temperatura promedio anual de 30o C; mientras que la estimación por la ecuación de Rikhter y Efanov (MRE) fue de 0.64 año-1, utilizando una edad de 2.5 años, correspondiente a la TMM de M. furnieri en CGSM y CP (20.7 cm). A partir de estos valores se obtuvo un estimado promedio de 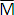 = 0.84 año-1. De este valor, se calculó la tasa de mortalidad por pesca (F) en 1.32 año-1, presentando un rango de variación entre 1.24 y 1.84 año-1. En consecuencia, la tasa de explotación (E) fue de 0.61 año-1 (con un rango entre 0.60 y 0.69 año-1).
= 0.84 año-1. De este valor, se calculó la tasa de mortalidad por pesca (F) en 1.32 año-1, presentando un rango de variación entre 1.24 y 1.84 año-1. En consecuencia, la tasa de explotación (E) fue de 0.61 año-1 (con un rango entre 0.60 y 0.69 año-1).
DISCUSIÓN
Reproducción
Este trabajo analiza algunos aspectos reproductivos y por primera vez los parámetros de crecimiento de M. furnieri para la CGSM-CP. Se determinó que los machos y hembras de M. furnieri poseen un crecimiento en peso muy similar, el cual se mantuvo relativamente constante para las hembras durante todo el periodo de muestreo, no ocurriendo lo mismo para los machos.
M. furnieri presentó un crecimiento en peso alométrico mayorante, indicando que su peso aumenta a una tasa mayor que la longitud. Esto fue evidente cuando se determinó que la constante "b" de la regresión potencial fue mayor a 3 (prueba t, p<0.05; Pauly, 1984). Estos resultados concuerdan con los de Escobar (1994), quien estimó para la misma área de estudio un valor de 3.19, cercano al de este estudio. A diferencia de esto, Manjarrés et al. (1993) determinaron que las hembras de M. furnieri en el área marina adyacente de la CGSM-CP mostraron un crecimiento en peso mayor que el de los machos, presentándose para estos últimos un crecimiento alométrico. La diferencia entre este resultado y el obtenido en el presente trabajo, se explica en el hecho de que en las regiones con condiciones estuarinas, el crecimiento en peso es mayor que en áreas costeras, lo cual está relacionado principalmente con la disponibilidad del alimento (Vazzoler, 1991).
Con respecto a la proporción de sexos de los peces, esta varió a lo largo del periodo de muestreo de manera análoga como ocurre en el ciclo de vida de las especies (Vazzoler, 1996). En el presente estudio, aún cuando la proporción de hembras fue mayor que la de machos durante todas las prospecciones, se presentaron grandes fluctuaciones entre épocas, especialmente en los meses de lluvia. Nikolsky (1963), señaló que aunque en la mayoría de las especies la relación tiende a ser 1:1, ésta puede variar considerablemente entre las especies y diferir de una población a otra, e incluso variar de un año a otro dentro de la misma población. En consecuencia, es entendible la existencia de distintas proporciones para la misma especie en CGSM-CP y su costa adyacente (Manjarrés et al., 1993; Escobar, 1994).
La presencia de hembras maduras y desovadas, durante casi todas las épocas de muestreo, sugiere un largo periodo reproductivo en el que se presentan varios desoves parciales; ocurriendo el principal en noviembre, cuando el factor de condición de la población fue mayor (Figura 2b). Tales eventos están relacionados con bajos valores de salinidad y temperatura y altos valores de precipitación y de caudales de los ríos que bajan de la Sierra Nevada de Santa Marta en CGSM-CP (Kaufmann y Hevert, 1973; Wiedemann, 1973; Blanco et al., 2006). Estos resultados en parte concuerdan con los obtenidos por Escobar (1994), quien señaló dos picos reproductivos, uno mayor de diciembre a febrero y uno menor desde marzo hasta junio. En mayor detalle, se observó que los individuos maduros y desovados fueron más abundantes en los sectores aledaños a la desembocadura de los ríos. Algo similar fue descrito para el estuario del río de la Plata por Acha et al. (1999) y Macchi et al. (2003) donde los desoves de M. furnieri suelen ocurrir en la parte más interna del estuario, argumentando que los sitios de desoves pueden ser seleccionados de acuerdo con las condiciones ambientales del agua, en este caso la salinidad como el principal factor.
La TMM estimada para hembras fue muy inferior a la reportada en otros estudios (Tabla 3). Saíz (1975), determinó una TMM entre 23.5 y 24.5 cm para las costas adyacentes de la desembocadura del río Magdalena; mientras que Escobar (1994) reportó una entre 26.3 y 30.3 cm para la CGSM. Con este estudio se puede llegar inferir una reducción en la TMM de M. furnieri, atribuida ésta a la intensa presión pesquera a la que ha sido sometido el recurso y a la falta de manejo pesquero. Esta situación de las especies ha sido descrita en la CGSM-CP (Tíjaro et al., 1998; Rueda y Santos-Martínez, 1999; Sánchez et al., 1998).
Crecimiento y mortalidad
Los estimados de L∞ obtenidos con los diferentes métodos en este estudio son inferiores a los reportados en la literatura, los cuales varían entre 48.8 y 78 cm; mientras que K presentó valores superiores a esos (Tabla 4). Teniendo en cuenta los valores mínimos en los estimadores de precisión (CV y PE) obtenidos de los tres métodos usados para estimar crecimiento, los mejores resultados fueron obtenidos por el método SLCA, seguidos por ELEFAN I y el gráfico de Powell-Wetherall. Sin embargo, los valores de L∞ y K obtenidos por ELEFAN I presentan mayor semejanza con los encontrados en la literatura (Tabla 4), por tal razón, y debido a que este método toma en cuenta la estacionalidad en el crecimiento, se decidió considerar estos valores para la estimación de las tasas de mortalidad.
Cuando se compararon los valores de Ø' obtenidos en este trabajo con los observados en otras poblaciones, no difirieron entre sí; por lo tanto, el crecimiento de M. furnieri en CGSM-CP corresponde al descrito en otras latitudes. Para la combinación de los parámetros L∞ y K que mejor se ajustó a los datos, se obtuvo un valor máximo de Rn igual a 0.2, señalando que no existe una clara progresión modal de las frecuencias de longitudes. Se detectó una oscilación estacional en el patrón de crecimiento (C) de 0.5, con una tasa de crecimiento mínima (WP) en enero de 0.08.
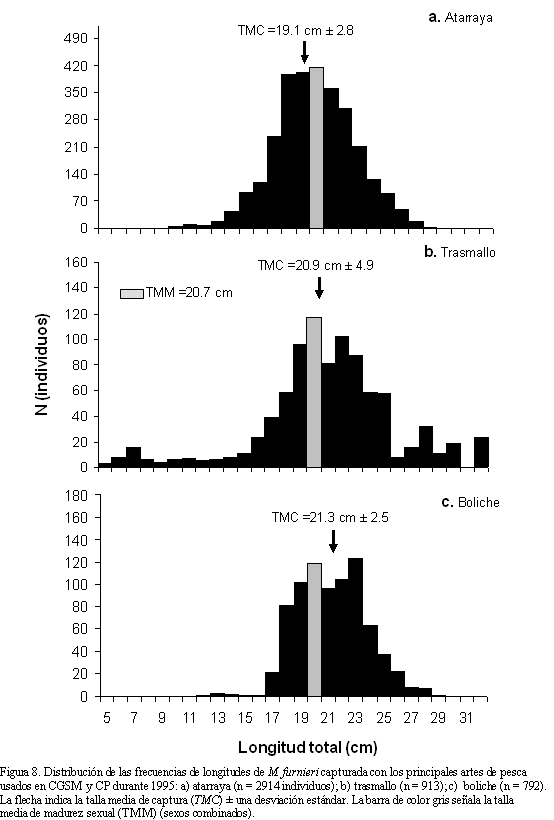
En la CGSM y CP se viene presentando un alto esfuerzo de pesca (Santos-Martínez et al., 1998; Rueda y Santos-Martínez, 1999; Rueda y Defeo, 2003), lo cual se ve reflejado en los valores de las tasas de explotación de muchas especies, por ejemplo para el chivo mapalé Cathorops mapale (E =0.66 año-1; Tíjaro et al., 1998), la mojarra rayada Eugerres plumieri (E = 0.61 año-1; Rueda y Santos-Martínez, 1999) y la lisa Mugil incilis (E = 0.71 año-1; Sánchez et al., 1998). Para el caso de M. furnieri, la tasa de explotación estimada indicó que esta especie se encuentra sobreexplotada (E = 0.61 año-1), bajo la premisa de una población alcanza su rendimiento óptimo cuando la fracción de muertes causada por la pesca es de 0.5 (Gulland, 1971). Una clara evidencia de la sobreexplotación de este recurso es el hecho de que M. furnieri está siendo capturada por la pesquería a partir de los 5.5 cm de longitud total, con una talla media de captura (TMC) de 20.4 cm, levemente inferior a la TMM (20.7 cm). Según Rueda y Santos-Martínez (1999), esto puede deberse a la utilización de artes de pesca poco selectivos en CGSM y CP como las atarrayas y redes camaroneras. Lo anterior afecta la renovación natural del recurso, ya que impide que al menos el 50% de la población alcance a madurar por primera vez.Tomando en cuenta las distribuciones de frecuencias de longitud en 1995 de M. furnieri para cada arte de pesca, se aprecia que las atarrayas (Figura 8a) son las que mayor efecto ejercieron sobre la población, ya que la TMC (19.1±2.8 cm) está por debajo de la TMM. Sin embargo, se determinó que los trasmallos (Figura 8b) también causaron un impacto sobre el recurso, ya que se observaron individuos capturados a partir de una longitud de 5 cm y una TMC de 20.9±4.9 cm. Aparentemente, las artes que menos impactaron al recurso fueron los boliches (Figura 8c), ya que se determinó una TMC igual a 21.3±2.5 cm. En general, todos los artes analizados afectan al recurso M. furnieri, ya que una TMC global fue 20.4±3.4 cm, valor que se sobrepone al de la TMM.
En conclusión, este trabajo sugiere que la población de M. furnieri en CGSM-CP está en la fase de sobreexplotación. Es necesario diseñar estrategias de manejo que sean consistentes con el enfoque precautorio para la pesca responsable de este recurso (Garcia, 1996; Caddy 1999). Retomando las sugerencias de Caddy (1999) y lo discutido por Rueda y Defeo (2003), las estrategias pueden ser aplicadas dentro de un marco de redundancia de manejo, donde tal marco podría consistir de una mezcla de medidas que involucre criterios de selectividad de artes, vedas en lugares estratégicos (p.e. cerca al manglar) y el aumento de las tallas medias de captura. En este sentido, este trabajo recomienda aumentar los tamaños de malla por encima de 6.98 cm y la talla media de captura a 21 cm. Así habrá certeza de capturar una mayor proporción de individuos por encima de la talla media de madurez sexual para garantizar la sostenibilidad de este recurso.
AGRADECIMIENTOS
Este trabajo hizo parte del proyecto de grado de E. Cancio para obtener el título de Ingeniero Pesquero en la Universidad del Magdalena, quién contó con el apoyo del Programa Valoración y Aprovechamiento de Recursos Marinos y Costeros del INVEMAR. Agradecemos a F. Newmark, E. Viloria y M. Rueda por colaborar en el desarrollo de este trabajo y a los pescadores de la CGSM por su importante apoyo en la colecta de los datos. Así mismo, a E.M. Acha (INIDEP, Argentina) por suministrar valiosa información. También agradecemos a dos anónimos evaluadores por sus comentarios.
BIBLIOGRAFÍA
1. Acha, E.M., H. Mianzan, C.A. Lasta y R.A. Guerrero. 1999. Estuarine spawning of the whithemouth croaker Micropogonias furnieri (Pisces: Sciaenidae), in the Río de la Plata, Argentina. Mar. Freswater Res,. 50: 57-65. [ Links ]
2. Aguilar, C., G. González-Sansón, E. Guevara y A. Bosch. 1992. Estructura de las comunidades de peces en la bahía de Cienfuegos y la laguna Guanaroca, Cuba. Rev. Invest. Mar., 13 (3): 222-232. [ Links ]
3. Álvarez-León, R. y J. Blanco. 1985. Composición de las comunidades ictiofaunísticas de los complejos lagunares y estuarios de la bahía de Cartagena, Ciénaga de Tesca y Ciénaga Grande de Santa Marta, Caribe Colombiano. En: Yánez-Arancibia (ed). Ecología de comunidades de peces en estuarios y lagunas costeras: 535-555. [ Links ]
4. Álvarez, R. y O. Pomares. 1997. Aspectos biológicos del roncador Micropogonias furnieri en el Golfo de Venezuela. Zootecnia Tropical 15(2):191-208. [ Links ]
5. Arena, G.J. y E. Hertl. 1983. Aspectos referentes al ciclo reproductivo de la corvina blanca (Micropogon opercularis) del sub-área platense. Inf. Réc. Inst. Nac. Pesca, Montevideo No. 36. 24 p. [ Links ]
6. Blanco, J. A., E. A. Viloria y J.C. Narváez B. 2006. ENSO and interannual salinity changes in the Ciénaga Grande de Santa Marta coastal lagoon system, colombian Caribbean. Est. Coast. Shelf. Sci.,66: 157-167. [ Links ]
7. Botero, L. y L.E. Mancera. 1996. Síntesis de los cambios de origen antrópico ocurridos en los últimos 40 años en la Ciénaga Grande de Santa Marta (Colombia). Rev. Acad. Colomb. Cien.,20: 465-474. [ Links ]
8. Botero, L. y H. Salzwedel. 1999. Rehabilitation of the Ciénaga Grande de Santa Marta, a mangrove-estuarine system in the Caribbean coast of Colombia. Ocean. Coast. Manage., 42: 243-256. [ Links ]
9. Caddy, J.F. 1999. Fisheries management in the twenty-first century: will new paradigms apply?. Rev. Fish. Biol. Fisheries, 9:1-43. [ Links ]
10. Castello, J. P. 1985. La ecología de los consumidores del estuario de la Lago dos Patos, Brasil. En: Yánez-Arancibia (ed). Ecología y comunidades de peces en estuarios y lagunas costeras: Hacia una integración del Ecosistema: 383-406. [ Links ]
11. Cervigón, F. 1985. La íctiofauna de las aguas estuarinas del delta del río Orinoco en la costa Atlántica Occidental, Caribe. En: Yánez-Arancibia (ed). Ecología y comunidades de peces en estuarios y lagunas costeras: Hacia una integración del Ecosistema: 57-78. [ Links ]
12. Cervigón, F. 1993. Los peces marinos de Venezuela, Tomo II. Fundación Científica Los Roques. Caracas, Venezuela. 498 p. [ Links ]
13. Escobar, M. 1994. Aspectos biológicos y ecológicos, con énfasis en reproducción y alimentación, de Micropogonias furnieri (Desmarest, 1823) y Stellifer venezuelae (Schultz) (Pisces: Sciaenidae), Ciénaga Grande de Santa Marta, Caribe Colombiano. Tesis Biología Marina, UJTL. 132 p. [ Links ]
14. Fisher, W. (ed.), 1978. FAO species identification sheets for fishery purposes. Western Central Atlantic (fishing area 31). Roma, FAO, Vol. 6. [ Links ]
15. García-Berthou E. y R. Moreno-Amich. 1993. Multivariate analysis of covariance in morphometrics studies of the reproductive cycle. Can. J. Fish. Aquat. Sci., 50:1394-1399. [ Links ]
16. Garcia, S.M. 1996. The precautionary approach to fisheries and its implications for fishery research, technology and management: an updated review. En: Precautionary approach to fisheries. Part 2. FAO Fish Tech Pap 350/2, Rome, p 1-75. [ Links ]
17. Gayanilo, F. C., P. Sparre y D. Pauly. 1993. The FISAT user's guide. FAO-ICLARM Stock Assessment Tools. FAO Comput. Inf. Ser. Fish. 99. 125 p. [ Links ]
18. Gulland, J.A. (ed.) 1971. The fish resources of the oceans. Fishing News Books. West Byfleet, Surrey, UK. 255 p. [ Links ]
19. Haimovici, M. 1977. Idade, cresciemto e aspecto gerais da biologia da corvina M. opercularis (Quoy y Gaimard, 1824) (Pises, Sciaenidae). Atlántica, 2(1): 21-49. [ Links ]
20. Holden, M.J y D.F.S. Raitt. 1975. Manual de Ciencia Pesquera: parte 2. Métodos para investigar los recursos y su aplicación. FAO, Documentos Técnicos de pesca 115. 211p. [ Links ]
21. IGAC, 1973. Monografía del Departamento del Magdalena. Inst. Geogr. Agustín Codazzi, Bogotá. [ Links ]
22. INVEMAR-LOUISIANA, 2001. Estructura y Función de un Ecosistema de manglar a lo largo de una trayectoria de restauración en diferentes niveles de perturbación. Informe Técnico Final: Programa CAM (Calidad Ambiental Marina). Conv. MMA-INVEMAR-COLCIENCIAS 429/97 - U. LOUSIANA AT LAFAYETTE. Santa Marta, Octubre de 2001. 242 p + anexos. [ Links ]
23. Isaac, V. J. 1988. Synopsis of biological data on the whitemouth croaker Micropogonias furnieri (Desmarest, 1823). FAO Fish. Sinopsis, 150. 35p. [ Links ]
24. Kaufmann, R. y H. Hevert. 1973. El régimen fluviométrico del Río Magdalena y su importancia para la Cienaga Grande de Santa Marta. Mitt. Inst. Colombo-Alemán Invest. Cient., 7: 121-137. [ Links ]
25. Lowe-McConnel, R.H. 1966. The Sciaenidae fishes of British Guaina. Bull. Mar. Sci.,16(1): 20-57. [ Links ]
26. Macchi, G.J., E.M. Acha y M. Militelli. 2003. Seasonal egg production of whitemouth croaker in the Rio de la Plata estuary, Argentina-Uruguay - Micropogonias furnieri. Fish.Bull., 101:332-342. [ Links ]
27. Manjarrés, L., J. Infante y A. Rueda. 1993. Aspectos biológico-pesquero de las principales especies ícticas capturadas en el área de Santa Marta. Proyecto integral de investigaciones y desarrollo de la pesca artesanal marítima en el área de Santa Marta: 69 - 100 p. [ Links ]
28. Narváez, J.C., M. Rueda, E. Viloria M., J. Blanco, J.A. Romero y F. Newmark. 2005. Manual del sistema de información pesquera del INVEMAR (SIPEIN Ver.3.0): Una herramienta para el diseño de sistemas de manejo. Instituto de Investigaciones Marinas y Costeras - INVEMAR. Santa Marta, Colombia. 128 p. (Serie de documentos generales del INVEMAR, No. 18). [ Links ]
29. Nikolsky, G.V. 1963. The Ecology of Fishes. Acd. Press London and New York. 392 p. [ Links ]
30. Pauly, D. 1980. On the interrelationships between natural mortality, growth parameters, and mean environmental temperature in 175 fish Stocks. J. Cons. CIEM 39(2): 175-192. [ Links ]
31. Pauly, D. 1984. Fish population dynamics in tropical waters: a manual for use with programmable calculators. ICLARM Studies and Reviews, Manila, 8: 325 pp. [ Links ]
32. Pauly, D. y J. Munro. 1984. Once more on the comparison of growth in fish and invertebrates. Fishbyte, 2(1):21. [ Links ]
33. Rueda M. y A. Santos-Martínez. 1997. Evaluación de la eficiencia y selectividad de la red bolichera en la pesquería de la Ciénaga Grande de Santa Marta. Caribe colombiano. Bol. Inv. Mar. Cost., 26: 17-34. [ Links ]
34. Rueda M. y A. Santos-Martínez. 1999. Population dynamics of the striped mojarra Eugerres plumieri from the Ciénaga Grande de Santa Marta, Colombia. Fish. Res. 42:155-166 [ Links ]
35. Rueda, M. y O. Defeo. 2003. Linking fishery management and conservation in a tropical estuarine lagoon: biological and physical effects of an artisanal fishing gear. Est. Coast. Shelf. Sci., 56: 1-9. [ Links ]
36. Saíz, E. 1975. Estudio biológico-pesquero del Micropogon furnieri (Desmarest, 1822) Pisces: Sciaenidae, "pacora" en el Caribe Colombiano. Tesis. Biología Marina. UJTL. 133 p. [ Links ]
37. Sánchez C.M., M. Rueda y A. Santos-Martínez. 1998. Dinámica poblacional y pesquería de la lisa Mugil incilis, en la Ciénaga Grande de Santa Marta. Rev. Acad. Colomb. Cien., 22(85) 507-517. [ Links ]
38. Santos-Martínez, A. 1989. Estudio biológico y ecológico de la ictiofauna de la Cienaga Grande de Santa Marta, Caribe colombiano. Tesis M. Sc. Univ. Nal. Col. Bogotá, 178 pp. [ Links ]
39. Santos-Martínez, A. y A. Acero. 1991. Fish community of the Ciénaga Grande de Santa Marta (Colombia). Composition and zoogeography. Ichthyol. Explor. Freshwaters, 2(3): 247-263. [ Links ]
40. Santos-Martínez, A., E. Viloria, C. Sánchez, M. Rueda, R. Tijaro, M. Grijalba y J. Narváez B. 1998. Evaluación de los principales recursos pesqueros de la Ciénaga Grande de Santa Marta, costa Caribe Colombiana. Código 2105-09-028-94, Santa Marta: INVEMAR. Vol. 2 + 3 disquete + anexos. [ Links ]
41. Sparre, P. y S. C. Venema. 1995. Introducción a la evaluación de recursos pesqueros tropicales. Parte I. Manual. FAO, Documento Técnico de Pesca 306 (1): 420 pp. [ Links ]
42. Tíjaro R., M. Rueda y A. Santos-Martínez. 1998. Dinámica poblacional del chivo mapalé Cathorops spixii en la Ciénaga Grande de Santa Marta y Complejo de Pajárales, Caribe colombiano. Bol. Inv. Mar. Cost., 27: 87-102. [ Links ]
43. Vazzoler, A. E. A. 1971. Diversifição fisiológica e morfológica de Micropogonias furnieri (Desmarest, 1822) ao sul de Cabo Frio. Brasil. Bolm. Inst. Oceanog., S. Paulo,20(2): 1-70. [ Links ]
44. Vazzoler, A. E. A. 1991. Sintese de conhecimentos sobre a biología da corvina, Micropogonias furnieri (Desmarest, 1823), da costa do Brasil. Atlántica, 13 (1): 55-74. [ Links ]
45. Vazzoler, A. E. A. 1996. Biología da reproducão de peixes teleósteos:Teoria e práctica. Universidade Estadual de Maringa. 169 p. [ Links ]
46. Wiedemann, H. 1973. Reconnaissance of the Ciénaga Grande de Santa Marta, Colombia: Physical parameters and Geological History. Mitt. Inst. Colombo-Alemán Invest. Cient., 7: 85-119. [ Links ]
47. Zar J. 1996. Biostatistical analysis. Third Edition. Prentice Hall, New Jersey, 918 pp. [ Links ]
FECHA DE RECEPCIÓN: 03/02/05 FECHA DE ACEPTACIÓN: 22/03/06