Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.35 no.1 Santa Marta Jan./Dec. 2006
DETERMINACIÓN DE LA CAPACIDAD ANTIEPIBIÓTICA DE LOS EXTRACTOS ORGÁNICOS CRUDOS DE LAS ESPONJAS MARINAS CRIBROCHALINA INFUNDIBULUM Y BIEMNA CRIBARIA
ANTIFOULING CAPACITY DETERMINATION OF CRUDE ORGANIC EXTRACTS FROM THE MARINE SPONGES CRIBROCHALINA INFUNDIBULUM AND BIEMNA CRIBARIA
Jazmín Arias1, Sven Zea2, Federico Newmark1 y Marisol Santos-Acevedo1
1Instituto de Investigaciones Marinas y Costeras (INVEMAR), Cerro Punta Betín, Santa Marta, Colombia. E-mail: fitosporaceae@yahoo.com (J.A), fnewmarkum@yahoo.es (FN), msantos@invemar.org.co (MSA)
2Universidad Nacional de Colombia, Departamento de Biología, CECIMAR/INVEMAR, Cerro Punta Betín, Santa Marta, Colombia. E-mail: szea@invemar.org.co
RESUMEN
Los organismos marinos sésiles pueden utilizar mecanismos físicos, químicos y biológicos para controlar (evitar o inducir) la epibiosis. Como una primera aproximación hacia mecanismos químicos, en este estudio se evaluó la capacidad antiepibiótica de los extractos orgánicos crudos de las esponjas marinas Cribrochalina infundibulum (=C. vasculum) y Biemna cribaria. Los extractos fueron incluidos a concentración natural en geles a base de agar, y dispuestos en campo durante 28 días para ofrecerlos como sustrato a la comunidad epibiótica natural y así comparar el grado de colonización en comparación con geles control sin extracto. Se encontró que los extractos de ambas esponjas inhiben significativamente la colonización de la mayoría de los grupos de organismos epifaunales, siendo B. cribaria más efectiva que C. infundibulum y, así mismo, que su tasa de liberación de extracto al medio es menor, por lo que su acción inhibitoria es más duradera.
PALABRAS CLAVE: Antiepibiosis, extractos orgánicos, Cribrochalina infundibulum, Biemna cribaria, Caribe colombiano.
ABSTRACT
Sessile organisms can use physical, chemical, and biological mecanisms to control, avoid or induce epibiosis. The antifouling capacity of crude organic extracts from the marine sponges Cribrochalina infundibulum (=C. vasculum) and Biemna cribaria, was evaluated. Natural concentrations of sponges extracts were added to agar based gels and deployed in the field during 28 days, to offer substrate to natural epibiotic community. Colonization extent was then compared with control gels without extracts. Extracts from both sponges significatively inhibited the colonization of most of epifaunal organisms. B. cribaria was found to be more effective than C. infundibulum; moreover its extract lixivation was lower with a longer inhibitory action.
KEY WORDS: Antifouling, Organic extracts, Cribrochalina infundibulum, Biemna cribaria, Colombian Caribbean.
INTRODUCCIÓN
La epibiosis se define como el asentamiento de organismos en crecimiento sobre las superficies animadas e inanimadas sumergidas; es un fenómeno que puede ser favorable, neutro o tener efectos letales tanto para el epibionte como para el basibionte (Henrikson y Pawlik, 1998; Puyana, 2002). Sin embargo, hay que tener en cuenta que no todos los organismos marinos presentan epibiontes.
La colonización de una nueva superficie sumergida en un medio acuático está compuesta generalmente por cuatro fases que se superponen: acondicionamiento bioquímico, colonización bacteriana, colonización unicelular y, finalmente, colonización de eucariotes multicelulares. En la primera fase hay adsorción de compuestos químicos orgánicos disueltos (Wahl, 1989; Callow y Callow, 2002); la colonización bacteriana se refiere a una cubierta bacteriana creciente formada por células vivas, muertas y mucopolisacáridos (Wahl, 1989; Else et al., 2003). La colonización por eucariotes unicelulares comprende la llegada de levaduras, protozoos y diatomeas y finalmente la colonización de organismos multicelulares se refiere al establecimiento de larvas meroplanctónicas y esporas algales (Wahl, 1989).
Entre las especies con una forma de vida sésil, es común la defensa química contra la epibiosis mediante la liberación o exudación de compuestos químicos (Van Alstyne y Paul, 1988; Wahl, 1989; Pawlik, 1993; Berembaum, 1995; Hay, 1996; Sammarco y Coll, 1997; Puyana, 2002; Thakur y Müller, 2004). Los extractos químicos de los organismos marinos contienen un vasto despliegue de compuestos con actividad antibacterial, antialgal, antilarval y otras actividades nocivas, menos definidas, que podrían ser empleadas para impedir, controlar o inducir la epibiosis. La protección contra la epibiosis es una posible función defensiva de algunos productos naturales marinos, aislados de organismos bentónicos o sésiles, en particular las esponjas (Henrikson y Pawlik, 1995).
Por otro lado, la detección de actividades antiepibióticas en los extractos orgánicos crudos de diversos organismos marinos tiene un notable interés en la industria, ya que actualmente hay una búsqueda en torno a alternativas limpias a los métodos antiepibióticos tradicionales (cobre, tributilestaño) que tienen serias consecuencias sobre el ambiente [toxicidad en un amplio rango de organismos acuáticos, contaminación de sedimentos en fondos marinos y dermatitis severa en humanos (IMO, 2002)], con el fin de contrarrestar los inconvenientes que causan los epibiontes sobre embarcaciones y otras estructuras sumergidas (aumento en el consumo de combustible, altos costos en la limpieza y remoción de pintura de los cascos, así como las medidas de conformidad asociadas (IMO, 2002; Callow et al., 2003)). Durante la realización de este estudio se buscó determinar la capacidad antiepibiótica de los extractos orgánicos crudos de las esponjas marinas Cribrochalina infundibulum y Biemna cribaria, con el fin de tener una aproximación al papel ecológico (defensa contra epibiontes) de los compuestos presentes en dichos extractos.
MATERIALES Y MÉTODOS
Recolección
Se seleccionaron las especies C. infundibulum y B. cribaria como ejemplo de una esponja expuesta y una críptica, respectivamente. Las esponjas fueron recolectadas mediante buceo con equipo autónomo, en la ensenada Granate (11o 20'-11o 21' 15'' N y 74o 08'-74o 07' 43'' W) en diciembre de 2003 a 23 m de profundidad (B. cribaria) y Punta de Betín (Bahía de Santa Marta, 11o 15' 6'' N y 74o 13' 15'') en febrero de 2004 a 11 m de profundidad (C. infundibulum). Se tomaron aproximadamente 600 g de cada esponja con ayuda de un cuchillo y se introdujeron en bolsas plásticas con cierre hermético. Se registraron las características de los organismos en su ambiente natural, tales como forma, coloración, consistencia y características de superficie y ósculos. Las esponjas se trasladaron a los laboratorios del Instituto de Investigaciones Marinas y Costeras -INVEMAR en Santa Marta. Se conservó un fragmento de cada especie en etanol 70% como muestra testigo, depositada en el Museo de Historia Natural Marina de Colombia, con sede en INVEMAR (INV-POR-895 para C. infundibulum; INV-POR-890 para B. cribaria). El resto de esponja se congeló inmediatamente a -15 oC para evitar la posible degradación de sus componentes químicos.
Preparación de los extractos
Para determinar la concentración natural de extracto en las esponjas se realizaron mediciones volumétricas de los fragmentos de esponja húmeda a ser extraída, en una probeta con agua de mar filtrada. Posteriormente se liofilizaron y se sometieron a extracción en dos rondas, una con metanol grado analítico y la otra, luego de separar el sobrenadante por filtración, con metanol: diclorometano (2:1). Los sobrenadantes de las dos rondas se juntaron y el solvente se evaporó en un rotavapor. Previo a su utilización, los extractos fueron resuspendidos en cantidades mínimas de metanol: diclorometano (2:1).
Desarrollo de la prueba antiepibiótica
Para el experimento se preparó un medio gelatinoso de agar compacto (Phytagel®), el cual se sirvió en cajas de Petri de 10 cm de diámetro, realizando 10 réplicas por tratamiento. Para cada caja se disolvieron para los controles 0.32 g de Phytagel en 20 ml de agua desionizada y para los tratamientos (extractos) se disolvieron 0.21 g de Phytagel en la misma cantidad de agua [Chaves (2003), metodología modificada de Henrikson y Pawlik (1995)]. Estas cantidades diferentes responden a la necesidad de lograr una consistencia equivalente en los geles control y aquellos con extracto. En cada caso se prepararon 200 ml de gel para llenar las 10 cajas réplicas, una vez disuelto el polvo de agar, se calentó y agitó para lograr homogeneizar la mezcla.
Inmediatamente y en caliente se añadieron los solventes y extractos. Para preparar los geles control se usaron, por caja de Petri, 5.13 ml de metanol: diclorometano (2:1); para los tratamientos de C. infundibulum, 4.8 ml de extracto y para los de B. cribaria, 2.87 ml de extracto. Estas cantidades equivalen al contenido natural de extracto en 20 ml de esponja en cada una de las especies estudiadas, y las cantidades del solvente utilizado para suspender el extracto. Previamente al servido de los geles, a las cajas se les pegó una malla plástica en el fondo para evitar que el gel se desprendiera al ser inmerso en el medio marino. Los geles calientes se sirvieron en las cajas y se dejaron enfriar a temperatura ambiente. Las cajas fueron pegadas sobre tabletas rectangulares de acrílico de 10 x 15 cm. Las tabletas fueron amarradas en orden aleatorio a un marco de tubo de PVC de media pulgada, que se ubicó a 1.5 m de profundidad en Punta Betín, amarrado en forma ligeramente inclinada (aproximadamente 20o), por un lado al tubo de toma de agua de mar, y por el otro a unos bloques de cemento, quedando el gel orientado boca abajo, hacia el fondo, para evitar que éstos se llenaran de sedimento y fueran colonizados principalmente por algas, y para promover una mayor fijación de epibiontes, que usualmente prefieren los sustratos crípticos. Esta estructura permaneció durante 28 días en el mar a partir de la cuarta semana de junio de 2004.
Las cajas fueron recuperadas y se llevaron al laboratorio, donde se mantuvieron en acuarios con agua de mar filtrada, en flujo semicerrado y continuo. Bajo el estereoscopio se contó el número de individuos sésiles por grupo principal detectado (poliquetos, ascidias, briozoos, hidroides, esponjas y algas clorofíceas). También se estimó su cobertura usando el método de rejilla de puntos (Henrikson y Pawlik, 1995; Pereira et al.,2002; Chaves, 2003) seleccionando 100 puntos al azar en cada caja, bajo los cuales se registró el organismo presente; la proporción de puntos ocupados por cada clase de organismo en relación al total de puntos se usó para calcular la cobertura en porcentaje de área. Conteos y coberturas se compararon entre tratamientos (controles y extractos) mediante las pruebas estadísticas de Kruskal-Wallis y de comparaciones múltiples de Dunn, p = 0.05 (Siegel y Castellan, 1988). Al finalizar las observaciones y cuantificaciones, se seleccionaron aleatoriamente cinco cajas del tratamiento con extracto de C. infundibulum y con B. cribaria, y se sometieron al mismo proceso de extracción que los tejidos de esponja, con el fin de determinar el porcentaje promedio de extracto (en peso) que quedó en los geles después de permanecer 28 días en el mar y tres días en acuarios con agua marina filtrada en recirculación.
RESULTADOS
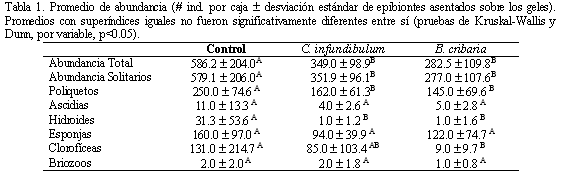
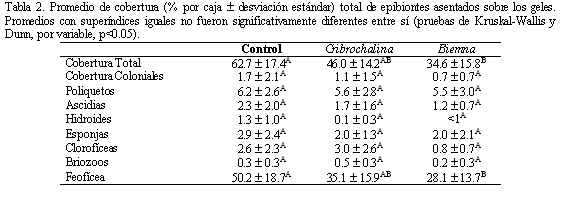
Después de 28 días en campo, se encontró en los controles una abundancia total de epibiontes significativamente mayor a los tratamientos, así como una de abundancia total de organismos solitarios, de poliquetos y de hidroides para ambos extractos. Para las algas clorofíceas encontradas (Enteromorpha) solamente el extracto de B. cribaria generó una menor abundancia (Tabla 1). En cuanto a cobertura, no hubo efecto en las variables analizadas por parte de los tratamientos; únicamente se presentó una disminución significativa de la cobertura total de epibiontes y de feofícea por parte de B. cribaria (Tabla 2).
En el caso de abundancia de poliquetos y de hidroides, la abundancia total de epibiontes y la abundancia total de organismos solitarios, existe un efecto notorio de inhibición del asentamiento por parte de los extractos de C. infundibulum y B. cribaria, ya que en los controles se presentó un número de individuos significativamente mayor (Kruskal-Wallis, p<0.05). Para la abundancia de clorofíceas, la cobertura de feofíceas y la cobertura total de epibiontes, se presentó una diferencia significativa (p<0.05) únicamente entre los controles y los geles con extracto de B. cribaria, mientras que C. infundibulum no tuvo efecto en estas variables; por lo tanto, B. cribaria tuvo más efecto inhibitorio en las diferentes variables medidas.
A pesar de que ninguna de las dos esponjas presenta naturalmente epibiontes, los extractos de éstas no inhibieron todos los grupos de organismos que se encontraron en los geles control. Después de 28 días de permanencia de los geles en el mar y tres en los acuarios, se encontró un remanente de extracto del 53.5% para B. cribaria y un 49.6% para C. infundibulum; lo cual indica una tasa de liberación ligeramente más baja del extracto de B. cribaria.
DISCUSIÓN
Los propágulos presentes en el medio marino normalmente se encuentran expuestos a un mosaico de señales positivas y negativas, como nutrientes, perturbaciones y organismos alelopáticos, que junto con las señales generadas por los extractos liberados de los geles podrían atenuar su asentamiento en los mismos. Sin embargo, no puede predecirse el comportamiento de las larvas frente a esta situación, ya que se desconoce el efecto particular de los extractos sobre los microepibiontes (Keough y Raimondi, 1995).
Los poliquetos serpúlidos y espirórbidos generalmente responden positivamente a la presencia de películas bacterianas (Fusetani, 1997), razón por la cual la disminución de estos epibiontes sobre los geles con extracto podría deberse en parte a una inhibición relativa de la formación de la biopelícula, sin embargo esto no ha sido comprobado. Por otra parte, la colonización bacteriana de superficies vivientes puede estar influenciada por los efectos de compuestos químicos exudados o asociados a la superficie, o respuestas quimotácticas (atracción o repulsión), o factores que afectan la motilidad de las células y la producción de polímeros extracelulares usados para que los organismos se fijen permanentemente (Puyana, 2002).
Las larvas que potencialmente responden diferencialmente a diversas señales químicas disueltas en la columna de agua hacen probable que los extractos liberados de los geles alteren las señales que favorecerían el asentamiento de dichas larvas, causando la disminución observada en la macroepibiosis (abundancia y cobertura totales de epibiontes, abundancias de poliquetos, Clorophyta e hidroides y cobertura de Phaeophyta). Se ha propuesto que esto podría darse muy cerca de la superficie, ya que los procesos de circulación en el mar pueden disolver rápidamente las señales químicas, haciendo poco probable que los compuestos solubles puedan estar presentes a concentraciones suficientes para influir en las larvas (Puyana, 2002). Sin embargo, en este estudio se determinó que la concentración de los extractos de las esponjas estudiadas se mantuvo en buena proporción en los geles, en especial para B. cribaria, aunque se desconoce aún el mecanismo de liberación por las esponjas, de los compuestos presentes en los extractos al medio.
Ninguna de las dos esponjas inhibió la totalidad de los organismos epibiontes. Esto indica que las esponjas podrían contener sustancias que no inhiben totalmente el asentamiento de algunos organismos, o que promueven el asentamiento de otros, o que la suma de los efectos de los compuestos contenidos en los extractos orgánicos crudos no tiene una inhibición efectiva de la epibiosis. Adicionalmente, la esponja podría usar otros mecanismos in vivo para evitar la epibiosis, como la liberación de altas cantidades de numerosos compuestos.
La posibilidad de que los extractos obtenidos de las esponjas no sean efectivos antiepibióticos contra ciertos organismos, podría tener varias causas: (1) Las esponjas simplemente no disuaden el asentamiento de algunos grupos de epibiontes por medio de este mecanismo. (2) Las sustancias antiepibióticas que aquellos organismos producen en ciertas temporadas podrían no haber coincidido con la época de recolección de las muestras. Se sabe que la producción de compuestos de algunos organismos marinos como las algas, presentan diferentes niveles de concentración durante el año (Hellio et al., 2003). (3) La presión de epibiosis marina varía durante el año debido a que, si bien en aguas tropicales el reclutamiento de invertebrados generalmente no está confinado a un periodo definido en el año, se presentan temporadas de reclutamiento en donde la intensidad fluctúa entre las especies (García y Salzwedel, 1993). Debido a que el ensayo se realizó en época lluviosa y la recolección de los ejemplares en época seca, existe la posibilidad de que no se haya detectado por completo el potencial antiepibiótico de los extractos orgánicos crudos de las esponjas estudiadas, ya que las defensas químicas contra epibiontes, consideradas metabólicamente costosas, pueden ser más prevalentes durante los momentos de picos de producción larval (Henrikson y Pawlik, 1998) cuando existe una relación entre la producción de sustancias antiepibióticas y picos de reclutamiento larval (Becerro et al., 1997). (4) La producción de extractos con marcada efectividad antiepibiótica podría presentarse sólo en ciertas poblaciones de la especie en cuestión, que puede no coincidir con aquella de donde se extraen los especímenes. (5) La esponja podría obtener ciertos beneficios de algunos epibiontes. A pesar de que los organismos epibiontes son generalmente considerados como detrimento para los hospederos, pueden tener efectos positivos si proveen un incremento en la resistencia a los consumidores (Hay, 1996). Se sabe que una variedad de compuestos de organismos marinos sésiles influencian el asentamiento larval y la metamorfosis de organismos bentónicos, algunos de los cuales juegan papeles importantes en la interacción de estos organismos, brindando por ejemplo protección al basibionte (Pawlik, 1992; Fusetani, 1997). Además, existe la posibilidad de que las larvas competentes usen características químicas de las esponjas como una señal para los sitios apropiados de establecimiento (Bingham y Young, 1991).
Las sustancias presentes en los extractos crudos están contenidas en diferentes fracciones químicas de las esponjas, de forma tal que la respuesta activa total puede ser una simple adición de las actividades individuales, o el resultado de un efecto sinergístico (Martín y Uriz, 1993; Selvin y Lipton, 2004). Por lo tanto, es posible que dentro del extracto también se presenten compuestos que estimulen el asentamiento de epibiontes, haciendo que el efecto de las sustancias antiepibióticas presentes en otras fracciones no se manifieste plenamente.
La carencia de epibiontes sobre las esponjas y el efecto de los extractos no parecen estar relacionados [cabe mencionar que en Cribrochalina se encontraron endobiontes que entran por la epidermis (Willemsen, 1994; Arias, 2004), lo cual se debe a varios factores: (1) Las características físicas de los dos sustratos son bastante disímiles; mientras que una superficie es viva (con todas las implicaciones dinámicas que esto involucra), la otra es inerte. (2) La textura, la forma y la humectación de las dos superficies no son comparables. (3) El lugar de obtención de la esponja es diferente al del montaje del experimento, por lo que las condiciones de microhábitat también difieren (profundidad, disposición de las superficies, corriente, temperatura, entre otras). Todo esto justifica profundizar en el uso real de los compuestos en la naturaleza, determinando primero cuáles son los responsables del efecto antiepibiótico y luego su ubicación a nivel celular y tisular. Además se debe evaluar si son exudados o se concentran en la superficie de la esponja y si los compuestos (y sus concentraciones) son constantes durante todas las fases de crecimiento de los organismos, entre individuos y poblaciones y a lo largo del año. Para tener una idea más aproximada de la potencialidad de los extractos provenientes de las esponjas marinas C. infundibulum y B. cribaria en el ámbito de la industria marina es preciso realizar ensayos que permitan determinar las cualidades antiepibióticas de las fracciones de los extractos y compuestos puros, provenientes de especímenes recolectados en diferentes épocas y localidades y compararlos con compuestos de uso comercial.
Otro factor a tener en cuenta en el empleo de los extractos como alternativa industrial es su permanencia en el medio que los contiene. Henrikson y Pawlik (1995) encontraron un remanente de 56% del extracto original de la esponja Hymeniacidon heliophila en los geles, al cabo de 21 días de permanencia en el mar. Hallando la tendencia de lixiviación del extracto de esta esponja y extrapolando a los 31 días (28 días de permanencia en el mar y tres en los acuarios), habría un remanente aproximado de 45.7%. Al comparar dichos valores con los obtenidos en este estudio, se puede observar una permanencia ligeramente mayor en los geles de los extractos de C. infundibulum (49.6%)y B. cribaria (53.5%). Sin embargo, debe tenerse en cuenta que ni en el presente estudio, ni en estudios anteriores realizados por otros autores, se ha verificado si el contenido del extracto obtenido de los geles coincide con el contenido de los extractos originales, esto se toma como un supuesto; además, aún no se sabe si los geles absorben exudados de los organismos fijados o del agua, que luego aparecerían en el extracto.
CONCLUSIONES
Los extractos orgánicos crudos de las esponjas marinas estudiadas inhibieron el asentamiento de varias clases de organismos epibiontes, siendo el de B. cribaria el que tuvo los valores más bajos (excepto en abundancia de ascidias, de hidroides y cobertura de esponjas). Adicionalmente tuvo una menor tasa de lixiviación desde la matriz gelatinosa.
La carencia de epibiontes sobre las esponjas marinas no parece estar relacionada con la capacidad antiepibiótica de los extractos provenientes de ellas; es decir, que no puede predecirse la respuesta de los extractos a partir de observaciones directas de la epifauna de los organismos in situ. Por lo tanto, los resultados obtenidos no son un reflejo de la realidad sino una aproximación a ella.
AGRADECIMIENTOS
Esta investigación fue financiada por el Fondo Colombiano de Investigaciones Científicas y Proyectos Especiales "Francisco José de Caldas" -COLCIENCIAS, dentro del "Proyecto piloto de prospección de bioactividad de organismos marinos colombianos", código: 2105-09-12456, y por el Instituto de Investigaciones Marinas y Costeras "José Benito Vives De Andréis" - INVEMAR. Contribución de INVEMAR y del Centro de Estudios en Ciencias del Mar - CECIMAR de la Facultad de Ciencias de la Universidad Nacional de Colombia.
BIBLIOGRAFÍA
1. Arias, J. 2004. Evaluación de la bioactividad y papel ecológico de los extractos orgánicos crudos de las esponjas marinas Cribrochalina vasculum y Biemna cribaria. Trabajo de grado para optar al título de Bióloga. Universidad Nacional de Colombia, Departamento de Biología, Bogotá. 82 p. [ Links ]
2. Becerro, M.A., M.J. Uriz y X. Turon. 1997. Chemically - mediated relations in benthic organisms: the chemical ecology of Crambe crambe (Porifera, Poecilosclerida). Hydrobiol., 185: 77-89. [ Links ]
3. Berembaum, M.R. 1995. Tournabout is fair play: secondary roles for primary compounds. J. Chem. Ecol., 21 (7): 925-940. [ Links ]
4. Bingham, B.L. y C.M. Young. 1991. Influence of sponges on invertebrate recruitment: a field test of allelopathy. Mar. Biol., 109: 19-26. [ Links ]
5. Callow, M.E y J.A. Callow. 2002. Marine biofouling: a sticky problem. Biologist, 49 (1): 1-5. [ Links ]
6. Callow, M.E. y A. S. Clare. 2003. Some new insights into marine biofouling. World Super Yacht, (1): 34-39. [ Links ]
7. Chaves, A. 2003. Evaluación del posible papel ecológico de los extractos orgánicos crudos de las esponjas excavadoras Cliona aprica Pang, 1973, C.caribbaea Carter, 1882, C.delitrix Pang, 1973 y C. tenuis Zea y Weil, sp. nov. Trabajo de grado para optar al título de Bióloga Marina. Fundación Universidad de Bogotá Jorge Tadeo Lozano. Santa Marta. 127 p. [ Links ]
8. Else, T.A., C.R. Pantle y P.S. Amy. 2003. Boundaries for biofilm formation: humidity and temperature. Appl. Environ. Microbiol., 69 (8): 5006 - 5010. [ Links ]
9. Fusetani, N. 1997. Marine natural products influencing larval settlement and metamorphosis of benthic invertebrates. Curr. Org. Chem., 1: 127-152. [ Links ]
10. García, C.B. y H. Salzwedel. 1993. Recruitment patterns of sessile invertebrates onto fouling plates in the bay of Santa Marta, Colombian Caribbean. An. Inst. Inv. Mar. Punta Betín., 22: 30-44. [ Links ]
11. Hay, M.E. 1996. Marine chemical ecology: what's known and what's next? J. Exp. Mar. Biol. Ecol., 200: 103 - 134. [ Links ]
12. Hellio, C., J.P. Marechal, B.Verón, G. Bremer, A.S. Clare y Y. Le Gal. 2003. Seasonal variation of antifouling activities of marine algae from the Brittany Coast (France). Mar. Biotechnol., 6: 67-82. [ Links ]
13. Henrikson, A.A. y J.R. Pawlik. 1995. A new antifouling assay method: results from field experiments using extracts of four marine organisms. J. Exp. Mar. Biol. Ecol., 194: 157-165. [ Links ]
14. Henrikson, A.A. y J.R. Pawlik. 1998. Seasonal variation in biofouling of gels containing extracts of marine organisms. Biofouling, 12 (1 - 3): 245-255 [ Links ]
15. IMO. International Maritime Organization. 2002. Antifouling systems. Londres, 31 p. [ Links ]
16. Keough, M.J. y P.T. Raimondi. 1995. Responses of settling invertebrate larvae to bioorganic films: effects of different types of films. J. Exp. Mar. Biol. Ecol., 185: 235-253. [ Links ]
17. Martín, D. y M.J. Uriz. 1993. Chemical bioactivity of Mediterranean benthic organisms against embryos and larvae of marine invertebrates. J. Exp. Mar. Biol. Ecol., 173: 11-27. [ Links ]
18. Pawlik, J.R. 1992. Chemical ecology of the settlement of benthic marine invertebrates. Oceanogr. Mar. Biol. Annu. Rev., 30: 273 - 335. [ Links ]
19. Pawlik, J.R. 1993. Marine invertebrate chemical defenses. Chem. Rev., 93: 1911-1922. [ Links ]
20. Pereira, R.C., A.G.V. Carvalho, B.A.P. Gama y R. Coutinho. 2002. Field experimental evaluation of secondary metabolites from marine invertebrates as antifoulants. Braz. J. Biol., 62 (2): 311-320. [ Links ]
21. Puyana, M. 2002. Chemical ecology in aquatic ecosystems. 23 p. En: Hardege (ed.): Chemical ecology. Encyclopedia of life support systems (EOLSS) under the auspices of the UNESCO. Ed. Publishers Oxford, Reino Unido. [ Links ]
22. Sammarco, P.W y J.C. Coll. 1997. Secondary metabolites -or primary? Re-examination of a concept through a marine example. Proc. 8th Int. Coral Reef Sym., 2: 1245-1250. [ Links ]
23. Selvin, J. y A.P. Lipton. 2004. Biopotentials of secondary metabolites isolated from marine sponges. Hydrobiol., 513: 231-238. [ Links ]
24. Siegel, S. y N.J. Castellan. 1988. Nonparametric statistics for the behavioral sciences. 2nd edition. Mc Graw-Hill Book Company.Nueva York, 399 p. [ Links ]
25. Thakur, N.L y W.E.G. Müller. 2004. Biotechnological potential of marine sponges. Current Science, 86 (11): 1506-1512. [ Links ]
26. Van Alstyne, K.L. y V.J. Paul. 1988. The role of secondary metabolites in marine ecological interactions. Proc. 6th Coral Reef Sym., 1: 175-186. [ Links ]
27. Wahl, M. 1989. Marine epibiosis I. Fouling and antifouling, some basic aspects. Mar. Ecol. Prog. Ser., 58: 175-189. [ Links ]
28. Willemsen, P.R. 1994. The screening of sponge extracts for antifouling activity using a bioassay with laboratory-reared cyprid larvae of the barnacle Balanus amphitrite. Int. Biodet. Biodeg., 361-373. [ Links ]
FECHA DE RECEPCIÓN: 25/04/05 FECHA DE ACEPTACIÓN: 20/09/06