Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.36 no.1 Santa Marta Jan./Dec. 2007
CAPACIDAD ANTIMITOTICA DE EXTRACTOS DE ESPONJAS MARINAS DEL CARIBE COLOMBIANO
ANTIMITOTIC CAPACITY IN EXTRACTS OF MARINE SPONGES FROM COLOMBIAN CARIBBEAN
Jennyfer Mora-Cristancho1, Sven Zea2, Marisol Santos-Acevedo1 y Federico Newmark-Umbreit1
1Instituto de Investigaciones Marinas y Costeras (INVEMAR), Cerro Punta de Betín A.A. 1016, Santa Marta, Colombia. E-mail: jmora@invemar.org.co (JMC); msantos@invemar.org.co (MSA); fnewmark@invemar.org.co (FNU)
2Universidad Nacional de Colombia, Departamento de Biología y Centro de Estudios en Ciencias del Mar CECIMAR . INVE MAR , Cerro Punta Betín, A.A. 1016, Santa Marta, Colombia. E-mail: szea@invemar.org.co
RESUMEN
La determinación de actividad antimitótica de extractos de organismos marinos genera expectativas para la obtención de sustancias con potencial anticancerígeno a partir de fuentes alternativas. Se evaluó la actividad antimitótica in vitro de extractos orgánicos crudos de 15 esponjas de la costa Caribe colombiana, en embriones del erizo de mar Lytechinus variegatus. El 80% de las especies (Spirastrella coccinea, Myrmekioderma rea, Iotrochota imminuta, Halichondria sp., Petromica ciocalyptoides, Cinachyrella kuekenthali, Biemna cribaria, Oceanapia peltata, Xestospongia proxima, Oceanapia bartschi, Polymastia tenax y Dragmacidon reticulata) mostró un nivel de actividad fuerte inhibiendo la divisiones mitóticas desde el primer estadio celular durante la división de los huevos fertilizados de este erizo. Los extractos de Halichondria sp., P. ciocalyptoides y X. proxima desintegraron los núcleos celulares instantáneamente. El extracto de Cribrochalina infundibulum resultó medianamente activo; mientras que los extractos de las esponjas Desmapsamma anchorata y Myrmekioderma gyroderma no mostraron actividad.
PALABRAS CLAVE: Bioprospección, Actividad citotóxica, Actividad antimitótica, Esponjas marinas, Caribe colombiano.
ABSTRACT
The determination of antimitotic activity of organic extracts from marine organisms generates expectations on the isolation of substances with potential anticancer activity. The antimitotic activity of crude organic extracts from 15 marine sponges from the Colombian Caribbean coast were tested in vitro against embryos of the sea urchin Lytechinus variegatus. 80% of the species evaluated (Spirastrella coccinea, Myrmekioderma rea, Iotrochota imminuta, Halichondria sp., Petromica ciocalyptoides, Cinachyrella kuekenthali, Biemna cribaria, Oceanapia peltata, Xestospongia proxima, Oceanapia bartschi, Polymastia tenax y Dragmacidon reticulata) showed significant levels of inhibiting activity on the mitotic divisions at the first cellular phase of fertilized eggs. The extracts from Halichondria sp., P. ciocalyptoides and Xestospongia proxima disintegrate the cellular nuclei instantly. Extracts from Cribrochalina infundibulum showed an intermediate level of activity, while extracts from Desmapsamma anchorata and Myrmekioderma gyroderma showed no activity.
KEY WORDS: Bioprospecting, Cytotoxic activity, Antimitotic activity, Marine sponge, Colombian Caribbean.
INTRODUCCIÓN
Las esponjas marinas poseen gran variedad de compuestos químicos que muestran diferentes tipos de actividad biológica (Faulkner, 2000; Mayer y Hamann, 2002; Kumar y Zi-rong, 2004). Se han registrado compuestos que tienen actividad antimicrobiana (Monks et al., 2002; Xue et al., 2004), neurotóxica (Rangel et al., 2001), citotóxica y antimitótica (Lewis, 1998; Rangel et al., 2001; Dembitsky, 2002), y actividad sobre enzimas (Troll et al., 1995; Lira et al., 2003). A partir del tipo de actividad biológica que muestran los compuestos se han sugerido diferentes funciones ecológicas como antiepibióticas, disuasores de alimentación, alelopatías, entre otras, que han sido base para abordar su ecología química. Aunque también por su posible utilidad en la industria y especialmente en la salud humana, ya que estos compuestos son candidatos ideales para investigaciones clínicas y moleculares con la posibilidad de ser desarrollados como nuevos fármacos.
De las esponjas marinas ya se han obtenido sustancias que están disponibles comercialmente como medicamentos; este es el caso del antiviral Ara A (Glaxo) y el anticancerígeno Ara C (Pharmacia) (Pomponi, 1999). Otras han mostrado actividad anticancerígena y se encuentran en etapa preclínica avanzada, como las topsentinas (aislada de Topsentia genitrix, Spongosorites sp. y Hexadella sp.), la debromohymenialdisina (aislada de Plakellia flabellata, Hymeniacidon aldis y Stylotella aurantia), la halichondrina B (aislada de Halichondria okadai), la jasplakilonida (aislada de Jaspis spp. o Dorypleres splendens), el discodermolido (aislado de Discodermia dissoluta) y el mycaperoxido B (aislado de Mycale spp.) (Monks et al., 2002; Cooper, 2004). Otros compuestos también aislados de esponjas marinas, como la isohomohalichondrina B, las espongistatinas y la lamellarina N (Munro et al., 1999). Así como, un alcaloide citotóxico aislado de Biemna sp. (Dembitsky, 2002) y las bastadinas (aisladas de Ianthella spp.) con actividad antimitótica (Lewis, 1998), han mostrado actividad in vitro contra líneas de células cancerígenas.
En Colombia, los avances en la búsqueda de este tipo de compuestos se registran en esponjas del Caribe colombiano, como Ircinia felix y Didiscus oxeata. De la primera se han extraído furanosestertepenos con actividad citotóxica contra embriones de erizo de mar, con actividad analgésica, actividad antitumoral en discos de zanahoria infectados con Agrobacterium tumefasciens y en algunas líneas de células tumorales humanas. En la segunda se encontró el compuesto (+)-curcufenol, con actividad citotóxica (Duque, 1998).
La actividad antimitótica de algunas esponjas marinas, se ha propuesto pueda ser parte de un mecanismo químico de defensa para evitar el asentamiento de larvas y de otros organismos con el fin de prevenir la epibiosis (Green et al., 1990 y Becerro et al., 1997). Teniendo en cuenta que los organismos epibióticos podrían interferir y disminuir la eficiencia en el proceso de filtración de la esponja (Becerro et al., 1997), este mecanismo evitaría su desarrollo desde los primeros estadios celulares.
De otro lado, las investigaciones farmacológicas en la búsqueda de compuestos marinos efectivos para el tratamiento del cáncer han dilucidado los mecanismos de acción de estos y por los cuales los agentes antimitóticos derivados de organismos marinos se agrupan en tres categorías. Los de tipo II actúan sobre el sitio de unión del GTP (e.g. isobromohalichondrina B, halichondrina B y espongistatinas), los de tipo III actúan sobre la estabilización de los microtúbulos (e.g. discodermolido), y los de tipo IV actúan desorganizando la red de microtúbulos de la célula (e.g. lamellarina N) (Munro et al., 1999). Los mecanismos de tipo III y IV han sido ampliamente investigados, ya que medicamentos como el Taxol® de origen vegetal (del pino Taxus brevifolia) actúan directamente sobre la tubulina, proteína que se encuentra libre en la célula o en los microtúbulos, rompiendo el equilibrio microtúbulos-tubulina y causando así su destrucción. Estas estructuras son esenciales en la formación del huso mitótico y su destrucción conlleva por ende a la pérdida de segregación cromosómica con la consecuente inhibición de la división y la muerte celular (Hadfield et al., 2003). Sin embargo, un agente antimitótico sensu stricto actúa bloqueando la mitosis mientras hay exposición a la sustancia; en contraste, un agente citotóxico causa daños irreversibles en las células expuestas.
La prueba de citotoxicidad y antimitosicidad en huevos fertilizados de erizos marinos ha sido utilizada comúnmente por biólogos y bioquímicos tanto en estudios sencillos de división celular como en aquellos que incluyen un fuerte componente molecular. Aunque son variados los tipos de células que pueden ser usados para comprobar la susceptibilidad in vitro frente a sustancias de interés, los gametos de erizos de mar pueden ser usados con mayor frecuencia por cuanto no requieren de técnicas sofisticadas de obtención, mantenimiento y observación y son lo suficientemente sensibles para identificar actividad positiva o negativa con claridad, igualmente para distinguir los efectos antimitóticos de los efectos tóxicos que pudiera presentar un compuesto. Una vez fertilizados los huevos, los embriones sufren divisiones sincrónicas en los primeros clivajes, permitiendo un inusual grado de uniformidad célula a célula cuando se investigan procesos tales como la mitosis, el clivaje o los eventos bioquímicos que ocurren durante la replicación celular. También es un ensayo adecuado para el estudio de la acción de fármacos, ya que los embriones son expuestos a estas durante los mismos estados del ciclo celular, lográndose de esta forma, un alto grado de reproducibilidad así como de uniformidad (Jacobs et al., 1981).
Conscientes de la necesidad de darle valor agregado a la diversidad biológica presente en el Caribe colombiano, así como de la importancia de dar continuidad al proceso de aprovechamiento de productos de origen marino con proyección en bioprospección para la industria farmacéutica en Colombia, el propósito de este trabajo fue evaluar la actividad citotóxica-antimitótica de los extractos orgánicos crudos de 15 esponjas marinas del Caribe colombiano frente a embriones del erizo blanco Lytechinus variegatus Lamarck, 1816.
MATERIALES Y MÉTODOS
Colecta y tratamiento de esponjas marinas
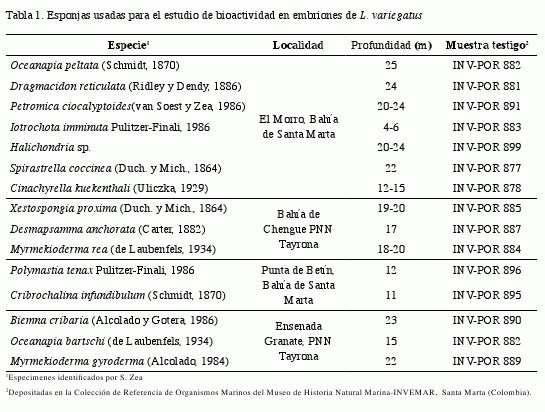
Se recolectaron aproximadamente 600 gramos de cada esponja mediante buceo autónomo en la Bahía de Santa Marta y la zona costera del Parque Nacional Natural Tayrona (PNNT), entre noviembre de 2003 y febrero de 2004 (Tabla 1). Las muestras fueron transportadas en bolsas con agua del medio hasta el laboratorio, en donde se retiró el exceso de agua y se mantuvieron a -15 °C.
ntes de iniciar el proceso de extracción, cada esponja fue lavada con agua destilada para remover arena y detritus y manualmente se retiraron los endobiontes y epibiontes del tejido. El tejido fue fraccionado en trozos de 3-4 cm de lado aproximadamente y liofilizado durante 15 horas. Posteriormente, se realizó el primer proceso de extracción con metanol Grado Reactivo (GR); la solución resultante de esta extracción fue filtrada y concentrada en rotavapor a 35-37 °C. La segunda extracción se realizó sobre los mismos
trozos de esponja con metanol y diclorometano GR (2:1); el extracto obtenido se mezcló con el anterior derivado de metanol y fue concentrado de la misma forma. Todos los extractos se almacenaron en oscuridad y a temperatura de congelación (-15º C) para su posterior uso en el bioensayo (Chaves-Fonnegra, 2005).
Prueba de citotoxicidad y antimitosicidad
Entre los meses de mayo a noviembre (estación lluviosa), se recolectaron erizos L. variegatus de un población que habita la pradera de Thalassia testudinum en la Bahía de Chengue (PNNT) mediante buceo a pulmón libre. Estos fueron transportados con agua del medio hasta el laboratorio de Bioprospección Marina del Instituto de Investigaciones Marinas y Costeras - INVEMAR (Santa Marta). Allí fueron inducidos a desovar con inyección intracelómica oral de KCl 0.5 M. Los óvulos fueron fertilizados con algunas gotas de esperma (el número de gotas dependió de la concentración del esperma obtenido). La mezcla de gametos se agitó por un minuto y posteriormente se comprobó la fertilización de la mayoría de los huevos. En los casos en los que aún no había fertilización de la mayoría de los huevos, se agregaron más gotas de esperma. Tras la fertilización, 3 mL de suspensión de huevos fueron servidos en cajas de Petri (10 cm de diámetro), más 3 mL de Agua de Mar Filtrada (AMF) y el volumen de extracto necesario para tener una concentración final de 10 mg/mL (entre 30-300 μL), calculado a partir del volumen de esponja del que se obtuvo el extracto (Daza y Vélez, 2004). Simultáneamente se realizaron dos controles; en el primero, se utilizaron 3 mL de huevos fertilizados más la cantidad de solvente equivalente al volumen de extracto aplicado más 3 mL de AMF, y en el segundo se usaron 3 mL de huevos y 3 mL de AMF. Los huevos fueron incubados a temperatura ambiente (25 ± 2 °C), con agitación manual, durante 90 minutos. Al cabo de este tiempo, los huevos se fijaron con unas gotas de formol 10% y se inició el conteo bajo el microscopio binocular, en un número de 7 campos determinados al azar. Se contó el número de huevos sin fertilizar y de los cigotos sin división, con dos células, con cuatro células y con 8 células. Se realizaron dos réplicas completas del ensayo para cada extracto evaluado y controles. Para determinar el nivel de la actividad de los extractos se usaron los promedios de las dos réplicas, según las categorías descritas en la Tabla 2. Cada extracto y sus controles se ensayaron por separado con huevos frescos.
Se calculó el porcentaje de cigotos en cada categoría con respecto al total de huevos fertilizados y sólo en los casos en que el porcentaje de inhibición no fue 100% en las dos réplicas (y en los controles fue 0%), se realizó un análisis de varianza (ANOVA) a una vía comparando el porcentaje de cigotos sin dividir entre el extracto y el control. Un extracto se consideró activo cuando se registró inhibición del 100% o hubo una diferencia significativa en el número de cigotos sin dividir entre éste y los controles. Como en varios casos hubo efecto de retardo en el proceso de clivaje con respecto a los controles, para demostrarlo se comparó entre tratamientos y controles, nuevamente por ANOVA a una vía, el porcentaje de cigotos con cuatro u ocho células, según el caso. Para determinar la diferencia entre medias del tratamiento y los controles se utilizó la prueba LSD (Least Significant Difference). Para todos los análisis se tuvo en cuenta una significancia estadística de 0.05.
RESULTADOS
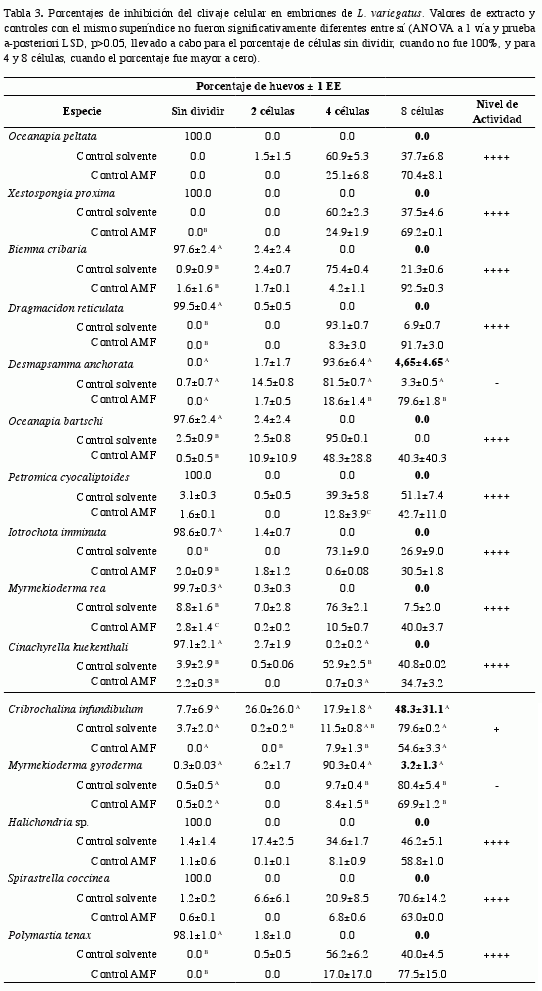
En la Tabla 3 se presentan los efectos de los extractos metanol:diclorometano (2:1) obtenidos de 15 esponjas marinas sobre las divisiones mitóticas de los huevos fertilizados de L. variegatus. Se realizaron 90 bioensayos para los cuales se obtuvo un promedio de fertilización de 94.8% (mínimo de 82.2%) y tanto el solvente como el AMF permitieron las divisiones hasta el último estadio de división celular considerado en la prueba (ocho células), en porcentajes de hasta 41.2% y 46.2%, respectivamente.
De las 15 esponjas estudiadas, Spirastrella coccinea, Myrmekioderma rea, Iotrochota imminuta, Halichondria sp., Petromica ciocalyptoides, Cinachyrella kuekenthali, Biemna cribaria, Xestospongia proxima, Oceanapia peltata, Oceanapia bartschi, Polymastia tenax y Dragmacidon reticulata mostraron actividad citotóxicaantimitótica significativa (inhibición mayor al 95%, significativamente diferente a los controles en los casos en que no fue 100%), siendo el efecto más frecuente la inhibición del clivaje celular desde el primer estadio.
Entre éstas, los extractos de B. cribaria y D. reticulata permitieron el desarrollo de los cigotos hasta el segundo estadio, pero con células asimétricas. En los ensayos con los extractos obtenidos a partir de Halichondria sp., P. ciocalyptoides y X. proxima se observó que los huevos fertilizados fueron completamente dañados, causando atrofia, retracción o disolución en los núcleos, pero sin producir lisis completa del cigoto como sí se ha observado en otras esponjas del Caribe (Rangel et al., 2001).
En Cribrochalina infundibulum no se detectó efecto de inhibición del extracto sobre el primer clivaje celular en los cigotos, pero sí en los siguientes (2 células 26.0%; 4 células 17.9%; 8 células 48.3%), lo que sugiere que este extracto tiene capacidad para retardar las divisiones mitóticas de los huevos fertilizados del erizo, y se corrobora por la existencia de una porcentaje significativamente mayor de cigotos en el estadio 2 y 4 células con respecto a los controles (Tabla 3). En este extracto también se observó que el porcentaje de cigotos con divisiones incompletas en una o más células fue aumentando de acuerdo al estadio celular, siendo del 23.0% en el estadio de dos células, 45.7% en el de cuatro y 60.0% en el de ocho; entonces, además del efecto retardante hay un efecto degenerativo en cada división que impidió el desarrollo normal del cigoto hacia etapas posteriores.
El extracto de Myrmekioderma gyroderma tampoco tuvo efecto antimitótico sobre los embriones en el primer estadio celular (Tabla 3), pero este extracto retardó su desarrollo, permitiendo el clivaje celular sólo hasta el estadio de 4 células (90.3%), siendo este último porcentaje significativamente diferente al de los controles, que sí alcanzaron en mayor proporción las 8 células (80.4% para control solvente, 69.9% control AMF). Además, los embriones observados en las 2 y 4 células presentaron divisiones incompletas y aumento del tamaño celular en 8.3% y 37.5% de los casos, respectivamente. Igualmente para D. anchorata no se observó efecto antimitótico sobre los embriones en el primer estadio celular y el clivaje celular alcanzó el estadio de 4 células (93.6%), con células de una talla mayor a la normal, es decir, que alcanzaban a entrar en contacto con las paredes del huevo. Adicionalmente, el porcentaje de células en este estadio es similar al del solvente. Se considera que estas dos especies tienen menor actividad antimitótica.
DISCUSIÓN
Respecto a Halichondria sp., no es sorprendente el alto nivel de actividad detectado en este estudio, ya que varias de las especies de este género han demostrado actividad antimicrobiana, hemolítica, ictiotóxica y contra la infección por HIV significativa (revisión en McKee et al., 1994); así como, actividad citotóxica (Li et al., 1995).
Situación semejante ocurre con el género Xestospongia del cual ya se conocen varios compuestos activos aislados de varias especies colectadas en el Indopacífico, que han mostrado actividad insecticida (McKee y Ireland, 1987) y contra diferentes líneas celulares de cáncer (McKee y Ireland, 1987; Kong et al., 1994; Tsukamoto et al., 2000); actividad antibiótica, cardiotónica y citotóxica (Kobayashi et al., 1992); actividad antitumoral (Shimura et al., 1994); actividad de inhibición enzimática (Concepción et al., 1995) y actividad antiepibiótica (Liu et al., 2004). Así como también, se han obtenido resultados positivos en otras pruebas de actividad biológica, entre ellas citotóxica y antimitótica con extractos crudos obtenidos de especies del Caribe colombiano (Zea et al., 1986).
En este estudio se presentó un mayor porcentaje de esponjas con actividad citotóxica-antimitótica significativa que en otros estudios en los cuales se ha realizado el mismo tipo de bioensayo usando extractos crudos obtenidos de diversas especies del Caribe colombiano (Zea et al., 1986). En dicho estudio, se registraron 4 de 11 especies de esponjas activas y solamente una de ellas (Didiscus oxeata) mostró un alto nivel de actividad (100%); mientras que, en otras se alcanzaron porcentajes de inhibición en la mitosis de 87.2%, 69.4% y 29.2% (Ircinia campana, Xestospongia muta y Agelas confiera, respectivamente). Rangel et al., (2001) encontraron que el 54% de las esponjas evaluadas (Aaptos sp., Amorphinopsis sp., Amphimedon sp., Arenosclera brasiliensis, Axinella aff. corrugada, Callyspongia sp., Chelonaplysilla aff. erecta, Chondrilla nucula, Geodia corticostylifera, Hymeniacidon aff. helliophila, Mycale laxissima, Oceanapia nodosa, Raspailia elegans) mostraron actividad a concentraciones de extracto significativamente menores (entre 62.5 a 1000 μg/mL) a las usadas en el presente estudio. De acuerdo con esto, es posible que la concentración de extracto usada aquí explique el alto porcentaje de esponjas que presentan actividad significativa en el ensayo.
De otro lado, respecto a Halichondria sp., P. ciocalyptoides y X. proxima, cuyos extractos destruyeron los núcleos de los embriones, esta observación corresponde a un efecto claro de citotoxicidad más que a un efecto antimitótico. En estudios adicionales se tendría que evaluar cuál es la concentración de extracto que provoca un efecto antimicótico y si las divisiones pueden ser reactivadas en ausencia de este o si el extracto actúa sólo mediante un efecto tóxico sobre embriones de L. variegatus.
De las especies consideradas en este estudio, se ha reportado actividad antimitótica de algunos compuestos obtenidos de las esponjas S. coccinea (del Caribe) (Williams et al., 2003) y de una especie relacionada a I. inmminuta colectada en el Indico, Iotrochota purpurea, (Dembitsky, 2002).
En cuanto al impacto que generan estos resultados, se ha propuesto que las sustancias que muestran actividad antimitótica sobre huevos fertilizados de erizos marinos también podrían inhibir el crecimiento de tumores en humanos (Rangel et al., 2001). En este sentido, en algunas de las especies incluidas en este trabajo se han registrado algunos estudios enfocados a evaluar los compuestos sobre líneas celulares de cáncer. De P. tenax, se identificaron tres esteroles oxigenados citotóxicos sobre la línea celular PC-3 de cáncer en humano (Santafé et al., 2002). Entre otros estudios de importancia clínica, se resalta el hallazgo de algunos compuestos aislados de las esponjas Dragmacidon aff. reticulata y P. ciocalyptoides, que inhiben la enzima adenosin fosforibosil transferasa (L-APRT) del parásito Leishmania tarentolae (Lira et al., 2003). De otro lado, entre los posibles compuestos activos a los cuales puede atribuirse la actividad observada en las esponjas de este estudio, sin descartar que estas esponjas posean sus propios compuestos activos y sean aún desconocidos para la ciencia, se registran para el género Myrmekioderma los compuestos (+)-curcufenol y (+)-curcudiol, los cuales han presentado actividad citotóxica, antimicrobiana, antiepibiótica, ictiotóxica y digestiva significativas (Tasdemir et al., 2003). El (+)-curcufenol (obtenido de Didiscus oxeata), también presentó actividad antitumoral en discos de zanahoria infectados por Agrobacterium tumefasciens (Salamanca et al., 1996). Un derivado de este compuesto inhibe la actividad de la H, K-ATPasa y tiene actividad frente a células de la línea HCT-116 (Tasdemir et al., 2003); mientras que para el género Xestospongia se aislaron las adociaquinonas A y B con actividad citotóxica para la línea de células tumorales de colon humano (KB16 y HEPA-3B) con CL50 de 0.26 μg/mL y menores a 0.1 μg /mL (Kuang-Liang, 1999).
En términos relativos, la baja actividad citotóxica-antimitótica en las especies D. anchorata y M. gyroderma, puede obedecer a una situación en la que la concentración de los compuestos en el tejido son bajos, indicando posiblemente que se requieran mayores concentraciones de extracto para detectar una respuesta. También, debería tenerse en cuenta que la bioactividad puede cambiar temporal y espacialmente en los organismos marinos e incluso entre individuos en un mismo sitio (Muricy et al., 1993, Henrikson y Pawlik, 1998).
CONCLUSIÓN
Los resultados de este estudio se constituyen en un criterio para seleccionar las especies con mayor potencial y en las cuales se deban centrar posteriores estudios en productos naturales marinos y farmacología, usando líneas celulares de cáncer específicas en humanos o en otros mamíferos. En este sentido las especies más interesantes fueron S. coccinea, C. kuekenthali, I. imminuta, O. bartschi, O. peltata, M. rea, D. reticulata y B. cribaria, porque sus extractos inhiben completamente las divisiones desde el primer estadío sin dañar las células (agentes antimitóticos), mientras que para el área de la toxicología resultan más interesantes las especies Halichondria sp., P. ciocalyptoides y X. proxima, que deterioran de manera irreversible los núcleos celulares.
AGRADECIMIENTOS
Este trabajo fue realizado gracias a la financiación del Fondo Colombiano de Investigaciones Científicas y Proyectos Especiales “Francisco José de Caldas” - COLCIENCIAS, código: 2105-09-12456 y el Instituto de Investigaciones Marinas y Costeras “José Benito Vives De Andréis”- INVEMAR; enmarcado en el “Proyecto piloto de prospección de bioactividad de organismos marinos colombianos”. Al grupo de Bioprospección Marina. Al apoyo logístico y del personal profesional del INVEMAR y de la Universidad Nacional de Colombia, especialmente a Camilo García, Juan Carlos Márquez, Andia Chávez, Jazmín Arias, Martha Díaz. A Diego Luis Gil por sus aportes al manuscrito final.
BIBLIOGRAFÍA
1 Becerro, M., X. Turon y M. Uriz. 1997. Multiple functions for secondary metabolites in encrusting marine invertebrates. J. Chem. Ecol., 23:1527-1547. [ Links ]
2 Chaves-Fonnegra, A., M. López-Victoria, F. Parra-Velandia y S. Zea. 2005. Ecología química de las esponjas excavadoras Cliona aprica, C. caribbaea, C. delitrix y C. tenuis. Bol. Invest. Mar. Cost., 34:43-67. [ Links ]
3 Concepción, G.P., T.A. Foderaro, G.S. Eldredge, E. Lobkovsky, J. Clardy, L.R. Barrows y C.M. Ireland. 1995. Topoisomerasa II-mediated DNA cleavage by Adociaquinones and Xestoquinones from the Philippine sponge Xestospongia sp. J. Med. Chem., 38:4503-4507. [ Links ]
4 Cooper, E.L. 2004. Drug discovery, CAM and natural products. J. Altern. Complement. Med., 1(3):215-217. [ Links ]
5 Daza C., Z., Velez G., P. 2004. Ensayos de disuasión alimentaria, alelopatía por contacto y citotoxicidad de los extractos orgánicos crudos de las esponjas Cliona varians (Duchassaing y Michelotti, 1864) y Scopalina ruetzleri (Wiedenmayer, 1977). Trabajo de Grado. Facultad de Biología Marina. Universidad Jorge Tadeo Lozano. Bogotá. [ Links ]
6 Dembitsky, V. 2002. Bromo-and-iodo containing alkaloids from marine microorganisms and sponges. Russian J. Bioorg. Chem., 28:170-182. [ Links ]
7 Duque, C. 1998. Búsqueda de compuestos bioactivos a partir de organismos marinos del Caribe colombiano. Rev. Acad. Colomb. Cienc., XXII (85):527-537. [ Links ]
8 Faulkner, J. 2000. Marine natural products. Nat. Prod. Rep., 17:7-55. [ Links ]
9 Green, G., S. Schulte, M. Jhu, G. Wrigth, B. Bakus y P. Gómez. 1990. Antibiosis and antifouling in marine sponges: laboratory versus field studies. 102-108. En: Ruetzler, K. (Ed.). New perspectives in sponge biology. Proc. Third Internat. Sponge Conf. Woods Hole. Oceanographic Institution. Woods Hole. Massachusetts. [ Links ]
10 Hadfield, J., S. Ducki, N. Hirts y A. McGown. 2003. Tubulin and microtubules as targets for anticancer drugs. Prog. Cell Cycle Res., 5:309-325. [ Links ]
11 Henrikson, A. y J.R. Pawlik. 1998. Seasonal variation in biofouling of gels containing extracts of marine organisms. Biofouling, 12(1-3):245-255. [ Links ]
12 Jacobs, R., S. White y L. Wilson. 1981. Selective compound derived from marine organisms: effects on cell division in fertilized sea urchin eggs. Fed. Proc., 40(1):28-31. [ Links ]
13 Kobayashi, J., T. Hirase, H. Shigemori, M. Ishibashi, M. Bae, T. Tsuji y T. Sasaki. 1992. New pentacyclic compounds from the okinawan marine sponge Xestospongia sapra. J. Nat. Prod., 55(7):994-998. [ Links ]
14 Kong, F., R.J. Andersen y T.M. Allen. 1994. Ingamines A and B, new cytotoxic from the marine sponge Xestospongia ingens. Tetrahedron, 50(21):6137-6144. [ Links ]
15 Kuang-Liang, L. 1999. Antitumor constituents from Formosan marine sponge Xestospongia sp. Magister Dissertation. National Sun Yat-Sen University. Marine Resourses Department. 50 p. http://etd.lib.nsysu.edu.tw/ETD-db/ETD-search/. [ Links ]
16 Kumar, R. y X. Zi-rong. 2004. Biomedical compounds from Marine organisms. Mar. Drugs, 2:123-146. [ Links ]
17 Lewis, J. 1998. Muscarine, imidazole, oxazole, thiazole and peptide alkaloids and other miscellaneous alkaloids. Nat. Prod. Rep., 15(4):371-395. [ Links ]
18 Li, H., S. Matsunaga y N. Fusetani. 1995. Halicylindramides A-C, antifungal and cytotoxic depsipeptides from the marine sponge Halichondria cylindrata. J. Med. Chem., 38:338-343. [ Links ]
19 Lira, S., R. Berlinck, O. Thiemann, M. Silva y R. Rocha. 2003. Atividade de extractos brutos de invertebrados marinhos com açao inibidora da enzima "Adenosine Phosphoribosyl Transferasa" de Leishmania tarentolae. XVIII Simpósio de Biologia Marinha. Universidad de São Paulo. CEBIMar/USP. www.usp.br/cbm/novo_site/simposio/simp_xviii/resumos/resB04-I.html [ Links ]
20 Liu, H., Y. Mishima, T. Fujiwara, H. Nagai, A. Kitazawa, Y. Mine, H. Kobayashi, X. Yao, J. Yamada, T. Oda y M. Namikoshi. 2004. Isolation of Araguspongine M, a new stereoisomer of an Araguspongine/ Xestospongin alkaloid, and dopamine from the marine sponge Neopetrosia exigua collected in Palau. Mar. Drugs, 2:154-163. [ Links ]
21 Mayer, A.M. y M.T. Hamann. 2002. Marine pharmacology in 1999: Compounds with antibacterial, anticoagulant, antifungal, anthelmintic, anti-inflammatory, antiplatelet, antiprotozoal and antiviral activities affecting the cardiovascular, endocrine, immune and nervous systems, and other miscellaneous mechanisms of action. Comp. Biochem. Physiol. C Toxicol. Pharmacol, 132:315-339. [ Links ]
22 McKee, T.C. y C.M. Ireland. 1987. Cytotoxic and antimicrobial alkaloids from the Fijian sponge Xestospongia caycedoi. J. Nat. Prod., 50(4):754-756. [ Links ]
23 McKee, T.C., I.J.H. Cardellina, R. Riccio, M.V. D`Auria, M. Iorizzi, L. Minale, R.A. Moran, R.J. Gulakowski, J.B. McMahon, R. W. Buckheit, K.M. Jr. Snader, y M.R. Boyd. 1994. HIV-Inhibitory natural products. 11. Comparative studies of sulfate sterols from marine invertebrates. J. Med. Chem., 37:793-797. [ Links ]
24 Monks, N., C. Lerner, A. Henriques, F. Farias, E. Schapoval, E. Suyenaga, A. da Rocha, G. Schwartsmann y B. Mothes. 2002. Anticancer, antichemotactic and antimicrobial activities of marine sponges collected off the coast of Santa Catarina, southern Brazil. J. Exp. Mar. Biol. Ecol., (281):1- 12. [ Links ]
25 Munro, M.H., J.W. Blunt, E. J. Dumdei, S.J. Hickford, R.E. Lill, S. Li, C.N. Battershill y A.R. Duckworth. 1999. The discovery and development of marine compounds with pharmaceutical potential. J. Biotech., 70:15-25. [ Links ]
26 Muricy, G., E. Hajdu, F. Araujo y A. Hagler. 1993. Antimicrobial activity of Southwestern Atlantic shallowwater marine sponges (Porifera). Sci. Mar., 57(4):427-432. [ Links ]
27 Pomponi, S. 1999. The bioprocess-technological potential of the sea. J. Biotech., 70:5-13. [ Links ]
28 Rangel, M., B. de Sanctis, J. de Freitas, J. Polatto, A. Granato, R. Berlinck y E. Hajdu. 2001. Cytotoxic and neurotoxic activities in extracts of marine sponges (Porifera) from the southeastern Brazilian coast. J. Exp. Mar. Biol. Ecol., 262:31-40. [ Links ]
29 Salamanca, A.M., C. Fonseca, L. Renjifo y C. Duque. 1996. Aislamiento y determinación de la CL50 y la actividad antitumoral del (+)- curcufenol y (+)- curcudiol de la esponja Didiscus oxeata. En: X Seminario Nacional de Ciencia y Tecnología del Mar. Octubre 28-31. Resúmenes. Bogotá. 28-31 p. [ Links ]
30 Santafé, G., V. Paz, J. Rodríguez y C. Jiménez. 2002. Novel cytotoxic oxygenated C-29 sterols from the Colombian marine sponge Polimastia tenax. J. Nat. Prod., 65:1161-1164. [ Links ]
31 Shimura, H., K. Iguchi, Y. Yamada, S. Nakaike, T. Yamagishi, K. Matsumoto y C. Yokoo. 1994. Aragusterol C: A novel halogenated marine steroid from an Okinawa sponge Xestospongia sp., possessing potent antitumor activity. Cell. Mol. Life Sci., 50(2):134-136. [ Links ]
32 Tasdemir, D., T. Bugni, G. Mangalindan, G. Concepción, M. Harper y C. Ireland. 2003. Bisabolane type sesquiterpenes from a marine Didiscus sponge. J. Turk Chem., 27:273-279. [ Links ]
33 Troll, W., N. Sueoka, L. Sueoka, L. Jeffrey y D. Heck. 1995. Inhibitors of protein phosphatases (Okadaic Acid and Tautomycin) block sea urchin development. Biol. Bull., 189: 201. [ Links ]
34 Tsukamoto, S., M. Takahashi, S. Matsunaga, N. Fusetani y R.W.N. van Soest. 2000. Hachijodines A-G: Seven new cytotoxic 3-alkylpyridine alkaloids from two marine sponges of the genera Xestospongia and Amphimedon. J. Nat. Prod., 63(5):682-684. [ Links ]
35 Williams, D., M. Roberge, R. Van Soest y J. Raymond. 2003. Spirastrelloide A, an antimitotic macrolide isolated from the Caribbean marine sponge Spirastrella coccinea. Org. Lett., 125(18):5296-5297. [ Links ]
36 Xue, S., H.T. Zhang, P.C. Wu, W. Zhang y Q. Yuan. 2004. Study on bioactivity of extracts from marine sponges in the Chinese sea. J. Exp. Mar. Bio. Ecol., 298:71-78. [ Links ]
37 Zea, S., A. Medina y C. Duque. 1986. Ichthyotoxic, cytotoxic and antimicrobial activity of some sponges of the Colombian Caribbean. An. Inst. Inv. Mar. Punta de Betín,5/16:31-48. [ Links ]
FECHA DE RECEPCIÓN: 02/05/06 FECHA DE ACEPTACIÓN: 08/08/07