Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.37 no.1 Santa Marta Jan./June 2008
ENSAMBLAJES DE PECES ARRECIFALES DEL ÁREA DE SANTA MARTA Y EL PARQUE NACIONAL NATURAL TAYRONA
REEF FISH ASSEMBLAGES IN SANTA MARTA AREA AND TAYRONA NATIONAL NATURAL PARK.
Julián Olaya-Restrepo1, María Catalina Reyes-Nivia2 y Alberto Rodríguez-Ramírez2
1 Universidad de Antioquia, Facultad de Ciencias Exactas y Naturales, Departamento de Biología, Colombia.julianolaya80@yahoo.com
2 Instituto de Investigaciones Marinas y Costeras (INVEMAR), A.A. 1016, Santa Marta, Colombia. macatarn@yahoo.com (M.C.R.N); betorod@invemar.org.co (A.R.R.)
RESUMEN
Los ensamblajes de peces arrecifales del área de Santa Marta y del Parque Nacional Natural Tayrona (PNNT) se caracterizaron a partir de la riqueza, diversidad, equitatividad, abundancia relativa (AR) y frecuencia de observación (FO) y se evaluó el posible efecto del PNNT sobre dichos atributos. La información se obtuvo en 20 estaciones mediante el censo de buceo errante (30 minutos). Se encontraron un total de 180 especies de peces. Los análisis de varianza indicaron que el PNNT al parecer ha tenido un efecto sobre la diversidad y equitatividad de especies (p< 0.05) mientras la riqueza es similar a lo largo del área estudiada. En términos de composición, se encontró que las dos zonas evaluadas presentan una moderada similaridad (Índice de Jaccard 0.69). No obstante, algunas familias como Serranidae, Haemulidae y Lutjanidae exhibieron diferencias en su composición de especies entre las zonas estudiadas. Los meros y pargos de gran tamaño se caracterizaron por presentar AR y FO bajas en ambas zonas y solamente se observaron diferencias entre especies pequeñas sin valor comercial. Estos resultados sugieren que si bien el PNNT puede favorecer la preservación de una alta diversidad de especies, las actividades de pesca deben ser controladas más eficazmente, de manera que la zona del parque promueva la protección y conservación de los recursos ícticos arrecifales más vulnerables a la pesca (meros-chernas y pargos).
PALABRAS CLAVE: Peces arrecifales, Riqueza, Abundancia relativa, PNNT, Caribe colombiano.
ABSTRACT
Variables such as richness, diversity, evenness, relative abundance (RA), and sighting frequency (SF) were assessed in order to characterize reef fish assemblages in Santa Marta and Tayrona Natural National Park (TNNP). The effect of the TNNP protection on these attributes was evaluated. Data were registered in 20 sites by means of the roving diver technique (30 min). A total of 180 fish species were recorded. Analyses of variance revealed significant differences in diversity and evenness between zones (p< 0.05) indicating a TNNP protection effect, but not differences in richness. Species composition was moderately similar between the two zones (Jaccard Index 0.69). Nevertheless, families such as Serranidae, Haemulidae, and Lutjanidae showed differences in species composition between evaluated zones. Large groupers and snappers exhibited RA and SF considerably low at both protected and not protected zones. Differences were only recorded between small body size and non-target species. These results suggest that the TNNP can be facilitating the preservation of high species diversity, but fishing control systems should be more efficient in order to promote protection and conservation of more vulnerable reef fish populations (snappers and groupers).
KEY WORDS: Reef fishes, Richness, Relative abundance, PNNT, Colombian Caribbean.
INTRODUCCIÓN
Cientos y en ocasiones miles de especies de peces que pueden encontrarse en los arrecifes coralinos hacen de éstos uno de los ambientes más ricos y diversos que hay sobre la tierra (Sale, 1991). Dentro del ecosistema arrecifal, los peces constituyen uno de los componentes bióticos más notorios, modificando la estructura del sustrato bentónico y convirtiéndose en el principal conducto para el movimiento de materia y energía (Wainwright y Bellwood, 2002).
Las variables que permiten caracterizar los ensamblajes de peces arrecifales, como la composición de especies, la diversidad, la abundancia relativa y la frecuencia de observación, pueden verse modificadas por un conjunto de factores tanto de tipo físico como biológico. Se ha observado que la alta heterogeneidad de ambientes (Nagelkerken et al., 2001, 2002), el grado de exposición al oleaje (Pattengill-Semmens y Semmens, 2003; Depczynski y Bellwood, 2005), la cobertura coralina y la rugosidad del sustrato (Carpenter, 1981; Williams, 1991; Gratwicke y Speight, 2005) influencian considerablemente ciertos parámetros de la comunidad. Adicional a estas variables ecológicas, deben sumarse importantes factores de tipo antrópico que han cobrado especial atención en las últimas décadas. Entre los más comunes están la pesca, el desarrollo costero, la descarga de aguas domésticas e industriales y las prácticas del buceo (Lubchenco et al., 2003). Algunos estudios han encontrado que la cercanía a los centros urbanos (McClanahan et al., 2000; Guidetti et al., 2003) y las actividades pesqueras (Polunin y Roberts, 1993; Chiappone et al., 2000) pueden generar cambios sustanciales sobre los ensamblajes de peces, disminuyendo su riqueza y abundancia. De hecho, se ha reconocido que la pesca es uno de los factores más significativos, ya que tiene efectos directos sobre la estructura de las comunidades de peces al reducir la abundancia, biomasa, número de especies y tamaño promedio de los individuos (Russ y Alcala, 1989; Chiappone et al., 2000).
El establecimiento de áreas marinas protegidas ha sido una estrategia comúnmente utilizada para conservar la diversidad biológica, para aumentar la riqueza de especies y para efectuar un manejo adecuado de las pesquerías ayudando a incrementar la productividad y evitando el colapso de las poblaciones de las especies explotadas (Kelleher, 1999; Polunin, 2002). Dentro de los objetivos de conservación del Parque Nacional Natural Tayrona -PNNT- (declarado hace más de tres décadas, ver resolución N°-0234 del 2004 Ministerio de Ambiente, Vivienda y Desarrollo) la resolución 026 de enero 26 de 2007 declara: “Conservar el mosaico ecosistémico marino costero y sus especies asociadas presentes en el área protegida, que incluye las formaciones coralinas, litoral rocoso, manglares, praderas de fanerógamas, fondos sedimentarios, playas y lagunas costeras y sus servicios ambientales”. A partir de lo anterior, el establecimiento del PNNT presume un efecto positivo sobre las comunidades de peces en comparación con aquellas de arrecifes cercanos a los centros urbanos del área de Santa Marta, Sin embargo, no existen antecedentes que corroboren esta suposición. En general, las publicaciones disponibles corresponden a listados de especies (Acero y Garzón-Ferreira, 1987, 1989; Reyes-Nivia et al., 2004) que no incluyen información sobre la estructura de las comunidades de peces a lo largo de toda el área.
Con este estudio se caracterizaron los ensamblajes de peces arrecifales del área de Santa Marta y del Parque Nacional Natural Tayrona (PNNT) a partir de la riqueza, diversidad, equitatividad, abundancia relativa (AR) y frecuencia de observación (FO) y se evaluó el posible efecto que la protección del PNNT ha ejercido sobre algunos de estos atributos. Así mismo se proporciona información de línea base acerca el estado general de ciertas especies.
ÁREA DE ESTUDIO
El área de Santa Marta y el PNNT se encuentran ubicados sobre la costa oriental del departamento de Magdalena en el Caribe colombiano. La costa es generalmente rocosa, con diversos acantilados, bahías, ensenadas, puntas e islotes, influenciadas por la Sierra Nevada de Santa Marta (Garzón-Ferreira y Díaz, 2003). Una característica importante de la región es un evento de surgencia durante la época seca (diciembremayo), provocado por la interacción de los vientos Alisios con la geomorfología de la costa lo que genera descensos en la temperatura y aumenta la salinidad de las aguas costeras (Ramírez, 1983).
Las formaciones coralinas que bordean la costa rocosa se ubican tanto en costados expuestos como protegidos al oleaje, y pueden organizarse en dos grupos: (1) bloques de roca metamórfica acumulados como producto de la erosión de los acantilados, colonizados por biota hermatípica a partir de los 5-8 m de profundidad y (2) formaciones coralinas edificadas sobre andamiajes más estables, generalmente protegidas de la acción del oleaje y constituidas en gran parte por corales masivos hemisféricos de gran tamaño. Al interior de las bahías se desarrollan arrecifes de parche y es posible encontrar una variedad de ambientes como manglares, praderas de pastos marinos, playas arenosas, pequeñas lagunas costeras y desembocaduras de riachuelos temporales (Garzón-Ferreira y Cano, 1991; Díaz et al., 2000).
MATERIALES Y MÉTODOS
Metodología
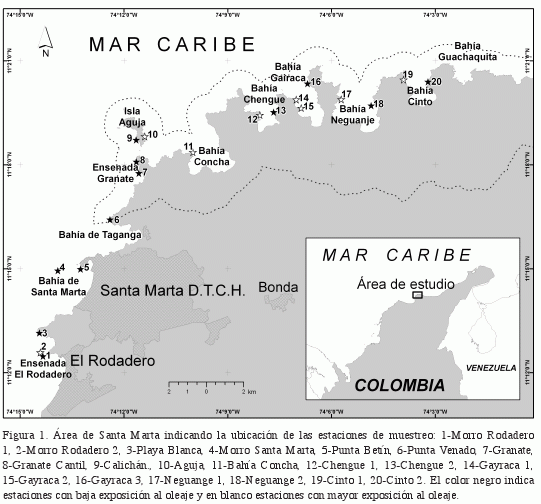
Durante los meses de abril y mayo (época seca) de 2005, se muestrearon 20 estaciones ubicadas sobre formaciones coralinas del área de Santa Marta y el PNNT (Figura 1), cuya profundidad abarcó el ámbito de 6 a 12 m. Se empleó el método de censo visual de buceo errante -CBE- que proporciona listados de peces y estimaciones de la abundancia relativa de cada especie (Schmitt y Sullivan, 1996). El CBE consistió en nadar libremente durante 30 minutos dentro de los límites de profundidad establecidos y anotar todas las especies observadas, así como cada individuo por especie. En el caso de los cardúmenes se realizó una estimación a decenas. Se realizaron cuatro censos por estación para un total de 120 minutos. Las curvas de diversidad acumulada (H’) contra tiempo de observación demostraron que 120 minutos son suficientes para evaluar la comunidad de peces y que inclusive después de 60 minutos, un incremento del 50% en el esfuerzo de muestreo (dos censos más) resulta en menos de un 3% de aumento en la diversidad de peces. Los censos fueron efectuados por dos investigadores experimentados, quienes examinaron cuidadosamente grietas, esponjas, parches de arena o cualquier posible refugio para registrar los peces de hábitos crípticos.
Análisis de la información
Para establecer el posible efecto del PNNT sobre los ensamblajes de peces, las estaciones fueron clasificadas de acuerdo con la intensidad de uso e influencia antrópica, dado que el límite geográfico del parque no se constituye en un factor determinante para los peces. De este modo, se tuvieron en cuenta los siguientes aspectos para cada estación: 1-Distancia a centros urbanos, 2- Distancia a ríos principales (río Gaira y río Manzanares), 3-Información sobre las actividades de pesca y buceo suministrada directamente por pescadores y operadores de buceo del área. Adicionalmente la clasificación se apoyó en revisión de información secundaria, observaciones de campo y del conocimiento previo de los investigadores en el área de estudio. Así, 11 estaciones pertenecen al grupo con
mayores impactos (pesca, actividades recreativas y descarga de aguas continentales) y se consideraron sin protección (SP). Las nueve restantes con menos influencia y más alejadas de los centros urbanos, concordaron con las estaciones ubicadas en cuatro bahías que hacen parte del área del PNNT y se presume para ellas un efecto de protección. En la tabla 1 se aprecia la categoría asignada a cada una de las estaciones.
Para comparar la composición de especies entre el PNNT y la zona de Santa Marta (con sus centros urbanos aledaños, zonas recreativas y de pesca) se utilizó un análisis de similaridad basado en el índice de presencia-ausencia de Jaccard (Ludwig y Reynolds, 1988). Para cada una de las estaciones se calculó la riqueza de especies, la diversidad de Shannon (H´) y el índice de equitatividad. Para examinar el efecto de la protección sobre estos atributos se realizó una ANOVA a una vía. Se utilizó el modelo lineal general y el procedimiento de los mínimos cuadrados (Sokal y Rohlf, 1981; SAS Institute, 1996).
El modelo contuvo el término que representa el efecto fijo de la protección. Antes de realizar el ANOVA se examinaron los supuestos de normalidad y homogeneidad de varianzas de los residuales. Los datos de la riqueza fueron transformados con log(x+1) para cumplir con estos requisitos. El modelo resultante fue:
Yij= μ + αi + eij
donde μ, es la media poblacional, αi es el efecto fijo de la protección y eij es el error experimental. El estado de las especies fue determinado a partir de dos variables: 1) la frecuencia de observación (FO) calculada como el porcentaje del número de censos en los cuales una especie es observada en el total de censos realizados por estación y 2) la abundancia relativa (AR) calculada como un puntaje ponderado (Schmitt y Sullivan, 1996) de la forma:
AR= ((nax1)+(nbx2)+(ncx3)+(ndx4))...... (nix9)) / (No total de censos por estación)
donde na, nb, nc y nd hasta ni representan el número de veces que cada categoría de abundancia le fue asignada a cada especie.
Para las categorías de abundancia se totalizó el número de individuos por especie y censo, y luego a cada total se le asignó una abundancia relativa mediante categorías logarítmicas (en base 2): 1= 1 individuo, 2= 2 individuos, 3= 3-4 individuos, 4= 5-8 individuos, 5= 9-16 individuos, 6= 17-32 individuos, 7= 33-64 individuos, 8= 65-128 individuos.
RESULTADOS
Composición general y atributos de la comunidad
Se registró un total de 180 especies distribuidas en 47 familias. La familia Serranidae dominó en cuanto al número de especies con 24, seguida por Haemulidae y Gobiidae con 13 especies cada una, Scaridae y Pomacentridae con 11, Labridae con 10 y Lutjanidae con 9 especies. La riqueza promedio por estación fue de 77 especies.
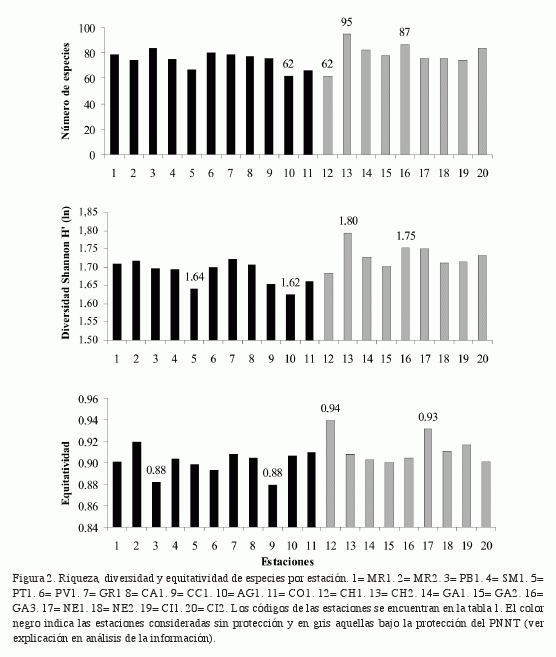
Los resultados del análisis de varianza (ANOVA) mostraron que no hay diferencias significativas en la riqueza de especies entre estaciones del grupo considerado sin protección (SP) y las del PNNT (p= 0.22) (Tabla 2). Al examinar la diversidad (Shannon), el ANOVA reveló diferencias significativas entre los dos niveles de protección (p< 0.05; Tabla 2). La diversidad promedio encontrada fue de 1.73±0.011 en las estaciones del PNNT y 1.68±0.10 en las estaciones consideradas sin protección. Finalmente, la equitatividad fue significativamente diferente entre zonas (p< 0.05; Tabla 2) con un valor promedio más alto en el PNNT que en las estaciones SP (0.913±0.004 y 0.900±0.011 respectivamente). La variación de los promedios de estos atributos a lo largo de todas las estaciones, así como valores máximos y mínimos se observan en la figura 2.
Distribución de especies
Se encontró que del total de las especies observadas, únicamente el 25% estuvo ampliamente distribuido en toda el área estudiada (mínimo en 16 de las 20 estaciones). Gran parte de las especies (52%) presentaron una baja distribución considerando que estuvieron presentes en máximo siete de los sitios o incluso fueron exclusivas de ciertas estaciones. El porcentaje restante de especies (23%) presentó una distribución media, es decir que se registraron en 8 a 15 de las estaciones. No obstante, al comparar la composición
de especies entre las estaciones SP y las del PNNT se encontró una importante similaridad (Índice de Jaccard 0.69) entre las dos zonas.
Composición de familias selectas
La composición de algunas familias de importancia comercial y/o ecológica varió entre las estaciones ubicadas en ambas zonas. De éstas, Serranidae (meros y chernas) presentó la mayor diferencia en su composición ya que de las 24 censadas en toda el área de estudio, siete fueron observadas en la zona SP (Hypoplectrus “Tan hamlet”, Hypoplectrus sp. 1, Mycteroperca tigris, M. venenosa, M. phenax, Rypticus saponaceus y Diplectrum formosum) y dos especies del género Epinephelus (E. guttatus y E. itajara) fueron vistas solamente en el PNNT. Por su parte Haemulidae (roncos) mostró que cuatro de sus especies se censaron únicamente en el PNNT (Haemulon parra, H. sciurus, H. striatum y Orthopristis ruber) y una en las estaciones SP (H. steindachneri). A pesar de presentar igual número de especies, la composición de la familia Lutjanidae (pargos) varió entre zonas. Las especies Lutjanus analis y L. cyanopterus sólo se observaron en las estaciones del PNNT y L. buccanella y L. griseus en las estaciones SP. Dentro de la familia Balistidae (ballestas), la especie Canthidermis sufflamen sólo fue vista en las estaciones del área protegida y Melichthys niger sólo se observó en el grupo de estaciones SP. Para la familia Pomacentridae (damiselas) únicamente hubo diferencias en la especie Abudefduf taurus, la cual sólo se observó en estaciones del PNNT. Dentro de la familia Scaridae (loros), Sparisoma radians fue vista solamente en las estaciones SP.
Abundancia relativa y frecuencia de observación
La mayor parte de las especies de peces arrecifales (80%) exhibieron FO menores al 70% y AR muy bajas (categoría 1= un individuo). El 20% restante estuvo constituido por las 30 especies con FO y AR más elevadas tanto en estaciones del PNNT como en las estaciones SP. Las especies con mayores abundancias relativas en ambos grupos fueron Acanthurus bahianus, Stegastes partitus, Chromis multilineata, Thalassoma bifasciatum y Myripristis jacobus (categorías 5-8= 9-128 individuos; Tabla 3). En general estas mismas especies obtuvieron altas frecuencias de observación (>84%) y por lo tanto su estado podría definirse como especies observadas a menudo y en altas densidades. Por su parte la mayoría de pargos y meros de gran tamaño se caracterizaron por presentar abundancias promedio <1 así como FO considerablemente bajas (1-20%) en ambas zonas (con excepción de Lutjanus mahogoni dentro del parque; Tabla 3). Así, las especies arrecifales de importancia pesquera mantienen la condición de especies que no se observan frecuentemente y que se presentan en densidades muy bajas.
Adicionalmente, se presentaron variaciones sustanciales en la FO y AR entre los dos grupos de estaciones para algunas especies. Por ejemplo, Haemulon plumieri y Lutjanus mahogoni estuvieron mejor representadas en estaciones del PNNT (Tabla 3) que en aquellas consideradas sin protección (63% - 1.23 y 57% - 1.70 respectivamente). La situación opuesta ocurrió con las especies Chaetodon sedentarius y Chromis insolata las cuales fueron más comunes y abundantes en las estaciones sin protección (Tabla 3) que en las del parque (36% - 0.36 y 25% - 1).
DISCUSIÓN
Composición general y atributos de la comunidad
Las familias dominantes en cuanto al número de especies para toda el área de estudio fueron: Serranidae, Haemulidae, Gobiidae, Scaridae y Pomacentridae. Este patrón parece ser consistente con el encontrado en la mayoría de arrecifes tanto del gran Caribe como del Caribe colombiano (Phillips y Pérez-Cruet, 1984; Mejía et al., 1998; Pattengil- Semmens y Semmens, 2003; Reyes-Nivia et al., 2004), sugiriendo que las comunidades de peces arrecifales en el área de Santa Marta son típicas de los ambientes coralinos tropicales del Caribe.
Al contrastar la riqueza de peces arrecifales de este estudio (180 especies) con la obtenida en otros trabajos (entre 120-173 especies) que han empleado el mismo protocolo de evaluación y similares esfuerzos de muestreo (Hoshino et al., 2003; Kramer et al., 2003; Nemeth et al., 2003; Pattengill-Semmens y Semmens, 2003), se encontró que el área de Santa Marta soporta una importante riqueza. Otro indicativo de esto, es el número promedio de especies observadas por estación (77), el cual fue mayor al registrado (56) en un estudio de amplia escala espacial (Kramer et al., 2003). Por lo tanto, se puede concluir que los arrecifes coralinos del área de Santa Marta y del Parque Tayrona son un importante refugio para las especies de peces asociadas a dichos ecosistemas.
La importante riqueza observada es probablemente resultado de la interacción de varios factores. Entre ellos, la alta diversidad y complejidad de los hábitat locales, ya que se ha reconocido que la zona costera del área estudiada es topográficamente heterogénea y presenta además de arrecifes, una gran variedad de ambientes como playas arenosas, acantilados, praderas de pastos marinos y manglares (Garzón-Ferreira y Díaz, 2003) que favorecerían la presencia de diversas especies de peces. En este sentido se ha encontrado que los manglares y los pastos marinos cumplen una función como “salas cuna”, promoviendo la presencia y mayor densidad de ciertas especies de peces en los arrecifes coralinos (Nagelkerken et al., 2001, 2002). Otros factores que se deben considerar son la influencia de diversas masas de agua y el fenómeno de surgencia local en Santa Marta, los cuales posiblemente han propiciando condiciones que favorecen la supervivencia de las larvas de peces. En relación con lo anterior, se ha determinado que para muchas especies de peces arrecifales la sobrevivencia larval está mediada por factores tales como un apropiado transporte hacia los arrecifes, disponibilidad de alimento, abundancia de depredadores y condiciones del ambiente pelágico (Leis, 1991; Cowen, 2002). Sin embargo, estudios detallados analizando la influencia de los factores referidos sobre la riqueza y abundancia de los peces arrecifales no han sido aún realizados en la región de Santa Marta.
Al comparar el número de especies observadas en otros arrecifes coralinos, tanto costeros como oceánicos del Caribe colombiano, se identificó nuevamente que el área aquí evaluada tiene una alta riqueza de peces arrecifales. Reyes-Nivia et al. (2004) encontraron un total de 198 especies para cinco localidades del Caribe colombiano. De éstas, 149 fueron censadas en dos estaciones de la bahía de Chengue en el PNNT donde se reconoció la mayor riqueza entre los lugares evaluados. Estos resultados confirman la importante riqueza de peces arrecifales que soporta el área de Santa Marta y el PNNT en Colombia. No obstante, la riqueza de esta área podría ser incluso mayor debido a que durante los censos se están subestimando especies de hábitos crípticos y nocturnos.
Si bien la riqueza de especies fue igual entre zonas, la diversidad (Shannon) y la equitatividad fueron mayores en las estaciones asociadas al PNNT que en las estaciones SP en el área de Santa Marta. Estos resultados sugieren que habría un efecto positivo de la protección del PNNT sobre estos dos atributos y por lo tanto estaría jugando un rol importante en la conservación de la diversidad de peces. Aunque algunas especies sólo fueron observadas en pocas estaciones, es muy posible que la mayoría de ellas se distribuyan a lo largo de toda el área de estudio (área de Santa Marta y PNNT). De este modo las diferencias en la diversidad o equitatividad se mantendrían y estarían relacionadas con las abundancias particulares de las especies y no a la composición.
Variación en la composición de familias selectas
La comparación de la composición de especies para algunas familias entre los dos niveles de protección evaluados exhibió diferencias principalmente en algunos grupos de importancia comercial. La familia Serranidae presentó variaciones en su composición con una mayor riqueza en las estaciones SP, dadas especialmente por algunas especies del género Mycteroperca. Este resultado es contradictorio con otros estudios donde se ha observado que las áreas más intensamente pescadas (o sin ninguna protección o regulación a la pesca) presentan ausencia de chernas, mientras las áreas protegidas son más ricas en dichas especies (Russ y Alcala, 1989; Chiappone et al., 2000). Sin embargo, considerando que las especies que marcaron la diferencia no estuvieron ampliamente distribuidas en las estaciones sin protección (presentes en una estación) y que dos especies del género Epinephelus sólo se censaron en el PNNT, no se pueden hacer generalizaciones. De manera similar se encontró que las diferencias en la composición de los pargos estuvieron influenciadas por la presencia de algunas especies en pocas estaciones del PNNT o SP. Considerando que las poblaciones de pargos arrecifales exhiben vulnerabilidad a la extracción (Koslow et al., 1988; Russ y Alcala, 1989; Polunin y Roberts, 1993), nuevamente se evidencian los efectos de la pesca en la estructura de los ensamblajes de peces. Por consiguiente, los bajos valores de AR y FO de grandes meros, chernas y pargos encontrados a lo largo de toda el área estudiada indican la escasez de estos recursos ícticos. Esto sugiere que el establecimiento del PNNT no ha tenido un efecto positivo sobre dichas poblaciones y consecuentemente insinúa una falta de efectividad en el cumplimiento de la normatividad para las actividades de pesca dentro del área protegida. De otro lado, parecería que la presencia del PNNT ha contribuido al mantenimiento de la riqueza de la familia Haemulidae, ya que la mayoría de especies de ésta familia se observaron en esa zona. Para este grupo, en contraste con los meros y pargos, las especies responsables de las diferencias fueron observadas en varias estaciones.
Abundancia relativa y frecuencia de observación
El estado de las especies que conforman los ensamblajes ícticos en los parches arrecifales de Santa Marta y el PNNT -en términos de frecuencia de observación (FO) y abundancia relativa (AR)- se enmarcó generalmente dentro de dos esquemas: 1) especies a menudo observadas pero con bajas densidades y 2) especies poco observadas y con densidades muy bajas. Fuera de estos dos esquemas, se encontraron las especies con mayor abundancia relativa y con alta frecuencia de observación (S. partitus, C. multilineata, T. bifasciatum y M. jacobus), incluyendo algunos herbívoros (A. bahianus, A. coeruleus, S aurofrenatum y S. viride) y carnívoros (Haemulon flavolineatum y Cephalopholis cruentata). Este resultado refleja la condición general de los arrecifes del Caribe, donde dichas especies están ampliamente distribuidas y se han reconocido entre las más comunes (Choat, 1991; Schmitt y Sullivan, 1996; Hoshino et al., 2003; Kramer et al., 2003; Nemeth et al., 2003; Pattengil-Semmens y Semmens, 2003).
Por otro lado, pequeños carnívoros como Bodianus rufus, Haemulon chrysargyreum y L. mahogoni no habían sido previamente mencionados entre las 25 especies más usualmente observadas (Schmitt y Sullivan, 1996; Claro y Cantelar-Ramos, 2003; Kramer et al., 2003; Nemeth et al., 2003; Pattengil-Semmens y Semmens, 2003). Este hecho puede atribuirse a la condición continental de Santa Marta a diferencia de los ambientes insulares evaluados en dichos estudios. En este sentido algunos trabajos han encontrado esquemas similares (Choat y Ayling, 1987; Meekan y Choat, 1997). De otro lado se deben considerar las presiones de pesca, puesto que afectan directamente la abundancia de especies de mayor tamaño y conllevan a una disminución de estas poblaciones y aumentan la abundancia relativa de especies más pequeñas y de menor valor comercial (Chiappone et al., 2000; Westera et al., 2003).
Las variaciones en términos de FO y AR para H. plumieri y L. mahogoni entre zonas se podrían explicar también desde la perspectiva de las presiones de pesca, puesto que se ha encontrado que las abundancias de estos grupos son mayores dentro de las áreas protegidas que en sitios adyacentes a éstas (Polunin y Roberts, 1993). Estos resultados sugieren de manera indirecta cómo dos especies no preferidas tradicionalmente por los pescadores podrían ser en la actualidad blancos de captura y extraídas con más frecuencia en arrecifes fuera del PNNT. Al respecto, desde hace varios años se ha señalado para el Caribe colombiano un cambio en la composición de la ictiofauna objetivo de captura hacia especies más pequeñas o no convencionales (Acero, 1993).
Un caso interesante dentro de las 30 especies mejor representadas en ambas zonas fue Chaetodon capistratus (Tabla 3), ya que ésta no suele ser frecuente y abundante en arrecifes perturbados. Es así como Acero y Rivera (1992) propusieron a dicha especie como bioindicadora del estado de salud de los arrecifes coralinos en esta zona del Caribe, dado que posee una elevada abundancia en sitios con altas coberturas de coral vivo y desaparece en ausencia de esta condición. Sin embargo, mediante el presente trabajo se logró identificar que dicha especie presenta valores similares de FO y AR en ambos grupos de estaciones (Tabla 3). Tomando en cuenta que C. capistratus es considerada como una especie que se alimenta principalmente de pólipos de corales escleractinios (Neudecker, 1985) y que la cobertura de coral en la bahía de Santa Marta es menor al 10% (Rodríguez-Ramírez et al., 2006; Vega-Sequeda, 2006), se plantea que esta especie ha experimentado un cambio sustancial en su dieta o ha desarrollado algún grado de adaptación a las áreas arrecifales con bajas coberturas. De esta forma se abre la discusión acerca de la propuesta de Acero y Rivera (1992) y se invita a profundizar en las explicaciones al esquema encontrado en esta investigación y si se presenta en otras áreas del Caribe.
En conclusión, los ensamblajes de peces arrecifales de Santa Marta y del PNNT presentaron diferencias que sugieren que la protección ofrecida por el parque puede favorecer la preservación de una alta diversidad de especies, mas no suficiente para la recuperación y mantenimiento de las poblaciones de peces más vulnerables a la pesca (meros, chernas y pargos). Por lo tanto se requiere implementar medidas de manejo eficaces y mecanismos de control que aseguren el cumplimiento de la normatividad relacionada con la pesca dentro del PNNT.
AGRADECIMIENTOS
Esta investigación se enmarcó en el proyecto “Estado Actual de las Comunidades de Peces Arrecifales del Área de Santa Marta: un soporte para el manejo del AMP Parque Nacional Natural Tayrona” y se realizó gracias al apoyo financiero del Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología COLCIENCIAS (proyecto N° 21-05-09-16826) y el Instituto de Investigaciones Marinas y Costeras INVEMAR. También agradecemos muy especialmente a Raúl Navas, Johanna Vega, Jaime Garzón y Nadia Santodomingo, quienes colaboraron para el desarrollo del proyecto. Este trabajo es el resultado directo del Trabajo de Grado del primer autor (Universidad de Antioquia, Facultad de Ciencias, Programa de Biología).
BIBLIOGRAFÍA
1 Acero, A. 1993. Una nueva mirada a los peces comerciales del Caribe continental colombiano. An. Inst. Invest. Mar. Punta de Betín, 29: 129-135. [ Links ]
2 Acero, A y J. Garzón-Ferreira.1987. Peces arrecifales de la región de Santa Marta (Caribe colombiano). I. Lista de especies y comentarios generales. Acta Biol. Col., 1 (3): 83-105. [ Links ]
3 Acero, A y J. Garzón-Ferreira.1989. Peces arrecifales de la región de Santa Marta (Caribe colombiano). II. Tres nuevos registros para el sur del Caribe. Car. J. Sci., 25 (1-2): 41-44. [ Links ]
4 Acero, A. y M. Rivera. 1992. Peces de la familia Chaetodontidae y Pomacanthidae en la región de Santa Marta (Colombia): densidad y relación con la calidad del arrecife. Carib. J. Sci., 28 (3-4): 184-190. [ Links ]
5 Carpenter, K.E. 1981. The influence of substrate structure on the local abundance and diversity of Philippine reef fishes. Proc. 4th Int. Coral Reef Sym., Manila, 2: 497-502. [ Links ]
6 Chiappone, M., R. Sluka y K. Sullivan-Sealey. 2000. Groupers (Pisces: Serranidae) in fished and protected areas of the Florida Keys, Bahamas and northern Caribbean. Mar. Ecol. Prog. Ser., 198: 261-272. [ Links ]
7 Choat, J.H. 1991. The biology of herbivorous fishes on coral reefs. 120-155. En:. Sale, P.F. (Ed.). The ecology of fishes on coral reef. Academic Press, San Diego. [ Links ]
8 Choat, J.H y A.M. Ayling. 1987. The relation between habitat structure and fish faunas on New Zeland reefs. J. Exp. Mar. Biol. Ecol., 110: 257-284. [ Links ]
9 Claro, R. y K. Cantelar-Ramos. 2003. Rapid assessment of coral communities of Maria La Gorda, southeast Ensenada de Corrientes, Cuba (part 2: reef fishes). Atoll Res. Bull., 496: 278-293. [ Links ]
10 Cowen, R.K. 2002. Larval dispersal and retention and consequences for population connectivity. 149-170. En: Sale, P.F. (Ed.). Coral Reef Fishes: Dynamics and diversity in a complex ecosystem. Academic Press, Elsevier Science, San Diego. [ Links ]
11 Depczynski, M. y D.R. Bellwood. 2005. Wave energy and spatial variability in community structure of small cryptic coral reef fishes. Mar. Ecol. Prog. Ser., 303: 283-293. [ Links ]
12 Díaz, J.M., L.M. Barrios, M.H. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G.H. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F.A. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. INVEMAR, Santa Marta. 176 p. [ Links ]
13 Garzón-Ferreira, J. y M. Cano. 1991. Tipos, distribución, extensión y estado de conservación de los ecosistemas marinos costeros del Parque Nacional Natural Tayrona. Reporte Final, INVEMAR, Santa Marta, 82 p. [ Links ]
14 Garzón-Ferreira, J. y J.M. Díaz. 2003. The Caribbean coral reefs of Colombia. 375-301. En: Cortés, J. (Ed.). Latin American Coral Reefs. Elsevier, Amsterdam. [ Links ]
15 Gratwicke, B. y M.R. Speight. 2005. The relationship between fish species richness, abundance and habitat complexity in a range of shallow tropical marine habitats. J. Fish Biol., 66: 650-667. [ Links ]
16 Guidetti, P., A. Terlizzi, S. Fraschetti y F, Boer. 2003. Changes in Mediterranean rocky-reef fish assemblages exposed to sewage pollution. Mar. Ecol. Prog. Ser., 253: 269-278. [ Links ]
17 Hoshino, K., M. Brandt, C. Manfrino, B. Riegl y S. Steiner. 2003. Assessment of the coral reef of the Turks and Caicos Island (part 2: fish communities).. Atoll Res. Bull., 496: 480-499. [ Links ]
18 Kelleher, G. 1999. Guidelines for marine protected areas. IUCN, Gland, Switzerland and Cambridge, UK. xxiv 107 p. [ Links ]
19 Koslow, J.A., F. Hanley y R. Wicklund. 1988. Effects of fishing on reef fish communities at Pedro Bank and Port Royal Cays, Jamaica. Mar. Ecol. Prog. Ser., 43: 201-212. [ Links ]
20 Kramer, P.A., K.W. Marks y T.L. Turnbull. 2003. Assessment of Andros Island reef system, Bahamas (part 2: fishes). Atoll Res. Bull., 496: 100-123. [ Links ]
21 Leis, J.M. 1991. The pelagic phase of coral reef fishes: larval biology of coral reef fishes. 183-230. En: Sale, P.F. (Ed.). The ecology of fishes on coral reefs. Academic Press, San Diego. [ Links ]
22 Lubchenco J, S.R. Palumbi, S.D. Gaines y S. Andelman. 2003. Plugging a hole in the ocean: The emerging science of marine reserves. Ecol. Appl., 13 (1): S3-S7. [ Links ]
23 Ludwig, J.A. y J.F. Reynolds. 1988. Statistical ecology: a primer on methods and computing. John Wiley and Sons, Nueva York. 337 p. [ Links ]
24 McClanahan, T.R., K. Bergman, M. Huitric, M. McField, T. Elfwing, M. Nyström y I. Nordemar. 2000. Response of fishes to algae reduction on Glovers Reef, Belize. Mar. Ecol. Prog. Ser., 206: 273-282. [ Links ]
25 Meekan M.G. y Choat J.H. 1997. Latitudinal variation in abundance of herbivorous fishes: a comparison of temperate and tropical reef. Mar. Biol., 128: 373-383. [ Links ]
26 Mejía, L.S., J. Garzón-Ferreira y A. Acero. 1998. Peces registrados en los complejos arrecifales de los cayos Courtown, Albuquerque y los bancos de Serrana y Roncador, Caribe occidental, Colombia. Bol. Ecotrópica, 32: 25-42. [ Links ]
27 Nagelkerken, I., S. Kleijnen, T. Klop, R.A.C. van den Brand, E. Cocheret de la Moniriène y G. van der Velde. 2001. Dependence of Caribbean reef fishes on mangroves and seagrass beds as nursery habitats: a comparison of fish fauna between bays with and without mangroves/seagrass beds. Mar. Ecol. Prog. Ser., 214: 225-235. [ Links ]
28 Nagelkerken, I., C.M. Roberts, G. van der Velde, M. Dorenbosch, M.C. van Riel, E. Cocheret de la Moniriène y P.H. Nienhuis. 2002. How important are mangroves and seagrass beds for coral-reef fish? The nursery hypothesis tested on an island scale. Mar. Ecol. Prog. Ser., 244: 299-305. [ Links ]
29 Nemeth, R.S., L.D. Whaylen y C.V. Pattengill-Semmens. 2003. A rapid assessment of coral reefs in the Virgin Island (part 2: fishes). Atoll Res. Bull., 496: 566-589. [ Links ]
30 Neudecker, S. 1985. Foraging pattern of chaetodontid and pomacanthid fishes at St. Croix. Proc. 5th Int. Coral Reef Cong., Tahiti, 5: 415-420. [ Links ]
31 Pattengill-Semmens, C.V. y B.X. Semmens. 2003. Status of coral reefs of Little Cayman and Grand Cayman, British West Indies, in 1999 (part 2:fishes). Atoll Res. Bull., 496: 226-247. [ Links ]
32 Phillips, P.C. y M.J. Pérez-Cruet. 1984. A comparative survey of reef fish in Caribbean and Pacific Costa Rica. Rev. Biol. Trop., 32 (1): 95-102. [ Links ]
33 Polunin, N.V.C. 2002. Marine Protected Areas: fish and fisheries. 293-318. En: Hart, P.J.B.y J.D Reynolds (Eds.). Handbook of fish and fisheries, Vol II, Blackwell Publishing, Oxford. [ Links ]
34 Polunin, N.V.C. y C.M. Roberts. 1993. Greater biomass and value of target coral-reef fishes in two small Caribbean marine reserves. Mar. Ecol. Prog. Ser., 100: 167-176. [ Links ]
35 Ramírez, G. 1983. Características fisicoquímicas de la bahía de Santa Marta (agosto 1980 - julio 1981). An. Inst. Invest. Mar. Punta de Betín, 13: 111-121. [ Links ]
36 Reyes-Nivia, M.C., A. Rodríguez-Ramírez y J. Garzón-Ferreira. 2004. Peces asociados a formaciones coralinas de cinco áreas del Caribe colombiano: listado de especies y primeros registros para las áreas. Bol. Invest. Mar. Cost., 33: 99-113. [ Links ]
37 Rodríguez-Ramírez, A., M.C. Reyes-Nivia, R. Navas-Camacho, S. Bejarano, J. Garzón-Ferreira y F. Zapata. 2006. Status of the coral reefs of Colombia in 2003. Proc. 10th Int. Coral Reef Sym., Okinawa, 1: 976-981. [ Links ]
38 Russ, G.R. y A.C. Alcala. 1989. Effects of intense fishing pressure on an assemblage of coral reef Fishes. Mar. Ecol. Prog. Ser., 56: 13-27. [ Links ]
39 Sale, P.F. (Ed.). 1991. The ecology of fishes on coral reefs. Academic Press, San Diego. 774 p. [ Links ]
40 SAS Institute. 1996. SAS/STAT guide for personal computers. 6th edition. SAS. Institute, Cary, NC. [ Links ]
41 Schmitt, E.F. y K.M. Sullivan.1996. Analysis of volunteer method for collecting fish presence and abundance data in the Florida Keys. Bull. Mar. Sci., 59 (2): 404-416. [ Links ]
42 Sokal, R.R. y F.J. Rohlf. 1981. Biometry. WH Freeman and company, Nueva York. 859 p. [ Links ]
43 Vega-Sequeda, J. 2006. Formaciones coralinas del área de Santa Marta: estado y patrones de distribución espacial de la comunidad bentónica. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Santa Marta. 72 p. [ Links ]
44 Wainwright, P.C. y D.R Bellwood. 2002. Ecomorphology of feeding in coral reef fishes. 33-55. En: Sale, P.F. (Ed.). Coral reef fish: dynamics and diversity in a complex ecosystem. Academic Press, Elsevier Science, San Diego. [ Links ]
45 Westera, M., P. Lavery y G. Hyndes. 2003. Differences in recreationally targeted fishes between protected and fished areas of a coral reef marine park. J. Exp. Mar. Biol. Ecol., 294: 145-168. [ Links ]
46 Williams, D.Mc.B. 1991. Patterns and processes in the distribution of coral reef fishes. 437-473. En: Sale, P.F. (Ed.). The ecology of fishes on coral reef. Academic Press, San Diego. [ Links ]
FECHA DE RECEPCIÓN: 14/08/06 FECHA DE ACEPTACIÓN: 18/04/08