Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.37 no.2 Santa Marta July/Dec. 2008
CULTIVO PILOTO DE MACROALGAS ROJAS (RHODOPHYTA) EN BAHÍA PORTETE, LA GUAJIRA, COLOMBIA
PILOT CULTURE OF RED SEAWEEDS (RHODOPHYTA) IN PORTETE BAY, LA GUAJIRA, COLOMBIA.
Oscar Delgadillo-Garzón1 y Federico Newmark2
1 Universidad Jorge Tadeo Lozano, Facultad de Biología Marina. Calle 127ª #53ª-68, Apto. 502, Bogotá, Colombia. E-mail: oskadelgadillo@gmail.com
2 Centro de Investigación de la Acuicultura de Colombia, CENIACUA, Carrera 9B # 113-60. Bogotá, Colombia. E-mail: fnewmark@ceniacua.org
RESUMEN
Se realizó un cultivo piloto de macroalgas en bahía Portete, La Guajira, Colombia, entre julio de 2005 y junio de 2006, con el fin de evaluar la factibilidad de implementarlo como alternativa productiva para las comunidades costeras de la región. Se sembraron 114 kg de las algas rojas Gracilaria cervicornis, Hydropuntia cornea, Hypnea musciformis y Grateloupia sp. sobre cuerdas de polipropileno y mallas cilíndricas en dos lugares de la bahía. La especie G. cervicornis tuvo tasas de crecimiento relativo (TCR) entre 0.1 % día-1 y 1.22 % día-1, con promedio de 0.44 % día-1, fuerte epifitismo y altas tasas de pérdida. La especie H. cornea presentó un promedio de TCR de 0.91 % día-1 y osciló entre 0.02 % día-1 y 3.5 % día-1 en el sitio uno, mientras que en el sitio dos el promedio de TCR fue de 0.97 % día-1 con ámbito entre 0.03 % día-1 y 4.1 % día-1 con el valor más alto observado en febrero de 2006. Los fragmentos de menor tamaño presentaron las mayores TCR e incremento de biomasa con respecto a los fragmentos de mayor peso. Las macroalgas H. musciformis y Grateloupia sp. no se ajustaron a los sistemas de cultivo debido a su fragilidad. Por otro lado, los factores ambientales temperatura y salinidad tuvieron alta variación en el tiempo, pero no presentaron correlación con las TCR. Sin embargo, en la época seca cuando se registró la menor temperatura y un incremento en los nutrientes debido al evento de surgencia históricamente documentado, se observaron las TCR más altas y una reducción en la carga de epífitos. Es probable que diferentes factores, como el movimiento del agua, concentración de nutrientes, temperatura, salinidad, herbivoría y epifitismo, tengan influencia en el crecimiento de las macroalgas. Es necesario realizar una completa caracterización de los parámetros fisicoquímicos y hacer experimentos enfocados a disminuir la incidencia de los diferentes factores ambientales y biológicos para tener un conocimiento real de la productividad de la bahía que, a juzgar por los mayores valores de TCR encontrados, tiene potencial para cultivos de algas incorporando mejoras tecnológicas en las actividades de maricultura.
PALABRAS CLAVE: Algas rojas, Cultivo piloto, Tasa de crecimiento relativo (TCR), Maricultura, Bahía Portete.
ABSTRACT
A seaweed pilot culture was developed in Portete bay, La Guajira, Colombia, between July 2005 and June 2006. The aim of this study was to evaluate the potential of this activity as a productive alternative to coastal communities thriving in the region. One hundred fourteen kilograms of the red algae Gracilaria cervicornis, Hydropuntia cornea, Hypnea musciformis and Grateloupia sp. were attached to polypropylene ropes and cylindrical meshes, at two sites of the bay. Gracilaria cervicornis had relative growth rates (RGR) between 0.1 % day-1 and 1.22 % day-1, with a mean of 0.44 % day-1, strong epiphytism and high loss rates. Hydropuntia cornea had a mean RGR of 0.91 % day-1 varying between 0.02 % day-1 and 3.5 % day-1 at site one, while at site two it had an average RGR of 0.97 % day-1 with a range between 0.03 % day-1 to 4.1 % day-1 with the maximum value recorded in February 2006. Small sized fragments exhibited the best RGR and biomass increase in comparison to larger fragments. Hypnea musciformis and Grateloupia sp. did not fare well under culture conditions due to their fragility. Environmental factors such as temperature and salinity had great variation in time, but no correlation was evident with RGR. The greatest RGR and epiphytism reduction were observed during the dry season where minimum temperatures were registered and there was an increase in nutrient availability due to a seasonal upwelling event. Different factors, such as water motion, nutrient concentration, temperature, salinity, herbivory, and epiphytism, exert some influence on seaweed growth, although is necessary to perform a complete characterization of physicochemical parameters in order to assess the bay’s productivity. It is also necessary to develop experiments aimed at reducing the incidence of different factors in the cultures. The RGR of some local algae species reported in this study suggest that Portete bay has adequate conditions to develop seaweed culture but, in order to do so, it is necessary to improve some of the culture techniques.
KEY WORDS: Red seaweed, Pilot culture, Relative growth rates (RGR), Mariculture, Portete bay.
INTRODUCCIÓN
El departamento de La Guajira es considerado una de las áreas con mayor productividad en el Caribe colombiano, debido al evento de surgencia que se genera durante la mayor parte del año en este sector (Álvarez-León et al., 1995), por lo que la explotación de los recursos marinos como crustáceos, moluscos, tortugas y peces han sido durante siglos el principal sustento para las comunidades costeras de pescadores y nativos Wayuú, en su mayoría marginadas y con niveles de vida precarios. Esta etnia, la más numerosa del país, se concentra principalmente en el centro y norte de la península (media y alta Guajira respectivamente). Tiene costumbres ancestrales como la caza, la recolección, la horticultura; sus principales ejes socioeconómicos son la pesca y el pastoreo (Guerra, 1990; Rueda-Almonacid et al., 1992; Borrero et al., 1996; Delgadillo y Lara, 2006).
En Colombia existen diversos estudios sobre algas marinas, entre los que se destaca el trabajo de Bula-Meyer (1985) sobre algas indicadoras de aguas de surgencia en el Caribe. Otras investigaciones sobre estos organismos en el país se han enfocado hacia la taxonomía (Bula-Meyer, 1995; Bula-Meyer y Díaz-Pulido, 1995), ecología (Bula-Meyer, 2001; Mejía-Niño y Garzón-Ferreira, 2003; García y Díaz-Pulido, 2006) y química (Bula-Meyer, 1991; Trespalacios et al., 2004; Díaz-Ruiz et al., 2006).
Se han realizado trabajos sobre la composición química de algunas algas de La Guajira (Cabezas et al., 1975). Sin embargo, la mayor parte de los estudios han sido de naturaleza taxonómica. Díaz-Pulido (2000) presentó un listado taxonómico de las algas encontradas al nororiente de Riohacha en la plataforma Chuchupa. Díaz-Pulido y Díaz-Ruiz (2003) registraron aproximadamente 171 especies de algas en la región, siendo las algas rojas las más diversas. En años posteriores, Santodomingo et al. (2005) evaluaron la diversidad de flora y fauna en las plataformas de gas de Chuchupa en donde observaron nueve especies de algas.
El desarrollo de la maricultura en Colombia ha sido enfocado principalmente hacia el cultivo de camarón (Aguilera, 1998; Salazar, 2002; FAO, 2004). En este campo, se han ejecutado estudios entre los sectores de Córdoba y Bolívar sobre las condiciones ambientales y sostenibilidad del cultivo mediante biofiltros de manglar para el tratamiento de aguas residuales (Rivera-Monroy et al., 1999; Gautier et al., 2001) y el cierre del ciclo de cultivo en cautiverio, con lo cual se evitó la importación de larvas de otros países y el ingreso de enfermedades (Newmark y Vallejo, 1995; Vallejo y Newmark, 1999; Suárez et al., 2001). Sobre otros organismos diferentes al camarón, en las últimas décadas entidades como INVEMAR, UNIMAG y CORPOGUAJIRA han avanzado con algunos intentos a escala piloto y experimental para cultivar bivalvos de la familia Pectinidae y Pteriidae en el medio natural, así como en la obtención de semillas en laboratorio (Valero y Caballero, 2003; Castellanos et al., 2005; Delgadillo y Lara, 2006; Velasco et al., 2007). Igualmente, en CENIACUA se han adelantado estudios sobre aspectos biológicos, reproductivos y de cultivo para pargos y meros (Botero-Arango y Castaño-Rivera, 2005; CENIACUA, 2006), mientras que en la región de Santa Marta se realizó un proyecto para el manejo sostenible de la langosta espinosa y su cultivo (Jaimes et al., 2004). De otro lado, se han realizado estudios para cultivar la ostra de mangle, repoblación de peces como liza y lebranche, y también cultivos piloto para sábalo y róbalo en los departamentos de Córdoba, Sucre, Bolívar, Atlántico, Magdalena y algunos sectores del Pacífico (Beltrán y Villaneda, 2000; Salazar, 2002). En suma, es evidente que el campo de la maricultura permanece relativamente inexplorado en Colombia, a pesar de la gran diversidad de organismos marinos en el país con potencial de cultivo.
Se han registrado aproximadamente 565 especies de algas marinas bentónicas en el Caribe colombiano, constituyendo casi la mitad de las especies conocidas del Atlántico occidental tropical y subtropical, indicando una alta diversidad en comparación con otros países (Díaz-Pulido y Díaz-Ruiz, 2003). De estas algas, en particular de las especies del Pacífico, y de zonas subtropicales y templadas del mundo, se obtienen diferentes productos como ficocoloides, alimentos, fármacos y fertilizantes, conformando actualmente una de las industrias con mayor producción a nivel mundial, generando cerca de seis billones de dólares anualmente y sustento para las comunidades costeras menos favorecidas, consolidándose así como una de las formas productivas más sencillas, rentables y amigables con el medio ambiente (Santelices, 1999; McHugh, 2003).
En Colombia, desde la década de los años ochenta, Bula-Meyer (1988, 1989a, 1989b) estableció la importancia de las algas como recurso de potencial económico y dio inicio a los primeros experimentos para su cultivo, con la especie Grateloupia filicina. Sin embargo, el desarrollo de esta empresa en Colombia no ha recibido el interés necesario para lograr su utilización y aprovechamiento, en vista de su reconocida viabilidad productiva. En el Cabo de la Vela, La Guajira, Rincones y Gallo (2004) cultivaron una especie aparentemente introducida de origen filipino Kappaphycus alvarezii, proyecto con excelentes perspectivas, pero que no tuvo continuidad debido a problemas con los requerimientos legales para la utilización de esta especie en aguas colombianas. En años posteriores en la región de Santa Marta, Delgadillo et al. (2005) y Montaño (2006) realizaron experimentos para el cultivo de las algas rojas Gracilaria cervicornis, G. blodgettii, G. mamillaris e Hypnea musciformis obteniendo resultados importantes para el avance de esta actividad en el país.
A finales de 2004, CORPOGUAJIRA en convenio con INVEMAR dieron inicio a un proyecto para la caracterización de la zona costera de La Guajira, dentro del cual se desarrolló un policultivo piloto de macroalgas y bivalvos en bahía Portete. Este lugar se escogió por presentar características ideales de una bahía con profundidades adecuadas para la instalación de los sistemas de cultivo, comunidades de pescadores Wayuú en las zonas adyacentes para realizar la transferencia tecnológica, facilidades logísticas para el desarrollo de la actividad y presencia de bancos de algas promisorias para el cultivo. De esta forma, los criterios utilizados para escoger a las macroalgas fueron: 1) especies con tasas de crecimiento admisibles para el cultivo, que se han utilizado en países como México, Venezuela, Brasil, algunas islas de las Antillas (Smith et al., 1984; Rincones, 1990; Robledo, 1999; Da Costa, 2001) y en Colombia (Bula-Meyer, 1989a), y 2) algas con productos potenciales para el mercado nacional como el agar y la carragenina de calidad reconocida y aceptable en otras investigaciones (Marinho- Soriano et al., 2001; Freile-Pelegrin et al., 2002; McHugh, 2003). Por consiguiente, el propósito de esta investigación fue validar la factibilidad de implementar el cultivo de macroalgas en bahía Portete, como una alternativa productiva para las comunidades costeras de la región.
ÁREA DE ESTUDIO
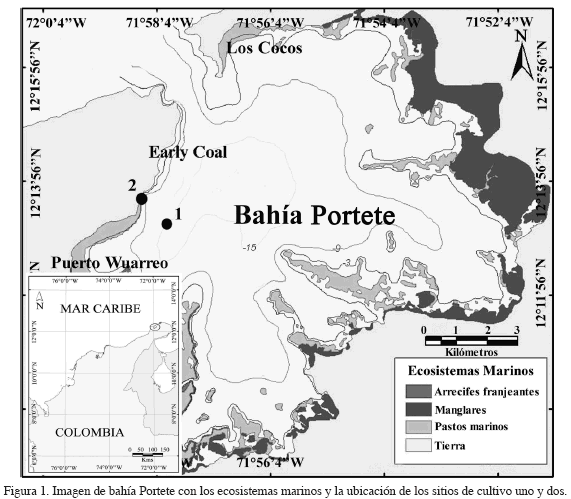
Bahía Portete está localizada en el norte de La Guajira (12° 07' N y 72° 02' W), tiene forma irregular, con un diámetro promedio de 13 km y una extensión de 125 km2 (Figura 1). La bahía se comunica con el mar por una boca de dos kilómetros de ancho ubicada en el noroccidente y se caracteriza por una elevada productividad y estabilidad ambiental (Garzón-Ferreira, 1989). La bahía se encuentra rodeada en su mayoría por manglares, presenta en su interior 1320 hectáreas de pastos marinos, desde la orilla hasta los cinco metros de profundidad, y formaciones coralinas a los costados occidental y sur de la bahía, entre los dos y cuatro metros de profundidad. Además, para ser un área relativamente pequeña, la bahía tiene una gran variedad de ambientes con aguas claras y turbias, costas rocosas, playas arenosas y fangosas, aguas tranquilas en algunas épocas del año y en determinados sectores, así como fuerte oleaje en diferentes lugares (Solano, 1994; Díaz et al., 2000, 2003).
Los factores ambientales son relativamente estables en bahía Portete, con temperaturas que oscilan entre 24 y 29 °C, y salinidades entre 34 y 37. El agua presenta alta turbidez causada por la resuspensión de sedimentos debido a la acción del viento, con ámbito promedio de visibilidad de uno a cuatro metros. El 70 % del fondo de la bahía está compuesto por lodo, fango, limo o arenas muy finas con arcilla, especialmente en las zonas más profundas. Los fondos de arenas finas a gruesas están distribuidos en profundidades menores a los seis metros, asociados a praderas de pastos y a formaciones coralinas. La máxima profundidad de la bahía es de 20 m; casi el 60 % del área presenta una profundidad menor a los nueve metros (Garzón-Ferreira, 1989; INVEMAR, 1992).
MATERIALES Y MÉTODOS
Sistema de cultivo
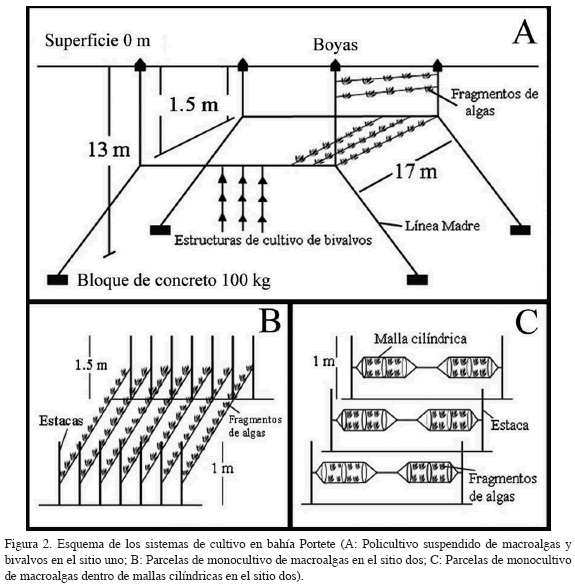
Los sistemas de cultivo se instalaron en el costado noroccidental de la bahía, en los sitios denominados uno y dos (Figura 1). En el sitio uno (12° 12' 49'' N y 71° 58' 34'' W) se ubicó un policultivo de macroalgas y bivalvos, para lo cual se extendieron cuerdas de polipropileno de 17 m de largo y 3 mm de diámetro, amarradas en las líneas madre del cultivo de bivalvos y suspendidas a profundidades entre 0.2 m y 1.5 m (Figura 2A). El sitio dos (12° 13' 06'' N y 71° 58' 45' W) se situó adyacente a la costa, sobre praderas de pastos marinos y macroalgas, donde se instalaron módulos de cultivo con cuerdas de polipropileno de cinco metros de largo suspendidas a 0.8 m de profundidad, amarradas entre estacas de madera (Figura 2 B), las cuales fueron enterradas a 1.0 m y 1.5 m (Bula-Meyer, 1988; Anderson et al., 1997; McHugh, 2003).
Se recolectó una biomasa total de 114 kg de las macroalgas rojas G. cervicornis, H. cornea, H. musciformis y Grateloupia sp., cada tres semanas, desde julio de 2005 hasta junio de 2006, provenientes de la zona submareal del sector noroccidental de la bahía. Las algas se lavaron con agua de mar, se limpiaron suavemente y se les evaluó el estado sanitario. Las algas jóvenes, sin partes blanquecinas y alteraciones de la pigmentación, se insertaron entre las cuerdas de polipropileno y se amarraron con nylon, en fragmentos con pesos entre 5 y 50 g, separados cada 20 cm a lo largo de la cuerda. Entre cada siembra, se realizaron actividades de mantenimiento y limpieza tanto de las algas como de las cuerdas, e igualmente se repuso el material perdido con nuevas algas recolectadas para este fin. Con las macroalgas G. cervicornis, H. musciformis y Grateloupia sp. se implementaron nuevas técnicas de cultivo en el sitio dos, atándolas dentro de mallas cilíndricas con el fin de darles mayor estabilidad (Figura 2 C).
Se extrajeron las líneas de cultivo cada 20 a 35 días, con el fin de hacer un seguimiento de las algas sembradas y obtener la tasa de crecimiento relativo (TCR),
la cual se expresó como porcentaje de crecimiento diario y se derivó de la fórmula de interés compuesto, propuesta por diferentes autores (Areces, 1995; Anderson et al., 1997; Marinho-Soriano et al., 2002) donde:
TCR = [(Pf/Pi)1/t - 1] x 100,
(Pf) peso final dividido por el (Pi) peso inicial,
(t) intervalo de tiempo transcurrido entre ambas observaciones.
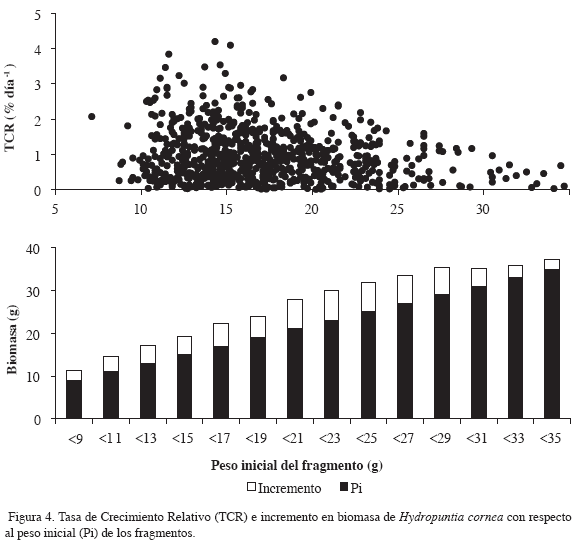
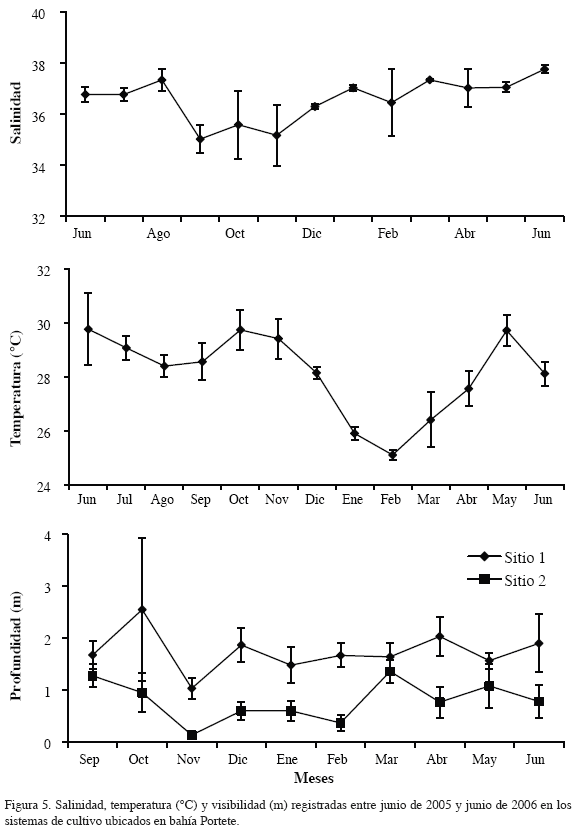
Durante el estudio se evaluó el efecto del peso inicial del fragmento (5 a 50 g) sobre la TCR y el incremento de biomasa o producción neta (% de peso ganado). Asimismo, se estimó el porcentaje de pérdida y crecimiento de los fragmentos sobre los sistemas de cultivo. La temperatura y salinidad fueron medidas con un conductímetro ATC con precisión de ± 1 % en la superficie del agua, durante diez días del mes en el sector de estudio e igualmente se midió la transparencia del agua con un disco Secchi en los sistemas de cultivo.
Análisis de la información
Los valores de TCR obtenidos no cumplieron los supuestos de normalidad y homogeneidad de varianza, por lo que se realizaron análisis no paramétricos con la prueba de Kruskal-Wallis, con el fin de determinar diferencias significativas en la TCR entre los dos sitios, los meses de estudio, las diferentes especies y el peso de los fragmentos, como también para cada parámetro ambiental en el tiempo. Con la misma prueba se determinaron diferencias en el incremento de biomasa dependiendo del tamaño del fragmento sembrado. Por otra parte, las proporciones de pérdida y crecimiento de los fragmentos se evaluaron con tablas de contingencia para conocer su dependencia en el tiempo y se utilizó el coeficiente de correlación por rangos de Spearman para conocer la relación entre la TCR con los parámetros ambientales (Zar, 1996). Todos estos análisis se realizaron con el software Statgraphics 4.0®.
RESULTADOS
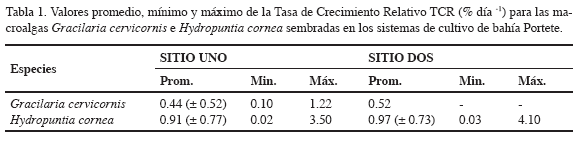
La TCR de G. cervicornis presentó promedio de 0.44 % día-1 (± 0.52) en el sitio uno y 0.52 % día-1 para dos fragmentos que crecieron en el sitio dos (Tabla 1). El porcentaje de pérdida de esta especie fue 97 % y 98.9 % para el sitio uno y dos respectivamente entre julio y octubre, por lo que se suspendió su siembra el resto del estudio debido a su fragilidad y poca permanencia en los sistemas de cultivo. De igual forma, H. musciformis y Grateloupia sp. no se ajustaron a los sistemas de cultivo, por lo que no se obtuvieron datos de crecimiento para estas especies.
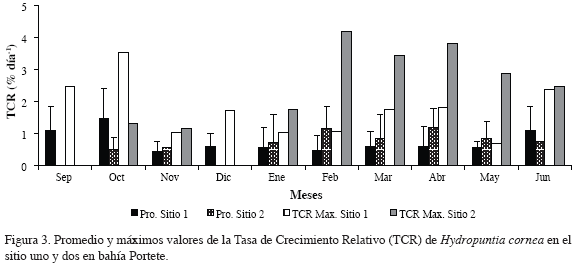
La macroalga H. cornea presentó un promedio de TCR de 0.91 % día-1 (± 0.77) en el sitio uno, con el mayor valor registrado en octubre de 2005. En el sitio dos, la TCR tuvo un promedio de 0.97 % día-1 (± 0.73) con el mayor crecimiento registrado para febrero de 2006 con un valor de 4.1 % día-1 (Tabla 1; Figura 3). Esta especie registró un porcentaje de pérdida de 85 % y 76 % en el sitio uno y dos respectivamente.
La prueba de Kruskal-Wallis reveló que no hubo diferencias significativas de la TCR entre los dos sitios de cultivo, aunque se percibió alta variación de este parámetro durante los meses de estudio en los dos lugares (p<0.01). De igual forma, se encontraron diferencias significativas en la TCR y en el aumento de biomasa dependiendo del tamaño de los fragmentos sembrados (p<0.01). Los fragmentos con menor peso presentaron altas TCR, los de peso intermedio mayor incremento de biomasa (Figura 4) y los de mayor peso tuvieron altas tasas de pérdida. El análisis de las proporciones de pérdida y crecimiento mostró que existe una asociación de estos parámetros con relación a la época del año (p<0.01).
La temperatura del agua durante el tiempo de estudio tuvo un ámbito de 25 a 31.9 °C con un promedio de 28.1 °C (± 1.66), mientras que la salinidad varió de 33.9 a 38 con un valor medio de 36.5 (± 1.10) (Figura 5). La transparencia del agua en el sitio uno varió de 0.8 a 4.5 m y en el sitio dos de 0.1 a 1.5 m, con promedios respectivos de 1.76 m (± 0.59) y 0.83 m (± 0.42) (Figura 5). La temperatura y la salinidad en los dos sitios y la transparencia en el sitio dos, presentaron una variación altamente significativa (p<0.01) en el tiempo de estudio. Por otro lado, el coeficiente de Spearman no mostró correlación de la TCR con los factores ambientales determinados en el estudio (p<0.05).Entre tanto, diferentes organismos crecieron como epífitos sobre los fragmentos de las algas y los sistemas de cultivo, observándose una mayor abundancia de los mismos sobre G. cervicornis en comparación con H. cornea. De agosto a noviembre de 2005 (época lluviosa), se encontraron adheridas a los fragmentos, algas filamentosas y de los géneros Dyctiota y Laurencia, hidroides, ascidias, poliquetos tubícolas, cirripedios de la especie Balanus trigonus, briozoarios del género Biflustra, bivalvos del género Electroma y lapas de la familia Fissurellidae. Los fragmentos fueron hospederos de pequeños camarones, anfípodos y poliquetos. Entre diciembre de 2005 y junio de 2006 se percibió una reducción de los epífitos, notándose únicamente la presencia del alga parda Feldmannia sp., el alga roja Jania sp. y el bivalvo Pteria colymbus. Además, asociadas a los sistemas de cultivo se encontraron las algas H. musciformis, G. cervicornis, Soliera sp. y Sargassum sp., al igual que los peces Sparisoma rubripinne, Gerres cinereus, Archosargus rhomboidalis, Acanthurus chirurgus y diferentes especies de la familia Haemulidae y Lutjanidae, algunas de las cuales se observaron alimentándose de los fragmentos de las algas sembrados.
DISCUSIÓN
El cultivo de macroalgas rojas en bahía Portete presentó diferentes patrones dependiendo de las especies y la incidencia de los factores ambientales en la época del año. Hypnea musciformis y Grateloupia sp. no se ajustaron a los sistemas de cultivo probablemente por ser plantas frágiles, que no resistieron el impacto del movimiento del agua y la corriente, lo cual quizá causó el desprendimiento de las mismas, puesto que estas macroalgas toleran amplios ámbitos de otros factores como temperatura, salinidad e irradiación (Bula-Meyer, 1989a; Ganesan et al., 2006).
De otra parte, aunque no fue posible hacer un análisis estadístico para comparar la TCR entre las especies G. cervicornis e H. cornea debido a la falta de datos, se percibieron claras diferencias de esta variable y en el porcentaje de pérdida y ganancia. Entre estas dos macroalgas G. cervicornis es la más delicada, finamente ramificada, frágil y muy vulnerable al epifitismo, lo que debilitó los implantes, no permitió su crecimiento y causó su desprendimiento de las cuerdas, además de las pérdidas ocasionadas por el fuerte movimiento del agua, y por las actividades de limpieza y mantenimiento, haciéndola una especie difícil de adaptar a las técnicas de cultivo, comportamiento similar a lo observado para especies del género en el Caribe y Brasil con morfologías similares (Smith et al., 1984; Smith, 1998; Marinho-Soriano et al., 2002). Por esta razón, el promedio y los ámbitos de TCR para esta especie fueron inferiores a los registros hechos para Gracilaria por Rincones (1990) en Venezuela, Robledo (1999) en la península de Yucatán y Delgadillo et al. (2005) en Santa Marta, quienes encontraron tasas superiores a 2.5 % día-1. De igual forma, los experimentos efectuados a profundidades menores de 0.5 m no tuvieron resultados satisfactorios debido a la decoloración de las macroalgas por la fuerte irradiación, descartando la posibilidad de realizar cultivos suspendidos superficiales en esta zona, contrastando con los trabajos realizados en otras partes del mundo (Anderson et al, 1997; Da Costa, 2001; McHugh, 2003).
La especie H. cornea presentó mejores TCR que G. cervicornis debido a que su morfología y manejo fueron adaptables a las condiciones de la bahía y los sistemas de cultivo. Los mayores valores de TCR para esta especie estuvieron por encima de los registrados en Santa Marta (Bula-Meyer, 1989a; Delgadillo et al, 2005), Venezuela (Rincones, 1990) y México (Robledo, 1999), y menores a los observados en Brasil por Da Costa (2001), donde la mayor TCR fue de 6.0 % día-1. Sin embargo, el promedio de TCR fue bajo debido a la alta variabilidad en la permanencia de los implantes, pérdidas por el mantenimiento (limpieza de fragmentos sembrados y sistemas de cultivo), y probablemente por la incidencia de factores ambientales y biológicos que claramente en otras investigaciones han afectado la productividad en los cultivos (Santelices y Doty, 1989; Robledo, 1999; McHugh, 2003).
Los valores similares de TCR en los dos sitios de estudio, corroborado con la prueba de Kruskal-Wallis, sugirió que el crecimiento de H. cornea en los sistemas de cultivo probablemente respondió a una incidencia simultánea de la dinámica de los factores ambientales (temperatura, salinidad, visibilidad, movimiento del agua, corrientes, irradiación, nutrientes y sedimentación) y biológicos sobre las algas. Entre tanto, la alta variación en el tiempo de la TCR demostró el efecto estacional de los factores ambientales, los cuales presentaron igualmente claras diferencias en los meses de estudio, a pesar de no ser evidente una correlación entre éstos y el crecimiento, debido a que las algas tienen alta tolerancia a los factores ambientales, como se ha observado en otros cultivos y experimentos (Dawes et al., 1999; Glenn et al., 1999; Yokoya et al., 1999; Marinho-Soriano et al., 2002). Sin embargo, es probable que exista una correspondencia entre el aumento de la TCR con la disminución de la temperatura e incremento en la concentración de nutrientes causado por el evento de surgencia, así como a un aumento en los niveles de irradiación, puesto que en la época seca del año los ámbitos de crecimiento de las algas alcanzaron los valores más altos de todo el estudio; estos factores tienen una fuerte incidencia en la productividad de los cultivos, como han señalado Capo et al. (1999), Robledo (1999) y Santelices (1999). Además, es posible que la reducción en la carga de epífitos en esta época haya facilitado la absorción de luz y nutrientes por parte de las algas, mejorando así las TCR.
Entre los factores ambientales, el movimiento del agua es reconocido por ejercer efectos negativos en el rendimiento de los cultivos, debido a su impacto directo sobre los fragmentos y los sistemas, afectando la permanencia y crecimiento de las algas, lo cual fue evidente en esta investigación, así como su efecto en la remoción de sedimentos, resuspensión de los mismos, niveles de irradiación y compensación por nutrientes (Santelices, 1999; Muñoz et al., 2004; Ryder et al., 2004; Thomsen, 2004). Además, la mayoría de cultivos de algas se realizan en lagunas arrecifales o lugares con movimiento moderado del agua, lo cual contribuye al proceso de autolimpieza de las algas, y si el lugar tiene un buen sistema de corrientes, ayuda a compensar la carga de nutrientes. Por otra parte, no es común que los cultivos se realicen en sectores con oleaje intenso, como fue observado en bahía Portete en la mayor parte del año y en algunos sectores (Areces, 1995; Navarro-Angulo y Robledo, 1999; McHugh, 2003). El efecto del tamaño de los fragmentos sembrados en los valores de TCR y en el aumento de biomasa, contrastó con lo registrado por Muñoz et al. (2004), para Kappaphycus alvarezii, y Smith y Bolton (1999), para otras especies de Gracilaria, en donde los fragmentos de mayor peso y tamaño presentaron altas TCR y mayor biomasa, lo cual no fue así en este estudio, probablemente porque los fragmentos de mayor tamaño fueron más susceptibles a pérdidas por el movimiento del agua, actividades de mantenimiento e impacto de los herbívoros.
La incidencia del epifitismo observada en esta investigación fue similar a lo citado por otros autores en cuanto al tipo de organismos, aunque su incidencia fue relativamente baja, puesto que en otras regiones la biomasa de los epífitos ha destruido completamente los cultivos o reducido drásticamente la producción (Bula-Meyer, 1989a; Anderson et al., 1997; Robledo, 1999). Igualmente, es probable que la ocurrencia de epífitos haya causado reducciones de biomasa en este estudio, por efectos sobre la salud de las algas, debilitándolas y causando su ruptura, así como reducciones en la TCR por recubrimiento de la superficie de los fragmentos, impidiendo la absorción de luz y nutrientes. También se ha registrado que los epífitos tienen un efecto indirecto en la atracción de herbívoros (Kuschel y Buschmann, 1991; Critchley et al., 2004). Entre tanto, el grado de epifitismo tiene relación con el mantenimiento que se haga de los fragmentos y sistemas de cultivo, el cual no se logró realizar con mayor frecuencia por parte de los auxiliares Wayuú que cumplían esta tarea, por lo que es difícil tener certeza de su influencia en la productividad del cultivo. No obstante, se ha observado que la especie H. cornea evita el epifitismo y presenta bajos niveles de los mismos, debido a la producción de sustancias alelopáticas (Dawes et al., 2000).
Los peces herbívoros también se han documentado como un problema en cultivos de algas (Smith, 1998; McHugh, 2003), ya que acantúridos, scáridos y la especie Archosargus rhomboidalis, registrada en la península de Yucatán por Robledo (1999), al parecer tuvieron fuerte influencia sobre las TCR en el cultivo, a juzgar por su presencia y ramoneo sobre los fragmentos de las algas. En vista de la asociación encontrada de las proporciones de pérdida y crecimiento de los fragmentos con relación a la temporada de estudio, se corroboró la posible incidencia de la variabilidad de los factores ambientales (temperatura, salinidad, nutrientes, sedimentación, entre otros) y biológicos (herbivoría, epifitismo), al igual que de sus interacciones ecológicas, en el crecimiento de las algas, preponderante en el desarrollo de los cultivos. De esta forma, es necesario hacer una completa caracterización de los factores ambientales, pues en esta investigación algunos de gran importancia no fueron medidos, como la irradiación y los nutrientes, los cuales tienen un fuerte impacto en la regulación del crecimiento de las algas y junto al movimiento del agua y la temperatura, crean complejas interacciones que determinan la fertilidad de un sitio para el éxito de las actividades productivas (Areces, 1995; Calumpong et al., 1999; Santelices, 1999).
Por lo demás, aunque muchas han sido las iniciativas para realizar cultivos de algas, los casos exitosos no son comunes, a pesar del gran potencial que existe en América Latina y el Caribe, debido principalmente a las bajas TCR de la mayoría de las especies y por la complejidad de las interacciones biológicas y ecológicas en esta zona tropical. Es por eso que en Brasil, México, Cuba y Venezuela se han iniciado planes de introducción de la especie Kappaphycus alvarezii la cual tiene excelentes perspectivas para cultivos comerciales en la franja tropical, pero ante todo bajo claros y rigurosos protocolos para su introducción y evaluación de impacto ambiental (Smith, 1998; Rincones y Rubio, 1999; Muñoz et al., 2004; Santelices, 2005).
En suma, el cultivo de macroalgas en bahía Portete establece las bases para iniciar la investigación sobre este campo en Colombia, la cual requiere un estudio prolongado de las áreas con potencial para el cultivo, la biología de las especies, su ecología y la química de los compuestos de interés farmacológico e industrial. Los cultivos piloto deben estar acompañados por una completa caracterización de los parámetros ambientales y biológicos, además de la implementación de nuevas técnicas, rutinas y experimentos tendientes a aislar la incidencia de los diferentes factores, con el fin de encontrar interacciones positivas que conlleven a una producción efectiva y así establecer con un mayor grado de certeza, la factibilidad de implementarlo a escala comercial en pro del desarrollo de las comunidades costeras.
AGRADECIMIENTOS
Esta investigación se enmarcó dentro del proyecto "Caracterización de la zona costera del departamento de La Guajira: una aproximación para su manejo integrado", posible gracias al apoyo financiero y logístico de la Corporación Autónoma Regional de La Guajira (CORPOGUAJIRA) y el Instituto de Investigaciones Marinas y Costeras (INVEMAR). Agradecemos al personal de Carbones del Cerrejón en Puerto Bolívar, Eliécer Ávila, Lina Báez y los operarios que colaboraron en la logística para las actividades de campo. Especial reconocimiento a la comunidad Wayuú de Malla Sur y Malla Norte, Sector de Media Luna, bahía Portete. Olga Lucía Lara y Claudia Castellanos por su colaboración para la consecución de este proyecto. Agradecemos a Martha Díaz-Ruiz por sus comentarios al documento.
BIBLIOGRAFÍA
1 Aguilera, M. 1998. Los cultivos de camarones en la costa Caribe colombiana. Serie Documentos de Trabajo sobre Economía Regional No. 2. Centro de Investigaciones Económicas del Caribe colombiano. Banco de la República, Cartagena. 57 p. [ Links ]
2 Álvarez-León, R., J. Aguilera-Quiñonez, C. Andrade-Amaya y P. Nowak. 1995. Caracterización general de la zona de surgencia de La Guajira colombiana. Rev. Acad. Colomb. Cienc., 19 (75): 679-694. [ Links ]
3 Anderson R.J., G.J. Levitt y A. Share. 1997. Experimental investigations for the mariculture of Gracilaria in Saldanha Bay, South Africa. J. Appl. Phycol., 8: 421-430. [ Links ]
4 Areces, J.A. 1995. Cultivo comercial de carragenófitas del género Kappaphycus Doty. 529-550. En: Alveal, K., M.E. Ferrario, E.C. Oliveira y E. Sar (Eds.). Manual de métodos ficológicos. Universidad de Concepción, Concepción, Chile. [ Links ]
5 Beltrán, C.S. y A.A. Villaneda. 2000. Perfil de la pesca y la acuicultura en Colombia. Instituto Nacional de Pesca y Acuicultura, Bogotá. 29 p. [ Links ]
6 Borrero, F., J.M. Díaz y A. Seczon. 1996. Las ostras perlíferas (Bivalvia: Pteriidae) en el Caribe colombiano. Historia de explotación, ecología y perspectivas para su aprovechamiento. INVEMAR, Serie Publicaciones Especiales No. 1, Santa Marta. 53 p. [ Links ]
7 Botero-Arango, J. y F. Castaño-Rivera. 2005. Inducción de la madurez gonadal del pargo palmero Lutjanus analis (Pices: Lutjanidae) mediante la aplicación de un fotoperiodo artificial de acondicionamiento. Bol. Invest. Mar. Cost., 34: 69-79. [ Links ]
8 Bula-Meyer, G. 1985. Un nuevo núcleo de surgencia en el Caribe colombiano detectado en correlación con las macroalgas. Boletín Ecotrópica, 12: 3-25. [ Links ]
9 Bula-Meyer, G. 1988. Cultivo y utilización comerciales de las algas marinas. Revista Ingeniería Pesquera, 6 (1-2): 6-54. [ Links ]
10 Bula-Meyer, G. 1989a. Experimental culture in the sea of the red macroalgae Grateloupia filicina. 101-104. En: Oliveira, E.C. y N. Kautsky (Eds.). Workshop: Cultivation of Seaweeds in Latin America. Sn. Sebastiao, Brasil. [ Links ]
11 Bula-Meyer, G. 1989b. Las macroalgas bénticas marinas como recurso potencial económico en Colombia. Rev. Acad. Colomb. Cienc., 17 (65): 383-387. [ Links ]
12 Bula-Meyer, G. 1991. Micro y macroalgas marinas alelopáticas. Revista Ingeniería Pesquera, 19 (1-2): 1-110. [ Links ]
13 Bula-Meyer, G. 1995. Macroalgas de la isla Gorgona (Pacíico colombiano) con nuevos registros y una explicación de la baja diversidad y biomasa. 23-45. La Isla de Gorgona. Nuevos estudios biológicos. Biblioteca José Jerónimo Triana No. 11. Universidad Nacional de Colombia, Bogotá. [ Links ]
14 Bula-Meyer, G. 2001. Ecología de las macroalgas del plano arenoso contiguo al talud de los sistemas coralinos con énfasis en el Caribe. Rev. Acad. Colomb. Cienc., 25 (97): 495-507. [ Links ]
15 Bula-Meyer, G. y Díaz-Pulido. 1995. Macroalgas del banco de las Ánimas y nuevos registros para el Caribe colombiano. Bol. Invest. Mar. Cost., 29: 3-26. [ Links ]
16 Cabezas, H., C. Vargas y J. Morales. 1975. Determinación del contenido de aminoácidos y evaluación in vitro de la cantidad de proteína de algunas especies de algas marinas pertenecientes a la costa Guajira colombiana. Tesis Biol., Universidad Nacional de Colombia. 126 p. [ Links ]
17 Calumpong, H., A. Maypa, M. Magbanua y P. Suárez. 1999. Biomass and agar assessment of three species of Gracilaria from Negros Island, central Philippines. Hydrobiologia, 398/399: 173-182. [ Links ]
18 Capo, T.R., J.C. Jaramillo, A.E. Boyd, B.E. Lapointe y J.E. Serafy. 1999. Sustained high yields of Gracilaria (Rhodophyta) grown in intensive large-scale culture. J. Appl. Phycol., 11: 143-147. [ Links ]
19 Castellanos, C., O. Delgadillo, O. Lara y F. Newmark. 2005. Desarrollo de un policultivo piloto de macroalgas-bivalvos como una alternativa productiva para las comunidades costeras del departamento de La Guajira, Caribe colombiano. 302-305. En: INVEMAR, Informe del Estado de los Ambientes Marinos y Costeros en Colombia, Serie de Publicaciones Periódicas No. 8, Santa Marta. 360 p. [ Links ]
20 CENIACUA. 2006. Centro de investigación de la acuicultura de Colombia. Programas de Investigación. Diversificación. http://www.ceniacua.org/articulo.html?modulo=programas& articulo_id=43. 10/2007. [ Links ]
21 Critchley, A.T., D. Largo, W. Wee, G. Bleicher L'Honneur, A.Q. Hurtado y J. Schubert. 2004. A preliminary summary on Kappaphycus farming and the impact of epiphytes. Jap. J. Phycol., 52: 231-232. [ Links ]
22 Da Costa, M. 2001. Cultivo de algas marinhas integrado ao cultivo de camaroes marinhos em gaiolas flutuantes no Baixo sul Baiano. http://web.uvic.ca/bmlp/port-news/port news32.html. 08/2006. [ Links ]
23 Dawes, C.J., J. Orduña-Rojas y D. Robledo. 1999. Response of the tropical red seaweed Gracilaria cornea to temperature, salinity and irradiance. J. Appl. Phycol., 10: 419-425. [ Links ]
24 Dawes, C., B. Teasdale y M. Friedlander. 2000. Cell wall structure of the agarophytes Gracilaria tikvahiae and Gracilaria cornea (Rhodophyta) and penetration by the epiphyte Ulva lactuca (Chlorophyta). J. Appl. Phycol., 12: 567-575. [ Links ]
25 Delgadillo, O. y O. Lara. 2006. Transferencia tecnológica para desarrollar actividades de maricultura con una comunidad Wayuú, en Bahía Portete, La Guajira. Memorias III Congreso Colombiano Acuicultura, Santa Marta. 156 p. [ Links ]
26 Delgadillo, O., M. Díaz-Ruíz y O. Lara. 2005. Experimentos preliminares en Santa Marta para integrar a las macroalgas Gracilaria dentro de un policultivo en la Guajira, Caribe colombiano. Resúmenes VII Congreso Ficología Latinoamérica y Caribe, V Reunión Iberoamericana de Ficología, La Habana. 56 p. [ Links ]
27 Díaz, J.M., L. Barrios, M. Cendales, J. Garzón-Ferreira, J. Geister, M. López, G. Ospina, F. Parra-Velandia, J. Pinzón, A. Vargas, F. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. INVEMAR, Serie de Publicaciones Especiales No. 5, Santa Marta. 176 p. [ Links ]
28 Díaz, J.M., D. Gómez-López, L. Barrios y P. Montoya. 2003. Composición y distribución de las praderas de pastos marinos en Colombia: 25-65. En: Díaz, J.M., L. Barrios y D. Gómez-López. (Eds.). Las praderas de pastos marinos en Colombia: estructura y distribución de un ecosistema estratégico. INVEMAR, Serie de Publicaciones Especiales No. 10, Santa Marta. [ Links ]
29 Díaz-Pulido, G. 2000. Vegetación marina de un sector de la plataforma continental de La Guajira (Caribe Colombiano). Bol. Invest. Mar. Cost., 29: 27-34. [ Links ]
30 Díaz-Pulido, G. y M. Díaz-Ruiz. 2003. Diversity of benthic marine algae of the Colombian Atlantic. Biota Col., 4 (2): 203-246. [ Links ]
31 Díaz-Ruiz, M., G. Bula-Meyer, S. Zea y A. Martínez. 2006. Ensayos de actividad biológica y ecología química de extractos orgánicos de macroalgas del Caribe colombiano. Bol. Invest. Mar. Cost., 35: 241-247. [ Links ]
32 FAO. 2004. El estado mundial de la pesca y la acuicultura. Departamento de pesca de la FAO. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma. 168 p. [ Links ]
33 Freile-Pelegrín, Y., D. Robledo, M. Pedersen, E. Bruno y J. Rónnqvist. 2002. Efecto del tratamiento de oscuridad y salinidad en el rendimiento y calidad del agar de Gracilaria cornea (Rhodophyceae). Cienc. Mar., 28 (3): 289-296. [ Links ]
34 Ganesan, M., S. Thiruppathi y B. Jha. 2006. Mariculture of Hypnea musciformis (Wulfen) Lamouroux in South east coast of India. Aquaculture, 256: 201-211. [ Links ]
35 García, C. y G. Díaz-Pulido. 2006. Dynamics of a macroalgal rocky intertidal community in the Colombian Caribbean. Bol. Invest. Mar. Cost., 35: 7-18. [ Links ]
36 Garzón-Ferreira, J. 1989. Contribución al conocimiento de la ictiofauna de bahía Portete, departamento de La Guajira, Colombia. Trianea, 3: 149-172. [ Links ]
37 Gautier, D., J. Amador y F. Newmark. 2001. The use of mangrove wetland as a bioilter to treat shrimp pond effluents: preliminary results of an experiment on the Caribbean coast of Colombia. Aquac. Res., 32: 787-799. [ Links ]
38 Glenn, E. P., D. Moore, M. Akutagawa, A. Himler, T. Walsh y S. G. Nelson. 1999. Correlation between Gracilaria parvispora (Rhodophyta) biomass production and water quality factors on a tropical reef in Hawaii. Aquaculture, 178: 323-331. [ Links ]
39 Guerra, W. 1990. Apalaanchi: una visión de la pesca entre los Wayuú. 163-190. En: Ardila, G. (Ed.) La Guajira. De la memoria al porvenir una visión antropológica. Centro Editorial Fondo FEN Colombia, Universidad Nacional de Colombia, Bogotá. [ Links ]
40 INVEMAR. 1992. Descripción inicial de unidades de monitoreo de ecosistemas marinos en la bahía Portete. Determinación del área de influencia de Puerto Bolívar afuera de la bahía Portete. Informe final, Inst. Invest. Mar. Cost., Santa Marta. 67 p. [ Links ]
41 Jaimes, J., Y. Pinzón y C. Trujillo. 2004. Explorando alternativas de pesca responsable con la langosta espinosa en Santa Marta. Fundación Sila Kangama, Santa Marta. 80 p. [ Links ]
42 Kuschel, F. A. y Buschmann A. H. 1991. Abundance, effects and management of epiphytism in intertidal cultures of Gracilaria (Rhodophyta) in southern Chile. Aquaculture, 92: 7-19. [ Links ]
43 Marinho-Soriano, E., T. Silva y W. S. Moreira. 2001. Seasonal variation in the biomass and agar yield from Gracilaria cervicornis and Hydropuntia cornea from Brazil. Biores. Tech., 77 (2): 115-120. [ Links ]
44 Marinho-Soriano, E., C. Morales y W. Moreira. 2002. Cultivation of Gracilaria (Rhodophyta) in shrimp ponds effluents in Brazil. Aquac. Res., 33: 1081-1086. [ Links ]
45 McHugh, D. 2003. A guide to the seaweed industry. FAO Fisheries Technical Paper. No. 441. Roma, 105 p. [ Links ]
46 Mejía-Niño, N. y J. Garzón-Ferreira. 2003. Dinámica de las interacciones alga-coral en dos bahías de la región de Santa Marta (Caribe Colombiano) con distinto grado de influencia antropogénica. Bol. Invest. Mar. Cost., 32: 243-261. [ Links ]
47 Montano, J. 2006. Ensayos de cultivo en medio natural de la macroalga Hypnea musciformis (Wulfen) Lamoroux en las áreas de Taganga y Puerto Luz (Santa Marta). Tesis Biol. Mar., Universidad de Bogotá Jorge Tadeo Lozano, Bogotá. 75 p. [ Links ]
48 Muñoz, J., Y. Freile-Pelegrín y D. Robledo. 2004. Mariculture of Kappaphycus alvarezii (Rhodophyta, Solieriaceae) color strains in tropical waters of Yucatán, México. Aquaculture, 239: 161-177. [ Links ]
49 Navarro-Angulo, L. y D. Robledo. 1999. Effects of nitrogen source, N:P ratio and N-Pulse concentration frequency on the growth of Gracilaria cornea (Gracilariales, Rhodophyta) in culture. Hydrobiologia, 398/399: 315-320. [ Links ]
50 Newmark, F. y A. Vallejo. 1995. Principales enfermedades de peneidos en cultivo: 105-151. En: Rodríguez, H., G. Polo y O. Mora (Eds.). INPA, Fundamentos de acuicultura marina, Santafé de Bogotá. 225 p. [ Links ]
51 Rincones, R. 1990. Experimental cultivation of an agarophyte, Gracilaria cornea in the northwest coast of Venezuela. 65-67. En: Oliveira E. y V. Kautsky (Eds.). Proceedings of a Workshop "Cultivation of Seaweeds in Latin America", International Foundation for Science, University of Sao Paulo, Brasil. [ Links ]
52 Rincones R. y H. Gallo. 2004. Proyecto Jimoula. El cultivo de algas marinas como una alternativa sustentable para las comunidades costeras de la península de la Guajira. Resumen ejecutivo, Biotecnología y acuicultura, BIOTACOL Ltda., Riohacha. 11 p. [ Links ]
53 Rincones, R. y R. Rubio. 1999. Introduction and commercial cultivation of the red alga Eucheuma in Venezuela for the production of phycocolloids. World Aquaculture Magazine, 30: 57-61. [ Links ]
54 Rivera-Monroy, V., L. Torres, N. Bahamón, F. Newmark y R. Twilley. 1999. The potential use of mangrove forests as nitrogen sink of shrimp aquaculture pond effluents: The role of denitrification. J. World Aquacult. Soc., 30 (1): 12-25. [ Links ]
55 Robledo, D. 1999. Agronomía marina: una alternativa para el desarrollo de las comunidades pesqueras de Dzilam de Bravo, Yucatán. Instituto Politécnico Nacional, Centro de Investigación y de Estudios Avanzados Mérida, Departamentos de Recursos del Mar, Laboratorio de Ficología, Informe Final, Mérida, México. 49 p. [ Links ]
56 Rueda-Almonacid, J., J. Mayorga y G. Ulloa. 1992. Observaciones sobre la captura comercial de tortugas marinas en la península de la Guajira, Colombia. Libro 4: 133-153. Contribución al conocimiento de las tortugas marinas de Colombia. Biblioteca Andrés Posada Arango. Serie de Publicaciones Especiales del Inderena. Instituto Nacional de los Recursos Naturales Renovables y del Ambiente, INDERENA, Bogotá. [ Links ]
57 Ryder, E., S. Nelson, C. McKeon, E. Glenn, K. Fitzsimmons y S. Napolean. 2004. Effect of water motion on the cultivation of the economic seaweed Gracilaria parvispora (Rhodophyta) on Molokai, Hawaii. Aquaculture, 238: 207-219. [ Links ]
58 Salazar, G. 2002. El cultivo de organismos acuáticos en pequeña escala en Colombia. Ministerio de Agricultura y Desarrollo Rural, Instituto Nacional de Pesca y Acuicultura, INPA, Bogotá. 31 p. [ Links ]
59 Santelices, B. 1999. A conceptual framework for marine agronomy. Hydrobiologia, 398/399: 15-23. [ Links ]
60 Santelices, B. 2005. Problemas y oportunidades para el cultivo de macroalgas en América Latina y el Caribe. Sesión oral 5. VII Congreso Ficología Latinoamérica y Caribe, V Reunión Iberoamericana Ficología. La Habana. p. 11. [ Links ]
61 Santelices, B. y M.S. Doty 1989. A review of Gracilaria farming. Aquaculture, 78: 95-133. [ Links ]
62 Santodomingo, N., A. Gracia, A. Rodríguez, C. Reyes, J. Reyes, J. C. Márquez, N. Cruz, D. Flórez, D. Báez, F. Cortés, G. Borrero y M. Díaz. 2005. Biodiversidad asociada a las plataformas de explotación de gas natural (Campo Chuchupa: La Guajira, Colombia). Informe Técnico, INVEMAR-ECOPETROL S.A., Santa Marta. 225 p. [ Links ]
63 Smith, A. H., K. Nichols y J. MacLachlan. 1984. Cultivation of seamoss Gracilaria in St. Lucia, West Indies. Hydrobiologia, 116-117: 249-251. [ Links ]
64 Smith, A. 1998. Seaweed resources of the Caribbean. Seaweed resources of the world: 324-330. Japan International Cooperation Agency, Yokosuka, Japón. [ Links ]
65 Smith, A. y J. Bolton. 1999. Organismic determinants and their effect on growth and regeneration in Gracilaria gracilis. J. Appl. Phycol., 11: 293-299. [ Links ]
66 Solano, O. 1994. Corales, formaciones arrecifales y blanqueamiento de 1987 en bahía Portete (Guajira, Colombia). An. Inst. Invest. Mar. Punta Betín, 23: 149-163. [ Links ]
67 Suárez, J., A. García, F. Newmark y R. Bador. 2001. Efecto de las condiciones de transporte, recepción, aclimatación y siembra de nauplios de Litopenaeus vannamei (Boone, 1931) sobre la sobrevivencia en larvicultura. Bol. Invest. Mar. Cost., 30: 3-18. [ Links ]
68 Thomsen, M. S. 2004. Species, thallus size and substrate determine macroalgal break force and break location in a low-energy soft-bottom lagoon. Aquat. Bot., 80: 153-161. [ Links ]
69 Trespalacios, A., R. Álvarez, M. Mercado, B. Quevedo y M. Huertas. 2004. Extracción de agar-agar a partir de algas rojas del Caribe colombiano. 31-32. III Congreso Colombiano de Botánica, Popayán. [ Links ]
70 Valero, A. y Y. Caballero. 2003. Guía práctica para el cultivo de bivalvos marinos del Caribe colombiano: madre perla, ostra alada, concha de nácar y ostiones. INVEMAR, Santa Marta. 43 p. [ Links ]
71 Vallejo, A. y F. Newmark. 1999. Estudio epizootiológico de Penaeus vannamei en tres fincas camaroneras del Caribe colombiano. Bol. Invest. Mar. Cost., 28: 19-42. [ Links ]
72 Velasco, L., J. Barros y E. Acosta. 2007. Spawning induction and early development of the Caribbean scallops Argopecten nucleus and Nodipecten nodosus. Aquaculture, 266 (1-4): 153-165. [ Links ]
73 Yokoya, N. S., H. Kakita, H. Obika y T. Kitamura. 1999. Effects of environmental factors and plant growth regulators on growth of the red alga Gracilaria vermiculophylla from Shikoku Island, Japan. Hydrobiologia, 398/399: 339-347. [ Links ]
74 Zar, H. 1996. Biostatistical analysis. Tercera edición, Prentice Hall, Upper Saddle River, EE. UU. 659 p. [ Links ]
FECHA DE RECEPCIÓN: 15/08/06 FECHA DE ACEPTACIÓN: 16/06/08