Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.37 no.2 Santa Marta July/Dec. 2008
DINÁMICA ESPACIAL Y TEMPORAL DE LA BIOMASA ALGAL ASOCIADA A LAS RAÍCES DE MANGLE EN LA BAHÍA DE BUENAVENTURA, COSTA PACÍFICA DE COLOMBIA.
SPATIAL AND TEMPORAL DYNAMICS OF ALGAL BIOMASS ASSOCIATED WITH MANGROVE ROOTS IN BUENAVENTURA BAY, PACIFIC COAST OF COLOMBIA.
Enrique Javier Peña-Salamanca
Universidad del Valle, Departamento de Biología, Calle 13 No 100-00 Cali, Colombia. Teléfono: 33393243. A.A. 25360. enripena@univalle.edu.co
RESUMEN
La variación espacial y temporal de la biomasa de especies de macroalgas asociadas al manglar que crecen en raíces de Rhizophora mangle y neumatóforos de Avicennia germinans en la bahía de Buenaventura, Colombia, fueron estudiadas en tres estaciones entre noviembre de 1999 y septiembre de 2003. Dieciocho especies fueron colectadas en todas las estaciones, las cuales incluyeron nueve Rhodophyceae, cinco Chlorophyceae y cuatro Cyanophyta (Cianobacterias). Cuatro especies (tres Rhodophyceae y una Ulvophyceae) dominaron la flora algal contribuyendo al 90 % de la biomasa total algal. Bostrychia calliptera fue la especie dominante con 32 % de la biomasa total, seguida por Boodleopsis verticillata (26 %), Catenella impúdica (18 %) y Caloglossa leprieurii (12 %). La biomasa total de las cuatro especies dominantes registró diferencias significativas entre los períodos climáticos del área de estudio (103.1 ± 25.9 g m-2 para el periodo de menos lluvias vs. 59.7 ± 12.5 g m-2 para el periodo lluvioso). La biomasa promedio por especie en la bocana del estuario fue significativamente más alta que en las áreas internas (promedio anual de 30.7 ± 10.8 vs. 13.8 ± 4.1 g m-2 respectivamente). Basados en la distribución vertical de la biomasa en la raíz, se detectó una zona superior estrecha y dominada por B. calliptera, una zona media amplia, con poblaciones mezcladas de C. impudica y B. calliptera, registrando valores anuales de biomasa total promedio de 86.8 ± 24.1 g m-2, y una zona baja desde la base de la raíz, dominada por C. leprieurii y B. verticillata. Los resultados indican que el nivel de inundación mareal y la distribución vertical en la raíz parecen ser los factores de mayor influencia en las variaciones de la biomasa algal.
PALABRAS CLAVE: Biomasa, Macroalgas, Bostrychia, Manglar, Distribución.
ABSTRACT
The spatial and temporal variation of biomass of mangrove-associated macroalgae growing on roots of Rhizophora mangle and pneumatophores of Avicennia. Germinans were studied at three sampling stations in Buenaventura bay, Colombia, between November 1999 and September 2003. Eighteen species of algae were collected including nine Rhodophyceae, five Chlorophyceae and four Cyanophyta (Cyanobacteria). Four species dominated the algal flora and collectively contributed with 90 % of the total algal biomass. Bostrychia calliptera was the most dominant with 32 % of the total biomass, followed by Boodleopsis verticillata (26 %), Catenella impudica (18 %), and Caloglossa leprieurii (12 %). Algal biomass between seasons showed significant differences, with higher biomass found during the dry season compared to those of the rainy season. The algal biomass at the mouth of the estuary was significantly higher than that found in the inner areas of the estuary (annual means of 30.7 ± 10.8 vs. 13.8 ± 4.1 g m-2 respectively).Three well-defined vertical zones were observed, based on algal biomass: A narrow upper zone, dominated by B. calliptera; a wide middle zone, with mixed populations of C. impudica and B. calliptera, registering annual mean of 86.8 ± 24.1 g m-2, and a bottom zone, dominated by C. leprieurii and B. verticillata. The results indicated that water level inundation and the vertical position along the roots seem to be the most important factors influencing the algal biomass.
KEY WORDS: Biomass, Macroalgae, Bostrychia, Mangrove, Distribution.
INTRODUCCIÓN
Los bosques de manglar son uno de los ecosistemas más importantes en el Pacífico colombiano, dominando las zonas costeras (Cantera, 1991; Peña, 1998; Cantera y Blanco, 2001). La comunidad de algas epífitas está dominada principalmente por algas rojas, de los géneros Bostrychia y Stictosifonia (Rodomelaceae, Ceramiales), Caloglossa (Delesseriaceae, Ceramiales) y Catenella (Caulacanthaceae, Gigartinales) (Schnetter y Bula, 1982; Peña et al., 1987; Peña y Palacios, 1988; Peña, 1998). Esta asociación de algas es llamada comúnmente como el complejo "Bostrichetum", que se refiere principalmente a la relación característica global de estos cuatro géneros (Post, 1936; De Oliveira, 1984; Dor, 1984; Tanaka y Chihara, 1987; Coppejans y Gallin, 1989; King y Puttock, 1994).
Estudios ecofisiológicos en algas epífitas del manglar han demostrado su amplio ámbito de tolerancia a fluctuaciones en factores como la salinidad, irradianza, temperatura, nutrientes y desecación debido a los ciclos de emersión-inmersión generados por la marea (West et al., 1993; Karsten et al., 1994; Moastert et al., 1995; Peña et al., 1999; Zucarello y Yeates, 2001). El resultado de este ambiente fluctuante puede influir en la dinámica de la biomasa y de sus patrones de distribución (Phillips et al., 1994; Broderick y Dawes, 1998; Melville et al., 2005).
La importancia ecológica de estas comunidades de algas epífitas radica en el aporte de su biomasa en la producción de carbono del ecosistema (Laursen y King, 2000). La mayoría de los estudios sobre el complejo Bostrychetum han sido realizados en manglares de las zonas subtropicales, pero relativamente poca atención se ha dedicado a esta asociación en las áreas tropicales (Burkholder y Almodóvar, 1973; Rodríguez y Stoner, 1990; Dawes, 1996). El objetivo de este estudio fue cuantificar la biomasa de una comunidad de macroalgas epífitas asociada a las raíces del mangle en la bahía de Buenaventura, y observar su dinámica estacional y espacial en el estuario.
ÁREA DE ESTUDIO
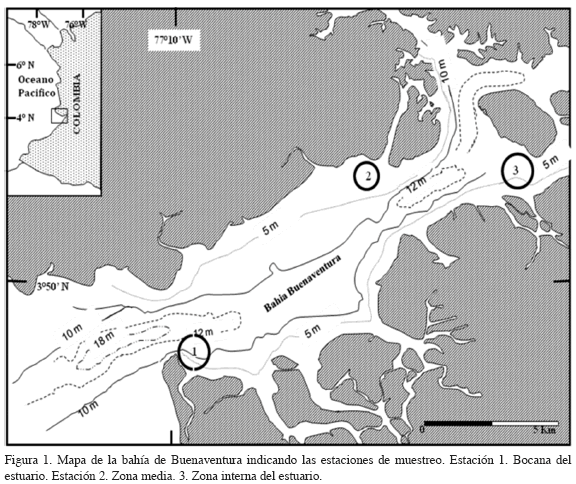
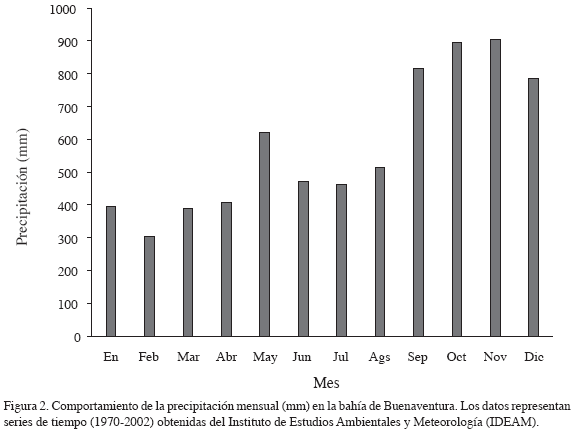
La bahía de Buenaventura (3°54' N, y 77°05' W) está localizada en la costa Pacífica de Colombia. Es un estuario poco profundo con un área de 70 km2, con un canal central de 16 km, un ancho promedio de 4 km y una profundidad promedio de 10 m (Figura 1). La boca de la bahía se conecta directamente con el océano Pacífico. El estuario se caracteriza por tener un clima tropical, con dos picos de lluvia: la estación menos lluviosa o época seca (de enero a agosto) y la estación de mayor precipitación o lluviosa (de septiembre a diciembre). El promedio de precipitación anual es de 4700 mm. El régimen mareal es semidiurno con un ámbito promedio de 3.2 m.
El estuario está rodeado por una extensa franja de manglares de ribera, especialmente en la parte sur de la bahía (Sánchez-Paez y Álvarez-León, 1997). Las especies más comunes del bosque en la línea de marea son Rhizophora mangle (L) y Avicennia germinans (L) Stearn. En la parte interior del bosque domina la presencia de especies como Laguncuria racemosa (L) Gaertn. f. y Mora oleífera (Triana) Ducke (Peña, 1998).
MATERIALES Y MÉTODOS
Recolección de muestras
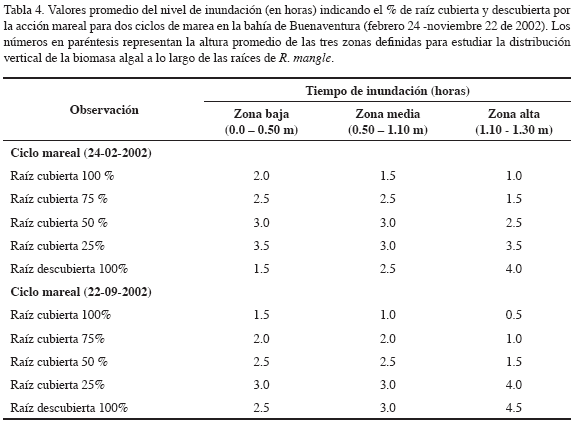
La recolección de las muestras se realizó en tres estaciones de muestreo: estación 1, bocana del estuario (punta Soldado), estación 2, parte media del estuario (Cangrejal) y estación 3, parte interna del estuario (desembocadura del río Dagua). Los muestreos se realizaron entre noviembre de 1999 y septiembre de 2003. Para cada año, la recolección se efectuó en febrero y julio, correspondientes a los meses menos lluviosos y entre septiembre y noviembre, correspondientes a los más lluviosos, para un total de 16 muestreos durante todo el periodo de estudio. En cada estación se estableció una línea de base perpendicular al borde de costa, con una longitud aproximada de 120 m, seleccionando tres transeptos al azar desde la periferia del manglar hacia la parte interna del bosque. Se localizaron tres cuadrantes de 1.0 m2 cada 10 m por transepto, para un total de nueve cuadrantes en cada estación. En cada cuadrante, se midió de manera detallada la forma de la raíz, el área de la superficie y el número total de raíces. Tres zonas fueron definidas a lo largo de las raíces: zona baja: desde la base de la raíz hasta 0.50 m. Zona media: de 0.50 m a 1.10 m. Zona alta: de 1.10 a 1.30 m. La altura final en la raíz se tomó con base en el nivel máximo promedio de inundación mareal para cada estación de muestreo. Se colectó la biomasa de algas epífitas para cada zona y por cada una de las especies encontradas. Las muestras se secaron entre 70 - 80 °C hasta que se logró un peso constante.
Las estimaciones de la tasa de renovación de la biomasa (turnover rate) fueron obtenidas de acuerdo con la metodología de Luning (1991). Estos cálculos se basaron en observaciones de la biomasa algal total por raíz, tomada para cada periodo climático en la zona de estudio (época de lluvias bajas y lluvias altas) durante los días de muestreo del presente estudio (noviembre 1999 a septiembre 2003), y de los valores de la productividad primaria neta obtenidos por Peña (1998). Para expresar los ámbitos de producción como gramos de peso seco por unidad de superficie, el valor neto diario de la tasa de productividad primaria (g C m-2 d-1) se convirtió a g de carbono m-2 d-1 usando el factor de conversión de 2.5 (Luning, 1990). Posteriormente, estos datos se integraron a valores promedio mensual, multiplicando el número de horas de fotoperiodo que recibe el alga por día y extrapolando estos valores a 30 (Luning, 1990). La biomasa total de cada especie se expresó como el peso seco promedio por la unidad del área de la superficie (m2). La biomasa algal para todo el estuario se estimó sumando la biomasa algal total por m2 en cada estación, multiplicando luego este valor por el área total de cobertura de manglar conocida en cada zona del estuario (Peña, 1998).
Mediciones hidrológicas
Valores promedio del nivel de inundación mareal en las zonas de estudio se obtuvieron durante dos ciclos de marea sucesivos, para épocas de puja y épocas de quiebra, siguiendo el protocolo descrito por Kjerfve (1990). La información fue obtenida simultáneamente durante el estudio titulado "Desarrollo del modelo hidráulico de la bahía de Buenaventura" (EIDENAR, 1999). Los datos de precipitación se obtuvieron de la estación meteorológica ubicada en las instalaciones del Puerto de Buenaventura, manejada por el Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM).
Análisis estadístico
El análisis de las variaciones espaciales y temporales de la biomasa algal se realizó mediante un modelo lineal general (GLM), teniendo en cuenta la biomasa como variable dependiente y como factores: el mes de muestreo, la distribución espacial en el estuario (estación) y la distribución vertical en la raíz (altura). Para el diseño del experimento se tomaron en cuenta el número de transeptos por estación (n = 3) y como repeticiones el número de cuadrantes en cada transepto y en cada estación (n = 9) durante todo el periodo de estudio (16 muestreos) para un total 144 observaciones. Se realizó un análisis de varianza (ANOVA) no paramétrico (datos no normales de la variable biomasa) para evaluar las diferencias de biomasa entre meses, estaciones y altura. Cuando las diferencias de ANOVA eran significantes (p <0.01), se llevó a cabo una prueba de rango múltiple de Tukey. A los datos de la variable biomasa se les practicó una prueba de homogeneidad de varianza (varianzas homogéneas). Los análisis estadísticos se llevaron a cabo usando el programa STATISTICA, versión 5.1 (1997).
RESULTADOS
Composición de especies y distribución de la biomasa
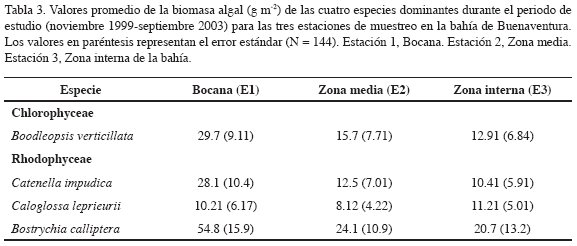
Se registraron un total de 18 especies de algas epífitas asociadas a las raíces de R. mangle y a los neumatóforos de A. germinans que incluyeron nueve especies de algas rojas (Rhodophyceae), cinco especies de algas verdes (Chlorophyceae) y cuatro especies de cianobacterias (Tabla 1). Todas las especies estuvieron presentes en todas las estaciones, y durante el período del estudio. No se observó ninguna diferencia en la composición de especies entre los neumatoforos de Avicennia y las raíces de Rhizophora. Sin embargo, los densos tapetes de algas compuestas por cianobacterias y diatomeas fueron más comunes en la parte inferior de los neumatóforos. Estas asociaciones estuvieron compuestas principalmente por cianobacterias de los géneros Lyngbya (L. aestuarii Liebm. Ex Gomont, L. confervoides Ag. Ex Gomont), Microcoleus sp. y Oscillatoria sp. Cuatro especies fueron las más abundantes durante el período del estudio representando el 90% de la biomasa algal total. Bostrychia calliptera (Montagne) Montagne fue la especie dominante, con el 32 % de la biomasa total, seguida por Boodleopsis verticillata Dawson (26 %), Catenella impúdica (Montagne) J. Agardh (18 %) y Caloglossa leprieurii (Montagne) J. Agardh (12 %).
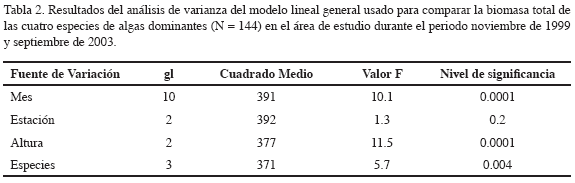
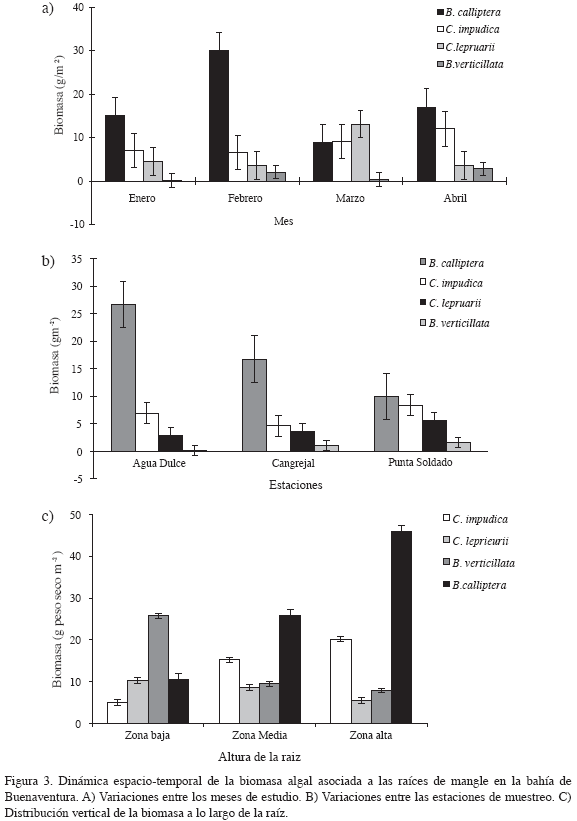
Los resultados del análisis de varianza mostraron diferencias significativas de la biomasa entre las especies (p < 0.004), entre los meses de estudio (p < 0.0001) y a lo largo de la distribución vertical (altura) de las raíces (p < 0.0001) (Tabla 2). El análisis de las interacciones de la biomasa algal total entre estación y altura no mostraron diferencias significativas. La biomasa total de las cuatro especies dominantes registró diferencias significativas entre los periodos climáticos del área de estudio (Figura 2). Durante la estación seca (enero-julio) se registraron los valores más altos, comparados con los datos reportados para la estación lluviosa (septiembre-noviembre), datos con promedios anuales de 103.1 ± 25.9 vs. 59.7 ± 12.5g m-2, respectivamente (Figura 3a). La biomasa total de las cuatro especies dominantes no mostró diferencias significativas (p<0.2) entre las estaciones de estudio (Tabla 2). Sin embargo, los resultados de la biomasa algal por especies sí registraron diferencias (Tabla 3), particularmente entre la estación 1 ó la bocana y estación 3 ó zona interna del estuario. La biomasa promedio por especie fue considerablemente menor en la parte interna de la bahía con respecto a la boca del estuario (promedios anuales de 30.7 ± 10.8 vs. 13.8 ± 4.1 g m-2, respectivamente) (Figura 3b). Diferencias significativas (p <0.01) en la biomasa algal se observaron igualmente a lo largo de la distribución vertical de las raíces del mangle (Figura 3c). Bostrychia calliptera mostró la biomasa más alta en la parte superior (1.10-1.30 m) de la raíz (35.9 ± 13.51 g m-2), seguida por Catenella impúdica (15.2 ± 7.13 g m-2). Boodleopsis verticillata y Caloglossa leprieurii colonizaron las partes más bajas (0-1.10 m) de la raíz (15.8 ± 9.22 y 10.2 ± 4.25 g m-2 respectivamente). La relación entre el nivel de inundación mareal y el tiempo de cobertura de la biomasa algal a lo largo de la raíz del manglar se observa en la Tabla 4. Los resultados revelaron que en promedio durante un ciclo mareal la región baja de la raíz permanece 100 % cubierta por agua, al menos dos horas, mientras la región alta de la raíz no alcanza a permanecer una hora cubierta 100 %. Por consiguiente, la biomasa algal de la zona alta de la raíz permanece más tiempo expuesta a la desecación durante la marea alta, mientras la biomasa algal de la zona baja está bajo el agua la mayor parte del ciclo mareal semidiurno.
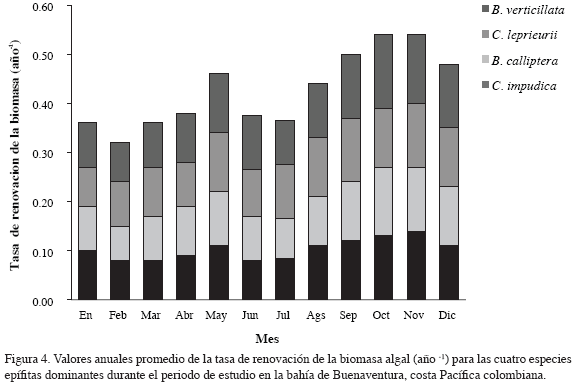
La tasa de renovación de biomasa para cada especie cambió de acuerdo con la estación climática, siendo mayor en la estación lluviosa que en la estación seca. La tasa promedio anual de renovación para todas las especies varió entre 0.09 año-1, equivalente a 33 días durante la estación seca, y 0.12 año-1, equivalente a 45 días durante la estación lluviosa (Figura 4).
DISCUSIÓN
Comunidad algal
La composición florística registrada en este estudio es similar a las asociaciones de macroalgas epífitas en manglar, como lo registran en otras áreas del mundo (Phillips et al., 1994; Broderick y Dawes, 1998; Laursen y King, 2000; Melville et al., 2005). En Australia, Davey y Woelkerling (1980, 1985), Womersley (1990), King y Puttock (1994), Laursen y King (2000) y Melville et al. (2005). En África del Sur, Lambert et al. (1989). En Japón, Tanaka y Chihara (1984a, 1984b, 1985, 1987). En Kenya, Coppejans y Gallin (1989). En Brasil, De Oliveira (1984) y Eston et al. (1992). La presencia durante todo el año de las especies registradas indica su estado de especies perennes (West et al., 1993; Edgar, 2000). Además de las macroalgas epífitas, las especies de cianobacterias filamentosas más comunes en la parte baja de las raíces y los neumatóforos corresponden a Lyngbya aestuarii, L. confervoides y Microcoleus sp. (Potts, 1980; Hussain y Khoja, 1993).
Dinámica de la biomasa
Los resultados demostraron que existen diferencias espaciales y temporales de la biomasa total de las especies dominantes de la flora algológica asociada a las raíces de mangle en la bahía de Buenaventura. La proximidad a las mayores descargas de agua dulce (ríos Dagua y Anchicaya) y las crecientes actividades humanas en el principal puerto de la ciudad, podrían explicar las diferencias significativas de la biomasa algal a lo largo del estuario. Adicionalmente, la inundación de la marea también parece tener efectos directos en la distribución de la biomasa de las especies. El nivel de inundación mareal, expresado en el rango de la marea de tipo semidiurno, sugiere ser otro factor que estaría influenciando la distribución espacial y vertical de la biomasa algal. En la costa Pacífica colombiana la marea varía entre tres a cuatro metros (Cantera y Blanco, 2001) y las algas epífitas están expuestas a la desecación por periodos de aproximadamente 3 a 4 horas debido a los ciclos de la emersión-inmersión generados por los ámbitos de marea. Durante la exposición, las macroalgas de la zona intermareal experimentan una variedad de condiciones medioambientales estresantes, como la alta intensidad de luz y desecamiento. Estas condiciones pueden afectar el metabolismo algal y la tasa de crecimiento (Karsten et al., 1994; Peña et al., 1999).
La diferencia en la distribución vertical de las macroalgas epífitas a lo largo de las raíces de Rhizophora y neumatóforos de Avicennia registrada en este estudio ha sido observada en otros manglares. En efecto, Davey y Woelkerling (1985) encontraron algas dominantes dentro de los primeros 5-10 cm de los segmentos de neumatóforos. Tanaka y Chihara (1987) registraron una concentración de Rhizoclonium más alta (0-0.35 m), una gran región media denominada Bostrychia-Caloglossa y una región baja de Catenella-Cladophora. Phillips et al. (1996) identificaron tres zonas verticales: una superior de Rhizoclonium, una media de Bostrychia y una más baja de Caloglossa. Más recientemente, Melville et al. (2005) en raíces de Rhizophora, registraron una típica zona media de Catenella nipae, con la biomasa más alta, seguida por una zona más baja de biomasa algal localizada en la base y dominada por Bostrychia moritziana.
La importancia ecológica de las macroalgas epífitas en los hábitats del mangle en la bahía de Buenaventura puede verse en su producción de biomasa anual. De acuerdo con los resultados encontrados, el promedio anual de producción de biomasa por la raíz en la bahía de Buenaventura fue calculado en 53 ± 11 g m-2. Con base en lo registrado en la literatura, estos resultados son equivalentes a la producción de fitoplancton en una columna de agua en estuarios tropicales (Almodóvar y Biebl, 1962) y a la producción de hojarasca de un manglar de barra en Puerto Rico (Rodríguez y Stoner, 1990). Dawes (1998) registra que la producción de las algas epífitas en un bosque de manglar en la Florida es comparable con la biomasa por m2 de la vegetación de macrófitas (turberas) en humedales (Dawes, 1990), valores para el total de la biomasa pueden estar subvalorados ya que los cojines de algas filamentosas que cubren el fondo de las raíces y los neumatóforos no han sido incluidos. En la bahía de Buenaventura la biomasa algal promedio en la base de las raíces del mangle, correspondiente a los cojines de algas conformados por Boodleopsis verticillata, es de 5.2 a 47.9 g m-2 (Peña, 1998).
Para estimar la dinámica temporal y la contribución ecológica de las algas epífitas en los ambientes de manglar, se calculó la tasa de renovación de la biomasa de las cuatro macroalgas dominantes (Figura 4). La tasa de renovación (turnover rate) para este tipo de algas epífitas no está disponible en la literatura y el estudio proporcionó los primeros datos disponibles para la comparación con otras zonas de manglar. Las algas epífitas en estos hábitats de manglar pueden multiplicar su biomasa de 9 a 12 veces por año, con valores más altos de enero a junio y los períodos más largos de renovación a finales de septiembre hasta diciembre. Estos datos son comparables con valores registrados para otras macroalgas (Jansson y Wulff, 1977; Wallentinus, 1978; Valiela, 1995). Los resultados indican que las algas epifitas en las raíces del mangle contribuyen significativamente a la producción primaria total del bosque y juegan un papel importante en las redes tróficas del ecosistema. Stoner y Zimmerman (1988) registran que las cianobacterias son la fuente primaria de carbono como hábitat en el sedimento para la macrofauna, camarones (Penaeidae) y el cangrejo azul (Callinectes sp.) en Laguna Joyuda, Puerto Rico. Estudios ecológicos más detallados en las interacciones alga-animal deben llevarse a cabo en los habitats del manglar para entender el papel funcional de la comunidad algal en la red trófica del ecosistema de manglar en la bahía de Buenaventura.
Los resultados del estudio permiten concluir que existe un patrón espacio-temporal de la biomasa algal asociada a las raíces de mangle en la bahía de Buenaventura, registrando los mayores valores en la boca de la bahía y coincidiendo con la época de menos lluvias en la zona de estudio. Las variaciones en la abundancia de la biomasa por especie a lo largo de la raíces del manglar permiten concluir que existe un patrón de distribución vertical de la biomasa algal, influenciado a su vez por los niveles de inundación mareal y la posición en la zona intermareal.
AGRADECIMIENTOS
El presente estudio fue financiado por el Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología Francisco José de Caldas (COLCIENCIAS) Proyecto No. 1106-09-127-94) y la Universidad del Valle, Cali, Colombia. El autor expresa sus agradecimientos a Marco Correa, Adriana Bejarano, Willy Montoya, Angela Oviedo y Yesid Lozano, estudiantes del Departamento de Biología (período 1999-2003), por su apoyo durante los periodos de muestreo. Raúl Neira, por su asesoria durante el trabajo de campo. Gerardo Toro, por su asistencia y realización de los análisis de imágenes Landsat y estimaciones de las áreas de manglar. Aleyda Maritza Acosta, por su apoyo en la tipografía y edición del manuscrito. Finalmente al Dr. Richard Zingmark, profesor de la Universidad de Carolina del Sur, EE.UU., por su guía en el diseño experimental del estudio.
BIBLIOGRAFÍA
1 Almodovar, L.R. y R. Biebl. 1962. Osmotic resistance of mangrove algae around La Parguera, Puerto Rico. Rev. Algol., 6: 203-208. [ Links ]
2 Broderick, M.E. y C.J. Dawes. 1998. Seasonal photosynthetic and respiratory responses of the red alga Bostrychia tenella (Ceremiales, Rhodophyta) from a salt marsh and mangal. Phycologia, 37: 82-88. [ Links ]
3 Burkholder, P.R. y L.R. Almodovar. 1973. Studies on mangrove algal communities in Puerto Rico. Florida Sci., 36: 50-66. [ Links ]
4 Cantera, J.R. 1991. Etude structurale des mangroves et des peuplements littoraux des deux baies du pacifique colombien (Málaga et Buenaventura). Rapport avec les conditions du milieu et les perturbations anthropiques. These d'Etat Sciences. Université dÁix-Marseille II, Marseille, France. 429 p. [ Links ]
5 Cantera, J.R. y J.F. Blanco. 2001. The estuary ecosystem of Buenaventura bay, Colombia. 265 - 280. En: Seeliger, U. y B. Kjerfve (Eds.). Coastal marine ecosystems of Latin America, ecological studies. Springer-Verlag, Nueva York. [ Links ]
6 Coppejans, E. y E. Gallin. 1989. Macroalgae associated with the mangrove vegetation of Gazi Bay, Kenya. Bull. Soc. Royal. Bot. Bel., 122: 47-60. [ Links ]
7 Davey, A. y W.J. Woelkerling. 1980. Studies on Australian mangrove algae. I. Victorian communities: Composition and geographic distribution. Proc. R. Soc. Vict., 91: 53-66. [ Links ]
8 Davey, A. y W.J. Woelkerling. 1985. Studies on Australian mangrove algae. III. Victorian communities: Structure and recolonization in Westernport Bay. J. Exp. Mar. Biol. Ecol., 85: 177-190. [ Links ]
9 Dawes, C. 1990. Seasonal changes in limestone and sand communities of the Florida west coast. Mar. Ecol., 11: 97-104. [ Links ]
10 Dawes, C. 1996. Macroalga diversity, standing stock and productivity in northern mangal on the west coast of Florida. Nova Hedwigia, Beiheft, 112: 525-535. [ Links ]
11 Dawes, C.J. 1998. Marine Botany. 2 edition, Wiley, Nueva York. 480 p. [ Links ]
12 De Oliveira, F.E.C. 1984. Brazilian mangal vegetation with special emphasis on the seaweeds. 55-56. En: Por, F.D. y I. Dor. (Eds.). Hydrobiology of the mangal - the ecosystem of the Mangrove Forest. I. Developments in Hydrobiology. Dr W. Junk Publishers, La Haya, Holanda. [ Links ]
13 Dor, I. 1984. Ephiphytic blue-green algae (cyanobacteria) of the Sinai mangal: Considerations on vertical zonation and morphological adaptation. 35-54. En: Por, F.D. y I. Dor (Eds.). Hydrobiology of the mangal - the ecosystem of the mangrove forests. I. Developments in Hydrobiology. Dr W. Junk Publishers, The Hague, Holanda. [ Links ]
14 Edgar, E. 2000. Australian marine life: The plants and animals of temperate waters. New Holland Publisher, Sydney. 129 p. [ Links ]
15 EIDENAR. 1999. Proyecto Modelo hidráulico de la bahía de Buenaventura. Universidad del Valle, Departamento de Mecánica de Fluidos, Informe Final, Cali. 450 p. [ Links ]
16 Eston, V.R., M.R. Braga, M. Cordeiro-Marino, M.T. Fujii, y N.S. Yokoya. 1992. Macroalgal colonization patterns on artificial substrates inside southeastern brazilian mangroves. Aquatic Bot., 42: 315-325. [ Links ]
17 Hussain, M.I. y T.M. Khoja. 1993. Intertidal and subtidal blue-green algal mats of open and mangrove areas in the Farasan Archipelago (Saudi Arabia), Red Sea. Bot. Mar., 36: 377-388. [ Links ]
18 Jansson, B.O. y L. Wulff. 1977. Ecosystem analysis of a shallow sound in the northern Baltic proper - A joint study by the Asko group. Contrib. Asko Lab. Univ. Stockholm., 18: 1-160. [ Links ]
19 Karsten, S., J.A. Koch, J. West y G.O. Kirst. 1994. The intertidal red alga Bostrychia simpliciuscula Harvey ex J. Agardh from a mangrove swamp in Singapore: Acclimation to light and salinity. Aquatic Bot., 48: 313-323. [ Links ]
20 King, R.J. y C.F. Puttock. 1994. Macroalgae associated with mangroves in Australia: Rhodophyta. Bot. Mar., 37: 181-191. [ Links ]
21 Kjerfve, B. 1990. Manual for investigation of hydrological process in mangroves ecosystems. UNESCO/UNDP Nueva Delhi. 79 p. [ Links ]
22 Lambert, G., T.D. Steinke y Y. Naidoo. 1989. Algae associated with mangroves in southern African estuaries. Cyanophyceae. S. Afr. J. Bot., 55: 476-491. [ Links ]
23 Laursen, W.J. y R.J. King. 2000. The distribution and abundance of mangrove macroalgae in Woolooware Bay, New South Wales, Australia. Bot. Mar., 43: 377-384. [ Links ]
24 Luning, K. 1990. Seaweeds. Their Environment, Biogeography and Ecophysiology. Wiley, Nueva York. 527 p. [ Links ]
25 Melville, F., A. Pulkownik y M. Burchett. 2005. Zonal and seasonal variation in the distribution and abundance of mangrove macroalgae in the Parramatta River, Australia. Est. Coast Shelf Sci., 64: 267-276. [ Links ]
26 Mostaert, A.S., U. Karsten y R.J King. 1995. Physiological responses of Caloglossa leprieurii (Ceramiales, Rhodophyta) to salinity stress. Phycol. Res., 43: 215 -222. [ Links ]
27 Peña, E.J. 1998. Physiological ecology of mangrove associated macroalgae in a tropical estuary. Ph.D Thesis dissertation. University of South Carolina, EE.UU. 259 p. [ Links ]
28 Peña, E.J. y M.L. Palacios. 1988. Macroalgas marinas bénticas asociadas al manglar de la costa Pacífica colombiana. 500-505. En: Memorias VI Sem. Nal. y Tec. Del Mar. CCO - Universidad Jorge Tadeo Lozano, Bogotá. [ Links ]
29 Peña, E.J., M.L. Palacios y A. Mejia. 1987. Estudio fitosociológico de una zona intermareal en la Bahía de Málaga, Costa Pacífica colombiana. Rev. Asoc. Col. Cienc. Biol., 4 (1): 12-21. [ Links ]
30 Peña, E.J., R. Zingmark y C. Nietch. 1999. Comparative photosynthesis of two species of epiphytic macroalgae on mangrove roots during submersion and emersion. J. Phycol., 35: 1206-1214. [ Links ]
31 Phillips, A., G. Lambert, J.E. Granger y T.D. Steinke. 1994. Horizontal zonation of ephiphytic algae associated with Avicennia marina (Forssk) Vierh. Pneumatophores at Beachwood Mangroves Nature Reserve, Durban, South. Africa. Bot. Mar., 37: 567-576. [ Links ]
32 Phillips, A., G. Lambert, J.E. Granger y T.D. Steinke. 1996. Vertical zonation of epiphytic algae associated with Avicennia marina (Forssk) Vierh. pneumatophores at Beachwood Mangroves Nature Reserve, Durban, South Africa. Bot. Mar., 39: 167-175. [ Links ]
33 Post, E. 1936. Zur Verbreitung y Okologie der Bostrychia-Caloglossa-Assoziation. Int. Rev. Gesamten Hydrobiol., 48: 47-152. [ Links ]
34 Potts, M. 1980. Blue-green algae (Cyanophyta) in marine coastal environments of the Sinai Peninsula; distribution, zonation, stratification and taxonomic diversity. Phycologia, 19: 60-73. [ Links ]
35 Rodríguez, C. y A.W. Stoner. 1990. The epiphyte community of mangrove roots in a tropical estuary: Distribution and biomass. Aquat. Bot., 36: 117-126. [ Links ]
36 Sánchez-Páez, H. y R. Álvarez-León. 1997. Diagnóstico y zonificación preliminar de los manglares del Pacífico colombiano. Ministerio del Medio Ambiente-OIMT, Santa Fé de Bogotá. 343 p. [ Links ]
37 Schnetter, R. y G. Bula. 1982. Marine algen der Pazifkuste von Kolombien. Chlorophyceae, Phaeophyceae, Rhodophyceae. Bibliotheca Phycol., 60: 1-287. [ Links ]
38 Stoner, A.W. y R.J. Zimmerman. 1988. Food pathways associated with penaeid shrimps in a mangrove-fringed estuary. Fish. Bull., 86: 543-552. [ Links ]
39 Tanaka, J. y M. Chihara. 1984a. Taxonomic studies of Japanese mangrove macroalgae I. Genus Bostrychia (Ceramiales, Rhodophyceae) (1). Bull. Natn. Sci. Mus., Tokyo, Ser. B., 10: 115-126. [ Links ]
40 Tanaka, J. y M. Chihara. 1984b. Taxonomic studies of Japanese mangrove macroalgae I. Genus Bostrychia (Ceramiales, Rhodophyceae) (2). Bull. Natn. Sci. Mus., Tokyo, Ser. B., 10: 169-176. [ Links ]
41 Tanaka, J. y M. Chihara. 1985. Taxonomic studies of Japanese mangrove macroalgae II. Two taxa of Caloglossa (Ceramiales, Rhodophyceae)(2). Bull. Natn. Sci. Mus., Tokyo, Ser. B., 11: 41-50. [ Links ]
42 Tanaka, J. y M. Chihara. 1987. Species composition and vertical distribution of macroalgae in Brackish waters of Japanese mangrove forest. Bull. Natn. Sci. Mus., Tokyo, Ser. B., 13: 141-150. [ Links ]
43 Valiela, I. 1995. Marine ecological processes. Springer-Verlag, Nueva York. 643 p. [ Links ]
44 Wallentinus, I. 1978. Productivity studies on Baltic macroalgae. Bot. Mar., XXI: 365-380. [ Links ]
45 West, J.A., G. Zuccarello, U. Karsten y H.P. Calumpong. 1993. Biology of Bostrychìa, Stictosìphonìa and Caloglossa (Rhodophyta, Ceramiales). 38-49. En: Proceedings of the Second RP-USA Phycology Symposium, 6-19 January 1992, Cebu and Dumaguete, Rusia. [ Links ]
46 Womersley, H.B.S. 1990. Biogeography of Australasian marine macroalgae. 368-381. En: Clayton, M.N. y R.J. King (Eds.). Biology of marine plants. Longman Cheshire, Melbourne. [ Links ]
47 Zuccarello, G. y J.T. Yeates. 2001. Population structure and physiological differentiation of haplotypes of Caloglossa leprieurii (Rhodophyta) in a mangrove intertidal zone. J. Phycol., 37: 291-298. [ Links ]
FECHA DE RECEPCIÓN: 01/03/07 FECHA DE ACEPTACIÓN: 19/08/08