Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.37 no.2 Santa Marta July/Dec. 2008
FORMACIONES CORALINAS DEL ÁREA DE SANTA MARTA: ESTADO Y PATRONES DE DISTRIBUCIÓN ESPACIAL DE LA COMUNIDAD BENTÓNICA.
CORAL FORMATIONS IN SANTA MARTA AREA: STATUS AND SPATIAL DISTRIBUTION PATTERNS OF THE BENTHIC COMMUNITY.
Johanna Vega-Sequeda1, Alberto Rodríguez-Ramírez2, María Catalina Reyes-Nivia2 y Raúl Navas-Camacho2
1Universidad Jorge Tadeo Lozano, Facultad de Ciencias Naturales, Programa de Biología Marina, Santa Marta, Colombia. johavega@gmail.com
2Instituto de Investigaciones Marinas y Costeras (INVEMAR), A.A. 1016, Santa Marta, Colombia. betorod@invemar.org.co (A.R..R); catareyes@invemar.org.co (M.C.R.N); rnavas@invemar.org.co (R.N.C)
RESUMEN
Se evaluaron 20 formaciones coralinas del área de Santa Marta en términos de: 1) composición y abundancia de los componentes del sustrato y 2) prevalencia de enfermedades coralinas y blanqueamiento. Para obtener la información se utilizaron bandas de 10 x 1 m y 10 x 2 m respectivamente. Se registró un total de 33 especies de corales duros. Las algas y los corales fueron los componentes de mayor cobertura, sin embargo sus promedios variaron ampliamente en el área de estudio (coral= 4.0 ± 0.9 %-62.0 ± 7.2 %; algas = 30.6 ± 11.0 %-78.3 ± 3.0 %). Las especies de coral con coberturas promedio más altas fueron Colpophyllia natans, Diploria strigosa, Acropora palmata y Montastraea cavernosa (7.5 ± 2.7 %, 6.7 ± 2.1 %, 4.0 ± 2.8 % y 3.8 ± 1.0 %, respectivamente). La prevalencia de enfermedades y blanqueamiento fue menor al 4 %. Las formaciones con coberturas de coral más altas se encontraron asociadas al Parque Nacional Natural Tayrona (Gayraca, Aguja, Chengue y Neguanje), mientras que las menores coberturas coralinas se hallaron cercanas a los centros urbanos (Santa Marta y El Rodadero). Aunque existen formaciones coralinas en buen estado en el área de Santa Marta, la tendencia generalizada es que las algas sean el componente predominante del sustrato arrecifal.
PALABRAS CLAVE: Formaciones coralinas, Estado, Distribución espacial, Santa Marta, Tayrona.
ABSTRACT
Twenty coral formations were evaluated in the area of Santa Marta in terms of: 1) composition and abundance of the principal substrate categories and 2) prevalence of coral diseases and bleaching. To obtain the information, bands of 10 x 1 m and 10 x 2 m were used, respectively. A total of 33 species of hard corals were registered. Algae and corals were the components with major cover, nonetheless, averages varied widely in the study area (coral= 4.0 ± 0.9 %-62.0 ± 7.2 %; algae = 30.6 ± 11.0 %-78.3 ± 3.0 %). The coral species with the highest averages cover were Colpophyllia natans, Diploria strigosa, Acropora palmata, and Montastraea cavernosa (7.5 ± 2.7 %, 6.7 ± 2.1 %, 4.0 ± 2.8 %, and 3.8 ± 1.0 %, respectively). Prevalence of coral diseases and bleaching were lower than 4 %. The reefs with the highest coral covers were associated to the Parque Nacional Natural Tayrona (Gayraca, Aguja, Chengue and Neguanje), whereas the lowest values were found near the urban centers (Santa Marta and El Rodadero). Even though there are some coral reefs showing relatively good conditions in the area of Santa Marta, the widespread trend is that algae are the predominant component of reef substratum.
KEY WORDS: Coral formations, Status, Spatial distribution, Santa Marta, Tayrona.
INTRODUCCIÓN
Un arrecife coralino es un sistema de gran diversidad e importancia ecológica debido a las complejas interacciones que allí se desarrollan, además de que es un ecosistema de alta productividad (Díaz et al., 1996; Birkeland, 1997; Hoegh-Guldberg, 1999) que ofrece variados servicios a la población costera y contribuye a la salud de la biosfera (Hoegh-Guldberg, 1999; Buddemeier et al., 2004). En los últimos años, se ha venido presentando deterioro en los ambientes coralinos a escala mundial, el cual se ve incrementado por la interacción de factores de estrés de tipo antrópico y climático (Hollock et al., 1993; Brown, 1997; Hoegh-Guldberg, 1999; Hughes y Conell, 1999; Knowlton, 2001; Buddemeier et al., 2004). En el Caribe colombiano han sido especialmente afectadas las áreas de San Andrés, Islas del Rosario, Islas de San Bernardo y la región de Santa Marta (Garzón-Ferreira y Kielman, 1994; Garzón-Ferreira, 1997; Díaz et al., 2000; Garzón-Ferreira et al., 2001; Garzón-Ferreira y Díaz, 2003). En ésta última se han observando cambios en la composición coralina, mortandades masivas de organismos arrecifales, reducción en el número de especies de coral y cobertura coralina, entre otros (Werding y Sánchez, 1988; Acosta, 1994; Garzón-Ferreira y Díaz, 2003; Martínez y Acosta, 2005). Aunque las formaciones coralinas del área de Santa Marta han sido descritas en diferentes documentos desde hace varios años (Antonius, 1972; Erhardt y Werding, 1975; Werding y Sánchez, 1988; Zea y Duque-Tobón, 1989; Garzón-Ferreira y Cano, 1991; Aerst y Soest, 1997; Aerts, 2000; Díaz et al., 2000), la información a gran escala sobre el estado de sus arrecifes no está actualizada debido principalmente a que la mayoría de trabajos que evalúan cambios temporales en las formaciones coralinas se realizaron hace más de 10 años (Werding y Sánchez, 1988; Zea, 1991, 1994; Acosta, 1994), siendo pocos los antecedentes recientes (Mejía-Niño y Garzón-Ferreira, 2003; Rodríguez-Ramírez y Garzón-Ferreira, 2003; Garzón-Ferreira et al., 2004; Acosta y Martínez, 2006; Rodríguez-Ramírez et al., 2006). En consecuencia, no se tiene certeza si han ocurrido procesos de recuperación o mantenimiento de las comunidades coralinas o si, por el contrario, la degradación ha continuado en toda el área. El presente estudio establece el estado de 20 formaciones coralinas del área de Santa Marta (incluyendo el Parque Tayrona), mediante la evaluación de los componentes bentónicos, la complejidad arrecifal y la prevalencia de enfermedades coralinas. Además se identifican los patrones de variación espacial de las formaciones evaluadas.
ÁREA DE ESTUDIO
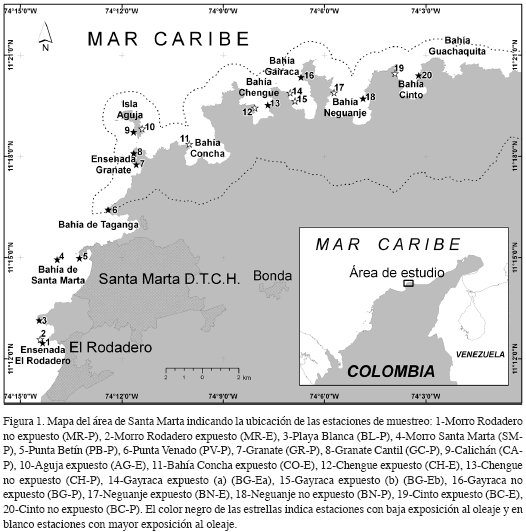
El área costera de Santa Marta se encuentra localizada en el departamento de Magdalena entre los puntos geográficos 11°12'- 11° 22' N y 73°57 '- 74°15' W (Díaz et al., 2000) e incluye la bahía del mismo nombre y el Parque Nacional Natural Tayrona -PNNT-(Figura 1). Dentro de la primera se encuentran dos áreas urbanas que en conjunto reúnen una población aproximada de 415000 personas (DANE, 2007): la ciudad de Santa Marta y el balneario El Rodadero, sobre las cuales llegan las descargas de los ríos Manzanares y Gaira, respectivamente. Asimismo, se estima que el área es visitada anualmente por unos 100000 turistas (Díaz et al., 2000). Las comunidades costeras del área de Santa Marta están influenciadas por una época seca (diciembre-abril) en la cual la presencia de los vientos Alisios del nororiente producen el fenómeno local de surgencia, que desciende la temperatura del agua (20°-25°C), eleva la salinidad (hasta 38) y la intensidad del oleaje. En la época de lluvias (mayo-noviembre) cesa la surgencia, el agua es más cálida (27°-29°C), disminuye la salinidad (34) y la carga de sedimentos es mayor, incrementando la turbidez (Ramírez, 1983; Bula-Meyer, 1985; Garzón-Ferreira y Díaz, 2003; Rodríguez-Ramírez y Garzón-Ferreira, 2003; Franco, 2005). La topografía de la costa es heterogénea debido a las estribaciones de la Sierra Nevada de Santa Marta, lo que genera formaciones de acantilados, bahías, puntas, islotes y ensenadas cuyos costados occidentales están más expuestos a la acción de los vientos y el oleaje (Garzón-Ferreira y Cano, 1991; Garzón-Ferreira, 1998). A pesar de la gran cantidad de fondos duros adecuados para el establecimiento de arrecifes, las formaciones coralinas del área son poco desarrolladas y su crecimiento es limitado en comparación con otras áreas del Caribe colombiano debido a la alta influencia de descargas continentales y el régimen estacional mencionado anteriormente (Antonius, 1972; Werding y Sánchez, 1988; Zea, 1993).
MATERIALES Y MÉTODOS
Metodologías de campo
Las observaciones de campo fueron realizadas en 20 estaciones con formaciones coralinas del área de Santa Marta y Parque Nacional Natural Tayrona (Figura 1) en los meses de marzo y abril del 2005.
Para su selección se tuvo en cuenta la información cartográfica de Garzón-Ferreira y Cano (1991) y Díaz et al. (2000), la ubicación en el ámbito de profundidad de mayor desarrollo coralino en la zona (4-15 m) y la localización tanto en zonas expuestas (-E) y no expuestas al oleaje (-P) durante la época seca (mayor intensidad de los vientos Alisios), así como en zonas con poca y alta influencia antropogénica, definidas por: 1-Distancia a centros urbanos, 2-Cercanía a ríos principales (ríos Gaira y Manzanares) y 3-Información sobre las actividades de pesca y buceo. Esta clasificación fue además apoyada de información secundaria, observaciones en campo y conocimiento previo de los investigadores en el área de estudio. En cada estación se evaluó la cobertura de las principales categorías del sustrato utilizando el método de transecto en banda descrito por Chiappone y Sullivan (1994) con algunas modificaciones; se evaluaron cuatro bandas (réplicas) de 10 x 1 m en cada estación (en vez de emplear dos bandas de 25 x 1 m). Para estimar la longitud de cada banda se colocó un cabo de referencia de 10 m. La información se registró con la ayuda de un cuadrante de 1 x 1 m dividido en 100 sub-cuadrantes de 10 x 10 cm, los cuales facilitaron la cuantificación de los componentes. El cuadrante se deslizó 10 veces sobre un cabo guía para completar los 10 m2. Los corales duros fueron identificados hasta nivel de género o especie y los demás organismos se agruparon en las categorías recomendadas por CARICOMP (2001) y Garzón-Ferreira et al. (2002). Curvas de diversidad acumulada demostraron que una banda de 10 m2 es representativa de la comunidad bentónica (Vega-Sequeda, 2006). Se determinó también la prevalencia de enfermedades en corales duros, implementando el protocolo descrito en CARICOMP (2001) y Garzón-Ferreira et al. (2002). Empleando los mismos cabos de referencia sobre los transectos de la estructura arrecifal, se evaluaron cuatro bandas de 10 x 2 m, cuyo ancho se determinó utilizando un tubo de PVC de 1 m de largo a ambos lados del cabo. En cada banda se contaron y examinaron todas las colonias (Scleractinia y Milleporina) mayores a 5 cm, se anotó la especie y la presencia de enfermedades o blanqueamiento. Para establecer la complejidad de sustrato de cada estación, se desplegó al azar (siguiendo el contorno arrecifal) cinco veces una cadena numerada con eslabones pequeños (1.7 cm) sobre una longitud de 10 m, contando el número de eslabones utilizados para cubrir los 10 m de transecto.
Análisis de la información
Estructura y prevalencia de enfermedades y blanqueamiento
Teniendo en cuenta que la unidad fundamental para los análisis fue el transecto de banda, se realizó una sumatoria de los porcentajes de cobertura de los diez cuadrantes de cada banda por especie coralina y demás categorías del sustrato (algas, esponjas, sustrato abiótico), y con base en esto se recalcularon los porcentajes por banda. Luego, con las cuatro bandas se realizaron cálculos de estadística descriptiva (promedio y error estándar), de esta manera cada una de las estaciones quedaron caracterizadas en términos de estructura. Además para cada banda se calculó: 1-prevalencia general de enfermedades y tipo de enfermedad, 2- prevalencia general de blanqueamiento, y 3- prevalencia de enfermedades y blanqueamiento por especie de coral. La prevalencia se expresó como el porcentaje de colonias que presenten alguna enfermedad o signo de blanqueamiento del total de colonias examinadas en la banda. A partir de estos cálculos básicos, se caracterizó cada estación (promedio de las cuatro bandas y error estándar). Adicionalmente, para explorar si el número de colonias enfermas estaba relacionado con el grado de exposición al oleaje y el nivel de protección (dentro y fuera del PNNT), se realizaron pruebas de independencia (tablas de contingencia; Χ2).
Complejidad del sustrato
Se empleó el índice de rugosidad (IR), el cual relaciona la longitud de la cadena y la longitud del transecto (Aronson et al, 1994; CARICOMP, 1994) de la siguiente manera:
IR = [Tamaño eslabón (mm) x No. Eslabones] / Longitud transecto (mm)
Posteriormente se promediaron los cinco IR para determinar la complejidad del sustrato por estación.
Patrones de distribución espacial
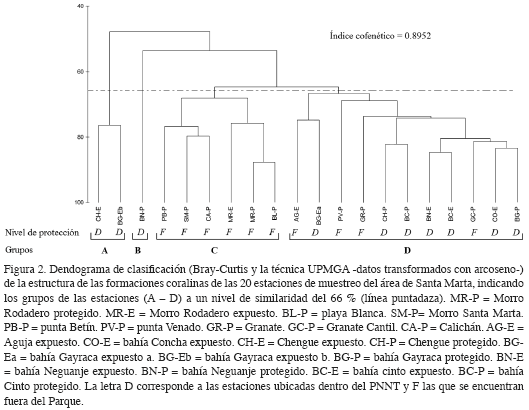
Mediante un análisis de clasificación se exploraron los patrones de distribución espacial de las formaciones arrecifales. La matriz original para estos análisis se construyó de tal forma que las filas correspondieron a las especies coralinas y categorías principales (algas, esponjas, sustrato abiótico) y las columnas a las 20 estaciones (promedio de las coberturas de las cuatro bandas en cada estación). Los datos de porcentaje fueron transformados con arcoseno de acuerdo con lo planteado por Zar (1996) y McCune y Grace (2002). Posteriormente, se excluyeron los componentes que no alcanzaron el 4 % de cobertura al menos en una estación. La matriz de similaridad se obtuvo a partir del coeficiente Bray-Curtis; el dendrograma resultante para la clasificación se construyó usando la técnica ligamiento promedio no ponderado. Empíricamente se ha demostrado que esta técnica origina una menor distorsión (mayor coeficiente cofenético) entre la matriz original y el dendrograma final (cf. Crisci y López, 1983) y ha demostrado ser apropiada para la delimitación de grupos en sitios con diferente estructura comunitaria (Clarke y Warwick, 1994). Además, para determinar cuáles especies coralinas o componentes del sustrato son las responsables del agrupamiento de las estaciones en los análisis de clasificación, se realizó un análisis inverso conforme a la metodología propuesta por Kaandorp (1986).
RESULTADOS
Estructura
El promedio de todas las estaciones indicó que para el área de Santa Marta más de la mitad del sustrato está cubierto por el componente algal (59.1 % ± 3.0), seguido por los corales duros (29.5 % ± 3.5) y el sustrato abiótico (9.0 % ± 1.5). Al discriminar la información de la categoría algal, se encontró que el césped de algas alcanzó el mayor valor de cobertura del sustrato con un 50.9 % ± 3.1, seguido por las algas incrustantes, algas frondosas y calcáreas (4.0 % ± 0.7, 3.7 % ± 2.0 y 0.5 % ± 0.2 respectivamente).
Con relación a los corales, se registraron 33 especies coralinas y las de mayor cobertura en el área fueron en su orden: Colpophyllia natans (7.5 % ± 2.7), Diploria strigosa (6.7 % ± 2.1), Acropora palmata (4.0 % ± 2.8) y Montastraea cavernosa (3.8 % ± 1.0); las especies restantes presentaron valores inferiores al 2 %. Valores de cobertura de cada especie pueden ser consultados en Vega-Sequeda (2006).
Al comparar entre estaciones (Tabla 1), se observa que la cobertura algal varió ampliamente entre las estaciones entre un 30.6 % ± 11.0 (estación AG-E) y 78.3 % ± 3.0 (estación PV-P). Por su parte, los valores de cobertura coralina fluctuaron notoriamente entre 4.0 % ± 0.9 (estación PB-P) y 62.0 % ± 7.2 (estación BG-Ea). La cobertura del sustrato abiótico alcanzó un valor mínimo de 0.6 % ± 0.2 (estación BN-P) y uno máximo de 25.0 % ± 9.7 (estación CA-P). Información detalla de los valores de cobertura de cada componente se encuentran en la tabla 1.
Prevalencia de enfermedades y blanqueamiento
En total se muestrearon 10725 colonias de corales y en promedio para el área de estudio (n=20 estaciones) la prevalencia de enfermedades coralinas no superó el 3.1 % ± 1.4 y el blanqueamiento el 0.4 % (± 0.1). Entre estaciones, la prevalencia de las enfermedades coralinas varió ampliamente entre 25.0 % ± 6.8 (en CH-E) y 0 % -varias estaciones- y el blanqueamiento registró una baja variación entre 1.6 % ± 1.0 (en MR-P) y 0 % -varias estaciones- (Tabla 1). Las tablas de contingencia (Χ2) indicaron que la mayor prevalencia de enfermedades fue dependiente de las estaciones ubicadas dentro del PNNT y de las que son expuestas al oleaje (cada una con gl = 1; p < 0.01 con corrección de Yates).
Se identificaron seis enfermedades: banda negra (BN), banda blanca (BB), banda amarilla (BA), plaga blanca (PB), lunares oscuros (LO) y serratiosis o White pox (WPx), de las cuales WPx, PB y LO fueron las enfermedades con mayor prevalencia (promedio general) en el área con 1.9 % ± 1.4, 0.9 % ± 0.4 y 0.3 % ± 0.1 respectivamente. Las enfermedades restantes obtuvieron porcentajes inferiores al 0.1 %. La prevalencia de PB varió entre las estaciones entre 5.2 % ± 2.4 (en BN-P) y 0 % (varias estaciones), la LO entre 1.6 % ± 1.6 (en BL-P y BG-Eb) y 0 % (varias estaciones) y WPx sobre A. palmata se observó sólo en CH-E (24.9 % ± 6.9) y BG-Eb (12.2 % ± 2.5) (Tabla 1).
En relación con las especies de corales duros, se encontraron once especies afectadas al menos por una enfermedad, siendo el síndrome de PB el que afectó al mayor número de especies (nueve). Los promedios generales de prevalencia (n=20) indicaron que A. palmata y C. natans fueron los corales más afectados por WPx con 1.9 % ± 1.4 y PB con 0.6 % ± 0.3 respectivamente.
Complejidad del sustrato
En promedio para el área de Santa Marta la complejidad del sustrato fue de 1.8 ± 0.03. La estación que presentó el mayor índice de rugosidad fue BG-Eb con 2.2 ± 0.1 a diferencia de CA-P que alcanzó el valor más bajo con 1.6 ± 0.04 (Tabla 1).
Distribución espacial
El análisis de clasificación mostró la formación de cuatro grupos principales a un nivel de similaridad del 66 % (Figura 2). Los grupos A, B y D reunieron las estaciones ubicadas dentro del PNNT -alejadas de los centros urbanos-, con algunas excepciones en el grupo D, en el cual se ubicaron estaciones de transición entre Santa Marta y el Parque -sectores de la Aguja, Granate y Punta Venado- (Figura 2). El grupo C reunió la mayoría de estaciones que se encuentran en las inmediaciones de la bahía de Santa Marta y El Rodadero, las cuales presentan mayor influencia antropogénica y de aguas continentales (Figura 2).
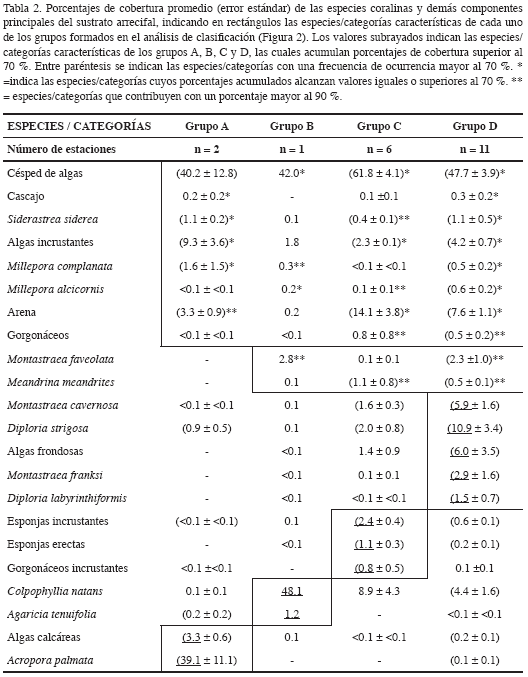
Por su parte, el análisis inverso indicó que las especies/categorías características que obtuvieron un porcentaje acumulado mayor al 70 %, para el grupo A fueron A. palmata y algas calcáreas, para el grupo B los corales C. natans y Agaricia tenuifolia, para el grupo C las esponjas incrustantes, esponjas erectas y gorgonáceos incrustantes, y para el grupo D Montastraea franksi, M. cavernosa, Diploria strigosa, D. labyrinthiformis y las algas frondosas (Tabla 2).
DISCUSIÓN
Estructura
De acuerdo con los datos de cobertura obtenidos, las algas y los corales duros son las categorías bentónicas de mayor importancia actualmente en el área de Santa Marta. Este esquema coincide con los resultados de varias evaluaciones realizadas durante la última década (Garzón-Ferreira et al., 2000; Rodríguez-Ramírez y Garzón-Ferreira, 2003; Martínez y Acosta, 2005; Rodríguez-Ramírez et al., 2005) y sugiere que la composición bentónica ha permanecido estable en el área en los últimos años. Las algas se mantienen como la categoría más conspicua del sustrato con un promedio (59.1 %) que se encuentra dentro del ámbito documentado por varios autores de entre 46 y 60 % (Garzón-Ferreira y Díaz, 2003; Garzón-Ferreira y Rodríguez-Ramírez, 2003; Martínez y Acosta, 2005). Según esto, no hay evidencia de un aumento generalizado reciente de las algas, a pesar de que este grupo ha incrementado su cobertura en los últimos años en algunos sitios del área estudiada (Garzón-Ferreira et al., 2000; Martínez y Acosta, 2005; Rodríguez-Ramírez et al., 2005). De cualquier forma, la dominancia de las algas refleja en parte el deterioro coralino y puede ser clave en los procesos de recuperación de la cobertura de coral, debido a que colonizan rápidamente espacios disponibles originados por mortalidad coralina, son fuertes competidoras de los corales (McCook et al., 2001; Buddemeier et al., 2004) e impiden el crecimiento de corales adultos y el asentamiento de nuevos reclutas (Garzón-Ferreira et al., 2000; Rogers y Miller, 2006).
Por otra parte, considerando que la presencia de algas se debe interpretar como una consecuencia mas no como una causa de mortalidad coralina (McCook et al., 2001; Mejía-Niño y Garzón-Ferreira, 2003), se sugiere que el deterioro arrecifal del área ha llevado a que el principal componente de la estructura actual en los arrecifes de Santa Marta sean las algas. Sumado a lo anterior y teniendo en cuenta que los factores de estrés coralino presentes en el área de estudio, tales como reducción de herbívoros, contaminación, sedimentación, depredación, pesca con dinamita y enfermedades coralinas (Díaz et al., 2000) pueden favorecer el desarrollo algal (Carpenter, 1986; Hollock et al., 1993; McCook, 1999), se presume que la predominancia de las algas se mantenga en el tiempo.
A nivel de estaciones, las algas alcanzaron valores más altos cerca a los centros urbanos, en lugares como Punta Venado, Punta Betín y Morro Rodadero (PV-P, PB-P y MR-E). En contraste, los valores más bajos se asociaron a sitios expuestos al oleaje y/o lejanos a centros urbanos como Aguja (AG-E), Gayraca (BG-Ea), Neguanje (BN-P) y Chengue (CH-E). Aunque la distribución y abundancia de las algas puede estar influenciada por muchos factores, este patrón sugiere que la mayor presencia de algas se relaciona con los arrecifes más afectados por las actividades humanas y descargas continentales, quizás como consecuencia del detrimento de los corales. En este sentido, autores como Acosta (1994), Zea (1994) y Martínez y Acosta (2005) han registrado cambios en las formaciones coralinas del área que implican entre otros, mortalidad coralina y reemplazo de corales por algas y/o esponjas principalmente, como resultado de las condiciones estresantes (fuerte influencia de aguas continentales, altas tasas de sedimentación y contaminación) a las que han estado sometidos los corales en cercanías de los centros urbanos en las últimas décadas.
Los bajos porcentajes de cobertura coralina en las estaciones cercanas a la ciudad de Santa Marta contrastan con los registrados hacia el nororiente en el PNNT (ver Tabla 1), donde la mayoría de estaciones (desde AG-E hacia el nororiente) exceden la cobertura promedio de 29.5 % del área. Este patrón coincide con el descrito por Acosta (1994) y Zea (1994), quienes lo atribuyen a un gradiente ambiental de mejores condiciones hacia el Tayrona (menor contaminación, sedimentación e influencia de descargas continentales). Sobresale en este estudio la estación BG-Ea, la cual tiene la mayor cobertura de coral (62.0 %) y una de las menores de algas (32.4 %). Estos resultados son acordes con los de Garzón-Ferreira y Cano (1991) y Rodríguez-Ramírez et al. (2005), quienes catalogan esta formación como saludable y notable por su alta abundancia coralina. Por el contrario, Punta Betín (PB-P) se destaca por su baja cobertura de coral (4.0 %) y alta cobertura de algas (76.6 %). Al respecto, Martínez y Acosta (2005) encontraron que en el área de Santa Marta (y el PNNT) las comunidades coralinas han sufrido una reducción del 13.8 % en su cobertura coralina promedio en la última década y advierten sobre el riesgo de desaparición de estos arrecifes.
Si bien varios de los sitios evaluados se ajustan al esquema generalizado de arrecifes dominados por algas y no por corales, como los observados en el Gran Caribe y varias localidades en Colombia (Done, 1992; Zea, 1993; Hughes, 1994; Díaz-Pulido et al., 2004; Acosta y Martínez, 2006), también es interesante que el PNNT existen arrecifes que presentan un patrón inverso -AG-E, CH-E, BG-Ea y BN-P- (ver Tabla 1). Por lo tanto, se debe tener especial atención en el manejo y protección de estos sitios, ya que podrían ser claves en el mantenimiento de las comunidades coralinas del área.
Dentro de las especies más abundantes (C. natans, D. strigosa, M. cavernosa y A. palmata) es importante señalar que A. palmata no se había reconocido como dentro de las más abundantes en el área (Garzón-Ferreira y Cano, 1991; Zea, 1994; Martínez y Acosta, 2005). Seguramente esto se debe a que esta especie no está ampliamente distribuida en el área, sino confinada a sitios someros y con alta intensidad de oleaje (Garzón-Ferreira et al., 2004). Por lo tanto, su abundancia relativa cobra relevancia, más aun si se tiene en cuenta que la condición de esta especie en el PNNT parece mejor que en otras áreas del Caribe colombiano, y puede ser clave para fines de conservación y restauración (Garzón-Ferreira et al., 2004).
Prevalencia de enfermedades y blanqueamiento
Las prevalencias generales de enfermedades y blanqueamiento registradas en este estudio (<4 %, Tabla 1) se pueden considerar bajas cuando se comparan con otras evaluaciones (Weil et al., 2000; Rodríguez-Ramírez et al., 2005, 2006). Esto sugiere que ambos factores tuvieron un papel secundario en la pérdida de cobertura viva durante el periodo de estudio en el área evaluada. No obstante, a nivel de estaciones las enfermedades podrían tener un rol más determinante en la pérdida de cobertura coralina. Así, las estaciones CH-E y BG-Eb se diferenciaron de las otras al presentar una alta prevalencia de enfermedades (25.0 % y 15.1 % respectivamente, Tabla 1), especialmente de serratiosis o White pox en A. palmata, la cual es específica de esa especie (Patterson et al., 2002; Sutherland et al., 2004).
Después de WPx, PB y LO fueron las enfermedades que presentaron la mayor prevalencia en el área de Santa Marta, acorde con Rodríguez-Ramírez et al. (2005, 2006). PB afectó el mayor número de especies coralinas, lo cual no es extraño porque según varios trabajos esta enfermedad se encuentra ampliamente distribuida en otras áreas del Caribe y ataca a gran número de especies de corales escleractíneos (Garzón-Ferreira et al., 2001; Sutherland et al., 2004; Rogers y Miller, 2006). Sin embargo, en esta investigación PB fue especialmente prevalente en BN-P y MR-P sobre C. natans, estaciones donde además se encontraron las mayores densidades de dicha especie, por lo que este coral podría ser más susceptible a esta enfermedad.
Los resultados encontrados para WPx en A. palmata y para PB en C. natans en el área de estudio sugieren que en ocasiones puede ser más determinante para la prevalencia de enfermedades la susceptibilidad de las especies que las condiciones medio ambientales. Se deben adelantar estudios o implementar el monitoreo de los hábitats que presentaron alta prevalencia de WPx y PB, de manera que pueda establecerse el rol de estas enfermedades en la pérdida de la cobertura coralina.
En cuanto al blanqueamiento, la mayoría de estaciones relativamente cercanas a Santa Marta presentaron colonias con signos de este fenómeno (Tabla 1). Dado que antes y durante la época de muestreo no se registró un fenómeno de blanqueamiento en el área de estudio, los signos de esta condición de deterioro debieron estar relacionados probablemente con factores que producen estrés, como la turbidez del agua y sedimentación (Zea, 1991; Garzón-Ferreira y Díaz, 2003; Jokiel, 2004).
Complejidad del sustrato
Para el área de Santa Marta y en general para Colombia, son escasos los antecedentes sobre la evaluación de la complejidad del sustrato arrecifal. Información de este tipo es importante a la hora de determinar cambios en su andamiaje, ya que puede ser un indicador de cambios estructurales del arrecife asociados a fuertes perturbaciones físicas (Aronson et al., 1994). De esta forma, la rugosidad promedio del área de Santa Marta (1.8) indica que las formaciones coralinas presentan una complejidad media-alta, al estar cerca al límite superior del ámbito registrado para el Gran Caribe -entre 1.1 y 2.1 en México y Barbados respectivamente- (CARICOMP, 1997). La mayor complejidad en CH-E y BG-Eb se explica por la dominancia del coral A. palmata. Por el contrario, CA-P, al poseer altos valores de cobertura de sustrato abiótico, principalmente arena, obtuvo la menor complejidad. Para el caso de PB-P, la escasa presencia de corales podría explicar el bajo valor de rugosidad, al igual que la representatividad de las algas y esponjas en esta estación (Tabla 1; Vega-Sequeda, 2006). En este sentido Hollock et al. (1993) y Ceccarelli et al. (2001) afirman que cuando estos organismos comienzan a reemplazar al coral el arrecife comienza a erosionarse, por lo tanto, la rugosidad es afectada por los procesos erosivos de los arrecifes. De otro lado, si se considera que A. palmata genera mayor complejidad y por lo tanto hábitats y refugios para peces y otros organismos (Szmant, 1997; Garzón-Ferreira et al., 2004; Weil, 2004), sería interesante para el área de Santa Marta explorar si dichos ambientes u otros con alta complejidad (como los arrecifes rocosos) están favoreciendo la diversidad y abundancia de organismos.
Distribución espacial
En general, las estaciones se agruparon de acuerdo al nivel de protección, es decir, si se localizaban dentro o fuera del Parque. Las estaciones que están fuera del PNNT (Figura 2, grupo C) se segregaron de aquellas dentro del Parque o sus límites (grupo A, B y gran parte del grupo D; Figura 2). Aunque esta separación no es una evidencia directa de la efectividad del área marina protegida del PNNT en la conservación, sugiere que las condiciones para desarrollo de los corales son mejores dentro de éste. De otra parte, los componentes característicos del análisis inverso (que obtuvieron un porcentaje acumulado mayor al 70 %, ver Tabla 2), mostraron que cada asociación se ajustó en cierta medida a las unidades ecológicas propuestas por Díaz et al. (2000). De esta forma, el grupo A corresponde a la unidad A. palmata-D. strigosa, por la dominancia de la primera especie y la gran cobertura de algas calcáreas; el grupo C a la unidad de octocorales-esponjas, en la que existe un mejor desarrollo de estos componentes con respecto al de los corales duros; el grupo D con la unidad de Montastraea spp. o la de corales mixtos en la que se observan frecuentemente especies de corales pétreos masivos. Para el grupo B se encontró una unidad no descrita por Díaz et al. (2000), donde predomina la especie C. natans.
Adicionalmente, se sugiere que en la región de Santa Marta los arrecifes se pueden distribuir en dos grandes grupos: 1-aquellos con altas coberturas de algas (55.3 - 76.6 %), bajas coberturas coralinas (4.0 - 31.8 %), y ubicados fuera del PNNT (cerca de las fuentes de estrés) y 2-aquellos caracterizados por un mosaico de hábitats con mejor representación de corales (24.4 - 62.0 %) y localizados dentro del PNNT o en los límites de transición entre el Parque y los centros urbanos. Este esquema modifica en parte el concepto del gradiente propuesto por Acosta (1994) y Zea (1994) de incremento coralino hacia el Parque, porque identifica que al interior del PNNT lo que se puede apreciar es una gran variabilidad en las coberturas coralinas, que no necesariamente reflejan un aumento progresivo de los corales hasta aquellos arrecifes más alejados de los centros urbanos.
Pese a los numerosos trabajos realizados en el área, con excepción del realizado hace 15 años por Garzón-Ferreira y Cano (1991), con esta investigación se pudo establecer en una escala espacial amplia la condición actual de las formaciones coralinas del área de Santa Marta. Aunque los arrecifes evaluados presentan diferentes estados, la tendencia generalizada es que el componente predominante del sustrato sean las algas. Las formaciones con mejores coberturas coralinas se encontraron dentro del PNNT en Aguja, Chengue, Gayraca y Neguanje, por lo tanto se recomienda realizar investigaciones para establecer que características han permitido el mantenimiento de estos sitios, de manera que esta información sirva para implementar medidas de protección adicionales a las que actualmente tiene el Parque. En el corto plazo se sugiere considerar zonas intangibles bajo el principio de precaución, ya que estas formaciones pueden estar desempañando un papel clave para el mantenimiento de la biodiversidad del área.
AGRADECIMIENTOS
Este estudio se realizó gracias apoyo financiero de COLCIENCIAS (proyecto N° 21-05-09-16826) y al apoyo financiero y logístico del Instituto de Investigaciones Marinas y Costeras (INVEMAR), en el marco del proyecto: "Estado de las comunidades de peces arrecifales del área de Santa Marta: un soporte para el manejo del AMP Parque Nacional Natural Tayrona". Estos resultados hicieron parte del trabajo de pregrado del primer autor. Muchas gracias a Julián Olaya y a Eduardo Vilarete por su ayuda en el trabajo de campo, a Jaime Garzón por su apoyo en el desarrollo de la tesis y a Fabián Cortés por su asesoría estadística.
BIBLIOGRAFÍA
1 Acosta, L. 1994. Contamination gradient and its effect on the coral community structure in the Santa Marta area, Colombian Caribbean. 233-239. En: Ginsburg, R.N (Ed.). Proceedings of the Colloquium on Global Aspect of Coral Reefs. Health, Hazards and History, RSMAS, University of Miami, Miami. 420 p. [ Links ]
2 Acosta, L. y S. Martínez. 2006. Continental and oceanic coral reefs in the Colombian Caribbean after a decade of degradation. Proc. 10th Int. Coral Reef Symp., 1926-1930. [ Links ]
3 Aerts, L. 2000. Dynamics behind standoff interactions in three reef sponge species and the coral Montastraea cavernosa. Mar. Ecol., 21 (3-4): 191 p. [ Links ]
4 Aerts, L. y R. Soest. 1997. Quantification of sponge/coral interactions in a physically stressed reef community, NE Colombia. Mar. Ecol. Prog. Ser., 148: 125-134. [ Links ]
5 Antonius, A. 1972. Ocurrence and distribution of stony corals (Anthozoa and Hydrozoa) in the vicinity of Santa Marta, Colombia. Mitt. Inst. Colombo-Alemán Invest. Cient., 6: 89-103. [ Links ]
6 Aronson, R., P. Edmuns, W. Precht, D. Swanson y D. Levitan. 1994. Large-scale, long-term monitoring of Caribbean coral reefs: Simple, quick, inexpensive techniques. Atoll. Res. Bull., 421, 19 p. [ Links ]
7 Birkeland, C. (Ed.). 1997. Life and death of coral reefs. Chapman and Hall, Nueva York, 536 p. [ Links ]
8 Brown, B.E. 1997. Disturbances to reefs in recent times. 354-379. En: Birkeland, C. (Ed.). Life and death of coral reefs. Chapman and Hall, Nueva York. [ Links ]
9 Buddemeier, R., J. Kleypas, y R. Aronson. 2004. Coral reefs and global climate change: Potential contributions of climate change to stresses on coral reef ecosystems. Pew Center on Global Climate Change, Arlington, E.E.U.U. 44 p. [ Links ]
10 Bula-Meyer, G. 1985. Un núcleo de surgencia en el Caribe colombiano detectado en correlación con las macroalgas. Boletín Ecotrópica, 12: 2-26. [ Links ]
11 CARICOMP. 1994. CARICOMP manual de métodos nivel 1: manual de métodos para el mapeo y monitoreo de parámetros físicos y biológicos en la zona costera del Caribe. DMC CARICOMP, Univ. West Indies, Kingston. 68 p. [ Links ]
12 CARICOMP. 1997. CARICOMP monitoring of coral reefs. Proc. 8th Int. Coral Reef Symp., 1: 651-656. [ Links ]
13 CARICOMP. 2001. Methods manual levels 1 and 2: manual of methods for mapping and monitoring of physical and biological parameters in the coastal zone of the Caribbean. CARICOMP Data Management Center. Univ. West Indies, Kingston. 85 p. [ Links ]
14 Carpenter, R. 1986. Partitioning herbivory and its effects on coral reefs algal communities. Ecol. Monogr., 56(4): 345-363. [ Links ]
15 Ceccarelli, D., G. Jones y L. McCook. 2001. Territorial damselfishes as determinants of the structure of benthic communities on coral reefs. Oceanogr. Mar. Biol., 39: 355-389. [ Links ]
16 Chiappone, M. y M. Sullivan. 1994. Ecological structure and dynamics of nearshore hard-bottom communities in the Florida Keys. Bull. Mar. Sci., 54 (3): 747-756. [ Links ]
17 Clarke K. y R. Warwick. 1994. Change in marine communities: An approach to statistical analysis and interpretation. Natural Environmental Research Council, Reino Unido. 144 p. [ Links ]
18 Crisci, J. y M. López. 1983. Introducción a la teoría y práctica de la taxonomía numérica. OEA, Serie de Biología. Monografía No. 26, 132 p. [ Links ]
19 DANE, 2007. Censo general 2005. Información básica. Población y vivienda: variables de personas. DANE. Colombia. http://190.25.231.242/cgibin/RpWebEngine.exe/PortalAction?& MODE=MAIN& BASE=CG2005BASICO& MAIN=WebServerMain.inl. 06/07/08. [ Links ]
20 Díaz, J.M., G. Díaz-Pulido, J. Garzón-Ferreira, J. Geister, J. Sánchez y S. Zea. 1996. Atlas de los arrecifes coralinos del Caribe colombiano: I. Complejos arrecifales oceánicos. INVEMAR, Serie de publicaciones especiales No. 2, Santa Marta. 83 p. [ Links ]
21 Díaz, J.M., L. Barrios, M. Cendales, J. Garzón-Ferreira, J. Geister, M. Lopez-Victoria, G. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F. Zapata, y S. Zea. 2000. Áreas coralinas de Colombia. INVEMAR, Serie de publicaciones especiales No. 5, Santa Marta. 175 p. [ Links ]
22 Díaz-Pulido, G., J. Sánchez, S. Zea, J. Díaz y J. Garzón-Ferreira. 2004. Esquemas de distribución espacial en la comunidad bentónica de arrecifes coralinos continentales y oceánicos del Caribe colombiano. Rev. Acad. Colomb. Cienc., 24 (108): 337-347. [ Links ]
23 Done, T. 1992. Phase shifts in coral communities and their ecological significance. Hydrobiologia, 247: 121-132. [ Links ]
24 Erhardt, H. y B. Werding. 1975. Los corales (Anthozoa e Hidrozoa) de la bahía de Santa Marta, Colombia. Bol. Mus. Mar. 7: 3-50. [ Links ]
25 Franco, A. 2005. Oceanografía de la ensenada de Gaira -El Rodadero-, más que un centro turístico en el Caribe colombiano. Universidad de Bogotá Jorge Tadeo Lozano, Santa Marta. 58 p. [ Links ]
26 Garzón-Ferreira, J. 1997. Arrecifes coralinos: ¿Un tesoro camino a la extinción? Ciencia y Tecnología, 15 (1): 11-19. [ Links ]
27 Garzón-Ferreira, J. 1998. Bahía Chengue, Parque Natural Tayrona, Colombia. 115 - 125. En: Kjerve, B. (Ed.). Caribbean Coastal Marine Productivity (CARICOMP): Caribbean coral reef, seagrass and mangrove site characteristics. UNESCO, París. [ Links ]
28 Garzón-Ferreira, J. y Cano, M. 1991. Tipos, distribución, extensión y estado de conservación de los ecosistemas marinos del Parque Nacional Natural Tayrona. FEN COLOMBIA (Fondo para la Protección del Medio Ambiente), Santa Marta. 82 p. [ Links ]
29 Garzón-Ferreira, J. y J.M. Díaz. 2003. The Caribbean coral reefs of Colombia. 275-301. En: Cortés, J. (Ed.). Latin American Coral Reefs. Elsevier Science B.V., Ámsterdam. [ Links ]
30 Garzón-Ferreira, J. y M. Kielman. 1994. Extensive mortality of corals in the Colombian Caribbean during the last two decades. 247-253. En: Ginsburg, R.N (Ed.). Proceedings of the Colloquium on Global Aspect of Coral Reefs. Health, Hazards and History. RSMAS, University of Miami, Miami. 420 p. [ Links ]
31 Garzón-Ferreira, J., D. Gil-Agudelo, B. Marín, N. Mejía-Niño, A. Rodríguez-Ramírez y J. Rojas-Ruíz. 2000. Evaluación preliminar de algunos indicadores de contaminación de origen terrestre en áreas coralinas de la región de Santa Marta, Caribe colombiano: informe de resultados. INVEMAR, Santa Marta. 55 p. [ Links ]
32 Garzón-Ferreira, J., D. Gil-Agudelo, L. Barrios y S. Zea. 2001. Stony coral diseases observed in southwestern Caribbean reefs. Hydrobiología, 460: 65-69. [ Links ]
33 Garzón-Ferreira, J., M. Reyes-Nivia y A. Rodríguez-Ramírez. 2002. Manual de métodos del SIMAC: Sistema Nacional de Monitoreo de Arrecifes Coralinos en Colombia. INVEMAR, Santa Marta. 102 p. [ Links ]
34 Garzón-Ferreira, J., M. Moreno-Bonilla y J. Valderrama. 2004. Condición actual de las formaciones coralinas de Acropora palmata y A. cervicornis en el Parque Nacional Natural Tayrona (Colombia). Bol. Invest. Mar. Cost., 33: 117-136. [ Links ]
35 Hoegh-Guldberg, O. 1999. Climate change, coral bleaching and the future of the world's coral reefs. Mar. Freshwater Res., 50: 839-866. [ Links ]
36 Hollock, P, F.E. Müller-Karger y J.C. Halas. 1993. Coral reef decline. Nat. Geogr. Res. Explor., 9 (3): 358-378. [ Links ]
37 Hughes, T. 1994. Catastrophes, phase shifts, and large-scale degradation of a Caribbean coral reef. Science, 265:1547-1551. [ Links ]
38 Hughes, T.P y J.H. Conell. 1999. Multiple stressors on coral reefs: A long-term perspective. Limnol. Oceanogr., 44 (3, part 2): 932-940. [ Links ]
39 Jokiel, P. 2004. Temperature stress and coral bleaching. 401-425. En: Rosenberg, E. y Y. Loya (Eds.). Coral health and disease. Springer, Alemania. [ Links ]
40 Kaandorp, J. 1986. Rocky substrate communities of the infralittoral fringe of the Boulonnais coast, NW France: A quantitative survey. Mar. Biol., 92: 255-265. [ Links ]
41 Knowlton, N. 2001. The future of coral reefs. Proc. Nat. Acad. Sci., 98 (10): 5419-5425. [ Links ]
42 Martínez, S. y A. Acosta. 2005. Cambio temporal en la estructura de la comunidad coralina del área de Santa Marta - Parque Nacional Natural Tayrona (Caribe colombiano). Bol. Invest. Mar. Cost., 34: 161-191. [ Links ]
43 McCook, L. 1999. Macroalgae, nutrients and phase shifts on coral reefs: Scientific issues and management consequences for the Great Barrier Reef. Coral Reefs, 18 (4): 357-367. [ Links ]
44 McCook, L., J. Jompa y G. Díaz-Pulido. 2001. Competition between corals and algae on coral reefs: A review of evidence and mechanisms. Coral Reefs, 19: 400-417. [ Links ]
45 McCune, B. y J. Grace. 2002. Analysis of ecological communities. MjM Software Design, Nueva York. 300 p. [ Links ]
46 Mejía-Niño, N. y J. Garzón-Ferreira. 2003. Dinámica de las interacciones alga-coral en dos bahías de la región de Santa Marta (Caribe colombiano) con distinto grado de influencia antropogénica. Bol. Inv. Mar. Cost., 32: 243-261. [ Links ]
47 Patterson, K., J. Porter, K. Ritchie, S. Polson, E. Mueller, E. Peters, D. Santavy y G. Smith. 2002. The etiology of white pox, a lethal disease of the Caribbean elkhorn coral, Acropora palmata. Proc. Nat. Acad. Sci, 99 (13): 8725-8730. [ Links ]
48 Ramírez, G. 1983. Características fisicoquímicas de la bahía de Santa Marta (agosto 1980-julio 1981). An. Inst. Inv. Mar. Punta Betín, 13: 111-121. [ Links ]
49 Rodríguez-Ramírez, A y J. Garzón-Ferreira. 2003. Monitoreo de arrecifes coralinos, pastos marinos y manglares en la bahía de Chengue (Caribe colombiano): 1993-1999. INVEMAR, Serie de publicaciones especiales No. 8, Santa Marta. 170 p. [ Links ]
50 Rodríguez-Ramírez, A., J. Garzón-Ferreira, S. Bejarano-Chavarro, R. Navas-Camacho, M. Reyes-Nivia, G. Duque, C. Orozco, F. Zapata y O. Herrera. 2005. Estado de los arrecifes coralinos en Colombia. 77-114. En: Informe del estado de los ambientes marinos y costeros en Colombia: año 2004. INVEMAR, Serie de publicaciones periódicas. No 8, Santa Marta. [ Links ]
51 Rodríguez-Ramírez, A., M. Reyes-Nivia, R. Navas-Camacho, S. Bejarano, J. Garzón-Ferreira y F. Zapata. 2006. Status of the coral reefs of Colombia in 2003. Proc. 10th Int. Coral Reef Symp., 976-981. [ Links ]
52 Rogers, C. y J. Miller. 2006. Permanent 'phase shifts' or reversible declines in coral cover? Lack of recovery of two coral reefs in St. John, US Virgins Islands. Mar. Ecol. Prog. Ser., 306: 103-114. [ Links ]
53 Sutherland, K., J. Porter y C. Torres. 2004. Diseases and immunity in Caribbean and Indo-Pacific zooxanthellate corals. Mar. Ecol. Prog. Ser., 266: 273-302. [ Links ]
54 Szmant, A. 1997. Nutrient effects on coral reefs: A hypothesis on the importance of topographic and trophic complexity to reef nutrient dynamics. Proc. 8th Int. Coral Reef Symp., 2: 1527-1532. [ Links ]
55 Vega-Sequeda, J. 2006. Estado de las formaciones coralinas del área de Santa Marta: estado y patrones de distribución espacial de la comunidad bentónica. Tesis Biol. Mar., Universidad Jorge Tadeo Lozano, Santa Marta. 72 p. [ Links ]
56 Weil, E. 2004. Coral reef diseases in the wider Caribbean. 35-68. En: Rosenberg, E. y Y. Loya (Eds.). Coral health and disease. Springer, Alemania. [ Links ]
57 Weil, E., I. Urreiztieta y J. Garzón-Ferreira. 2000. Geographic variability in the incidence of coral and octocoral diseases in the wider Caribbean. Proc. 9th Int. Coral Reef Symp., 2: 1231-1238. [ Links ]
58 Werding, B. y H. Sánchez. 1988. Deterioro observado en las formaciones coralinas de la bahía de Santa Marta, Colombia. An. Inst Inv. Mar. Punta Betín, 18: 9-16. [ Links ]
59 Zar, J. 1996. Biostatistical analysis. 3a ed. Prentice-Hall, Nueva Jersey. 662 p. [ Links ]
60 Zea, S. 1991. Establecimiento de estaciones base para monitorear el efecto de condiciones naturales y de origen humano en comunidades coralinas de Santa Marta y Parque Nacional Natural Tayrona. Informe final, INVEMAR, Santa Marta. 62 p. [ Links ]
61 Zea, S. 1993. Cover sponge and other sessile organism in rocky and coral reef habitats of Santa Marta, Colombian Caribbean Sea. Carib. J. Sci., 29 (1-2):75-88. [ Links ]
62 Zea, S. 1994. Patterns of coral and sponge abundance in stressed coral reefs at Santa Marta, Colombian Caribbean. 257-264. En: Soest, R., van Kempen y J. Bracekman, (Eds). Sponge in time and space. Balkema, Rótterdam. [ Links ]
63 Zea, S. y F. Duque-Tobón. 1989. Bleaching of reef organisms in the Santa Marta region, Colombia. Trianea (Act. Cient. Tecn., INDERENA), 3: 37-51. [ Links ]
FECHA DE RECEPCIÓN: 12/01/07 FECHA DE ACEPTACIÓN: 24/08/08