Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.37 no.2 Santa Marta July/Dec. 2008
CONTENIDOS DE CADMIO, COBRE, ZINC Y PLOMO EN ÓRGANOS DE RHIZOPHORA MANGLE DE LA CIÉNAGA GRANDE DE SANTA MARTA, CARIBE COLOMBIANO.
CONTENTS OF CADMIUM, COPPER, ZINC, AND LEAD IN ORGANS OF RHIZOPHORA MANGLE IN RIVER SEVILLA MOUTH-CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIAN CARIBBEAN.
Yury A. Naranjo-Sánchez1 y Walberto Troncoso-Olivo2
1Universidad del Magdalena, Santa Marta, Colombia. yurimar2001@yahoo.com
2Instituto de Investigaciones Marinas y Costeras (INVEMAR), Cerro Punta Bettín, A.A. 1016, Santa Marta, Colombia. wtroncoso@invemar.org.co
RESUMEN
Para determinar los contenidos de cadmio, cobre, zinc y plomo en hojas, tallos y raíces de Rhizophora mangle se tomaron muestras en tres parcelas ubicadas en la desembocadura del río Sevilla-Ciénaga Grande de Santa Marta, en octubre de 2003. Las mediciones de las concentraciones de metales, se hicieron mediante la técnica de espectrometría de emisión atómica de plasma inductivamente acoplado (ICP-AES). Los resultados indicaron que la concentración de plomo en órganos de R. mangle estuvo bajo el límite de detección del método utilizado (<2.38 μg/g), a excepción de las raíces absorbentes (16.3 μg/g); y que existen diferencias significativas en los contenidos de cadmio, cobre y zinc entre órganos de R. mangle, encontrándose el siguiente orden de concentración: raíces absorbentes > tallo > hojas jóvenes > hojas adultas > raíces aéreas.
PALABRAS CLAVE: Manglar, Rhizophora mangle, Metales pesados, Ciénaga Grande de Santa Marta, Colombia.
ABSTRACT
In order to determine the contents of cadmium, copper, zinc, and lead in leaves, stalks, and root of Rhizophora mangle, samples from three parcels located in the river Sevilla mouth - Ciénaga Grande de Santa Marta, were taken in October 2003. Measures of metals concentrations were made through the Inductively Coupled Plasma Atomic Emission Spectrometry technique (ICP-AES). The results indicated that lead concentration in R. mangle organs was below method detection limit (<2.38 μg/g) except the absorbent root (16.3 μg/g); and significant differences exist in the contents of cadmium, copper, zinc, and lead into R. mangle organs, following this concentration order: absorbent roots > stalk > young leaves > adult leaves > aerial roots.
KEY WORDS: Mangrove, Rhizophora mangle, Heavy metals, Ciénaga Grande de Santa Marta, Colombia.
INTRODUCCIÓN
Entre las principales fuentes de contaminación acuática se encuentran las producidas por actividades urbanas, industriales y agrícolas; las cuales generan una gran cantidad de residuos que generalmente sin tratamientos adecuados son vertidos a los ríos, siendo estos los más importantes medios de transporte y descarga hacia el mar (Gamboa y Bonilla, 1983). Por lo anterior, el equilibrio natural en cuanto a las condiciones del entorno en los ecosistemas marinos y costeros se ha visto alterado en las últimas décadas por un marcado aumento de contaminantes, entre los que se encuentran los metales pesados, los cuales han recibido especial atención debido a sus efectos tóxicos duraderos (Lacerda et al., 1988), a su baja biodegradabilidad (Aquino, 1980; Campos, 1990) y a su intensiva acumulación en ambientes costeros y estuarinos en donde generalmente se desarrollan ecosistemas de manglar (Lacerda y Abráo, 1984).
En el sistema lagunar de la Ciénaga Grande de Santa Marta (CGSM) los manglares bordean el inmenso complejo de ciénagas y canales; allí la producción y exportación de materia orgánica por los manglares es alta y está relacionada con la gran productividad de la ciénaga (Hernández et al., 1980). La ecorregión CGSM sufrió un proceso de degradación paulatino del sistema natural, principalmente por actividades antrópicas que generaron una variación en las condiciones hidráulicas del sistema. Lo cual causó un aumento en la salinidad de los suelos y el agua, la desaparición de más de la mitad del bosque de manglar nativo y el incremento en la sedimentación y contaminación química (INVEMAR, 2002). Los trabajos de recuperación y rehabilitación del sistema lagunar de la CGSM y de los bosques de manglar asociados a este se iniciaron en 1995, involucrando la reapertura de varios canales que comunican al río Magdalena con la CGSM, con el fin de restablecer el flujo de agua dulce a los terrenos del manglar (Perdomo et al., 1999).
Pese a todo el proceso de rehabilitación, se sabe que las principales descargas de contaminantes hacia la CGSM provienen del río Magdalena, a través de los caños de intercomunicación y otras escorrentías menores; así como de las áreas dedicadas a los cultivos agroindustriales, ubicadas en el margen oriental de la CGSM y el piedemonte de la Sierra Nevada de Santa Marta (SNSM) en las cuales se aplican grandes cantidades de plaguicidas (Marín, 2003). Las mediciones de metales pesados en tejidos de árboles de manglar de la CGSM son pocas; existe al respecto el trabajo de Campos y Gallo (1997), en donde básicamente se determinaron los niveles de Cd, Cu y Zn en hojas de R. mangle; sin embargo, la variación en los contenidos de metales pesados en diferentes tejidos de R. mangle no se ha tratado.
El Programa de Calidad Ambiental Marina del Instituto de Investigaciones Marinas y Costeras (INVEMAR) en el marco del proyecto "El manglar como biofiltro de contaminantes químicos", recopiló información durante un año sobre concentración de metales pesados en sedimentos y manglar. El objetivo del presente trabajo fue determinar los contenidos de cadmio, cobre, zinc y plomo en tejidos de R. mangle (hojas, tallo y raíz) de la CGSM, en el marco del proyecto señalado.
ÁREA DE ESTUDIO
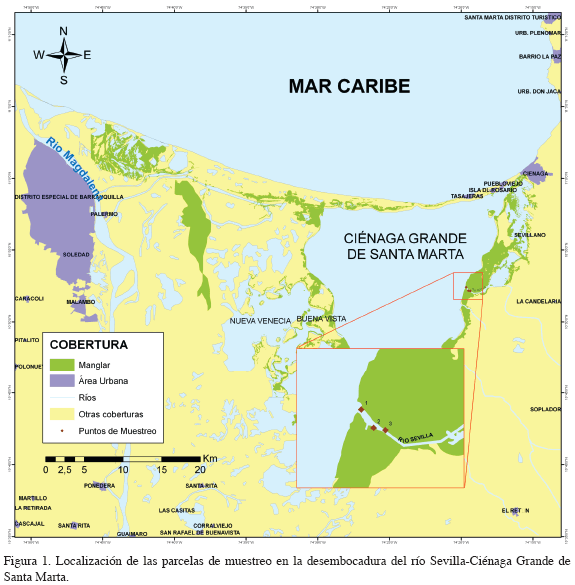
El trabajo de campo se realizó en la desembocadura del río Sevilla, al norte de Colombia. Este río se sitúa en la llanura fértil que hay entre la SNSM y la CGSM (bañada por numerosos ríos como Fundación, Aracataca, Tucurinca, Orihueca y Frío); es una región que históricamente ha influido sobre los patrones de circulación de la CGSM por las descargas de agua continental que realiza (Escobar, 1991). En la desembocadura del río Sevilla se mezclan la vegetación herbácea y arbórea, dando lugar a un bosque mixto con mayor participación de especies de ambientes pantanosos como cantagallo (Erythrina glauca), suán (Ficus dendrocida), pivijay (Ficus pallida), palma de nolí (Elaeis oleifera), buche (Pithecellobium lanceolatum), penda (Dalbergia brownei), Machaerium lunatum, Stigmaphyllum ovatum y Sacrostemma clausum (Hernández-Camacho et al., 1992), que es gradualmente reemplazada por bosques de manglar a medida que se acerca a la ciénaga. Los bosques localizados en esta vertiente de la CGSM se encuentran en buen estado, con la excepción de los de manglar de la laguna Sevillano, cerca a la Boca de la Barra, donde se encuentran áreas de manglar muerto.
La región alrededor del sistema de la CGSM es muy árida (Gónima et al., 1998) con dos épocas climáticas bien definidas; la de verano (sequía mayor) entre diciembre y abril; la de invierno (lluvia mayor) entre septiembre y noviembre y las temporadas menores (transición) de lluvias y sequía en mayo- junio y de julio-agosto, respectivamente (Bula, 1977; Blanco et al., 2005). Aunque este patrón climático no siempre se conserva entre años, es la tendencia general que presentan los datos analizados.
Se seleccionó esta zona teniendo en cuenta que existe un denso y saludable bosque de manglar formado por Avicennia germinans y Laguncularia racemosa, con predominancia de Rhizophora mangle en las orillas del río expuesto a la descarga de residuos provenientes de la SNSM, con un gran aporte de materia orgánica terrestre y de contaminantes químicos desde las zonas de cultivos aledaños a su ribera (Perdomo y Schnetter, 2004). Además, se tiene un registro de datos sobre concentraciones de metales pesados con el monitoreo llevado a cabo entre 1995 y 2002, en el cual se encontraron las mayores concentraciones para algunos elementos en la CGSM; 0.6 y 0.11 μg/g ps de Cd y Hg respectivamente (INVEMAR, 2002). Estas dos condiciones, predominancia de R. mangle y registro de alta concentración de metales pesados para la zona, eran necesarias para evaluar el bosque de manglar como posible biofiltro de metales pesados.
En la figura 1 se muestra la estación y puntos de muestreo en la desembocadura del río Sevilla-CGSM. Las parcelas de muestreo se distribuyeron en la desembocadura del río Sevilla de la siguiente manera: la parcela uno (10°52'24.4''N, 74°19'38.6W) se localizó en la zona de confluencia del río y la CGSM (punto más cercano a la Ciénaga), la parcela dos (10°52'11.3''N, 74°19'29.7''W) se ubicó en la parte media de la desembocadura y la parcela tres (10°52'9.7''N, 74°19'21.3''W) es el punto más adentrado al río. Las tres parcelas se tomaron teniendo en cuenta la predominancia de R. mangle en la ribera.
MATERIALES Y MÉTODOS
Fase de campo
Con el fin de determinar el contenido de cadmio, cobre, zinc y plomo, se realizó un muestreo en octubre de 2003, en el cual se tomaron muestras de hojas, tallos y raíces de R. mangle en tres parcelas establecidas en la desembocadura del río Sevilla-CGSM. Cada parcela de muestreo ubicada en la ribera del río, estuvo formada por tres árboles maduros y saludables de R. mangle; de cada uno se tomaron muestras de hojas jóvenes y viejas (entre 15 y 20 manualmente), tallos (se eliminó la corteza del tallo y se extrajo la parte interna raspándola con una navaja de vidrio), raíces absorbentes y aéreas (cortándolas manualmente con una navaja de vidrio). El material vegetal se puso en bolsas plásticas debidamente rotuladas, las cuales se colocaron en neveras plásticas refrigeradas mientras se transportaban al laboratorio de química del INVEMAR, en donde se refrigeraron hasta su posterior análisis. Para caracterizar la estación de muestreo se midieron variables in situ en el agua superficial y en la interfase agua-sedimento en cada parcela, tales como salinidad (salinómetro WTW LF330 en UPS), temperatura (conductímetro WTW LF330 dotado de un sensor térmico en °C), potencial rédox (conductímetro WTW pH/Ion340i/ set en mV) y pH (pHmetro WTW LF330); todos los instrumentos fueron previamente calibrados.
Fase de laboratorio
El material vegetal se secó por separado en un liofilizador (Freezone 4.5, a -47 °C y 127 x 10-3 mbar de presión). Cada muestra se maceró con un mortero de porcelana, se tomaron alícuotas de 0.4 g y se colocaron en tubos de teflón previamente lavados con HNO3 2N. Posteriormente a cada tubo se le adicionó una mezcla de ácidos nítrico y clorhídrico (HNO3-HCl) en proporción 2:1, después de lo cual se colocaron en un digestor a presión (marca Berghof Marssen) a 160 °C por tres horas y finalmente se diluyeron a 10 mL con HCl 0.1N (modificado de INVEMAR, 2002; Garay et al., 2003). En cada proceso de digestión se montaron cinco muestras y un blanco reactivo. Estos extractos fueron envasados en frascos de polipropileno hasta su análisis.
La determinación del contenido de metales en las muestras se realizó utilizando la técnica de espectrometría de emisión atómica de plasma inductivamente acoplado (ICP-AES), en una instalación espectrométrica marca SPECTRO (Spectroflame Modula, Operación Manual Versión 1.20), siguiendo el método descrito por Jarvis y Jarvis (1992), así como el manual de Garay et al. (2003). Para garantizar la veracidad de los resultados obtenidos se evaluaron los métodos analíticos empleados, determinando el porcentaje de recuperación, límite de detección, el límite de cuantificación, precisión y exactitud, realizando el procedimiento de extracción total en un material de referencia (TORT-2, certificada por el Laboratorio del Consejo Nacional de Investigadores de Canadá en el Programa de Estándares de Química Analítica Marina; NRC, 1994; Tabla 1) y análisis de muestras preparadas en laboratorio mediante el procedimiento de añadido recuperado; los resultados obtenidos para las muestras de manglar fueron comparados con los del material referente.
Todos los reactivos utilizados fueron de grado analítico, y todas las soluciones fueron preparadas con agua desionizada calidad Millipore. Todos los análisis se realizaron por duplicado y un blanco reactivo en cada análisis realizado.
Análisis de datos
Se establecieron promedios de los contenidos de cadmio, zinc y cobre en cada una de las tres parcelas (tres réplicas para cada órgano). Estos promedios (órganos de R. mangle) y los determinados por Parra y Espinosa (2007) en los sedimentos de las mismas parcelas de muestreo, fueron utilizados para calcular el factor de concentración (FCo), el cual describe la posible absorción o acumulación de metales pesados presentes en el medio circundante por parte del manglar (Lacerda et al., 1986), según la igualdad:
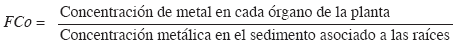
El FCo se interpreta de la siguiente manera: FCo>1, acumulación del metal en el tejido o planta; FCo=1, equilibrio entre las concentraciones del tejido y el medio; FCo<1, no hay acumulación del metal en el tejido o planta, la cual puede estar liberando activamente los iones que absorbe o también puede significar que el tejido aún no ha empezado el proceso de acumulación o que los iones son transferidos de un tejido a otro.
Previa comprobación de los supuestos de normalidad y homogeneidad de varianzas, se realizó un ANOVA factorial no paramétrico para determinar diferencias estadísticamente significativas en los contenidos de cadmio, cobre y zinc entre parcelas y entre órganos. Adicionalmente, se aplicaron los test de comparación múltiple de Dunnett T3 (Montgomery, 1991) para zinc y cadmio y de Games-Howell (SPSS Inc., 2002) para cobre. El uso de test diferentes para los metales se hizo teniendo en cuenta la sensibilidad y potencia que éstos tuvieran en cada grupo de datos para encontrar diferencias entre cada par de órganos.
RESULTADOS
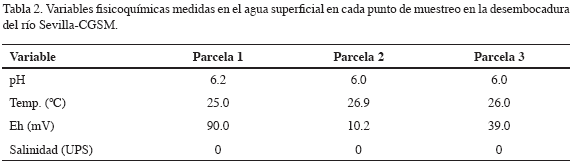
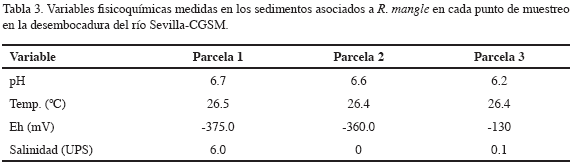
Los valores registrados para las variables físico-químicas medidas in situ (salinidad, pH, temperatura y potencial rédox) en agua superficial e interfase agua-sedimento respectivamente, se muestran en las tablas 2 y 3. Estas variables son de gran importancia ya que están estrechamente relacionadas a los procesos de solubilidad y biodisponibilidad de metales en estuarios (Head, 1976; Cross y Sunda, 1978; Davis, 1978; Campos y Gallo, 1997).
En general, la salinidad registró valores de 0 en agua superficial e interfase agua-sedimento, característicos de agua dulce, a excepción de la salinidad de 6 medida en la parcela más cercana a la ciénaga (parcela 1). La temperatura presentó valores promedio de 27 °C tanto en agua superficial y en sedimentos, permaneciendo casi constante en las tres parcelas. Para el potencial rédox (Eh), los valores más bajos se midieron en sedimentos con -375 mV y los valores más altos en agua superficial (90 mV); la tendencia del Eh medido en sedimentos fue de aumentar de la parcela 1 a la parcela 3, permaneciendo en el agua superficial con valores positivos en las tres parcelas. El pH medido para agua superficial y sedimentos (con promedios de 6.1 y 6.5 respectivamente) en las tres parcelas fue cercano a la neutralidad característica de aguas estuarinas (Garay et al., 2003).
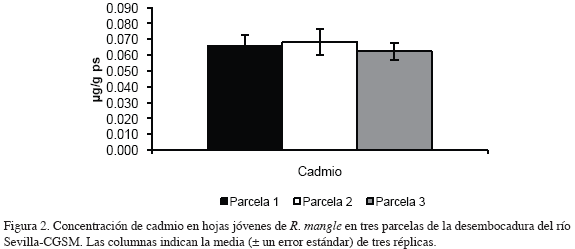
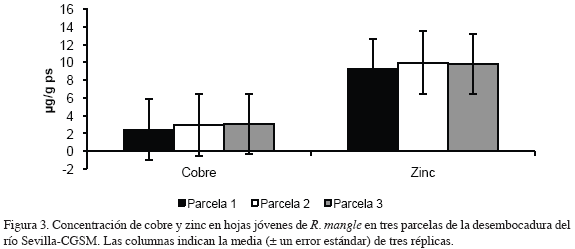
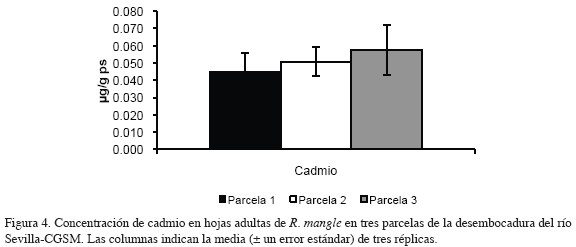
En las figuras 2, 3, 4 y 5 se muestran las concentraciones de los metales medidos en hojas jóvenes y adultas de R. mangle en tres parcelas de la desembocadura del río Sevilla-CGSM, respectivamente. La concentración de cadmio en hojas jóvenes fluctuó en un ámbito muy estrecho en las tres parcelas, con un contenido promedio de 0.065 μg/g ps (desviación estándar 0.006); en hojas adultas, la concentración de cadmio aumentó progresivamente de la parcela 1 a la 3, con valores mínimos y máximos de 0.045 y 0.057 μg/g ps respectivamente.
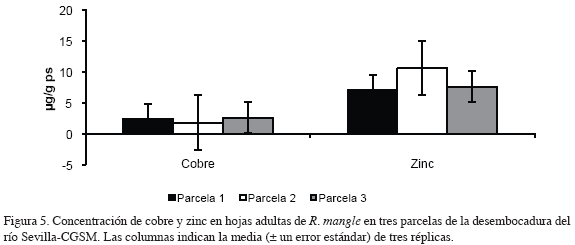
El contenido de cobre en hojas jóvenes mostró una tendencia a aumentar con respecto a la parcela más cercana a la ciénaga, con un valor máximo de 3.1 y mínimo de 2.44 μg/g ps (desviación estándar 0.348); en hojas adultas el contenido de cobre mostró valores máximos en las parcelas 1 y 3 de 2.38 y 2.59 μg/g ps respectivamente y un valor mínimo de 1.8 μg/g ps en la parcela 2 (desviación estándar 0.041). Los contenidos de zinc para hojas jóvenes y adultas mostraron un comportamiento similar; con valores máximos en la parcela 2 de 9.97 y 10.56 μg/g ps y valores mínimos en la parcela 1 de 9.25 y 7.08 μg/g ps respectivamente (desviación estándar 0.381). Las concentraciones de plomo medidas en hojas jóvenes y hojas adultas de R. mangle estuvieron bajo el límite de detección del método utilizado (<2.38 μg/g ps; Garay et al., 2003) y por esta razón no aparecen en las figuras y análisis de resultados.
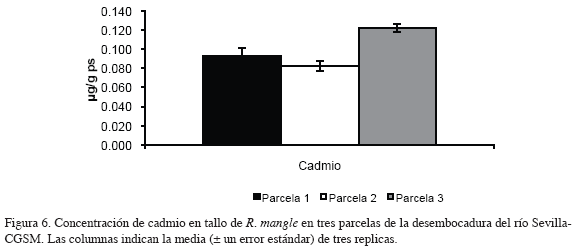
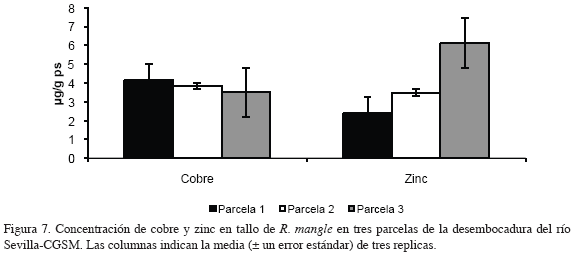
En las figuras 6 y 7 se muestran las concentraciones de los metales medidos en tallo de R. mangle en tres parcelas de la desembocadura del río Sevilla-CGSM.
El contenido de cadmio en tallo mostró un valor máximo de 0.12 μg/g ps en la parcela 3 y un promedio de 0.09 μg/g ps en las parcelas 1 y 2. Las concentraciones de cobre medidas en tallo en las tres parcelas tuvieron valores similares con promedios de 4.00 μg/g ps, y una tendencia a disminuir de la parcela 1 a la parcela 3.
Los contenidos de zinc en tallo en las tres parcelas mostraron un comportamiento inverso a los de cadmio; ya que los valores tendieron a incrementar de la parcela 1 a la 3 con valores mínimos y máximos de 2.38 y 6.13 μg/g ps respectivamente. Las concentraciones de plomo medidas en tallo de R. mangle estuvieron por debajo del límite de detección del método utilizado (<2.38 μg/g ps; Garay et al., 2003) y por esta razón no aparecen en las figuras y análisis de resultados.
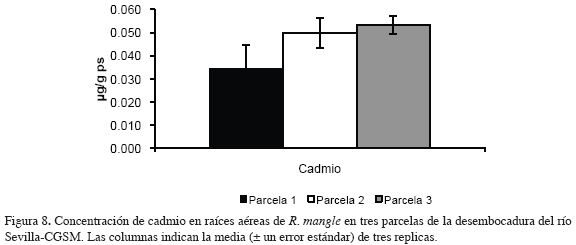
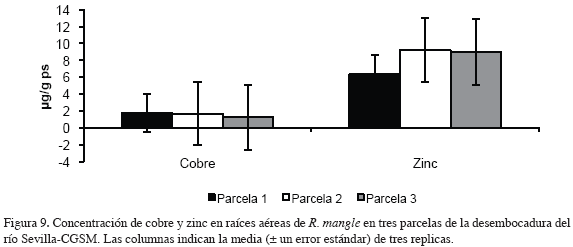
En la figuras 8 y 9 se muestran las concentraciones de los metales medidos en raíces aéreas de R. mangle en tres parcelas de la desembocadura del río Sevilla-CGSM.
Las concentraciones de cadmio medidas en raíces aéreas mostraron un leve incremento de la parcela 1 a la parcela 3, con valores mínimos y máximos de 0.03 y 0.05 μg/g ps respectivamente.
Los contenidos de cobre en raíces aéreas mostraron valores similares; en promedio se registró un valor de 1.56 μg/g ps, con tendencia a disminuir las concentraciones de la parcela 1 a la 3. Las concentraciones medidas de zinc mostraron valores similares en las parcelas 2 y 3 con un valor promedio de 9.11 μg/g ps y un valor mínimo en la parcela 1 de 6.33 μg/g ps. Las concentraciones de plomo medidas en raíces aéreas de R. mangle estuvieron por debajo del límite de detección del método utilizado (<2.38 μg/g ps; Garay et al., 2003) y por esta razón no aparecen en las figuras y análisis de resultados.
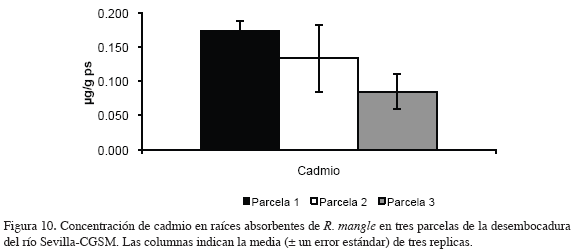
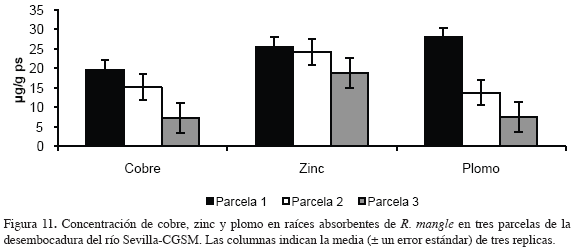
En la figura 10 y 11 se muestran las concentraciones de los metales medidos en raíces absorbentes de R. mangle en tres parcelas de la desembocadura del río Sevilla-CGSM.
La concentración de cadmio, cobre, zinc y plomo en raíces absorbentes mostró un comportamiento similar en las tres parcelas; como tendencia general se vio una disminución en los contenidos de la parcela 1 a la parcela 3. El cobre y el plomo presentaron ámbitos amplios de variación en las concentraciones con valores mínimos de 7.2 y 7.4 μg/g ps en la parcela 3 y máximos de 19.57 y 27.92 μg/g ps en la parcela 1 respectivamente, superando estos últimos dos o tres veces a los valores mínimos. Los contenidos de cadmio y zinc tuvieron un ámbito estrecho de variación donde los valores más bajos se presentaron en la parcela 3 con 0.09 y 18.85 μg/g ps y las concentraciones más altas en la parcela 1 con 0.17 y 25.43 μg/g ps, respectivamente.
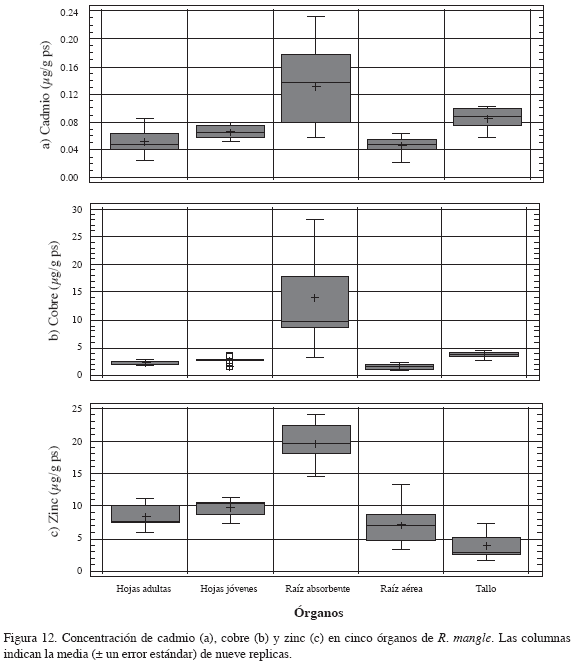
El análisis estadístico denotó que no existen diferencias significativas en la concentración de metales entre parcelas; pero sí fue significativamente diferente entre órganos (Tabla 4, Figura 12). El test T3 de Dunnett mostró que hay diferencias estadísticamente significativas para la concentración de zinc entre las raíces absorbentes y los demás órganos en estudio (tallo, raíces aéreas, hojas jóvenes y hojas adultas), ya que en las raíces absorbentes la concentración fue en promedio 22.8 μg/g ps, mientras que en los otros órganos fue de 7.5 μg/g ps; también se dieron diferencias entre tallo comparado con hojas jóvenes y adultas, por la baja concentración en el tallo.
El test T3 de Dunnett determinó diferencias estadísticamente significativas en la concentración de cadmio entre tallo y hojas adultas. Por último, la aplicación del test de comparación múltiple de Games-Howell, mostró que existen diferencias significativas en la concentración de cobre entre todos los órganos en estudio, excepto entre hojas jóvenes y hojas adultas.
De manera general, la concentración de cadmio y cobre en los órganos de R. mangle mostró un comportamiento similar, con el siguiente orden: raíces absorbentes > tallo > hojas jóvenes > hojas adultas > raíces aéreas. La concentración de zinc en los órganos, presentó el siguiente orden decreciente: raíces absorbentes > hojas jóvenes > hojas adultas > raíces aéreas > tallo.
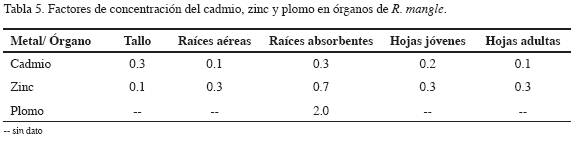
En la tabla 5 se muestran los valores del FCo para cuatro metales en órganos de R. mangle. Los FCo del cadmio, zinc y plomo en tallo, raíces aéreas, hojas jóvenes y hojas adultas, mostraron valores menores que 1; a diferencia del FCo medido para plomo en raíces absorbentes que presentó un valor de 2. El FCo para el cobre no fue calculado debido a falta de datos.
DISCUSIÓN
En el ámbito mundial, el impacto en plantas de manglar expuestas a metales pesados ha sido considerado como mínimo o no existente (Peters et al., 1997). Las especies de manglar han desarrollado estrategias que minimizan la captación de altas concentraciones de metales, incluyendo la exclusión de metales a través de la rizosfera por reacciones de oxidación y la preferente fijación de metales en los tejidos de las raíces (Doyle y Otte, 1997; Ong Che, 1999). Estos atributos de los manglares han sido propuestos como una manera de mitigar la polución de metales en áreas costeras (Lacerda et al., 2000).
Las diferencias entre los contenidos de metales en órganos de R. mangle entre las tres parcelas ubicadas en el río Sevilla-CGSM no fueron significativas. Esto pudo ser debido a la cercanía de los puntos de muestreo a lo largo de la desembocadura y a la fuente de metales (que es la misma para las parcelas), donde las características de los árboles de manglar en el trayecto fueron casi constantes, con evidencias de un bosque uniforme y saludable; esto sugiere el hecho de que la tasa de absorción de un metal varía con los cambios en las condiciones fisiológicas de las plantas (Bryan, 1976).
Las diferencias estadísticamente significativas en los contenidos de cadmio, cobre, zinc y plomo entre órganos de R. mangle, sobre todo en las raíces absorbentes en relación a los demás órganos, se puede explicar por el hecho de que las raíces más profundas son las responsables de la captación de nutrientes y ellas están en constante interacción con los sedimentos asociados (Lacerda, 1998; Hernández, 2002). Helmisaari et al. (1999) demostraron la importancia de las raíces en la dinámica del ciclo de elementos esenciales y los efectos negativos de la elevada exposición metálica en el funcionamiento de bosques terrestres.
Walsh et al. (1979), así como Jayasekera (1991), demostraron bajo condiciones controladas que las mayores concentraciones de metales son acumuladas por las raíces profundas y sólo una pequeña porción de estos es traslocada al resto de la planta. Machado et al. (2004) sugieren que la presencia de placas de hierro (grandes depósitos de metales) generados por el oxígeno transportado y descargado vía aerénquima, encontrado en las finas raíces de R. mangle, pueden moderar la captación de metales esenciales por éstas e inducir una acumulación en la interfase raíz-sedimento.
El tallo fue el órgano que, después de las raíces absorbentes, presentó mayor concentración de cadmio y cobre (en promedio 0.10 y 4.00 μg/g ps, respectivamente); relacionándose con lo registrado por Lacerda (1998) sobre la particularidad de los árboles de algunas especies de manglar a incorporar los metales pesados en tejidos perennes, principalmente el tronco o tallo, y hacer de estos compartimentos vertederos semipermanentes de estos elementos. Silva et al. (1990) determinaron la concentración de algunos metales traza en diferentes órganos de R. mangle, registrando las concentraciones más altas de cobre en tallo (0.6 μg/g ps) después de las raíces profundas; siendo este último valor mucho menor al hallado en el presente estudio.
Entre hojas jóvenes y adultas no hubo diferencias significativas en la concentración de cadmio, cobre y zinc. Al respecto, Lacerda (1998) sostiene que las hojas más jóvenes presentan en general mayores concentraciones de metales que las viejas, debido a que en las primeras fases de formación la hoja acumula muchos iones de elementos que servirán para su crecimiento; y durante dichas fases los elementos menos móviles (como cadmio, cobre, zinc y plomo) son lentamente traslocados; además, el crecimiento de la hoja produce una dilución de la concentración de elementos de la hoja joven debido al aumento de biomasa. Lacerda et al. (1988) demostraron este fenómeno en árboles de R. mangle durante su desarrollo. Sin embargo, Chiu y Chou (1991) no encontraron ninguna diferencia significativa en las concentraciones de metales poco móviles como cobre, zinc, plomo y cadmio entre hojas jóvenes y viejas de Kandelia candel en Taiwán. Lo anteriormente expuesto sugiere que las plantas de manglar pueden tener mecanismos con los cuales regulan la concentración de estos metales en sus hojas debido a los requerimientos básicos de la planta (Strasburger et al., 1997).
El cobre y el zinc son considerados esenciales para las plantas (ATSDR, 1997). El zinc es absorbido por las plantas como ión divalente y hace parte de hormonas del crecimiento; actualmente está comprobada la presencia de zinc en unas ochenta enzimas vegetales (Salisbury y Ross, 1994). Por su parte, el cobre normalmente no es un elemento limitante para las plantas, debido a que su requerimiento es mínimo y la oferta desde el medio es alta; éste es absorbido como ión cúprico divalente en suelos aireados (Cu+2) o como ión cuproso monovalente en suelos húmedos con poco oxígeno (Baran, 1995). Por lo tanto es probable que el cobre y el zinc sean extraídos activamente desde el medio acumulándose o traslocándose en tejidos de rápido crecimiento.
Groot et al. (1976) afirman que el porcentaje de zinc transportado en forma sólida depende de las descargas de agua, en donde a mayor entrada (como en la época lluviosa mayor) aumenta el material suspendido y por lo tanto el contenido de zinc. La liberación de cobre se da por cambios en la salinidad producto de las precipitaciones. Las altas concentraciones de cobre y zinc medidas en los órganos en estudio pueden estar reflejando la influencia del río Sevilla (PRO-CIÉNAGA, 1994). De tal manera, cuando el material suspendido en el agua de río se mezcla con la de mar, se puede presentar liberación de zinc (Groot et al., 1976), facilitando la movilidad y aumentando la disponibilidad del metal (Silva et al., 1990).
Comparando las concentraciones de metales medidas, el cadmio presentó bajas concentraciones en los órganos de R. mangle. Este elemento es considerado no esencial (De La Lanza et al., 1989). Su presencia en las plantas puede deberse a que ejerce sus efectos tóxicos compitiendo con otros metales esenciales (zinc y cobre) por enzimas activas o sitios de proteína de membrana y reaccionando con grupos biológicamente activos (interacciones antagónicas). De esta manera, puede interrumpir los procesos metabólicos normales de las células (Visviki y Rachlin, 1991). Pocos estudios existen sobre la tolerancia de metales pesados en plantas de manglar. Walsh et al. (1979) demostraron que R. mangle es particularmente resistente al cadmio y al plomo debido a la precipitación de componentes metálicos insolubles en la superficie externa de las raíces de la planta, inducidas por su metabolismo y otros factores, evitando su traslocación hacia otros órganos de la planta.
El contenido de plomo se detectó sólo en las raíces absorbentes; esto se puede explicar por el hecho de que es un metal poco móvil en el ambiente y a menudo se une fuertemente a las partículas en suspensión y a los sedimentos (Berg et al., 1995). A su vez, el destino del plomo se ve afectado por procesos que llevan a la formación de complejos metálicos orgánicos relativamente estables y la mayor parte de éste queda retenido y poco se transporta a las aguas superficiales o subterráneas (Alloway, 1990). Esto nos indica que las concentraciones de plomo depositadas en los sedimentos no están en formas solubles o biodisponibles para ser absorbidas por las plantas de manglar de la estación en estudio y por lo tanto no habrá traslocación de éstas hacia las partes aéreas. Lacerda et al. (1993) registran que menos del 1% del plomo es disponible para la captación de las raíces de R. mangle, confirmando la baja biodisponibilidad de metales en suelos de manglar. Similares resultados han sido encontrados en Asia (Chiu y Chou, 1991; Tam et al., 1995).
Por otra parte, Salisbury y Ross (1994) determinaron que, en respuesta a la captación excesiva de iones metálicos, como Cd, Pb, Zn y Cu, algunas plantas son capaces de sintetizar enzimáticamente fitoquelatinas (péptidos que pueden ligar iones metálicos); es posible que el cadmio y el plomo induzcan eficazmente la producción de éstas (Ahner y Morel, 1995), inactivándolos y acumulándolos dentro de la pared celular, ya que no tienen función fisiológica definida. El comportamiento descrito podría ser una perspectiva de estudio en algunas especies de manglar para determinar si este fenómeno está actuando.
A partir de las concentraciones de cadmio, cobre, zinc y plomo encontradas en los órganos de R. mangle en la desembocadura del río Sevilla-CGSM, se identificó a las raíces absorbentes como el órgano con mayor acumulación de estos elementos metálicos, pero aun así su capacidad de absorción es baja, comparada con la de otras especies de plantas que habitan en el mismo lugar de estudio (Quian et al., 1999; Troncoso, 2003). A partir de esta información sería necesario estudiar los diferentes procesos fisiológicos que afectan la química del suelo circundante y la consecuente precipitación de los metales en esta zona donde circunda el bosque de manglar.
Los factores de concentración (FCo) calculados para el cadmio, zinc y plomo en tallos, raíces aéreas, hojas jóvenes y hojas adultas indicaron que no se está dando una acumulación en los tejidos acorde con lo registrado por otros autores en otras áreas estuarinas. Por ejemplo, Lacerda et al. (1986) encontraron factores de concentración menores que 1 para cobre, zinc, plomo y cadmio en plantas de manglar de 18 bosques a lo largo del sureste de la costa de Brasil, incluyendo sitios altamente contaminados por metales traza. Así mismo, Lacerda (1998) afirma que el género Rhizophora es capaz de oxidar su rizosfera, pero esto no es suficiente para que se disocien todos los metales de sulfuros precipitados, que es uno de los principales factores que controla la concentración de metales pesados en los suelos de manglar. El factor de concentración medido para plomo en raíces absorbentes (FCo>1) reveló una posible acumulación o adsorción de este metal en dicho órgano, probablemente porque es el tejido que está en constante interacción con los sedimentos de manglar en los cuales se han registrado una relativamente alta concentración de metales inmóviles o en formas insolubles como el plomo (Lacerda, 1997).
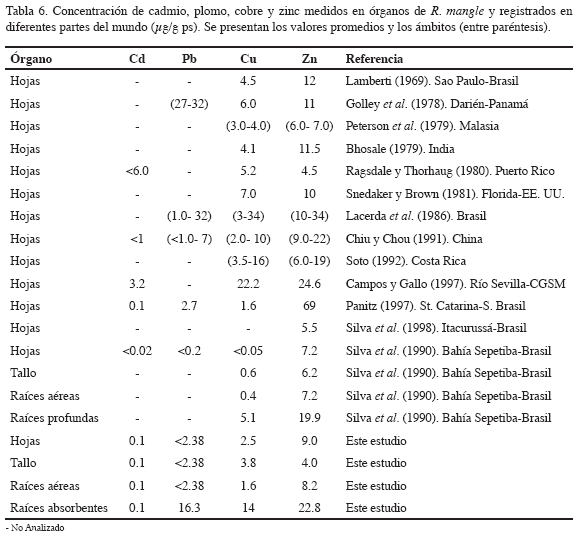
Los factores de concentración calculados para cada metal en los órganos de R. mangle sugieren la existencia de mecanismos que evitan la captación de metales biodisponibles presentes en los suelos de manglar, como lo registran Parra y Espinosa (2007) en los mismos puntos de muestreo. En la tabla 6 se muestra la concentración de metales pesados medidos en órganos de R. mangle y registrados en diferentes partes del mundo. Las concentraciones de metales halladas en tejido de manglar para el presente trabajo son similares a las registradas por otros autores en condiciones similares (Lacerda et al., 1993).
Al comparar con otros registros, se encontró que los árboles de manglar en la CGSM parecen responder al patrón de poca absorción de metales pesados; probablemente la sedimentación que se presenta alrededor de las raíces zancos de esta vegetación favorece la función de atrapar metales que ingresan en los flujos de agua, los cuales se creía realizaba el manglar. Esta situación es demostrada por los factores de concentración calculados, en los que se evidencia la baja absorción de metales por los órganos del mangle.
De manera general, la concentración de los cuatro metales en hojas, tallo y raíces aéreas mostró el siguiente orden de concentración: Zn > Cu > Cd > Pb. Para raíces absorbentes el orden fue: Zn > Pb > Cu > Cd; reafirmando lo encontrado por Sadiq y Zaidi (1994), así como Lacerda et al. (1986), en diferentes bosques de manglar del golfo de Persia y la costa de Brasil, respectivamente.
AGRADECIMIENTOS
Este trabajo fue posible gracias al apoyo del Instituto de Investigaciones Marinas y Costeras (INVEMAR). Se agradece especialmente a todo el personal del Programa Calidad Ambiental Marina, así como a los aportes del profesor Néstor Campos de la Universidad Nacional de Colombia y del profesor Luís Manjarrés de la Universidad del Magdalena.
BIBLIOGRAFÍA
1 Ahner, B.A. y F. Morel. 1995. Phytochelatin production in marine algae, induction by various metals. Limnol. Oceanogr., 40 (4): 658-665. [ Links ]
2 Alloway, B. 1990. Heavy metals in soils. John Wiley and Sons, Inc., Nueva York. 230 p. [ Links ]
3 Aquino, V. 1980. Contaminación marina por metales pesados y otros efluentes industriales y domésticos. 109-129. En: Pérez N., H. (Ed.). Contaminación e impacto ambiental marino costero. Equinoccio Edit. Univ. Simón Bolívar, Caracas. 233 p. [ Links ]
4 ATSDR-Agency for toxic substances and disease registry. 1997. Toxicological profile for cyanide (update). http://www.atsdr.cdc.gov/clist.html. 05/06/05. [ Links ]
5 Baran, E. 1995. Química bioinorgánica. McGraw-Hill, Madrid. 415 p. [ Links ]
6 Berg, H., M. Kiibus y N. Kautsky. 1995. Heavy metals in tropical lakes Kariba, Zimbadwe. Water, Air Soil Pollut., 83: 237-252. [ Links ]
7 Bhosale, L.J. 1979. Distribution of trace elements in the leaves of mangroves. Indian J. Mar. Sci., 8: 58-59. [ Links ]
8 Blanco, J.A., E.A. Viloria y J.C. Narváez. 2005. ENSO and salinity changes in the Ciénaga Grande de Santa Marta coastal lagoon system, Colombian Caribbean. Est. Coast. Shelf Sci., 66: 157-167. [ Links ]
9 Bryan, G.W. 1976. Some aspect of heavy metals tolerance in aquatic organisms. 7-34. En: Loock-Wood, A.P.M (Ed.). Effects of pollutants on aquatic organisms. Cambridge University Press, Cambridge. 193 p. [ Links ]
10 Bula, g. 1977. Algas marinas bentónicas indicadores de un área de surgencia frente a la costa Caribe de Colombia. An. Inst. Invest. Mar. Punta Betín, 9: 45-71. [ Links ]
11 Campos, N.H.1990. La contaminación por metales pesados en la Ciénaga Grande de Santa Marta, Caribe colombiano. Caldasia, 16 (77): 231-244. [ Links ]
12 Campos, N.H y M. Gallo. 1997. Contenidos de Cd, Cu y Zn en Rhizophora mangle y Avicennia germinans de la Ciénaga Grande de Santa Marta y la bahía de Chengue, costa Caribe colombiana. Rev. Acad. Colomb. Cienc., 21 (79): 73-90. [ Links ]
13 Chiu, C.Y. y C. Chou. 1991. The distribution and influence of heavy metals in mangrove forest of the Tamshui Estuary in Taiwan. Soil Sci. Plant Nutr., 37: 659-669. [ Links ]
14 Cross, F.A. y G. Sunda, 1978. Relationship between bioavaility of trace metals and geochemical processes in estuaries. 429-442. En: Wiley, L. (Ed.). Estuarine interactions. Academic, New York. 603. [ Links ]
15 Davis, R.A. 1978. Principles of oceanography. Reading Addisonwesley Publishing Company, Massachusetts. 505 p. [ Links ]
16 De La Lanza, G., M. Ortega, J.L. Laparra, R.M. Carrillo y J.L. Godinez. 1989. Análisis químico de metales pesados (Hg, Pb, Cd, As, Cr y Sr) en las algas marinas de Baja California. An. Inst. Biol. Univ. Nac. Autón. México, Ser. Bot., 59 (1): 89-102. [ Links ]
17 Doyle, M.O. y M.L. Otte. 1997. Organism-induced accumulation of iron, zinc and arsenic in wetland soils. Environ. Pollut., 96: 1-11. [ Links ]
18 Escobar, A. 1991. Planos inundables del Caribe Colombiano. 1-21. En: CORPES Costa Atlántica (Ed.). Perfil ambiental del Caribe colombiano, informe técnico final. Santa Marta. 115 p. [ Links ]
19 Gamboa, B.R. y R. Bonilla. 1983. Distribución de metales pesados (Fe, Mn, Cu y Zn) en sedimentos superficiales de la cuenca Tuy-Cariaco. Bol. Inst. Oceanogr. Univ. Oriente, 22 (1 y 2): 103-110. [ Links ]
20 Garay, J., G. Ramírez, J. Betancourt, B. Marín, B. Cadavid, L. Panizo, L. Lesmes, J. Sánchez, H. Lozano y A. Franco. 2003. Manual de técnicas analíticas para la determinación de parámetros físico-químicos y contaminantes marinos: aguas, sedimentos y organismos. INVEMAR, serie documentos generales No. 13, Santa Marta. 177 p. [ Links ]
21 Golley, F.B., J.T. McGinnis, R.G. Clements, G.I. Child y R.J. Duever. 1978. Ciclagem de Minerais Em um Ecossistema de Floresta Tropical Úmida. Universidad de Sao Paulo, Sao Paulo, Brasil. 257 p. [ Links ]
22 Gónima, L., J.E. Mancera-Pineda y L. Botero. 1998. Aplicación de imágenes de satélite al diagnóstico ambiental de un complejo lagunar estuario tropical: Ciénaga Grande de Santa Marta, Caribe colombiano. INVEMAR, Serie Publicaciones Especiales N° 4, Santa Marta. 52 p. [ Links ]
23 Groot, A.J., W. Salomons y E. Allersma. 1976. Processes affecting heavy metals in estuarine sediments. 131-157. En: Burton, J.D. (Ed.). Estuarine chemistry. Academic, Londres. 229 p. [ Links ]
24 Head, P.C. 1976. Organic processes in estuaries. 54-91. En: Burton, J.D. y P.S. Liss (Eds.). Estuarine chemistry. Academic, London. 229 p. [ Links ]
25 Helmisaari, H.S., K. Makkonen, M. Olsson, A. Viksna, y E. Malkónen. 1999. Fine-root growth, mortality and heavy metal concentrations in limed and fertilized Pinus silvestris (L.) stands in the vicinity of a Cu-Ni smelter in SE Finland. Plant and Soil, 209: 193-200. [ Links ]
26 Hernández, A. 2002. Las micorrizas. http://www.550m.com/usuarios/cdeea/MICORRIZAS.htm. 14/02/2004. [ Links ]
27 Hernández-Camacho, J., P. Hildebrand y R. Álvarez. 1980. Problemática del manejo de manglares con especial referencia al sector occidental de la Ciénaga Grande de Santa Marta, Magdalena, Colombia. 364-386. En: Seminario Latinoamericano sobre el Estudio Científico y el Impacto Humano en el Ecosistema de Manglares. UNESCO, Montevideo. [ Links ]
28 Hernández-Camacho, J., A. Hurtado-Guerra, R. Ortiz-Quijano y T. Walschburger. 1992. Unidades biogeográficas de Colombia. 105-154. En: Halffter, G. (Ed.). La diversidad biológica de Iberoamérica. Acta Zoológica Mexicana, Xalapa (Veracruz) México. Vol. Especial, 389 p. [ Links ]
29 INVEMAR. 2002. Informe técnico final 1999-2002. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de los recursos pesqueros durante la rehabilitación de la CGSM: un enfoque adaptativo. INVEMAR (Ed.), Santa Marta. 172 p. [ Links ]
30 Jarvis, I. y K. Jarvis. 1992. Inductively coupled plasma-atomic emission spectrometry in exploration geochemistry. J. Geochem. Explor., 44: 139-200. [ Links ]
31 Jayasekera, R. 1991. Chemical composition of the mangrove Rhizophora mangle L. J. Plant Physiol., 138: 119-121. [ Links ]
32 Lacerda, L.D. 1997. Trace metals in mangrove plants: Why such low concentrations? 171-178. En: Kjerfve, B., L.D. Lacerda y E.H.S. Diop (Eds.). Mangrove ecosystem studies in Latin America and Africa. United Nations Educational Publisher. La Haya, Holanda. [ Links ]
33 Lacerda, L.D. 1998. Trace metals biogechemistry and diffuse pollution in mangrove ecosystems. Mangrov. Ecosyst., Occas. Papers, ISME. 2: 1- 65. [ Links ]
34 Lacerda, L.D. y J.J. Abraó. 1984. Heavy metal accumulation by mangrove and salt marsh intertidal sediments. Rev. Brasil. Bot., 7: 49-52. [ Links ]
35 Lacerda, L.D., C. Rezende, D. Jose y M. Francisco. 1986. Metallic composition of mangrove leaves from the Southeastern Brazilian coast. Rev. Brasil. Biol., 46 (2): 395-399. [ Links ]
36 Lacerda, L.D., L.A. Martinelli, C.E. Rezende, A.A. Mazeto, A.R. Ovalle, R.L. Victoria, C.A. Silva y A.B. Nogueira. 1988. The fate trace metals in suspended matter in a mangrove creek during a tidal cycle. Scien. Total Envir., 75: 169-180. [ Links ]
37 Lacerda, L.D., E.V. Carvalho, K.F. Tanizaki, R.C. Ovalle y C.E. Rezende. 1993. Biogeochemistry and trace metals distribution of mangrove Rhizospheres. Biotrópica, 25: 252-257. [ Links ]
38 Lacerda, L.D., W. Machado y M. Moscatelli. 2000. Use of mangroves in landfill management. GLOMIS Electronic J., 1 (1): 1. [ Links ]
39 Lamberti, A. 1969. Contribuicáo ao conhecimento da ecologia das plantas do manguezal de Itanhaém. Universidade de Sao Paulo, Faculdade de Filosofía, Ciencias e Letras, Bol. 23, 217 p. [ Links ]
40 Machado, W., K.F. Tanizaki y L.D. Lacerda. 2004. Metal accumulation on the fine roots of Rhizophora mangle L. ISME/GLOMIS Electronic J., 4 (1): 1-2. [ Links ]
41 Marín, B. 2003. Las aguas de mi Ciénaga Grande: descripción de las condiciones ambientales de la Ciénaga Grande de Santa Marta. INVEMAR, Serie Documentos Generales No. 9, Santa Marta. 36 p. [ Links ]
42 Montgomery, D.C. 1991. Diseño y análisis de experimentos. Iberoamericana, México D.F. 589 p. [ Links ]
43 NRC - National Research Council of Canada Institute for National Measurement Standards. 1994. TORT-2. Lobster hepatopancreas reference material for trace metals. Certified reference material. Ottawa, Canadá. 2 p. [ Links ]
44 Ong Che, R.G. 1999. Concentration of 7 heavy metals in sediments and mangrove root samples from Mai Po, Hong Kong. Mar. Pollut. Bull., 39: 269-279. [ Links ]
45 Panitz, C.M. 1997. Ecological description of the Itacorubi mangroves, Ilha Santa Catarina, Brazil. 204-223. En: Kjerfve, B., L.D. Lacerda y S. Diop (Eds.). Mangrove ecosystem studies in Latin America and Africa. UNESCO, Paris. [ Links ]
46 Parra, J.P. y L.F. Espinosa. 2007. Acumulación de Pb, Cd y Zn en sedimentos asociados a Rhizophora mangle, en el río Sevilla-Ciénaga Grande de Santa Marta, Colombia. Rev. Acad. Colomb. Cienc., 31 (120): 347-354. [ Links ]
47 Perdomo, L. y M.L. Schnetter. 2004. Regeneración natural y repoblación de los manglares. 173 - 186. En: Garay, J., J. Restrepo, O. Casas, O. Solano y F. Newmark (Eds.). Los manglares de la ecorregión Ciénaga Grande de Santa Marta: pasado, presente y futuro. INVEMAR, Serie de publicaciones especiales No. 11, Santa Marta. 236 p. [ Links ]
48 Perdomo, L., I. Ensminger, L. Espinosa, C. Elster, M. Wallner-Kersanach y M. Schnetter. 1999. The mangrove ecosystem of the Ciénaga Grande de Santa Marta (Colombia): Observations on regeneration and trace metals in sediment. Mar. Poll. Bull., 37 (8-12): 393-403. [ Links ]
49 Peters, E.C., N.J. Gassman, J.C. Firman, R.H. Richmond, y E.A. Power. 1997. Ecotoxicology of tropical marine ecosystems. Environ. Toxicol. Chem., 16: 12-40. [ Links ]
50 Peterson, P.J., M.A. Burton, M. Gregson, S.M. Nye y E.K. Porter. 1979. Accumulation of tin by mangrove species in West Malaysia. Sci. Total Environ., 11: 213-221. [ Links ]
51 PRO-CIÉNAGA. 1994. Estudio de impacto ambiental: reapertura de canales en el delta exterior derecho del río Magdalena. Informe Final, Pro-Ciénaga, Santa Marta. 382 p. [ Links ]
52 Quian, J.H., A. Zayed, Y.L. Zhu, M. Yu y N. Terry. 1999. Phytoaccumulation of trace elements by wetland plants: III. Uptake and accumulation of ten trace elements by twelve plant species. J. Environ. Qual., 28: 1448-1455. [ Links ]
53 Ragsdale, H.L. y A. Thorhaug. Trace metal cycling in the U.S. coastal zone: A synthesis. Am. J. Bot., 980 (67): 1102-12. [ Links ]
54 Sadiq, M. y T.H. Zaidi. 1994. Sediment composition and metal concentrations in mangrove leaves from the Saudi coast of the Arabian Gulf. Environ. Impact Assess. Rev., 14 (5-6): 1-8. [ Links ]
55 Salisbury, F.B. y C.W. Ross. 1994. Fisiología vegetal. Iberoamericana, México D.F. 687 p. [ Links ]
56 Silva, C.A., L.D. Lacerda y C.E. Rezende. 1990. Metals reservoir in a red mangrove forest. Biotrópica, 22 (4): 339-345. [ Links ]
57 Silva, C.A., A.A. Mozeto y Á.R. Ovalle. 1998. Distribution and fluxes as macrodetritus of phosphorus in red mangroves, Sepetiba Bay, Brazil. Mangroves and Salt Marshes, 2 (1): 37-42. [ Links ]
58 Snedaker, S.C. y M.S. Brown. 1981. Water quality and mangrove ecosystem dynamics. (EPA-600/4-81-002) US EPA. Office of Pesticides and Toxic Substances, Gulf Breeze, U.S.A. 79 p. [ Links ]
59 Soto, R. 1992. Nutrient concentration and retranslocation in coastal vegetation and mangroves from the Pacific coast of Costa Rica. Brenesia, 37: 33-50. [ Links ]
60 SPSS Inc. 2002. SPSS Modelos Avanzados 11.5.150 p. [ Links ]
61 Strasburger, E., F. Noll, H. Schenck y A.F. Schimper. 1997. Tratado de botánica. 33va edición. Editorial Marín, Barcelona. 639 p. [ Links ]
62 Tam, N.F., S.H. Li, C.Y. Lan, G.Z. Chen, M.S. Li y Y.S. Wong. 1995. Nutrients and heavy metal concentrations of plants and sediments in Futian mangrove forest. Hydrobiologia, 295: 149-158. [ Links ]
63 Troncoso, W. 2003. Cambios temporales y espaciales de los contenidos de cadmio, cobre y zinc en plantas macrófitas (Eichornia crassipes e Ipomoea setifera) en el canal del Clarín-Ciénaga Grande de Santa Marta, Caribe Colombiano. Tesis de M.Sc., Universidad Nacional de Colombia, Santa Marta. 108p. [ Links ]
64 Visviki, I. y J.W. Rachlin. 1991. The toxic action and interactions of cooper and cadmium to the marine alga Dunaliella minuta, in both acute and chronic exposure. Arch. Environ. Contam. Toxicol., 20: 271-275. [ Links ]
65 Walsh, G.E., K.A. Ainsworth y R. Rigby. 1979. Resistance of red mangrove (Rhizophora mangle L.) seedings to lead, cadmium and mercury. Biotropica, 11 (1): 22-27. [ Links ]
FECHA DE RECEPCIÓN: 09/10/06 FECHA DE ACEPTACIÓN: 24/08/08