Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.37 no.2 Santa Marta July/Dec. 2008
NOTA:
PRESENCIA DE TUBOS CALCÁREOS BIOGÉNICOS EN LA ESTRUCTURA DEL CORAL MADRACIS MYRIASTER (SCLERACTINIA: POCILLOPORIDAE) DE AGUAS PROFUNDAS EN EL CARIBE COLOMBIANO
PRESENCE OF CALCAREOUS BIOGENIC TUBES ON CORAL MADRACIS MYRIASTER STRUCTURE (SCLERACTINIA: POCILLOPORIDAE) FROM DEEP-WATER IN COLOMBIAN CARIBBEAN
Tomás López, Nadiezdha Santodomingo y Javier Reyes
Instituto de Investigaciones Marinas y Costeras (INVEMAR), Cerro Punta de Betín, A.A. 1016, Santa Marta, Colombia. tomas_lopez@invemar.org.co (T.L.); nsantodomingo@invemar.org.co (N.S.); J_reyes_forero@hotmail.com (J.R.)
ABSTRACT
A large number of branches from the scleractinian coral Madracis myriaster, collected in deep waters of the Colombian Caribbean, showed both inside and around the skeleton calcareous structures constructed by tubiculous organisms. Here, based on the growth strategy of the coral and the physical conditions of deep-water areas, we describe the functional effect of the tube structures on deep coral frameworks formation and growth.
KEY WORDS: Calcareous Tubes, Colombian Caribbean, Deep-Water, Growth Strategy, Madracis myriaster.
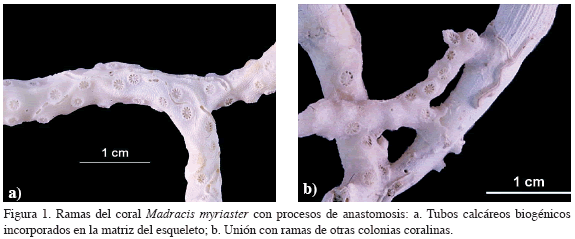
Madracis myriaster (Milne-Edwards y Haime, 1849) es una especie de coral escleractinio azooxantelada, endémica del Atlántico occidental, que habita aguas cálidas y someras o ambientes profundos en el rango de profundidad entre los 20 y 700 m (Best, 2001). En el Caribe colombiano, ha sido descrita como la principal constructora de formaciones coralinas en dos de las tres localidades conocidas con significativa abundancia de corales azooxantelados en ambientes afóticos (Reyes et al., 2005). La especie presenta crecimiento ramificado irregular con procesos de anastomosis entre las ramas y elementos adyacentes a la colonia (Figuras 1a, b). Numerosas especies de corales de ambientes afóticos presentan formas de crecimiento similar, encontrando entre ellas tanto corales duros (i.e. Lopheliapertusa, Madrepora oculata y Oculina varicosa), como corales blandos (i.e. Corallium secundum y Paragorgia arborea) (Freiwald et al., 2004). El crecimiento ramificado y la capacidad de anastomosis pueden ser estrategias que permiten construir estructuras más grandes y rígidas bajo las condiciones propias de ecosistemas de profundidad (Roberts, 2005).
En muestras de Madracis myriaster obtenidas a partir de exploraciones realizadas por el INVEMAR a lo largo del margen continental del Caribe colombiano, fueron encontrados de forma frecuente tubos de carbonato de calcio sobre y en el interior de las ramas, aparentemente sin perjudicar el desarrollo y la supervivencia del coral (Figuras 1a; 2). La asociación de corales en ambientes profundos (L. pertusa y M. ocullata) con invertebrados tubícolas (el poliqueto Eunice norvegica) ha sido descrita como una forma de desarrollo que le permite a ambas partes obtener beneficios para sobrevivir en estos ambientes; los poliquetos tubícolas, tras implantarse en el tejido coralino, son calcificados e incorporados en la matriz del esqueleto ganando protección adicional y sostén al mismo tiempo que limpian los pólipos de sedimentos, defienden la colonia contra agresores y estimulan su crecimiento y desarrollo con el sistema de tubos gradualmente incorporados (Mortensen, 2001; Roberts, 2005).
En las muestras colectadas, se analiza el efecto funcional de los tubos calcáreos sobre el andamiaje de M. myriaster, basado en la estrategia de crecimiento colonial de la especie y en algunos de los efectos bioerosivos comúnmente observados en formaciones coralinas. Los arrecifes coralinos de profundidad soportan comunidades animales ampliamente diversas; no obstante, debido al limitado acceso a estos ambientes, el rol ecológico de la fauna asociada y las interacciones biológicas en la comunidad han sido pobremente entendidos (Mortensen, 2001; Rogers, 2004; Zibrowius y Taviani, 2005). Por esta razón, los corales de aguas tropicales someras, más ampliamente conocidos, son empleados como marco de referencia para la comparación de algunos aspectos ecológicos que ocurren en comunidades coralinas de profundidad.
ACRECIÓN, BIOEROSIÓN E INTERACCIONES ECOLÓGICAS EN ARRECIFES CORALINOS
El crecimiento de los arrecifes coralinos se da básicamente por dos vías: debido a los procesos de reproducción y reclutamiento de corales escleractinios (Richmond, 1997) y por la acumulación de CaCO3 durante el crecimiento de organismos "hermatípicos" o constructores de arrecifes (Achituv y Dubinsky, 1990). Por su parte, la bioerosión en arrecifes es el proceso por el cual un organismo, debido a su forma de vida, erosiona y debilita el esqueleto calcáreo de los organismos hermatípicos (Glynn, 1997). En este último proceso intervienen organismos epilíticos (habitan las superficies expuestas del substrato), endolíticos (presentes en el interior del esqueleto) y chasmolíticos (en grietas, hoyos o depresiones), cada grupo caracterizado por una serie de rastros característicos tras el proceso erosivo. La estructura y forma de los arrecifes coralinos es el resultado del balance continuo entre el crecimiento y la degradación (Hutchings, 1986).
La relación simbiótica que conforman especies de aguas someras con zooxantelas le permite al coral subsistir en un medio con bajos niveles de nutrientes y, adicionalmente, construir grandes andamiajes calcáreos por precipitación de CaCO3 en su esqueleto, el cual es favorecido por la fotosíntesis de las algas (Muller-Parker y D'Elia, 1997). Esta dependencia fotosintética determina la zonación de los corales zooxantelados en aguas someras, encontrando diferentes formas de crecimiento que morfológicamente varían de acuerdo al grado de exposición a la turbulencia, la intensidad lumínica y el aporte de sedimentos, principalmente (Achituv y Dubinsky, 1990; Hubbard, 1997). Así, es posible observar predominio de formas ramificadas o arborescentes en zonas someras, con altos niveles de energía y aporte de sedimentos, hasta formas hemisféricas masivas o costrosas a mayor profundidad (Veron, 2000).
El conocimiento de las condiciones que propician el desarrollo de los arrecifes coralinos de profundidad es limitado; se sabe que generalmente habitan áreas con condiciones relativamente estables, con elevados niveles salinos, alto aporte de sedimentos y partículas orgánicas provenientes de capas superiores, corrientes cargadas de nutrientes, así como bajas temperaturas y poco oxígeno (Freiwald et al., 2004; Rogers, 2004). Debido a la limitada fuente de energía, las elevadas tasas de sedimentación y las condiciones físico-químicas de ambientes afóticos, las tasas de crecimiento de los corales de profundidad son más reducidas que las encontradas en ambientes someros y las especies deben adoptar formas de crecimiento que le permita a la colonia estar por encima del nivel de enterramiento de sedimentos y a los pólipos tener el máximo acceso a la fuente de alimento (Buhl-Mortensen y Mortensen, 2004; Rogers, 2004; Roberts, 2005). Por esto, muchos de los corales de ambientes afóticos presentan formas arborescentes y digitiformes, con ramas elevadas sobre la capa relativamente calma cerca del fondo orientadas perpendicularmente a las corrientes de agua prevalecientes (Buhl-Mortensen y Mortensen, 2004; Freiwald et al., 2004).
Las formaciones de algunos corales de aguas profundas se encuentran comúnmente asociadas con organismos tubícolas, de cuyas interacciones biológicas se promueve la formación de nuevas colonias y el crecimiento del arrecife. Por ejemplo, se ha observado que el poliqueto E. norvegica y algunas especies de polinoidos, se asientan tanto sobre tejido coralino como sobre los esqueletos de L. pertusa y M. oculata y construyen sistemas de tubos calcáreos, los cuales con el crecimiento del coral, son paulatinamente recubiertos por tejido coralino e incluidos dentro del esqueleto (Wilson, 1979; Mortensen, 2001; Rogers, 2004; Roberts, 2005). Tales estructuras biogénicas son útiles para el organismo tubícola como protección, ventilación o fuente de alimento (Cammen, 1987), beneficiándose de los detritos, partículas y microorganismos atrapados por los pólipos o en el mucus secretado por el coral y ganando además las mismas ventajas otorgadas por la morfología del coral (Buhl-Mortensen y Mortensen, 2004). El efecto de los tubos incluidos en el esqueleto coralino, combinado con el incremento de peso por el crecimiento de la colonia, ocasiona su colapso y el rompimiento de ramas adultas, que cayendo cerca de la colonia original, constituyen el sustrato de crecimiento lateral del andamiaje coralino. Eventualmente, los fragmentos o colonias hijas, crecen lo suficiente y se fusionan con el resto de la estructura gracias a la capacidad de anastomosis, conformando "parches" coralinos con la forma de anillo característico de ambientes afóticos, cuya parte viva de la estructura coralina se encuentra apoyada sobre fragmentos de coral muerto y sedimentos (Wilson, 1979; Rogers, 2004).
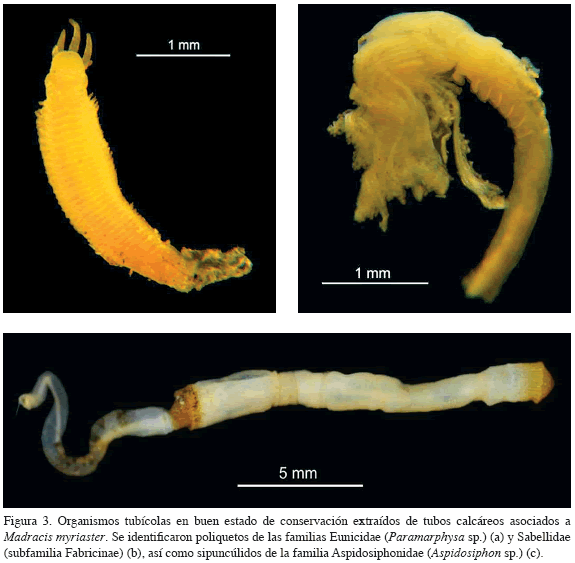
Es posible que algunos organismos, entre los que se encuentran ciertos poliquetos, construyan sus propios tubos calcáreos al secretar después de asentarse una matriz orgánica que se endurece; sin embargo, existen otros que adoptan los tubos de otros animales como sitio de protección y morada (Hickman et al., 2001). Aunque fueron examinados algunos tubos calcáreos visibles, muchos de los organismos encontrados en su interior no mantenían un buen estado de conservación que permitiera su identificación. Hasta el nivel taxonómico más específico posible, se identificaron poliquetos de las familias Eunicidae (Paramarphysa sp.) y Sabellidae (subfamilia Fabricinae) y sipuncúlidos de la familia Aspidosiphonidae (Aspidosiphon sp.) (Figura 3).
Estudios más detallados en ecosistemas marinos de ambientes afóticos en los mares colombianos serán necesarios para adquirir un mejor conocimiento de la biología y ecología de los corales de profundidad, esclareciendo a su paso interacciones entre distintas especies que aún son desconocidas y que podrían ser vitales incluso para especies de provecho comercial.
AGRADECIMIENTOS
A las expediciones Macrofauna realizadas por el INVEMAR entre 1998 y 2002. Un agradecimiento especial a Fabián Cortés, Héctor Sáenz, Edwin Gómez, Luís Alonso Gómez, Inger Daniel, Norella Cruz, Paola Flórez y Adriana Gracia por su orientación y asesoría.
BIBLIOGRAFÍA
1 Achituv, Y. y Z. Dubinsky. 1990. Evolution and zoogeography of coral reefs. 1-9. En: Dubinsky, Z. (Ed.). Ecosystems of the world 25, Coral Reefs. Elsevier Science B.V., Amsterdam. 550 p. [ Links ]
2 Best, M.B. 2001. Some notes on the terms "deep-sea ahermatipic" and "azooxanthellate", illustrated by the coral genus Madracis. 19-29. En: Willison, J.H.M., J. Hall, S.E. Gass, E.L.R. Kenchington, M. Butler y P. Doherty (Eds.). Proceedings of the First International Symposium on Deep-Sea Corals. Ecology Action Centre and Nova Scotia Museum, Halifax. 231 p. [ Links ]
3 Buhl-Mortensen, L. y P.B. Mortensen. 2004. Symbiosis in deep-water corals, review article. Symbiosis, 37: 33-61. [ Links ]
4 Cammen, L.M. 1987. Polychaeta. 217-260. En: Pandian, T.J. y F.J. Vernberg (Eds.). Animal energetics. Volume 1. Academic Press, San Diego. 523 p. [ Links ]
5 Freiwald, A., J.H. Fossá, A. Grehan, T. Koslow y J.M. Roberts. 2004. Cold-water coral reefs, out of sight-no longer out of mind. UNEP-WCMC, Cambridge. 84 p. [ Links ]
6 Glynn, P.W. 1997. Bioerosion and coral-reef growth: A dynamic balance. 68-95. En: Birkeland, C. (Ed.). Life and death of coral reefs. Chapman and Hall, Nueva York. 536 p. [ Links ]
7 Hickman, C.P.Jr., L.S. Roberts y A. Larson. 2001. Integrated principles of Zoology, Eleventh Edition. Mc. Graw-Hill, Nueva York. 899 p. [ Links ]
8 Hubbard, D.K. 1997. Reefs as dynamic systems. 43-67. En: Birkeland, C. (Ed.). Life and death of coral reefs. Chapman and Hall, NuevaYork. 536 p. [ Links ]
9 Hutchings, P.A. 1986. Biological destruction of coral reefs, a review. Coral Reefs, 4 (4): 239-252. [ Links ]
10 Mortensen, P.B. 2001. Aquarium observations on the deep-water coral Lophelia pertusa (L. 1758) (Scleractinia) and selected associated invertebrates. Ophelia, 54 (2): 83-104 p. [ Links ]
11 Muller-Parker, G. y C.F. D'Elia. 1997. Interactions between corals and their symbiotic algae. 96-113. En: Birkeland, C. (Ed.). Life and death of coral reefs. Chapman and Hall, Nueva York. 536 p. [ Links ]
12 Reyes, J., N. Santodomingo, A. Gracia, G. Borrero-Pérez, G. Navas, L.M. Mejía-Ladino, A. Bermúdez y M. Benavides. 2005. Southern Caribbean azooxanthellate coral communities off Colombia. 309-330. En: Freiwald, A. y J.M. Roberts (Eds.). Cold-water corals and ecosistems. Springer-Verlag, Berlín. 1279 p. [ Links ]
13 Richmond, R.H. 1997. Reproduction and recruitment in corals: critical links in the persistence of coral reefs. 175-197. En: Birkeland, C. (Ed). Life and death of coral reefs. Chapman and Hall, Nueva York. 536 p. [ Links ]
14 Roberts, J.M. 2005. Reef-aggregating behaviour by symbiotic eunicid polychaetes from cold-water corals: do worms assemble reefs? J. Mar. Biol. Ass. UK, 85: 813-819. [ Links ]
15 Rogers, A. 2004. The biology, ecology and vulnerability of deep-water coral reefs. International Union for Conservation of Nature and Natural Resources, British Antartic Survey, Cambridge.13 p. [ Links ]
16 Veron, J. 2000. Corals of the world. Australian Institute of Marine Science and CRR Qld Pty Ltd., Townsville, Australia. 1: 463 p. [ Links ]
17 Wilson, J.B. 1979. "Patch" development of the deep-water coral Lopheliapertusa (L.) on Rockall Bank. J. Mar. Biol. Ass. UK, 59: 165-177. [ Links ]
18 Zibrowius, H. y M. Taviani. 2005. Remarkable sessile fauna associated with deep coral and other calcareous substrates in the Strait of Sicily, Mediterranean Sea. 807-819. En: Freiwald, A. y J.M. Roberts (Eds.). Cold-water corals and ecosistems. Springer-Verlag, Berlín. 1279 p. [ Links ]
FECHA DE RECEPCIÓN: 28/08/07 FECHA DE ACEPTACIÓN: 06/10/08