Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.38 no.1 Santa Marta Jan./June 2009
LA COMUNIDAD DE COPÉPODOS EN LAS ISLAS DE PROVIDENCIA Y SANTA CATALINA (CARIBE COLOMBIANO) DURANTE EL PERÍODO LLUVIOSO (OCTUBRE) 2005
THE COPEPOD COMMUNITY AT PROVIDENCE AND SANTA CATALINA ISLANDS (COLOMBIAN CARIBBEAN), DURING A RAINY SEASON (OCTOBER) 2005
María del Pilar Martínez-Barragán1, Andrés Franco-Herrera2, Jairo Medina-Calderón3 y Adriana Santos-Martínez3
1Universidad de Bogotá Jorge Tadeo Lozano, Carrera 4 No. 22-61. Bogotá, Colombia martinezbmp@yahoo.es
2Universidad de Bogotá Jorge Tadeo Lozano, Sede Santa Marta, Facultad de Ciencias Naturales, Programa de Biología Marina, Carrera 2 No. 11-68, Edificio Mundo Marino, Santa Marta, Colombia. andres.franco@utadeo.edu.co
3Universidad Nacional de Colombia, Instituto de Estudios Caribeños, Sede Caribe, San Andrés Isla, Colombia. jhmedinac@unal.edu.co (J.M.C.), asantosma@unal.edu.co (A.S.M.)
RESUMEN
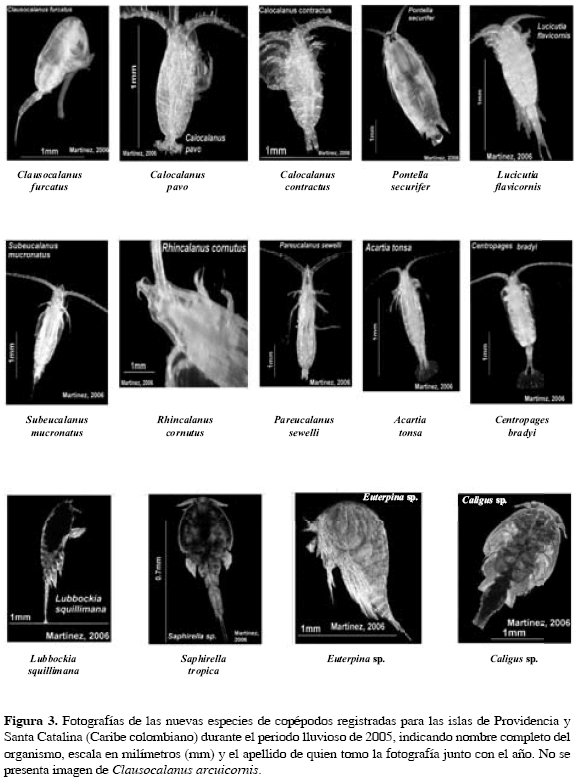
Con el fin de contribuir al conocimiento de la comunidad zooplanctónica, en particular de la subclase Copepoda en las islas de Providencia y Santa Catalina (Caribe colombiano), se analizaron 47 estaciones en el mes de octubre de 2005 (época lluviosa). Se encontraron en total 42 especies pertenecientes a los órdenes Calanoida, Poecilostomatoida, Cyclopoida, Harpacticoida y Siphonostomatoida, de las cuales Clausocalanus arcuicornis, C. furcatus, Calocalanus pavo, C. contractus, Pontella securifer, Lucicutia flavicornis, Subeucalanus mucronatus, Rhincalanus cornutus, Pareucalanus sewelli Centropages bradyi, Acartia tonsa, Lubbockia squillimana, Saphirella tropica, Euterpina sp. y Caligus sp., fueron nuevos registros para las islas. Su distribución espacial y abundancia estuvieron influenciadas principalmente por la entrada de la Corriente Ecuatorial del Caribe, el paso de los huracanes Wilma y Beta en el Caribe colombiano y la presencia de aguas terrígenas en el lado oeste de las islas.
PALABRAS CLAVE: Copépodos, Distribución, Composición, Providencia y Santa Catalina.
ABSTRACT
In order to contribute to the zooplanktonic community knowledge, particularly the Copepoda subclass at Providence and Santa Catalina Islands (Colombian Caribbean), 47 zooplankton samples got in October 2005 (rainy season) were analyzed. 42 species from Calanoida, Poecilostomatoida, Cyclopoida, Harpacticoida and Siphonostomatoida orders were found. Clausocalanus arcuicornis, C. furcatus, Calocalanus pavo, C. contractus, Pontella securifer, Lucicutia flavicornis, Subeucalanus mucronatus, Rhincalanus cornutus, Pareucalanus sewelli, Centropages bradyi, Acartia tonsa, Lubbockia squillimana, Saphirella tropica, Euterpina sp. and Caligus sp., were new records for the islands. The Caribbean Equatorial Current circulation, Wilma and Beta Hurricanes passing through the Colombian Caribbean and continental runoff on the west side of the island, were the principal factors affecting copepod abundances and spatial distribution.
KEY WORDS: Copepods, Distribution, Composition, Providence and Santa Catalina.
INTRODUCCIÓN
La subclase Copepoda, que conforma aproximadamente entre el 60 y 80 % del total de la biomasa zooplanctónica en las regiones oceánicas y neríticas (Raymont, 1983; Campos y Suárez-Morales, 1994), con cerca de 11500 especies (Humes,1994) y que se caracteriza por presentar una amplia diversidad morfológica, de hábitos alimentarios y distribución biogeográfica (Boltovskoy, 1981; Raymont, 1983; Suárez-Morales y Gasca, 2000; Turner, 2004), es uno de los componentes más importantes del zooplancton, debido a que es el principal consumidor tanto de fitoplancton como de componentes del bucle microbiano y consecuentemente es la mayor presa del ictioplancton y otros carnívoros pelágicos (Kleppel, 1993; Turner y Roff, 1993; Susuki et al., 1999; Turner, 2004). Los organismos de esta subclase, considerados como los metazoos más abundantes de la tierra (Turner, 2004), han sido estudiados moderadamente en áreas costeras, estuarinas y continentales del Caribe colombiano (Renteria de Monsalve, 1975, 1976; Camacho-Casas, 1978; Franco et al., 1992; Bernal y Zea 1992, 1993, 2000; Bernal et al., 1994; Bernal-Valderrama, 1994; Camargo-Fajardo, 1994); sin embargo, es muy poco el énfasis que se le ha dado a esta comunidad en las zonas oceánicas.
En estas islas solamente se cuenta con el estudio realizado por Giraldo y Villalobos (1983), quienes analizaron la composición y abundancia del zooplancton superficial, registrando 141 especies, de las cuales 54 pertenecían al grupo Copepoda, siendo por lo tanto, el taxón más importante en cuanto a su abundancia y frecuencia de aparición. Con el fin de contribuir al conocimiento de los copépodos en esta ecorregión y de documentar una línea base introductoria para posteriores investigaciones taxonómicas, sistemáticas y ecológicas, se llevó a cabo un estudio sobre la composición de los copépodos en las islas de Providencia y Santa Catalina, Caribe colombiano, las cuales son consideradas como Reserva Mundial de la Biosfera por su alta productividad, diversidad biológica y las extensiones más importantes de ecosistemas coralinos del territorio nacional.
MATERIALES Y MÉTODOS
Área de estudio
Las islas de Providencia y Santa Catalina, integrantes del archipiélago de San Andrés y Providencia, se ubican en el mar Caribe occidental entre los 13°19' y 13°24' N y entre los 81°21' y 81°24' W (Garay et al., 1988), afuera de la plataforma continental centroamericana a una distancia de 720 Km de la costa atlántica colombiana Físicamente se encuentran separadas por el canal de Aury con aproximadamente 180 m de largo. Presentan una topografía abrupta conformada por un complejo de rocas volcánicas de origen pliocénico (efusión magnética), ocupando un área de 22 Km2 y una elevación sobre los 360 msnm (Geister, 1992). En su lado este, entre los extremos norte y sur a una distancia de 2500 a 3000 m, se encuentra asentado un extenso sistema arrecifal holocénico de 32 Km El clima regente para el archipiélago conforme a la clasificación climática de Strahler y Strahler (1976) es húmedo seco tropical, las condiciones marinas y meteorológicas en general para las islas y el Caribe, obedecen a dos épocas climáticas: seca (enero a abril) y lluviosa (junio a diciembre), siendo mayo el mes de transición entre éstas (IGAC, 1986; Andrade et al., 1996; Díaz et al., 1996).
En las islas, al igual que en el resto del Caribe, se encuentra la influencia de los vientos alisios del este y noreste, con temporadas esporádicas de vientos del oeste (W) y noreste (NE) en la mitad del año, pero su mayor intensidad se alcanza en la época seca durante el mes de febrero. Sin embargo, estas variables se pueden ver afectadas principalmente por la ubicación del archipiélago en el cinturón de huracanes del Caribe (Geister, 1992), como se pudo observar para la fecha de muestreo (octubre de 2005) al presentarse los huracanes Beta y Wilma (CIOH, 2005), que provocaron aumento en la velocidad de los vientos (≈ 50 nudos), la precipitación y el oleaje con alturas hasta de 5 y 6 m. Respecto a su hidrología se observa el ingreso de la corriente Ecuatorial del Caribe, la cual incide sobre los accidentes geográficos en dos direcciones, uno que continúa su trayectoria noroeste y otro que circula hacia el suroeste del área, mezclándose con las aguas de escorrentía provenientes de Nicaragua y Panamá, formando una zona de remolino anticiclónico (Díaz et al., 1996).
Diseño muestreal
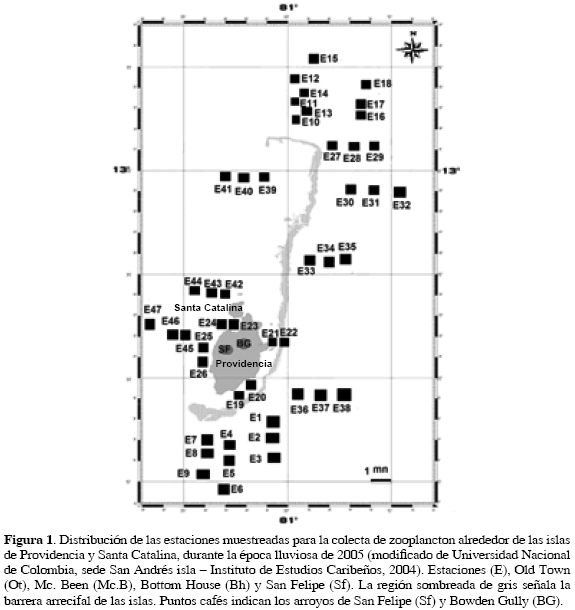
En el mes de octubre del 2005, se realizaron arrastres superficiales en 47 estaciones, con una red de zooplancton de 250 μm de poro, 1 m de largo y con un diámetro de boca de 30 cm, a la cual se le instaló un flujómetro de rotor mecánico previamente calibrado para determinar el volumen del agua filtrada (Boltovskoy, 1981) y posteriormente calcular la densidad de individuos (ind/1000 m3). Se ubicaron 27 estaciones entre las zonas norte (N), sur (S) y oeste (W) de las islas (nueve en cada una), 12 fueron asignadas para la zona este (E) y finalmente ocho para la zona interna (laguna arrecifal), comprendida por los sectores de Bottom House (Bh), Mc. Been (Mc. B), Old Town (Ot) y San Felipe (Sf) (con dos estaciones para cada sector) (Figura 1).
Los individuos fueron narcotizados con una cantidad de CO2 contenido en una solución comercial de bicarbonato de sodio en una relación volumétrica de 1:1, proceso que se aceleró con su continua refrigeración a una temperatura -1 °C, con lo cual se impidió la descomposición temprana de los organismos (Boltovskoy, 1981). Posteriormente, se fijaron con solución de formalina con base de agua de mar al 4 % y se separaron en una placa Bogorov de 5 mL, para su identificación a partir de las claves taxonómicas de Trégouboff y Rose (1957), Owre y Foyo (1967), Deboyd y Smith (1977), Boltovskoy (1981) y Campos y Suárez-Morales (1994). Para este proceso, después de estudiar los individuos en un microscopio de luz Nikon-SE de 100X de aumento, se realizaron disecciones con agujas entomológicas para observar con más detalle las ornamentaciones y formas de las antenas, anténulas, mandíbulas, maxilas, maxilípedos y patas, en especial la quinta, para identificar hasta el nivel de especie Finalmente se midieron la salinidad del agua con un refractómetro marca Vista A366ATC (±1. 0), la temperatura con un termómetro de mercurio convencional marca Brand (±1°C) y el pH con un pHmetro marca Schott modelo CG 842, por estación.
Estadísticamente, se llevó a cabo un análisis de clasificación jerárquico a partir del índice de similaridad de Bray Curtis, con la técnica del ligamiento de promedio no ponderado (UPGMA) para observar la distribución de las especies en el área de estudio a partir de la formación de agrupaciones. Para establecer una relación entre la densidad de las especies y cada una de las variables físicas (temperatura, salinidad y pH) se utilizó la correlación de Spearman en el programa Statgraphic 5.0, siendo éste el método más apropiado para comparar dos variables con una distribución no normal (Ramírez, 1999; Clarke y Warwick, 2001).
RESULTADOS
Composición y distribución
Se identificaron en total 42 especies de copépodos, pertenecientes a 21 familias y a los órdenes Calanoida, Poecilostomatoida, Cyclopoida, Harpacticoida y Siphonostomatoida, con una abundancia promedio de 12.18±5.19 ind/1000m3. Las especies Undinula vulgaris (24.57 %) en estadios adultos y copepoditos, Clausocalanus arcuicornis (21.65 %), Farranula gracilis (15.17 %) y Paracalanus quasimodo (7.72 %) fueron las más abundantes y frecuentes en las islas de Providencia y Santa Catalina. Sin embargo, cabe resaltar que Calocalanus pavo (3.88 %), Corycaeus (U.) lautus (3.8 %), Oithona plumifera (3.09 %), Distioculus minor (3.03 %), Acrocalanus longicornis (2.59 %) y Oncaea mediterranea (2.48 %), fueron muy frecuentes pero con abundancias relativas bajas (Tabla 1).
En cuanto a la distribución de las especies, en la tabla 1 se puede observar que 25 de ellas presentaron un amplio ámbito de distribución alrededor de las islas; U. vulgaris, Calanus sp., Clausocalanus arcuicornis, Acrocalanus longicornis, Paracalanus quasimodo, Calocalanus pavo, Pontella securifer, Candacia pachydactyla, Temora stylifera, Acartia tonsa, Corycaeus sp., C. (U) lautus, C. (O) latus, C. (C) speciosus, Farranula gracilis, Oncaea mediterranea, O. venusta, Copilia mirabilis, Distioculus minor y Oithona plumifera se hallaron entre 20 y 48 estaciones ubicadas en las cinco zonas. Continuamente con un máximo de 15 estaciones entre cuatro zonas se encontraron a Euchaeta marina, Centropages braydi, Labidocera sp., Subeculanaus mucronatus y Paracalanus sp. Las demás especies mostraron una menor frecuencia de aparición.
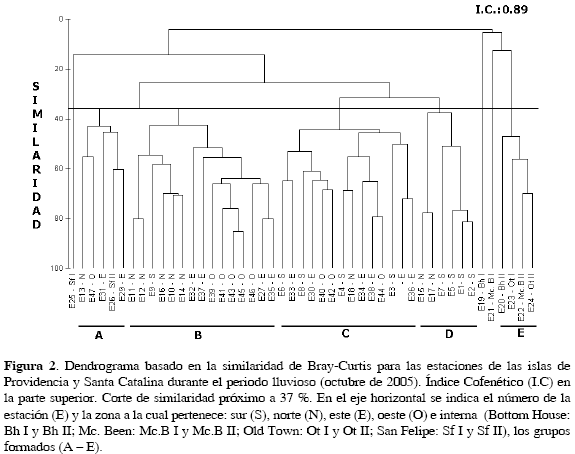
Esta amplia distribución, de más del 50 % de las especies, generó una similaridad en la composición taxonómica de las estaciones. Este comportamiento es más evidente en el análisis de clasificación, donde a partir de un corte de similaridad próximo a 37 % se establecieron cinco grupos (A, B, C, D y E), de los cuales cuatro (A - D) muestran una mezcla de las estaciones ubicadas en las zonas norte, sur, este y oeste y la exclusión de E19, E21 y E25 de la zona interna (Figura 2). El grupo E estuvo formado por estaciones de la zona interna, las cuales presentaron los más bajos valores de abundancia (0.22 - 0.66 ind/1000m3) y número de especies (2-14) en el área de estudio, dominando en ellas Acartia tonsa (54.59 %). Lo opuesto, se observó en el grupo D, reuniendo las estaciones con las mayores abundancias (64.91 - 13.91 ind/1000m3) y el dominio de U. vulgaris (32.28 %), C. arcuicornis (30.18 %) y F. gracilis (8.62 %), especies que en porcentajes menores también se presentaron en las otras agrupaciones.
Los grupos C y B contienen 14 y 15 estaciones respectivamente, que conjugan las zonas este, oeste, norte y sur; sin embargo, cabe resaltar que entre estos dos grupos las abundancias no presentaron diferencias marcadas, como se pudo observar con los grupos A y D. En el grupo C se pudo diferenciar dos subgrupos, los cuales comparten el dominio de C. arcuicornis y U. vulgaris; sin embargo, la subdivisión es ocasionada por la presencia de Oithona plumifera (6.42 %), Distioculus minor (5.53 %), Corycaeus lautus (4.68 %) y Calocalanus pavo (4.02 %) en las estaciones E36, E28, E3, E44, E38, E34, E18 y E4 y F. gracilis (19.31 %), A. longicornis (5.59 %) y Oncaea mediterranea (3.13 %) en las estaciones E42, E40, E30, E8, E33 y E6, que constituyen el segundo subgrupo. De igual manera el grupo B mostró dos subgrupos que presentaron en común el dominio de U. vulgaris y F. gracilis, pero aquí su separación se debió a la presencia adicional de O. mediterranea (7.48 %) y Corycaeus speciosus (5.98 %) en las estaciones E37, E35, E27, E46, E45, E43, E41, E39 y E32 con abundancias relativas altas y C. pavo (18.95%), C. lautus (9.74 %) y O. plumifera (9.08 %) para el segundo con E14, E10, E16, E9, E12 y E11. Finalmente en el grupo A F. gracilis (18.62 %), U. vulgaris (15.61 %), P. quasimodo (12.11 %) y C. lautus (7.16 %), fueron los más representativos.
De acuerdo con la comunidad descrita por Giraldo y Villalobos (1983), se tienen como nuevos registros las especies Clausocalanus arcuicornis, C. furcatus, Calocalanus pavo, C. contractas, Pontella securifer, Lucicutia flavicornis, Subeucalanus mucronatus, Rhincalanus cornutus, Pareucalanus sewelli Centropages bradyi, Acartia tonsa, Lubbockia squillimana, Saphirella tropica, Euterpina sp., Caligus sp. (Figura 3).
Variables físicas
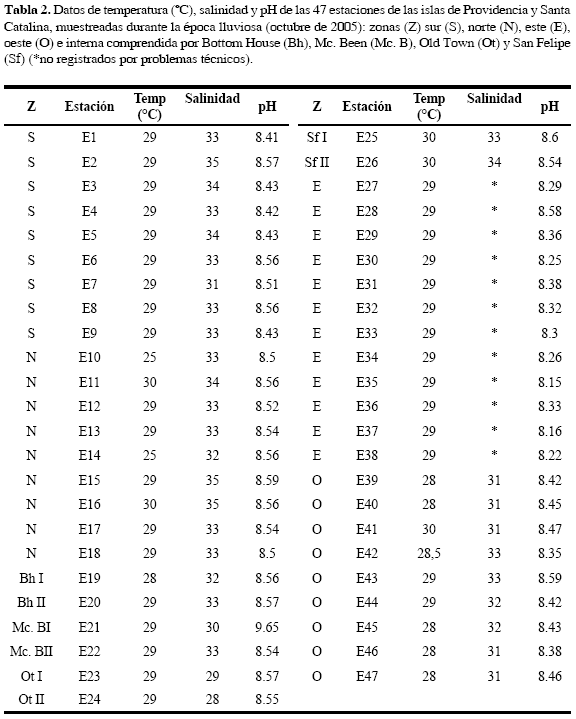
Para las islas de Providencia y Santa Catalina en el mes de octubre de 2005, se registró una temperatura del agua promedio de 28.8±0.05 °C, exhibiendo los valores más altos en E11, E16 (zona norte), E25, E26 (zona interna) y E41 (zona oeste) con 30 °C y el menor en E10 (zona norte) con 25 °C. Respecto a la salinidad, por problemas técnicos no se pudo medir en las estaciones de la zona este, sin embargo los valores obtenidos fluctuaron entre 28 y 34, las salinidades más altas se observaron en E2 (zona sur), E15 y E16 (zona norte) con 35 y las más bajas corresponden a E24 (zona interna), E39, E40, E45, E46 y E47 (zona oeste) con 28 y de acuerdo al pH, E25 (zona interna) presentó el valor más alto con 8.6 y el menor E35 (zona este) con 8.15 (Tabla 2).
De los tres factores físicos (temperatura, salinidad y pH) incluidos en esta correlación (Spearman < 0.05), la salinidad fue el único que presentó una correlación significativa con la densidad total (r= 0.42, p= 0.013, n= 35). Respecto a la temperatura y el pH las correlaciones fueron muy bajas, reflejando que dichas variables no presentan un efecto significativo en la densidad zooplanctónica (rT°= 0.031, p= 0.832; rpH= -0.185, p= 0.214).
DISCUSIÓN
En las muestras de zooplancton de las islas, para esta fecha de muestreo (octubre de 2005), el grupo Copepoda fue el más abundante y diverso con una abundancia relativa de 70.3 % conformado principalmente por copépodos calanoideos y poecilostomatoideos. Este dominio también se observó en los estudios realizados por Giraldo y Villalobos (1983) para el archipiélago de San Andrés y Providencia como además es evidente en diferentes regiones de la gran cuenca del Gran Caribe, por ejemplo, Herman y Beers (1969) para Bermudas obtuvieron una dominancia para este grupo entre 75 y 80 %, en Barbados este valor alcanzó el 78 % (Lewis y Fish, 1969) y en Costa Rica hasta el 95 % (Morales y Murillo, 1996). Castellanos-Osorio y Suárez-Morales (1997), en la zona arrecifal de Mahahual, Quintana Roo (México), y Heidelberg et al. (2004) para Jamaica indican igualmente una dominancia de copépodos mayores del 70 %. Esto se debe probablemente a su amplio ámbito de distribución biogeográfica, presentado la mayoría de las especies una afinidad tropical-subtropical, una distribución batimétrica generalmente superficial (Owre Foyo, 1967; Campos y Suárez-Morales, 1994; López-Salgado et al., 2000; Boxshall y Halsey, 2004; Perlaba y Grazia-Mazzochi, 2004, Tabla 1) y anexamente por su gran capacidad de adaptación a las diversas condiciones de los ecosistemas acuáticos, expresado en su diversidad morfológica y nutricional (Boltovskoy, 1981).
En cuanto a su abundancia y frecuencia de aparición las especies más representativas en este muestreo fueron Undinula vulgaris, Clausocalanus arcuicornis, Farranula gracilis, Paracalanus quasimodo, Calocalanus pavo, Oithona plumifera, Distioculus minor, Acrocalanus longicornis y Oncaea mediterranea. Estas especies, junto con Corycaeus (C.) speciosus y Clausocalanus furcatus, son consideradas oceánicas, típicas de las aguas superficiales del mar Caribe y han sido registradas en los trópicos ecuatoriales, en regiones adyacentes al noroeste del Atlántico, en el Caribe occidental, la corriente de la Florida, la corriente de la Guayana y en el Golfo de México (Owre y Foyo, 1967; Lewis y Fish, 1969; Suárez-Morales y Gasca, 1989; Campos y Suárez-Morales, 1994; López-Salgado et al., 2000).
La presencia de estas especies, junto con Temora stylifera, Pareucalanus sewelli, Euchaeta marina y C. contractus en el área, puede indicar el ingreso de la corriente Ecuatorial del Caribe, debido a su asociación con aguas oceánicas provenientes del sistema de esta corriente, que se presenta con elevadas salinidades y temperaturas mayores a los 20 °C (Calef y Grice, 1967). Esto se observó en el presente estudio con una temperatura entre 25 y 30 °C y salinidades entre 31 y 35, así como por Giraldo y Villalobos (1983), quienes registran temperaturas mayores a 24.9 °C y salinidades de 35.5. A pesar de que estas especies han sido registradas en varios estudios del zooplancton en el Caribe, se han observado algunas particularidades en este estudio. Por ejemplo, que U. vulgaris también ha sido registrada como una especie de tendencia nerítica, indicadora de la influencia de aguas oceánicas en las costas y sistemas arrecifales (Renon, 1993) y que el género Clausocalanus es uno de los más abundantes en medio oligotróficos, en especial en periodos de lluvias, cuando la masa fitoplanctónica es escasa (Frost y Fleminger, 1968; Perlaba y Grazia-Mazzochi, 2004).
De las nueve especies registradas por primera vez (Figura 3), Caligus sp. no es común en la comunidad zooplanctónica debido a sus hábitos de vida, ya que pertenece al grupo de los copépodos parásitos de peces, sin embargo su presencia en este muestreo se puede atribuir, probablemente, a su ciclo de vida en donde los primeros tres estadios de copepoditos son planctónicos (Cressey, 1983); no obstante, se resalta que los estudios sobre las fases de desarrollo de estos organismos son pocos.
La abundancia de la comunidad de copépodos, como su distribución en las islas, estuvo influenciada por el ingreso de la corriente Ecuatorial del Caribe y la temporada ciclónica a la cual se sometió el mar Caribe en el mes de octubre, con un total de cuatro huracanes (Stan, Vince, Wilma y Beta), dos tormentas tropicales y dos depresiones (CIOH, 2005). El complejo arrecifal de Providencia y Santa Catalina se ubica en el área de bifurcación de esta corriente, la cual entra por el lado este con un flujo superficial y pasa después rumbo oeste a suroeste (Díaz et al., 1996). En este punto adyacente con el efecto de masa de los cayos y bancos de la zona central se genera un remolino anticiclónico en la zona sur y por lo tanto una área rica en nutrientes (Garay et al., 1988; Geister, 1992; Andrade y Barton, 2000; López-Salgado et al., 2000; Molares et al., 2004). Esto pudo influir en el registros de las mayores abundancias en las estaciones de esta zona y, conforme a su recorrido, posiblemente ocasionó la distribución paralela de los componentes de la comunidad de copépodos alrededor de Providencia y Santa Catalina, que se intensificó más por el incremento en el movimiento de las aguas circundantes, por el paso de Beta y Wilma (CIOH, 2005), que provocaron aumento en la velocidad de los vientos (≈ 50 nudos), la precipitación y el oleaje, con alturas hasta 5 y 6 m.
Complementario a los anteriores aspectos, cabe destacar que la dinámica hidrológica del archipiélago, cambia a lo largo del año de manera constante (Garay et al., 1988). Esta característica se acopla con la descripción de las aguas oceánico-tropicales como medios relativamente estables, tipificados con pequeñas fluctuaciones estacionales en las variables fisicoquímicas (Webber y Roff, 1995). Esta situación incide, por lo tanto, en no establecer diferencias espaciales de la comunidad, como se observó en el presente estudio, así como en otras áreas de la cuenca del Caribe como Costa Rica (Moore y Sander, 1976) y Jamaica (Yoshioka et al., 1985; Heilderberg et al., 2004).
La segunda área en registrar altos valores de abundancia fue la zona este, lo cual se confiere en conjunto a la entrada de la corriente Ecuatorial por este costado de las islas y a la presencia de la barrera arrecifal, que se describe como un sistema de refugio de organismos, que en muchos casos constituyen su único mecanismo de defensa en la evasión de depredadores y una gran fuente de alimentación (Hamner y Carleton, 1979), permitiendo así una alta concentración de organismos sobre y entre sus estructuras coralinas (Emery, 1968). Sin embargo, su presencia no contribuyó para establecer diferencias en cuanto a la composición, lo cual se observó más claro en el análisis de clasificación, con la formación de cuatro grupos donde se mezclan estaciones de la zona sur, norte, este y oeste (Figura 2).
Respecto a la zona interna, la exclusión de tres de sus estaciones de las agrupaciones formadas a partir del análisis de clasificación y la reunión de cinco en el grupo E (Figura 2), se puede atribuir a sus características físicas y ubicación. En esta zona se hallan aguas terrígenas con una disposición radial hacia el mar destacando el arroyo San Felipe y Bowden Gully (Geister, 1992), lo que les confiere un incremento de material vegetal (e.g tallos, hojas) y por lo tanto el acople y dominio específicamente de Acartia tonsa. Esta especie presenta un amplio ámbito de tolerancia de salinidad y temperatura; sin embargo, ha sido registrada con gran éxito en medios estuarinos y con altos contenidos de material vegetal debido a su capacidad omnívora, la cual le permite ingerir grandes células de fitoplancton (que son comunes en medios con influencia de aguas continentales) y controlar a sus competidores potenciales depredando a sus nauplios y copepoditos (Paffenhofer, 1991). Este comportamiento pudo influir en las bajas abundancias y número de especies de copépodos registrados. De acuerdo con su ubicación, esta zona no se vio muy alterada por los huracanes, debido al efecto de barrera del arrecife coralino para las estaciones de Bottom House (Bh), Mc Been (McB), San Felipe (Sf) y Old Town (Ot), reforzándose además la protección de estos dos últimos lugares por la región montañosa (Geister, 1992).
En síntesis, la comunidad de copépodos de las islas de Providencia y Santa Catalina, se puede caracterizar de tipo pelágico - oceánico y nerítico (i.e. por la influencia de aguas terrígenas por el lado oeste de las islas), siendo Undinula vulgaris, Clausocalanus arcuicornis, Farranula gracilis, Paracalanus quasimodo, Calocalanus pavo, Oithona plumifera, Distioculus minor, Acrocalanus longicornis y Oncaea mediterranea las especies más importantes de acuerdo a su abundancia y frecuencia de aparición. Como nuevos registros están Clausocalanus arcuicornis, C. furcatus, Calocalanus pavo, C. contractus, Pontella securifer, Lucicutia flavicornis, Subeucalanus mucronatus, Rhincalanus cornutus, Pareucalanus sewelli, Centropages bradyi, Acartia tonsa, Lubbockia squillimana, Saphirella trópica, Euterpina sp., Caligus sp. La distribución y abundancia estuvieron afectadas por la corriente Ecuatorial del Caribe, los huracanes Wilma y Beta y por características propias de las islas. Conforme a la importancia de esta comunidad en el funcionamiento de los sistemas acuáticos y la poca información sobre ella, específicamente en la región oceánica del Caribe colombiano, se deberían implementar más estudios que abarquen no solamente aspectos taxonómicos sino también de comportamiento, con base en diversos factores fisicoquímicos (e.g. sustrato, épocas climáticas, horas de colecta, profundidad) y biológicos (e.g. ciclos reproductivos, fases de desarrollo, interacciones con otros organismos) que puedan otorgar mayor información sobre su estructura y por consiguiente obtener datos fundamentales para posteriores análisis.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia, sede Caribe, que llevó a cabo el proyecto "Revalidación de los caladeros de pesca en las islas de Providencia y Santa Catalina, Caribe colombiano" (código 116109-16817) en el cual se enmarcó este trabajo y a COLCIENCIAS, por su apoyo económico. A la Universidad de Bogotá Jorge Tadeo Lozano sede Santa Marta, específicamente al grupo de "Dinámica y Manejo de Ecosistemas Marino-Costeros", por el apoyo científico y académico para analizar las muestras y también a los docentes e investigadores Adolfo Sanjuán y Néstor H. Campos por su apoyo incondicional.
BIBLIOGRAFÍA
1 Andrade, C. A. y E. D. Barton. 2000. Eddy development and motion in the Caribbean Sea. J. Geophys. Res., 26: 105-201. [ Links ]
2 Andrade, C. A., L. Giraldo y S. Lonin. 1996. Nota sobre la circulación de las aguas en el bajo Alicia y el sector de San Andrés Islas. Bol. Cient. CIOH, 17: 27-36. [ Links ]
3 Bernal-Valderrama, A. R. 1994. Aspectos ecológicos de la comunidad de zooplancton nerítico en el departamento del Magdalena. Tesis M. Sc. Biología Marina, Univ. Nacional de Colombia, Santa Marta. 72 p. [ Links ]
4 Bernal, A. R. y S. Zea. 1992. Análisis de los cambios nictimerales y diarios del zooplancton superficial de la bahía de Santa Marta, Mar Caribe colombiano 753-754 En: VIII Seminario Nacional de Ciencias y Tecnologías del Mar, Congreso Centroamericano y del Caribe de Ciencias del Mar, Santa Marta. 1144 p. [ Links ]
5 Bernal, A. R. y S. Zea. 1993. Variaciones nictimerales en la comunidad de zooplancton de la Bahía de Santa Marta, Mar Caribe colombiano. An. Inst Invest. Mar Punta de Betín, 22: 5-20. [ Links ]
6 Bernal, A. R. y S. Zea. 2000. Estructura de la comunidad de zooplancton en condiciones de descarga continental y de afloramiento costero en Santa Marta, Caribe colombiano. Bol. Invest. Mar. Cos., 29: 3-26. [ Links ]
7 Bernal, A. R., B. Werding y S. Zea. 1994. Variación espacial y temporal de biomasa zooplanctónica en el sector nerítico del mar Caribe colombiano. 187-196. En: Campos, N. H. y A. Acero (Eds.) Contribuciones en ciencias del mar en Colombia Investigación y desarrollo de territorios promisorios. Universidad Nacional de Colombia, Bogotá. 262 p. [ Links ]
8 Boltovskoy, D. (Ed.). 1981. Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton marino. Publicación Especial del INIDEP, Mar del Plata, Argentina. 936 p. [ Links ]
9 Boxshall, G. A. y S. H. Halsey. 2004. An introduction to copepod diversity. The Dorset Press, Dorchester. Reino Unido. 421 p. [ Links ]
10 Calef, G. W. y G. D. Grice. 1967. Influence of the Amazon river outflow on the ecology of the western tropical Atlantic II. J. Mar. Res., 25: 84-94. [ Links ]
11 Camacho-Casas, G. 1978. Características hidrográficas y zooplanctónicas de la Ciénaga Grande de Santa Marta. Instituto Nacional de los Recursos Naturales Renovables y del ambiente (INDERENA). Proyecto de ecodesarrollo-actividad ecológica de aguas. Cartagena, Colombia. 65 p. [ Links ]
12 Camargo-Fajardo, L. F. 1994. Estudio cualitativo y semicuantitativo del zooplancton superficial en el embalse El Guajaro (Atlántico) Colombia. Trianea (Act. Cien. Tecn. INDERENA), 5: 235-253. [ Links ]
13 Campos, A. y E. Suárez-Morales. 1994. Copépodos pelágicos del golfo de México y mar Caribe. I. Biología y sistemática. Centro de Investigaciones de Quintana Roo (CIQRO), México. 353 p. [ Links ]
14 Castellanos-Osorio, I. A. y E. Suárez-Morales. 1997. Observaciones sobre el zooplancton en la zona arrecifal de Mahahual, Quintana Roo (mar Caribe mexicano). An. Inst. Biol. Univ. Nac. Auton. Mex. Zool., 68 (2): 237-252. [ Links ]
15 CIOH. 2005. Boletín meteomarino del Caribe colombiano. Centro de Investigaciones Oceanográficas e Hidrológicas de la Armada Nacional de Colombia. Cartagena. 123: 3-4. [ Links ]
16 Clarke, K. R. y R. M. Warwick. 2001. Change marine communities: An approach to statistical analysis and interpretation. Segunda edición. PRIMER-E Ltd. Plymouth Marine Laboratory, Plymouth, Reino Unido. 165 p. [ Links ]
17 Cressey, R. F. 1983. Crustaceans as parasites of other organisms. 251-273. En: Bliss, D. E., y A. J. Provenzano, Jr., (Eds.). The biology of the crustacea, Vol 6 (5). Academic Press, Inc. Nueva York. 290 p. [ Links ]
18 Deboyd, L. y A. Smith 1977 Guide to marine zooplankton and marine invertebrate larvae Editorial Kendall/Hunt. California, EE. UU. 161 p. [ Links ]
19 Díaz, J. M., G. Díaz., J. Garzón., J. Geister., J. A. Sánchez y S. Zea. 1996. Atlas de los arrecifes coralinos del Caribe colombiano y complejos arrecifales oceánicos. Primera edición. INVEMAR. Santa Marta. 83 p. [ Links ]
20 Emery, A. R. 1968. Preliminary observation on coral reef plankton. Limnol. Oceanogr., 13: 293-303. [ Links ]
21 Franco, A., D. R. Avendaño, W. Bernal y M. Uribe. 1992. Contribución al conocimiento del plancton de isla Tesoro, Parque Nacional Natural Corales del Rosario, Caribe colombiano. 754-762. En: VIII Seminario Nacional de Ciencias y Tecnologías del Mar, Congreso Centroamericano y del Caribe de Ciencias del Mar, Santa Marta. 1144 p. [ Links ]
22 Frost, B. y A. Fleminger. 1968. A revision of the genus Clausocalanus (Copepoda: Calanoida) with remarks on distributional patterns in diagnostic characters Bull Scripps Int. Ocean., 12: 1-235. [ Links ]
23 Garay, J., F. Castillo., C. Andrade., J. Aguilera., L. Niño., M. de la Pava., W. López y G. Márquez. 1988. Estudio oceanográfico del área insular y oceánica del Caribe colombiano. Archipiélago de San Andrés y Providencia y cayos vecinos. Bol. Cient CIOH, 9: 3-73. [ Links ]
24 Geister, B. J. 1992. Modern reef development and Cenozoic evolution of an oceanic island/ref complex: Isla de Providencia (western Caribbean Sea, Colombia). Erlangen, 27: 1-70. [ Links ]
25 Giraldo, R. A. y S. A. Villalobos. 1983. Composición y distribución del zooplancton superficial de San Andrés y Providencia y su relación con algunos parámetros fisicoquímicos: Crucero Océano V Área I. Tesis Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 82 p. [ Links ]
26 Hamner, W. M. y J. H. Carleton. 1979. Copepod swarms: Attributes and roles in coral reef ecosystems. Limnol. Oceanogr., 24 (1): 1-14. [ Links ]
27 Heidelberg, K. B., K. P. Sebens y J. E. Purcell. 2004. Composition and sources of near reef zooplankton on a Jamaican forereef along with implications for coral feeding. Coral Reefs, 23: 263-276. [ Links ]
28 Herman, S. y J. R. Beers. 1969. The ecology of inshore plankton populations in Bermuda. Part II. Seasonal abundance and composition of the zooplankton. Bull. Mar Sci., 19: 487-503. [ Links ]
29 Humes, A. G. 1994. How many copepods?. Hydrobiologia, 292/293: 1-7. [ Links ]
30 IGAC. 1986. San Andrés y Providencia: Aspectos geográficos. Instituto Geográfico Agustín Codazzi, Bogotá. 155 p. [ Links ]
31 Kleppel, G. S. 1993. On the diets of calanoids copepods. Mar. Ecol. Prog. Ser., 99: 183-195. [ Links ]
32 Lewis J. B. y A. G. Fish. 1969. Seasonal variation of the zooplankton fauna of surface waters entering the Caribbean sea at Barbados. Carib. J. Sci., 9: 1-24. [ Links ]
33 López-Salgado, I., R. Gasca y E. Suárez-Morales. 2000. La comunidad de copépodos (Crustacea) en los giros a mesoescala en el occidente del Golfo de México (Julio, 1995). Rev. Biol. Trop. 48 (1): 435-446. [ Links ]
34 Molares, B. R., J. T. Vanegas., V. J. Bustamante y A. C. Andrade. 2004. Aspectos oceanográficos de las aguas sobre la depresión Providencia en mayo de 2004. Bol. Cient. CIOH, 22: 11- 25. [ Links ]
35 Moore, E. y F. Sander. 1976. Quantitative and qualitative aspects of zooplankton and breeding of copepods at two Caribbean coral reef stations. Est. Coast. Mar. Sci., 4: 489-607. [ Links ]
36 Morales, R. A. y M. M. Murillo. 1996. Distribution, abundance and composition of coral reef zooplankton, Cahuita National Park, Limón, Costa Rica. Rev. Biol. Trop., 44 (2): 619-630. [ Links ]
37 Owre, H. B. y M. Foyo. 1967. Copepods of the Florida current. Manuals for the identification of the fauna of the tropical Western Atlantic Fauna caribaea: Crustacea, Part I: copepoda Institute of Marine Science, Miami. 137 p. [ Links ]
38 Paffenhofer, G. A. 1991. Some characteristics of abundant subtropical copepods in estuarine, shelf and oceanic water. Bull. Plankton Soc. Japan, Spec., 1: 201-216. [ Links ]
39 Perlaba, U. y M. Grazia-Mazzocchi. 2004. Vertical and seasonal distribution of eight Clausocalanus species (Copepoda: Calanoida) in oligotrophic water. J. Mar Sci., 61: 645-653. [ Links ]
40 Ramírez, A. 1999. Ecología aplicada: diseño y análisis estadístico. Universidad de Bogotá Jorge Tadeo Lozano, Bogotá. 325 p. [ Links ]
41 Raymont, J. 1983. Plankton and productivity in the oceans. Pergamon Press International Library. Oxford. EE. UU. 824 p. [ Links ]
42 Reid, J. W. 1990. Continental and coastal free-living Copepoda (Crustacea) of México, Central America and the Caribbean region. 174-213. En: Navarro, D. y J. Robinson (Eds.). Diversidad biológica en la reserva de la biosfera de Sian Kaán Quintana Roo, México. Centro de Investigaciones de Quintana Roo/Program of Studies in Tropical Conservation, University of Florida, México. 598 p. [ Links ]
43 Renon, J. P. 1993. Répartition du copépode planctonique Undinula vulgaris Dana dans trois type de mixieux coralliens. Ann. Inst. Oceanogr., 69: 239-247. [ Links ]
44 Rentería de Monsalve, B. 1975. Dinámica zooplanctónica e hidrográfica de la bahía de Cartagena. Divulg. Pesq., 10 (4-5): 1-15. [ Links ]
45 Rentería de Monsalve, B. 1976. Fauna planctónica de la Ciénaga Grande de Santa Marta y su relación con el medio. Divulg. Pesq., 11 (4-5): 1-15. [ Links ]
46 Strahler, A. N. y A. H. Strahler. 1976. Elements of physical geography. Nueva York, John Wiley. 469 p. [ Links ]
47 Suárez-Morales, E. y R. Gasca. 1989. Copépodos epiplanctónicos (Crustacea) del Canal de Yucatán (mayo- junio, 1984). Carib. J. Sci., 25 (3-4): 196-202. [ Links ]
48 Suárez-Morales, E. y R. Gasca. 2000. The planktonic copepod community at Mahahual reef, Western Caribbean. Bull. Mar. Sci., 66 (1): 255-267. [ Links ]
49 Susuki. K., Y. Nokamua y J. Hirami. 1999. Feeding by the small Calanoid copepod Paracalanus sp. A heterotrophic dinoflagellates and ciliates. Aquat. Microbiol. Ecol., 17: 99-103. [ Links ]
50 Trégouboff, G. y M. Rose. 1957. Manual de planctonologie Méditerranéenne. Ilustrations. Centre National de la Recherche Scientifique. París 128 p. [ Links ]
51 Turner, T. J. 2004. The important of small planktonic copepods and their roles en pelagic marine food webs. Zool. Stud., 43 (2): 255-266. [ Links ]
52 Turner, J. T. y J. C. Roff. 1993. Trophic levels and trophospecies in marine plankton: Lessons from the microbial food web. Mar. Microb. Food Webs, 7: 225-248. [ Links ]
53 UNC. 2004. Proyecto de revalidación de caladeros de las islas de Providencia y Santa Catalina, Caribe colombiano. Universidad Nacional de Colombia, San Andrés. 24 p. [ Links ]
54 Webber, M. K. y J. C. Roff. 1995. Annual structure of the copepod community and its associated pelagic environmental off Discovery Bay, Jamaica. Mar. Biol., 123: 467-479. [ Links ]
55 Yoshioka, P. M., G. P. Owen y D. Pesante. 1985. Spatial and temporal variations in Caribbean zooplankton near Puerto Rico. J. Plankton Res., 7 (6): 733-751. [ Links ]
FECHA DE RECEPCIÓN: 14/11/07 FECHA DE ACEPTACIÓN: 24/03/09