Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.38 no.2 Santa Marta July/Dec. 2009
COMPARACIÓN TEMPORAL EN LA ESTRUCTURA DE UNA COMUNIDAD CORALINA EN PRIMEROS ESTADOS DE SUCESIÓN, ISLA DE SAN ANDRÉS, COLOMBIA
TEMPORAL COMPARISON IN THE CORAL COMMUNITY STRUCTURE IN ITS EARLY SUCESIONAL STATE, SAN ANDRES ISLAND, COLOMBIA
Juliana Jaramillo-González y Alberto Acosta
Pontificia Universidad Javeriana, Unidad de Ecología y Sistemática - UNESIS, Cra 7 # 43-82. Bogotá, Colombia, julijaramillo@gmail.com (J.J.G.), laacosta@javeriana.edu.co (A.A.)
RESUMEN
Los arrecifes coralinos del mundo han sufrido un declive durante las pasadas tres décadas. Estos cambios se han evaluado en arrecifes en franja; sin embargo, se desconoce si los tensores causantes de dichos cambios afectan la dinámica de una comunidad coralina en los primeros estados de la sucesión antes del desarrollo de un arrecife. Para resolver este interrogante, se monitoreó durante 2004, 2005 y 2006 una comunidad coralina aislada en San Andrés. Se compararon temporalmente la abundancia, cobertura y mortalidad parcial sufrida por la comunidad coralina y sus poblaciones de coral dominantes. La comunidad coralina no presentó variación estadística en riqueza, abundancia, cobertura, ni en área de mortalidad parcial. Sin embargo, esta comunidad sí varió en composición con la entrada de dos especies de coral (Acropora cervicornis y Scolymia cubensis) y la salida de otras dos especies coralinas (Diploria clivosa y Siderastrea siderea) sugiriendo procesos locales de extinción (causados posiblemente por sedimentación y resuspensión) y colonización (dispersión). Aunque la comunidad coralina como un todo mostró estabilidad, la mortalidad parcial de tres de sus especies dominantes (Montastraea annularis, Porites astreoides y Colpophyllia natans) aumentó y la cobertura de Agaricia agaricites disminuyó en el tiempo (siendo la población más sensible en este sistema). Los resultados sugieren una dinámica similar pero más rápida a la registrada en etapas avanzadas de desarrollo arrecifal (arrecifes franjeantes), donde las variables más sensibles actúan a nivel de población (no comunidad), siendo la mortalidad parcial el factor más importante al explicar la tasa de recambio de especies (composición), la pérdida anual de cobertura coralina y cambios en la distribución de talla colonial de las poblaciones dominantes.
PALABRAS CLAVE: Cambio estructural, Comunidad coralina, Dinámica, Mortalidad parcial, Sucesión.
ABSTRACT
The coral reefs worldwide have suffered a decline during the past three decades. These changes have been evaluated in fringing reefs; nevertheless, it is not known if the factors causing those changes affect the coral community dynamics during the first states of the succession, before the development of a reef. To resolve this question, during 2004, 2005, and 2006 we monitored an isolated coral community in San Andres. We compared trough time the abundance, coverage and partial mortality suffered by the coral community and its dominant coral populations. The coral community did not present statistical variation in richness, abundance, coverage, neither in the area of partial mortality. However, this community did change in composition with the entry of two coral species (Acropora cervicornis and Scolymia cubensis) and the exit of other two coral species (Diploria clivosa and Siderastrea siderea) suggesting local processes of extinction (caused possibly by sedimentation and resuspension) and colonization (dispersion). Although the coral community as a whole showed stability, the partial mortality of three of its dominant species (Montastraea annularis, Porites astreoides and Colpophyllia natans) increased and the coverage of Agaricia agaricites diminished over time (been the population more sensitive in this system). These results suggest similar but faster dynamic when compared to the theory reported to advanced stages of reef development (fringing reefs), where the more sensitive variables appeared at population rather than community level, partial mortality being the most important factor explaining the rate of replacement of species (composition), the annual lost of coral coverage, and changes in colonial size distribution of the dominant populations.
KEY WORDS: Coral community, Dynamics, Partial mortality, Structural change, Succession.
INTRODUCCIÓN
Los arrecifes coralinos son considerados uno de los ecosistemas más diversos y productivos del planeta, pues albergan el 70 % de la biodiversidad marina (Connell, 1978) y producen aproximadamente 5-20 gC/m2/día, a pesar de crecer en aguas a veces oligotróficas (Garzón-Ferreira, 1997). Su formación en islas oceánicas es un proceso de sucesión ecológica ligado a la erupción de volcanes profundos, que dan como resultado la constitución de islas (Castro y Huber, 2000). El primer paso para la conformación de arrecifes coralinos insulares es la colonización del sustrato por parte de larvas de coral, las cuales con el tiempo forman sobre éste un mosaico irregular de colonias coralinas aisladas que sirve de hábitat para otros corales y organismos sésiles, este mosaico se conoce como tapete coralino (Díaz et al., 2000) y es el primer estado sucesional en este proceso. El crecimiento hacia arriba y hacia los lados de las colonias inicialmente aisladas hace que éstas se fusionen entre sí y se compacten (Díaz et al., 2000) formando una comunidad coralina (segundo estado sucesional) que, según Pandolfi (2002), se define como un grupo de organismos que se encuentran en una proximidad cercana uno del otro en un mismo tiempo. En este estudio se considera el tapete y la comunidad coralina como los primeros estados de sucesión (deinida como el patrón no estacional, direccional y continuo de colonización y extinción de las poblaciones de especies en una comunidad, o simplemente como la distribución cronológica de organismos y secuencia ecológica de especies o comunidad que se predice ocurrirá dentro de un área o habitat según un tipo particular de disturbio; Begon et al, 2006) en la conformación de tipos de arrecifes de mayor complejidad.
Continuando con el proceso de sucesión ecológica, la comunidad coralina se levanta paulatinamente hacia la superficie (crecimiento vertical) dando origen a un arrecife tridimensional en franja el cual es más desarrollado, complejo, resistente y resiliente. Debido a procesos tectónicos sucedidos alrededor de la isla o costa en la que se desarrolla, el arrecife en franja se puede convertir en arrecife barrera. Por último, a partir de un arrecife barrera se puede generar un anillo de cobertura coralina conocido como atolón (Díaz et al, 1996; Castro y Huber, 2000; Veron, 2000). Los arrecifes en franja, barrera y atolón son considerados como etapas sucesionales avanzadas, pero las etapas previas para llegar a ellos se caracterizan por presentar una comunidad o ensamble coralino típico, cuya composición y cobertura depende de las condiciones geomorfológicas y oceanógraficas del lugar.
Debido a la gran importancia a nivel económico, turístico y recreacional, los arrecifes coralinos son fuente importante de bienes y servicios (Geister y Díaz, 1997; Moberg y Folke, 1999). Sin embargo, este beneficio proporcionado a los habitantes de zonas aledañas se encuentra en peligro, ya que en las pasadas tres décadas se ha observado un patrón general de declive de estos sistemas en varias regiones del Caribe, incluyendo Colombia (ver Hughes, 1989, 1996; Hughes y Tanner, 2000; Linton y Fisher, 2004; Martínez y Acosta, 2005; Rodríguez-Ramírez et al, 2006). Este patrón de degradación es atribuido a la incidencia de frecuentes e intensos disturbios que ocurren en múltiples escalas (Connell et al, 1997; Hughes y Connell, 1999) tales como exposición al oleaje (Prahl, 1989), fluctuación de las condiciones ambientales (Pinzón et al, 1998; Pandolfi, 2002; Berkelmans et al, 2004), variación en producción de nutrientes (Huston, 1985) y resuspensión de sedimento (Díaz et al, 1996).
Este deterioro se ha evidenciado en la reducción de diversidad y cobertura coralina (Gardner et al, 2003; Martínez y Acosta, 2005) e incremento en enfermedades y cobertura de macroalgas y zoantídeos (Salazar-Vallejo, 2002; Valdivia y de la Guardia, 2004; Acosta et al, 2005). Lo anterior ha conllevado a un cambio en la composición de este ecosistema, ya que en varios lugares han pasado de ser sistemas dominados por especies coralinas formadoras de arrecifes de crecimiento tridimensional, como Acropora sp. y Montastraea sp. (Hughes, 1984; Pandolfi, 2002), a sistemas constituidos principalmente por especies como Agaricia sp., Porites sp. (Gardner et al, 2003; Vidal et al, 2005) o macroalgas (Hughes, 1996).
Así mismo, se ha encontrado que algunas de las poblaciones coralinas halladas en los arrecifes han variado su estructura (Bak y Meesters, 1998). Esta variación se ve reflejada en la distribución de tallas de sus colonias (Meesters et al., 2001), la cual es el resultado de procesos como mortalidad parcial o total, fisión y fusión de colonias y tasa de reclutamiento (Hughes y Jackson, 1980, 1985; Acosta y Acevedo, 2006; Alvarado 2008).
En el caso de Colombia el monitoreo realizado por el SIMAC (Sistema Nacional de Monitoreo de Arrecifes Coralinos; Rodríguez-Ramírez et al., 2005) entre 1998 y 2004, mostró que los arrecifes en franja de la costa Caribe disminuyeron la cobertura coralina. Así mismo, Martínez y Acosta (2005) registraron un decrecimiento en cobertura en los arrecifes en franja de Punta Betín, Morro Grande, ensenada de Granate entre 1989 y 2002, y bahía Gayraca entre 1992 y 2002. En San Andrés, el monitoreo hecho por el SIMAC también mostró una disminución de área de tejido coralino vivo (Rodríguez-Ramírez et al., 2005). Mismo resultado presentó el estudio de Arango (2002) entre 1995 y 2002 en la isla de Providencia. No obstante, el monitoreo de Garzón-Ferreira et al. (2002), llevado a cabo entre el 2000 y 2002 en Providencia, indicó resultados contrastantes, ya que el arrecife estudiado ganó cobertura coralina. Al igual que las comunidades, las poblaciones coralinas del Caribe colombiano también han disminuido su cobertura en los últimos años. Sin embargo, se sabe poco acerca de su distribución de tallas, a excepción de Dendrogyra cylindrus (Acosta y Acevedo, 2006), y la forma en que factores como el hábitat, recursos disponibles y disturbios naturales o antropogénicos afectan las tasas de reclutamiento, crecimiento, sobrevivencia y mortalidad de estas poblaciones.
No obstante, los estudios que han determinado el declive coralino y dinámica del sistema tanto en el Caribe como en Colombia se han llevado a cabo en escalas temporales mayores a cinco años y en arrecifes en franja continuos (etapa sucesional avanzada), sin embargo no se conocen estudios sobre la dinámica de comunidades coralinas aisladas espacialmente (etapas tempranas de sucesión). Según Brewer (1988) y Temperton et al. (2004), estas comunidades, por ser el segundo estado sucesional en la formación de arrecifes coralinos (menor complejidad estructural), deberían responder rápidamente a los cambios externos tanto a nivel de estructura como de función. La comprensión de este modelo explicativo ayudará a entender la dinámica de ecosistemas degradados (retroceso en la sucesión). Es por ello que el presente estudio tiene como objetivo veriicar, para una comunidad coralina (isla de San Andrés, Caribe colombiano), si en corta escala temporal existe variación en composición, diversidad, riqueza, abundancia, cobertura y mortalidad parcial, tanto a nivel de la comunidad como un todo, como a nivel de las poblaciones de coral dominantes.
ÁREA DE ESTUDIO
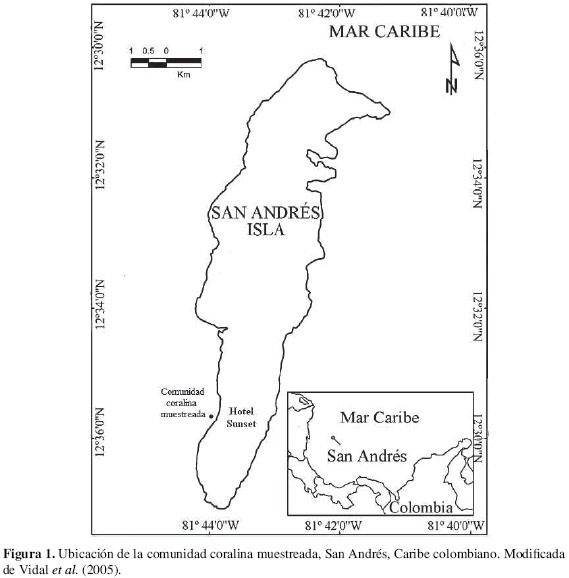
La isla de San Andrés se encuentra ubicada en el mar Caribe a 150 km al sudeste de Nicaragua y 800 km de la costa colombiana (Figura 1; Díaz et al, 1995). Esta isla de origen volcánico (basamento a más de 1000 m de profundidad) formada desde el Oligoceno-Mioceno (Díaz et al, 1996) presenta una superficie de 25 km2, un promedio de temperatura anual de 27 °C y precipitación media de 1900 mm. La superficie oceánica adyacente a la isla presenta una temperatura superficial promedio de 27.5 °C, siendo menor entre febrero y marzo (26.8 °C) y mayor entre agosto y septiembre (30.2 °C). La salinidad del agua fluctúa entre 34 y 36.3 (Geister y Díaz, 1997). A partir de la segunda mitad del año se pueden presentar tormentas esporádicas debido a que la isla está ubicada dentro del cinturón de huracanes del Caribe (Díaz et al, 1996).
Los arrecifes coralinos de la isla representan el 77 % de las áreas coralinas de Colombia (Díaz et al., 2000) y poseen 35 de las 115 especies de corales escleractíneos registradas en el Caribe (Reyes, 2000; Vidal et al., 2005). Estas especies se encuentran distribuidas en cinco unidades ecológicas entre 0 y 60 m: 1) Costras de coral sobre roca, 2) Acroporapalmata - Diploria strigosa, 3) Octocorales - Corales mixtos, 4) Corales mixtos, y 5) Agaricia sp. - Corales mixtos (Díaz et al., 2000). La isla presenta en el oeste tapete coralino, comunidades coralinas y arrecife en franja; en el este comunidades coralinas en la laguna, arrecife barrera (continua y discontinua) y pináculos; hacia el norte comunidades coralinas en la laguna y arrecife barrera y hacia el sur comunidades coralinas y arrecife en franja. La mayor parte de los estudios y monitoreos de coral se han realizado sobre el arrecife en franja de los costados oeste y norte de la isla (Díaz et al., 1996).
El decaimiento de los arrecifes coralinos de la isla de San Andrés se atribuye principalmente a factores de tipo natural y antropogénico. Dentro de las causas naturales se encuentran: los huracanes (Salazar-Vallejo, 2002), el calentamiento global (Pinzón et al., 1998; Berkelmans et al., 2004), las enfermedades epidémicas (Díaz et al., 1995) y la depredación (Huston, 1985); como causas antropogénicas se reconocen las actividades extractivas de recursos renovables, la contaminación por hidrocarburos, aguas negras y desechos sólidos y la destrucción física accidental del coral (Díaz et al., 1995).
Estación de muestreo
La comunidad coralina muestreada en este estudio se encuentra en la terraza sur - occidental de sotavento de San Andrés (12° 30' 02.7'' N y 81° 43' 54.3'' W). Esta comunidad fue seleccionada por: 1) ser somera (9.6 m) y encontrarse aislada del arrecife en franja por una matriz de arena, lo cual permite su fácil identificación y delimitación, 2) su área (15.2 m2), ya que facilita el estudio de todas las especies de coral de la comunidad, y 3) la poca distancia a la que se encuentra de la costa (aproximadamente 63.6 m; Figura 1). Cabe notar que al estar rodeada por la matriz de arena, la comunidad coralina está expuesta a constante sedimentación por partículas finas, mediado por corrientes, mareas y oleaje, siendo este el factor de estrés más conspicuo.
Para conocer la variación de la estructura de la comunidad coralina y sus poblaciones de coral se cuantificaron una vez por año en 2004, 2005 y 2006 la abundancia, cobertura y mortalidad parcial de cada colonia de coral encontrada en ella. Para obtener el valor de cobertura se midió el largo y ancho máximos de cada colonia (expresando el producto en área), y para evaluar la mortalidad parcial, definida como el área de tejido muerto que cubre una colonia coralina (Torres, 2003), se estimó porcentualmente el valor de tejido muerto con respecto al área total de la colonia, para luego por medio de una regla de tres convertir este porcentaje a centímetros cuadrados.
Para cada especie coralina se determinó la abundancia total, cobertura total en cm2 (sumatoria de la cobertura de cada colonia), el área de mortalidad parcial total en cm2 (sumatoria de la mortalidad parcial de cada colonia) y el porcentaje de cambio (Valor de la variable en el 2006/Valor de la variable en el 2004) de estas tres variables entre 2004 y 2006. Adicionalmente, para la comunidad coralina como un todo, se calculó la abundancia total (sumatoria de la abundancia de todas las especies coralinas), la cobertura total en cm2 (sumatoria de la cobertura de todas las especies coralinas), el área de mortalidad parcial total (sumatoria del área de mortalidad parcial de todas las especies coralinas) y el porcentaje de cambio (Valor de la variable en el 2006 x 100%/Valor de la variable en el 2004) de estas tres variables entre 2004 y 2006.
Por otra parte, se estimaron los índices de riqueza de Margalef (S-1/LnN), diversidad de Shannon (H = - ∑Pi*LnPi) y la equidad (H/LnS) para cada año estudiado. Así mismo se halló la varianza de la diversidad (VarH = {∑Pi(LnPi)2=(∑Pi*LnPi)/N}-{S-1/2N2}) de cada uno de los años y se empleó la prueba t para comparar en el tiempo el índice de Shannon según Magurran (1998), de la siguiente manera:
t = H1-H2/(VarH1+VarH2)1/2
t = H1-H3/(VarH1+VarH3)1/2
t = H2-H3/(VarH2+VarH3)1/2
donde H1, H2 y H3 es la diversidad del 2004, 2005 y 2006 respectivamente, y la VarH1, VarH2 y VarH3 es la varianza de la diversidad de los años 2004, 2005 y 2006, respectivamente.
A su vez, con cada una de las variables estudiadas en las poblaciones coralinas (abundancia, cobertura y mortalidad parcial), se calculó el índice de fluctuación (conocido también como índice de Dubois) de la comunidad coralina para cada año. Este índice permite ver los años en los que alguna variable fue estable o presentó un cambio condicionado por alguna especie. El índice compara por ejemplo la abundancia total y relativa de las especies de coral para un determinado año y se estima de la siguiente manera (Guisande et al. 2006):
D = ∑Pi*Log2 (Pi/Pim)
donde Pi es la proporción relativa de la variable i y Pim el estado de referencia, que se calcula como la media de las proporciones relativas de la variable i durante el período de estudio. Los valores bajos (cercanos a 0) representan estabilidad y los valores altos (cercanos o mayores a 1) representan gran fluctuación en la comunidad.
Para conocer si la variación entre los años fue estadísticamente significativa, por medio del programa estadístico SPSS 13.0 se comprobó la normalidad (pruebas de Kolmogorov-Smirnov cuando n>30; Shapiro-Wilk cuando n<30) y la homogeneidad de varianzas (prueba de Levene) del número de colonias, cobertura y mortalidad parcial. La abundancia y cobertura total de la comunidad coralina y la abundancia por especie no lograron distribución normal con ninguna transformación, razón por la cual fueron comparadas en el tiempo con la prueba no paramétrica de Kruskal-Wallis (p= 0.05). La mortalidad parcial de la comunidad coralina como un todo fue transformada con el Ln(x) (Guisande et al., 2006) y comparada en el tiempo con un análisis de varianza a una vía (ANOVA, p= 0.05).
Las coberturas de Eusmilia fastigiata, Mycetophyllia lamarkiana, Diploria labyrinthiformis e Isophyllastrea rigida no fueron transformadas por presentar una distribución normal, mientras que las de Leptoseris cucullata, Porites porites y Mycetophyllia ferox se transformaron con Ln(x) y la de Favia fragum con 1/(x), ello con el objetivo de comparar en el tiempo dicha variable, para cada una de estas especies, mediante un análisis de varianza a una vía (ANOVA, p= 0.05). Las 13 especies restantes de la comunidad coralina no presentaron una distribución normal en cuanto a su cobertura con ninguna transformación, así que su comparación temporal se hizo por medio de Kruskal-Wallis (p= 0.05).
Los datos de la variable mortalidad parcial para Madracis decactis, Montastraea cavernosa y P. porites no fueron transformados, mientras que para Porites astreoides y Colpophyllia natans sí se transformaron por medio de Ln(x) y 1/(x2), respectivamente (Guisande et al., 2006), motivo por el cual la comparación temporal de mortalidad parcial se realizó con un análisis de varianza de una vía (ANOVA, p= 0.05). Por su parte, los datos de mortalidad parcial para Montastraea annularis y Agaricia agaricites no mostraron una distribución normal con ninguna transformación, y para Montastraea franksi, L. cucullata, E. fastigiata y M. ferox se presentaron un número bajo de colonias afectadas por mortalidad parcial, razón por la cual para estas seis especies coralinas se comparó la mortalidad parcial en el tiempo con Kruskal-Wallis (p= 0.05).
En los casos donde los análisis estadísticos mostraron diferencias signiicativas en el tiempo para la abundancia, cobertura y mortalidad parcial, a nivel de la comunidad o de las poblaciones coralinas, se aplicaron las pruebas de
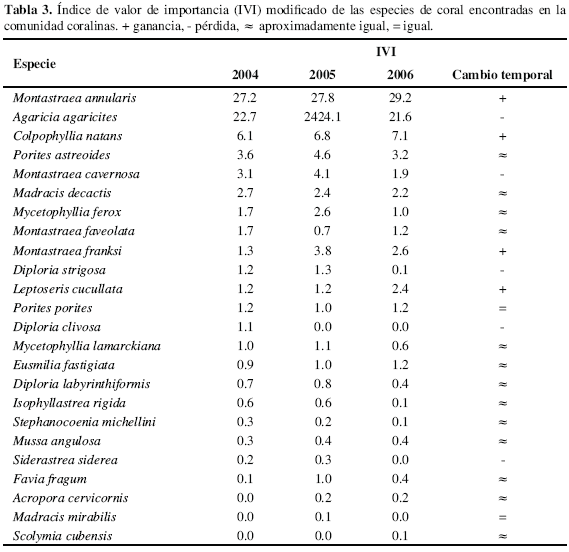
comparación múltiple de Mann-Whitney (p= 0.05), para las diferencias arrojadas por Kruskal-Wallis, y de Tuckey (p= 0.05), para las diferencias halladas por medio de la ANO VA. Adicionalmente, se calculó para cada población coralina de la comunidad el índice de valor de importancia (IVI) en cada año así:
IVI = (% Cobertura de cada población + % Densidad de colonias de la población por m2)/2
Cabe notar que para el cálculo del IVI no se tuvo en cuenta el porcentaje de frecuencia relativa de cada población ya que sólo se muestreó una comunidad coralina. El IVI da una idea de la importancia relativa de las poblaciones en la comunidad. Las poblaciones se categorizaron, de forma arbitraria, según la variación del índice IVI en el tiempo (2004-2006) de la siguiente forma: 1) si aumentaron una unidad o más, ganaron importancia relativa en el tiempo; 2) si disminuyeron una unidad, perdieron importancia en el tiempo; y 3) aumentaron o disminuyeron en menos de una unidad, presentaron una importancia relativa similar en el tiempo.
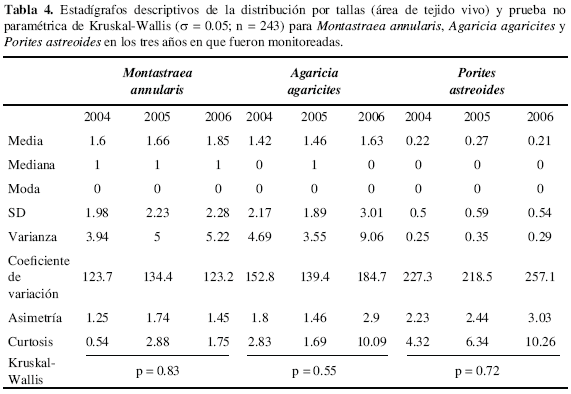
Basándose en la metodología empleada por Bak y Meesters (1999), se realizó para las especies más importantes de la comunidad (valores más altos de IVI) la distribución de talla (cm2) de sus colonias, tanto en escala lineal como en escala Log normal. Esta distribución se representó en histogramas comparativos y se calcularon estadígrafos descriptivos para comparar los tres años monitoreados, para ello se siguió la metodología empleada por Bak y Meesters (1998). Por último, con el fin de conocer la existencia de diferencias significativas en la distribución de tallas de las especies coralinas más importantes de la comunidad, se comprobó la normalidad (pruebas de Kolmogorov-Smirnov cuando n>30; Shapiro-Wilk cuando n<30) y la homogeneidad de varianzas (prueba de Levene); al no cumplirse estos dos supuestos para ninguna de las especies, se aplicó la prueba no paramétrica de Kruskal-Wallis (p= 0.05).
RESULTADOS
La comunidad coralina se encontró compuesta por 21 especies de coral en 2004 y 2006 y 22 en 2005 (Tabla 1). La composición de corales escleractíneos varió en un 16.6 % en los tres años debido al ingreso a la comunidad coralina de Acropora cervicornis en 2005 y Scolymia cubensis en 2006 y la salida de Diploria clivosa y Siderastrea siderea en 2005 y 2006, respectivamente (Tabla 1).
La riqueza, diversidad y equidad de la comunidad coralina monitoreada se mantuvieron relativamente constantes en el tiempo (Tabla 2). La relativa estabilidad de la comunidad se ratificó con: 1) la prueba t de Shannon, pues la diversidad no presentó diferencias significativas entre 2004 y 2005 (p>0.05), 2004 y 2006 (p>0.05) y 2005 y 2006 (p>0.05); y 2) el índice de fluctuación, ya que la abundancia y cobertura total de las especies no fluctuaron en el tiempo (valor cercano a cero; Tabla 2). Sin embargo, la mortalidad parcial total de las especies de la comunidad presentó moderada fluctuación, particularmente en 2004 (Tabla 2).
Ni la comunidad coralina (Kruskal-Wallis; n= 64; p= 0.9) ni ninguna especie de coral presentaron diferencias significativas en abundancia entre 2004 y 2006; aunque la abundancia total de la comunidad coralina presentó una tendencia al aumento en 13 % (Tabla 1), tendencia dada por la ganancia de colonias de especies como F. fragum y L. cucullata (Tabla 1). La cobertura total de la comunidad no mostró diferencias significativas entre los años (Kruskal-Wallis; n= 64; p= 0.65), pero si decreció en un 6 % (Tabla 1), disminución reflejada en la pérdida de área de tejido vivo de especies tales como D. strigosa, I. rigida y Stephanocoenia michellini (Tabla 1). Agaricia agaricites fue la única especie de la comunidad coralina que presentó diferencias significativas (Kruskal-Wallis; n= 366; p= 0.0005) en cobertura, disminuyendo ésta en el tiempo en 19 % (Tabla 1). Estas diferencias significativas fueron entre 2004 y 2006 (MannWhitney; n= 247; p= 0.023) y 2005 y 2006 (Mann-Whitney; n= 251; p<0.05).
La comunidad como un conjunto no presentó diferencias significativas (ANOVA; n= 24; p= 0.4) entre los años (2004, 2005 y 2006) con respecto a la mortalidad parcial; sin embargo, se observó una tendencia al aumento de un 11 % (Tabla 1), causada por la pérdida de tejido vivo de C. natans, E. fastigiata, M. decactis, P. astreoides y M. annularis (Tabla 1). Montastrea annularis (Kruskal-Wallis; n= 60; p= 0.03), M. decactis (ANOVA; n= 5; p= 0.01) y M. cavernosa (ANOVA; n= 8; p= 0.005) presentaron diferencias significativas en el tiempo con respecto a la mortalidad parcial de sus colonias, aumentando ésta en las dos primeras especies y disminuyendo en la tercera (Tabla 1). Para M. annularis estas diferencias significativas fueron dadas entre 2005 y 2006 (Mann-Whitney; n= 29; p= 0.01). En el caso de M. decactis y M. cavernosa no se pudo aplicar la prueba de Tuckey, ya que en 2005 y 2006 sólo se encontró una colonia con mortalidad parcial para la primera y en 2004 y 2006 se hallaron tres y una colonia respectivamente, con tejido muerto para la segunda especie.
Las especies coralinas de mayor importancia en la comunidad según el IVI en los tres años de estudio fueron M. annularis, A. agaricites, C. natans y P. astreoides (Tabla 3). Adicionalmente, de las 24 especies coralinas encontradas en la comunidad, seis ganaron importancia en el tiempo, entre ellas M. annularis, C. natans y M. franksi; cinco la perdieron, encontrándose A. agaricites, M. cavernosa y D. strigosa; 13 permanecieron aproximadamente igual, hallándose P. astreoides, M. decactis y M. ferox; y dos mantuvieron igual su importancia en la comunidad (Tabla 3).
Los histogramas de la distribución de tallas (área de tejido vivo) de M. annularis, A. agaricites y P. astreoides con y sin transformación, presentaron un sesgo positivo (sesgo a la derecha; Figuras 2, 3, 4) en cada uno de los tres años, lo que significa que la mayoría de sus colonias se encontraron en tamaños pequeños. Los histogramas para comparar la distribución de tallas de C. natans, no se pudieron construir por la baja abundancia de colonias.
Por último, la distribución de tallas de las especies importantes de la comunidad no presentó diferencias estadísticamente significativas en el tiempo en que fueron monitoreadas (Tabla 4). No obstante, la media de la distribución de M. annularis y A. agaricites fue mayor en 2006 con respecto a 2004 y 2005, mientras que esta medida fue mayor en 2006 para P. astreoides. Por otro lado, la asimetría de la distribución por tallas presentada por A. agaricites y P. astreoides fue mayor en 2006 con respecto a 2004 y 2005, contrario a la obtenida para M. annularis, la cual fue mayor en 2005 con respecto a los otros dos años y la curtosis de estas tres especies fue mayor en 2006, con respecto a 2004 y 2005 (Tabla 4).
DISCUSIÓN
Aunque no se observó mayor cambio en la riqueza y diversidad de la comunidad en el tiempo, si se presentó una variación de 16.6 % en cuanto a su composición, lo que podría indicar que estos índices ecológicos, usados ampliamente en el estudio de cambios en comunidad (ver Hughes, 1989, 1996; Jokiel et al, 2004; Langmead y Sheppard, 2004), no dan evidencia del cambio temporal de una comunidad (McClanahan et al, 2002). La estabilidad en la riqueza, diversidad y equidad en el tiempo puede atribuirse a que el número de especies que entraron al sistema fue equivalente al número de especies que salieron y a que la abundancia de las especies dominantes no presentó mayor variación en los tres años de estudio, siendo los cambios temporales en composición una variable más sensible.
Teniendo en cuenta que Martínez y Acosta (2005) encontraron que la composición de los arrecifes en franja de Punta Betín, Morro Grande y Granate cambió a nivel de especies coralinas en un 46, 41 y 31 %, respectivamente en un lapso de 13 años, y para Gayraca en un 34 % en 10 años, la variación en la composición de la comunidad coralina aquí estudiada fue relativamente alta para el corto período de tiempo monitoreado. Extrapolando la información a una década, esto indicaría que la comunidad coralina presentó una tasa de recambio mayor a la cuantificada en arrecifes en franja lo cual podría ser causado por la disponibilidad de hábitats a ser colonizados, como se pone en evidencia con la entrada de A. cervicornis y de S. cubensis al sistema, y por la posible menor resiliencia del sistema (menor complejidad de interacciones), como ha sido demostrado en bosques (Halpern, 1988) o baja tolerancia de los nuevos colonizadores (salida de especies).
Según Bak y Engel (1979), el ingreso de A. cervicornis en un sistema depende más de la reproducción asexual por vía de fragmentación que por reproducción sexual, ya que esta especie presenta una baja tasa de reclutamiento larval (Quinn y Kojis, 2006). Sin embargo, el ingreso de esta especie al sistema monitoreado se debe posiblemente al asentamiento larval, ya que es poco probable que un fragmento de otra colonia de A. cervicornis ubicada cerca al sitio de estudio (distancia mínima 5 m) hubiera llegado a la comunidad coralina estudiada.
A su vez, el ingreso al sistema de S. cubensis puede ser explicado por el asentamiento de larvas ya que esta especie presenta una alta tasa de reclutamiento (Szmant, 1986). Vidal et al. (2005) registraron para la terraza occidental de San Andrés una densidad de 4 individuos/m2 en un gradiente de profundidad de 8 a 30 m, ámbito de profundidad en el cual se encuentra la comunidad coralina monitoreada. Esto contradice lo expuesto por Ordóñez (2004), quien encontró que para San Andrés las colonias de esta especie se observan usualmente en las zonas profundas del arrecife debido a su alta resistencia a la sedimentación y a baja intensidad lumínica (Bak, 1975). No obstante, en este estudio S. cubensis se encontró en condiciones similares a las que según Bak (1975) esta especie es tolerante, es decir grietas donde la penetración de luz es baja y la tasa de resuspensión de sedimentos es alta.
La variación de la estructura de la comunidad coralina puede explicarse por la mortalidad parcial y total sufrida por las especies de coral, pues ésta variable podría estar incidiendo en: 1) la pérdida paulatina de especies de la comunidad coralina, 2) la disminución en cobertura total coralina, y 3) la distribución de tallas con sesgo positivo de las especies dominantes de la comunidad.
La pérdida de S. siderea y D. clivosa en el sistema se podría atribuir a la mortalidad causada por factores como sedimentación y resuspensión (fragmentos finos de CaCO3) y huracanes de gran influencia en el área de estudio (por lo menos uno por década). Según Meesters et al. (1997) y Nugues y Roberts (2003), S. siderea es una especie altamente vulnerable a sufrir mortalidad en zonas donde hay sedimentación, ya que presenta poca habilidad para remover las partículas de sedimento (Bak y Elgershuizen, 1976) y para regenerar tejido vivo (Meesters et al., 1997). Otra fuente de mortalidad coralina en la isla fue el paso del huracán Beta que, según Rodríguez-Ramírez y Reyes-Nivia (2005), causó gran resuspensión de sedimento en el archipiélago, lo que podría haber contribuido a la salida repentina de S. siderea del sistema, por estar esta especie cerca del fondo arenoso en contacto con material resuspendido a poca profundidad.
La resuspensión de sedimento podría explicar también la desaparición de D. clivosa de la comunidad pues, según lo expuesto por Semon et al. (2006), la especie es altamente susceptible a tensores crónicos que conducen a la mortalidad parcial de sus colonias y, como se observó en este estudio, el área de tejido muerto fue mayor que la cobertura viva de esta especie, lo que no permitió la regeneración, aunque se conoce que esta especie presenta alta habilidad de regeneración de tejido (Ginsburg et al., 2001). Sin embargo, no se pueden descartar otras causas de mortalidad coralina en el sistema, las cuales aún permanecen por ser identificadas y cuantificadas.
La tasa de pérdida anual de cobertura coralina fue mayor en el presente estudio (2 %) con respecto a la registrada por el SIMAC (0.68 %; Rodríguez-Ramírez et al, 2005) para San Andrés, ya que la comunidad estudiada, al no ser un sistema cercano al climax y no presentar un alto número de especies e interacciones (menor tiempo de colonización), posiblemente no posee alta capacidad de resistencia y/o resiliencia a perturbaciones (Brewer, 1988; Kormondy, 1996), como es el caso de los arrecifes en franja donde se realizó el estudio de Rodríguez-Ramírez et al. (2005), cuyas poblaciones han tenido mayor tiempo para adaptarse y/o ser seleccionadas en ese habitat. Se infiere que la tasa de pérdida anual de cobertura coralina también resulta una variable más sensible en la comunidad coralina que en el arrecife más desarrollado (en franja). Sin embargo, en relación con el tiempo de monitoreo de este estudio (dos lapsos de tiempo, cada uno de un año), la tasa de pérdida anual de cobertura coralina aquí registrada para la comunidad resultó relativamente baja en comparación con registros en arrecifes en franja deteriorados en el Caribe, como es el caso de Jamaica donde se perdió anualmente a nivel somero 4.25 % de cobertura coralina en un lapso de cinco años (Hughes, 1989).
Por otra parte, el aumento en un 11 % de mortalidad parcial de la comunidad coralina en este estudio fue mayor al encontrado por el SIMAC (Rodríguez-Ramírez et al, 2005) para San Andrés, el cual fue de sólo el 2 % en arrecifes en franja. Este aumento en mortalidad parcial en la comunidad coralina estudiada podría ser consecuencia de menor tolerancia de colonizadores (genotipos no adaptados) a las condiciones ambientales desfavorables producidas por la resuspensión de las partículas finas de sedimento encontradas alrededor de la misma (Nugues y Roberts, 2003; Wielgus et al, 2004; Dikou et al, 2006) o de otros factores no identificados (depredación; efecto antropogénico por buceo); los cuales, según Vermeij y Bak (2003), inciden aumentando el proceso de reproducción asexual vía fisión de las poblaciones de coral. Este mecanismo reproductivo se conoce también como fragmentación, término más apropiado, ya que la ruptura de las colonias generalmente se da por factores físicos (ej. tormentas, corrientes, mareas, entre otros) o biológicos que (ej. enfermedades) que producen la mortalidad parcial de las colonias sin necesidad de gasto energético para la reproducción por parte del coral (Acosta et al., 2001; Weilgus et al., 2004).
Al igual que lo encontrado en esta investigación, los estudios de Kenyon et al. (2006) en Jamaica y Bythell et al. (1993) en las Islas Vírgenes estadounidenses hallaron una distribución de tallas con sesgo positivo, es decir, mayor número de colonias de tamaño pequeño. Según Vermeij y Bak (2003), esta distribución podría ser el resultado del reclutamiento de juveniles (principalmente en especies incubadoras de larvas) o fisión y/o fragmentación de colonias grandes debido a la mortalidad parcial (principalmente en especies de larga vida) por alto estrés. En el caso de estudio los dos procesos, al parecer, estarían involucrados como se infiere a continuación, pero aún deben ser cuantiicados en detalle.
El aumento de la mortalidad parcial en un 8 y 31 % para M. annularis y P. asteroides, respectivamente, podría estar contribuyendo a la fragmentación de las colonias. Este tipo de reproducción asexual ocurre cuando lesiones rodean y aislan porciones de tejido vivo (Meesters et al., 1997) y, según Hughes y Jackson (1980, 1985) y Hughes y Tanner (2000), estas dos especies coralinas emplean dicho tipo de reproducción como defensa para evitar la pérdida completa del tejido vivo, lo cual conllevaría a la pérdida de la colonia. En el caso de M. annularis, a mayor tamaño de la colonia aumenta la probabilidad de sufrir mortalidad parcial y por ende a fragmentarse y formar ramets (Hughes y Jackson, 1980, 1985; Hughes, 1984; Meesters et al., 1997), como fue corroborado recientemente para una población de isla Grande e isla Tesoro, Caribe colombiano (Alvarado, 2008). En cuanto a P. astreoides, Bythell et al. (1993) encontraron que en las islas Vírgenes esta especie se fragmenta, reduciendo la cobertura de la población, similar a lo observado en el presente estudio.
Por otra parte, el elevado número de juveniles y adultos pequeños observado en la distribución de tallas de A. agaricites, podría atribuirse a la alta tasa de reclutamiento que esta especie presenta (Bak y Engel, 1979; Hughes y Jackson, 1985). Sin embargo, la aparente alta tasa de juveniles de A. agaricites registrada en el presente estudio podría relacionarse con la mortalidad parcial sufrida por sus colonias, ya que Bythell et al. (1993) y Meesters et al. (1997) indican que el reclutamiento de esta especie podría darse para sobreponerse a la mortalidad sufrida. Por su parte, Rogers et al. (1984) dicen que el alto reclutamiento podría también estar relacionado con la disponibilidad de sustrato libre para colonizar, lo cual puede sugerir baja abundancia de colonias adultas en la población.
CONCLUSIONES
Aunque la comunidad coralina se encontró estable, su composición mostró variación en un período corto de tiempo. A nivel poblacional, las especies dominantes, M. annularis y P. astreoides, aumentaron la mortalidad parcial, particularmente M. annularis, mientras que A, agaricites disminuyó significativamente su cobertura, como lo demuestra el sesgo en la distribución de tallas hacia colonias pequeñas.
Estos resultados están posiblemente relacionados con potenciales tensores (sedimento y resuspensión) que influyen las poblaciones de coral, afectando su mortalidad parcial y total, proceso determinante de la estructura de las poblaciones. Este proceso explicaría adecuadamente: 1) la salida de especies de la comunidad, 2) la disminución en cobertura de ciertas poblaciones, y 3) los procesos de fragmentación sufridos por M. annularis y P. astreoides.
Así mismo, los cambios de la estructura de la comunidad coralina son más evidentes a nivel de población que a nivel de comunidad y podrían ser un primer indicio de alteración de esta última, siendo la composición la variable más sensible a corto plazo. Los resultados obtenidos muestran que la comunidad coralina sufre cambios similares, en algunas variables (ej. riqueza, diversidad), a los observados en etapas sucesionales más avanzadas, como es el caso de los arrecifes en franja, pero más acelerados para variables sensibles, como las tasas de recambio de especies y de pérdida anual de cobertura coralina por mortalidad parcial y la distribución de tallas de las poblaciones dominantes.
AGRADECIMIENTOS
A la tienda de buceo Sharky en San Andrés por el apoyo logístico para llevar a cabo este estudio y a los estudiantes de Ecología Marina del 2004 de la Pontificia Universidad Javeriana por la toma de datos.
BIBLIOGRAFÍA
1 Acosta, A. y A. Acevedo. 2006. Population structure and colony condition of Dendrogyra cylindrus (Anthozoa: Scleractinia) in Providencia Island, Colombian Caribbean. Proceedings of the 10th International Coral Reef Symposium, 4: 1605-1610. [ Links ]
2 Acosta, A., M. Casas, C. Vargas y J. E. Camacho. 2005. Lista de Zoantharia (Cnidaria: Anthozoa) del Caribe y de Colombia. Biota Colombiana, 6: 147-162. [ Links ]
3 Acosta, A., P. W. Sammarco y L. F. Duarte. 2001. Asexual reproduction in a zoanthid by fragmentation: The role of exogenous factors. Bull. Mar. Sci., 68: 363-381. [ Links ]
4 Alvarado, E. M. 2008. Efecto de las lesiones naturales sobre la fecundidad: Implicaciones en la estructura de talla de una población del coral Montastraea annularis en un arrecife degradado del Caribe colombiano. Tesis de Doctor en Ciencias, Universidad del Valle, Cali. 128 p. [ Links ]
5 Arango, G. D. 2002. Estructura de la comunidad coralina en la isla de Providencia, Caribe colombiano: ¿Evidencia de cambio después de siete años? Trabajo de grado, Pontificia Universidad Javeriana, Bogotá. 66 p. [ Links ]
6 Bak, R. P. M. 1975. Ecological aspects of the distribution of reef corals in the Netherlands Antilles. Bijdragen tot de. Dierkunde, 45: 181-190. [ Links ]
7 Bak, R. P. M. y J. H. B. W. Elgershuizen. 1976. Patterns of oil-sediment rejection in corals. Mar. Biol., 37: 105-113. [ Links ]
8 Bak, R. P. M. y M. S. Engel. 1979. Distribution, abundance and survival of juvenile hermatypic corals (Scleractinia) and the important of life history strategies in the parent coral community. Mar. Biol., 54: 341-352. [ Links ]
9 Bak, R. P. M. y E. H. Meesters. 1998. Coral population structure: The hidden information of colony-size frequency distribution. Mar. Ecol. Progr. Ser., 162: 301-306. [ Links ]
10 Bak, R. P. M. y E. H. Meesters. 1999. Population structure as a response of coral community to global change. Am. Zool., 39: 56-65. [ Links ]
11 Begon, M., C. R. Townsend y J. L. Harper. 2006. The nature of the community: Patterns in space and time, 469-498. En: Begon, M., C. R. Townsend y J. L. Harper (Eds.). Ecology, from individuals to ecosystems. Cuarta edición. Blackwell, E.E.U.U. 738 p. [ Links ]
12 Berkelmans, R., G. Death, S. Kininmonth y W. J. Skirving. 2004. A comparison of the 1998 and 2002 coral bleaching events on the Great Barrier Reef: spatial correlation, patterns and predictions. Coral Reefs, 23: 74-83. [ Links ]
13 Brewer, R. 1988. Community and ecosystem ecology: Community change. 489-531. En: Saunders College (Ed.). The science of ecology. Saunders College, Philadelphia. 922 p. [ Links ]
14 Bythell, J. C., E. H. Gladfelter y M. Bythell. 1993. Chronic and catastrophic natural mortality of three common Caribbean reef corals. Coral Reefs, 12: 143-152. [ Links ]
15 Castro, P. y M. E. Huber. 2000. Coral reefs. 276-299. En: Kevin, T. K. (Ed.). Marine biology. Tercera edición. McGraw Hill, Boston. 444 p. [ Links ]
16 Connell, J. H. 1978. Diversity in tropical rain forest and coral reefs. Science, 199: 1302-1310. [ Links ]
17 Connell, J. H., T. P. Hughes y C. C. Wallace. 1997. A 30-year study of coral abundance, recruitment, and disturbance at several scales in space and time. Ecol. Monogr., 67: 461-488. [ Links ]
18 Díaz, J. M., J. Garzón-Ferreira y S. Zea. 1995. Los arrecifes coralinos de la isla de San Andrés, Colombia: estado actual y perspectivas para su conservación. Academia Colombiana de Ciencias Exactas, Físicas y Naturales, Colección "Jorge Álvarez Lleras", 7, Bogotá. 150 p. [ Links ]
19 Díaz, J. M., G. Díaz-Pulido, J. Geister, J. A. Sánchez y S. Zea. 1996. Atlas de los arrecifes coralinos del Caribe colombiano. Tomo I. Complejos arrecifales oceánicos. Serie de Publicaciones Especiales No. 2., Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andreis"-INVEMAR, Santa Marta. 83 p. [ Links ]
20 Díaz, J. M., L. M. Barrios, M. H. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G. H. Ospina, F. Parra-Velandia, J. H. Pinzón, B. Vargas-Ángel, F. A. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Serie de Publicaciones Especiales No. 5. Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andreis"-INVEMAR, Santa Marta. 175 p. [ Links ]
21 Dikou, A. y R. von Woesik. 2006. Partial colony mortality reflects coral community dynamics: A fringing reef study near a small river in Okinawa, Japan. Mar. Pollut. Bull., 52: 269-280. [ Links ]
22 Gardner, T. A., I. M. Cote, J. A. Gill, A. Grant y A. R. Watkinson. 2003. Long-term region-wide declines in Caribbean corals. Science, 301: 958-960. [ Links ]
23 Garzón-Ferreira, J. 1997. Arrecies coralinos: ¿Un tesoro camino a la extinción?. Colombia: Ciencia y Tecnología, 15: 11-19. [ Links ]
24 Garzón-Ferreira, J., A. Rodríguez-Ramírez, S. Bejarano-Chavarro, R. Navas-Camacho y C. Reyes-Nivia. 2002. Estado de arrecifes coralinos en Colombia. 84-113. En: INVEMAR (Ed.). Informe del estado de los ambientes marinos y costeros en Colombia: Año 2002. Serie Publicaciones Periódicas 5, Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andreis"-INVEMAR, Santa Marta. 275 p. [ Links ]
25 Geister, J. y J. M. Díaz. 1997. A field guide to the oceanic barrier reefs and atolls of the southwestern Caribbean (Archipelago of San Andrés and Providencia, Colombia). Proceedings of the 8th International Coral Reef Symposium, 1: 235-262. [ Links ]
26 Ginsburg, R. N., E. Gischler y W. E. Kiene. 2001. Partial mortality of massive reef-building corals: An index of patch reef condition, Florida Reef Tract. Bull. Mar. Sci., 69: 1149-1173. [ Links ]
27 Guisande, C, A. Barreiro, I. Maneiro, I. Riveiro, A. R. Vergara y A. Vaamonde. 2006. Tratamientos de datos. Díaz de Santos, Madrid. 362 p. [ Links ]
28 Halpern, C. B. 1988. Early succesional patways and the resistance and resilience of forest communities. Ecology, 69: 1703-1715. [ Links ]
29 Hughes, T. P. 1984. Population dynamics based on individual size rather than age: A general model with reef coral example. Am. Nat., 123: 778-795. [ Links ]
30 Hughes, T. P. 1989. Community structure and diversity of coral reefs: The role of history. Ecology, 70: 275-279. [ Links ]
31 Hughes, T. P. 1996. Demographic approaches to community dynamics: A coral reef example. Ecology, 77: 2256-2260. [ Links ]
32 Hughes T. P. y J. H. Connell. 1999. Multiple stressors on coral reefs: A long-term perspective. Limnol. Oceanogr., 44: 932-940. [ Links ]
33 Hughes, T. P. y J. B. C. Jackson. 1980. Do corals lie abut their age? Some demographic consequences of partial mortality, fission, and fusion. Science, 209: 713-715. [ Links ]
34 Hughes, T. P. y J. B. C. Jackson. 1985. Population dynamics and life histories of foliaceous corals. Ecol. Monogr., 55: 141-166. [ Links ]
35 Hughes, T. P. y J. E. Tanner. 2000. Recruitment failure, life histories and long-term decline of Caribbean coral. Ecology, 81: 2250-2263. [ Links ]
36 Huston, M. A. 1985. Patterns of species diversity on corals reefs. Annu. Rev. Ecol. Syst., 16: 149-177. [ Links ]
37 Jokiel, P. L., E. K. Brown, A. Friedlander, K. Rodgers y W. R. Smith. 2004. Hawai'i coral reef assessment and monitoring program: Spatial patterns and temporal dynamics in reef coral communities. Pac. Sci., 58: 159-174. [ Links ]
38 Kenyon, J.C, P.S. Vroom, K.N. Page, M.J. Dunlap, C.B. Wilkinson y GS Aeby. 2006. Community structure of hermatypic corals at French Frigate Shoals, Norhtwestern Hawaiian Island: Capacity for resistance and resilience to selective stressors. Pac. Sci., 60: 153-175. [ Links ]
39 Kormondy, E. J. 1996. Stability and change in communities. 299-335. En: Kormondy, E. J. (Ed.). Concepts of ecology. Cuarta edición, Prentice Hall, New Jersey. 559 p. [ Links ]
40 Langmead, O. y C. Sheppard. 2004. Coral reef community dynamics and disturbance: a simulation model. Ecol. Model., 175: 271-290. [ Links ]
41 Linton, D. y T. Fisher. 2004. Coral reef communities. 46-54. En: Linton, D. y T. Fisher (Eds.). Report Desing. CARICOMP-Caribbean Coastal Marine Productivity Program: 1993-2003. Kingston, Jamaica. 92 p. [ Links ]
42 Magurran, A. E. 1998. Ecological diversity and its measurement. Croom Hell, Londres. 179 p. [ Links ]
43 Martínez, S. y A. Acosta. 2005. Cambio temporal en la estructura de la comunidad coralina del área de Santa Marta - Parque Nacional Natural Tayrona (Caribe colombiano). Bol. Invest. Mar. Cost., 34: 141-167. [ Links ]
44 McClanahan, T., N. Polunin y T. Done. 2002. Ecological status and the resilience of coral reefs. Conservation Ecology, 6: 18. http//www.consecol.org/vol6/iss2/art18. 15/11/06. [ Links ]
45 Meesters, E. H., I. Wesseling y R. P. M. Bak. 1997. Coral colony tissue damage in six species of reef-building corals: partial mortality in relation with depth and surface area. J. Sea. Res, 37: 131-144. [ Links ]
46 Meesters, E. H., M. Hilterman, E. Kardinaal, M. Keetman, M. de Vries y R. P. M. Bak. 2001. Colony size-frequency distributions of scleractinian coral populations: spatial and interspecific variation. Mar. Ecol. Progr., 209: 43-54. [ Links ]
47 Moberg, F. y C. Folke. 1999. Ecological goods and services of coral reef ecosystems. Ecol. Econ., 29: 215-233. [ Links ]
48 Nugues, M. M. y C. M. Roberts. 2003. Partial mortality in massive reef corals as an indicator of sediment stress on coral reefs. Mar. Pollut. Bull., 46: 314-323. [ Links ]
49 Ordóñez, M. S. 2004. Variación en la estructura de la comunidad de corales hermatípicos juveniles entre arrecifes continentales (isla Fuerte e isla Grande) y oceánicos (San Andrés y Providencia), Caribe colombiano. Trabajo de grado. Pontificia Universidad Javeriana, Bogotá. 148 p. [ Links ]
50 Pandolfi, J. M. 2002. Coral community dynamics at multiple scales. Coral Reefs, 21: 13-23. [ Links ]
51 Pinzón, J. H., A. M Perdomo, O. D. Solano y G. R. Navas. 1998. Blanqueamiento coralino de 1995 en la región de Santa Marta, Caribe colombiano. Caribb. J. Sci., 34: 330-333. [ Links ]
52 Prahl, H. 1989. Patrones de diversidad en los corales del Caribe colombiano. Bulletin del 'Institut de Geologie du Bassin D'Aquitaine, 45: 63-71. [ Links ]
53 Quinn, N. J. y B. L. Kojis. 2006. Invertebrate recruitmen patterns inside and outside Discovery Bay, Jamaica. Proceedings of the 10th International Coral Reef Symposium, 1: 83-90. [ Links ]
54 Reyes, J. 2000. Lista de los corales (Cnidaria: Anthozoa: Scleractinia) de Colombia. Biota Col., 1: 164-176. [ Links ]
55 Rodríguez-Ramírez, A. y M. C. Reyes-Nivia. 2005. Evaluación rápida del impacto del Huracán Beta sobre los ecosistemas marinos y costeros en la isla de Providencia. 87-92. En: INVEMAR (Ed.). Informe del estado de los ambientes marinos y costeros en Colombia: Año 2005. Serie de Publicaciones Periódicas, No. 8. Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis"-INVEMAR, Santa Marta. 360 p. [ Links ]
56 Rodríguez-Ramírez, A., J. Garzón-Ferreira, S. Bejarano-Chavarro, R. Navas-Camacho, M. C. Reyes-Nivia, G. Duque, C. Orozco, F. Zapata y O. Herrera. 2005. Estado de los arrecifes coralinos en Colombia. 77-114. En: INVEMAR (Ed.). Informe del estado de los ambientes marinos y costeros en Colombia: Año 2004. Serie de Publicaciones Periódicas, No. 8. Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis"-INVEMAR, Santa Marta, 210 p. [ Links ]
57 Rodríguez-Ramírez, A., M. C. Reyes-Nivia, R. Navas-Camacho, S. Bejarano, J. Garzón-Ferreira y F. Zapata. 2006. Status of the corals reefs of Colombia in 2003. Proceedings of the 10th International Coral Reef Symposium, 4: 976-981. [ Links ]
58 Rogers, C. S., H. C. Fitz, M. Gilnack, J. Beets y J. Hardin. 1984. Scleractinian coral recruitment patterns at Salt River submarine Canyon, St. Croix, U.S. Virgin Islands. Coral Reefs, 3: 69-76. [ Links ]
59 Salazar-Vallejo, S. I. 2002. Huracanes y biodiversidad costera tropical. Rev. Biol. Trop., 50: 415-428. [ Links ]
60 Semon, K. L., K. Sullivan-Sealey y V. L. Nero. 2006. The influence of habitat selection and diversity on the population dynamics of stony corals species of the Bahamian Archipelago. Proceedings of the 10th International Coral Reef Symposium, 2: 335-340. [ Links ]
61 Szmant, A. M. 1986. Reproductive ecology of Caribbean reef corals. Coral Reefs, 5: 43-54. [ Links ]
62 Temperton, V. M., R. J. Hobbs, T. Nuttle y S. Halle. 2004. Assembly rules and restoration ecology: bridging the gap between theory and practice. Island Press, Washington. 439 p. [ Links ]
63 Torres, C. 2003. Aspectos demográficos de la especies coralina Porites astreoides en la terraza arrecifal de sotavento de la isla de San Andrés (Caribe colombiano). Trabajo de grado, Pontificia Universidad Javeriana. Bogotá. 66 p. [ Links ]
64 Valdivia, A. y E. de la Guardia. 2004. Estructura de la comunidad de corales en el arrecife costero de Boca de Canasi, La Habana, Cuba. Rev. Invest. Mar., 25: 15-22. [ Links ]
65 Vermeij, M. J. A y R. P. M. Bak. 2003. Inferring demographic processes from population size structure in corals. Proceedings of the 9th International Coral Reef Symposium, 1: 589-593. [ Links ]
66 Veron, J. 2000. Corals and coral reefs. 21-29. En: Stafford-Smith, M. (Ed). Corals of the world. Volume 1. New Litho. Townsville, Australia. 463 p. [ Links ]
67 Vidal, A. M., C. M. Villamil y A. Acosta. 2005. Composición y densidad de corales juveniles en dos arrecifes profundos de San Andrés isla, Caribe colombiano. Bol. Invest. Mar. Cost., 34: 211-225. [ Links ]
68 Wielgus, J., N. E. Chadwick-Furman y Z. Dubinsky. 2004. Coral cover and partial mortality on anthropogenically impacted coral reefs at Eilat, northern Red Sea. Mar. Pollut. Bull., 48: 248-253. [ Links ]
FECHA DE RECEPCIÓN: 31/07/08 FECHA DE ACEPTACIÓN: 26/08/09