Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. v.38 n.2 Santa Marta jul./dic. 2009
FERTILIDAD Y FECUNDIDAD DE MONTASTRAEA ANNULARIS EN UN ARRECIFE DEGRADADO
FERTILITY AND FECUNDITY OF MONTASTREA ANNULARIS IN A DEGRADED REEF
Elvira Alvarado Ch.1 y Alberto Acosta2
1Universidad de Bogotá Jorge Tadeo Lozano, Bogotá, Colombia. elvira.alvarado@utadeo.edu.co
2Pontificia Universidad Javeriana, Facultad de Biología, Bogotá, Colombia. laacosta@javeriana.edu.co
RESUMEN
Este estudio determinó el ciclo gametogénico, fecundidad y fertilidad de Montastraea annularis en el arrecife de isla Grande, archipiélago de Nuestra Señora del Rosario, uno de los arrecifes más degradados del Caribe colombiano. La población de estudio se caracteriza por poseer colonias medianas (alrededor de 3379 cm2), con mortalidad parcial en 27 % de los ramets y total en el 10 % de los mismos. Las colonias presentan un alto número de ramets pequeños producto de la fisión (76 % menores a 50 cm2). Basado en las características de la estructura de tallas de la población mencionada, el objetivo de esta investigación fue explicar el bajo reclutamiento registrado en la zona, a través de la respuesta reproductiva de una población con dominancia de ramets pequeños. Entre septiembre de 2003 y septiembre de 2004, se tomaron muestras de tejido y se elaboraron placas histológicas para detallar el desarrollo gamético de oocitos y espermarios y cuantificar la fecundidad. Adicionalmente, durante septiembre de 2003 y 2004, se recolectaron huevos liberados in situ. Los resultados indicaron que la oogénesis ocurre entre mayo y septiembre y la espermatogénesis entre julio y septiembre. La fertilidad fue baja (35 % y 40 %, in situ e histología, respectivamente), así como la fecundidad (20 y 11 huevos/cm2/año-1, in situ e histología, respectivamente). De un 33 % de ramets que mostraron presencia de espermarios, sólo un 3 % de los mesenterios presentaron gametos masculinos y dentro de éstos, la presencia de los paquetes espermáticos también fue escasa (4 espermarios/gónada). Aunque la talla de los ramets no mostró una relación significativa con la fertilidad o la fecundidad, sí se observó que ramets entre 50 y 100 cm2 eran más fecundos que los de tallas muy pequeñas (< 50 cm2) o muy grandes (> 200 cm2). El pobre esfuerzo reproductivo observado puede, en parte, explicar, el bajo número de colonias pequeñas que exhibe la población estudiada, lo cual es esperado tanto para sitios degradados, como para poblaciones con alta tasa de fisión. Los resultados sugieren que la viabilidad de la población de M. annularis en isla Grande, está determinada por el bajo número de ramets fértiles y la baja fecundidad, pero especialmente por la escasa producción de gametos masculinos.
PALABRAS CLAVE: Degradación, Fecundidad, Fertilidad, Gametogénesis, Montastraea annularis.
ABSTRACT
This study determined the gametogenic cycle, fecundity and fertility of Montastraea annularis, in the Isla Grande coral reef, Archipelago of Nuestra Señora del Rosario, one of the most degraded reefs in the Colombian Caribbean. The surveyed population is currently characterized by medium size colonies (ca. 3379 cm2), with 27 % of the ramets showing partial mortality and 10 % with total mortality. Colonies present high number of small sized ramets formed by fission (76 %, smaller than 50 cm2). Based on the above mentioned population structure characteristics, the aim of this research was to explain the low recruitment rate reported for this reef through the reproductive response of a population dominated by small ramets. Between September 2003-2004, tissue fragments were collected and histological slides were made to detail the development of oocytes and spermaries and to estimate fecundity. Additionally during September of 2003 and 2004, in situ spawned eggs were collected to quantify fecundity. Results showed that oogenesis occurred between May and September and the spermatogenesis between July and September. Fertility was low (35 % and 40 %, in situ and histology, respectively) as well as fecundity (20 and 11 eggs/cm2/year-1, in situ and histology, respectively). Of the 33 % of ramets that showed spermaries, only 3 % of the mesenteries presented male gametes and in these, the presence of sperm cysts was also scarce (4 espermaries/gonad). Although the size of the ramets did not show a statistical relationship with fertility or fecundity, ramets between 50 and 100 cm2 were found more fecund than smaller (<50 cm2) or larger ramets (>200 cm2). The poor reproductive effort found can, in part, explain the low number of small colonies in the studied population, which in turn is expected in degraded sites and in populations with high fission rates. The results suggest that the viability of the population of M. annularis at Isla Grande is defined by the low number of fertile ramets and the low fecundity, but especially by low production of male gametes.
KEY WORDS: Degradation, Fecundity, Fertility, Gametogenesis, Montastraea annularis.
INTRODUCCIÓN
En general, las especies que liberan gametos una vez al año son especies longevas, de crecimiento lento, reproducción retardada, con alta inversión anual en gametos pero baja tasa de reclutamiento. No obstante, si bien muchas de estas características se conservan en las especies, las perturbaciones naturales u originadas por el hombre pueden determinar cambios en las respuestas reproductivas como, por ejemplo, la disminución en fecundidad (Harrison y Wallace, 1990) o en fertilidad (Sakai, 1998). La baja fertilidad, fecundidad, fertilización o reclutamiento inciden directamente en la estructura de una población, ya que pueden determinar la ausencia de juveniles, los cuales eventualmente reemplazan a las colonias grandes y por lo tanto su declinamiento tiene consecuencias deletéreas en la persistencia de la población (Hughes y Tanner, 2000).
Montastraea annularis (Ellis y Solander, 1786) es un coral hermatípico dominante desde hace millones de años (Pandolfi et al., 2002). Se ha reconocido como una de las más importantes y abundantes especies de coral del Caribe (Weil y Knowlton, 1994; Barrios, 2000; Hughes y Tanner, 2000). Los estudios de la biología reproductiva realizados en el Caribe indican que esta especie es hermafrodita, liberadora de gametos y que presenta un ciclo gametogénico anual, cuya duración oscila entre cinco y seis meses (mayo-septiembre/octubre; Szmant, 1986; Soong, 1991; Van Veghel y Kahman, 1994). Los gametos maduros son liberados entre agosto y octubre, seis y siete días después de luna llena entre las 20:40- 21:40 (Szmant, 1986; 1991; Soong, 1991; Wyers et al, 1991; Gittings et al, 1992; Van Veghel, 1994; Steiner, 1995; Sánchez et al, 1999). Si bien, autores como Szmant (1991), Soong (1991) y Van Veghel y Kahman (1994) demuestran que en colonias de mayor tamaño hay mayor fecundidad, los juveniles son raros en los estudios de campo, registrándose 0.02 +/- 0.14 (STD) a 0.92 +/- 0.99 individuos por metro cuadrado (Chiappone y Sullivan, 1996). Se argumenta entonces que dado el gran esfuerzo reproductivo, la baja abundancia de larvas recientemente asentadas es atribuible a factores como pobre viabilidad de embriones, alta mortalidad en el plancton o bajo éxito de asentamiento y reclutamiento (Szmant, 1991; Pizarro, 2006).
Estudios sugieren que en especies de larga vida, tallas grandes y masivas como los corales, se espera bajo reclutamiento, ya que las probabilidades de mortalidad total de una colonia (genet) es baja (Hughes, 1984). Por tal motivo, tradicionalmente se ha aceptado que especies como M. annularis, con infrecuente tasa de reclutamiento, utilizan la estrategia de la apuesta compensatoria (Roff, 2002) o de efecto de almacenamiento (Warner y Chesson, 1985) para reproducirse cuando las condiciones son favorables (Edmunds, 2002). No obstante, dada la disminución del tamaño de las poblaciones de M. annularis en el Caribe (Gardner et al, 2003), la pérdida de cobertura de tejido vivo (entre el 30 y 50 % del tejido vivo de más del 50 % de las colonias cuantificadas está muerto, Garzón-Ferreira et al, 2001) y su consecuente cambio en la estructura de talla causada por enfermedades (Ginsburg et al., 2001; Garzón-Ferreira et al., 2001,2005; Foley et al., 2005), depredación (Bythell et al, 1993), sobrecrecimiento algal (Mumby et al, 2005), blanqueamiento (Weil, 2004) y la intensificación que se predice de estos eventos anteriormente mencionados (Aronson y Pretch, 2000; Edmunds y Elahi, 2007), se espera que la estructura de talla y la fecundidad asociada a ésta, se traduzca en menor reclutamiento. Lo anterior implica por lo tanto, reclutamiento de origen local (autoabastecimiento), que en la actualidad parece ser la tendencia (Hughes y Tanner, 2000; Hughes et al, 2000; Mumby y Dytham, 2006; Pizarro, 2006).
Las características reproductivas de las especies de coral tienen patrones básicos; no obstante, éstas pueden variar en ambientes cada vez menos predecibles o con altas tasas de deterioro. Por ello es necesario entender cómo es la respuesta de los individuos a estos tensores, para evaluar la capacidad de recuperación natural de las poblaciones. Debido a que en la zona de estudio (isla Grande) la estructura de tallas coloniales es caracterizada por ausencia de colonias jóvenes, dominio de ramets por debajo de la talla reproductiva (Alvarado y Acosta, 2009) y bajo reclutamiento (Cárdenas, 2005; López, 2007), este estudio tuvo como objetivo evaluar la respuesta reproductiva de ramets sanos de la población, en un arrecife deteriorado del Área Marina Protegida Parque Nacional Natural Corales del Rosario y San Bernardo, usando como parámetros el desarrollo gamético, fertilidad y fecundidad.
ÁREA DE ESTUDIO
El archipiélago de Nuestra Señora del Rosario (10°7'-10°14' N; 75°37'-75°52' W), se encuentra al sur-oeste de la ciudad de Cartagena y en inmediaciones del Canal del Dique que vierte aguas del río Magdalena. Durante la estación lluviosa (septiembre a noviembre), las aguas turbias provenientes del Canal llegan al parque (Restrepo y Kjerfve, 2000) como resultado de la disminución de los vientos alisios y de la entrada de la contracorriente de Panamá en dirección norte (Leblé y Cuignon, 1987). El trabajo de campo se realizó en el arrecife franjeante al norte de isla Grande, entre 3 y 10 m de profundidad, dentro de la unidad Montastraea sp., donde la cobertura de coral vivo representa el 40 %, el sustrato muerto 25 % y la cobertura algal 23 % (Zapata, 2005). La comunidad coralina en el arrecife de isla Grande, detrás de la cresta arrecifal (hasta 12 m de profundidad) se caracteriza por una riqueza de 20 especies de coral, dentro de las cuales Porites astreoides presenta la mayor cobertura (12.7 %), seguida de P. porites (6.8 %) y M. annularis (4.0 %). Las algas filamentosas son el componente biótico más abundante en la comunidad (19.9 %), seguida por algas del género Halimeda (14.7 %). Las colonias de Montastraea se encuentran rodeadas de arena y esqueletos de Acropora cervicornis (Díaz et al., 2000; Zapata, 2005; López, 2007).
MATERIALES Y MÉTODOS
Para determinar el ciclo gametogénico y la fecundidad de Montastraea annularis, mensualmente de septiembre 2003 a septiembre 2004 tres días después de cada luna llena, se tomó una muestra de tejido del centro de 15 ramets completamente sanos (sin lesiones) provenientes de cinco o seis colonias diferentes (dos o tres ramets por colonia). Los tejidos se extrajeron con un corazonador de 5 cm de diámetro y se fijaron inmediatamente en solución Zenker (Carson, 1996) por 24 horas. Posteriormente se lavaron en agua corriente durante 24 horas y se fijaron en alcohol etílico al 70 %. Las muestras se decalcificaron en ácido nítrico al 4 % (con recambio cada seis horas) y el tejido resultante fue embebido en parafina a 58 °C para obtener cortes transversales y longitudinales. Los cortes se realizaron con un micrótomo cada 5 um, y las secciones de tejido utilizados se escogieron cada 250 um y luego se fijaron en láminas (15 cortes por muestra). La tinción se efectuó con azul de Heidenhains y Naranja G (Peters, 2001). En cada sección se examinaron entre seis y nueve pólipos para determinar fertilidad (presencia de huevos y/o espermarios en los pólipos de los ramets) y fecundidad (número de gametos/gónada/pólipo/cm2). Los cortes transversales de septiembre, con oocitos y espermarios maduros (n = 18 muestras histológicas) se utilizaron para estimar la fecundidad, el número de gónadas por pólipo, el número de gametos femeninos y masculinos por mesenterio, gónada y pólipo. Para describir el desarrollo gametogénico se escogieron todas aquellas placas que tenían gametos y de éstas la que mayor tejido reproductivo presentaba. Cada sección transversal con gametos fue analizada a 40, 100, 400 y 1000 aumentos para detallar las características del estadio de desarrollo en el que se encontraban los huevos y los espermarios. El ciclo gamético fue establecido con los cortes transversales de acuerdo a los criterios de Szmant et al. (1997), Glynn et al. (2000), Alvarado et al. (2004) y Vargas-Ángel et al. (2006). El tamaño medio de los gametos femeninos y masculinos en todos los estadios de maduración fue obtenido de los cortes longitudinales, para lo cual se utilizó un micrómetro ocular calibrado (Olympus OSM-4 10X/13) adaptado a un microscopio de luz.
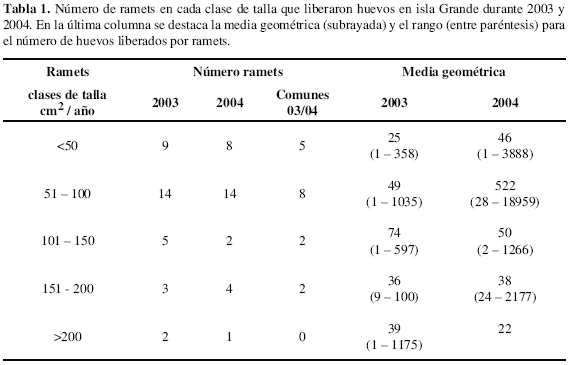
Adicionalmente, para determinar la fecundidad y la fertilidad de ramets in situ, los días 5, 6 y 7 después de luna llena, en septiembre de 2003 y 2004, se recolectaron los gametos. En septiembre de 2003 se recogieron los gametos liberados por 87 ramets, pertenecientes a 22 colonias seleccionadas en agosto de 2003 por tener más del 95 % del tejido vivo sano. En 2004 se recolectaron nuevamente los gametos de 81 de estos mismos ramets (un clon no se pudo relocalizar en 2004 y cinco perdieron la bolsa recolectora de huevos durante la primer noche). A las 16:00 de cada día mencionado, se colocaron bolsas plásticas a los ramets (codificadas), las cuales se amarraron con alambre dulce a su base (esqueleto desnudo). Al día siguiente, 07:00, se recogieron las bolsas con gametos. Una vez en superficie a cada bolsa se le agregó formalina al 10 % para preservar los huevos. En el laboratorio, sobre placas Bogorov y usando un estereoscopio, se hizo el conteo total de huevos por ramet. A cada ramet codificado se le midió el diámetro mayor y menor y mediante la fórmula de una elipse se determinó su talla (cm2). Las tallas se clasificaron en cinco clases teniendo en cuenta como intervalo, la talla mínima reproductiva (50 cm2, Szmant, 1986; Van Veghel y Kahman, 1994).
Análisis estadístico
Para determinar si existía relación entre el número total de huevos liberados (log x+2) y la talla del ramet se realizó un análisis de varianza a una vía (ANOVA) previa verificación del supuesto de normalidad (chi cuadrado) y homogeneidad de varianzas (Levene). El análisis de correlación de Spearman se utilizó para conocer la relación entre la presencia-ausencia de huevos en muestras histológicas y la talla del ramet.
RESULTADOS
Ciclo gametogénico
El ciclo gametogénico de Montastraea annularis en el arrecife de isla Grande es anual y dura cinco meses. Inicia en mayo y termina en septiembre con la liberación de los huevos y espermatozoides maduros. La oogénesis antecede a la espermatogénesis aunque la liberación es sincrónica. A partir de agosto se observaron huevos maduros, pero no espermatozoides. Gametos femeninos y masculinos se encontraban entremezclados dentro del mismo mesenterio.
Oogénesis
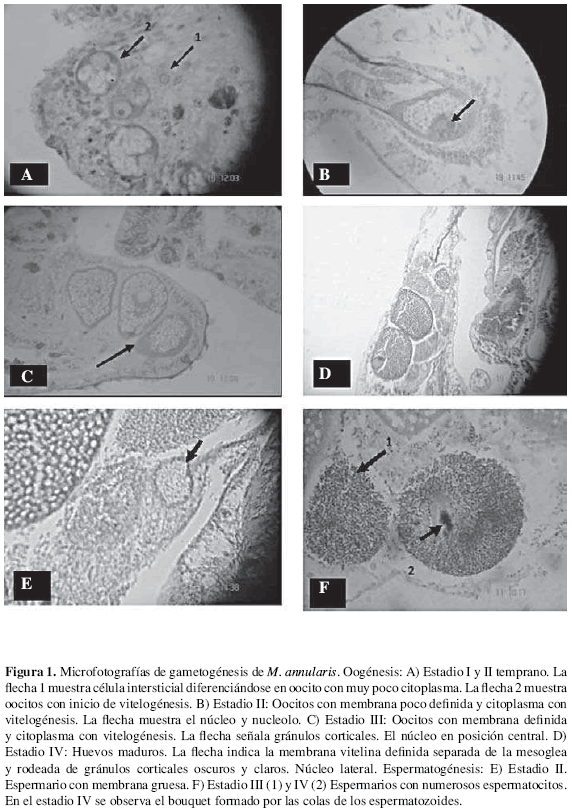
Estadio I (Fig. 1A). Oocitos en desarrollo observados como células engolfadas dentro de mesoglea teñida de azul claro. Célula con muy poco citoplasma transparente o gris azulado. El núcleo, cuando se observó, estaba en posición central. Diámetro mayor en corte transversal 21.6 +/- 12 µm (STD, n = 5). Este estadio se evidenció sólo en muestras de mayo.
Estadio II (Fig. 1B). Oocitos rodeados por mesoglea. La membrana no es deinida pero algunas veces aparecen gránulos corticales azul oscuro bordeando la célula. En el citoplasma hay inicio de vitelogénesis. Las vesículas transparentes no están bien delineadas y algunas están rodeadas por glicógeno. El núcleo de color gris, con nucleolo rojo, se encuentra en posición central. Diámetro mayor en corte transversal de 57.9 +/- 25.2 µm (STD, n = 13). Este estadio se presentó entre junio (92 %) y julio (8 %).
Estadio III (Fig. 1C). Oocitos con membrana azul definida y bordeando internamente gránulos corticales; algunas veces se observan microvellocidades en el borde exterior (x1000). Citoplasma con abundantes vesículas deinidas y rodeadas por gránulos de glicógeno teñidos de color naranja. El núcleo gris en posición ventral o migrando hacia los lados. Diámetro mayor en corte transversal de 121.5 +/- 46.3 µm (STD, n = 23). Este estadio se presentó en julio (22 %), agosto (61 %) y septiembre (17 %).
Estadio IV (Fig. 1D). Huevos maduros, con membrana vitelina separada de la mesoglea y rodeada internamente por gránulos corticales azules oscuros y claros. El citoplasma compuesto por glicógeno, naranja o magenta, alrededor de vesículas transparentes. Núcleo gris de aspecto granular con membrana nuclear, en posición lateral. Hacia el exterior de estos huevos, se observan microvellocidades (x1000). Diámetro mayor en corte transversal de 164.6 +/- 68 µm (STD, n = 69). En corte longitudinal la talla promedio fue de 181 +/- 62 µm (STD, n = 221). Este estadio se presentó en muestras de agosto (12 %) y septiembre (88 %).
En las muestras de los demás meses (octubre 2003 a abril 2004) no se encontró tejido reproductivo.
Espermatogénesis
Estadio I. Dado que no se vieron células germinales iniciales migrando hacia la mesoglea, este estadio no se pudo describir.
Estadio II. Agregación de varios espermatogonios teñidos de azul oscuro formando espermarios azules, definidos por una membrana gruesa, engolfada en la mesoglea. Varios espermarios por gónada. El diámetro mayor promedio de cada espermario, en corte longitudinal, fue de 60.7 +/- 13.3 µm (STD, n = 19). Este estadio se encontró en julio y agosto.
Estadio III (Fig. 1E). Espermarios con poco citoplasma y muchos espermatocitos en desarrollo ubicados generalmente hacia la periferia. La pared de los espermarios es definida, delgada, teñida de rojo y con microvellocidades en el exterior. El diámetro de espermario promedio fue de 108 +/- 33 µm (STD, n = 9). Este estadio se presentó en agosto y septiembre.
Estadio IV (Fig. 1F). Espermario con membrana definida, de apariencia ibrosa, con numerosos espermatozoides de cabezas rojas con colas negras, amarillas o verdes-café, dirigidas hacia el centro, formando canales y en forma de bouquet. El diámetro de espermario promedio en corte longitudinal fue de 143.3 +/- 31uµ (STD, n = 39). Este estadio solo se observó en septiembre.
Fertilidad y fecundidad
El porcentaje de ramets con gónadas femeninas encontrados a través de cortes histológicos fue de 40 %. En un cm2 se encontraron aproximadamente 10 +/- 1 pólipos. De éstos, 1.1 pólipos eran reproductivos y presentaban en promedio cinco gónadas femeninas. En cada gónada había en promedio 2 +/- 1.8 huevos (STD). De acuerdo a lo anterior se determinó que para M. annularis la fecundidad de ramets fue en promedio de 11 huevos/cm2 en un ciclo reproductivo anual (dos huevos por gónada, cinco gónadas por pólipo, 1.1 pólipo reproductivo por cm2). Además, el porcentaje de ramets con gónadas masculinas fue de 36 %, con un promedio de 4 +/- 2.2 (STD) espermarios por gónada (rango entre 1 y 12). Los pocos espermarios observados se presentaron consistentemente en sólo dos mesenterios de los pólipos reproductivos. En general la presencia de espermarios fue rara en las muestras, lo cual se resalta por el hecho de que solamente el 3.1 % de los mesenterios tenía gónadas masculinas (n = 95).
Por otra parte, de los ramets escogidos para determinar fecundidad in situ, alrededor de un 35 % liberó gametos, 6-7 días después de luna llena en septiembre del 2003 (33/87) y 2004 (29/81), entre las 21:20 y 22:05. Los ramets liberaron sólo en uno de los dos días mencionados, pero no en los dos. No obstante, hubo mayor porcentaje de ramets liberados el día seis (84 %) que en el día siete (16 %). Al comparar la fertilidad (presencia-ausencia de gametos) entre años se observó que el 21 % de los ramets (n = 17) liberaron en los dos años, 35 % (n = 28) liberaron en cualquiera de los dos años y 44 % (n = 36) no se reprodujeron en ninguno de los dos años. Considerando que el ramet que más huevos liberó (18959), tenía un área de 64.07 cm2 y teniendo presente que se encontró un promedio de 10 pólipos/cm2, se estimó que la máxima fecundidad de un ramet era de 30 huevos/cm2/año. Sin embargo, tomando el total de huevos liberados por 29 ramets en el 2004 (n = 48719) y el área total ocupada por éstos (2313.2 cm2; n = 29) y considerando que en un cm2 había 1.1 pólipos, se infiere que el número de huevos liberados por cm2 al año es de 20.
No se encontró una relación significativa entre el número de huevos cuantificado a través de histología y la talla de los ramets (p= 0.284: ANOVA). No obstante, la mayoría de los ramets que presentaron gametos estaban en las clases de talla 2 a 4 (entre 50-200 cm2). De igual forma, la relación entre la talla de los ramets y el número de huevos que liberaron in situ, no fue significativa (p= 0.15, correlación de Spearman); sin embargo, la clase entre 50-100 cm2 fue la que mayor número de huevos liberó (Tabla 1).
DISCUSIÓN
Las características reproductivas de Montastraea annularis en cuanto se refiere a la gametogénesis son similares a las descritas por otros autores (e.g. Szmant 1991, Van Veghel 1994). La periodicidad anual, la duración del ciclo (cinco meses) y los estadios de maduración (cinco estadios para gametos femeninos y cuatro para gametos masculinos) fueron coincidentes con lo descrito en la literatura. La oogénesis inicia en mayo y termina en septiembre, mientras que la espermatogénesis inicia en julio y termina en septiembre coincidiendo con los registros de Szmant (1991) y Van Veghel (1994). A partir de agosto se encuentran gametos femeninos maduros, pero sólo hasta septiembre maduran los gametos masculinos. De acuerdo con estudios anteriores, oocitos y espemarios maduros se encuentran a partir de agosto y desde este mes hay liberación de gametos (Szmant, 1991; Van Veghel, 1994, Mendes y Woodley 2002). En el presente estudio no se observó liberación de gametos en agosto ni en octubre, lo cual difiere de otros estudios en la región del Gran Caribe tales como los de Soong (1991; Panamá), Szmant (1991; Puerto Rico), Gittings et al. (1992; Texas), Van Veghel (1994; Curazao), Szmant et al. (1997; Florida), Sánchez et al. (1999; Islas del Rosario), Mendes y Woodley (2002; Jamaica) y Pizarro (2006; San Andrés). No obstante, todos los autores coinciden en que septiembre es el mes pico en la liberación de productos sexuales. Dado que la liberación in situ sólo se presentó en septiembre (para 2003 y 2004), en mayor abundancia el día seis que el día siete después de luna llena y que en las muestras histológicas no se encontraron espermarios maduros en agosto o productos sexuales en octubre, se sugiere que esta población de M. annularis tendería a una liberación masiva de gametos en un lapso corto de tiempo, lo cual implica alta sincronía en el ciclo gamético.
Se ha sugerido que la alta sincronía puede ser un mecanismo para aumentar la probabilidad de fertilización ya que individuos que liberan en noches diferentes o en diferentes tiempos (meses) están en desventaja por una clara reducción sustancial en la probabilidad de fertilización exitosa de sus gametos (Oliver y Babcock, 1992). De acuerdo con Harrison y Wallace (1990) y Babcock (1995), el evento de liberación masiva se presenta en una gran variedad de corales a lo largo de la franja tropical en un período del año en el cual la temperatura superficial del agua es más cálida. En la Gran Barrera Australiana la liberación se da en un solo evento (Harrison y Wallace, 1990) mientras que en el Caribe se da en varios (Szmant, 1986). En el arrecife estudiado la liberación se presentó en un solo evento (septiembre), lo cual contrasta con otros estudios en latitudes similares como en Panamá y Curazao (Soong, 1991; Van Veghel, 1994), donde se registra liberación durante varios meses (septiembre-octubre) y varios días. Para autores como Mendes y Woodley (2002), la liberación de gametos de M. annularis en estos meses puede ser una adaptación para evitar las lluvias y disminuir el riesgo de falla reproductiva y de mortalidad larval, debido a la reducción de la salinidad en el agua superficial (Harrison y Wallace, 1990). En Colombia, los meses más lluviosos se presentan en octubre y noviembre, llegando la salinidad del agua a bajar de 35 a 30 (Alvarado y Corchuelo, 1992). Por otra parte, dada la cercanía del Canal del Dique y su influencia en la zona de estudio, la llegada de aguas más dulces en época de lluvias implica también la llegada de nutrientes y en especial de sedimentos de origen continental (Corchuelo y Alvarado, 1990; Alvarado y Corchuelo, 1992; Restrepo et al, 2006), lo cual puede afectar la sobrevivencia de gametos. Otra causa de la liberación simultánea y masiva, un día en un mes particular, podría ser para maximizar la fertilización en aguas quietas, tal como ocurrió durante la liberación observada en campo. Coma y Lasker (1997) encontraron que, aunque a través de los años la fertilización in situ de una especie de octocoral fue similar (55 %), las tasas de fertilización variaron entre meses y días de liberación, pero que los mayores eventos de liberación coincidían con los de mayor fertilización. Sin embargo, no se puede descartar que sea causado por el azar y que las colonias monitoreadas in situ y por histología, no representen el patrón real de liberación en la población.
La poca abundancia de espermatozoides (3 % de los pólipos cuantificados poseían espermarios maduros), aún en ramets sanos (mejor escenario), podrían explicar, en parte, el bajo reclutamiento registrado para el arrecife de isla Grande (Cárdenas, 2005; López, 2007). Omori et al. (2001) indican que especies hermafroditas que liberan gametos y que tienen fertilización externa, requieren una alta concentración de esperma en las primeras horas después de la liberación. Por lo tanto, la limitación de esperma y el efecto de dilución en la columna de agua es una causa indiscutible de una baja producción de plánulas que posteriormente se convertirán en juveniles. Lasker et al. (1996) sugieren que la limitación en esperma podría causar bajo éxito de fertilización en especies gonocóricas en las cuales hay un número reducido de colonias masculinas. Si bien este no es el caso de las colonias de M. annularis puesto que es una especie hermafrodita, la desproporción que se encontró entre la producción de huevos versus espermarios sí es parecida, por lo cual también se podría pensar en que la ausencia de juveniles podría ser causada no sólo por la baja fertilidad, baja fecundidad y menor número de eventos de desove encontrada, sino también por la baja producción de esperma. Van Veghel (1994) encontró que sólo un 32 % de las colonias de M. annularis tenían gametos masculinos, con lo cual sugiere baja producción de esperma también en arrecifes de Curazao. A pesar de que la alta sincronía minimizaría en parte la baja producción de esperma, ésta no sería suficiente para compensar el déficit, siendo así un factor limitante que debe ser investigado más a fondo. Se descarta que el resultado del bajo número de gametos se deba a la desintegración de los mismos a partir de la cuarta hora después de la liberación como ha sido descrito por Oliver y Babcock (1992) ya que, por una parte, varios ramets mostraron una gran cantidad de huevos al día siguiente durante la recolección (hasta 19000 huevos) y, por otra parte, porque en las muestras histológicas, la baja fecundidad fue evidente a lo largo del ciclo gametogénico, especialmente en referencia a los espermarios.
La fecundidad promedio de 11 huevos cm2/año (histología) y 20 cm2/año (conteo total de huevos liberados por 29 ramets en el 2004) con un máximo de 30 huevos cm2/año, es uno y dos órdenes de magnitud menor que la registrada por Van Veghel y Kahman (1994) en Curazao (102 huevos cm2/año) y por Szmant (1991) de 1200 cm2/año. Las diferencias no sólo están dadas por el número de huevos promedio encontrado en los tejidos de ramets reproductivos (fecundidad), sino también por el número de gónadas presentes en los pólipos (fertilidad). La pobre fecundidad encontrada en pocos ramets fértiles, muestra una población vulnerable. Es probable que además de los factores mencionados anteriormente, la baja fecundidad en isla Grande se deba al estado de deterioro ambiental del arrecife (alta turbidez y sedimentación ocasionada por el río Magdalena, Restrepo y Kjerfve, 2000), lo cual concuerda con lo encontrado por Kojis y Quinn (1984) y Guzmán y Holst (1993) quienes registraron una correlación negativa entre la fecundidad y la turbidez y sedimentación encontrada en áreas cercanas a áreas urbanas e industriales.
Se ha airmado que las colonias no se reproducen todos los años y que, además, la proporción de colonias fértiles varía entre años y entre arrecifes (Harrison y Wallace, 1990; Hughes et al., 2000), lo cual también se observó, ya que menos de la mitad de los ramets liberaron en cualquiera de los dos años. También se ha afirmado que un 50 a 58 % del tejido de cada ramet es reproductivo (Pizarro, 2006; Van Veghel y Kahman 1994, respectivamente) y que los productos reproductivos están concentrados en los pólipos del centro (Pizarro, 2006). Debido a que el tejido analizado fue tomado del centro de los ramets, se descarta que este factor haya incidido en los bajos valores registrados. Por otra parte, se ha sugerido que ramets de M. annularis que han sufrido lesiones, no sólo muestran disminución en la fecundidad de los pólipos alrededor de las lesiones, sino que además no presentan gónadas en pólipos que han regenerado recientemente (Van Veghel y Bak, 1994; Alvarado, obs. pers). En isla Grande hay mayor número de lesiones sobre M. annularis entre julio y septiembre tanto por depredación (Sánchez et al., 2004, Chasqui et al., 2007, Alvarado y Acosta, 2009) como por interacción con algas y esponjas (Alvarado y Acosta, 2009), lo cual también ayudaría a explicar la baja fecundidad.
De acuerdo con Tsounis et al. (2006), las tallas coloniales tienen una relación directa con la fecundidad ya que colonias pequeñas pueden ser fecundas pero aún no haber alcanzado tallas que representen 100 % de fertilidad de sus pólipos (Le., todos los pólipos fértiles). Lo anterior podría explicar el bajo número de huevos en los ramets pequeños, especialmente en aquellos menores a 50 cm2, que son los más abundantes de la población (57 %, Al varado y Acosta, 2009). En concordancia, Szmant (1991) y Pizarro (2006) registraron que algunos pocos ramets por debajo de la talla reproductiva liberaron huevos. No obstante, Van Veghel y Kahman (1994) registraron ausencia de fecundidad en ramets menores a la talla reproductiva (< 50 cm2).
El bajo porcentaje de ramets que liberaron (35 %), la baja fecundidad presentada en los pólipos estudiados y el bajo número de huevos contados por liberación (promedio 2 y máximo 30 huevos/cm2/año) podrían estar explicando la ausencia de juveniles en el medio tal como se registró para la población en el área de estudio (Cárdenas, 2005; López, 2007). Si se tiene en cuenta que esta población se encuentra en un arrecife degradado con más del 60 % de cobertura coralina muerta (Alvarado et al, 1989; Zapata, 2005), que el mayor aporte de gametos lo realizan ramets de tallas pequeñas entre 50 y 100 cm2 (19 % de la población, Alvarado y Acosta, 2009) y que hay escaso número de gametos, particularmente espermatozoides (este estudio), se podría sugerir que los individuos de esta población tienen un bajo éxito reproductivo. En la mayoría de los trabajos sobre reclutamiento en el Caribe se afirma que los juveniles de M. annularis en campo son relativamente raros (Szmant, 1986; Hughes, 1989; Chiaponne y Sullivan, 1996). Sin embargo, tanto Szmant (1986) en Puerto Rico, como Pizarro (2006) en la isla oceánica de San Andrés, sugieren que, dada la alta producción de huevos, la razón para encontrar pocos juveniles es la pobre viabilidad de los embriones, la alta mortalidad de gametos y larvas en el plancton y el pobre éxito de reclutamiento. Contrario a lo anterior, los resultados muestran que la producción de huevos en M. annularis no es alta en la zona de estudio y por lo tanto que la ausencia de juveniles en la población puede ser consecuencia de la baja fertilidad y fecundidad actual. Una explicación tradicional a la baja tasa de reclutamiento en especies como M. annularis es que la vida larga y la alta fecundidad, son los elementos claves para que se presente en la naturaleza la estrategia de la apuesta compensatoria. Esta estrategia implica que cuando el ambiente para los adultos es predecible en el tiempo y el espacio pero la sobrevivencia de los juveniles es baja y fluctuante, el esfuerzo reproductivo debe ser bajo y por lo tanto, el esfuerzo de reproducción se debería repartir en varios años, dentro de los cuales unos pocos serían favorables permitiendo la sobrevivencia de un número suficiente de juveniles que reemplacen a los adultos que perecen (Roff, 2002).
Según Warner y Chesson (1985), en un ambiente cambiante se crea una situación en la cual el reclutamiento varía considerablemente de una estación reproductiva a la siguiente y, si los adultos sobreviven bien, un evento favorable de reclutamiento puede sostener la población por largos períodos de tiempo. Pero si hay un 50 % o más de probabilidad de períodos no favorables en la vida de un individuo, entonces se esperan fluctuaciones en el número de adultos de la población. Este no es el caso de la población estudiada ya que el ambiente en el que se encuentra parece no ser predecible para los adultos. Por una parte porque las colonias adultas están expuestas a perturbaciones de origen natural y antropogénico, crónicas y agudas, que causan alta mortalidad parcial y fisión (Hughes y Tanner, 2000; Gardner et al., 2003; Alvarado, obs. pers.). Por otra parte, la alta tasa de reclutamiento que se requeriría para compensar la mortalidad adulta está limitada por la baja fecundidad que se encontró. Por lo tanto, ante un escenario de aumento de temperatura y de precipitación por el cambio climático global (Hoegh-Gulberg, 1999), con consecuente aumento en la sedimentación y turbidez y disminución de la salinidad y teniendo en cuenta la baja fertilidad y fecundidad y la constante pérdida de cobertura de tejido vivo, es probable que la población no se mantenga, ya que ésta no se estaría reemplazando por medio de juveniles. Dadas las condiciones anteriores, para que la población persista, el reclutamiento debe ser más frecuente e intenso, pero éste depende de una alta fertilidad y fecundidad, la cual, según los resultados obtenidos, está seriamente disminuida.
AGRADECIMIENTOS
Se agradece a E. González, A. Rojas, R. M. González, y D. Morales por la elaboración de placas histológicas y la medición de los gametos. A B. Vargas-Ángel y E. C. Peters por la orientación en la descripción de los estadios gametogénicos. A D. L. Duque por su colaboración en toda la fase de campo, C. Barreto y M. A. Rodríguez por su asesoría en la parte estadística. Al personal del Parque Nacional Corales del Rosario por las facilidades logísticas y su interés en que el proyecto se pudiera realizar. Al personal de la biblioteca de la Universidad de Bogotá Jorge Tadeo Lozano por su invaluable apoyo en la consecución de la literatura. A J. A. Sánchez, F. A. Zapata, S. Zea y A. Canosa por su permanente acompañamiento en el proceso de la investigación. A V. Pizarro porque con su conocimiento colaboró grandemente en la discusión de los resultados y a los evaluadores anónimos porque con su revisión minuciosa mejoraron este manuscrito. Este documento forma parte de la tesis doctoral del primer autor. Permiso de Investigación DTCA023-UAESPNN.
BIBLIOGRAFÍA
1 Alvarado, E. M. y A. Acosta. 2009. Lesiones naturales y regeneración de tejido en ramets del coral Montastraea annularis (Scleractinia: Faviidae) en un arrecife degradado del Caribe Colombiano. Rev. Biol. Trop., 57 (4): 939-954. [ Links ]
2 Alvarado, E. M. y A. Acosta. (En prensa). Lesiones naturales y regeneración de tejido en ramets del coral Montastraea annularis (Scleractinia: Faviidae) en un arrecife degradado del Caribe Colombiano. Rev. Biol. Trop., 57 (4). Diciembre. [ Links ]
3 Alvarado, E. M, L. A. Acosta y R. García. 2004. Sexual reproduction in the reef-building coral Diploria labyrinthiformis (Scleractinia: Faviidae), Colombian Caribbean. Rev. Biol. Trop. 52 (4): 859-868. [ Links ]
4 Alvarado, E. M. y M. C. Corchuelo. 1992. Los nutrientes, la temperatura y la salinidad provenientes del Canal del Dique como factores de deterioro en el Parque Nacional Natural Corales del Rosario. 277-287. En: CCO (Ed.). Memorias del VIII Seminario Nacional de Ciencias y Tecnologías del Mar, Santa Marta. 1147 p. [ Links ]
5 Alvarado, E. M, G. Pinilla y T. León. 1989. Parque Nacional Natural Corales del Rosario. Plan de manejo volumen I. Documento Técnico. Sistema de Parques Nacionales, Ministerio del Medio Ambiente, Universidad de Bogotá Jorge Tadeo Lozano, Centro de Investigaciones Científicas, Bogotá. 325 p. [ Links ]
6 Aronson, R. B. y W. F. Precht. 2000. Herbivory and algal dynamics on the coral reef at discovery Bay, Jamaica. Limnol. Oceanogr., 45: 251-255. [ Links ]
7 Babcock, R. 1995. Synchronous multispecific spawning on coral reefs: potential for hybridization and roles of gamete recognition. Reprod. Fértil. Dev., 7: 943-950. [ Links ]
8 Barrios, L. 2000. Evaluación de las principales condiciones de deterioro de los corales pétreos en el Caribe colombiano. Tesis de Maestría, Universidad Nacional de Colombia, Bogotá. 166 p. [ Links ]
9 Bythell, J. C, E. H. Gladfelter y M. Bythell. 1993. Chronic and catastrophic natural mortality of 3 common Caribbean reef corals. Coral Reefs, 12: 143-152. [ Links ]
10 Cárdenas, F. 2005. Distribución vertical, composición, riqueza y densidad de corales hermatípicos juveniles en isla Grande, Caribe colombiano. Trabajo de pregrado. Pontificia Universidad Javeriana, Bogotá. 77 p. [ Links ]
11 Carson, F. L. 1996. Histotechnology. A self-instructional text. Segunda Edición. Chicago-ASCP Press, Chicago. 304 p. [ Links ]
12 Chasqui, L. H., E. M. Alvarado. A. Acero P. y F. Zapata. 2007. Efecto de la herbivoría y coralivoría por peces en la supervivencia de corales transplantados en el Caribe colombiano. Rev. Biol. Trop., 55 (3-4): 825-837. [ Links ]
13 Chiappone, M. y K. M. Sullivan. 1996. Distribution, abundance and species composition of juvenile scleractinian corals in the Florida reef tract. Bull. Mar. Sci., 58 (2): 555-569. [ Links ]
14 Coma, R. y H. Lasker. 1997. Small-scale heterogeneity of fertilization success in a broadcast spawning octocoral. J. Exp. Mar. Biol. Ecol, 214: 107-120. [ Links ]
15 Corchuelo, M. C. y E. M. Alvarado. 1990. Factores físico-químicos imperantes en el Parque Nacional Natural Corales del Rosario. 337-342. En: Memorias VII Seminario Nacional de Ciencias y Tecnologías del Mar, Cali. 792 p. [ Links ]
16 Díaz, J. M., L. M. Barrios, M. H. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G. H. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Angel, F. A. Zapata y S. Zea. 2000. Areas coralinas de Colombia. Serie de Publicaciones Especiales. No 5. INVEMAR, Santa Marta. 176 p. [ Links ]
17 Edmunds, P. 2002. Long-term dynamics of coral reefs in St. John, US Virgin Islands. Coral Reefs, 21: 357-367. [ Links ]
18 Edmunds, P. y R. Elahi. 2007. The demographics of a 15- year decline in cover of the Caribbean reef coral Montastraea annularis. Ecol. Monogr., 77 (1): 3-18. [ Links ]
19 Foley, J. E., S. H. Sokolow, E. Girvetz, C. W. Foley y P. Foley. 2005. Spatial epidemiology of Caribbean yellow band syndrome in Montastrea spp. coral in the eastern Yucatán, México. Hydrobiología, 548: 33-40. [ Links ]
20 Gardner, T. A., I. M. Côté, J. A. GilL, A. Grant y A. R. Watkinson. 2003. Long-term region-wide declines in Caribbean corals. Science, 301: 958- 960. [ Links ]
21 Garzón-Ferreira, J., D. Gil-Agudelo, L. Barrios y S. Zea. 2001. Stony coral diseases observed in southwestern Caribbean Reefs. Hydrobiología, 469: 65-69. [ Links ]
22 Garzón-Ferreira, J., S. Zea y J. M. Díaz. 2005. Incidence of partial mortality and other health indicators in hard-coral communities of four southwestern Caribbean atolls. Bull. Mar. Sci., 76 (1): 105-122. [ Links ]
23 Ginsburg, R., E. Gischeler y W. Kiene. 2001. Partial mortality of massive reef-building corals. An index of patch reef conditions, Florida Reef tract. Bull. Mar. Sci., 69 (3): 1149-1173. [ Links ]
24 Gittings, S., G. Gregory, K. Kenneth, C. Combs, B. Holland y T. Bright. 1992. Mass spawning and reproductive viability of reef corals at the east flower garden bank, Northwest Gulf of Mexico. Bull. Mar. Sci., 51 (3): 420-428. [ Links ]
25 Glynn, P. W., S. B. Colley, J. H. Ting, J. L. Maté y H. M. Guzmán. 2000. Reef coral reproduction in the eastern Pacific: Costa Rica, Panamá and Galápagos Islands (Ecuador). IV. Agariciidae, recruitment and recovery of Pavona varians and Pavona sp.a. Mar. Biol., 136: 785-805. [ Links ]
26 Guzmán, H. M. y I. Holst. 1993. Effects of chronic oil-sediment pollution on the reproduction of the Caribbean reef coral Siderastrea siderea. Mar. Poll. Bull., 26 (5): 276-282. [ Links ]
27 Harrison, P. y C. Wallace. 1990. Reproduction, dispersal and recruitment of scleractinian corals. 133-207. En: Dubzinsky, Z. (Ed.). Ecosystems of the world 25. Coral Reefs. Elsevier Science B.V., Amsterdam. 550 p. [ Links ]
28 Hoegh-Guldberg, O. 1999. Climate change, coral bleaching and the future of the world's coral reefs. Mar. Freshwater Res., 50: 839-866. [ Links ]
29 Hughes, T. P. 1984. Population dynamics based on individual size rather than age: a general model with a reef coral example. Am. Nat., 123 (6): 277-293. [ Links ]
30 Hughes, T. P. 1989. Community structure and diversity of coral reefs: the role of history. Ecology, 70: 275-279. [ Links ]
31 Hughes, T. P. y J. E. Tanner. 2000. Recruitment failure, life histories and long term decline of Caribbean corals. Ecology, 81 (8): 2250-2263. [ Links ]
32 Hughes, T. P., A. H. Baird, E. A. Dinsdale, N. A. Moltschaniwskyj, M. S. Pratchett, J. E. Tanner y B. L. Willis. 2000. Supply-side ecology works both ways: the link between benthic adults, fecundity, and larval recruits. Ecology, 81 (8): 2241-2249. [ Links ]
33 Kojis, B. L. y N. J. Quinn. 1984. Seasonal and depth variation of Acropora palifera at two reefs in Papua New Guinea. Coral Reefs, 3 (3): 165-172. [ Links ]
34 Lasker, H., D. Brazeau, J. Calderón, M. Coffroth, R. Coma y K. Kim. 1996. In situ rates of fertilization among broadcast spawning gorgonian corals. Biol. Bull., 190: 45-55. [ Links ]
35 Leblé, S. y R. Cuignon. 1987. El archipiélago de las Islas del Rosario. Estudio morfológico, hidrodinámico y sedimentológico. Bol. Cient. Cent. Invest. Oceanogr. Hidrogr. CIOH, 7: 37-52. [ Links ]
36 López, T. 2007. Abundancia, distribución y composición taxonómica de corales escleractínios juveniles en formaciones coralinas del archipiélago de las islas del Rosario, Caribe colombiano. Trabajo de pregrado, Universidad de Bogotá Jorge Tadeo Lozano, Santa Marta. 109 p. [ Links ]
37 Mendes, J. y J. Woodley. 2002. Timing of reproduction in Montastraea annularis: relationship to environmental variables. Mar. Ecol. Prog., Ser. 227: 241-251. [ Links ]
38 Mumby, P. J. y C. Dytham. 2006. Metapopulation dynamics of hard corals. 157-202. En: Kritzer, J. P. y P. F. Sale (Eds.). Marine metapopulations. Elsevier Academic Press, Burlington, EE. UU. 529 p [ Links ]
39 Mumby, P. J., N. L. Foster y E. A. Glynn. 2005. Patch dynamics of coral reef macroalgae under chronic and acute disturbance. Coral Reefs, 24: 681-692. [ Links ]
40 Oliver, J. y R. Babcock. 1992. Aspects of the fertilization ecology of broadcast spawning corals: sperm dilution effects and in situ measurements of fertilization. Biol. Bull., 183: 409-417. [ Links ]
41 Omori, M., H. Fukami, H. Kobinata y M. Hatta. 2001. Significant drop of fertilization of Acropora corals in 1999: An after-effect of heavy coral bleaching?. Limnol. Oceanogr., 46 (3): 704-706. [ Links ]
42 Pandolfi, J., C. Lovelock y A. Budd. 2002. Character release following extinction in a Caribbean reef coral species complex. Evolution, 56 (3): 479-501. [ Links ]
43 Peters, E. 2001. Coral tissue slide reading workshop. Mote Marine Laboratory. Tropical Research Laboratory. Summerland Key, EE. UU. 14 p. [ Links ]
44 Pizarra, V. 2006. The importance of connectivity between coral populations for the management of the Seafiower Biosphere Reserve. Tesis doctoral, University of New Castle, New Castle. 172 p. [ Links ]
45 Restrepo, J. y B. Kjerfve. 2000. Magdalena River: interannual variability (1975-1995) and revised water discharge and sediment load estimates. J. Hydrol., 235: 137-149. [ Links ]
46 Restrepo, J., P. Zapata, J. Diaz, J. Garzón-Ferreira y C. García. 2006. Fluvial fluxes into the Caribbean Sea and their impact on coastal ecosystems: The Magdalena River, Colombia. Global Planet. Change, 50: 33-49. [ Links ]
47 Roff, D. 2002. Life history evolution. Sinauer Associates, Inc. Sutherland. 527 p. [ Links ]
48 Sakai, K. 1998. Effect of colony size, polyp size, and budding mode on egg production in a colonial coral. Biol. Bull., 195: 319-325. [ Links ]
49 Sánchez, J., E. M. Alvarado, M. Gil, H. Charry, O. Arenas, L. Chasqui y R. García. 1999. Synchronous mass spawning of Montastraea annularis (Ellis & Solander) and Montastraea faveolata (Ellis & Solander) (Faviidae: Scleractinia) at Rosario Islands, Caribbean coast of Colombia. Bull. Mar. Sci., 65 (3): 873-879. [ Links ]
50 Sánchez, J., M. Gil, L. H. Chasqui y E. M. Alvarado. 2004. Grazing dynamics on a Caribbean reef-building coral. Coral Reefs, 23: 578-583. [ Links ]
51 Soong, K. 1991.Sexual reproduction patterns of shallow-water reef corals in Panamá. Bull. Mar. Sci., 49 (3): 832-846. [ Links ]
52 Steiner, S. 1995. Spawning in scleractinian corals from SW Puerto Rico (West Indies). Bull. Mar. Sci., 56 (3): 899-902. [ Links ]
53 Szmant, A. 1986. Reproductive ecology of Caribbean reef corals. Coral Reefs, 5: 43-54. [ Links ]
54 Szmant, A. 1991. Sexual reproduction by the Caribbean reef corals Montastrea annularis and M. cavernosa. Mar. Ecol. Prog. Ser., 74: 13-25. [ Links ]
55 Szmant, A. M., E. Weil, M. E. W. Miller y D. E. Colon. 1997. Hybridization within the species complex of the scleractinian coral Montastraea annularis. Mar. Biol., 129: 561-572. [ Links ]
56 Tsounis, G., S. Rossi., M. Aranguren, J. Gili y W. Arntz. 2006. Effects of spatial variability and colony size on the reproductive output and gonadal development cycle of the Mediterranean red coral (Corallium rubrum L.). Mar. Biol., 148: 513-527. [ Links ]
57 Van Veghel, M. L. J. 1994. Reproductive characteristics of the polymorphic Caribbean reef building coral Montastraea annularis. I. Gametogenesis and spawning behavior. Mar. Ecol. Prog. Ser., 109: 209-219. [ Links ]
58 Van Veghel, M. L. J. y M. Kahman.1994. Reproductive characteristics of the polymorphic Caribbean reef building coral Montastraea annularis. II. Fecundity and colony structure. Mar. Ecol. Prog. Ser., 109: 221-227. [ Links ]
59 Vargas-Ángel, B., S. Colley, S. Hoke y J. Thomas. 2006. The reproductive seasonality and gametogenic cycle of Acropora cervicornis off Broward County, Florida, USA. Coral Reefs, 25: 110-122. [ Links ]
60 Warner, R. y P. Chesson. 1985. Coexistence mediated by recruitment fluctuations: a field guide to the storage effect. Am. Nat., 125: 769-787. [ Links ]
61 Weil, E. 2004. Coral reef disease in the wider Caribbean: status and prognosis. 35-64. En: Rosenberg, E. y Y. Loya (Eds.). Coral disease and health. Springer, Berlín. 488 p. [ Links ]
62 Weil E. y N. Knowlton. 1994. A multi-character analysis of the Caribbean coral Montastraea annularis (Ellis & Solander, 1786) and its two sibling species, M. faveolata (Ellis & Solander, 1786) and M. franksi (Gregory, 1895). Bull. Mar. Sci., 55 (1): 151-175. [ Links ]
63 Wyers, S., S. Barnes y S. Smith. 1991. Spawning of hermatypic corals in Bermuda: a pilot study. Hydrobiología, 216/217: 109-116. [ Links ]
64 Zapata, P. 2005. Análisis histórico de los impactos naturales y antrópicos sobre los arrecifes coralinos del Parque Nacional Natural Corales del Rosario, Caribe Colombiano. Trabajo de grado, Universidad de Bogotá Jorge Tadeo Lozano, Santa Marta. 84 p. [ Links ]
FECHA DE RECEPCIÓN: 21/05/08 FECHA DE ACEPTACIÓN: 03/09/09