Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versão impressa ISSN 0122-9761
Bol. Invest. Mar. Cost. v.38 n.2 Santa Marta jul./dez. 2009
EFECTOS DE LA RECOMUNICACIÓN DEL RÍO MAGDALENA CON SU ANTIGUO DELTA: CAMBIOS EN LA PRODUCCIÓN PRIMARIA FITOPLANCTÓNICA Y RESPIRACIÓN EN EL COMPLEJO PAJARALES,1989 A 2005
EFFECTS OF THE MAGDALENA RIVER RECOMMUNICATION WITH ITS FORMER DELTA: CHANGES IN THE PHYTOPLANKTONIC PRIMARY PRODUCTION AND RESPIRATION IN THE PAJARALES COMPLEX, 1989 TO 2005
Johan D. Rodríguez-Chila1,3, José E. Mancera-Pineda2 y Héctor J. López-Salgado3
1Universidad del Magdalena, Programa de Biología, Santa Marta, Colombia, johandavid.rodriguez@gmail.com
2Universidad Nacional de Colombia, Sede Caribe, Instituto de Estudios Caribeños, Departamento de Biología, San Andres isla, San Luis Free Town No. 52-44. jemancerap@unal.edu.co
3Universidad del Magdalena, Instituto de Investigaciones Tropicales-INTROPIC, Santa Marta, Colombia, hector.lopezs@hotmail.com
RESUMEN
Con el propósito de evaluar posibles efectos de la recomunicación del río Magdalena con su antiguo delta, fueron estimadas en el Complejo Pajarales (CP) la producción primaria fitoplanctónica, respiración pelágica, pigmentos fotosintéticos y variables fisicoquímicas asociadas. Los muestreos se realizaron entre septiembre y diciembre de 2005 y su diseño fue similar al de un estudio previo a la recomunicación, que se tomó como base para la comparación. Los resultados muestran aumentos significativos en la producción primaria neta en relación a los años 1988-89 (de 598 gC/m2/año a 982 gC/m2/año); dicha producción estuvo impulsada principalmente por el amonio, sin encontrarse relación significativa ni con la transparencia ni con la clorofila a. El sistema, luego de la recomunicación con el río Magdalena, es menos eficiente en la síntesis de materia orgánica; la tasa respiratoria aumentó, indicando mayores y más prolongados eventos de heterotrofía, los cuales a su vez, podrían estar asociados a mayores entradas de materia orgánica y nutrientes inorgánicos provenientes del río Magdalena. Los resultados en su conjunto evidencian un incremento en la eutroficación del CP entre 1989 y 2005.
PALABRAS CLAVE: Producción primaria, Respiración pelágica, Clorofila a, Nutrientes, Complejo Pajarales.
ABSTRACT
The phytoplankton primary production, pelagic respiration, photosynthetic pigments, and physical-chemical associated variables in the Pajarales Complex, were estimated to assess the potential effects of the Magdalena River recommunication with its former delta, The study carried out between September and December 2005, followed the same experimental design than one done before to the recommunication The results show a significant increase of the net primary production when compared with the years 1988-89 (from 598 gC/m2/year to 982 gC/m2/year). The actual production seems to be driven mainly by ammonia, and there is no correlation neither with the water transparency nor the chlorophyll a concentration. The ecosystem is less efficient in the synthesis of organic matter after the recommunication with the Magdalena river. The respiration rate increased, showing higher and more prolonged heterotrophy, which may be associated to higher organic matter and inorganic nutrient inputs from the Magdalena River. The results confirm eutrophication increase in the CP between 1989 and 2005.
KEY WORDS: Primary production, Pelagic respiration, Chlorophyll a, Nutrients, Pajarales Complex.
INTRODUCCIÓN
Los estuarios y lagunas costeras son considerados de gran importancia ecológica, económica y social. Además de representar alrededor del 15 % de las costas del mundo (Subba-Rao, 1978), se caracterizan por su alta producción biológica, capacidad de amortiguamiento y como zonas de criadero y refugio de grandes poblaciones de invertebrados y peces, de valor ecológico y comercial (Reid y Wood, 1976; Yañez-Aranciabia y Nugent, 1977; Nixon, 1982; Day et al., 1989). Estas características convierten a estos ecosistemas en generadores de abundantes bienes y servicios, que han sido aprovechados históricamente por asentamientos y actividades humanas (Reid y Wood, 1976; Day et al., 1989). Sin embargo, la explotación intensiva de estos ecosistemas sin el conocimiento de sus procesos ecológicos fundamentales, ha generado en muchos casos continuos problemas ambientales que conducen a la pérdida de hábitat y a desequilibrios ecológicos, causando impactos negativos como la sobreexplotación, eutroficación, introducción de especies, contaminación, desecación y pérdida de biodiversidad; situación que crea la necesidad de mejorar el nivel de entendimiento de la estructura y funcionamiento de estos ecosistemas. Las estimaciones de producción primaria fitoplanctónica (PPF) y respiración pelágica (R) han sido objeto de muchas investigaciones en diversos ecosistemas acuáticos a nivel mundial, precisamente por que reflejan una parte importante del funcionamiento del ecosistema, suministrando información de la capacidad de carga (Vollenweider, 1974), del flujo de materia y energía, de la dinámica de nutrientes y del estado trófico (Nixon, 1982), lo cual es fundamental para evaluar la susceptibilidad a los posibles impactos naturales y/o antropogénicos, como, por ejemplo, acuacultura, contaminación, eutroicación, alteraciones hidrológicas, entre otras.
La ecorregión Ciénaga Grande de Santa Marta (CGSM), de la cual hace parte el complejo de Pajarales (CP), es el sistema lagunar-estuarino más grande e importante de Colombia (Botero y Botero, 1989) y es considerada como una de las más productivas del mundo (Knoppers, 1993). Dicha producción estimada en 982 gC/m2/año (Rodríguez, 2007) y 990 gC/m2/año (Hernández y Gocke, 1990) para CP y CGSM, respectivamente, sustenta una importante pesquería artesanal cercana a los 10.000 TM/año (Santos-Martínez et al, 1997), constituyendo la principal fuente de alimento e ingresos de aproximadamente 30000 habitantes (Botero y Salzwedel, 1999).
En las últimas décadas la ecorregión CGSM ha sufrido alteraciones antropogénicas en el intercambio natural de flujos de agua tanto marina como dulce ocasionadas por la construcción de canales a lo largo del río Magdalena, de los tributarios de la Sierra Nevada de Santa Marta, la desecación de ciénagas menores y principalmente por la construcción de carreteras sobre la isla de Salamanca y paralelas al río Magdalena (Botero y Salzswedel, 1999). Lo anterior, sumado al déficit hídrico estimado en 1031 mm/año (Botero y Salzswedel, 1999) y a la variabilidad ambiental y climática (Kaufmann y Hevert, 1973; Wiedemann, 1973; Blanco et al, 2006), causó un incremento progresivo de la salinidad del agua (Hurtado et al, 1995), hipersalinización de suelos, que a su vez generó muerte masiva de manglar (Botero, 1990) y disminución sustancial en diversidad y abundancia de aves, peces e invertebrados asociados al humedal (Botero y Marshall, 1994).
El deterioro de las condiciones ambientales motivó acciones enfocadas a rehabilitar la CGSM en términos de su función, procesos, usos y valores; que iniciaron en 1993 con un programa interinstitucional cuyos mayores esfuerzos se centraron en el restablecimiento de la hidrología del humedal, mediante la recomunicación del sistema con el río Magdalena a través de cinco canales preexistentes que fueron puestos en funcionamiento durante 1996 (Clarín, Torno y Almendros) y 1998 (Renegado y Aguas Negras) (PROCIÉNAGA, 1995; Botero y Salzswedel, 1999). Después de la recomunicación continuaron programas de monitoreo de las condiciones ambientales para evaluar sus efectos y probables beneficios sobre los bosques de manglar, la producción pesquera, la concentración de contaminantes, las variables fisicoquímicas y la estructura del plancton (Rivera-Monroy y Mancera, 2001; INVEMAR, 2003,2004); con la ausencia de un estudio de los posibles efectos sobre los procesos de producción primaria fitoplanctónica (PPF) y la respiración pelágica (R). Con el propósito de evaluar posibles efectos de la recomunicación del río Magdalena con su antiguo delta, se evaluaron para el CP la PPF y R; y se orientó a responder las siguientes preguntas especificas: 1) ¿Cómo son los niveles actuales de PPF y R en el CP?; 2) ¿Existen diferencias en los niveles de PPF y R antes y después de la recomunicación con el río Magdalena?; 3) En caso de encontrar diferencias, ¿éstas podrían corresponder a respuestas del ecosistema a la recomunicación?
ÁREA DE ESTUDIO
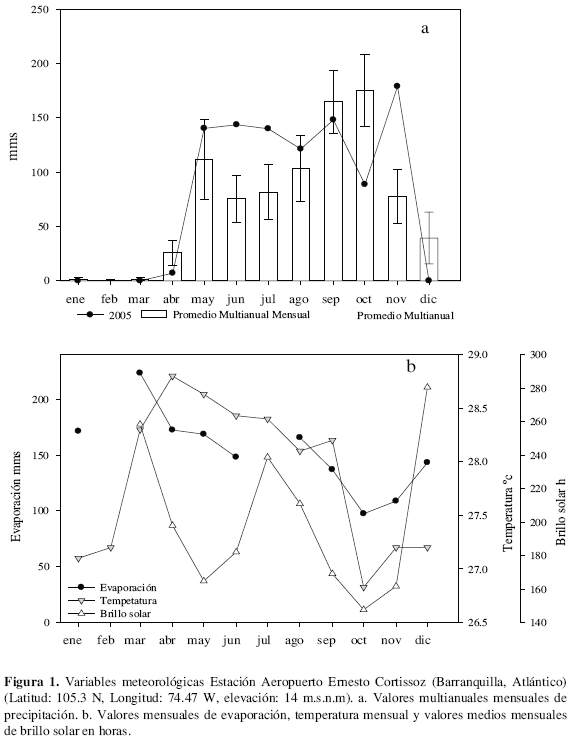
El Complejo de Pajarales (CP) localizado en el centro de la costa Caribe colombiana, entre los 10° 40' y 11° 00' N y 74° 31' y 74° 40' O (IGAC, 1974) (Figura 1), hace parte de la ecorregión de la Ciénaga Grande de Santa Marta (CGSM), antiguo delta del río Magdalena, la cual fue designada "humedal de importancia internacional RAMSAR y Reserva de la Biosfera". Limita al norte con la "Vía Parque Nacional Natural Isla de Salamanca-VIPIS" y al sur con el Santuario de Fauna y Flora de la CGSM; hacia el occidente, recibe aportes del río Magdalena a través de los caños Clarín, Aguas Negras y Renegado e intercambia aguas con la CGSM por el oriente mediante los caños Clarín y Grande. Las ciénagas y canales del CP cubren una extensión aproximada de 152.79 km2 y están rodeadas por manglar (Avicennia germinans, Rhizophora mangle y Laguncularia racemosa); la mayor parte del fondo es fangoso y su profundidad oscila entre 1.8 y 5.0 m. El clima de la región es cálido-seco con temperaturas anuales entre 27 - 34 °C; precipitación y evapotranspiración promedio (1967-1984), para la zona norte de 807 mm y 1953.8 mm, respectivamente (Blanco et al., 2006); el más alto brillo solar (2500-2825 horas/año) y la mayor intensidad lumínica del país (2140 kcal/cm2). Las temporadas de sequía y lluvia están bien definidas; una época seca en primeros meses del año que alcanza su pico entre marzo y abril, y una lluviosa entre septiembre y noviembre (Blanco et al., 2006); además de la fluctuación en las diferentes épocas climáticas, la precipitación presenta marcadas diferencias entre años (Rivera-Monroy et al., 2001). El régimen de mareas tiene amplitudes irregulares que varía entre 15 y 30 cm (Cosel, 1985) y en asocio con los vientos alisios promueven la entrada de importantes volúmenes de agua marina al sistema. Una descripción más detallada del área de estudio se puede encontrar en Wiedemann (1973), PROCIÉNAGA (1995) y Botero y Mancera (1996). Durante el año 2005, en el cual se realizó este estudio, el comportamiento climático, presentó la tendencia general, con bajas precipitaciones (0-7 mm) entre enero y abril, correspondiente con la época seca y altos niveles de precipitación entre mayo y noviembre (71-175 mm, Figura 1a). La evaporación mensual presentó valores altos durante la época seca y bajos entre los meses de septiembre a noviembre, concordante con la temperatura (Figura 1b); según la relación anual de precipitación y evaporación, la región presentó un déficit hídrico de -570 mm, el cual resulta menor al registrado para la región de -1146.8 mm (Blanco et al., 2006). El brillo solar mensual por su parte presentó un comportamiento bimodal y se ajustó a los valores medidos desde 1973; su menor intensidad se presentó entre septiembre y noviembre, meses característicos del período lluvioso. Las estaciones de muestreo seleccionadas fueron: ciénaga La Redonda (RED), caño Dragado (CDG), ciénaga La Luna (LUN) y la ciénaga Pajaral (PAJ) (Figura 2). El criterio de selección se basó en que corresponden a las estaciones muestreadas en 1989 por Rondón (1991), principal fuente de comparación de este estudio; a su representatividad dentro del CP, según el comportamiento de la salinidad (Giraldo et al., 1995), considerada la variable de mayor inluencia en los pulsos del sistema lagunar (Blanco et al., 2006) y por su ubicación con referencia a los principales caños rehabilitados.
MATERIALES Y MÉTODOS
Muestreos
Para hacer factible la comparación entre antes y después de la recomunicación del CP con el río Magdalena, el diseño de muestreo fue muy similar al estudio previo a la recomunicación realizado en 1989 por Rondón (1991); fueron muestreadas las mismas estaciones, cuantificadas las mismas variables con los mismos métodos. Se adelantaron cinco campañas de muestreos diarios en períodos de dos a tres semanas entre septiembre y diciembre de 2005, con recorridos entre las 9:00 y 11:00 h, a bordo de una lancha con motor fuera de borda. Debido al patrón no homogéneo de distribución del plancton, en cada una de las estaciones se establecieron tres puntos geo-referenciados en busca de integrar la variabilidad presente en los cuerpos de agua. En cada punto se tomaron muestras a nivel superficial, medio y fondo de la columna de agua, utilizando una botella tipo Van Dorn (3 L). Simultáneamente, se registraron las variables isicoquímicas a los mismos niveles de la columna de agua. El agua se puso en recipientes plásticos de 20 L previamente rotulados, y posteriormente se utilizó para la determinación de la PPF y la R in situ y la determinación de pigmentos fotosintéticos y nutrientes inorgánicos en laboratorio.
Variables fisicoquímicas y meteorológicas
Se determinaron la salinidad, pH, temperatura y oxígeno disuelto con sondas previamente calibradas (WTW-LF, pH y Oxi-98); se midió la transparencia del agua con disco Secchi y la profundidad con una vara metrada. A partir de muestras de agua colectadas en recipientes de polietileno (500 mL), se determinó en laboratorio la concentración de nitrógeno (NO3=, NO2- y NH4+), fósforo (PO4=) y silicio (SiO4=). Se siguieron los procedimientos indicados en Gocke (1986) y APHA (1998), utilizando celdas de 1 cm, en espectrofotómetro SPECTRONIC 20 GENESYS. Se adquirió información de precipitación, evapotranspiración, temperatura y brillo solar para el año 2005, de la estación meteorológica del aeropuerto Ernesto Cortizzos, ubicada en Barranquilla- Atlántico, perteneciente al Instituto de Hidrología, Meteorología y Estudios Ambientales de Colombia-IDEAM.
Producción primaria y respiración pelágica
Para la determinación de la PPF y la R se aplicó por triplicado el método de las botellas claras y oscuras (Gaarden y Gran, 1927), el cual ha sido empleado anteriormente con éxito en la CGSM (Hernández y Gocke, 1990; Rondón, 1991). Las muestras tomadas de la columna de agua en cada una de las estaciones fueron depositadas en recipientes plásticos de 20 L de capacidad y se vertieron por medio de mangueras plásticas de 0.5 mm de diámetro a botellas tipo Winkler de 100 mL. En cada estación se tomaron tres réplicas para la fijación del oxígeno inicial, tres para respiración y tres para cada nivel lumínico de producción, para un total de 84 botellas. Las incubaciones se realizaron en tubos de aerifico, simulando mediante filtros de nylon previamente calibrados con un luxómetro (Minipal, MLM1010), intensidades lumínicas de 100,75,50,25 y 1 %. Los tubos de aerifico con las botellas Winkler se llenaron de agua y se acomodaron horizontalmente en la superficie de la columna de agua. Durante el período de incubación se movió frecuentemente el montaje para homogenizar el contenido de las botellas, disminuyendo el posible error al sedimentar el fitoplancton. Las incubaciones se realizaron in situ entre las 11:30 y 14:30 h. El oxígeno inicial se fijó inmediatamente al iniciar la incubación y las botellas restantes claras y oscuras, después de 3 h. Posteriormente se cuantificó el oxígeno disuelto por medio del método de Winkler, con modificaciones Strickland y Parsons (1972). Las titulaciones se realizaron utilizando una Bureta Digital Brand III (precisión ±0.05 mL). A partir de los valores en mgO2L-1 obtenidos se calculó la PPF como producción primaria neta (PPN) y producción primaria bruta (PPB); así como la respiración pelágica(R), según los procedimientos descritos en Vollenweider (1974) y Gocke (1986).
Clorofila a, feofitina a e índice de pigmentos
Se filtraron muestras de agua a través de filtros de fibra de vidrio Whatman GF/C 47mm. Para la extracción de los pigmentos se utilizó acetona al 90 % durante 24 h en refrigeración y en ausencia de luz y se empleó el método espectrofotométrico para determinar la absorbancia de los extractos. Posteriormente se calcularon la clorofila a y la feofitina a mediante la ecuación de Lorenzen (1967) y el Índice de pigmentos de acuerdo con la relación Absorbancia430/Absorbancia665 (Margalef, 1995).
Análisis de los datos
La comparación de los niveles de PPF y R, y otras variables consideradas, se realizó con los registros obtenidos en 1989 por Rondón (1991). Para determinar diferencias significativas en los niveles de PPF y R entre 1989 y 2005, se realizó un análisis no paramétrico de Kruskal-Wallis. Adicionalmente se comparó la relación entre la PPN y R, mediante un diagrama de fases. Para las variables diferentes PPF y R, realizaron representaciones gráficas con el programa SIGMAPLOT 10.0®.
Para explicar la relación entre PPF, R y sus factores reguladores, se aplicó un análisis multivariado de componentes principales, previa transformación logarítmica de los datos [Log (x+1)]. Posteriormente se realizó un análisis de regresión múltiple paso a paso, con el fin de establecer qué variables influyeron en mayor grado sobre la PPF y R. Para realizar este análisis se emplearon dos grupos de variables, las respuesta (PPF y R) y las fisicoquímicas y biológicas (salinidad, temperatura, pH, oxígeno disuelto, Secchi, amonio, nitritos, nitratos, fosfatos, silicatos, clorofila a). Los análisis de Kruskal-Wallis y componentes principales fueron realizados con el paquete estadístico STATISTICA 6.0®, y la regresión múltiple con SPSS 10.0®.
RESULTADOS
Variables fisicoquímicas
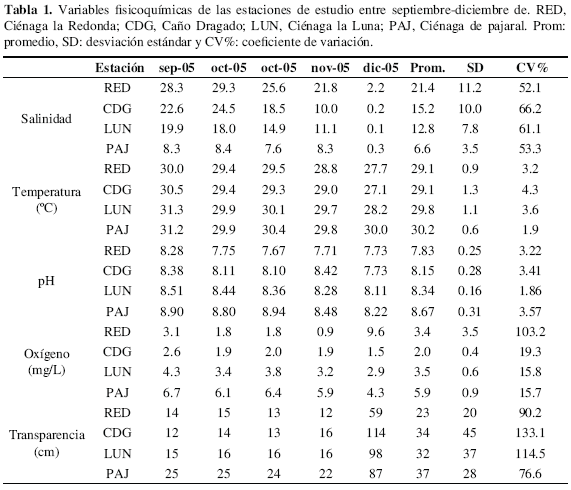
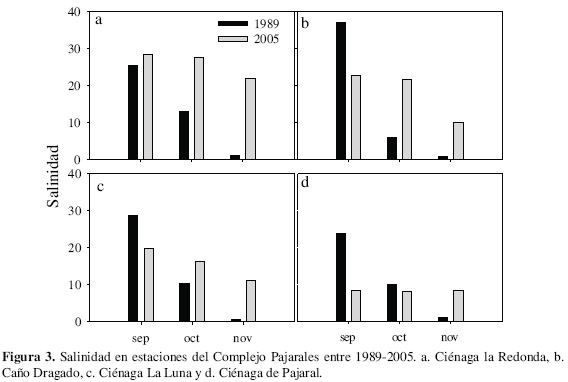
Durante 2005 la salinidad presentó un marcado gradiente descendiente en sentido Norte-Sur, con valores más altos en RED (21.4 ± 11.2), seguidos de CDG, la LUN y finalmente PAJ (6.60 ± 3.51) (Tabla 1). Los coeficientes de variación (CV) fueron mayores al 30 %, indicando amplia variación a través del tiempo. Los valores obtenidos durante 2005 con respecto a 1989 para los mismos meses, muestran que, a partir de octubre, en todas las estaciones la salinidad fue mayor (Figura 3).
La temperatura del agua fluctuó entre 31.3 y 27.1 °C, registrados para LUN en septiembre y CDG en diciembre. Esta variable presentó una leve tendencia a disminuir en el tiempo, no obstante los bajos CV indicaron poca variabilidad (Tabla 1). El máximo promedio se registró en PAJ (30.3 ± 0.6 °C) y el mínimo en CDG (29.1 ± 1.3 °C).
El pH osciló desde valores alcalinos de 8.94 (PAJ segunda quincena octubre) hasta valores cercanos a la neutralidad de 7.67 (noviembre en RED). En estas mismas estaciones se registraron los promedios máximos (8.67 ± 0.31) y mínimos (7.83 ± 0.25) de todo el sistema. Para esta variable el gradiente fue inverso al descrito para la salinidad y similar al de temperatura (Tabla 1).
Las concentraciones de oxígeno disuelto en las estaciones RED, CDG y LUN, fueron relativamente bajas (menores de 4 mg/L) y se mantuvieron casi constantes, mientras que en promedio PAJ presentó la mayor concentración (5.9 ± 0.9 mg/L). De acuerdo con el CV sólo RED presentó un alto grado de variación, pero este se debió principalmente a la altísima concentración de diciembre (Tabla 1). En 2005 la concentración de oxígeno siempre fue menor que las registradas para 1989 en todas las estaciones, con una diferencia bien marcada en la RED (Figura 4).
La transparencia del agua presentó el mismo patrón entre estaciones, manteniéndose poco variable hasta noviembre (entre 25 y 12 cm), mientras que en diciembre se observaron los valores más altos en todo el sistema (114 y 59 cm). El promedio máximo de Secchi se presentó en PAJ (37 ± 28 cm) y el mínimo en RED (23 ± 20 cm). De acuerdo con los CV, todas las estaciones presentaron una variación significativa a través del tiempo (Tabla 1).
Nutrientes inorgánicos disueltos
Durante 2005 la concentración de amonio osciló entre 0.1 y 14.2 µg.at/L, presentándose entre estaciones un comportamiento similar, con concentraciones altas en septiembre y diciembre, mientras que en octubre y noviembre se obtuvieron las más bajas concentraciones (Tabla 2). El promedio más alto se presentó en RED (6.3 ±7.1 µg.at/L) y el menor en PAJ (1.3 ±1.6 µg.at/L). Los nitritos oscilaron entre 3.0 (RED) y 0.2 µg.at/L (LUN y PAJ). RED fue la estación que registró la concentración promedio máxima (1.5 ± 1.0 µg.at/L) y PAJ la mínima (0.3 ± 0.2 µg.at/L). Los nitratos presentaron en casi todos los casos valores no detectables, excepto en octubre (primera quincena) cuando se registraron concentraciones de 3.0, 2.6, 1.0 y 0.8 µg.at/L en RED, CDG, LUN y PAJ, respectivamente (Tabla 2). Las concentraciones de nitratos en 2005 presentaron en todas las estaciones marcadas diferencias con relación a 1989 (Figura 5). En 2005, sólo se detectaron valores en noviembre, mientras que en 1989, los nitratos estuvieron disponibles durante toda la época de lluvias.
De acuerdo con los CV las concentraciones de fosfato durante 2005 presentaron variación significativa en el tiempo. Este nutriente fluctuó entre 2.8 (RED) y 0.4 µg.at/L (RED, CDG y LUN). RED presentó la concentración promedio más alta (1.7 ± 1.1) y PAJ la mínima (0.5 ± 0.2) (Tabla 2). Al comparar 1989 y 2005 se encontraron concentraciones de fosfato similares entre septiembre y octubre, mientras que en noviembre de 1989 se registraron aumentos en las concentraciones de hasta 4.8 µg.at/L con relación a 2005 (Figura 6).
La concentración de silicatos en 2005 no presentó un patrón claro ni en tiempo ni espacio. La máxima concentración fue de 1437.9 (LUN) y la mínima 287.3 µg.at/L (PAJ). La concentración promedio máxima se presentó RED (1051.3 ± 348.0 µg.at/L) y la mínima en PAJ (756.2 ± 470.4 µg.at/L). Los CV muestran variación significativa en el tiempo para cada estación (Tabla 2).
La relación DIN:DIP osciló entre 39 y 1 en CDG. Durante todo el período muestreado en RED y PAJ se presentaron deficiencias por nitrógeno principalmente entre octubre y noviembre. En las estaciones CDG y LUN se presentó deficiencia por fósforo en diciembre cuando se registró alta concentración de amonio (Tabla 2). La máxima relación promedio DIN:DIP se registró en CDG (12 ± 15) y la mínima en PAJ (4 ± 37). De acuerdo con los CV la relación DIN:DIP presentó una variación significativa durante el período de muestreo.
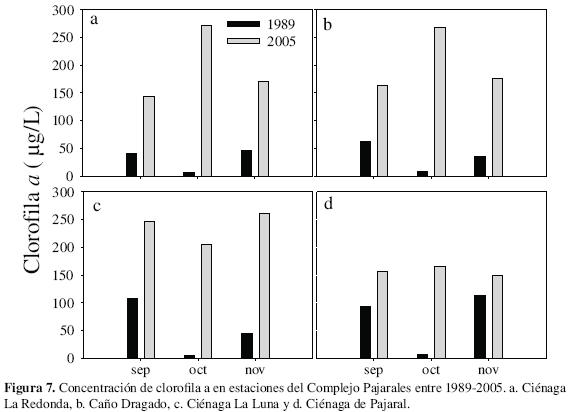
Clorofila a, feofitina a e índice de pigmentos La concentración de clorofila a presentó una amplia variación durante 2005, entre 312.1 y 19.6 µg/L (RED y CDG respectivamente). Entre septiembre y noviembre se presentaron altas concentraciones de clorofila a en todas las estaciones (312.1 y 143.3 µg/L) y en diciembre, al final de las lluvias, ésta llegó a sus concentraciones más bajas (65.0 y 19.6 µg/L) (Tabla 3). Este cambio entre noviembre y diciembre generó una variación significativa de acuerdo con los CV estimados. El promedio máximo se encontró en LUN (187. 7 ± 52. 9 µg/L) y el mínimo en PAJ (134.7 ± 40.9 µg/L). La concentración de clorofila a muestra claramente las diferencias entre los años estudiados, marcadas principalmente por las altas concentraciones encontradas durante el 2005 (Figura 7).
Para feofitina a se detectaron concentraciones bajas (1.4 µg/L) y no detectables, mientras que el índice de pigmentos varió entre 2.87 y 2.07, con promedio máximo de 2.56 ± 008 (CDG) y mínimo de 2.36± 0.13 (PAJ) (Tabla 3).
Producción primaria y respiración pelágica
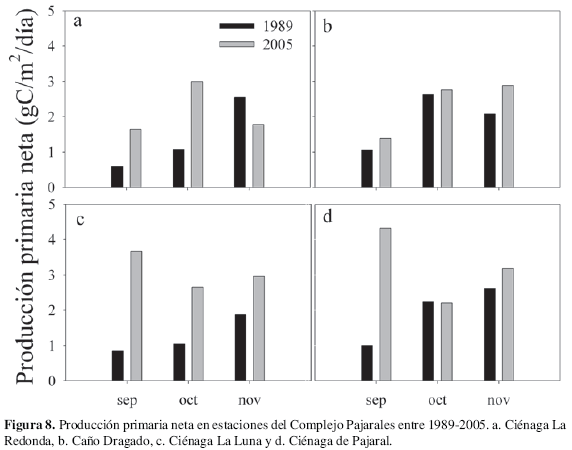
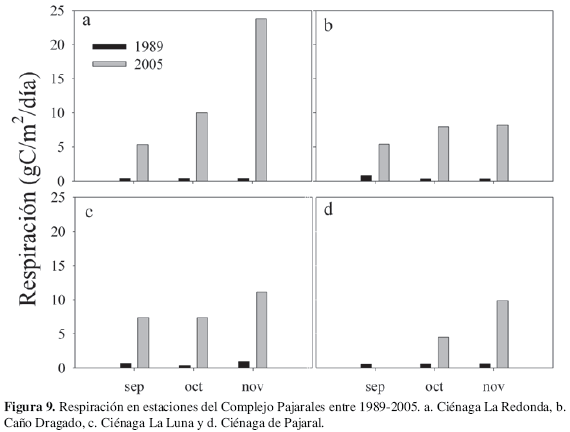
Los niveles de PPN fluctuaron entre 4.33 y 1.38 gC/m2/d en PAJ y CDG respectivamente. Los valores del CV indicaron que en las estaciones RED, PAJ y CDG se presentaron variaciones significativas en el tiempo, mientras que LUN presentó poca variación (Figura 8). Por otro lado R presentó una amplia variación entre 23.81 gC/m2/d y 3.97 gC/m2/d (Figura 9). Las estaciones RED y PAJ fueron las más variables, mientras que LUN y DRG presentaron poca variación en el tiempo. El promedio máximo se midió en RED (12.29 ± 8.22 gC/m2/d) y el mínimo en PAJ (6.31 ±3.11 gC/m2/d). El ámbito de variación de la PPB está comprendido entre 25.59 y 6.40 gC/m2/d. Las tendencias tanto temporal como espacial que presentan en todas las estaciones siguen un patrón similar a R (Figura 9 y 10). El promedio máximo se registró en RED (14.65 ± 7.96 gC/m2/d) y el mínimo en PAJ (8.85 ± 3.63 gC/m2/d). La mayor variación temporal se presentó en RED y PAJ mientras que LUN y CDG se caracterizaron por ser poco variables.
En general en todas las estaciones y fechas comparadas se observan mayores niveles de PPF y R en 2005 con respecto a 1989 (Figuras 8, 9 y 10). Este aumento es aún más evidente en el caso de R que se incrementó en un 96 %. El resultado del análisis de Kruskal-Wallis confirma éstas diferencias significativas entre 1989 y 2005 en los niveles de PPN, R y PPB (Tabla 4).
Metabolismo neto y tasas de productividad
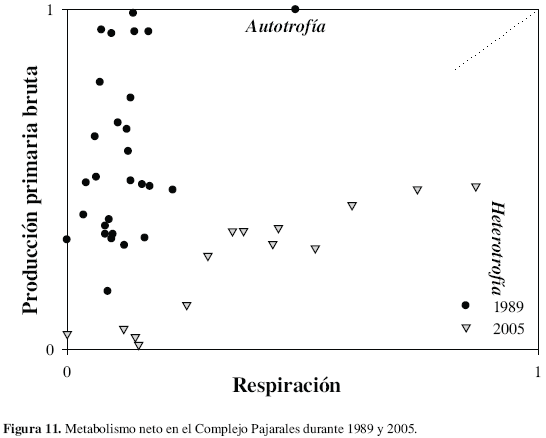
El CP fue heterotrófico durante 2005, ninguna de las estaciones presentó metabolismo positivo, mientras que en 1989 el ecosistema se caracterizó por presentar una condición autotrófica (Figura 11). Estos resultados indican que en 2005 las pérdidas por R fueron mucho mayores que la PPB a pesar de la alta tasa de producción del fitoplancton, situación diferente a lo registrado en 1989.
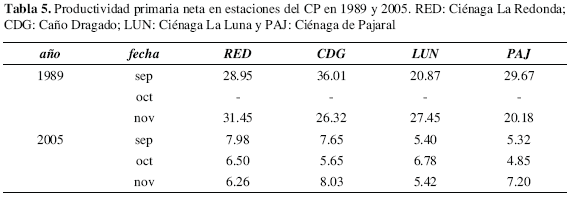
La productividad primaria neta o "tasa de renovación" muestra la cantidad neta de carbono fijado por unidad de clorofila a durante una hora. Los valores registrados para el año 2005 presentan un ámbito de variación de 8.74 y 4.10 mgC/ mgChl a/h. Los CV para las estaciones indicaron poca variación a través del tiempo. El promedio máximo de productividad neta se encontró en RED (6.81 ± 1.99 mgC/ mgChl a/h) y el mínimo en PAJ (5.56 ± 1.27 mgC/mgChl a/h). La productividad primaria bruta osciló entre 9.59 y 4.79 mgC/mgChla/h. El promedio máximo lo presentó RED (8.39 ± 1.85 mgC/mgChla/h) y el mínimo en LUN (7.09 ± 2.29). La variación para cada estación muestra una relativa homogeneidad a través del tiempo.
Los valores de productividad primaria neta y bruta presentan grandes diferencias entre 1989 y 2005. En 1989 el CP presentaba valores altos (entre 36.0 y 29.1 mgC/mgChla/h) de productividad primaria neta con respecto a 2005 (7.9 y 4.9 mgC/mgChla/h) (Tabla 5).
Relación entre variables ambientales, PPF y R
Para el conjunto de variables, los tres primeros componentes explicaron el 75.4 % de la variación original (Tabla 5). El primer componente explicó un 36.45 % y mostró como principales eigenvectores a Secchi, oxígeno, pH, salinidad, nitritos y fosfatos. Esta asociación muestra las correlaciones que existieron durante este período entre las variables físicas mencionadas y la concentración de nitritos y fosfatos. En cuanto al segundo componente representó el 20.95 % de la variación y correlacionó principalmente a clorofila a, nitratos y las productividades bruta y neta. Por otra parte el tercer componente explica el 18.00 % de la variación y mostró correlaciones inversas entre el amonio y la PPN, la R y la PPB (Tabla 6). Del conjunto de variables fisicoquímicas y biológicas que se utilizaron en la regresión múltiple, sólo el amonio se correlacionó significativamente con la PPN (61 %) y la temperatura con R y PPB (50 y 48 %, respectivamente; Tabla 7).
DISCUSIÓN
La producción primaria neta (PPN) estimada para el CP en 2005 fue alta con valores entre 1.38 y 4.33 gC/m2/d, lo cual podría deberse a varios factores, entre los que se destacan la transparencia y la concentración de nutrientes. Algunos autores han propuesto que la transparencia podría estar regulando la PPF tanto en la CGSM (Hernández y Gocke, 1990; Hernández y Márquez, 1991), como en el CP (Rondón, 1991); sin embargo, la falta de relación entre la transparencia y las tasas de producción registradas en este y otros trabajos, sugieren algo diferente (Zea et al., 1998). Durante el período estudiado la transparencia del agua fue muy baja, excepto en diciembre donde la disponibilidad de luz en la columna de agua fue total para todas las estaciones. De otra parte, autores como Kucklick (1987) han registrado que la producción fitoplanctónica en la CGSM se mantiene aún en condiciones de baja transparencia, debido a los cambios en la composición planctónica a lo largo de la sucesión anual.
En diferentes sistemas lagunares-estuarinos se ha encontrado que la disponibilidad de nutrientes inorgánicos disueltos puede regular la abundancia y metabolismo de los productores primarios (Alpine y Cloren, 1992). Los estudios realizados en CP y CGSM no han permitido establecer una clara relación entre disponibilidad de nutrientes inorgánicos y PPF (Hernández y Gocke, 1990; Hernández y Márquez, 1991; Rondón, 1991). Dentro de las posibles razones para la falta de correlación entre estas dos variables pueden estar el rezago temporal entre la asimilación de nutrientes y el reflejo en el incremento de la PPF, la sucesión de tipos de fitoplancton adaptados a diferentes necesidades nutricionales y el control de la biomasa del fitoplancton por la herbivoría (Zea et al., 1998). Así mismo, la complejidad del metabolismo del nitrógeno y fósforo, asociado a los cambios en las concentraciones de cada una de sus formas, ha conllevado a amplias variaciones en la relación DIN:DIP, inclusive durante la misma época climática (Sánchez y Zea, 2000; Rivera-Monroy y Mancera, 2001), sin indicar claramente cual de estos dos elementos podría estar limitando la PPF. No obstante, durante 2005, la relación DIN:DIP sugiere que el N antes que el P pudo ser el limitante de la PPF en el CP. De hecho, los análisis de regresión múltiple indican que la PPN puede ser explicada hasta en un 60 % por la variación en la concentración de amonio.
La fuente de nutrientes en los estuarios puede ser alóctona por escorrentía, descarga de ríos o aporte de humedales adyacentes, o autóctona producto del reciclaje al interior del mismo sistema, o ser una mezcla de ambas fuentes (Hoppe et al., 1983; Hernández y Márquez, 1991). Las bajas concentraciones de nitrógeno y fósforo medidas y algunas relaciones entre salinidad y nutrientes, como la detectada entre 1993 y 2004 que muestra mayores concentraciones de amonio en años de mayor salinidad (INVEMAR, 2004), sugieren que el aporte autóctono de nutrientes es un mecanismo más importante que el aporte alóctono, para el sostenimiento de la alta PPF del CP. No obstante, las entradas de agua dulce también parecen ser de vital importancia en la dinámica general del sistema, pues regulan condiciones físico-químicas de las masas de agua, claves en los procesos biológicos de PPF y R. En el presente estudio con el ingreso de agua dulce se incrementó la transparencia del agua (Tabla 1). Las estaciones estudiadas en el año 2005 mostraron un gradiente en el aporte hídrico al CP, aumentando desde RED hacia PAJ (Tabla 1). Este gradiente encontrado desde el 2002 (INVEMAR, 2006) indica que los aportes del río Magdalena al CP son mayores a través del caño Aguas Negras que del caño Clarín.
Durante la mayoría de las investigaciones realizadas en la CGSM y CP se ha utilizado la concentración de clorofila a como un indicador de la PPF, de la biomasa o de ambos (INVEMAR, 2003). No obstante, en el presente estudio las variaciones en la clorofila a no estuvieron correlacionadas con cambios en la PPF (Tablas 5 y 6). Así mismo, llaman la atención los bajos valores de feofitina a encontrados que, junto con los valores obtenidos para el índice de pigmentos de Margalef, que varió entre 2.87 y 2.07 con promedio máximo de 2.56 ± 0.08 (CDG) y mínimo de 2.36± 0.13 (PAJ) (Tabla 3), estarían mostrando que, en todos los casos observados, la comunidad fitoplanctónica no fue afectada por procesos tales como pastoreo por parte del zooplancton, muerte de algas por diversas causas (cambios abruptos en salinidad y temperatura) o entradas de material detrítico vegetal, lo cual es poco probable. Muéstreos más seguidos en el tiempo probablemente muestren otras facetas de las poblaciones fitoplanctónicas del CP, como lo han sugerido algunos autores (Odum, 1972).
Los ámbitos de PPN en el CP en 2005 (1.38 - 4.33 gC/m2/d) presentaron con máximos más altos que los estimados por Rondón en 1988 para la misma época climática, en los mismos sitios de muestreo y con las mismas técnicas de análisis (0.31 - 3.20 gC/m2/d) (Rondón, 1991). La PPN anual del CP para 1989 fue de 598 gC/m2/año (1.64 gC/m2/d), correspondiendo a un sistema hipereutrófico, de acuerdo con la categorización de Nixon (1995). Si se tiene en cuenta que la PPN promedio del CP para la época lluviosa de 1989 fue de 1.7 gC/m2/d y que las determinaciones realizadas en la época de secas arrojaron como promedio 1.69 gC/m2/d, entonces para todo el sistema la magnitud en las épocas mencionadas fue muy similar. Ahora, si se considera que durante el año 2005 se presentó el mismo comportamiento que en 1989, en cuanto a magnitud general, el promedio obtenido para la época de lluvias de 2.7 gC/m2/d, representaría el promedio diario anual. Así, la PPN anual estimada para este año sería de 982 gC/m2/d. Este valor es superior al registrado por Rondón (1991), lo que indica un aumento en la eutroficación, además es muy similar al registrado para el centro de la CGSM (990 gC/m2/año) en 1987-88 por Hernández y Gocke (1990).
En cuanto a la relación entre la clorofila a y la R, la falta de correlación indica que otros elementos del seston, diferentes al fitoplancton (organismos heterotróficos, bacterias y zooplancton), contribuyeron en mayor proporción a la R. Estos resultados difieren de los registrados para la CGSM y CP (Gocke et al, 2003a), donde las estaciones con mayor clorofila a indicaron un mayor aporte del itoplancton a la R y viceversa. Los valores R registrados en el presente estudio fueron muy altos (23.81- 3.97 gC/m2/d), si los comparamos con los registrados en 1989 para el CP (1.87- 0.08 gC/m2/d), lo que demuestra un aumento en la actividad heterotrófica del sistema pelágico del CP. La CGSM y el CP han sido considerados como sistemas autotróficos, donde la producción de materia orgánica es mayor que su descomposición (Hernández y Gocke 1990; Rondón, 1991). Esta condición es característica de los sistemas lagunares-estuarinos, los cuales generalmente actúan como fuente de materia orgánica para las áreas costeras adyacentes (Winter et al., 1996). La heterotrofía, por el contrario, es característica de sistemas oligotróicos, que requieren de subsidios alóctonos de materia orgánica (Howarth et al., 1996; Smith y Hollibaugh, 1997).
Durante 1997, poco después de la reapertura del caño Clarín, se hallaron condiciones de heterotrofía en la CGSM y CP, principalmente en las ciénagas PAJ y LUN (Gocke et al., 2003a), donde las formas fitoplanctónicas más pequeñas (0.2 - 2.0 µm) aportaron en mayor grado a la producción general del sistema. Simultáneamente con el anterior estudio, Gocke et al. (2003b) estimaron la contribución de las bacterias heterotróicas en la degradación de la materia orgánica en el sistema pelágico, a partir de la diferencia entre la respiración bacteriana y respiración de la comunidad. Tanto en el grupo correspondiente a las estaciones de la CGSM como del CP, los valores medios de la contribución bacteriana a R alcanzaron un 37 %. Empero la importancia de la actividad de la comunidad heterotróica en los procesos de degradación de la materia orgánica, la alta correlación entre la R y la concentración de cloroila a, indicaron la dominancia de los grupos autotróicos (itoplancton) en este proceso (Gocke et al., 2003a). Durante 2005 la condición heterotrófica prevaleció en tiempo y espacio (Figura 11), lo que muestra que esta condición estaría siendo más frecuente en el CP. La R se relacionó con bajas concentraciones de oxígeno en la columna de agua, indicando entrada de materia orgánica e inorgánica al sistema.
El efecto de adición de N y P sobre las tasas de PPF en comunidades fitoplanctónicas de la ciénaga de Pajaral y río Fundación fue evaluado por Vega (2002); los resultados mostraron que cuando se adicionaron bajas concentraciones de N y P, especialmente este último, la tasa fotosintética aumentó con respecto al control (sin adición de nutrientes), pero cuando aumentaron las concentraciones de nutrientes, la tasa fotosintética disminuyó, posiblemente por estrés isiológico. Estos resultados sugieren que los cambios de autotrofía a heterotrofía en el CP podrían estar asociados a importantes entradas de materia orgánica y nutrientes inorgánicos provenientes del río Magdalena, cargas que se incrementaron después de su recomunicación con el CP. Estos mayores aportes alóctonos, podrían estar generando estrés isiológico en las poblaciones itoplanctónicas como lo propone Vega (2002), y/o favorecer el crecimiento de poblaciones con individuos de menor tamaño, como lo registraron Gocke et al. (2003a), circunstancias que a su vez representan menor eficiencia en la PPF.
De acuerdo con lo expuesto, los evidentes cambios en la base trófica del CP, considerando los aumentos en las tasas de PPF, R, productividades y el metabolismo general entre 1989 y 2005, podrían estar relacionados con los cambios generados por la recomunicación del sistema, ya evaluados desde otros componentes. No obstante, es imprescindible la toma de más datos y un seguimiento continuo a fin de reafirmarlos como una respuesta del ecosistema a la recomunicación.
AGRADECIMIENTOS
Esta investigación se realizó en el marco del proyecto "Cambios en la productividad primaria de la Ciénaga Grande de Santa Marta después de la recomunicación con el río Magdalena", financiado por el Fondo Patrimonial para la investigación de la Universidad del Magdalena - FONCIENCIAS. Los autores agradecen a la Universidad Nacional de Colombia y a la Universidad del Magdalena, por la cofinanciación de los grupos de investigación: Modelación de Ecosistemas Costeros e Intérpretes de Ecosistemas.
BIBLIOGRAFÍA
1 Alpine, A. E. y J. E. Cloern. 1992. Trophic interactions and direct physical effects control phytoplankton biomass y production in an estuary. Limnol. Oceanogr., 37 (5): 946-955. [ Links ]
2 APHA, 1998. Standard methods for examination of water and wastewater. Edition 20, Alexandria, EE. UU. 1161 p. [ Links ]
3 Blanco, J. A., E. A. Viloria y J. C. Narváez. 2006. ENSO and salinity changes in the Ciénaga Grande de Santa Marta coastal lagoon system, Colombian Caribbean. Est. Coast. Shelf Sci., 66: 157-167. [ Links ]
4 Boteró, L. 1990. Massive mangrove mortality on the Caribbean coast of Colombia. Vida Silvestre Neotropical, 2 (2): 77-78. [ Links ]
5 Boteró, L. y H. Salzwedel. 1999. Rehabilitation of the Ciénaga Grande de Santa Marta, a mangrove-estuarine system in the Caribbean coast of Colombia. Ocean Coast. Manag., 42: 243-256. [ Links ]
6 Boteró, L. y J. E. Mancera. 1996. Síntesis de los cambios de origen antrópico ocurridos en los últimos 40 años en la Ciénaga Grande de Santa Marta (Colombia). Rev. Acad. Colomb. Cienc, 20 (78): 465-474. [ Links ]
7 Boteró L. E. y L. Boteró. 1989. Problemática ambiental del sistema Ciénaga Grande de Santa Marta, Delta Exterior del rio Magdalena. 11-28. En: Boteró, J. E. (Ed.). Colombia y el agua: tres aspectos. Serie 5. FESCOL, Bogota. 78 p. [ Links ]
8 Boteró, L. y M. Marshall. 1994. Biodiversity within the living, dying and dead mangrove forests of the Ciénaga Grande de Santa Marta. Mote Marine Laboratory Technical Report Number 366. Tallahassee, EE. UU. [ Links ]
9 Cosel, R. V. 1985. Moluscos de la región de la Ciénaga Grande de Santa Marta (costa del Caribe de Colombia). An. Inst. Invest. Mar Cost. Punta Betín, 15/16: 79-370. [ Links ]
10 Day, J. C. Hall, M. Kemp, y A. Yañez-Aranciabia.1989. Estuarine ecology. Jhon Willey, Nueva York. 558 p. [ Links ]
11 Gaarden. T. y H. H. Gran. 1927. Investigation of the production of the plankton in the Oslo Fjork. Ons. Int. Explor. Mer. 42: 1-48. [ Links ]
12 Giraldo, R. H., J. Martínez, L. H. Hurtado, S. Zea y E. R. Madera. 1995. Análisis de clasificación de series temporales: el caso de la salinidad en la Ciénaga Grande de Santa Marta, Colombia. An. Inst. Invest. Mar. Punta Betín, 24: 123-134. [ Links ]
13 Gocke, K. 1986. Manual para determinar los procesos de producción y degradación en biotopos marinos, especialmente en lagunas costeras y manglares (mimeógrafo). Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 86 p. [ Links ]
14 Gocke K, E. Mancera, A. Vidal y D. Fonseca. 2003a. Planktonic primary production and community respiration in several coastal lagoons of the outer delta of the Río Magdalena, Colombia. Bol. Invest. Mar. Cost., 32: 125-144. [ Links ]
15 Gocke K, J. E. Mancera y A. Vallejo. 2003b. Heterotrophic microbial activity and organic matter degradation in coastal lagoons of Colombia. Rev. Biol. Trop. Mar., 51 (1): 85-98. [ Links ]
16 Hernández, C. y K. Gocke. 1990. Productividad primaria en la Ciénaga Grande de Santa Marta, Colombia. An. Inst. Invest. Mar. Punta Betín, 19-20: 101-119. [ Links ]
17 Hernández, C. y G. Márquez. 1991. Producción primaria en el ecosistema Ciénaga Grande de Santa Marta, laguna costera del Caribe Colombiano. Trianea, 4: 385-407. [ Links ]
18 Hoppe, H. G., K. Gocke, D. Zamorano y R. Zimmermann.1983. Degradation of macromolecular organic compounds in a tropical lagoon (Ciénaga Grande, Colombia) and its ecological significance. Int. Revue Ges. Hydrobiol., 68 (6): 811-824. [ Links ]
19 Howarth, R. W. R. Schneider y D. Swaney. 1996. Metabolism and organic carbon fluxes in the tidal freshwater Hudson River. Estuarios, 19: 848-865. [ Links ]
20 Hurtado, L. H., J. E. Mancera, R. Giraldo, S. Zea y R. Madera. 1995. Comportamiento espacial y temporal de la salinidad en la Ciénaga Grande de Santa Marta, Colombia, período 1970-1994. En: Botero, L. y E. Mancera (Eds.). Estudio ecológico de la Ciénaga Grande de Santa Marta-delta exterior del río Magdalena, tercera etapa. Informe final, Instituto de Investigaciones Marinas y Costeras- INVEMAR, Santa Marta. [ Links ]
21 IGAC, 1974. Monografía del departamento del Magdalena. Ministerio de Hacienda y Crédito Público. Instituto Geográfico "Agustín Codazzi", Bogotá. 146 p. [ Links ]
22 INVEMAR. 2004. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe 2004. MMA-BID-INVEMAR. Santa Marta, Colombia. 105 p. [ Links ]
23 INVEMAR. 2006. Red de vigilancia de la calidad ambiental marina en Colombia-REDCAM. Instituto de investigaciones Marinas y Costeras "José Benito Vives de Andréis"-INVEMAR. http://www.invemar.org.co/siam/redcam. 04/11/07. [ Links ]
24 Kaufmann, R. y F. Hevert. 1973. El régimen luviométrico del río Magdalena y su importancia para la Ciénaga Grande de Santa Marta. Mitt. Inst. Colombo-Alemán Invest. Cient., 7: 121-137. [ Links ]
25 Knoppers, B. 1993. Aquatic primary production in coastal lagoons. 219-260. En: Kjerfve, B. (Ed.). Coastal lagoons processes. Elsevier Science Publisher B.V. Amsterdam. [ Links ]
26 Kucklick, M. 1987. Biomasa del fitoplancton y contenido del seston en un estuario de manglar (Ciénaga Grande de Santa Marta). Tesis doctoral, Universität Stuttgart, Stuttgart, Alemania. 262 p. [ Links ]
27 Lorenzen, C. J. 1967. Determination of chlorophyll and pheopigments: spectronic equation. Limnol. Oceanogr., 12: 343-346. [ Links ]
28 Margalef, R. 1995. Ecología. Ediciones Omega, SA. Barcelona. 951 p. [ Links ]
29 Nixon, S. W. 1982. Nutrients dynamics, primary production and fisheries yield of lagoons. Oceanol. Acta, 125: 357-371. [ Links ]
30 Nixon, S.W. 1995. Coastal marine eutrophication: A definition, social causes, and future concerns. - Ophelia, 41: 199-219. [ Links ]
31 Odum, E. 1972. Ecología. Tercera Edición, Editorial Interamericana S.A., México D. F. 639 p. [ Links ]
32 PROCIENAGA. 1995. Proyecto de rehabilitación de la Ciénaga Grande de Santa Marta. Plan de Manejo Ambiental, v 6.95. Santa Marta. [ Links ]
33 Reid, W. y R. Wood. 1976. Ecology of inland waters and estuaries. Segunda edición, Van Nostran Conpany, Nueva York. 485 p. [ Links ]
34 Rivera-Monroy, V. H. y J. E. Mancera. 2001. Estructura y función de un ecosistema de manglar a lo largo de una trayectoria de restauración en diferentes niveles de perturbación: El caso de la región Ciénaga Grande de Santa Marta. Informe final, COLCIENCIAS-INVEMAR-University of Louisiana at Lafayette. [ Links ]
35 Rodríguez, J. D. 2007. Producción primaria fitoplanctónica y respiración pelágica en el Complejo Pajarales-Ciénaga Grande de Santa Marta, después de su recomunicación con el río Magdalena. Tesis de pregrado, Universidad del Magdalena, Santa Marta. 101 p. [ Links ]
36 Rondón, E. H. 1991. Estimación de la productividad primaria fitoplanctónica en las ciénagas del Complejo Pajarales, Caribe colombiano. Tesis Biología, Pontificia Universidad Javeriana, Bogotá. 80 p. [ Links ]
37 Sánchez, R. y S. Zea, 2000. Metabolismo de nitrógeno y fósforo inorgánicos disueltos en la columna de agua en una laguna costera tropical (Caribe Colombiano). Caribb. J. Sei., 36 (1-2): 127-140 p. [ Links ]
38 Santos-Martínez, A., N. Bateman, E. Viloria, M. E. Rueda, L. M. Grijalba, R. Tijaro y J. C. Narváez. 1997. Variación temporal y espacial de la estructura de la comunidad íctica de algunas ciénagas del Complejo de Pajarales-delta exterior del río Magdalena. En: Mancera, J. E. (Ed.). Monitoreo del efecto ambiental de la construcción de canales en el delta exterior del río Magdalena. Informe de avance. Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 91 p. [ Links ]
39 Smith, S. V. y J. T. Hollibaugh. 1997. Annual cycle and intertidal variavility of ecosystem metabolism in a temperate climate environment. Ecol. Monogr., 67: 509-533. [ Links ]
40 Strickland, J. y T. Parsons. 1972. A practical handbook of sea water analysis. Fish. Res. Bd. Canad. Bull., 167: 311 p. [ Links ]
41 Subba-Rao. 1978. Coastal lagoon research, present and future. UNESCO technical paper in marine science, 33: 191-231. [ Links ]
42 Vega, D. 2002. Efectos del enriquecimiento con nitrógeno y fósforo sobre el metabolismo de la comunidad fitoplanctónica en la ciénaga de Pajarales y Río Fundación, Caribe colombiano. Tesis Biología, Univ. Magdalena, Santa Marta. 60 p. [ Links ]
43 Vollenweider, R. 1974. A manual on methods for measuring primary production in aquatic environments. Segunda edición. International Biological Program. Blackwell Scientific Publications. Oxford. 225 p. [ Links ]
44 Wiedemann, H., 1973. Reconnaissance of the Ciénaga Grande de Santa Marta, Colombia: physical parameters and geological history. Mitteilungen des Instituto Colombo-Alemán de Investigaciones Científicas, 7: 85-119 p. [ Links ]
45 Winter, P. E. D., T. A. Schlachter y D. Baird. 1996. Carbon flux between an estuary and the ocean: A case of outwelling. Hydrobiologia, 337: 123- 132. [ Links ]
46 Yañez-Arancibia, A. y R. S. Nugent. 1977. El papel de los peces en estuarios y lagunas costeras. An. Centro. Cienc. Mar. Limnol. Univ. Autónoma de México., 4 (1): 107-114. [ Links ]
47 Zea, S., R. Giraldo H., J. E. Mancera y J. Martínez-C. 1998. Relaciones contemporáneas y rezagadas entre variables físico-químicas y biológicas en la Ciénaga Grande de Santa Marta, Caribe colombiano. Bol. Invest. Mar Cost., 27: 67-85. [ Links ]
FECHA DE RECEPCIÓN: 10/03/08 FECHA DE ACEPTACIÓN: 21/09/09