Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.39 no.1 Santa Marta Jan./June 2010
DISTRIBUCIÓN ESPACIAL, ABUNDANCIA Y RELACIÓN CON CARACTERÍSTICAS DEL HÁBITAT DEL CARACOL PALA EUSTROMBUS GIGAS (LINNAEUS) (MOLLUSCA: STROMBIDAE) EN EL ARCHIPIÉLAGO NUESTRA SEÑORA DEL ROSARIO, CARIBE COLOMBIANO*
SPATIAL DISTRIBUTION, ABUNDANCE AND RELATIONSHIP TO HABITAT FEATURES OF THE QUEEN CONCH EUSTROMBUS GIGAS (LINNAEUS) (MOLLUSCA: STROMBIDAE) IN NUESTRA SEÑORA DEL ROSARIO ARCHIPELAGO, CARIBBEAN COAST OF COLOMBIA
Kelly Gómez-Campo, Mario Rueda y Carolina García-Valencia
Instituto de Investigaciones Marinas y Costeras-INVEMAR, A.A 1016, Cerro Punta Betín, Santa Marta, Colombia. kelly_gomez@invemar.org.co (K.G.C.), mrueda@invemar.org.co (M.R.); cgv@invemar.org.co (C.G.V.)
RESUMEN
Se evaluó la densidad poblacional y distribución espacial de Eustrombus gigas (Linnaeus) en el archipiélago Nuestra Señora del Rosario, así como su asociación a diferentes hábitats, a partir del muestreo sistemático de 184 estaciones en dos épocas climáticas, húmeda (mayo-noviembre) y seca (diciembre-abril) que coinciden con el período reproductivo de la especie. En cada estación se contaron y midieron los individuos presentes en un área circular de 1256.6 m2 mediante buceo autónomo, a la vez que se hicieron observaciones in situ sobre los tipos de hábitats presentes. La densidad promedio (± DE) fue baja comparada con otras regiones del Caribe, 4.0 ind/ha ±10.8 y 3.7 ind/ha ±9.3, para las épocas húmeda y seca, respectivamente. Los individuos adultos, representaron 89 y 64 % de la población muestreada en cada época climática, especialmente agrupados en bajo Tortugas e isla Tesoro. Aunque se observó actividad reproductiva durante la época húmeda, la densidad de individuos estuvo por debajo de niveles críticos que garanticen el éxito reproductivo de la población. El análisis de distribución mostró que la abundancia de adultos estuvo espacialmente estructurada en ambas épocas climáticas, con agregaciones de individuos principalmente en bajo Tortugas e isla Tesoro. Los juveniles no mostraron estructura espacial debido a la baja abundancia observada Los modelos de regresión múltiple explicaron 48 y 14 % de la varianza total en la abundancia de adultos para la época húmeda y seca, respectivamente, con la profundidad, el tamaño medio de grano y porcentaje de coral mixto como variables predictoras. Se recomienda declarar zonas de protección especial a isla Tesoro y bajo Tortugas para la protección de población desovante; mientras que la misma medida de conservación se sugiere implementar en isla Arena para la protección de juveniles en praderas de pastos marinos.
PALABRAS CLAVE: Archipiélago Nuestra Señora del Rosario, Eustrombus gigas, Abundancia, Distribución espacial, Caracol pala.
ABSTRACT
Population density and spatial distribution of the Caribbean conch, Eustrombus gigas (Linnaeus), as well as its association to different habitats were evaluated at 184 stations sampled systematically in two seasons (wet and dry) in Nuestra Señora del Rosario archipelago. Each individual was counted and measured in a circular area of 1256.6 m2 (sampling unit) by SCUBA diving and in situ observations on the types of habitats were made. The average density (±SD) of the species was low compared with other regions in the Caribbean, 4.0 ind/ha ±10.8 and 3.7 ind/ha ±9.3, for the wet and dry seasons, respectively. Adults represented 89 and 64 % of the population surveyed for each season, and were specifically located at Bajo Tortugas and Isla Tesoro. Although reproductive activity was observed during the wet season, population density was below critical levels to guarantee the population's reproductive success. The spatial distribution analysis showed that the abundance of adults was spatially structured in both seasons, with important aggregations at Bajo Tortugas and Isla Tesoro. Juveniles did not show spatial structure for neither season due to the low observed abundance. Multiple regression models explained 48 and 14 % of the total variance in the abundance of adults during the wet and dry seasons, respectively; with depth, mean grain size, and percentage of mixed coral as predictor variables. It is recommended to establish Bajo Tortugas and Isla Tesoro as special protected areas in order to maintain the adult spawning stock, while the same conservation measure should be implemented at Isla Arena in order to protect juveniles on seagrass beds.
KEY WORDS: Nuestra Señora del Rosario archipelago, Eustrombus gigas, Abundance, Spatial distribution, Queen conch.
INTRODUCCIÓN
El gasterópodo Eustrombus gigas (Linnaeus), anteriormente llamado Strombus gigas (Petuch y Roberts, 2007), es conocido comúnmente en Colombia como caracol pala y debe su gran importancia al valor económico de su carne y al papel ecológico en su hábitat (Randall, 1964). Es una especie herbívora que habita generalmente entre 2 y 20 m de profundidad sobre fondos de praderas de pastos marinos, parches de arena, cascajo y praderas de macroalgas a lo largo de todo el Caribe, desde Bermuda y el sur de Florida hasta la costa norte de Sudamérica (Randall, 1964; Ray y Stoner, 1994; Glazer y Kidney, 2004).
En Colombia se ha trabajado considerablemente sobre los aspectos biológicos de E. gigas (Duque, 1974; García, 1991; Lagos, 1994; Chiquillo et al., 1997), destacando una talla media de madurez sexual de 240 mm y 221 mm para hembras y machos, respectivamente; y evidenciando una época de reproducción entre los meses de junio y enero por la presencia de masas de huevos en el hábitat y la migración de individuos adultos a aguas más someras, que coincide con el periodo de lluvias o época húmeda. Adicionalmente, Márquez (1993) observó una clara estratificación de la estructura poblacional en donde los juveniles se agruparon en aguas someras y sobre praderas de pastos marinos, mientras los adultos en sustratos arenosos en aguas más profundas, infiriendo una correlación entre la densidad de individuos, la talla y las características del hábitat
En las últimas décadas se ha desarrollado a gran escala la pesca comercial de E. gigas como respuesta a la alta demanda internacional, hasta el punto de llevarlo a la Lista Roja de Animales Amenazados de la Unión Internacional para la Conservación de la Naturaleza -UICN, 1994- como especie 'comercialmente amenazada', la especie está además listada en el Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres CITES (CITES, 2003). Además de la presión pesquera, la destrucción de hábitats de crianza a causa de diferentes métodos de pesca y contaminación constituye un factor importante que influye potencialmente en la amenaza de la especie (Mora, 1994). Por todo lo anterior, la regulación por parte de CITES para el manejo pesquero y conservación en los países afectados, pretende propiciar la recuperación de las poblaciones y los hábitats esenciales para evitar la potencial extinción de la especie. En este sentido la literatura ha documentado que la creación de áreas marinas protegidas (AMPs) (Stoner, 1997) y las estrategias de repoblación y trasplante (Stoner y Glazer, 1998), son medidas de conservación prometedoras para la recuperación de la especie. No obstante, el diseño de AMPs para la protección de agregaciones reproductivas o mecanismos de recuperación de poblaciones a través de estrategias de repoblación y trasplante, requiere el conocimiento de la distribución espacial de la especie objeto de estudio y su asociación con el hábitat que ocupa (Stoner, 1997, 2003).
En la última reunión realizada para el manejo del recurso "Taller Regional para el Desarrollo de Estrategias Colaborativas en el Manejo de Caracol Pala en el Caribe Sur Occidental, Islas de San Andrés, 2008", se reconoció que el archipiélago Nuestra Señora del Rosario (NSR), junto con San Bernardo, son lugares del Caribe continental colombiano donde aún se registra E. gigas, con algunas observaciones aisladas en La Guajira y los bajos de Isla Fuerte. Aunque el archipiélago NSR está declarado como Parque Nacional Natural, es un lugar sometido a intensas actividades antrópicas, como turismo y pesca, actividades que han conducido a que la población de E. gigas presente signos de sobreexplotación con una disminución en las capturas y en su talla media en la pesca artesanal. Medidas de conservación, como la declaración de áreas intangibles (cerradas a la intervención humana), no han rendido los frutos esperados, probablemente por la falta de control y vigilancia o por la falta de conservación dirigida exclusivamente a E. gigas con base en el conocimiento del estado actual de la población y su contexto espacial asociado a la heterogeneidad de hábitats existentes en el área de estudio (Díaz et al., 2000).
Es fundamental reconocer que en la naturaleza los organismos se encuentran formando agregaciones o gradientes en respuesta a características estructurales controladas por variables bióticas y abióticas que presentan los hábitats (Legendre, 1993), para contribuir a un mayor entendimiento de la dinámica poblacional de los organismos y su relación con el ambiente. Lo anterior ha redundado en importantes aplicaciones para el manejo y conservación de especies usando nuevos enfoques de la ecología, basados en la incorporación de la modelación espacial de poblaciones en estudios ecológicos (Legendre, 1993). Esta investigación, basándose en muestreos intensivos de la población y el hábitat que ocupa, buscó identificar patrones de distribución espacial y temporal teniendo en cuenta períodos de actividad reproductiva (época húmeda) y no reproductiva (época seca) de E. gigas en el archipiélago NSR, además de estimar su abundancia y determinar su relación con variables descriptoras del hábitat. Esta información permitirá generar un conocimiento fundamental para apoyar y contribuir a la formulación de planes de repoblación, trasplante y/o diseño de áreas marinas protegidas dirigidas a conservar la especie.
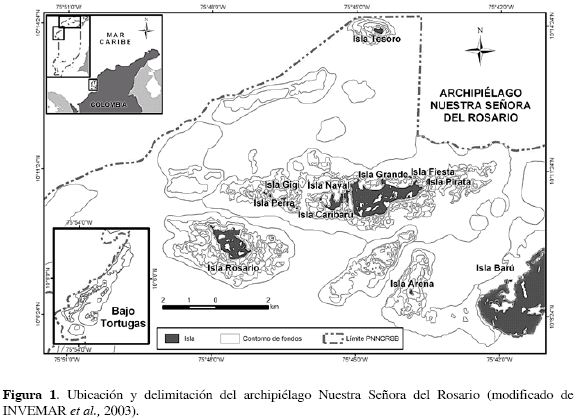
ÁREA DE ESTUDIO
El archipiélago NSR hace parte del Parque Nacional Natural Corales del Rosario y San Bernardo (PNNCRSB), se encuentra en el mar Caribe colombiano, dentro de la jurisdicción del Distrito Turístico, Cultural e Histórico de Cartagena de Indias en el departamento de Bolívar. Presenta una localización geográfica entre 10°06' y 10°15' N y 75°36' y 75°50' W (Alvarado et al., 1986; Díaz et al., 2000). De este Parque hacen parte 28 islas de distinto tamaño (Genet, 1992). El archipiélago fue declarado Parque Nacional Natural en 1977 (Figura 1), dada la necesidad de conservar y proteger áreas naturales poco intervenidas para la realización de investigaciones científicas, actividades recreativas y de educación ambiental. El área del PNNCRSB posee un clima tropical costero, con dos épocas climáticas en el año: época húmeda (mayo-noviembre) con lluvias frecuentes, temperatura del agua alrededor de 29 °C y oleaje suave; y época seca (diciembre-abril) sin lluvias, temperatura de 27 °C y oleaje fuerte (Alvarado et al., 1986; Bohórquez, 2002).
MATERIALES Y MÉTODOS
Diseño de muestreo
Tomando como base la cartografía preexistente de fondos potencialmente favorables para E. gigas en el archipiélago NSR (Díaz et al., 1996), se diseñó un muestreo sistemático. Teniendo en cuenta que la época de reproducción del caracol pala -junio a diciembre- en el área de estudio (Lagos, 1994) coincide con el aumento de la temperatura del agua, la baja influencia de los vientos Alisios y el período de mayores lluvias, se organizaron 87 estaciones separadas cada 500 m durante una época húmeda (agosto 2004) y 97 en una época seca (febrero 2005), que correspondieron a las mismas estaciones de la época húmeda y 10 complementarias. Por razones prácticas, las estaciones se agruparon en diferentes sectores segregados espacialmente (Figura 1): Bajo Tortugas (BT), Isla Tesoro (TROS), Isla Grande norte (IGN), Isla Grande sur (IGS), Isla Grande oriental (IGO), Isla Rosario (IR) e Isla Arena (IA). En cada estación (unidad de muestreo) se hizo una inmersión con equipo de buceo autónomo (SCUBA), cubriendo un área circular de 1256.64 m descrita por un radio de 20 m, en la que se hicieron recorridos concéntricos a 10 y 20 m, alrededor de un lastre de 30 kg atado con un cabo a una boya. Todos los caracoles encontrados en el área circular se contaron y se midieron, teniendo en cuenta su longitud total o sifonal LT (medida que se toma del ápice de la espira al final del canal sifonal) y grosor de labio GL (medida que se toma a 40 mm de profundidad del borde de la concha en su parte central). Simultáneamente se consideraron como variables descriptoras del hábitat los siguientes parámetros: profundidad, temperatura, salinidad, densidad de vástagos de Thalassia testudinum y tipo de fondo determinado por medio de la cuantificación de la cobertura del sustrato en porcentaje a partir de la observación de las proporciones de los diferentes fondos (porcentaje de esponjas, porcentaje de T. testudinum, porcentaje de arena, porcentaje de cascajo, porcentaje de algas, porcentaje de coral mixto, porcentaje de octocorales, porcentaje de Syringodium filiforme). Adicionalmente, se extrajo una muestra de sedimento por estación de muestreo para determinar contenido de materia orgánica y tipo de sedimento de acuerdo con el tamaño de grano.
Análisis de información
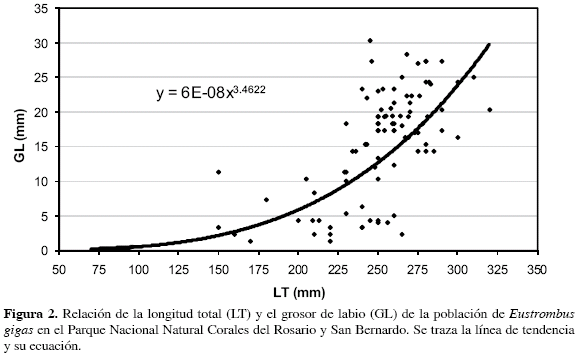
Densidad. La densidad de individuos de cada estación se estandarizó a individuos por hectárea (ind/ha). Para efectos de evaluar la estructura de la población, los individuos se clasificaron en dos grupos de edades: juveniles observables en campo (<12 cm de LT) y adultos. Appeldoorn (1988) menciona que un aspecto inusual en la biología del caracol pala es que el crecimiento en longitud total de la concha cesa en el momento de la maduración sexual, incrementándose sólo el grosor del labio de la concha, por lo cual se ha enfatizado que el grosor de labio es una medida para identificar juveniles y adultos de E. gigas. El ámbito de variación de la medida de grosor de labio que determina la edad de primera madurez y la fase adulta varia de >1 mm, utilizado por Pérez y Aldana (2000), hasta 14.2 mm, registrado por Appeldoorn (1988), como promedio para el primer grupo de edad de individuos adultos. Para este estudio se tuvo en cuenta la presencia de un labio extendido y se consideraron individuos juveniles cuando su grosor de labio no superó 8 mm, de acuerdo con Lagos (1994) quien determinó el ciclo reproductivo y la talla de madurez sexual de E. gigas en el área de estudio. La relación grosor de labio vs longitud total (Figura 2) se ajustó a una función potencial que corresponde al ámbito de variación de grosores de labio de individuos maduros registrados en la bibliografía (Appeldoorn, 1988; Pérez y Aldana, 2000). Se realizó un análisis exploratorio de datos con fines de conocer las medidas de tendencia central y variabilidad, las cuales condujeron a aplicar la prueba de Mann-Whitney (U; Zar, 1996) para evaluar diferencias en la abundancia de juveniles y adultos entre épocas climáticas, períodos que coinciden con el ciclo reproductivo de E. gigas en el archipiélago NSR (Lagos, 1994).
Distribución espacial. Se usaron técnicas geoestadísticas (análisis semivariográfico y kriging en bloques) para identificar patrones de distribución espacial de la densidad de E. gigas y para estimar la abundancia total efectiva en el área de estudio por medio del programa. El contexto espacial abordado asumió que la densidad de E. gigas (variable Z), medida en un sitio (x), representó un proceso estocástico Z(x), con una variable regionalizada. Lo anterior, unido a un gran número de estaciones cubiertas en un período de tiempo corto, posibilitó la aplicación de métodos estadísticos (Cressie, 1993; Legendre, 1993; Burrough y McDonell, 1998). Debido a que el propósito del análisis geoestadístico es modelar datos espacialmente correlacionados, la función de estructura espacial o semivariograma experimental γ(h) fue calculada como (Matheron, 1971):
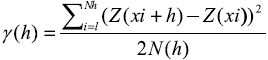
donde Z(xi) es el valor de la variable (e.g. densidad) en la estación xi, Z (xi+h) es otro valor de la variable separado de xi por una distancia discreta h y N(h) y es el número de pares de observaciones separadas por h. Para determinar el tipo de distribución espacial, los semivariogramas experimentales se ajustaron a los modelos teóricos: esférico, exponencial, lineal y Gaussiano (Burrough y McDonell, 1998). La selección del mejor modelo se hizo con base en los siguientes criterios: suma de cuadrados reducida (SCR), coeficiente de determinación (r2) y componente espacialmente estructurado o varianza espacial explicada (C/(Co+C)). Los modelos ajustados permitieron estimar los siguientes parámetros que definieron la función de dependencia espacial: variabilidad de microescala (Co: efecto pepita); valor asintótico de la semivarianza que indica la distancia más allá de la cual no existe estructura espacial (Co+C: meseta) y distancia de influencia espacial o tamaño relativo del parche (Ao: rango). La predicción espacial de la variable en los sitios no muestreados se hizo usando los parámetros estimados del semivariograma, mediante la técnica de kriging en bloques, la cual posibilitó la elaboración de mapas de densidad. La abundancia total se estimó mediante la sumatoria de las medias de densidad de los bloques Z (xi) a través del área irregular muestreada (A) (Burrough y McDonell, 1998):

Para evaluar los resultados de kriging se utilizó el análisis de validación cruzada, en la que los valores observados y estimados por el modelo espacial son relacionados evaluando el ajuste con una regresión lineal. Una relación 1:1 indica que el modelo predice exactamente los valores observados, entonces la pendiente (B) es 1.0 y el intercepto (a) es 0.0. Todos los análisis geoestadísticos se realizaron en el programa GS+ Versión7.0©, Gamma Design Software, Geoestadística para Ciencias Ambientales.
Relación entre la densidad y variables descriptoras del hábitat. Para evaluar la relación entre variables predictoras del hábitat (profundidad, salinidad, temperatura, densidad de vástagos, tamaño medio de grano, tipo de sedimento, porcentaje de materia orgánica en el sedimento, porcentaje de esponjas, porcentaje de T. testudinum, porcentaje de arena, porcentaje de cascajo, porcentaje de algas, porcentaje de coral mixto, porcentaje de octocorales, porcentaje de S. filiforme) y la variable dependiente (densidad de juveniles y adultos) se usó análisis de regresión múltiple. Inicialmente se verificó la relación lineal entre variables mediante correlación de Pearson; aquellas variables predictoras correlacionadas significativamente (p< 0.05), fueron tomadas en cuenta para el análisis de regresión múltiple (Zar, 1996):
Y = β0 + β1X1 + β2X2 + ... βkXk + ε
donde β0 ,β1 ,β2 ,...βk son los coeficientes de regresión múltiple y X1, X2,... Xk son las variables descriptoras del hábitat. El modelo se construyó mediante la técnica de regresión por pasos hacia atrás, es decir, que las variables potencialmente predictoras fueron removidas una a una hasta obtener el mejor modelo. La remoción secuencial de variables descriptoras del hábitat se determinó por una restricción realizada a priori sobre el nivel de significancia que debe tener cada variable para integrar el modelo (valores del estadístico F>3). La contribución independiente de cada variable descriptora del hábitat a la predicción de la densidad de caracol, fue evaluada por medio de la correlación parcial y la redundancia. Todos los análisis de correlación y regresión múltiple se realizaron con el programa STATISTICA 6.1© Data Analysis Software System.
RESULTADOS
Densidad
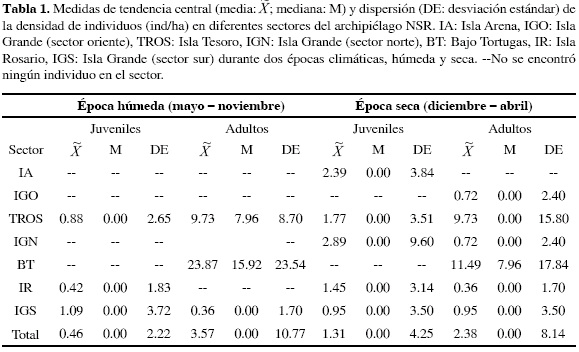
La abundancia de individuos no presentó diferencias entre épocas climáticas ni en adultos ni en juveniles (U87,97 = 4170.5; p= 0.82 y U87,97 = 3893; p= 0.06; respectivamente); sin embargo, es claro el carácter marginal de la segunda comparación. En época húmeda se registraron 44 individuos en total, de los cuales 11 % fueron juveniles y 89 % adultos Los individuos juveniles sólo se encontraron en los sectores isla Grande sur, isla Tesoro e isla Rosario, con densidades medias en cada sector que no sobrepasaron 1.1 ind/ha (Tabla 1). Debido a la baja presencia de juveniles, los individuos adultos representaron la población de E. gigas en época húmeda, con una densidad media de 3.6±10.77 ind/ha. En el sector bajo Tortugas, todos los individuos encontrados fueron adultos con un ámbito de 0.0-55.70 ind/ha y un valor medio de 23.9±23.5 ind/ha, así como en el sector isla Rosario donde se encontró también una densidad relevante de 9.7±8.70 ind/ha (Tabla 1).
En época seca se encontraron 45 individuos vivos en total, de los cuales 36 % fueron juveniles y 64 % adultos. La densidad media de juveniles fue 1.3±4.25 ind/ha (Tabla 1). Los valores más altos se registraron en los sectores isla Grande norte (2.9±9.6 ind/ha) e isla Arena (2.4±3.8 ind/ha), seguidos de isla Tesoro, isla Rosario e isla Grande sur, mientras que los sectores bajo Tortugas e isla Grande oriental no presentaron individuos juveniles. Con relación a la población adulta, los sectores bajo Tortugas e isla Tesoro mostraron las densidades medias más altas en el archipiélago (11.5±17.84 ind/ha y 9.7±15.8 ind/ha). Las densidades medias más bajas se registraron en isla Grande sur, isla Grande norte, isla Grande oriental e isla Rosario (<1.00 ind/ha). En el sector bajo Tortugas, todos los individuos encontrados fueron adultos, con un ámbito de 0.0-55.70 ind/ ha, mientras que en el sector isla Arena no se encontraron individuos adultos.
Distribución espacial
Por la presencia de ceros informativos y distribución asimétrica de las variables analizadas, se transformaron los datos con Log(x+1). Los semivariogramas experimentales de la abundancia de adultos fueron explicados para ambas épocas climáticas por el modelo Gaussiano (λ(h)= Co + C[1-exp(-h2/Ao2)]) en términos de los valores más bajos de SCR y más altos de r2 (Figura 3). Los semivariogramas alcanzaron asíntotas que definieron distancias de dependencia espacial de 11310 m y 9220 m para las épocas húmeda y seca, respectivamente, con un valor muy alto de varianzas espaciales explicadas (C/(Co+C)= 0. 99) y un valor muy bajo de variabilidad de microescala (Co= 0.001) (Tabla 2). La validación cruzada de las interpolaciones de kriging arrojaron valores en los parámetros de la regresión que indicaron mayor calidad de las interpolaciones durante la época húmeda (α= 0.205; β= 0.629; r2= 0.44) que durante la seca (α= 0.205; β=0.379; r2= 0.07) (Tabla 2). Dicha calidad se constató con los mapas de desviación estándar (Gómez-Campo, 2005) que mostraron baja variabilidad de la densidad en el área interpolada.
Los mapas de kriging generados a partir de la densidad de individuos mostraron concentraciones importantes de caracoles en el norte y al suroeste del área de estudio (isla Tesoro y bajo Tortugas, respectivamente) (Figura 4). De esta información, la abundancia total efectiva de E. gigas se estimó en 936±11 individuos para la época húmeda y 422±7 individuos para la seca. La densidad de individuos juveniles no se ajustó a algún modelo, por tanto una idea de su distribución fue determinada usando mapa de cuartiles. Estos mapas indicaron que el 75 % del área interpolada mostró valores de densidad de cero, mientras que el 25 % restante del área mostró densidades 15.92 ind/ha (2 ind/1256.64 m2) durante la época húmeda y 31.83 ind/ha (4 ind/1256.64 m2) durante la época seca en los sectores isla Grande, isla Tesoro, isla Rosario e isla Arena (Figura 4).
Relación entre la abundancia y variables que describen el hábitat
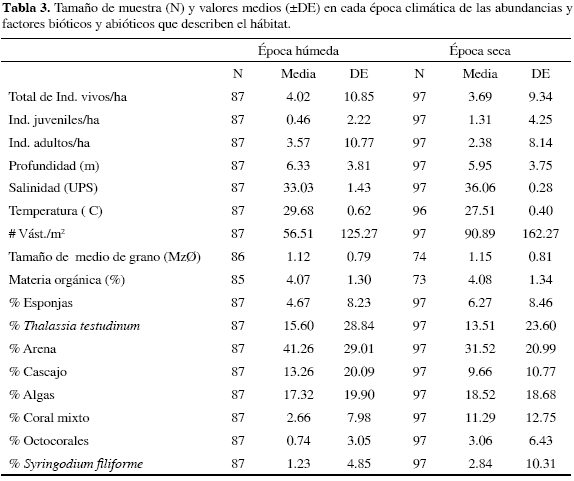
De las variables abióticas descriptoras del hábitat (Tabla 3), se encontró que la temperatura difirió entre épocas climáticas (H1,183 = 137.62; p<< 0.05), siendo más baja en la época seca (U: p< 0 05) De igual manera la salinidad presentó diferencias estacionales (Hl,184 = 146.94; p<< 0.05), con valores más bajos durante la época húmeda (U: p< 0.05); datos que coinciden con las condiciones físico-químicas de cada época climática. En lo referente a las variables que describen el fondo, se observaron diferencias en la densidad de vástagos, 56.51 vást/m2 (DE= 125.27) en la época húmeda y 90.89 vást/m2 (DE= 162.27) en la seca, con altas desviaciones en los datos observados en campo (Tabla 3). El análisis de sedimentos, detectó una clasificación que exhibe predominio de 'arenas medias' en los sectores isla Arena, isla Grande oriental, isla Grande norte, isla Rosario e isla Grande sur, con valores de tamaño medio de grano que van desde 1.11±0.71 hasta 1.34±0.48 Ø en isla Arena e isla Grande norte, respectivamente, y un valor máximo de 3.53 Ø en isla Grande sur. En los sectores bajo Tortuga y Tesoro se registraron 'arenas gruesas y gravas' con un tamaño medio de grano de 0.53±0.72 Ø y 0.08±0.48 Ø, respectivamente, y un valor máximo de -0.62 Ø. Por otra parte, la materia orgánica presente en el sedimento registró valores medios entre 3 y 4 %, el máximo valor se encontró en el sector isla Grande Sur con 8.61 %, mientras que el valor más bajo se presentó en Tesoro con 2.30 %.
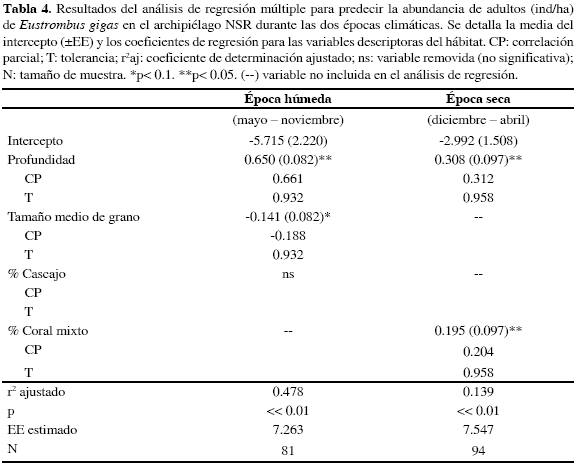
En época húmeda la densidad de adultos presentó una correlación positiva con la profundidad (r= 0.63; p< 0.05), mientras que el tamaño medio de grano presentó una correlación negativa (r= -0.31; p< 0.05); así mismo, el porcentaje de cascajo mostró correlación positiva con la densidad de adultos (r= 0.26; p< 0.05). El modelo de regresión múltiple para individuos adultos explicó significativamente un 48 % de la varianza total de E. gigas (Tabla 4), con la profundidad y el tamaño medio de grano como principales predictores. El nivel de tolerancia fue alto (T> 0.9) para las dos variables incluidas, manifestando la ausencia de predictores redundantes (Tabla 3) Ninguna de las variables que caracterizaron el hábitat presentó correlación con la abundancia de juveniles durante esta época climática.
En época seca la densidad de individuos adultos presentó una correlación con la profundidad (r= 0.35; p< 0.05) y el porcentaje de coral mixto (r= 0.26; p< 0.05). En consecuencia el modelo de regresión múltiple explicó significativamente un 14 % de la varianza de la densidad de adultos incluyendo a la profundidad y el porcentaje de coral mixto como variables predictoras que afectaron directamente la densidad de individuos. En esta época, la densidad de juveniles se correlacionó directamente con el porcentaje de T. testudinum (r= 0.22; p< 0.05).
DISCUSIÓN
Densidad
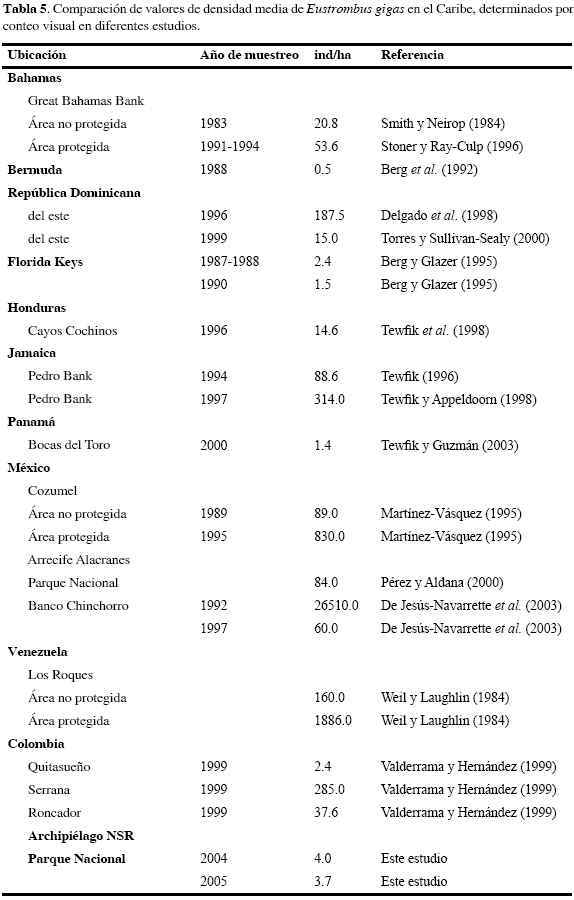
Es difícil realizar comparaciones directas de registros de densidad con otros estudios dadas las diferencias metodológicas en muestreo, ausencia parcial de información y falencias en la clasificación de la estructura de la población (juveniles- adultos). Una evaluación discreta de algunos estudios realizados sugirió que existe una gran variabilidad regional en las densidades de E. gigas (Tabla 5). Valores medios en el archipiélago NSR fueron siempre <5 ind/ha, muy cercanos y comparables a los registrados en Bermuda, Florida, Panamá y Colombia (Quitasueño). Es claro cómo, a través de los años, las densidades medias de la población del caracol disminuyen drásticamente. Es el caso de República Dominicana, donde tan sólo en tres años las densidades pasaron de 188 a 15 ind/ha. La densidad más alta registrada en este estudio -Bajo Tortugas, 24 ind/ha- representó 3 y 1 % de la densidad más alta registrada en México (830 ind/ha; Martínez-Vásquez, 1995) y Venezuela (1886 ind/ha; Weil y Laughlin, 1984). Sin embargo, un área protegida en Venezuela (Los Roques) fue abruptamente afectada por la pesca ilegal de E. gigas, como ha ocurrido con otras poblaciones de muchas regiones del Caribe (Appeldoorn, 1994).
El componente estructural dominante de la población de E. gigas en el archipiélago NSR son los adultos. La baja densidad de juveniles en el archipiélago puede atribuirse a la intensa actividad pesquera en el área de hace unos años. La condición de sitio turístico estimuló hace varios años la intensa extracción de caracol para suplir la demanda que, sin tener en cuenta volúmenes de captura, tallas, ni áreas específicas de pesca, llevó a disminuir de forma importante el recurso (Mora, 1994). Otro factor que pudo haber influenciado la baja densidad de juveniles es la urbanización del conjunto de islas que componen el archipiélago, lo que ha implicado a través de los años la destrucción de grandes extensiones de fondos compuestos principalmente por praderas de pastos (Alvarado, 1988), hábitat más importante para el desarrollo de los primeros años de vida de la especie. Por esta razón, es claro que los sectores menos intervenidos por actividades antrópicas, como bajo Tortugas e isla Tesoro (declaradas Áreas Intangibles, Decreto 622/77), puedan presentar las abundancias más altas de E. gigas.
La población de adultos en isla Tesoro y bajo Tortugas (individuos de cuatro años de edad) podrían representar un grupo de donadores o parentales para el sistema y el futuro de las poblaciones en el área de estudio. No obstante, estudios sobre actividad reproductiva de adultos realizados en Bahamas (Stoner y Ray-Culp, 2000) evidenciaron el efecto 'Allee' en las poblaciones de E. gigas, es decir, la ocurrencia de tasas de crecimiento poblacional negativas promovidas por la baja probabilidad de encuentro para la cópula entre los especímenes. Estos autores mostraron que nunca ocurrieron encuentros reproductivos cuando las densidades poblacionales fueron <56 ind/ha. En el archipiélago NSR, durante el período comprendido entre julio y agosto (época reproductiva según Lagos et al., 1996), se observó actividad reproductiva evidenciada en la presencia de masas de huevos, en dos áreas con una densidad poblacional de 24 ind/ha (bajo Tortugas) y 11 ind/ha (isla Tesoro). Aunque en este estudio no se evaluó un comportamiento reproductivo denso-dependiente, es posible que si bien existen adultos disponibles para una recuperación de la población, la actividad reproductiva podría estar siendo afectada por la baja probabilidad de encuentros. Stoner y Ray-Culp (2000) proponen que a densidades tan bajas como las registradas en el archipiélago NSR la población podría no tener progenie y el reclutamiento dependería sólo de fuentes externas, como la retención de larvas y la sobrevivencia de juveniles en los hábitats de crianza apropiados.
Distribución espacial
La estimación de la abundancia total efectiva de E. gigas generó una visión del estado de la población en el archipiélago NSR. Las estimaciones registradas en la literatura están basadas en una extrapolación de datos que no tiene en cuenta la distribución de la población ni el contexto espacial en el que habitan (Petitgas, 1996).
Tewfik et al. (1998) estimaron una abundancia total aproximada de 14.6 ind/ha en Honduras (223818 individuos en un área total de 15330 ha), mientras que en este estudio la abundancia total estimada fue de 0.27 ind/ha en la época húmeda (936±11 individuos en 3041 ha) y 0.14 ind/ha durante la época seca (422±7 individuos en 3041 ha). Estas abundancias tan bajas reflejan un indicio del severo decaimiento de la población en el área de estudio que enfatiza su inminente riesgo de extinción. El análisis variográfico reveló que la abundancia se estructuró espacialmente dentro de un ámbito de 11000 a 9000 m en las épocas húmeda y seca, respectivamente. La baja contribución del efecto pepita (<10 %) indicó que la escala de muestreo fue adecuada para medir el proceso espacial de la abundancia de E. gigas. Los tamaños de parche estimados en el archipiélago NSR son de gran magnitud considerando el área de estudio, lo cual sugiere que los individuos están muy alejados, generando además baja probabilidad de encuentros reproductivos.
Los mapas de distribución espacial de la densidad, reflejaron un patrón muy parecido entre épocas climáticas, con sectores específicos que representan altas densidades de individuos adultos (bajo Tortugas e isla Tesoro). Entre los aspectos que pudieron ocasionar la concentración de individuos adultos en dichos sectores está su condición como áreas exclusivas por la lejanía con las islas de interés turístico y el acceso. Bajo Tortugas es un sector que promueve alta sobrevivencia de E. gigas, por su difícil accesibilidad tanto para pescadores como para el sector turístico y por sus mayores profundidades (>10 m). En el sector isla Tesoro 'área intangible', la vigilancia y control son estrictos y se aplica la restricción completa de 'no pesca', a diferencia de isla Rosario que a pesar de ser también un 'área intangible' no recibe la atención y vigilancia requerida de acuerdo a lo que reflejan los resultados y las actividades observadas durante el trabajo de campo de este estudio.
El grupo de juveniles son individuos que se presentan en el ambiente natural en agregaciones ocupando sectores específicos del hábitat. Según Stoner y Ray-Culp (1993), las agregaciones de juveniles en Bahamas, forman una elipse con un eje longitudinal paralelo al eje principal de la dirección de la corriente. A primera vista, la ausencia de autocorrelación espacial de juveniles en ambas épocas climáticas en este estudio debida a la baja abundancia imposibilitó identificar patrones de distribución para juveniles. Lo anterior fue corroborado al registrarse en ambas épocas climáticas el 75 % del área muestreada con densidades de cero. El 25 % restante se encontró en los sectores isla Grande, isla Rosario, isla Tesoro e isla Arena.
Relación entre la abundancia y variables que describen el hábitat
En el archipiélago NSR la profundidad es una variable que contribuye a predecir la abundancia de individuos durante ambas épocas climáticas, con un modelo de regresión que explicó significativamente el 48 % de la varianza de densidad de individuos adultos, valores que sugieren un buen modelo para explicar la variabilidad de la abundancia de E. gigas. Estos resultados coinciden con lo registrado por Alcolado (1976), en el sentido que la distribución de la especie está ligada con la profundidad. Este autor encontró que los caracoles adultos tienen una distribución batimétrica más fuerte, que se encuentran formando grupos hasta los 40 m de profundidad. Sin embargo, esta distribución de caracoles en aguas más profundas del archipiélago NSR puede ser atribuida a la presión pesquera (Bené y Tewfik, 2003). En el mismo sentido, Stoner (1997) afirma que en lugares donde se pesca con equipo autónomo SCUBA (Puerto Rico) los caracoles se encuentran distribuidos a mayores profundidades (18-25 m), mientras que en lugares donde está prohibida la pesca con este tipo de equipo (Exuma Park, Bahamas), las mayores abundancias se registran a menores profundidades (10-15 m). Por esta razón, teniendo en cuenta la pesca indiscriminada en el archipiélago NSR, la mayor cantidad de individuos se encontró en las mayores profundidades de difícil acceso.
Otra variable predictora de la densidad de E. gigas fue el tamaño medio de grano MzØ, cuyos valores más bajos corresponden a arenas muy gruesas y los más altos a arenas muy finas. Esta variable presentó una correlación con la abundancia de la especie, por lo tanto, donde se registraron arenas más gruesas (menores MzØ) se encontraron a su vez una mayor cantidad de individuos adultos Según Randall (1964), el caracol pala hace parte del grupo de organismos herbívoros que habitan en los fondos marinos basando su alimentación en epífitos y afectando directamente la estructura de la comunidad bentónica. Así, es lógico pensar que los individuos prefieran arenas gruesas sobre las que pueden moverse para un pastoreo sin mucha dificultad, de esta manera funcionan ecológicamente como reguladores de la abundancia de detrito en su hábitat (Stoner et al., 1995) E. gigas se caracteriza por presentar su actividad reproductiva asociada a fondos de arenas gruesas y cascajo (Weil y Laughlin, 1984; Lagos et al., 1996; Glazer y Kidney, 2004), como se observó en este estudio durante la época húmeda en bajo Tortugas e isla Tesoro. Es probable que los fondos semidesérticos sean los lugares óptimos para las actividades reproductivas de E. gigas, ya que presentan mayor facilidad de desplazamiento sumado a la necesidad de formar depresiones en la arena (D'Asaro, 1965) para la depositación de las masas de huevos y su posterior camuflaje mediante la adherencia de granos de arena.
La única variable que presentó correlación con la abundancia de caracoles juveniles, fue el porcentaje de cobertura de T. testudinum en el sustrato marino. Durante la época seca, se observó una mayor cantidad de juveniles asociados directamente a este tipo de hábitat. Estos organismos se caracterizan por alimentarse de macrodetritos, incluyendo partes muertas de hojas de pastos marinos (Stoner, 1989), lo que hace que dichos ambientes sean propicios para el ciclo de vida de caracoles juveniles. Estos resultados concuerdan con lo registrado por varios autores en las islas Vírgenes y Bahamas, Gran Caribe (Randall, 1964; Stoner y Ray-Culp, 1993; Stoner y Schwarte, 1994), donde los juveniles de E. gigas están directamente asociados a parches de pastos marinos Según Stoner et al (1995), los juveniles se agregan durante cierta época del año en sectores específicos de praderas de pastos, donde la protección contra depredadores y la disponibilidad de alimento hace del hábitat un lugar seguro y propicio para el crecimiento. Es claro que la tasa de depredación disminuye con el aumento de la complejidad de la pradera de pastos (Ray y Stoner, 1994). Sin embargo, parece ser que la escogencia de praderas densas por parte de individuos juveniles es un comportamiento adaptativo y la distribución puede ser consecuencia de efectos como la preferencia por detritos, presencia de ciertas algas y componentes del sedimento. El comportamiento de juveniles coincide con lo registrado por Stoner y Ray-Culp (1993) en Shark Rock (Bahamas), donde la distribución de caracoles juveniles en praderas de pastos marinos fue independiente a la densidad de vástagos, lo que sugiere que la escogencia de la pradera puede llegar a ser específica de un sitio.
Los resultados aquí expuestos permiten contribuir y apoyar la generación de medidas de manejo y conservación para E. gigas en el archipiélago NSR, por lo tanto se sugiere declarar sectores de protección especial: I) las áreas de desove de isla Tesoro y bajo Tortugas, y II) el sector de isla Arena, considerando que es un área potencial de crianza con predominancia de praderas de pastos, aislada, sin mayor intervención humana y donde se encontraron individuos juveniles; y/o usarla para programas de repoblación o trasplante. Cualquier medida debe estar basada en un sistema de manejo con control efectivo y que garantice la activa participación de la comunidad que reside en el área: nativos, pescadores, ocupantes y sector turístico.
AGRADECIMIENTOS
Este documento es parte del trabajo de grado de KGC. Los autores desean agradecer al Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología (COLCIENCIAS) por el apoyo financiero (proyecto código 2105-09-13528), al Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" (INVEMAR), el Centro de Investigaciones, Educación y Recreación de las Islas del Rosario (CEINER) y la Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales (UAESPNN) por el apoyo técnico y logístico. Al grupo de trabajo del proyecto por la asistencia, colaboración y apoyo incondicional en el trabajo de campo, en el desarrollo de la investigación y elaboración del documento.
BIBLIOGRAFÍA
1 Alcolado, P. 1976. Crecimiento, variaciones morfológicas de la concha y algunos datos biológicos del cobo Strombus gigas L. (Mollusca, Mesogastropoda). Acad. Cien. Ser. Oceanol., 34: 1-36. [ Links ]
2 Alvarado, E. 1988. El Parque Nacional Natural Corales del Rosario: situación actual. VI Seminario Nacional de las Ciencias y Tecnologías del Mar. Comisión Colombiana del Oceano, Bogotá. 48 p. [ Links ]
3 Alvarado, E., F. Duque, L. Flórez y R. Ramírez. 1986. Evaluación cualitativa de los arrecifes coralinos de las islas del Rosario (Cartagena-Colombia). Bol. Ecotrópica: Ecosistemas Tropicales, 15: 1-30. [ Links ]
4 Appeldoorn, R. 1988. Age determination, growth, mortality and age of first reproduction in adult queen conch, Strombus gigas L., off Puerto Rico. Fish. Res., 6: 363-378. [ Links ]
5 Appeldoorn, R. 1994. Spatial variability in the morphology of queen conch and its implications for management regulations. 145-157. En: Appeldoorn, R. y B. Rodríguez (Eds.). Biología, pesquería y cultivo del caracol Strombus gigas. Fundación Científica Los Roques, Caracas. 376 p. [ Links ]
6 Bené, C. y A. Tewfik. 2003. Biological evaluation of marine protected area: evidence of crowding effect on a protected population of queen conch in the Caribbean. Mar. Ecol., 24 (1): 45-58. [ Links ]
7 Berg, C. J. y R. Glazer. 1995. Stock assessment of a large marine gastropod (Strombus gigas) using randomized and stratified towed-diver censusing. ICES Mar. Sci. Symp., 199: 247-258. [ Links ]
8 Berg, C. J., F. Couper. K. Nisbet y J. Ward. 1992. Stock assessment of queen conch, Strombus gigas, and harbour conch, S. costatus, in Bermuda. Proc. Gulf Carib. Fish. Inst., 41: 433-438. [ Links ]
9 Bohórquez, C. 2002. Guía Parque Nacional Natural los Corales del Rosario y San Bernardo. Convenio CEINER-UEASPNN-MINAMBIENTE, Cartagena. 44 p. [ Links ]
10 Burrough, P. y R. McDonnell. 1998. Principles of geographical information systems. Oxford University Press, Nueva York. 333 p. [ Links ]
11 Chiquillo, E., J. Gallo y J. Ospina. 1997. Aspectos biológicos del caracol pala, Strombus gigas Linnaeus, 1758 (Mollusca: Gastropoda: Strombidae), en el departamento archipiélago de San Andrés, Providencia y Santa Catalina (Caribe colombiano). Bol. Cient. INPA, 5: 159-179. [ Links ]
12 CITES, 2003. Convención sobre el comercio internacional de especies amenazadas de fauna y flora silvestres. Examen del comercio significativo de especies del Apéndice II (resolución Conf. 12.8 y Decisión 12.75). Progresos realizados en la aplicación del examen de comercio significativo (fases IV y V). Decimonovena reunión del comité de fauna, Ginebra, Suiza. 73 p. [ Links ]
13 Cressie, N. 1993. Statistics for spatial data. John Wiley & Sons, Nueva York. 900 p. [ Links ]
14 D'Asaro, C. 1965. Organogenesis, development and metamorphosis in the queen conch Strombus gigas with notes on breeding habits. Bull. Mar. Sci., 15 (2): 359-416. [ Links ]
15 De Jesús-Navarrette, A., A. Medina-Quej y J. J. Oliva-Rivera. 2003. Changes in the queen conch (Strombus gigas l.) population structure at Banco Chinchorro, Quintana Roo, Mexico, 1990-1997. Bull. Mar. Sci., 73 (1): 219-229. [ Links ]
16 Delgado, G. A., M. Chiappone, F. X. Geraldes, E. Pugibet, K. M. Sullivan, R. E. Torres y M. Vega. 1998. Abundance and size frequency of queen conch in relation to benthic community structure in Parque Nacional del Este, Dominican Republic. Proc. Gulf Carib. Fish. Inst., 50: 1-31. [ Links ]
17 Díaz, J. M., G. Díaz, J. Garzón, J. Geister, J. A. Sánchez y S. Zea. 1996. Atlas de los arrecifes coralinos del Caribe colombiano, I: complejos arrecifales oceánicos. Publicación Especial No. 2, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 83 p. [ Links ]
18 Díaz, J. M., L. Barrios, M. Cendales, J. Garzón, J. Geister, M. López, G. H. Ospina, F. Parra, J. Pinzón, B. Vargas, F. A. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Serie de Publicaciones Especiales No. 5, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 176 p. [ Links ]
19 Duque, F. 1974. Estudio biológico-pesquero de Strombus (Tricornis) gigas L. (Mollusca, Gastropoda) en el archipiélago de San Bernardo (Bolívar). Trabajo de grado. Univ. Jorge Tadeo Lozano, Bogotá. 74 p. [ Links ]
20 García, M. I. 1991. Biología y dinámica poblacional del caracol de pala Strombus gigas L. (Mollusca, Mesogastropoda) en las diferentes áreas del archipiélago de San Andrés y Providencia. Trabajo de grado. Univ. Valle, Cali. 183 p. [ Links ]
21 Genet, P. 1992. Informe final proyecto: cartografía y fondos submarinos islas del Rosario (Colombia) y apreciación de sus áreas a partir de imágenes de satélite Spot. Bol. Cient. CIOH, 11: 15-26. [ Links ]
22 Glazer, R. y J. Kidney. 2004. Habitat associations of adult queen conch (Strombus gigas L.) in an unfished Florida Keys back reef: applications to essential fish habitat. Bull. Mar. Sci., 75 (2): 205-224. [ Links ]
23 Gómez-Campo, K. 2005. Distribución espacial de la población de Strombus gigas Linnaeus, 1758 (Mollusca: Strombidae) y características del hábitat que la explican en el archipiélago Nuestra Señora del Rosario, Caribe colombiano. Trabajo de grado, Univ. Jorge Tadeo Lozano, Santa Marta. 103 p. [ Links ]
24 INVEMAR, UAESPNN, CARDIQUE, EPA-CARTAGENA y DIMAR. 2003. Elaboración de un modelo de desarrollo sostenible para los archipiélagos de Nuestra Señora del Rosario y San Bernardo. Informe técnico. Resolución del MAVDT número 456, Bogotá. 256 p. [ Links ]
25 Lagos, A. L. 1994. Algunos aspectos biológicos y pesqueros del caracol pala Strombus gigas Linnaeus, 1758. Trabajo de grado, Univ. Jorge Tadeo Lozano, Bogotá. 154 p. [ Links ]
26 Lagos, A., S. Hernández, H. Rodríguez y P. Victoria. 1996. Algunos aspectos bioecológicos y reproductivos del caracol de pala Strombus gigas Linnaeus, 1758 en el archipiélago de San Bernardo, Caribe colombiano. Bol. Cient. INPA, (4): 141-160. [ Links ]
27 Legendre, P. 1993. Spatial autocorrelation: trouble or paradigm? Ecology, 74: 1659-1673. [ Links ]
28 Márquez, E. 1993. Biología poblacional del caracol pala Strombus gigas Linnaeus, 1758 en las islas de Providencia y Santa Catalina. Trabajo de grado, Univ. Jorge Tadeo Lozano, Bogotá. 154 p. [ Links ]
29 Martínez-Vásquez, D. 1995. ¿Qué pasa con las poblaciones de caracol en Cozumel? Informe CRIP, Puerto Morelos, 2 (2), 15 p. [ Links ]
30 Matheron, G. 1971. The theory of regionalized variables and its applications. Cahiers du CMM, facs. 5, Ecole Nat. Sup. Mines, París. 211 p. [ Links ]
31 Mora, O. 1994. Análisis de la pesquería del caracol pala (Strombus gigas L.) en Colombia. 137-144. En: Appeldoorn, R. y B. Rodríguez (Eds.). Biología, pesquería y cultivo del caracol Strombus gigas. Fundación Científica Los Roques, Caracas. 376 p. [ Links ]
32 Pérez, M. y D. Aldana. 2000. Distribución, abundancia, densidad y mofometría de Strombus gigas (Mesogasteropoda: Strombidae) en el arrecife Alacranes, Yucatán, México. Rev. Biol. Trop., 48 (1): 51-57. [ Links ]
33 Petitgas, P. 1996. Geostatistics and their applications to fisheries survey data. 113-142. En: Megrey, B. y E. Moksness (Eds.). Computers in fishery research. Chapman y Hall, Londres. 142 p. [ Links ]
34 Petuch, E. J. y C. E. Roberts. 2007. The geology of the Everglades and adjacent areas. CRC Press, Boca Ratón, EE. UU. 212 p. [ Links ]
35 Randall, J. 1964. Contributions to the biology of the queen conch Strombus gigas. Bull. Mar. Sci., 14: 246-295. [ Links ]
36 Ray, M. y A. Stoner. 1994. Experimental analysis of growth and survivorship in a marine gastropod aggregation: balancing growth with safety in numbers. Mar. Ecol. Prog. Ser., 105: 47-59. [ Links ]
37 Smith, G. B. y M. Neirop. 1984. Distribution, abundance, and potential yield of shallow-water fishery resource of the Little and Great Bahamas Banks: UNDP/FAO Fisheries Division Project BHA/82/002. Food and Agriculture Organization of the United Nations-FAO, Roma. 78 p. [ Links ]
38 Stoner, A. 1989. Density-dependent growth and grazing effects of juvenile queen conch Strombus gigas L. in a tropical seagrass meadow. J. Exp. Mar. Biol. Ecol., 130: 119-133. [ Links ]
39 Stoner, A. 1997. The status of queen conch, Strombus gigas, research in the Caribbean. Mar. Fish. Rev., 59 (13): 14-22. [ Links ]
40 Stoner, A. 2003. What constitutes essential nursery habitat for a marine species? A case of study of habitat form and function for queen conch. Mar. Ecol. Prog. Ser., 257: 275-289. [ Links ]
41 Stoner, A. y R. Glazer. 1998. Variation in natural mortality: implications for queen conch stock enhancement. Bull. Mar. Sci., 62 (2): 427-442. [ Links ]
42 Stoner, A. y M. Ray-Culp. 1993. Aggregation dynamics in juvenile queen conch (Strombus gigas): population structure, mortality, growth and migration. Mar. Biol., 116: 571-582. [ Links ]
43 Stoner, A. y M. Ray-Culp. 1996. Queen conch, Strombus gigas, in fished and unfished locations of the Bahamas: effects of a marine fishery reserve on adults, juveniles, and larval production. Fish. Bull., 94: 551-565. [ Links ]
44 Stoner, A. y M. Ray-Culp. 2000. Evidence for 'Allee Effects' in an over-harvested marine gastropod: density-dependent mating and egg production. Mar. Ecol. Prog. Ser., 202: 297-302. [ Links ]
45 Stoner, A. y K. Schwarte. 1994. Queen conch, Strombus gigas, reproductive stocks in the central Bahamas: distribution and probable sources. Fish. Bull., 92: 171-179. [ Links ]
46 Stoner, A., M. Ray-Culp y M. Waite. 1995. Effects of a large gastropod on macrofaunal communities in tropical sea grass meadows. Mar. Ecol. Prog. Ser., 121: 125-137. [ Links ]
47 Tewfik, A. 1996. An assessment of the biological characteristics, abundance and potential yield of the queen conch (Strombus gigas) fishery on the Pedro Bank off Jamaica. Tesis M.Sc. Acadia University, Wolfville, Canadá. 139 p. [ Links ]
48 Tewfik, A. y R. S. Appeldoorn. 1998. Queen conch (Strombus gigas) abundance survey and potential yield estimates for Pedro Bank, Jamaica. Fisheries Division, Jamaica. 31 p. [ Links ]
49 Tewfik, A. y H. Guzmán. 2003. Shallow-water distribution and population characteristics of Strombus gigas and S. costatus in Bocas del Toro, Panamá. J. Shelf. Res., 22 (3): 789-794. [ Links ]
50 Tewfik, A., H. Guzmán y G. Jácome. 1998. Assessment of the queen conch Strombus gigas (Gastropoda) population in Cayos Cochinos, Honduras. Rev. Biol. Trop., 46: 137-150. [ Links ]
51 Torres, R. E y K. M. Sullivan-Sealey. 2002. Abundance, size frequency and spatial distribution of queen conch (S. gigas) in south-eastern Dominican Republic: a four-year population study in Parque Nacional del Este. Proceedings of the Gulf and Caribbean Fishery Institute, 53: 120-128. [ Links ]
52 Valderrama, M. y S. Hernández. 1999. Determinación de la abundancia del recurso caracol de pala Strombus gigas en los bajos Serrana, Serranilla, Roncador y Quitasueño como base para la definición de cuotas de pesca en el archipiélago de San Andrés y Providencia, Caribe colombiano. INPA Subdirección de Investigaciones, Bogotá. 16 p. [ Links ]
53 Weil, E. y R. Laughlin. 1984. Ecología, cultivo y repoblación del botuto Strombus gigas L. en el Parque Nacional Archipiélago de los Roques. Fundación Científica Los Roques, Informe final, Caracas. 481 p. [ Links ]
54 Zar, J. 1996. Biostatistical analysis, Tercera Edicion. Prentice-Hall, Inc., New Jersey, 662 p. [ Links ]
FECHA DE RECEPCIÓN: 14/10/2005 FECHA DE ACEPTACIÓN: 21/04/2010
Contribución No. 1050 del Instituto de Investigaciones Marinas y Costeras-INVEMAR.