Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.39 no.2 Santa Marta July/Dec. 2010
ESTRUCTURA DE LAS PRADERAS DE THALASSIA TESTUDINUM EN UN GRADIENTE DE PROFUNDIDAD EN LA GUAJIRA, CARIBE COLOMBIANO*
STRUCTURE OF SEAGRASS BEDS (THALASSIA TESTUDINUM) ALONG A DEPTH GRADIENT IN LA GUAJIRA, COLOMBIAN CARIBBEAN.
Margarita R. Albis Salas1, Diana I. Gómez-López2, Guillermo Duque3
1 Universidad Nacional de Colombia, Departamento de Biología y Centro de Estudios en Ciencias del Mar (CECIMAR), INVEMAR, Cerro Punta Betín, Santa Marta, Colombia. mralbiss@unal.edu.co
2 Instituto de Investigaciones Marinas y Costeras-INVEMAR, Programa de Biodiversidad y Ecosistemas Marinos (BEM), Santa Marta, Colombia. digomez@invemar.org.co
3 Universidad Nacional de Colombia, Facultad de Ingeniería y Administración, Departamento de Ingeniería-Ingeniería Ambiental, Carrera 32 Chapinero, Palmira, Colombia. gduquen@palmira.unal.edu.co
RESUMEN
La distribución espacial de los pastos marinos depende de las condiciones ambientales presentes, destacándose la profundidad, temperatura, salinidad, sustrato y nutrientes. La plataforma continental de La Guajira presenta extensas praderas de pastos marinos dominadas por Thalassia testudinum, las cuales representan más del 80 % del total nacional. Con el fin de caracterizar su distribución en función de la profundidad, materia orgánica y tipo de sustrato, se midieron algunas variables estructurales de T. testudinum en 15 estaciones situadas en uno de los tres siguientes intervalos de profundidad: somero (0-2 m), medio (2-4 m) y profundo (>4 m). Mediante cuadrantes de 20 x 20 cm se determinó la densidad de vástagos, en subcuadrantes de 20 x 10 cm se tomaron muestras para biomasa foliar, peso de epífitos, pastoreo y área foliar; y mediante un corazonador se extrajo el material para la biomasa total. Altos valores en densidad de vástagos (437.5 m-2), biomasa foliar (84.8 g m-2), biomasa total (5.9 kg m-2) y área foliar (24.8 cm2) están asociados con profundidades menores a 3.5 m; mientras que a mayor profundidad las plantas son más dispersas (137.5 m2), con poca biomasa (7.5 g m-2) y hojas pequeñas (4.6 cm2). La biomasa de epífitos alcanzó más del doble del peso húmedo de las hojas, presentando valores altos en praderas profundas (52.5 %) donde el pastoreo fue menor (53.3 %). Adicionalmente, fueron encontradas praderas de alto desarrollo en zonas protegidas, alto contenido de materia orgánica y predominancia de sedimentos finos.
PALABRAS CLAVE: Thalassia testudinum, Estructura vegetativa, Factores ambientales, Caribe colombiano, La Guajira.
ABSTRACT
The spatial distribution of seagrass beds depends on environmental factors such as light, temperature, salinity, substrate type, and nutrient availability. There is an extensive area of seagrass beds dominated by Thalassia testudinum along the shallow continental shelf of La Guajira, representing more than 80 % of the seagrass beds in Colombia. In order to describe seagrass distribution and its relation to organic matter, substrate type and depth structural variables of T. testudinum were measured at l5 locations placed at one of the following depth ranges: shallow (0-2 m), intermediate (2-4 m), and deep (>4 m). Shoot density was measured with 20 x 20 cm quadrants while shoot samples were collected from 20 x 10 cm sub-quadrants in order to measure leaf biomass, epiphyte weight, grazing and leaf area. Total biomass and sediment core were measured from sediments core samples. High values of shoot density (437.5 m-2), leaf biomass (84.8 g m-2), total biomass (5.9 kg m-2) and leaf area (24.8 cm2), were related with depths less than 3.5 m while at higher depths plants presented lower shoot density (137.5 m2), biomass (7.5 g m-2) and leaf area (4.6 cm2). The epiphyte weight registered high values in deeper seagrass beds (52.5 %) where grazing had lesser impact (53.3 %). Additionally, better devolped seagrass beds were found in areas of organic matter content, fine sediments and protected areas.
KEY WORDS: Thalassia testudinum, Vegetative structure, Environmental factors, Colombian Caribbean, La Guajira.
INTRODUCCIÓN
Las praderas de fanerógamas marinas son consideradas ecosistemas de gran importancia debido a su alta producción primaria y refugio de vertebrados e invertebrados, que contribuyen al balance de carbono en las costas y a la biodiversidad marina (Duarte y Chiscano, 1999; Heck et al., 2003). Características del medio como corrientes, oleaje, disponibilidad de luz, temperatura, salinidad, sedimentos y nutrientes condicionan la composición y distribución espacial de las praderas (Eldridge y Morse, 2000; Fourqurean et al., 2003; Thorhaug et al., 2006; Lee et al., 2007). Las praderas de Thalassia testudinum requieren para un crecimiento óptimo de un 15 al 30 % de luz incidente, 20 a 30 °C de temperatura, 24 a 35 de salinidad, sedimentos con profundidades mayores a 10 cm y carbono, nitrógeno y fósforo como principales constituyentes del material vegetal (Phillips y Meñez, 1988; Touchette y Burkholder, 2000). Adicionalmente, el contenido de materia orgánica juega un papel fundamental para el buen desarrollo de los lechos de pastos, ya que es una reserva importante de energía en el sedimento (Miyajimal et al., 1998).
El área geográfica con mayor extensión de praderas en Colombia es la plataforma continental de La Guajira conteniendo 347 Km2, que representan más del 80 % de pastos marinos existentes en el Caribe colombiano (Díaz et al., 2003). Sin embargo, los estudios concernientes al conocimiento del estado y dinámica del ecosistema en la región son escasos. En bahía Portete se encontraron variaciones de biomasa del pasto marino entre estaciones y entre épocas de muestreo durante los meses de agosto y octubre-diciembre (Díaz y Garzón-Ferreira, 1992). Díaz- Pulido (1997) describe de manera general la distribución de los ecosistemas marinos del Caribe colombiano incluyendo los pastos marinos. Castillo-Torres (2002) y Montoya-Maya (2002) realizaron respectivamente un estudio integral sobre la estructura y fauna asociada y estado ambiental de los pastos marinos en todo el Caribe colombiano, abarcando parte de La Guajira en época de transición a lluvias (julio-agosto). Por último, Díaz et al. (2003) hicieron una recopilación de todos los trabajos realizados hasta el momento en las praderas en Colombia, brindando una amplia información acerca de la extensión, distribución y estado del ecosistema. Algunos atributos estructurales estáticos como densidad de vástagos, área foliar y biomasa han sido ampliamente utilizados como descriptores de las condiciones del medio y estado de las praderas de pastos marinos (Hackney y Durako, 2004): las dimensiones foliares, lo más sensible de la planta por su exposición continua e inmediata al medio (Peralta et al., 2002; Hackney y Durako, 2004); la biomasa considerada indicativa de la salud de las plantas porque representa la cantidad de carbono invertido en estructura (Sfriso y Ghetti, 1998; Burkholder et al., 2007); y la densidad de vástagos muestra la calidad de refugio de las praderas para la fauna asociada (Alcolado et al., 2001).
En el presente trabajo se determinó la estructura de las praderas de T. testudinum en época seca mayor, analizándose el efecto que tienen sobre las variables biológicas factores ambientales importantes para el desarrollo de las praderas como profundidad, sedimento y materia orgánica. Así mismo, se evaluaron las relaciones entre las estaciones para analizar la distribución general de los lechos de pastos marinos en la plataforma continental de La Guajira.
ÁREA DE ESTUDIO
La Guajira se caracteriza por un clima seco y cálido con promedios de lluvia menores a 500 mm y temperaturas medias anuales de 29 °C. Presenta un régimen de lluvias bimodal determinado por las variaciones de los vientos alisios del noreste y la Zona de Convergencia Intertropical (ZCIT) (Bula-Meyer, 1990). El fenómeno de surgencia de aguas subsuperficiales varía a lo largo del año con la fuerza del viento, siendo más fuerte de diciembre a marzo-julio durante la temporada seca y débil entre octubre y noviembre en época de lluvia (Andrade y Barton, 2005).
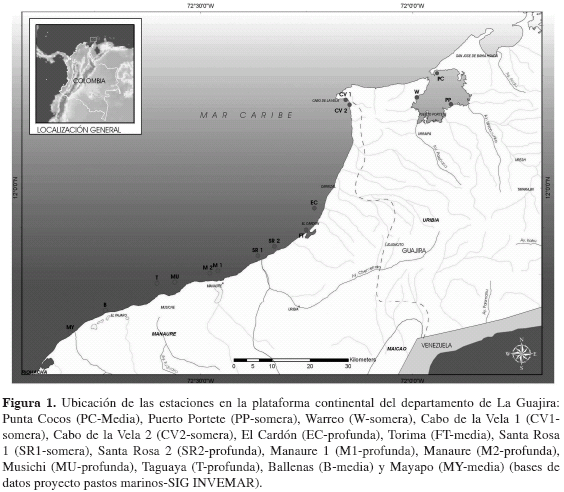
El estudio se desarrolló en marzo de 2006 sobre la zona somera de la plataforma continental de La Guajira en el área comprendida entre Bahía Portete (12°11'38''N - 71°54'56''W) y Mayapo (11°39'55'' N - 72°48'07'' W). Se abarcaron dos grandes áreas que corresponden a la división terrestre de La Guajira: alta Guajira entre El Cardón y Bahía Portete y la media Guajira desde Torima hasta Mayapo (Ramírez, 2005).
MATERIALES Y MÉTODOS
Trabajo de campo y laboratorio Se ubicaron 15 estaciones de muestreo tomando como criterio praderas monoespecíficas de T. testudinum con cobertura mayor al 40 % y con un área igual o superior a 600 m2, divididas para su posterior análisis en tres intervalos de profundidad: somera (0-2 m) (Warreo, Puerto Portete, Cabo de La Vela 1 y Cabo de La Vela 2), media (2-4 m) (Torima, Ballenas, Santa Rosa 1, Mayapo y Punta Cocos) y profunda (>4 m) (El Cardón, Taguaya, Santa Rosa 2, Manaure 1, Manaure 2 y Musichi) (Figura 1).
En cada estación de muestreo se midieron parámetros físico-químicos tales como la profundidad, salinidad, temperatura y transparencia del agua. Se establecieron 10 cuadrantes de 20 x 20 cm donde se contó el número de vástagos (Dennison, 1990) y en un subcuadrante de 20 x 10 cm se cortó a ras todo el material vegetal presente. En el laboratorio se determinó la biomasa foliar para cada cuadrante y el porcentaje de pastoreo, longitud, ancho y área foliar para cada hoja (Caricomp, 2001). El porcentaje de peso de epífitos se midió calculando la diferencia del peso inicial en húmedo después de haberle aplicado un baño con HCl al 10 % (Ángel y Polanía, 2001).
Con un corazonador (20 cm de diámetro) se extrajo todo el material vegetal y se tomó una muestra representativa de sedimento. Se midió manualmente la máxima longitud a la que se encontraron los rizomas y con base en Caricomp (2001) se determinó la biomasa de la planta. El material vegetal se separó en dos grupos, hojas-vástagos cortos (biomasa en pie) y rizomas vivos-raíces vivas (biomasa rizoidal). Teniendo en cuenta que las hojas son descalcificadas previamente se calcula la biomasa a partir del peso seco de cada grupo.
Para la clasificación del sedimento se tomaron 100 g de muestra seca, se pasaron por una batería de tamices con seis intervalos de diámetro (2000, 1000, 500, 250, 125 y 63 µm) y se pesó cada sección por separado para determinar su proporción (Wentworth, 1992). El contenido de materia orgánica se midió por medio de incineración de la materia orgánica del sedimento (Buchanan y Kain, 1997).
Tratamiento de datos
Los datos de las variables estructurales densidad de vástagos, biomasa foliar, biomasa en pie, biomasa rizoidal y biomasa total fueron extrapolados a metro cuadrado para facilitar la comparación con los resultados de otros trabajos. La biomasa de epífitos se convirtió a porcentaje al igual que el contenido de materia orgánica. La intensidad lumínica se determinó aplicando la fórmula sugerida en Carruthers et al. (2001).
Para observar el comportamiento de las praderas en su conjunto se calcularon medidas de tendencia central como máximos y mínimos, desviación estándar y coeficientes de variación. Con el fin de establecer si existían diferencias significativas entre los tres intervalos de profundidad establecidos, en principio se escogieron las variables que tienen réplica por estación tales como longitud, ancho y área foliar, densidad de vástagos, pastoreo, peso de epífitos y biomasa foliar. Para comprobar la homogeneidad de varianza y distribución normal de los datos se realizó un gráfico de residuales y el test de Shapiro-Wilk respectivamente. Para alcanzar una distribución normal los datos fueron transformados mediante logaritmo natural y raíz cuadrada. Luego se hizo un análisis de varianza paramétrica a una vía tomando como factor principal la profundidad. Finalmente, mediante el test de comparaciones múltiples a posteriori de Tukey-Kramer se determinaron las semejanzas y diferencias entre los tres intervalos de profundidad (Zar, 1999).
Para relacionar los atributos estructurales (longitud, ancho y área foliar, densidad de vástagos, pastoreo, peso de epífitos, biomasa foliar, biomasa rizoidal y biomasa en pie) y las variables ambientales (materia orgánica, tamaño de grano del sedimento y profundidad), se realizó en primera instancia una reducción de las variables estructurales a través del análisis de componentes principales (Dibgy y Kempton, 1987). Del análisis se obtuvieron los valores propios o la varianza explicada por cada componente, el peso de cada variable dentro del componente y las coordenadas de cada estación en cada componente. Las coordenadas de las estaciones en los primeros tres componentes principales fueron correlacionadas con los valores de las variables ambientales mediante el índice de correlación no paramétrica de Pearson (Siegel y Castellan, 1988).
Mediante el análisis de conglomerados eligiendo el método de agrupamiento de ligamiento promedio no ponderado y la distancia euclidiana como medida de distancia entre los grupos formados (Zar, 1999), se observaron las relaciones entre las estaciones y las asociaciones existentes. Para ello se usó la matriz de variables estructurales ancho y longitud foliar, porcentaje de epífitos, biomasa foliar, biomasa en pie y biomasa rizoidal, estandarizadas previamente debido a su diferente escala de medida.
RESULTADOS
Características del medio
Durante la época de muestreo la salinidad y temperatura superficial oscilaron entre 38-43 y 25.5-27.5 °C, respectivamente. La intensidad lumínica presentó para casi todas las estaciones valores entre 23.7 % en Cabo de La Vela 1 y 2 y 1.1 % en Torima con un promedio general de 13.6 %. La materia orgánica fluctuó entre 1.0 y 6.4 % del peso del sedimento, registrando los valores más altos en las estaciones de Bahía Portete (6.4 %). Cabo de la Vela (4.4 %) y Torima (3.6 %). Existe una proporción moderada de cada tipo de grano con una mayor porcentaje de las arenas medias (500-250 μm) y finas (250-125 μm), exceptuando cabo de La Vela 1 (76 % de arenas finas), Ballenas y Punta Cocos (45 % de arenas medias).
Análisis de clasificación
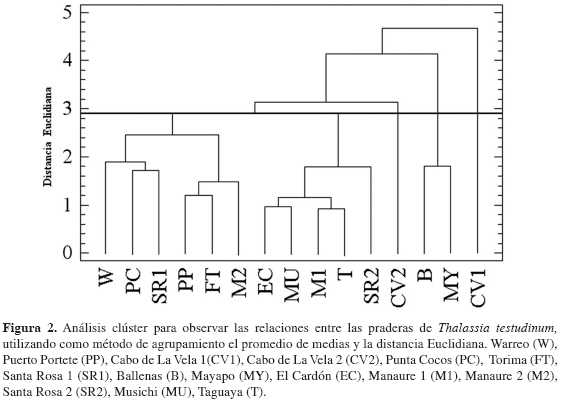
En el análisis de clasificación se discriminaron cinco grupos, distribución que obedece principalmente a la profundidad y las condiciones particulares de cada pradera (Figura 2). En Cabo de la Vela 1 (asociación 1) la pradera presentó un alto desarrollo de los atributos estructurales densidad de vástagos, número de hojas y biomasa rizoidal. Se encontró predominio de arenas finas (76 %), alto contenido de materia orgánica (4.4 %), salinidad 23.7 y una temperatura de 26 ºC.
Análisis de clasificación En el análisis de clasificación se discriminaron cinco grupos, distribución que obedece principalmente a la profundidad y las condiciones particulares de cada pradera (Figura 2). En Cabo de la Vela 1 (asociación 1) la pradera presentó un alto desarrollo de los atributos estructurales densidad de vástagos, número de hojas y biomasa rizoidal. Se encontró predominio de arenas finas (76 %), alto contenido de materia orgánica (4.4 %), salinidad 23.7 y una temperatura de 26 ºC. Figura 2. Análisis clúster para observar las relaciones entre las praderas de Thalassia testudinum, utilizando como método de agrupamiento el promedio de medias y la distancia Euclidiana. Warreo (W), Puerto Portete (PP), Cabo de La Vela 1 (CV1), Cabo de La Vela 2 (CV2), Punta Cocos (PC), Torima (FT), Santa Rosa 1 (SR1), Ballenas (B), Mayapo (MY), El Cardón (EC), Manaure 1 (M1), Manaure 2 (M2), Santa Rosa 2 (SR2), Musichi (MU), Taguaya (T). En Ballenas y Mayapo (asociación 2) se encontró el mayor número de renuevos observados con bajas densidades foliares, hojas cortas y angostas, poca biomasa y vástagos muy dispersos. Ambas se encuentran cercanas a la ciudad de Riohacha y se caracterizaron por el poco contenido de materia orgánica (1.6-1.9 %), baja incidencia de luz (5.2-5.6 %), salinidad de 39-40, temperatura de 27.2-27.5 °C y sedimentos con predominio de granos medianos (30-40 %).
A pesar de estar muy cercanas las estaciones realizadas en el Cabo de la Vela y presentar características muy similares en cuanto al porcentaje de materia orgánica, salinidad, temperatura e incidencia lumínica, en Cabo de La Vela 2 (asociación 3) se encontró un menor desarrollo de la biomasa rizoidal y densidad de vástagos, un ascenso del tamaño de las hojas y sedimentos con predominio de arenas de grano grueso (20 %). La asociación 4 está compuesta por todas las estaciones profundas menos Manaure 2, clasificada en el grupo 5 principalmente por presentar valores menores de biomasa de epífitos. Estas praderas se caracterizaron por el poco contenido de materia orgánica (1.0-2.1 %) y predominio de granos medios (26-36 %). La salinidad osciló entre 38-40, la temperatura 25.5-26.2 ºC y la incidencia de luz entre 7.3-23.7 %.
Finalmente, la última asociación está compuesta por las praderas de bahía Portete, las estaciones más someras del intervalo de profundidad medio (Torima y Santa Rosa 1) y Manaure 2 (2.5-3.5 m). En general las praderas someras presentaron un mayor desarrollo estructural, además tuvieron los menores valores de biomasa de epífitos acompañados de una gran variedad de fauna asociada observada en campo. Se encontraron características diferenciales en el medio con valores bajos de materia orgánica en Torima y Santa Rosa (1.2-1.3 %) y altos en las praderas de bahía Portete (5.3-6.4 %). Los granos predominantes fueron las arenas finas en Santa Rosa 2 y Punta Cocos (36-45 %), arenas gruesas en Puerto Portete y Warreo (23-25 %) y arenas medias en Manaure 2 (39 %). La salinidad osciló entre 39-43, la temperatura 26.0-27.3ºC y la incidencia de luz entre 6.6-20.2 %.
Análisis de varianza
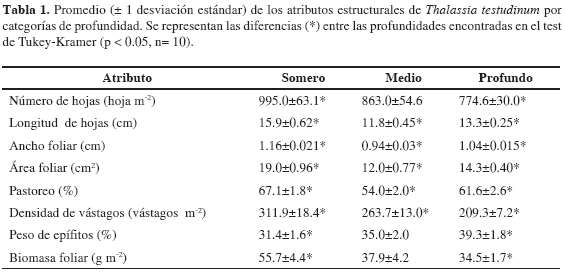
Los resultados obtenidos en el análisis de varianza (p<0.05), corroborado por el análisis de correlación y lo observado en campo demuestran que la profundidad es un factor importante sobre la estructura de los pastos marinos de La Guajira. El test de comparación de Tukey-Kramer mostró que existe un gradiente en el desarrollo de los atributos número de hojas y la biomasa foliar de menor a mayor profundidad, mientras que la biomasa de epífitos presenta una tendencia inversa (Tabla 1).
La densidad de vástagos, el área, la longitud y el ancho foliar fueron diferentes en las tres categorías. En el intervalo de profundidad medio (2-4 m) se exhibieron los menores valores en las dimensiones foliares y en las praderas profundas (>4 m) los menores valores de densidad de vástagos (Tabla 1).
Análisis de componentes principales
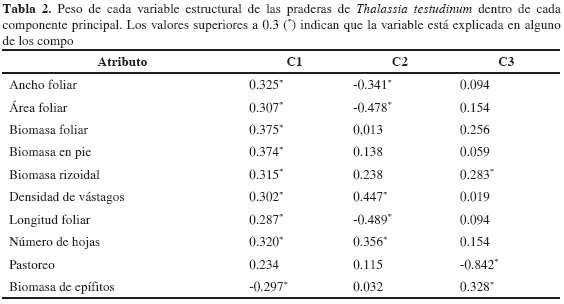
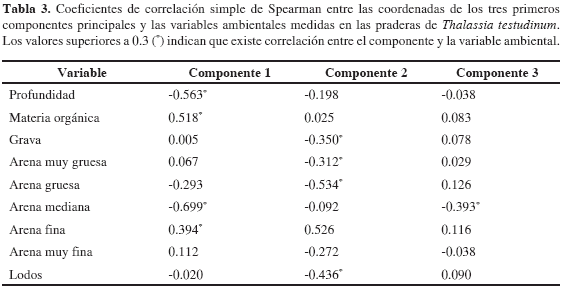
Con el fin de encontrar las relaciones entre los atributos estructurales de T. testudinum y la profundidad, materia orgánica y sedimento, mediante del análisis de componentes principales se escogieron los tres primeros componentes que explican en su orden 62.4, 17.4 y 7.3 % de la varianza de los atributos estructurales para un total de 87.1 %. Teniendo en cuenta los resultados de las correlaciones del primer componente, se encontraron relaciones positivas entre las variables estudiadas (excepto pastoreo) con el contenido de materia orgánica y las arenas finas. Con el segundo componente se corroboró un mejor desarrollo de la densidad de vástagos y número de hojas con el predominio de arenas finas, mientras que el tamaño de las hojas es mayor donde predominen las gravas, las arenas muy gruesas y gruesas. En el tercer componente es de resaltar la relación inversa entre la biomasa de epífitos y el porcentaje de pastoreo (Tabla 2 y 3).
DISCUSIÓN
Gracias al efecto de la surgencia y los vientos alisios las condiciones ambientales en La Guajira en esta época climática son muy particulares en cuanto a la baja temperatura (22.6-25.8 °C), alta salinidad (36.5-37.2) y alta disponibilidad de nutrientes (Cabrera y Donoso, 1993). En las praderas estudiadas se encontró un menor desarrollo en comparación al trabajo realizado por Castillo-Torres (2002) en La Guajira en transición a lluvias, respecto a los atributos estructurales biomasa en pie (104.7-272.0 gm-2), biomasa foliar (81.3-158.7 gm-2) y área foliar (29.4-42.6 gm-2). La salinidad es un componente ambiental determinante en la estructura y funcionamiento de los pastos marinos (Montague y Ley, 1993), altas concentraciones pueden afectar el balance interno de carbono y oxígeno de la planta. Sin embargo, la salinidad probablemente no sea un agente altamente nocivo en la estructura de la pradera de La Guajira ya que en época seca se encuentra dentro de las concentraciones ideales para su buen desarrollo (30-40) (Touchette, 2007). En otras partes del Caribe tropical, sin presencia del fenómeno de surgencia, se ha registrado mayor biomasa foliar, producción primaria y tasa de renovación en julio, época de transición a lluvia en Venezuela (Pérez et al., 2006) y lluvias en Costa Rica (Fonseca et al., 2007; Nielsen-Muñoz y Cortés, 2008). En Tobago, sin embargo la producción primaria registrada fue más alta en la época seca (Juman, 2005).
El aumento de nutrientes puede afectar las plantas indirectamente por la estimulación en el crecimiento de algas oportunistas y aumento de mesoherbívoros que pueden alcanzar más del doble del peso húmedo de las hojas (52.3 % en Ballenas). Los epífitos hacen más pesada la hoja convirtiéndose en un blanco fácil para herbívoros como Lytechinus variegatus, muy común en el área de estudio, los cuales pueden consumir gran parte de la producción foliar (Peterson et al., 2002).
Castillo-Torres (2002) menciona que las praderas desde Cabo de La Vela hasta Riohacha presentaron altos valores de materia orgánica (hasta de 16.4 %) junto con hojas de gran tamaño. Los bajos valores encontrados en este estudio en la media Guajira se deben quizás a la influencia escasa o nula de los cuerpos de agua continentales en la época seca. Particularmente en Ballenas y Mayapo, el bajo aporte de ríos como el Ranchería puede causar aumento en la transparencia de la columna de agua que permitiría más energía lumínica disponible para invertir en la formación de renuevos, los cuales fueron aproximadamente el 90 % de los vástagos observados.
El mayor desarrollo en el tamaño de las hojas y biomasa en praderas con una profundidad menor a 3.5 m obedece a la mayor disponibilidad de energía lumínica para la fijación de carbono (Ralph et al., 2007). Este desarrollo estructural permite a su vez retener la materia orgánica que se produce internamente formando una reserva de nutrientes en el sedimento que conlleva a mejores condiciones de las praderas (Miyajimal et al., 1998). En Bahía Portete la protección geográfica adicional y el aporte de materia orgánica de los corales, algas y manglares presentes generan las condiciones para el óptimo desarrollo de estas praderas. En Cabo de la Vela 1 también se facilita la retención del material por su ubicación en la zona más protegida del cabo. Posiblemente el aporte de arcillas y finos desde el continente facilite la formación de las terrazas observadas en el área y estimule el desarrollo de un sistema rizoidal robusto capaz de darle firmeza a las plantas en este sustrato inestable.
Las praderas de pastos marinos se desarrollan sobre diversos tipos de sustrato, incluyendo fondos pedregosos (Nielsen-Muñoz y Cortés, 2008). Algunos autores registran mayor biomasa (Nielsen-Muñoz y Cortés, 2008) y número de hojas en sedimentos finos, más raíces en sedimentos arenosos y mayor desarrollo de rizomas sobre arenas gruesas a medias con bajo contenido de materia orgánica (Erftemeijer y Koch, 2001). En el Caribe colombiano, Ángel y Polanía (2001) registraron una relación inversa entre la biomasa foliar y densidad con arenas finas y una relación positiva con los granos gruesos y cascajos, sin embargo, Díaz et al. (2003) anotaron mayor desarrollo de la biomasa foliar y rizoidal en sedimentos finos. En el presente estudio se encontró un mejor desarrollo de los atributos estudiados con los sedimentos finos y el contenido de materia orgánica, adicionalmente hojas de mayor tamaño fueron relacionadas en sustratos donde predominaron gravas, arenas muy gruesas y gruesas.
A pesar de que la disponibilidad de luz es menor en las praderas profundas, no se registró un respuesta de aumento en su superficie fotosintética para captar mayor energía lumínica (Burkholder et al., 2007), como sucede en praderas profundas estudiadas en isla Grande (islas del Rosario) por Palacios et al. (1992), encontrando para la biomasa y el área foliar valores de 22.0 gm-2 -8.3 cm2 (somero, 1 m), 38.0 gm-2 -15.1 cm2 (medio, 3.5 m), 109.0 gm-2 -24.4 cm2 (profundo, 7 m) respectivamente. Sin embargo, otros autores como Echeverri (1983), en la bahía de Neguange, y Castillo-Torres (2002) también encuentran una disminución de la biomasa foliar, ancho de las hojas y densidad con la profundidad. Diversos trabajos en otras partes del mundo han demostrado que los pastos marinos disminuyen la densidad y aumentan área foliar en gradientes de profundidad y en repuesta a la diminución de luz en la columna de agua (Lee y Dunton, 1997; Carlson et al., 2003), sin embargo, la alta variabilidad y la poca especificidad de estos atributos pueden conllevar a diversas respuestas dependiendo de las condiciones del hábitat.
Al igual que el trabajo de Castillo-Torres (2002) en el presente estudio se encontró una relación inversa entre los epífitos y el pastoreo. A mayor profundidad se registró un aumento de la biomasa de epífitos, pero la menor densidad de los vástagos, biomasa foliar, biomasa en pie y el pequeño tamaño de las hojas puede reducir la calidad de refugio de la pradera para los herbívoros y por tanto la herbivoría (Montfrans et al., 1984).
CONCLUSIONES
Las praderas someras registraron un desarrollo estructural mayor al presentado para las demás profundidades. La mayor densidad de vástagos de pasto marino se encontró en sustrato de sedimentos finos, mientras que las hojas con mayor tamaño fueron comunes en sustratos en los que las gravas y arenas gruesas predominaron. Se registró una relación inversa entre el grado de epifitismo y el pastoreo foliar relativo a la densidad foliar y a la profundidad, debido a la capacidad del follaje de T. testudinum que sirve como área de protección y hábitat de diversas especies de fauna. Aunque en la parte marina no hay una división biológica entre media y alta Guajira, se evidenció una diferenciación que puede estar marcada por la influencia del río Ranchería en la media Guajira, pudiendo afectar la dinámica estructural anual de los pastos marinos.
AGRADECIMIENTOS
Este estudio fue financiado por la Corporación Autónoma Regional de La Guajira (Corpoguajira), e INVEMAR a través del convenio de cooperación 001 de 2004 para el desarrollo del proyecto marco. Al doctor Sven Zea por su apoyo y aportes en el trabajo. Al equipo de trabajo Martha Ortiz y Felipe Ballesteros. Al personal del laboratorio de química del INVEMAR por su colaboración en el desarrollo de la fase cuantitativa y a Dagoberto Venera, Nadia Albis y Fabián Cortés por su apoyo en la fase analítica de este estudio.
BIBLIOGRAFÍA
1 Alcolado, P. M., G. Alleng, K. Bonair, D. Bone, K. Buchan, P. G. Bush, K. Meyer, J. R. García, J. Garzón- Ferreira, P. M. H. Gayle, D. T. Gerace, F. X. Geraldes, E. Jordán-Dahlgren, B. Kjferve, E. Klein, K. Koltes, R. S. Laydoo, D. M. Linton, J. C. Ogden, H. A. Oxenford, C. Parker, P. Penchaszadeh, L. P. P. J. Pors, J. Ramírez-Ramírez, F. Ruiz-Rentería, J. D. Ryan, S. R. Smith, J. Tschirky, R. Varela, S. Walker, E. Weil, W. J. Wiebe, J. D. Woodley y J. C. Zieman. 2001. The Caribbean coastal marine productivity program (Carcicomp). Bull. Mar. Sci., 69 (2): 819-829. [ Links ]
2 Andrade, C. A. y E. D. Barton. 2005. The Guajira upwelling system. Coast. Shelf. Res., 25 (9): 1003- 1022. [ Links ]
3 Ángel, I. y J. Polanía. 2001. Estructura y distribución de los pastos marinos en San Andrés Isla, Caribe colombiano. Bol. Ecotrópica, 35: 1-24. [ Links ]
4 Buchanan, J. y J. Kain. 1997. Measurement of the physical and chemical environment. 30-51. En: Holme, N. y A. McIntyre (Ed.). Methods for the study of marine benthos. Manual No. 16, Blackwell Scientific Publication, Oxford y Edinburgh. 334 p. [ Links ]
5 Bula-Meyer, G. 1990. Oceanografía. 100-114. En: Jimeno, M. J. (Ed.). Caribe colombiano. Fondo FEN Univ. Nacional de Colombia, Bogotá. 264 p. [ Links ]
6 Burkholder, J. M., D. A. Tomasko y B. W. Touchette. 2007. Seagrasses and eutrophication. J. Exp. Mar. Biol. Ecol., 350 (1-2): 46-72. [ Links ]
7 Cabrera, E. y M. C. Donoso. 1993. Estudio de las características oceanográficas del Caribe colombiano Región III, Zona 1, PDCTM. Bol. Cient. CIOH., 13: 19-32. [ Links ]
8 Caricomp. 2001. Methods manual levels 1 and 2: manual of methods for mapping and monitoring of physical and biological parameters in the coastal zone of the Caribbean. Caribbean Coastal Marine Productivity Data Management Center. Univ. West Indies, Kingston, Jamaica. 85 p. [ Links ]
9 Carlson, P. R. Jr, L. A. Yarbro, K. Madley, H. Arnold, M. Merello, L. Vanderbloemen, G. McRae y M. J. Durako. 2003. Effect of El Niño on demographic, morphological, and chemical parameters in turtle-grass (Thalassia testudinum): an unexpected test of indicators. Environ. Monit. Assess., 81 (1-3): 393-408. [ Links ]
10 Carruthers, T. J. B., B. J. Longstaff, W. C. Denninson, E. G. Abal y K. Aioi. 2001. Measurement of light penetration in relation to seagrass. 369-392. En: Short, F. T. y R. G. Coles (Eds.). Global seagrass research methods. Elsevier Science B.V., Ámsterdam. 482 p. [ Links ]
11 Castillo-Torres, P. 2002. Caracterización estructural y evaluación del estado ambiental de las praderas de pastos marinos del Caribe colombiano. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Santa Marta. 66 p. [ Links ]
12 Dennison, W. C. 1990. Shoot density. 61-63. En: Phillips, R. C. y P. C. McRoy (Eds.). Seagrass research methods. Monographs on oceanography methodology No. 9, UNESCO, París. 210 p. [ Links ]
13 Díaz, J. M. y J. Garzón-Ferreira. 1992. Descripción inicial de unidades de monitoreo de ecosistemas marinos en la bahía de Portete: Determinación del área de influencia de Puerto Bolívar afuera de la bahía de Portete. Informe final, Instituto de Investigaciones Marinas y Costeras-IMVEMAR, Santa Marta. 67 p. [ Links ]
14 Díaz, J. M., L. M Barrios y D. I. Gómez-López (Eds.). 2003. Praderas de pastos marinos en Colombia: Estructura y distribución de un ecosistema estratégico. Serie Publicaciones Especiales No. 10, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 160 p. [ Links ]
15 Díaz-Pulido, G. 1997. Informe nacional sobre el estado de la biodiversidad en Colombia: ecosistemas marinos y costeros. Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 142 p. [ Links ]
16 Dibgy, P. G. y R. A Kempton. 1987. Multivariate analysis of ecological comunities. Chapman and Hall, Londres. 206 p. [ Links ]
17 Duarte, C. M. y C. L. Chiscano. 1999. Seagrass biomass and production: a reassessment. Aquat. Bot., 65: 159-174. [ Links ]
18 Echeverri, B. 1983. Estudio de la fauna de invertebrados de una pradera de Thalassia testudinum Koning, biomasa e incidencia de algunos factores ambientales sobre el ecosistema en la bahía de Neguanje Parque Nacional Natural Tayrona. Tesis Biol. Univ. Antioquia, Medellín. 80 p. [ Links ]
19 Eldridge, P. M. y J. W. Morse. 2000. A diagenetic model for sediment-seagrass interactions. Mar. Chem., 70: 89-103. [ Links ]
20 Erftemeijer, P. y E. Koch. 2001. Sediment geology methods for seagrass habitat. 345-367. En: Short, F. T. y R. G. Coles (Eds.). Global seagrass research methods. Elsevier Science B.V., Ámsterdam. 482 p. [ Links ]
21 Fonseca, A. C, V. Nielsen y J. Cortés. 2007. Monitoreo de pastos marinos en Perezoso, Cahuita, Costa Rica (sitio Caricomp). Rev. Biol. Trop., 55 (1): 55-66. [ Links ]
22 Fourqurean, J. W. F., J. N. Boyer, M. J. Durako, L. N. Hefty y B. J. Peterson. 2003. Forecasting responses of seagrass distributions to changing water quality using monitoring data. Ecol. Appl., 13 (2): 474- 489. [ Links ]
23 Hackney, J. W. y M. J. Durako. 2004. Size-frequency patterns in morphometric characteristics of the seagrass Thalassia testudinum reflect environmental variability. Ecol. Indic., 4: 55-71. [ Links ]
24 Heck Jr, K. L., C. Hays y R. J. Orth. 2003. Critical evaluation of the nursery role hypothesis for seagrass meadows. Mar. Ecol. Prog. Ser., 253:123-136. [ Links ]
25 Juman, R. A. 2005. The structure and productivity of the Thalassia testudinum community in Bon Accord Lagoon, Tobago. Rev. Biol. Trop., 53 (1): 219-227. [ Links ]
26 Lee, K. S. y K. H. Dunton. 1997. Effects of in situ light reduction on the maintenance, growth and partitioning of carbon resources in Thalassia testudinum Banks ex König. J. Exp. Mar. Biol. Ecol., 210: 53-73. [ Links ]
27 Lee, K. S, S. R. Park y Y. K. Kim. 2007. Effects of irradiance, temperature, and nutrients on growth dynamics of seagrasses: A review. J. Exp. Mar. Biol. Ecol., 350 (1-2): 144-175. [ Links ]
28 Miyajimal, T., I. Koikel, H. Yamano y H. Lizumi. 1998. Accumulation and transport of seagrass-derived organic matter in reef flat sediment of Green Island, Great Barrier Reef. Mar. Ecol. Prog. Ser., 175: 251-259. [ Links ]
29 Montague, C. L. y J. A. Ley. 1993. A possible effect of salinity fluctuation on abundance of benthic vegetation and associated fauna in northeastern Florida Bay. Estuaries, 16: 703-717. [ Links ]
30 Montfrans, J. V., L. Wetzel y R. Orth. 1984. Epiphyte-grazer relationships in seagrass meadows: Consecuences for seagrass grow and production. Estuaries, 7 (4): 289-309. [ Links ]
31 Montoya-Maya, P. 2002. Evaluación de la macrofauna epibentónica asociada a las praderas de Thalassia testudinum (Banks ex Köning) en el Caribe colombiano. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Santa Marta. 82 p. [ Links ]
32 Nielsen-Muñoz, V. y J. Cortés. 2008. Abundancia, biomasa y floración de Thalassia testudinum (Hydrocharitaceae) en el Caribe de Costa Rica. Rev. Biol. Trop., 56 (4): 175-189. [ Links ]
33 Palacios, D., G. Díaz y P. Rodríguez. 1992. Producción primaria de Thalassia testudinum y relación de su biomasa con el peso de epífitos, Isla Grande (Parque Nacional Natural Corales del Rosario), Caribe colombiano. 607-618. En: CCO (Ed.). Memorias del VIII Seminario Nacional de Ciencias del Mar, Santa Marta. 1144 p. [ Links ]
34 Peralta, G., J. L. Pérez-Lloréns, I. Hernández y J. J. Vergara. 2002. Effects of light availability on growth, architecture and nutrient content of the seagrass Zostera noltii Hornem. J. Exp. Mar. Biol. Ecol., 269: 9-26. [ Links ]
35 Pérez, D., M. Guevara y D. Bone. 2006. Temporal variation of biomass and productivity of Thalassia testudinum (Hydrocharitaceae) in Venezuela, Southern Caribbean. Rev. Biol. Trop., 54 (2): 329-339. [ Links ]
36 Peterson, B. J., D. Craig, L. M. Rutten y J. W Fourqurean. 2002. Disturbance and recovery following catastrophic grazing: studies of a successional chronosequence in a seagrass bed. Oikos, 97: 361- 370. [ Links ]
37 Phillips, R. C. y E. G. Meñez. 1988. Seagrasses. Smithson. Contrib. Mar. Sci., 34: 1-104. [ Links ]
38 Ralph, P. J., M. J. Durako, S. Enríquez, C. J. Collier y M. A. Doblin. 2007. Impact of light limitation on seagrasses. J. Exp. Mar. Biol. Ecol., 350 (1-2): 176-193. [ Links ]
39 Ramírez, B. K. 2005. La perspectiva wayúu sobre los conocimientos y la biodiversidad. 39-42. En: Escobar, E. M., P. Escobar, A. Pazmiño y A. Ulloa (Eds.). Las mujeres indígenas en los escenarios de la biodiversidad. Fundación Natura Colombia, Bogotá. 202 p. [ Links ]
40 Sfriso, A. y P. F. Ghetti. 1998. Seasonal variation in biomass, morphometric parameters and production of seagrasses in the lagoon of Venice. Aquat. Bot., 61: 207-223. [ Links ]
41 Siegel, S. y N. J. Castellan Jr. 1988. Nonparametric statistics for the behavioral sciences, segunda edición McGraw-Hill Book Company, Nueva York. 399 p. [ Links ]
42 Thorhaug, A., A. D. Richardson y G. P. Berlyn. 2006. Spectral reflectance of Thalassia testudinum (Hydrocharitaceae) seagrass: low salinity effects. Am. J. Bot., 93:110-117. [ Links ]
43 Touchette, B. W. 2007. Seagrass-salinity interactions: Physiological mechanisms used by submersed marine angiosperms for a life at sea. J. Exp. Mar. Biol. Ecol., 350: 194-215. [ Links ]
44 Touchette, B. W. y J. M. Burkholder. 2000. Review of nitrogen and phosphorus metabolism in seagrasses. J. Exp. Mar. Biol. Ecol., 250: 133-167. [ Links ]
45 Wentworth, C. A. 1992. Scale of grade and class terms for clastic sediments. Geology, 30: 377-392 p. [ Links ]
46 Zar, J. 1999. Biostatistical analysis. Cuarta edición, Prentice-Hall, Nueva Jersey. 663 p. [ Links ]
FECHA DE RECEPCIÓN: 20/08/2008 FECHA DE ACEPTACIÓN: 05/10/2010
*Contribución No. 1062 del Instituto de Investigaciones Marinas y Costeras - INVEMAR y No 335 del Centro de Estudios en Ciencias del Mar, CECIMAR, de la Facultad de Ciencias, Universidad Nacional de Colombia sede Caribe.