Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.39 no.2 Santa Marta July/Dec. 2010
PRIMER HALLAZGO DE APIOMITHRAX VIOLACEUS (A. MILNE-EDWARDS) (BRACHYURA: EPIALTIDAE: PISINAE) PARA EL CARIBE
FIRST RECORD OF APIOMITHRAX VIOLACEUS (A. MILNE-EDWARDS) (BRACHYURA: EPIALTIDAE: PISINAE) FROM THE CARIBBEAN
Carlos Lira, Juan Bolaños, Gonzalo Hernández, Jesús Hernández y Régulo López
Universidad de Oriente, Núcleo Nueva Esparta, Grupo de Investigación en Carcinología, Isla de Margarita, Venezuela. Apartado Postal 658, Porlamar 6301. carlos.lira@ne.udo.edu.ve
RESUMEN
Hasta ahora, la subfamilia Pisinae Dana, 1851 estaba representada en las costas caribeñas de Venezuela por seis especies [Chorinus heros (Herbst, 1790); Libinia ferreirae Brito Capello, 1871; Herbstia depressa Stimpson, 1870; Sphenocarcinus corrosus A. Milne-Edwards, 1878; Pelia mutica (Gibbes, 1850) y Nibilia antilocapra (Stimpson, 1871)], que representan 38 % de los cangrejos de esta subfamilia señalados para el mar Caribe. Durante una revisión de material pendiente de identificar perteneciente a la colección de crustáceos del Laboratorio de Carcinología de la Universidad de Oriente, Isla de Margarita, Venezuela, fueron hallados nueve especímenes (seis machos y tres hembras) de Apiomithrax violaceus (A. Milne-Edwards, 1868). La distribución hasta ahora conocida de este Pisinae estaba circunscrita a Mauritania hasta Angola en el Atlántico oriental, Isla Ascensión en el Atlántico central, Brasil y el Delta del Orinoco en el Atlántico occidental. Todos los ejemplares fueron colectados en aguas marinas venezolanas en las siguientes localidades: Isla de Margarita: Playa Valdés, península de Macanao; Estado Sucre (área continental): Guayacán. Este es el registro más septentrional de la especie y la primera vez en ser señalada para el mar Caribe, incrementando a 17 el número de especies de Pisinae conocidas para esta área.
PALABRAS CLAVE: Majoidea, Biodiversidad, Venezuela.
ABSTRACT
Up to now, the sub-family Pisinae Dana, 1851 was represented in the Caribbean coasts of Venezuela by six species [Chorinus heros (Herbst, 1790); Libinia ferreirae Brito Capello, 1871; Herbstia depressa Stimpson, 1870; Sphenocarcinus corrosus A. Milne-Edwards, 1878; Pelia mutica (Gibbes, 1850) and Nibilia antilocapra (Stimpson, 1871)], which make up 38 % of the Pisinae crabs reported for the Caribbean Sea. During an examination of unidentified material from the crustacean collection of the Laboratory of Carcinology at Universidad de Oriente, Margarita Island, Venezuela, nine specimens (six males and three females) of Apiomithrax violaceus (A. Milne-Edwards, 1868) were discovered. Until now the distribution of this Pisinae species was known to range from Mauritania to Angola in the eastern Atlantic, Ascension Island in the central Atlantic, as well as Brazil and Orinoco Delta in the western Atlantic. All specimens were collected in Venezuelan waters, at the following locations: Margarita island: Playa Valdés, Península de Macanao, Boca Chica, El Maguey; Sucre State (mainland): Guayacán. This is the most northerly record of the species and it is the first time to be reported for the Caribbean Sea, increasing the number of known species of Pisinae to 17 in this area.
KEY WORDS: Majoidea, Biodiversity, Venezuela.
INTRODUCCIÓN
La clasificación de la superfamilia Majoidea Samouelle, 1819 ha sufrido numerosos arreglos en las últimas décadas (ver Bowman y Abele, 1982; Hendrickx, 1995; Martin y Davis, 2001). En la actualidad se reconocen cinco familias: Majidae, Inachidae, Inachoididae, Oregoniidae y Epialtidae, esta última dividida en cuatro subfamilias: Epialtinae, Tychiinae, Pliosomatinae y Pisinae (Ng et al., 2008). La subfamilia Pisinae está representada en el mar Caribe por 16 especies agrupadas en ocho géneros: Chorinus, Herbstia, Libinia, Nibilia, Notolopas, Pelia, Rochinia y Sphenocarcinus. Según Marcano y Bolaños (2001), el primer registro de cangrejos Pisinae provenientes de aguas venezolanas, fue realizado por Rathbun (1925), quien señaló la presencia de Notolopas brasiliensis. Posteriormente se han realizado señalamientos de seis nuevas especies para aguas caribeñas venezolanas: Chorinus heros (Herbst, 1790); Libinia ferreirae Brito Capello, 1871; Herbstia depressa Stimpson, 1870; Sphenocarcinus corrosus A. Milne-Edwards, 1878; Pelia mutica (Gibbes, 1850) y Nibilia antilocapra (Stimpson, 1871) (ver Rodríguez, 1980; Melo, 1996; Sánchez, 1997; Marcano y Bolaños, 2001; Hernández-Ávila et al., 2007; 2008). Éstas representan 44 % de las especies de Pisinae mencionadas por Boschi (2000) para la Provincia caribeña. Adicionalmente, en 2008, Apiomithrax violaceus (A. Milne-Edwards, 1868) fue hallada en la costa atlántica venezolana (Mora-Day et al., 2008).
El Grupo de Investigación en Carcinología de la Universidad de Oriente (GICUDONE) realiza colectas permanentes en el área marina costera del oriente venezolano para mantener un inventario de la biodiversidad carcinológica en la zona y mantiene una colección de referencia de las especies colectadas. El presente trabajo es resultado de esa actividad y registra por primera vez para el mar Caribe la presencia de Apiomithrax violaceus, con base en material proveniente de dicha colección de referencia.
MATERIALES Y MÉTODOS
Los nueve ejemplares analizados pertenecen a la colección de referencia del Laboratorio de Carcinología de la Universidad de Oriente, isla de Margarita, Venezuela. Los organismos fueron sexados y medidos utilizando un vernier de 0.1 mm de apreciación. Se realizaron registros fotográficos de las muestras.
RESULTADOS
Apiomithrax violaceus (A. Milne-Edwards, 1868)
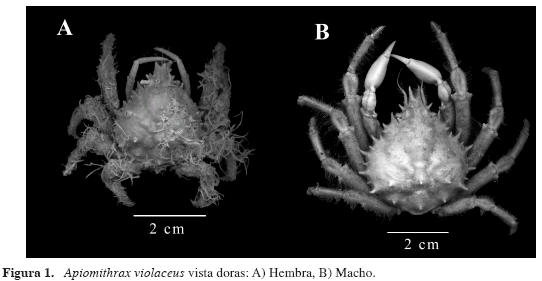
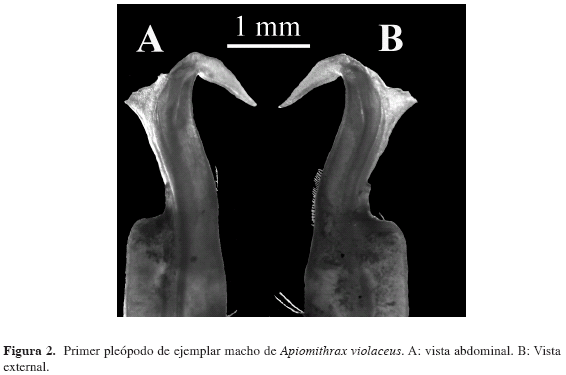
Fig. 1A, B; 2A, B.
Micropisa violacea A.Milne-Edwards, 1868: 50, lám.16, figs. 3-6. Rathbun, 1925: 303, lám. 101, lám. 241 figs. 5-8.
Phycodes antennarius A. Milne-Edwards 1869: 374.
Herbstia violacea. Miers, 1881: 206
Apiomithrax violaceus. Melo, 1996: 253. Bezerra et al., 2005, 920, fig. 1
Diagnosis: Caparazón ligeramente más largo que ancho, recubierto por unas setas cortas que le dan apariencia afelpada. Rostro bifurcado en su línea media en dos cuernos cortos, divergentes, incurvados hacia el interior en sus ápices. Órbitas grandes, cresta supraocular poco avanzada, armada en su ángulo posterior por una espina gruesa que apunta hacia fuera y ligeramente hacia atrás, separada de la espina postorbital por una fisura estrecha. Segmento basal de la antena armado con dos espinas en el margen anterior. Región hepática con cuatro espinas, la mayor submarginal ventral. Margen anterolateral del caparazón con tres espinas pequeñas y tres grandes dispuestas en forma alterna, margen posterolateral con una espina pequeña aledaña a la última espina anterolateral. Superficie dorsal con las áreas bien definidas. Región protogástrica con cuatro espinas dispuestas más o menos en línea con las espinas del área hepática, regiones mesogástrica, cardíaca e intestinal cada una con una espina, la mesogástrica con seis, de las cuales las dos más anteriores son submarginales, de mayor tamaño e incurvadas en el ápice. Región metabranquial con dos espinas en línea con la espina intestinal. Tercer par de maxilípedos con isquio dentado en el borde interno. Quelípedos del macho ligeramente más largos que el caparazón, con palma inflada, dedos delgados con un fuerte hiato entre ellos; los de las hembras más delgados y cortos, sin la palma inflada. Patas caminadoras disminuyendo paulatinamente de tamaño de la primera a la última, la primera ligeramente mayor que el quelípedo.
Primer par de pleópodos del macho largo, alcanza el margen distal del último somito abdominal, se hace más angosto bruscamente hacia el cuarto distal, con proyecciones apicales que le dan forma de "T", con la proyeccion externa más larga que la interna y ligeramente flexionada hacia abajo distalmente. Segundo par de pleópodos muy cortos, con el ápice en forma de copa.
Material examinado: Isla de Margarita: Playa Valdés, dos machos, III/1995, sustrato rocoso; dos machos, VIII/2006. Península de Macanao: una hembra, sin datos de colecta; Boca Chica, una hembra, X/2005, colectores D. Fernández y A. Rosales, sustrato rocoso, 1.5 m; El Maguey, un macho, una hembra, VIII/2009, colectores R. López y J. Bolaños, en red de pesca. Estado Sucre (área continental): Guayacán, un macho, VII/2004, colectores J. Hernández e I. Magán, sustrato rocoso, 1 m.
Medidas: machos: 20.6-41.0 mm ancho de caparazón (AC) y 22.3-42.2 mm largo de caparazón (LC); hembras: 24.9-32.6 mm AC y 28.7-34.2 mm LC.
Distribución: Atlántico oriental: Mauritania hasta Angola (Manning y Holthuis, 1981). Atlántico central: Isla Ascensión (Manning y Chace, 1990). Atlántico occidental: Brasil (Rathbun, 1925; Melo, 1996; Santos y Coelho, 1997), Delta del Orinoco, Venezuela (Mora-Day et al., 2008). mar Caribe: Isla Margarita, Sucre (presente estudio).
DISCUSIÓN
La subfamilia Pisinae Dana, 1851 ha sido considerada hasta años recientes como una familia por algunos investigadores del continente americano (Hendrickx, 1995; Martin y Davis, 2001), sin embargo, al analizar especies de éste y otros grupos (e.g. Epialtinae MacLeay, 1838; Tychinae Dana 1851 y Pliosomatinae Števčić, 1994) provenientes del Atlántico y del Pacífico Indo occidental, tal clasificación pareciera basarse en caracteres confusos y subjetivos (Griffin y Tranter, 1986; Ng et al., 2008), por lo cual Ng et al. (2008) la mencionan como una subfamilia de la familia Epialtidae MacLeay, 1838, aún cuando reconocen que es el grupo más heterogéneo dentro de la Superfamilia Majoidea Samouelle, 1819.
De acuerdo con la información documentada, los registros de Pisinae para las costas caribeñas de Venezuela, han sido los siguientes: Melo (1996) señaló que la distribución de Herbstia depressa comprende las Antillas, Venezuela y Brasil, pero no indicó cual fue el material estudiado; Chorinus heros ha sido colectada en islas Margarita y Cubagua, Libinia ferreirae en Zulia, Vargas y Miranda (Rodríguez, 1980; Marcano y Bolaños, 2001); Sphenocarcinus corrosus en Sucre (Sánchez, 1997; Marcano y Bolaños, 2001), Pelia mutica en Isla Cubagua (Hernández-Ávila et al., 2007) y Nibilia antilocapra en Isla Margarita (Hernández-Ávila et al., 2008). Según Marcano y Bolaños (2001), el primer registro de un Pisinae para el país fue Notoplax brasiliensis, realizado por Rathbun (1925), sin embargo el material estudiado por esta investigadora provenía de Colombia y Brasil, y no de Venezuela.
Apiomithrax violaceus es una especie de distribución amplia en el Atlántico, circunscrita hasta ahora a Mauritania hasta Angola en el Atlántico oriental (Manning y Holthuis, 1981), Isla Ascensión en el Atlántico central (Manning y Chace, 1990) y Brasil (Rathbun, 1925; Melo, 1996; Santos y Coelho, 1997) y Venezuela en el Atlántico occidental. En Brasil esta especie es poco frecuente hacia la región noreste de ese país, con sólo tres registros, el más equinoccial de los cuales pertenece al estado de Ceará (03º41'S-39º04'W) (Bezerra et al., 2005). En Venezuela fue hallada por primera vez en la costa atlántica, más específicamente en Punta Pescadores- caño Mariusa, en el delta del Orinoco (Mora-Day et al., 2008), y constituía el único registro hasta la fecha. Otras especies de la subfamilia, presentes en el mar Caribe y aún no halladas en Venezuela son: Libinia bellicosa Oliveira, 1944, L. dubia H. Milne Edwards, 1834, L. emarginata Leach, 1815, L. erinacea (A. Milne-Edwards, 1879), L. rhomboidea Streets, 1870, Rochinia crassa (A. Milne-Edwards, 1879), R. hystrix (Stimpson, 1871), R. tanneri (Smith, 1883) y R. umbonata (Stimpson, 1871).
Las especies del género Libinia habitan generalmente aguas más someras que las del género Rochinia. Libinia bellicosa puede ser encontrada en aguas someras, entre 10 y 30 m de profundidad, y su distribución comprende la costa caribeña de Panamá, Guayanas y Brasil (Melo, 1996). L. dubia está presente prácticamente en cualquier tipo de fondo en estuarios y mares abiertos, desde aguas rasas hasta 46 m y está distribuida desde Massachusetts hasta Texas (EE. UU.), Bahamas y Cuba (Williams, 1984; Abele y Kim, 1986). Libinia emarginata habita en cualquier tipo de sustrato, en aguas someras, pudiendo llegar hasta 124 m de profundidad, su distribución comprende desde Nueva Escocia (EE. UU.) hasta el golfo de México (Williams, 1984), mientras que L. erinacea está distribuida desde los cayos de Florida (EE. UU.) hasta la costa norte de Cuba (Abele y Kim, 1986) y L. rhomboidea es encontrada en Cuba y Yucatán, México (Rathbun, 1925).
Por su parte, Rochinia crassa habita sustratos arenosos y lodosos, desde 66 hasta 1216 m, y su distribución comprende desde Massachusetts hasta Texas (EE. UU.), el norte de Cuba, el oeste de Cabo La Vela (Colombia) y Guayana Francesa (Williams, 1984), R. hystrix habita desde 27 hasta 118 m y está distribuida desde el estrecho de Florida (EE. UU.) hasta St. Vincent, Barbados y Cuba (Abele y Kim, 1986), R. tanneri habita fondos arenosos y de conchilla, desde 128 hasta 708 m, desde Massachusetts hasta el estrecho de Florida (EE. UU.) (Abele y Kim, 1986) y R. umbonata presenta una distribución batimétrica que comprende desde 161 hasta 900 m, desde Carolina del Norte y el golfo de México, hasta Nicaragua, Antillas, Bahamas y St. Vincent (Williams, 1984). Este constituye el primer registro de Apiomithrax violaceus en el mar Caribe, lo cual eleva a 17 el número de especies de la subfamilia conocidas para esta área. A continuación se presenta una clave para la determinación de tales especies, modificada de las claves suministradas en Rathbun (1925), Abele y Kim (1986) y Melo (1996).
Clave para la determinación de las especies de Pisinae presentes en el Caribe
- Espina postocular reducida o ausente..................... Sphenocarcinus corrosus
Espina postocular representada por un proceso en forma de copa en la cual los ojos se retraen...................... 2 - Proceso supraocular no en contacto con la espina postocular......................3
Proceso supraocular en contacto con la espina postocular......................(Libinia)...................... 12 - (2) Sin diente en el margen orbital entre el proceso supraocular y la espina postocular...................... 4
Un diente en el margen orbital entre el proceso supraocular y la espina postocular...................... 8 - (3) Proceso supraocular proyectado anteriormente en una espina...................... (Rochinia)...................... 5
Proceso supraocular no proyectado anteriormente en una espina...................... Pelia mutica - (4) Superficie dorsal del caparazón con seis espinas sobre la línea media y seis espinas gástricas...................... Rochinia crassa
Superficie dorsal del caparazón con menos de seis espinas o tubérculos sobre la línea media y menos de seis espinas gástricas...................... 6 - (5) Espinas del caparazón y rostro largas y delgadas, una espina en el ángulo de la cavidad bucal...................... R. hystrix
Espinas del caparazón y rostro cortas o de longitud moderada, sin espina en el ángulo de la cavidad bucal...................... 7 - (6) Tubérculos dorsales largos y de ápices truncados...................... R. umbonata
Tubérculos o espinas dorsales agudos, no largos ni de ápices truncados...................... R. tanneri - (3) Rostro corto. Caparazón suborbicular o claramente ovalado...................... 9
Rostro largo. Caparazón estrecho, más largo que ancho...................... 10 - (8) Patas ambulatorias con largos própodos y dáctilos cortos. Isquio del tercer maxilípedo mucho más largo que el mero...................... Herbstia depressa
Patas ambulatorias con dáctilos casi tan largos como los própodos. Isquio del tercer maxilípedo ligeramente más largo que el mero...................... Apiomithrax violaceus - (8) Primer par de patas ambulatorias mucho más largo que los tres pares restantes...................... 11
Primer par de patas ambulatorias no mucho más largo que los tres pares restantes...................... Nibilia antilocapra - (10) Órbitas muy abiertas. Diente postorbital pequeño. Antenas escondidas por el rostro...................... Chorinus heros
Órbitas no muy abiertas. Diente postorbital de buen tamaño. Antenas visibles a los lados del rostro...................... Notolopax brasiliensis - (2) Mero de los quelípedos inermes o armados sólo por una espina o tubérculo...................... 13
Mero de los quelípedos armados con una hilera longitudinal de tubérculos y espinas...................... L. bellicosa - (12) Seis espinas sobre la línea media dorsal del caparazón...................... 14
Más de seis espinas sobre la línea media dorsal del caparazón...................... Libinia emarginata - (13) Sin espinas en el área media de la región hepática...................... 15
Una espina en el área media de la región hepática...................... 16 - (14) Horquilla del rostro somera en los adultos, ápices de los cuernos rostrales romos, espinas de los márgenes laterales de buen tamaño y subiguales en juveniles...................... L. dubia
Horquilla del rostro en juveniles más profunda que en L. dubia, cuernos rostrales agudos, convergentes en las puntas, espinas de los márgenes laterales pequeñas en juveniles, excepto la posterior que es muy larga y delgada...................... L. erinacea - (14) Cuatro espinas en la región branquial al lado del arco marginal, órbitas profundas, proyectándose fuera de la línea del caparazón...................... L. rhomboidea
Cinco espinas en la región branquial al lado del arco marginal, órbitas someras, no proyectándose fuera de la línea del caparazón...................... L. ferreirae
AGRADECIMIENTOS
Los ejemplares de la localidad de Boca Chica fueron colectados por Ducverly Fernández y Alberto Rosales, estudiantes de Biología Marina de la Universidad de Oriente, Núcleo Nueva Esparta y donados a la colección de referencia GICUDONE. Los autores agradecen también las acertadas y valiosas sugerencias y correcciones realizadas por los doctores Néstor Hernando Campos y Rafael Lemaitre y un tercer arbitro anónimo, así como la revisión y corrección de la versión en inglés del resumen realizada por el Dr. Juan Ignacio Gaviria.
BIBLIOGRAFÍA
1 Abele, L. y W. Kim. 1986. An illustrated guide to the marine decapod crustaceans of Florida. Tallahassee, State Fla Dep. Environ. Regul., 8 (1): 1-760. [ Links ]
2 Bezerra, L., A. Almeida y P. Coelho. 2005. Primero registro de Apiomithrax violaceus (A. Milne-Edwards) e Hipoconcha arcuata Stimpson (Crustacea: Decapoda: Brachyura) para o litoral do Caerá, Brasil. Rev. Bras. Zool., 22 (4): 919-922. [ Links ]
3 Boschi, E. 2000. Species of decapod crustaceans and their distribution in the American zoogeographic provinces. Rev. Invest. Des. Pesq., 13: 1-136. [ Links ]
4 Bowman, T. y L. Abele. 1982. Classifications of recent Crustacea. 1-27. En: Abele, L. G. (Ed.). Systematics the fossil record and biogeography. The Biology of Crustacea, Vol. 1, Academic Press, Nueva York. 319 p. [ Links ]
5 Griffin, D. J. y H. A. Tranter. 1986. The Decapoda Brachyura of the Siboga expedition. Part VIII. Majidae. Siboga-Expeditie, 39: 1-335. [ Links ]
6 Hendrickx, M. E. 1995. Checklist of brachyuran crabs (Decapoda: Brachyura) from eastern Tropical Pacific. Bull. L'Inst. Royal Sci. Nat. Belgique, 65: 125-150. [ Links ]
7 Hernández-Ávila, I., A. Gómez, C. Lira y L. Galindo. 2007. Benthic decapod crustaceans (Crustacea: Decapoda) of Cubagua Island, Venezuela. Zootaxa, 1557: 33-45. [ Links ]
8 Hernández-Ávila, I., C. Lira y J. Bolaños. 2008. First record of Nibilia antilocapra (Stimpson, 1871) (Crustacea: Decapoda: Pisinae) from Venezuelan waters. Rev. Biol. Mar. Oceanogr., 43 (3): 687-689. [ Links ]
9 Manning, R. B. y F. A. Chace, Jr. 1990. Decapod and stomatopod crustacean from Ascencion Island, South Atlantic Ocean. Smith. Contrib. Zool., 503: 1-91. [ Links ]
10 Manning, R. B. y L. B. Holthuis. 1981. West African brachyuran crabs (Crustacea: Decapoda). Smith. Contrib. Zool., 306: 1-379. [ Links ]
11 Marcano, J. y J. Bolaños. 2001. Cangrejos májidos (Decapoda: Brachyura: Majidae) de las aguas someras marinas venezolanas. Bol. Inst. Oceanog. Venezuela Univ. Oriente, 40 (1 y 2): 71-82. [ Links ]
12 Martin, J. W. y G. E. Davis. 2001. An update classification of the recent Crustacea. Nat. Hist. Mus. Los Angeles Coun, 39: 1-124. [ Links ]
13 Melo, G. A. S. 1996. Manual de identificação dos Brachyura (Caranguejos e Siris) do litoral brasileiro. Editora Plêiade, Sao Paulo. 603 p. [ Links ]
14 Miers, E. J. 1881. On a collection of Crustacea made by Baron Hermann Maltzam at Goree Island, Senegambia. Ann. Mag. Nat. Hist. London, 5 (8): 204-220. [ Links ]
15 Milne-Edwards, A. 1868. Observations sur le faune carcinologique des iles du Cap Vert. Nouv. Arch. Mus. d'Hist. Nat. Paris, 4 (7): 49-68. [ Links ]
16 Milne-Edwards, A. 1869. Description des quelques espèces nouvelles des Crustacés provenant du voyage de M.A. Bouvier aux iles du Cap Vert. Rev. Mag. Zool. Paris, 21: 374-378. [ Links ]
17 Mora-Day, J., L. Mesa y J. Capelo. 2008. Crustáceos decápodos. 53-72. En: Lasso, C. y J. Señaris (Eds.). Biodiversidad animal del caño Macareo, Punta Pescador y áreas adyacentes, delta del Orinoco. StatoilHydro Venezuela AS-Fundación La Salle de Ciencias Naturales, Caracas. 196 p. [ Links ]
18 Ng, P. K., D. Guinot y P. J. Davie. 2008. Systema Brachyurorum: Part I. An annoted checklist of extant brachyuran crabs of the world. Raff. Bull. Zool., 17: 1-286. [ Links ]
19 Rathbun, M. 1925. The spider crabs of America. Bull. U. S. Nat. Mus., 129: 1-613. [ Links ]
20 Rodríguez, G. 1980. Crustáceos decápodos de Venezuela. Instituto Venezolano de Investigaciones Científicas, Caracas. 444 p. [ Links ]
21 Sánchez, L. A. 1997. Crustáceos presentes en la pesca industrial de arrastre al norte de Estado Sucre y alrededores de la isla de Margarita, Venezuela. Tesis Maestría Cien. Mar., Instituto Oceanográfico de Venezuela, Univ. Oriente, Cumaná, Venezuela. 154 p. [ Links ]
22 Santos, M. A. C. y P. A. Coelho. 1997. Majidae (Crustacea: Decapoda: Brachyura) do litoral de Jaboatão dos Guararapes, Pernamuco, Brasil. Trab. Oceanogr. Univ. Fed. Pernambuco, Recife, 25: 205-213. [ Links ]
23 Williams, A.B. 1984. Shrimps, lobsters and crabs of the Atlantic coast of the eastern United States, Maine to Florida. Smithsonian Institution Press, Washington. 550 p. [ Links ]
FECHA DE RECEPCIÓN: 11/03/2010 FECHA DE ACEPTACIÓN: 11/10/2010