Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.40 no.1 Santa Marta Jan./June 2011
DETERMINACIÓN DEL CONTENIDO DE METALES PESADOS EN LAS FRACCIONES GEOQUÍMICAS DEL SEDIMENTO SUPERFICIAL ASOCIADO A LOS MANGLARES DE LA CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIA*
HEAVY METALS DETERMINATION IN GEOCHEMICAL FRACTIONS OF SURFACE SEDIMENT ASSOCIATED WITH MANGROVES IN CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIA
Luisa Fernanda Espinosa1, Juan Pablo Parra1,2 y Carlos Villamil1,3
1 Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta, Colombia. lespinosa@invemar.org.co
2 Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Química, Bogotá, Colombia.
3 Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Biología, Bogotá, Colombia.
RESUMEN
El ecosistema de manglar de la Ciénaga Grande de Santa Marta (CGSM) ha estado sometido a fuertes presiones antropogénicas que han ocasionado, entre otros, cambios en las características fisicoquímicas de sus sedimentos. En condiciones normales, los sedimentos asociados al manglar generan equilibrios que permiten la retención de metales pesados en distintas formas químicas, al romperse este equilibrio los metales que no son retenidos en la matriz sedimentaria, pueden ser removilizados y hacerse biodisponibles. Con el propósito de establecer el potencial de movilidad y biodisponibilidad de los metales Cr, Mn, Ni, Cu, Zn, Cd, As y Pb en sedimentos superficiales asociados al manglar en la CGSM, se analizaron sus contenidos en cuatro áreas con diferente grado de cobertura de manglar. Los metales fueron extraídos siguiendo el esquema de extracción secuencial de Tessier y se midieron por la técnica de Espectrometría de Plasma Inductivamente Acoplado. En general, las mayores concentraciones de los metales estudiados se encontraron en formas no biodisponibles. Los metales Mn, Ni, Cu, Cd, As y especialmente Zn, podrían ser potencialmente movilizados por cambios del potencial redox del sedimento principalmente. No obstante, las concentraciones de los elementos encontradas en las fracciones móviles son muy bajas y no representan riesgo ambiental.
PALABRAS CLAVE: Metales pesados, Extracción secuencial de Tessier, Movilidad, Biodisponibilidad, Sedimento de manglar.
ABSTRACT
The mangrove ecosystem of CGSM has been subjected to strong anthropogenic pressures that have caused changes in the physical and chemical sediment features, among others. Under normal conditions, the sediments associated to the mangroves generate balances that allow the retention of heavy metals in different chemical forms. When the balance is disrupted, metals in the sediment can be mobilized and become available to the biota. In order to establish the mobility and bioavailability potential of Cr, Mn, Ni, Cu, Zn, Cd, As and Pb in surface sediments associated to the mangroves in the CGSM, their contents were analyzed in four areas with different levels of mangrove cover. The metals were extracted following the sequential extraction scheme of Tessier and measured by Inductively Coupled Plasma Emission Spectrometry technique (ICP-ES). In general, higher concentrations of the studied metals were found in the non-bioavailable fraction. The metals Mn, Ni, Cu, As Cd and especially Zn could be potentially mobilized by sediment changes mainly by the oxidation state of sediment; nevertheless, the concentrations of the potentially mobile elements are very low and do not represent environmental risks.
KEY WORDS: Heavy metals, Tessier sequential extraction, Mobility, Bioavailability, Mangrove sediment.
INTRODUCCIÓN
Los sedimentos de manglar tienen una capacidad extraordinaria de acumular metales en formas que son poco biodisponibles y difíciles de remover, debido a sus propiedades físicas y químicas, caracterizadas por su condición reductora y por ser ricos en materia orgánica y en sulfuros (Tam y Wong, 1996; Vane et al., 2009), lo que ha llevado a visualizar a los ecosistemas de manglar como sitios potenciales de saneamiento ambiental (Clough et al., 1983). No obstante, por cambios en las propiedades del sedimento como pH, contenidos de limos y arcillas, salinidad, potencial redox y por alteración de las condiciones anaeróbica y aeróbica, entre otros, los metales pueden removilizarse o resuspenderse hacia la columna de agua, convirtiéndose en fuentes secundarias de contaminación (Tam y Wong, 1996).
La retención de metales antropogénicos que ingresan a los ecosistemas de manglar asociados a las partículas y a los oxi-hidróxidos de Fe y Mn, se lleva a cabo en la capa superficial del sedimento, los cuales quedan atrapados paulatinamente por efecto físico de las raíces de mangle, que disminuyen la velocidad de la corriente del agua, obligando a que las partículas se precipiten (Lacerda y Abrão, 1984; Tam y Wong, 1996; Lacerda et al., 1999; Machado et al., 2002). En los sedimentos de manglar predominan las condiciones reductoras, bajo las cuales los oxi-hidróxidos se reducen y se disuelven, liberando los metales asociados a la columna del agua. Dado que las aguas del sistema de manglar son ricas en sulfuro disuelto, debido al metabolismo predominante de la reducción del sulfato del sedimento, muchos de los metales liberados a la columna de agua precipitan eficientemente como sulfuros insolubles (Lacerda et al., 1997). Adicionalmente, los manglares tienen influencia sobre la movilidad de los metales, a través de la disminución del oxígeno disuelto producido por la descomposición de la materia orgánica, producto de la hojarasca (Aragón et al., 1999; Ramos e Silva et al., 2006), por lo tanto, los cambios estacionales en la geoquímica redox del sedimento pueden tener una fuerte influencia sobre la movilidad y biodisponibilidad de los metales (Koretsky et al., 2006).
Uno de los principales ecosistemas de manglar en el Caribe colombiano es el de la Ciénaga Grande de Santa Marta (CGSM), el cual ha estado sometido a presiones naturales y antrópicas que han contribuido a su deterioro gradual. La interrupción de los flujos naturales de la CGSM con el mar por la construcción de la carretera Ciénaga- Barranquilla, y con el río Magdalena por la construcción de la Carretera Palermo-Sitio Nuevo, la desecación de ciénagas, el aprovechamiento incrementado de las aguas de los ríos de la Sierra Nevada de Santa Marta (SNSM) y la sedimentación de caños, llevaron a la muerte de más del 50 % del manglar. Desde la década de los años 70 del siglo pasado, se vienen elaborando planes de restauración del ecosistema original, entre los que se destacan las obras de dragado de canales, para restablecer el ingreso de agua dulce desde el río Magdalena y el establecimiento del Plan de Manejo Ambiental (PMA), cuyo principal objetivo fue minimizar los efectos negativos sobre los manglares y sus recursos asociados. Estas acciones, en conjunto con eventos climáticos La Niña, mejoraron las condiciones ambientales del sistema por la disminución de la salinidad en aguas y sedimentos y el aumento en cobertura de mangle en algunos sectores (Blanco et al., 2006; Espinosa et al., 2007), originando sitios con bosques de alta, media y baja cobertura y con condiciones físico-químicas favorables para el establecimiento, crecimiento y desarrollo del mangle. Junto con el PMA, se lleva a cabo el monitoreo de los cambios en el sistema y se han evaluado los niveles de metales pesados en agua, sedimento y biota de la CGSM (Usme, 1984; Gallo y Campos, 1997; Parra y Espinosa, 2008). Con estos estudios, se ha podido demostrar que las mayores entradas de metales pesados a la CGSM se producen a través del río Magdalena, los cuales muestran un gradiente de descenso hacia los cuerpos de agua internos del sistema, alcanzando niveles de casi un orden de magnitud por debajo de los medidos en aguas del río Magdalena (Espinosa et al., 2007). Esta disminución se ha atribuido a la presencia del bosque de manglar, que contribuirían en la captación y retención de metales en los sedimentos aledaños a las plantas, actuando como un filtro natural para estos contaminantes, disminuyendo la contaminación en el sistema.
El objetivo de este estudio fue cuantificar el contenido de los metales Cr, Mn, Ni, Cu, Zn, Cd, As y Pb asociados a las cinco fracciones establecidas en la extracción secuencial de Tessier, en los sedimentos superficiales de cuatro estaciones del complejo lagunar CGSM con diferente grado de cobertura vegetal, para determinar su potencial de movilización y biodisponibilidad. Los metales analizados se seleccionaron teniendo en cuenta las actividades que se desarrollan en la cuenca del río Magdalena, como posibles fuentes de estos contaminantes al sistema CGSM.
ÁREA DE ESTUDIO
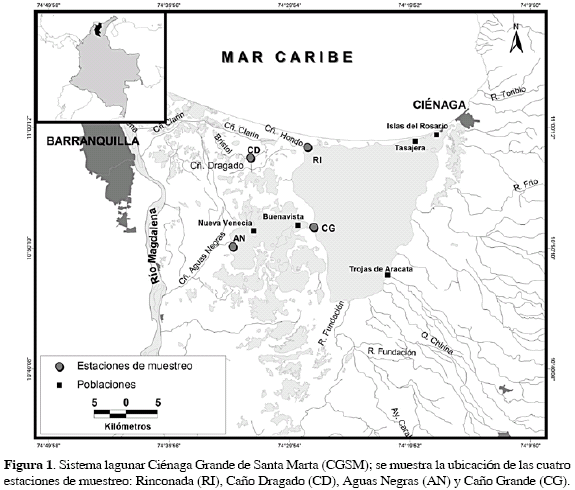
El complejo lagunar CGSM está situado al norte de Colombia, entre 10°43' y 11°00' N y 74°16' y 74°38' W (Figura 1). Está cubierto por manglares, bosque seco tropical y plantas acuáticas asociadas a pantanos de agua dulce, las cuales representan una importante heterogeneidad de hábitats que sustenta la biodiversidad allí existente. En 1969, dos sectores del complejo lagunar recibieron estatus de protección, la zona norte, a través de la declaración del "Vía Parque Isla de Salamanca"; y la zona sur, en el "Santuario de Fauna y Flora de la Ciénaga Grande de Santa Marta". En 2000, las Naciones Unidas declararon a la ecorregión CGSM como "humedal de importancia internacional RAMSAR y Reserva de la Biósfera" (UNESCO, 2000), lo cual enfatiza su importancia nacional y mundial como ecosistema natural estratégico.
Desde los años 50 del siglo pasado, este sistema estuarino ha estado sometido a diversas presiones naturales y antropogénicas que han afectado su equilibrio hídrico, con implicaciones de hipersalinización de aguas y suelos, con lo cual hacia la década de los 90, se había estimado una pérdida de aproximadamente 70 % del bosque de manglar (Botero y Mancera, 1996; Perdomo et al., 1998; Botero y Salzwedel, 1999). Con el propósito de restablecer el régimen hídrico en algunas áreas de la CGSM, para contribuir a la regeneración natural del bosque de manglar, en 1996 se abrieron seis caños que ingresaban agua del río Magdalena al sistema estuarino y se reconectó parcialmente la laguna con el mar a través de una serie de "box-culverts" construidos debajo de la carretera Ciénaga-Barranquilla (Botero y Salzwedel, 1999). Como consecuencia de esto, en la actualidad se encuentran sitios con diferentes estados de conservación-recuperación del bosque de manglar.
Las cuatro estaciones de muestreo se seleccionaron teniendo en cuenta el estado actual de conservación-recuperación del bosque de manglar, así: Rinconada, por ser el sector que soportó menor impacto por el desequilibrio hídrico y el aumento de la salinidad, se caracteriza por tener un bosque en relativo buen estado de conservación, con predominio de árboles de Avicennia germinans (L) Stearn con Diámetro a la Altura del Pecho (DAP) entre 10 y 44 cm; Caño Grande, estación con bosque reforestado con individuos de Rhizophora mangle L que actualmente superan en su mayoría 7 cm de DAP y 15 m de altura; Aguas Negras, estación con bosque en recuperación natural, dominado por árboles de A. germinans con DAP entre 10 y 24 cm; y Caño Dragado, estación sin cobertura vegetal viva (Figura 1).
MATERIALES Y MÉTODOS
El muestreo se realizó en junio de 2007, durante la época climática de transición entre las lluvias y el período seco. El sedimento se colectó con corazonadores fabricados con tubos de PVC de 8 cm de diámetro, los cuales se transportaron al laboratorio y se congelaron inmediatamente. El potencial redox (Eh) del sedimento superficial, se midió in situ con una sonda portátil WTW pH 315i, con electrodo de platino y solución electrolítica de referencia de KCl 3 M Sentix ORP-WTW, previamente verificada con una solución estándar WTW (de +220 mV a pH 7.00). En el laboratorio se tomaron los 5 cm superficiales del testigo, los cuales se homogenizaron y subdividieron. Una fracción se usó para determinar el porcentaje de humedad, el porcentaje de materia orgánica (MO), el pH, la salinidad y el porcentaje de limos y arcillas; y la otra fracción se subdividió en dos, para determinar los contenidos de metales pesados por duplicado.
Los procedimientos utilizados para medir las propiedades fisicoquímicas se encuentran descritos en el manual de técnicas analíticas de INVEMAR (Garay et al., 2003). Para la determinación del porcentaje de humedad, 10 g de sedimento se secaron en estufa a 50 °C por ocho días, la humedad correspondió a la pérdida en peso de la muestra. Para determinar el pH y la salinidad, se realizó una suspensión de 1 g de sedimento seco en 5 mL de agua desionizada y se midieron las variables en la solución con sondas previamente calibradas (WTW pH 315i y WTW 320, respectivamente), esta relación se hizo buscando una humedad del 80 % similar a las muestras en campo. El porcentaje de MO se determinó calcinando 3 g de muestra (secada previamente a 105 °C) en mufla a 550 °C, durante 4 h; la materia orgánica corresponde a la pérdida en peso de la muestra calcinada. Para la determinación de limos y arcillas, se rehumedeció el sedimento seco con hexametafosfato de sodio [(NaPO3)Na2O] al 1 %, se tamizó en una malla de 63 µm y se secó en estufa a 80 °C. El porcentaje de limos y arcillas se expresó como el cociente entre la masa obtenida a través del tamiz de 63 µm y la masa total (Hall, 1991; Garay et al., 2003).
Los metales fueron determinados en la fracción de limos y arcillas, la cual se obtuvo tamizando el sedimento con una malla de nylon de 63 µm. Se usaron dos tipos de extracción: (i) total con HNO3 + HF + HClO4, en caliente en tubos de teflón y (ii) secuencia! en cinco fracciones, siguiendo el método propuesto por Tessier et al. (1979). Para la extracción total se utilizaron 0.5 g de sedimento seco y para la extracción secuencia], 1.5 g de sedimento seco. Este último método se realizó con el propósito de separar los metales en las siguientes fracciones geoquímicas: (F1) metales fácilmente intercambiables, (F2) metales asociados a carbonatos, (F3) metales asociados a oxi-hidróxidos de Fe y Mn, (F4) metales oxidables (asociados a compuestos orgánicos y a sulfuros) y (F5) metales residuales (asociados a silicatos). Las fracciones, reactivos usados y las condiciones del método se muestran en la Tabla 1.
Para evaluar la precisión y la recuperación de la extracción total se empleó el estándar de referencia MESS-3. Este estándar se preparó por triplicado obteniendo recuperaciones para Cr de 93.1 % (97.7 + 4.9 µg g-1), Mn 92 % (298.1 + 14.9 µg g-1), Ni 88.3 % (41.4 + 2.1 µg g-1), Cu 85.3 % (28.9 + 1.44 µg g-1), Zn 96. 7 % (153. 7 + 7. 7 µg g-1), Cd 86 % (0.20 + 0.01 µg g-1), y Pb 87.9 % (18.5 + 0.9 µg g-1). Los reactivos utilizados fueron grado analítico y suprapuro, según el caso. Todo el material fue lavado con acido nítrico al 10 %.
Con el propósito de determinar la influencia de las condiciones fisicoquímicas del sedimento sobre la distribución de los metales en las fracciones geoquímicas, se realizaron análisis de correlación con el programa Statistica. Además, para establecer si existen diferencias entre los cuatro sitios de muestreo para los metales en estudio, se utilizó un análisis canónico para las cuatro estaciones, cada una con sus cinco fracciones, utilizando el paquete estadístico PAST ver 1.86 (Hammer et al., 2001).
Por otra parte, para tratar de establecer el potencial toxicológico de los metales analizados sobre la fauna de la CGSM, las concentraciones se compararon con la Concentración Umbral Efectiva (TEC), definida en la guía de calidad de los sedimentos de Canadá, como el valor de concentración por debajo del cual no se espera que ocurran efectos adversos sobre organismos sensibles que habitan en los sedimentos (Vane et al., 2009).
RESULTADOS
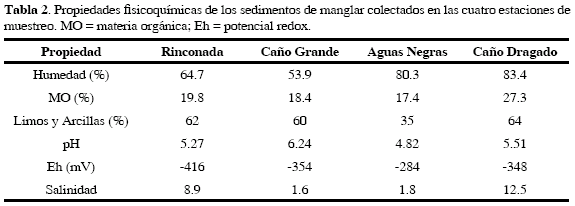
Las condiciones fisicoquímicas del sedimento superficial de las cuatro estaciones de muestreo se describen en la Tabla 2. En las estaciones Aguas Negras y Caño Dragado se encontraron los mayores porcentajes de humedad (>80 %), a diferencia de las otras dos estaciones que tienen mayor cobertura vegetal. Los porcentajes de materia orgánica en las estaciones Rinconada, Caño Grande y Aguas Negras estuvieron en el ámbito de 17 a 19 %, en tanto que en la estación Caño Dragado (sin cobertura vegetal) el contenido de materia orgánica fue más elevado, alcanzando un valor de 27.3 %. Con excepción de la estación Aguas Negras, las restantes tuvieron elevados contenidos de limos y arcillas > 60 %.
El pH de las cuatro estaciones de muestreo fue menor a 7 unidades, con el valor de acidez más pronunciado en la estación Aguas Negras (4.82; Tabla 2). El potencial redox (Eh) mostró condiciones reductoras (<100mV), especialmente en las estaciones Rinconada y Caño Dragado, en las cuales también se observaron los valores de salinidad más altos (Tabla 2), indicando condiciones estuarinas. La menor salinidad fue medida en Caño Grande y Aguas Negras, lo que evidencia que estas estaciones reciben mayores aportes de agua dulce desde el río Magdalena.
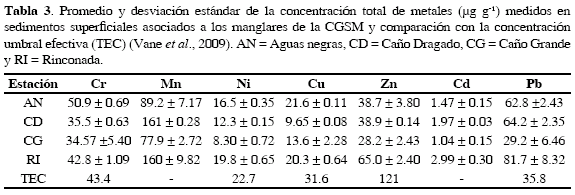
Las mayores concentraciones de Ni, Zn, Mn, Cd y Pb totales, se encontraron en la estación Rinconada y las de Cr y Cu en Aguas Negras. Con excepción del Cu, las menores concentraciones de todos los metales se presentaron en la estación Caño Grande (Tabla 3).
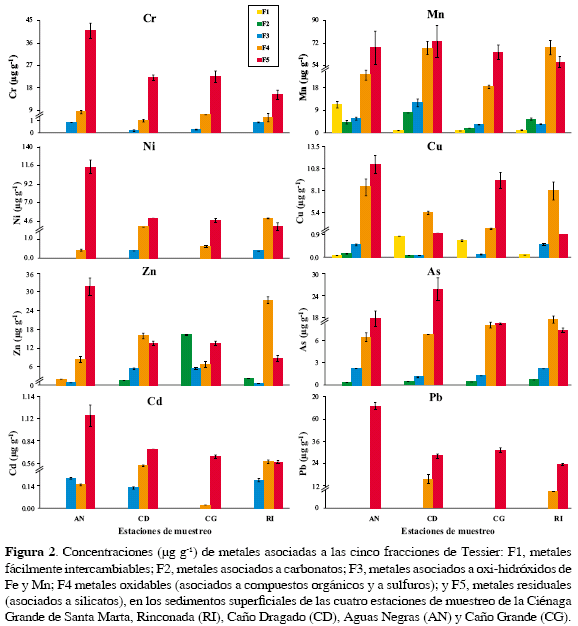
En general, los metales estudiados se encuentran asociados a la fracción residual (F5), es decir como parte de la red silicatada del sedimento (Figura 2). Más del 70 % del Cr (extraído) estuvo asociado a esta fracción, especialmente en la estación Aguas Negras, donde se encontró la mayor concentración (39.9 µg g-1). En Caño Dragado y Caño Grande la concentración fue similar (~21.5 µg g-1) y en Rinconada se observó la concentración más baja (14.7 µg g-1). El remanente de concentración de Cr extraído (<30 %), se encontró en las fracciones oxidable, asociada a materia orgánica y sulfuros (F4) y asociada a oxi-hidróxidos de Fe y Mn (F3), esta última representando entre el 1 y el 5 % del total. El Cr asociado a las fracciones fácilmente intercambiables (F1) y de carbonatos (F2) estuvo por debajo del límite de detección (<0.010 µg g-1).
Las mayores concentraciones de Mn se determinaron en la fracción F5, en las estaciones Caño Dragado (72.7 µg g-1) y Aguas Negras (67.8 µg g-1). Las mayores concentraciones relacionadas con la materia orgánica y sulfuros (F4) se encontraron en las estaciones Caño Dragado y Rinconada (67.5 µg g-1 y 68.0 µg g-1 respectivamente). Es de destacar que en Aguas Negras la concentración de Mn (11.2 µg g-1) en la fracción fácilmente intercambiable (F1) fue superior a la de las demás estaciones (<0.90 µg g-1). Las concentraciones de Mn en las fracciones asociadas a carbonatos (F2) y a oxi-hidróxidos de Fe y Mn (F3) en las cuatro estaciones, representaron entre 3. 0 y 7. 0 % del contenido total (Figura 2).
El Ni en las estaciones Aguas Negras, Caño Dragado y Caño Grande estuvo principalmente asociado a la fracción F5, en concentraciones de 11.3, 4.97 y 4.65 µg g-1, respectivamente (Figura 2). En Rinconada, la mayor concentración de Ni estuvo asociada a la fracción F4 (5.02 µg g-1). Solamente en las estaciones Caño Dragado y Rinconada se presentó una pequeña concentración de Ni asociada a la fracción F3 que representa el 5 % del contenido total (Figura 2). El Ni asociado a las fracciones F1 y F2 estuvo por debajo del límite de detección del método (<0.010 µg g-1).
En las estaciones Aguas Negras y Caño Grande, las mayores concentraciones de Cu estuvieron asociadas a la fracción F5 (11.2 y 9.28 µg g-1 respectivamente) y en Caño Dragado y Rinconada (5.38 y 8.04 µg g-1, respectivamente) a la fracción F4 (Figura 2). El Cu de las fracciones F1, F2 y F3 representó menos del 5 % del total en todas las estaciones, excepto en Caño Dragado, en la cual el Cu intercambiable fue casi el 10 % del total (0.87 µg g-1); y en Caño Grande y Rinconada, en las cuales el Cu asociado a carbonatos estuvo por debajo del límite de detección del método (<0.020 µg g-1).
A diferencia de los otros metales analizados, en cada estación las concentraciones más altas de Zn se encuentran en diferentes fracciones (Figura 2). En Aguas Negras la mayor concentración de este elemento (31.7 µg g-1) se encontró en la fracción F5; en Caño Dragado y Rinconada las mayores concentraciones (15.9 y 27. 5 µg g-1, respectivamente) se determinaron en la fracción F4; y en Caño Grande, la mayor concentración de Zn (16.2 µg g-1), se presentó en la fracción asociada con carbonatos (F2).
Las mayores concentraciones de As se encontraron en las estaciones Aguas Negras y Caño Dragado (17.6 y 25.6 µg g-1, respectivamente), principalmente asociadas a la fracción F5 (Figura 2). En Caño Grande y Rinconada las concentraciones de As en las fracciones F4 y F5 fueron muy similares (8.0 y 8.16 µg g-1 en Caño Grande y 8.73 y 7.30 µg g-1 en Rinconada). En todas las estaciones la concentración de As asociado a las fracciones F2 y F3 fue <2.0 µg g-1 (Figura 2). El As fácilmente intercambiable (F1) estuvo por debajo del límite de detección del método en las cuatro estaciones de muestreo (<0.020 µg g-1).
Con excepción de la estación Rinconada, la mayor concentración de Cd se determinó en la fracción F5, 1.16 µg g-1 en Aguas Negras; 0.738 µg g-1 en Caño Dragado y 0.649 µg g-1 en Caño Grande (Figura 2). En Rinconada, el 44 % del Cd total estuvo asociado a la fracción F4 (0.589 µg g-1), el 43 % a la fracción F5 (0. 579 µg g-1), y el 13 % restante a la fracción F3 (0.177 µg g-1). En las estaciones Aguas Negras y Caño Dragado, cerca del 10 % del Cd total estuvo asociado a la fracción F3 (0.189 y 0.129 µg g-1 respectivamente). En las cuatro estaciones, el Cd fácilmente intercambiable estuvo por debajo del límite de detección del método (<0.001 µg g-1).
En Aguas Negras y Caño Grande, el 100 % del Pb estuvo asociado a la fracción F5 (55.1 y 31.3 µg g-1, respectivamente). En Caño Dragado el 64 % estuvo asociado a la fracción F5 (28.26 µg g-1) y el 36 % restante (15.9 µg g-1) a la fracción F4; y en Rinconada el 88 % del Pb estuvo asociado a la fracción F5 (23.4 µg g-1) y el remanente 12 % (3.1 µg g-1) a la fracción F4 (Figura 2). En las otras fracciones F1, F2 y F3 el Pb estuvo por debajo del límite de detección (<0.008 µg g-1).
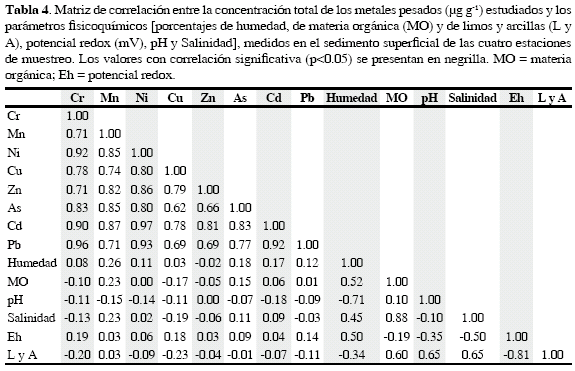
Los análisis de correlación mostraron que las concentraciones totales de todos los metales están directamente correlacionadas entre sí (p<0.05), pero no con las variables humedad, materia orgánica, pH, salinidad, potencial redox, ni limos y arcillas. Por otra parte, se observa que la humedad está directamente relacionada con MO, salinidad y potencial redox, e inversamente relacionada con pH y contenido de limos y arcillas (Tabla 4). La MO está directamente relacionada con salinidad y contenido de limos y arcillas. El pH y la salinidad están directamente relacionados con el contenido de limos y arcillas, e inversamente relacionados con potencial redox. Y el potencial redox está inversamente relacionado con el contenido de limos y arcillas. Cabe destacar que las variables que tienen mayor correlación son MO con salinidad (0.88) y potencial redox con contenido de limos y arcillas (-0.81).
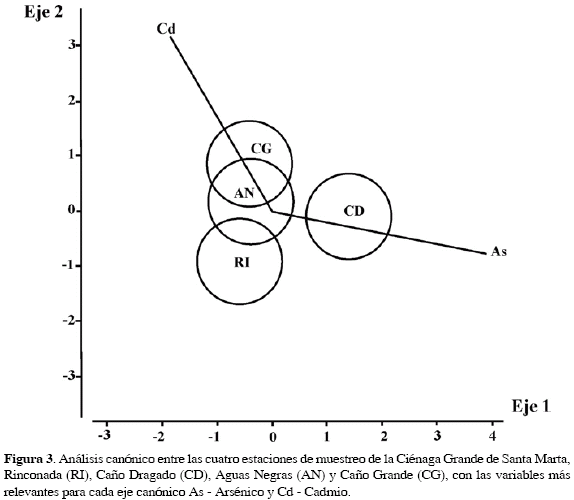
El análisis canónico muestra que el primer eje explica 58.51 % de la varianza total, pero estadísticamente no se registran diferencias entre las estaciones para los ocho metales (X2= 32.82; p>0.10). No obstante, en la Figura 3 se observa que Caño Dragado (estación sin cobertura vegetal) está distante de las otras tres estaciones; el metal que más aporta a esta situación sobre el primer eje canónico es el arsénico (r = 0.635). En el segundo eje canónico, que explica 14.62 % de la varianza, cadmio es el elemento que mayor correlación tiene con este eje (r = 0. 527).
DISCUSIÓN
Conocer la distribución de los metales en las fracciones geoquímicas del sedimento permite hacer predicciones acerca de su potencial movilidad y biodisponibilidad cuando hay cambios en las condiciones fisicoquímicas de los sedimentos. En este sentido, la técnica analítica de extracción secuencial propuesta por Tessier es de gran utilidad, ya que trata de imitar las diversas condiciones ambientales bajo las cuales los sedimentos pueden liberar metales a la columna de agua y por lo tanto sirven como indicadores de su biodisponibilidad potencial.
Por otra parte, la caracterización fisicoquímica del sedimento es determinante de los contenidos y formas químicas en que se encuentran los metales. Los contenidos de limos y arcillas y de MO controlan las concentraciones de metales, ya que aumentan la superficie de adsorción favoreciendo su retención, principalmente por intercambio iónico y adsorción específica en comparación con las partículas de cuarzo (Chatterjee et al., 2007). Los altos contenidos de MO en las estaciones de muestreo son consecuencia de la enorme producción de hojarasca de los árboles de mangle y las condiciones anaerobias dominantes en este tipo de humedales, que en conjunto generan suelos con turba (Cohen y Bailey, 1997; MacFarlane et al., 2007; Zhou et al., 2010). Si bien los análisis estadísticos no muestran correlación de estas variables con los metales, es claro que en las estaciones Rinconada, Caño Grande y Caño Dragado las concentraciones de metales en las fracciones más móviles (F2 a F4) son mayores, comparadas con Aguas Negras, que tiene menores contenidos de limos y arcillas (Figura 2, Tabla 2). La estación Caño Dragado, a pesar de no presentar actualmente cobertura vegetal que favorezca la producción de hojarasca, obtuvo los mayores contenidos de MO, debido principalmente a la depositación de enormes cantidades de material vegetal al momento de su degradación, este sitio estaba cubierto por árboles de mangle antes de su completo y paulatino deterioro.
En sedimentos como los de la CGSM, donde predominan las condiciones reductoras (Eh negativos; Tabla 2), se esperaría que los metales estuvieran asociados a la fracción oxidable (F4 sulfuros o materia orgánica), en la cual los metales son poco móviles (Koretsky et al., 2006). Además, en este sistema tan variable los cambios en el estado de oxidación de los sedimentos pueden generar la movilización de los metales y hacerlos biodisponibles a los organismos que allí habitan, incluidas las plantas de mangle (Lacerda et al., 1999, Machado et al., 2002). No obstante, como se muestra en la Figura 2, en todas las estaciones de muestreo los metales estudiados se presentan asociados principalmente a la fracción F5 y en menor concentración a F4 y F3. El único metal que se salió de este esquema fue Zn en la estación Caño Grande, donde las mayores concentraciones están asociadas a los carbonatos (F2; Figura 2) que es una fracción más lábil y por lo tanto puede movilizarse más fácilmente desde el sedimento hacia la columna de agua, por cambios en el sistema especialmente en el pH. Estos resultados muestran que, en general, los metales estudiados ingresan al sistema haciendo parte de las partículas sedimentarias, por cuanto no van a estar disponibles en grandes concentraciones para los organismos, ni siquiera por fuertes variaciones del pH o del potencial redox. Se sabe que la mayor fuente de metales pesados a la CGSM es el río Magdalena, en el cual las formas químicas de estos elementos depende de las características geológicas de su cuenca (Ingeominas, 2001).
Metales como el Cr, considerado como litofílico de acuerdo con la clasificación de Goldschmidt, se asocian fuertemente al sílice (formando minerales de relativamente baja densidad), a la materia orgánica o a los óxi-hidróxidos de Fe y Mn (Koretsky et al., 2006). Como se muestra en la Figura 2, Cr en todas las estaciones estuvo asociado principalmente a la fracción F5, es decir como parte de la red silicatada de las partículas sedimentarias y en menor concentración a F4 (materia orgánica y sulfuros) y F3 (óxi-hidróxidos de Fe y Mn). Si bien en la estación Aguas Negras la concentración total de Cr estuvo por encima de la concentración Umbral Efectiva TEC (por sus siglas en inglés; 43.4 µg g-1; Tabla 3), no existe riesgo toxicológico por este metal para los organismos que habitan en sedimentos de las estaciones muestreadas, ya que la mayor concentración (39.9 µg g-1) está en la fracción F5 y su origen es geológico, por lo tanto la concentración del Cr que podría movilizarse (Figura 2) está cerca de cuatro veces por debajo del valor TEC.
Mn igual que Cr es un elemento litofílico que, bajo condiciones anóxicas, puede adsorberse sobre los sulfuros, ácidos volátiles o incorporarse dentro de los sulfuros en alto grado de piritización, pero generalmente no se asocia con la materia orgánica (Koretsky et al., 2006). Adicionalmente, en sedimentos litorales Mn se ha encontrado asociado principalmente con la fase de los carbonatos (Koretsky et al , 2006). Aunque en los sedimentos del manglar de la CGSM una pequeña cantidad de Mn se encuentra asociada a la fracción de los carbonatos (F2), el mayor contenido de este elemento está asociado a las fracciones F4 (sulfuros) y F5 (silicatos). Si bien los análisis estadísticos no muestran correlación entre el contenido de este metal y el potencial redox, en la Figura 2 se observa que las mayores concentraciones de Mn asociadas a la fracción F4, se midieron en las estaciones Caño Dragado y Rinconada, las cuales presentan los valores más bajos de potencial redox (Tabla 2), convirtiéndose estas dos estaciones en sitios potenciales de movilización de Mn por cambio de las condiciones predominantemente reducidas a condiciones más oxidadas.
Los metales restantes, Cu, Zn, As, Cd y Pb, se encuentran dentro de la clasificación de calcófilos, los cuales se caracterizan por tener baja afinidad por el oxígeno, por lo que se encuentran preferencialmente como sulfuros altamente insolubles (Koretsky et al., 2006). En los sedimentos del manglar de la CGSM, estos metales tienen comportamiento diferente en cada estación de muestreo. En la estación Aguas Negras, las mayores concentraciones están haciendo parte de la fracción F5, es decir en la forma no biodisponible; solamente Cu en la fracción F4 se encuentra en una concentración relativamente alta comparada con las demás estaciones (Figura 2), quizás acomplejado con la materia orgánica, ya que es la forma característica como se encuentra este elemento en sedimentos reductores (Koretsky et al., 2006).
En las estaciones Caño Dragado y Rinconada, los metales Cu y Zn están principalmente asociados a la fracción F4 (sulfuros y materia orgánica). Esto se debe a que Zn, bajo condiciones anóxicas, se encuentra asociado a sulfuros y carbonatos, y al igual que Cu también tiene una fuerte afinidad por la materia orgánica (Koretsky et al., 2006). En estas dos estaciones los metales Cu y Zn tienen potencial de movilización y biodisponibilidad por la ocurrencia de cambios en las condiciones de oxido-reducción; no obstante la concentración de estos metales en la fracción F4 (con potencial de movilización) no superan el valor TEC (Tabla 3), por lo tanto no se considera que exista riesgo ambiental en la CGSM por la liberación de estos dos metales.
En la estación Caño Grande, el único metal con potencial de movilización es Zn, ya que las mayores concentraciones se encuentran asociadas a una de las fracciones más lábiles (F2; asociada a carbonatos). Sin embargo, al igual que los otros elementos calcófilos, la concentración de este metal en las fracciones móviles está por debajo del valor TEC (Tabla 3), por lo tanto tampoco se considera que en esta estación el Zn tenga efecto negativo sobre los organismos que habitan en el sedimento.
CONCLUSIONES
Los resultados muestran que al bosque de manglar de la CGSM actualmente no están entrando metales pesados en concentraciones que puedan generar riesgo a los organismos que allí habitan, ya que éstos se encuentran principalmente asociados a la red cristalina del sedimento y por tanto no son biodisponibles.
A pesar de que las cuatro estaciones de estudio tienen sedimentos con características fisicoquímicas diferentes y su cobertura de manglar es también diferente, no se pudieron establecer diferencias significativas entre los contenidos de metales en cada fracción geoquímica, ni tendencias relacionadas con dichas variables.
La baja concentración de los metales y la falta de correlación de las concentraciones en cada fracción con las variables fisicoquímicas, no permiten establecer el potencial de movilización de ellos en estudio bajo las condiciones del ecosistema de manglar de la CGSM.
AGRADECIMIENTOS
Los autores agradecen a Jorge Paramo y a Héctor Aníbal Campos por su ayuda en los análisis estadísticos; a Janet Vivas por la elaboración del mapa de estaciones; a los auxiliares Osman Aragón, Carlos Henry y Halbin Serrano de la Unidad de Laboratorios LABCAM del Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andreis" INVEMAR por su apoyo en los análisis de laboratorio; y a Carlos Carbonó, por su ayuda en los muestreos de campo. A INVEMAR por el apoyo logístico y administrativo. Este proyecto fue financiado por el Departamento Administrativo de Ciencia Tecnología e Innovación de Colombia COLCIENCIAS, a través del proyecto cod: 2105-335-18557.
BIBLIOGRAFÍA
1 Aragón, G. T., A. R. Ovalle y J. P. Carmouze. 1999. Porewater and the formation of iron sulfides in a mangrove ecosystem, Sepetiba Bay, Brazil. Mangr. Salt. Marsh., 3: 85-93. [ Links ]
2 Blanco, J. A., E. A. Viloria y J. C. Narváez. 2006. ENSO and salinity changes in the Ciénaga Grande de Santa Marta coastal lagoon system, Colombian Caribbean. Estuar. Coast. Shelf. Sci., 66: 157-167. [ Links ]
3 Botero, L. y J. E. Mancera. 1996. Síntesis de los cambios de origen antrópico ocurridos en los últimos 40 años en la Ciénaga Grande de Santa Marta (Colombia). Rev. Acad. Colomb. Cienc., 20 (78): 465-474. [ Links ]
4 Botero, L. y H. Salzwedel. 1999. Rehabilitation of the Ciénaga Grande de Santa Marta, a mangrove-estuarine system in the Caribbean coast of Colombia. Ocean. Coast. Manag., 42: 243-256. [ Links ]
5 Chatterjee, M., E. V. Silva-Filho, S. K. Sharkar, S. M. Sella, A. Bhattacharya, K. K. Satpathy, M. V. R. Prasad, S. Chakraborty y B. D. Bhattacharya. 2007. Distribution and possible sources of trace elements, in the sediment cores of a tropical macrotidal estuary and their ecotoxicological significance. Environ. Internal., 33: 346-356. [ Links ]
6 Clough, B. F., K. G. Boto y P. W. Attiwill. 1983. Mangroves and sewage: a re-evaluation. Tasks for Vegetation Science, 8: 151-161. [ Links ]
7 Cohen, A. D. y A. M. Bailey. 1997. Petrographic changes induced by artificial coalification of peat: comparison of two planar facies (Rhizophora and Cladium) from the Everglades-mangrove complex of Florida and a domed facies (Cyrilla) from the Okefenokee Swamp of Georgia. Int. J. Coal. Geol., 34: 163-194. [ Links ]
8 Espinosa, L. F., M. L. Gómez y J. A. Acosta (Eds). 2007. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de los recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe técnico final, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 105 p. [ Links ]
9 Gallo, M. C. y N. H. Campos. 1997. Contenidos de Cd, Cu y Zn en sedimentos de zonas de manglar en la Ciénaga Grande de Santa Marta y la bahía de Chengue, Caribe colombiano. Cont. Amb., 16 (28-29): 13-24. [ Links ]
10 Garay, J., G. Ramírez, J. M. Betancourt, B. Marín, B. Cadavid, L. Panizzo, L. Lesmes, J. E. Sánchez, S. H. Lozano y A. Franco. 2003. Manual de técnicas analíticas para la determinación de parámetros fisicoquímicos y contaminantes marinos: agua, sedimentos y organismos. Serie Documentos Generales No. 13, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 117 p. [ Links ]
11 Hall, L. A. 1991. A preliminary investigation into the speciation of trace metals in sediments from the gulf of Paria off the coast of Trinidad. Environ. Internal., 17: 437-447. [ Links ]
12 Hammer, O., D. A. T. Harper y P. D. Ryan. 2001. PAST: Paleontological Statistics Software Package for education and data analysis. Paleontol. Electron., 4 (1): 9. [ Links ]
13 Ingeominas. 2001. Compilación y análisis de datos geoquímicos de metales traza en algunas zonas del río Magdalena (Colombia). Informe técnico, Bogotá. 59 p. [ Links ]
14 Koretsky, C. M., J. R. Haas, D. Miller y N. T. Ndenga. 2006. Seasonal variations in pore water and sediment geochemistry of littoral lake sediments (Asylum Lake, MI, USA). Geochem. Transact., 7: 11. http://www.geochemicaltransactions.com/content/7X1/11. [ Links ]
15 Lacerda, L. D. y J. J. Abrao. 1984. Heavy metal accumulation by mangrove and saltmarsh intertidal sediments. Ver. Bras. Biol., 7: 49-52. [ Links ]
16 Lacerda, L. D., J. L. Freixo y S. M. Coelho. 1997. The effect of Spartina alterniflora Loisel on trace metals accumulation in inter-tidal sediments. Mangr. Salt. Marsh., 1: 201-209. [ Links ]
17 Lacerda, L. D., M. G. Ribeiro Jr. y B. B. Gueiros. 1999. Manganese dynamics in a mangrove mud flat tidal creek in SE Brazil. Mangr. Salt. Marsh., 3: 105-115. [ Links ]
18 MacFarlane, G. R., C. E. Koller y S. P. Blomberg. 2007. Accumulation and partitioning of heavy metals in mangroves: A synthesis of field-based studies. Chemosphere, 69: 1454-1464. [ Links ]
19 Machado, W., M. Moscatelli, L. G. Rezende y L. D. Lacerda. 2002. Mercury, zinc, and cooper accumulation in mangrove sediments surrounding a large landfill in southeast Brazil. Environ. Poll., 120: 455-461. [ Links ]
20 Parra, J. P. y L. F. Espinosa. 2008. Distribución de metales pesados (Pb, Cd y Zn) en perfiles de sedimento asociado a Rhizophora mangle en el río Sevilla - Ciénaga Grande de Santa Marta, Colombia. Bol. Invest. Mar. Cost., 37 (1): 95-110. [ Links ]
21 Perdomo, L., I. Ensminger, L. F. Espinosa, C. Elster, M. Wallner-Kersanach y M. L. Schnetter. 1998. The mangrove ecosystem of the Ciénaga Grande de Santa Marta (Colombia): Observations on regeneration and trace metals in sediments. Mar. Pollut. Bull., 37 (8-12): 393-403. [ Links ]
22 Ramos e Silva, C. A., A. P. da Silva y S. R. de Oliveira. 2006. Concentration, stock and transport rate of heavy metals in a tropical red mangrove, Natal, Brazil. Mar. Chem., 99: 2-11. [ Links ]
23 Tam, N. F. Y. y Y. S. Wong. 1996. Retention and distribution of heavy metals in mangrove soils receiving wastewater. Environ. Pollut., 94 (3): 283-291. [ Links ]
24 Tessier, A., P. G. C. Campbell y M. Bisson. 1979. Sequential extraction procedure for the speciation of particulated metals. Anal. Chem., 51: 844-851. [ Links ]
25 UNESCO. 2000. List of biosphere reserves: the Ciénaga Grande de Santa Marta. The MAB programme. http://portal.unesco.org/science/es/ev.php. 17/03/2009. [ Links ]
26 Usme, S. 1984. Evaluación de la contaminación por cadmio y cobre en sedimentos procedentes de la Ciénaga Grande de Santa Marta. Tesis Quím., Univ. Nacional de Colombia, Bogotá. 85 p. [ Links ]
27 Vane, C. H., I. Harrison, A. W. Kim, V. Moss-Hayes, B. P. Vickers y K. Long. 2009. Organic and metal contamination in surface mangrove sediments of South China. Mar. Pollut. Bull., 58: 129-166. [ Links ]
28 Zhou, Y., B. Zhao, Y. Peng y G. Chen. 2010. Influence of mangrove reforestation on heavy metal accumulation and speciation in intertidal sediments. Mar. Pollut. Bull. doi:10.1016/j. marpolbul.2010.03.010. [ Links ]
FECHA DE RECEPCIÓN: 18/03/2009 FECHA DE ACEPTACIÓN: 28/10/2010
*Contribución No. 2073 del Instituto de Investigaciones Marinas y Costeras-INVEMAR y No. 357 del Centro de Estudios en Ciencias del Mar-CECIMAR, de la Facultad de Ciencias, Universidad Nacional de Colombia sede Caribe.