Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.40 no.1 Santa Marta Jan./June 2011
HÁBITOS ALIMENTARIOS DE SAGITTA FRIDERICI RITTER-ZAHONY EN LAS AGUAS COSTERAS DE LA PROVINCIA DE BUENOS AIRES, ARGENTINA
FEEDING HABITS OF SAGITTA FRIDERICI RITTER-ZAHONY IN COASTAL WATERS OFF BUENOS AIRES PROVINCE, ARGENTINA
Natalia Elizabeth Sato1,2, Daniel Hernández2 y María Delia Viñas1,2,3
1 Consejo Nacional de Investigaciones Científicas y Técnicas, Av. Rivadavia 1917, Ciudad Autónoma de Buenos Aires, Argentina. nesato@mdp.edu.ar
2 Instituto Nacional de Investigación y Desarrollo Pesquero, Paseo Victoria Ocampo N° 1, B7602HSA Mar del Plata, Buenos Aires, Argentina.
3 Universidad Nacional de Mar del Plata, Funes 3250, Mar del Plata, Argentina.
RESUMEN
Se determinó por primera vez la dieta de las poblaciones locales de Sagitta friderici, un quetognato dominante en las aguas costeras de Argentina. Las muestras fueron recolectadas mensualmente en la Estación Permanente de Estudios Ambientales (38° 28' S, 57° 41' W, 48 m profundidad) desde marzo de 2000 hasta abril de 2001. Los copepoditos de las especies Oithona nana, Oithona spp. y Calanoides carinatus y sus huevos fueron las presas dominantes. El porcentaje de quetognatos conteniendo alimento fluctuó entre 7 a 35 % con un valor medio de 21.71 ± 8.64 %. Este índice varió entre los diferentes meses, sin mostrar un claro patrón estacional. El número de presas ingeridas por quetognato fue más elevado en marzo y julio de 2000 que en los otros meses examinados; S. friderici consumió principalmente presas con un ancho de 0.10-0.19 mm. Una relación directa fue observada entre el ancho de la cabeza del depredador y el ancho de las presas; S. friderici podría estar compitiendo por el alimento con las larvas de Engraulis anchoita.
PALABRAS CLAVE: Sagitta friderici, Depredación, Copépodos, Comunidad planctónica, Ecología trófica.
ABSTRACT
For the first time for local populations the diet of the dominant chaetognath Sagitta friderici was determined in coastal waters off Argentina. Samples were collected monthly in Estación Permanente de Estudios Ambientales (38° 28' S, 57° 41' W, 48 m depth) from March 2000 through April 2001. Copepodite stages of the species Oithona nana, Oithona spp. and Calanoides carinatus and their eggs were the dominant prey. The food containing ratio varied from 7 to 35 % with a mean value of 21.71 ± 8.64 %. This index varied among the different months with no clear seasonal pattern. The number of prey eaten by the chaetognath was higher in March and July 2000 than in the other examined months; S. friderici consumed mainly prey 0.10-0.19 mm wide. A direct relationship was observed between the head width of the predator and the width of prey; S. friderici could be competing for food with the larvae of Engraulis anchoita.
KEY WORDS: Sagitta friderici, Predation, Copepods, Planktonic community, Feeding ecology.
INTRODUCCIÓN
Los quetognatos son depredadores activos con una amplia distribución en todo el mundo, habitando desde las aguas costeras hasta el mar abierto (Bone y Pierrot-Bults, 1991). Todas las especies de este grupo taxonómico son principalmente carnívoras, consumiendo una gran variedad de presas zooplanctónicas que incluyen copépodos, apendicularias, quetognatos, poliquetos, larvas de decápodos, cladóceros, huevos y larvas de peces, entre otros (Alvariño, 1985; Giesecke y González, 2004). Los quetognatos son considerados entre los más importantes carnívoros primarios en los ecosistemas pelágicos (Gibbons, 1994). Como grandes depredadores de copépodos, juegan un rol fundamental en los ecosistemas marinos, transfiriendo energía hacia los niveles tróficos superiores (Terazaki, 1998). Según Nagasawa y Marumo (1981), los quetognatos son considerados como eslabones primordiales en el flujo energético entre los copépodos y los grandes depredadores, que incluyen entre ellos a varias especies de peces comercialmente importantes Los quetognatos pueden ejercer un significativo impacto de depredación sobre la comunidad de copépodos de un área determinada, afectando el tamaño de la población de las presas (Stuart y Verheye, 1991).
Son organismos sumamente activos, móviles y voraces. Presentan básicamente un cuerpo alargado, dividido en cabeza, tronco y cola (Boltovskoy, 1981). En la cabeza se ubican lateralmente los ganchos, que son estructuras quitinosas, alargadas y ligeramente curvadas. En la superficie dorsal de la cabeza se ubican los ojos, estructuras particulares con al menos cinco lentes enfocando a distintas direcciones y en la superficie ventral se ubica la boca que se encuentra rodeada por hileras de dientes. El celoma del tronco está enteramente surcado por el tubo digestivo que es recto y desemboca a la altura del septo tronco-caudal (Boltovskoy, 1981; Alvariño, 1985).
La depredación comienza al poco tiempo de eclosionar el huevo (Boltovskoy, 1981). Éstos pueden detectar a sus presas por sensibilidad al movimiento, detección química y detección visual. Se acercan a sus presas con veloces proyecciones repentinas hacia delante, atrapándola con los ganchos y engulléndola entera (Boltovskoy, 1981).
Cabe destacar la importancia de los estudios sobre depredación en los ambientes costeros, dado que frecuentemente constituyen áreas de desoves de peces tales como Engraulis anchoita que, al igual que varias otras especies de engráulidos y algunos clupeidos, constituyen un recurso pesquero de gran importancia por la densidad, extensión de sus cardúmenes y rol en las tramas tróficas. Las larvas de peces se alimentan del zooplancton, que también constituyen el alimento de otros depredadores muy abundantes, tales como los quetognatos. Se ha observado que los quetognatos compiten fuertemente por el alimento con las larvas de peces consumiendo fundamentalmente distintos estadios de desarrollo de los copépodos (Viñas y Ramírez, 1996; Baier y Purcell, 1997b; Marazzo et al., 1997; Duró y Saiz, 2000). Estos depredadores en su conjunto afectan, en parte, la abundancia y la diversidad de los ambientes costeros (Baier y Purcell, 1997b; Baier y Terazaki, 2005; Tonnesson y Tiselius, 2005).
Sagitta friderici Ritter-Zahony (1911) es un quetognato muy abundante en las aguas costeras del Océano Pacífico y del Atlántico, como también del mar Mediterráneo (Ramírez y Viñas, 1982; Mazzoni, 1990; Pierrot-Bults y Nair, 1991; Daponte et al., 2004). Esta especie es dominante en las costas del mar argentino (Mazzoni, 1990) y si bien se han realizado allí estudios sobre su patrón de distribución espacial y la variación estacional de su estructura poblacional, aún se desconocen sus hábitos alimentarios (Ramírez y Viñas, 1982; Mazzoni, 1990; Daponte et al., 2004). Por lo tanto, el objetivo de esta investigación fue estudiar por primera vez los hábitos alimentarios de S. friderici en una estación costera de la Provincia de Buenos Aires, República Argentina, tomando en cuenta un ciclo anual.
ÁREA DE ESTUDIO
En la Estación Permanente de Estudios Ambientales (EPEA; 38° 28' S, 57° 41' W, 48 m profundidad) de la Provincia de Buenos Aires, República Argentina (Figura 1), se estudian a largo plazo las variaciones en la comunidad del plancton en relación con los factores ambientales, con el objetivo de detectar posibles sucesos extraordinarios causados por cambios climáticos y oceanográficos. Aunque su localización corresponde a "aguas costeras", está influenciada en algunas ocasiones por la advección de las "aguas de la plataforma media" de origen subantártico y, en otras, por las aguas dulces del río de la Plata (Lucas et al., 2005). Por lo tanto, la estación es muy dinámica en términos hidrográficos (Lutz et al., 2006). Efectivamente, hacia el norte del área de estudio se encuentra el frente del río de la Plata que presenta una marcada variabilidad espacial y mantiene una estructura de cuña salina permanente. Hacia el sur (39° S, 62° W) se destacan dos sectores: uno externo bajo la influencia de aguas de plataforma que ingresan desde el sur (Golfo San Matías) aportando alto contenido de sal y una franja litoral costera con aguas diluidas por los aportes de los ríos Negro y Colorado (Guerrero, 1998; Lucas et al., 2005).
MATERIALES Y MÉTODOS
Un total de 14 muestras de plancton se recolectaron mensualmente desde marzo de 2000 hasta abril de 2001, empleando una red mini bongo de 20 cm de diámetro de boca y 67 µm de tamaño de malla, la cual fue arrastrada oblicuamente desde profundidades cercanas al fondo hasta la superficie durante las horas del día. Los arrastres fueron cortos (tiempo de arrastre: 2 min; tasa de arrastre: 20 m/min) y la manipulación y la fijación se realizaron en un tiempo <5 min. Las muestras fueron preservadas con formaldehído al 2 % en agua de mar.
La abundancia, estructura de la población y ciclo de vida de S. friderici durante el período de estudio fue extensamente analizado por Daponte et al. (2004). En el presente trabajo, únicamente se llevó a cabo el estudio de la dieta de S. friderici tomando en cuenta los estadios madurativos de la especie.
En el laboratorio, 100 ejemplares de S. friderici fueron removidos al azar de cada una de las muestras. Cada ejemplar fue teñido con solución saturada de azul de metileno para visualizar las gónadas y asignarle un estadio madurativo de acuerdo con el desarrollo de los ovarios y vesículas seminales (Daponte et al., 2004). Los estadios considerados fueron: juveniles (0) con ausencia de ovarios y vesículas seminales; estadio intermedio (I) con ovarios poco desarrollados conteniendo pequeños oocitos y algunos espermatocitos ocupando el celoma de la cola, vesículas seminales ausentes; estadio intermedio (II) con ovarios largos conteniendo oocitos de diferentes tamaños, espermatocitos ocupando el celoma de la cola, vesículas seminales en desarrollo; adultos (III) con ovarios y vesículas seminales completamente desarrollados.
A cada ejemplar se le midió el largo total del cuerpo desde el extremo de la cabeza hasta el final de la cola, excluyendo la aleta caudal. El ancho de la cabeza de cada uno también fue medido. Todas las mediciones se realizaron utilizando lupa binocular dotada de ocular micrométrico con un nivel de precisión de 40 X. El tubo digestivo de cada ejemplar fue diseccionado con agujas muy finas, bajo lupa binocular. Solamente se consideraron las presas localizadas en la región posterior del tubo digestivo. Las presas encontradas dentro de la boca o en cercanías de ella no fueron tomadas en cuenta debido a que probablemente fueron ingeridas en la red durante el muestro, un fenómeno que ocurre habitualmente (Terazaki, 1993). Las presas fueron removidas, diseminadas sobre un portaobjeto y teñidas con solución saturada de azul de tolouidina para lograr una mejor visualización e identificación de las mismas. Posteriormente fueron identificadas hasta el menor nivel taxonómico posible utilizando la literatura taxonómica (Ramírez, 1970; Boltovskoy, 1981; Bradford-Grieve et al., 1999). Las apendicularias se detectaron por sus pellets fecales (López-Urrutia y Acuña, 1999). Los quetognatos fueron reconocidos por la presencia de los ganchos (Boltovskoy, 1981). Con la finalidad de poder identificar los huevos de copépodos encontrados dentro de los tubos digestivos de S. friderici, se realizaron una serie de incubaciones durante 24 h de las hembras de copépodos de las especies dominantes en el área de estudio (Calanoides carinatus, Ctenocalanus vanus, Paracalanus spp. y Oithona nana) (Marrari et al., 2004). Los ejemplares se obtuvieron durante la primavera mediante arrastres lentos del muestreador minibongo equipado con una red de 67 µm de tamaño de malla. Para obtener el medio de cultivo, se colectó agua del sitio de muestreo y se registró su temperatura (12 °C). Luego de colectar el agua de mar, se filtró sobre 22 µm para extraer el zooplancton pero no el fitoplancton. Las muestras se conservaron en heladera portátil a la misma temperatura y salinidad del medio hasta llegar al laboratorio. Los cultivos se mantuvieron a su vez en condiciones de temperatura (12 °C) y salinidad (33.5) y fotoperiodo similares a las registradas in situ al momento de la extracción de las muestras. Para ello se utilizó una cámara de incubación con control digital de temperatura y fotoperiodo. Al cabo de 24 h, se fijaron las muestras con formaldehído al 4 % y se procedió a registrar el diámetro de los huevos y sus características particulares. Los huevos de copépodos encontrados dentro de los tubos digestivos de los quetognatos, fueron identificados al nivel de especie comparándolos con los obtenidos de las incubaciones.
Se registró el número y tamaño (largo total y ancho/diámetro) de las presas. También se determinó la estructura del tamaño del depredador y de las presas. Las relaciones entre el tamaño del depredador (largo total del cuerpo y ancho de la cabeza) y el tamaño de las presas (largo total y ancho del cuerpo) se analizaron con el coeficiente de correlación de Pearson y el Test de t Student (Sokal y Rohlf, 1979).
El porcentaje conteniendo alimento (PCA) fue estimado como el número de quetognatos con alimento / número total de quetognatos X 100, y el valor modal fue comparado con los otros valores aplicando el test tipo Dunnet (Zar, 1996). También se estimó el número de presas ingeridas por quetognato (NPQ) como el número total de presas por ítem / número total de quetognatos. La comparación de los valores obtenidos de NPQ entre los meses analizados, se realizó aplicando el test no paramétrico de comparaciones múltiples de tipo Dunnet entre el grupo control y los otros grupos (Zar, 1996).
RESULTADOS
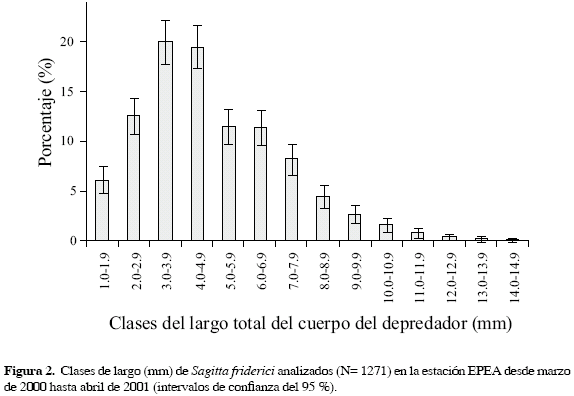
De 1271 ejemplares examinados, 32.73 % correspondieron al estadio madurativo 0 (juveniles); 33.36 y 27.62 % a los estadios intermedios I y II, respectivamente. Sólo el 6.29 % correspondió a los adultos (estadio madurativo III). Las clases de tallas de 3.0-3.9 mm y 4.0-4.9 mm pertenecientes a los estadios madurativos juveniles e intermedios fueron las predominantes (Figura 2).
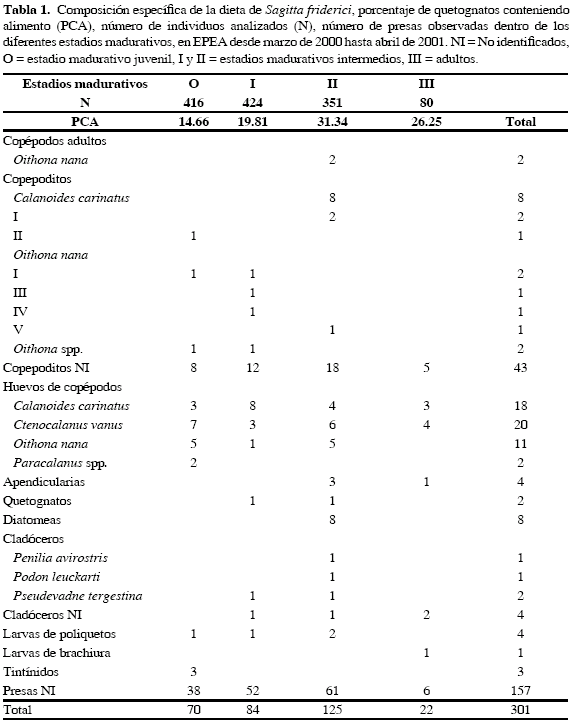
Solamente el 21.72 % del total contenían partículas de alimento en sus tubos digestivos; S. friderici ingirió una gran variedad de presas pero en bajo número (Tabla 1). Los estadios madurativos 0, I y II consumieron principalmente presas pequeñas. Los copepoditos de Oithona nana, Oithona spp. y Calanoides carinatus (todos < 1 mm de largo del cuerpo) y huevos de copépodos (< 0.216 mm de diámetro) fueron las principales presas.
El PCA varió entre 7 y 35 % con un valor medio de 21.71 ± 8.64 % (Tabla 2). La comparación entre el valor modal (PCA = 35) y los otros valores mostraron diferencias significativas solamente para valores de PCA < 18 sin mostrar un claro patrón estacional (Tabla 3). El PCA fluctuó con los estadios madurativos y resultó máximo en individuos con estadio II (PCA = 31.34) (Tabla 1). El NPQ varió entre 0.07 presas quetognato-1 y 0.4 presas quetognato-1 (Tabla 2). El valor modal correspondiente a marzo de 2000 fue significativamente diferente de los otros valores, con excepción de julio de 2000 (Tabla 3).
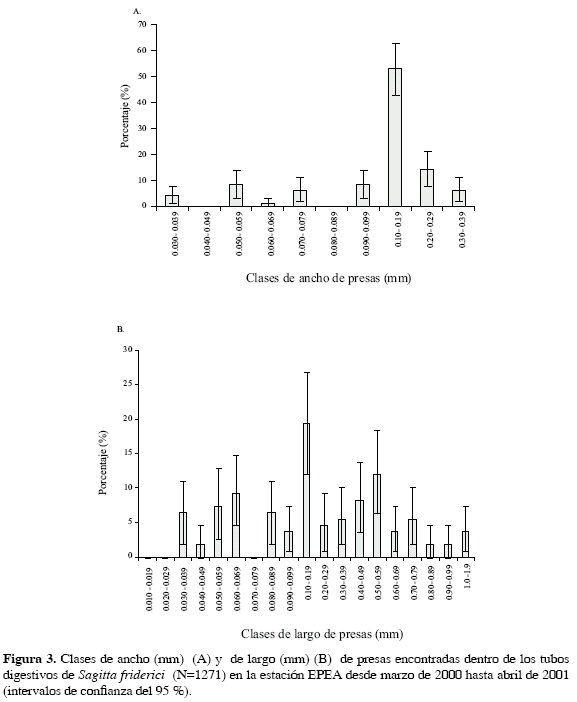
Sagitta friderici consumió fundamentalmente presas con un ámbito de ancho de 0.10-0.19 mm y dentro de él, se incluyen a todos los estadios de desarrollo de los copépodos y a los cladóceros (Figura 3A). No se observó una clara preferencia por alguna clase de talla de largo de presas (Figura 3B). No se observó tampoco correlación entre el largo de la presa y el largo del cuerpo del depredador, en cambio se detectó correlación entre el ancho de la cabeza del quetognato y el ancho de las presas (r = 0.2411; 0.01 < p < 0.05; n = 100).
DISCUSIÓN
La presencia permanente de los estadios inmaduros de S. friderici durante todo el período de estudio, indicó que la especie se reproduce continuamente, resultando el ambiente muy favorable para el desarrollo de sus poblaciones (Daponte et al., 2004). Sin embargo, se observaron elevados porcentajes de tubos digestivos vacíos (78.28 %). Resultados similares fueron obtenidos por Marazzo et al. (1997) en las aguas costeras de Brasil. Este hecho podría ser explicado por la rápida digestión que presentan estos organismos y también por los procesos de regurgitación y defecación durante el muestreo, producto del estrés (Feigenbaum, 1982; Baier y Purcell, 1997a; Giesecke y González, 2004). Es conocido que, en los estudios de contenido estomacal en zooplancton, no es lo más adecuado la fijación de los animales en formaldehído, debido a que este fijador puede alterar el contenido estomacal y posterior identificación del mismo y generar estrés durante la muerte del animal, que puede llevar a procesos de regurgitación (Morales et al., 1990; Bautista y Harris, 1992; Ramírez et al., 2005). Las muestras colectadas y analizadas en el presente trabajo no tenían como único fin el estudio de los contenidos estomacales, sino también de otra serie de variables biológicas y ambientales, lo cual hizo necesario el uso de un fijador de amplio espectro como el formaldehído. Existen otros procesos de fijación con agua carbonatada (soda: agua de mar 5:1) que favorecen la relajación y disminuyen la regurgitación (Morales et al., 1990; Bautista y Harris, 1992; Ramírez et al., 2005).
Solamente 47.85 % del total de las presas fueron identificadas. Esto ocurrió porque únicamente se registraron las presas localizadas en la parte posterior del tubo digestivo, exhibiendo un alto grado de digestión que dificultó su identificación. La diversidad en la composición de la dieta fue concordante con la diversidad observada en el medio (Viñas et al., 2003). Se determinó que los copépodos en sus distintos estadios de desarrollo fueron el alimento principal, representando 79.17 % de la dieta. Otros estudios revelaron resultados similares (Falkenhaug y Sakshaug, 1991; Stuart y Verheye, 1991; Marazzo et al., 1997; Duró y Saiz, 2000). Las especies de copépodos más numerosas en los tubos digestivos de los depredadores fueron también las más abundantes en el ambiente: O. nana, C. carinatus y C. vanus (Viñas et al., 2003), siendo numéricamente dominantes los de talla <1 mm de largo. Estos últimos fueron a su vez los componentes más abundantes del zooplancton durante el período de estudio (Viñas et al., 2003). Es sabido que especies de hábitos carnívoros por su movilidad y tamaño requieren diferente valor nutricional que algunos herbívoros, y el consumo de copépodos por parte de este quetognato le permitiría alcanzar el valor energético requerido (Sameoto, 1972; Feigenbaum, 1982). Según Prieto et al. (2006), los copépodos poseen altos valores nutricionales, con porcentajes elevados de proteínas de excelente calidad y de lípidos, constituyendo además una fuente importante de vitaminas y minerales, que favorecen el óptimo desarrollo de los organismos que los consumen.
Se observaron también elevados porcentajes de huevos de copépodos dentro de los tubos digestivos, a pesar de que estas presas no presentan movimiento. Sin embargo es sabido que los quetognatos detectan a sus presas no solamente por las vibraciones o sensibilidad química, sino también visualmente (Alvariño, 1985). En este caso, los huevos libres en el medio fueron probablemente detectados por estímulos químicos o visuales. Los quetognatos consumieron huevos libres y huevos que se encontraban dentro de los sacos ovígeros portados por la hembra, como por ejemplo en O. nana, aunque en la mayoría de los casos sólo fueron detectados los huevos en los tubos digestivos de los depredadores y no las hembras que lo portaban. Los huevos de los crustáceos requieren un tiempo de digestión muy alto, probablemente a causa del elevado contenido de aceites y derivados (0resland, 1987). Por lo tanto, resulta más fácilmente digerible la hembra, que sus propios huevos, y esta tasa de digestión diferencial ha sido documentada por Álvarez-Cadena (1993).
El PCA varió entre 7 y 35 %. Similares resultados fueron documentados por Marazzo et al. (1997) en las aguas costeras de Brasil. Los altos valores registrados para el estadio madurativo II estarían relacionados con los procesos reproductivos, dado que en dicho período del ciclo de vida se produce el desarrollo intensivo de las gónadas (Marazzo et al., 1997; Batistic et al., 2003).
Los bajos valores de NPQ fueron coincidentes con lo observado por otros autores (Stuart y Verheye, 1991; Marazzo et al., 1997). En los trabajos mencionados se emplearon para el muestreo mallas de 200 µm y por lo tanto, se excluyeron los individuos más pequeños (<4 mm largo total del cuerpo). Por el contrario, en el presente trabajo los individuos pequeños (1-4 mm) fueron retenidos por la malla de 67 µm empleada para el muestreo y, por primera vez, se analizaron los hábitos alimentarios de estos individuos de pequeña talla que constituyeron una fracción muy importante de la población bajo estudio. Elevados valores de NPQ fueron observados en marzo y julio de 2000. Esto es esperable cuando las presas son abundantes (Tonnesson y Tiselius, 2005). En dichos meses se registraron elevados números de presas en el medio (Viñas et al., 2003).
Sagitta friderici consumió fundamentalmente presas con un ancho comprendido entre 0.10 y 0.19 mm. Algunos estudios sugieren que los quetognatos seleccionan sus presas por especie y otros por la talla (Pearre, 1980; Gibbons y Stuart, 1994; Marazzo et al., 1997). Cabe destacar que durante la primavera y el varano, Engraulis anchoita desova intensamente en las aguas costeras bonaerenses y, por lo tanto, puede observarse un alto porcentaje de larvas de primera alimentación (Ciechomski, 1966, 1967). Esto es coincidente con los picos de producción planctónica en dicha área para primavera y verano (Carreto et al., 1995; Negri y Silva, 2003; Viñas et al., 2003; Carreto et al., 2007). La dieta de las larvas de E. anchoita se compone básicamente de huevos, nauplios de copépodos, y copepoditos (Viñas y Ramírez, 1996). Estas larvas ingieren presas con un ámbito aproximado de ancho que varía entre <0.0450 y 0.20 mm (Ciechomski, 1967; Viñas y Ramírez, 1996). Los tipos de presas y el ámbito de valores de ancho, fueron similares para S. friderici, indicando que ambas especies podrían estar compitiendo por el alimento en algunas estaciones del año, principalmente durante la primavera y el verano
Se detectó una clara relación entre el ancho de la cabeza de S. friderici y el ancho de las presas en coincidencia con lo observado por Terazaki (1996) para S. enflata en las aguas del Pacífico central. Feigenbaum y Maris (1984) indicaron que los quetognatos jóvenes seleccionan presas pequeñas tales como tintínidos o nauplios de copépodos y que a medida que crecen consumen individuos de mayor talla como copépodos adultos y otras presas grandes. Stuart y Verheye (1991) y Gibbons (1994) determinaron para S. friderici en aguas costeras de Sudáfrica que a medida que aumentan en talla van incorporando a sus dietas presas más grandes Esto indicaría claramente que para los quetognatos la selección del alimento estaría determinada básicamente por el tamaño (incluyendo quizá el ancho) de la presa.
CONCLUSIONES
Los resultados del presente trabajo sobre los hábitos alimentarios de S. friderici constituyen el primer aporte sobre este tema para el mar argentino; S. friderici, es un depredador común en las aguas costeras bonaerenses, muy abundante a lo largo de casi todo el año. En base a los resultados obtenidos se puede concluir que este quetognato produciría un impacto de depredación sobre las poblaciones de copépodos de las especies C. carinatus, C. vanus y O. nana, por el consumo intensivo de sus huevos y copepoditos. El PCA no evidenció un claro patrón estacional; S. friderici registró selectividad por tamaño (ancho) de presas coincidentemente a lo registrado por otros autores En el futuro serían necesarios estudios detallados sobre otras variables tales como tasas de depredación y tiempos de digestión para comprender claramente su rol ecológico en relación al impacto de la depredación que S. friderici ejercería sobre sus principales presas dentro de la comunidad planctónica costera bonaerense, evaluando en profundidad la posible competencia por el alimento con las larvas de E. anchoita.
AGRADECIMIENTOS
Al Instituto Nacional de Investigación y Desarrollo Pesquero (INIDEP, Proyecto: Dinámica del plancton marino) por proveer las muestras y facilidades del laboratorio. Un agradecimiento para el Dr. Fernando Ramírez por su ayuda en la identificación de los copépodos y al Lic. Rubén Negri por su aporte en la identificación del fitoplancton. También un especial agradecimiento a los evaluadores anónimos que con sus sugerencias e indicaciones han mejorado notablemente la calidad de este trabajo. Esta investigación fue parcialmente sostenida por la Agencia Nacional para la Promoción Científica y Técnica, PICT 15227/2003, el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) y la Universidad Nacional de Mar del Plata, EXA 322/05.
BIBLIOGRAFÍA
1 Álvarez-Cadena, J. N. 1993. Feeding of the chaetognaths Sagitta elegans Verril. Estuar. Coast. Shelf Sci., 36: 195-206. [ Links ]
2 Alvariño, A. 1985. Predation in the plankton realm, mainly with reference to fish larvae. Invest. Mar., 2: 1-122. [ Links ]
3 Baier, C. T. y J. E. Purcell. 1997a. Effects of sampling and preservation on apparent feeding by chaetognaths. Mar. Ecol. Prog. Ser., 146: 37-42. [ Links ]
4 Baier, C. T. y J. E. Purcell. 1997b. Trophic interactions of chaetognaths, larval fish, and zooplankton in the South Atlantic Bight. Mar. Ecol. Prog. Ser., 146: 43-53. [ Links ]
5 Baier, C. T. y M. Terazaki. 2005. Interannual variability in a predator-prey interaction: climate, chaetognaths and copepods in the southeastern Bering Sea. J. Plankton Res., 27: 1113-1125. [ Links ]
6 Batistic, M., J. Mikus y J. Njire. 2003. Chaetognaths in the South Adriatic: vertical distribution and feeding. J. Mar. Biol. Assoc., 83: 1301-1306. [ Links ]
7 Bautista, B. y R. P. Harris. 1992. Copepod gut contents, ingestion rates and grazing impact on phytoplankton in relation to size structure of zooplankton and phytoplankton during a spring bloom. Mar. Ecol. Prog. Ser., 82: 41-50. [ Links ]
8 Boltovskoy, D. 1981. Atlas del zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton marino. Publicación especial del INIDEP, Mar del Plata, Argentina. 936 p. [ Links ]
9 Bone, Q. H. y A. C. Pierrot-Bults. 1991. The biology of Chaetognaths. Oxford University Press, Oxford. 173 p. [ Links ]
10 Bradford-Grieve, J. M., E. L. Markhaseva, C. E. F. Rocha y B. Abiahy. 1999. Copepoda. 869-1098. En: Boltovskoy, D. (Ed.). South Atlantic zooplankton. Backhuys Publishers, Leiden, Holanda. 1098 p. [ Links ]
11 Carreto, J. I., V. Lutz, M. O. Carignan, A. D. Cucchi-Colleoni y S. G. de Marcos. 1995. Hydrography and chlorophyll a in a transect from the coast to the shelf-break in the Argentinian Sea. Cont. Shelf Res., 15: 315-336. [ Links ]
12 Carreto, J. I., M. O. Carigan, N. G. Montoya y A. D. Colleoni-Cucchi. 2007. Ecología del fitoplancton en los sistemas frontales del mar argentino. 11-31. En: Boschi, E. E. (Ed.). El mar argentino y sus recursos pesqueros. Instituto Nacional de Investigación y Desarrollo Pesquero, Mar del Plata. 31 p. [ Links ]
13 Ciechomski, J. D. 1966. Development of the larvae and variations in the size of the eggs of the Argentine anchovy, Engraulis anchoita Hubbs and Marini. Contribución del Instituto de Biología Marina Mar del Plata, 39: 281-290. [ Links ]
14 Ciechomski, J. D. 1967. Investigations of food and feeding habits of larvae and juveniles of the Argentine anchovy Engraulis anchoita. Calif. Coop. Oceanic Fish. Invest. Rep., 11: 72-81. [ Links ]
15 Daponte, M. C., F. L. Capitanio, D. E. Nahabedian, M. D. Viñas y R. M. Negri. 2004. Sagitta friderici Ritter-Zahony (Chaetognatha) from South Atlantlic waters: abundance, population structure, and life cycle. J. Mar. Sci., 61: 680-686. [ Links ]
16 Duró, A. y E. Saiz. 2000. Distribution and trophic ecology of chaetognaths in the western Mediterranean in relation to an inshore-offshore gradient. J. Plankton Res., 22: 339-361. [ Links ]
17 Falkenhaug, I. y E. Sakshaug. 1991. Prey composition and feeding rate of Sagitta elegans var. arctica (Chaetognatha) in the Barents Sea in early summer. Polar Res., 10: 487-506. [ Links ]
18 Feigenbaum, D. 1982. Feeding by the chaetognath, Sagitta elegans, at low temperatures in Vineyard Sound, Massachusetts. Limnol. Oceanogr., 27: 699-706. [ Links ]
19 Feigenbaum, D. L. y R. C. Maris. 1984. Feeding in the Chaetognatha. Oceanogr. Mar. Biol., 22: 343-392. [ Links ]
20 Gibbons, M. J. 1994. Diel vertical migration and feeding of Sagitta friderici and Sagitta tasmanica in the Southern Benguela upwelling region, with a comment on the structure of the guild of primary carnivores. Mar. Ecol. Prog. Ser., 111: 225-240. [ Links ]
21 Gibbons, M. J. y V. Stuart. 1994. Feeding and vertical migration of the chaetognaths Sagitta friderici (Ritter-Zahony, 1911) in the Southern Benguela during spring 1987, with notes on seasonal variability of feeding ecology. South African. J. Mar. Sci., 14: 361-372. [ Links ]
22 Giesecke, R. y H. E. González. 2004. Feeding of Sagitta enflata and vertical distribution of chaetognaths in relation to low oxygen concentrations. J. Plankton Res., 26: 475-486. [ Links ]
23 Guerrero, R. A. 1998. Oceanografía física del estuario del río de la Plata y el sistema costero de El Rincón. 29-54. En: Lasta, C. A. (Ed.). Resultados de una campaña de evaluación de recursos demersales costeros de la provincia de Buenos Aires y del litoral uruguayo. Informe técnico No. 2, Instituto Nacional de Investigación y Desarrollo Pesquero (INDIEP), Mar del Plata, Argentina. 141. [ Links ]
24 López-Urrutia, A. y J. L. Acuña. 1999. Gut throughput dynamics in the appendicularians Oikopleura dioca. Mar. Ecol. Prog. Ser., 191: 195-205. [ Links ]
25 Lucas, A., R. Guerrero, H. Mianzan, E. M. Acha y C. Lasta. 2005. Coastal oceanographic regimes of the Northern Argentine Continental Shelf (34º S). Estuar. Coast. Shelf S., 65: 405-420. [ Links ]
26 Lutz, V. A., A. Subramaniamc, R. M. Negri, R. I. Silva y J. I. Carreto. 2006. Annual variations in biooptical properties at the "Estación Permanente de Estudios Ambientales (EPEA)" coastal station, Argentina. Cont. Shelf Res., 26: 109-1112. [ Links ]
27 Marazzo, A., C. F. Machao y C. S. R. Nogueira. 1997. Notes on the feeding of Chaetognatha in Guanabara Bay, Brazil. J. Plankton Res., 19: 819-828. [ Links ]
28 Marrari, M., M. D. Viñas, P. Martos y D. Hernández. 2004. Spatial patterns of mesozooplankton distribution in the Southwestern Atlantic Ocean (34º-41º S) during Austral Spring: Relationship with the hydrographic conditions. J. Mar. Sci., 61: 667-679. [ Links ]
29 Mazzoni, H. 1990. Chaetognatha del mar argentino. Ciclos estacionales de la distribución espacial y otros aspectos ecológicos. Tesis Doctoral. Universidad de Buenos Aires, Buenos Aires. 202 p. [ Links ]
30 Morales, C. E., B. Bautista y R. P. Harris. 1990. Estimates of ingestion in copepods assemblages: gut fluorescence in relation to body size classes. Trophic relationships in the marine environment. Proc. 24th Europ. Mar. Biol. Symp., 565-577. [ Links ]
31 Nagasawa, S. y R. Marumo. 1981. Chaetognaths as food of demersal fishes in the East China Sea. Seikai Reg. Fish. Res. Lab., 56: 1-13. [ Links ]
32 Negri, R. M. y R. I. Silva. 2003. Contribución de las distintas fracciones del fitoplancton a la biomasa fototrófica durante un ciclo anual en la estación EPEA (38° 28'S- 57° 41'W). V Jornadas Nacionales de Ciencias del Mar Mar del Plata. 147 p. [ Links ]
33 Øresland, V. 1987. Feeding of the chaetognaths Sagitta elegans and S. setosa at different seasons in Gulmarsfjorden Sweden. Mar. Biol. Prog. Ser., 63: 201-109. [ Links ]
34 Pearre, S. Jr. 1980. Feeding by Chaetognatha: the relation of prey size to predator size in several species. Mar. Ecol. Prog. Ser., 39: 69-79. [ Links ]
35 Pierrot-Bults, A. C. y V. R. Nair. 1991. Distribution patterns in chaetognaths. 86-117. En: Steele, Q., H. Kapp y A. C. Pierrot-Bults (Eds.). The biology of Chaetognaths. Oxford University Press, Oxford. 169 p. [ Links ]
36 Prieto, M., F. Castaño, J. Sierra, P. Logato y J. Botero. 2006. Alimento vivo en la larvicultura de peces marinos: copépodos y mesocosmos. Rev. MVZ Córdoba., 11 (1): 30-36. [ Links ]
37 Ramírez, F. C. 1970. Copépodos planctónicos del sector bonaerense del Atlántico Sudoccidental. Proyecto de desarrollo pesquero FAO, Serie de informes técnicos Vol. 10 No. 5, Instituto de Biología Marina, Mar del Plata, Argentina. 116 p. [ Links ]
38 Ramírez, F. C. y M. D. Viñas. 1982. Variación estacional de los estados gonadales y las frecuencias detalla en Sagitta friderici, un quetognato nerítico del área de Mar del Plata. Physis., 41: 99-111. [ Links ]
39 Ramírez, J. G., A. Franco-Herrera, D. Rincón y L. Castro. 2005. Tasa de producción de fecas y coprofagía en Eucalanus subtenuis (Copepoda, Calanoidea), bajo condiciones controladas de laboratorio. Bol. Invest. Mar. Cost., 34: 193-209. [ Links ]
40 Sameoto, D. D. 1972. Yearly respiration rate and estimated energy budget for Sagitta elegans. J. Fish. Res. Bd. Can., 29: 987-996. [ Links ]
41 Sokal, R. R. y F. J. Rohlf. 1979. Biometría. Blume Ediciones, Madrid. 832 p. [ Links ]
42 Stuart, V. y H. M. Verheye. 1991. Diel migration and feeding patterns of the chaetognath, Sagitta friderici, off the west coast of South Africa. J. Mar. Res., 49: 493-515. [ Links ]
43 Terazaki, M. 1993. Deep-sea adaptation of the epipelagic chaetognath Sagitta elegans in the Japan Sea. Mar. Ecol. Prog. Ser., 98: 79-88. [ Links ]
44 Terazaki, M. 1996. Vertical distribution of pelagic chaetognaths and feeding of Sagitta enflata in the Central Equatorial Pacific. J. Plankton Res., 18: 673-682. [ Links ]
45 Terazaki, M. 1998. Life history, distribution, seasonal variability and feeding of the pelagic chaetognaths Sagitta elegans in the Subarctic Pacific: A review. Plankton Biol. Ecol., 45: 1-17. [ Links ]
46 Tonnesson, K. y P. Tiselius. 2005. Diet of the chaetognaths Sagitta setosa and S. elegans in relation to prey abundance and vertical distribution. Mar. Ecol. Prog. Ser., 289: 177-190. [ Links ]
47 Viñas, M. D. y F. C. Ramírez. 1996. Gut analysis of first-feeding anchovy larvae from Patagonian spawning area in relation to food availability. Arch. Fish. Mar. Res., 43: 231-256. [ Links ]
48 Viñas, M. D., R. Negri, F. Capitanio, C. Daponte y R. Silva. 2003. Ciclo anual del mesozooplancton y de algunos componentes del microzooplancton en la estación EPEA (38° 28' S, 57° 41' W). V Jornadas Nacionales de Ciencias del Mar, Mar del Plata, Argentina. 183 p. [ Links ]
49 Zar, J. H. 1996. Biostatistical analysis. Prentice Hall, New Jersey. 662 p. [ Links ]
FECHA DE RECEPCIÓN: 07/12/2009 FECHA DE ACEPTACIÓN: 14/01/2011