Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.40 no.2 Santa Marta July/Dec. 2011
DISTRIBUCIÓN DE LA MEGAFAUNA BENTÓNICA DEL CARIBE COLOMBIANO ASOCIADA A VARIABLES AMBIENTALES DEL FONDO MARINO*
DISTRIBUTION OF COLOMBIAN CARIBBEAN BENTHIC MEGAFAUNA SPECIES IN RELATION WITH DEEP SEA ENVIRONMENTAL GRADIENTS
Martha Patricia Vides Casado
Instituto de Investigaciones Marinas y Costeras-INVEMAR, Programa de Investigación para la Gestión Marina y Costera, A. A. 1016, Santa Marta, Colombia. mvides@invernar.org.co
RESUMEN
El presente análisis relaciona la distribución espacial de especies de la megafauna bentónica con gradientes de variables ambientales estimadas cerca al fondo oceánico, haciendo uso de datos obtenidos a lo largo de la provincia del mar Caribe colombiano. Los datos utilizados corresponden a muestras de megafauna bentónica obtenidas en 96 sitios de colecta entre los años 1999 y 2008 en un ámbito de profundidad entre 15 y 900 m. La distribución latitudinal de los taxa mayores se analizó a través de perfiles del fondo de 100 km de longitud desde la línea de costa. Se utilizaron curvas de acumulación de especies con intervalos de confianza de 95% para hacer las comparaciones. La distribución de la megafauna bentónica se relacionó con los parámetros ambientales del fondo a través de análisis estadísticos (auto-correlación espacial, análisis de correspondencia y agrupamiento jerárquico). La profundidad se identificó como el principal factor regulador en la distribución de los ensamblajes. Se definieron ensamblajes particulares y las especies que los separaban: el camarón de aguas profundas Glyphocrangon neglecta, el coral solitario Deltocyathus eccentricus, el camarón Penaeopsis serrata, el galatéideo Agononida longipes, el ofiuro Ophiura acervata y la jaiba Portunus spinicarpus. Este estudio se constituye en uno de los puntos de partida para modelos de predicción de distribución de especies, en ejercicios de selección de sitios para la planificación de la conservación marina.
PALABRAS CLAVE: Megafauna, Bentos, Ensamblajes, Profundidad, Caribe colombiano.
ABSTRACT
This analysis relates the spatial distribution of benthic megafauna species with estimated environmental variables gradients close to the seafloor, using data obtained along the Colombian Caribbean sea province. The data used correspond to samples of benthic megafauna obtained in 96 collection sites between 1999 and 2008 at a depth range between 15 and 900 m. The latitudinal distribution of higher taxa was analyzed through profiles of 100 km length from the coastline. Species accumulation curves with confidence intervals of 95% were used to make comparisons. The distribution of benthic mega fauna was related to environmental parameters through statistical analysis (auto-spatial correlation, correspondence analysis, and hierarchical clustering). The depth was identified as the main factor regulating the distribution of assemblages. Species that separated the assemblages were defined: the deep-water shrimp Glyphocrangon neglecta, the solitary coral Deltocyathus eccentricus, the shrimp Penaeopsis serrata, the squat lobster Agononida longipes, thebrittle star Ophiura acervata and the crab Portunus spinicarpus. This study is one of the starting points for predictive models of species distribution in conservation planning selection site exercises.
KEY WORDS: Macrofaunal, benthos, assemblages, depth, Western Caribbean.
INTRODUCCIÓN
Un componente fundamental y requerido en procesos tendientes al manejo y conservación de la biodiversidad marina es el conocimiento acerca de en dónde se encuentran los elementos distintivos y representativos de la misma. Estos dos términos, introducidos por Roff y Taylor (2000) en ejercicios de planificación de áreas representativas de biodiversidad marina, hacen referencia a aquellas expresiones de diversidad con características extraordinarias (o no), que la hacen relevante en términos ambientales. Estas expresiones varían en extensión y por ende en el valor otorgado en los procesos de selección de sitios, dado que no todos los niveles que constituyen biodiversidad marina pueden estar sujetos a conservación (Margules et al., 2002).
Esta situación conlleva a la búsqueda y selección de expresiones de biodiversidad lo suficientemente robustas y complejas para permitir la identificación de elementos distintivos pero, de igual forma, lo suficientemente extensas y generales para permitir la identificación de expresiones representativas y sus procesos, dentro de un sistema de clasificación biogeográfica, que permita la administración del recurso en un contexto regional o nacional (Alonso et al, 2008). Estas diferentes expresiones son los llamados "sustitutos" de biodiversidad en la clasificación ecológica jerárquica utilizada en ejercicios de planificación para la conservación de biodiversidad marina (Zacharias y Roff, 2000). Las propuestas globales de clasificación de expresiones de biodiversidad marina varían desde micro-comunidades (sitios de < 10 km), hábitats (10s de km), paisajes marinos (100s de km), eco-regiones (1000s de km), hasta el nivel de provincias marinas (mayores a 1000 km) (Day y Roff, 2000), en concordancia con el nivel espacial de manejo requerido para su conservación.
El área correspondiente al margen continental de Colombia sobre el mar Caribe se ubica dentro del Gran Ecosistema Marino del Caribe, uno de los 64 Grandes Ecosistemas Marinos (Large Marine Ecosystems-LME) identificados a nivel global (Sherman y Hempel, 2008). Cada Gran Ecosistema Marino se caracteriza por condiciones físicas y biológicas tales como: productividad, rasgos batimétricos, hidrografía y poblaciones con interdependencia trófica; incluyen regiones del océano y del espacio costero que abarcan cuencas hidrográficas y se extienden más allá del borde de la plataforma continental, incluyendo los sistemas marginales de corrientes marinas.
En concordancia con el sistema de clasificación global MEOW (Marine Ecoregions of the World), una de las primeras divisiones marinas propuestas a escala global (Spalding et al, 2007), el área de mar territorial colombiano sobre el Caribe se ubica en la Cuenca Marina Atlántico Tropical y, a su vez en la Provincia Atlántico Noroeste Tropical. En un ejercicio de regionalización marina nacional, que nace de la necesidad de clasificar los paisajes y ecosistemas costeros y marinos de Colombia a escala 1:500000 (IDEAM et al., 2007), el término Provincia adquiere una nueva dimensión espacial; dentro de dicha clasificación la totalidad de la extensión de mar territorial de Colombia sobre el Caribe recibe la denominación de Región Biogeográfica Marina Atlántico Tropical. Esta región se divide a su vez en dos Provincias: Cayos y Bancos y Mar Caribe. En el caso de la Provincia Mar Caribe, donde se ha llevado a cabo la colección de muestras de megafauna bentónica aquí analizadas, se diferencian tres Ecozonas: Cuenca Colombia, Plataforma Continental del Caribe y Talud Caribaná.
A la fecha, no se reconoce un sistema unificado de clasificación biogeográfica marina en Colombia, más allá del que define sistemas costeros (Sullivan y Bustamante, 1999) o ecorregiones (Díaz y Gómez, 2000; Díaz y Acero, 2003; IDEAM et al, 2007), que permita hacer clasificaciones a escalas regionales (>100 km) como base para el manejo y establecimiento de áreas marinas protegidas (Costello et al., 2010). Según las estimaciones de Miloslavich et al. (2010) Colombia estaría ocupando el cuarto lugar en porcentaje de contribución relativa a la diversidad regional del Caribe (diversidad gamma medida en cinco taxa).
Mucha de la ambigüedad en la representación de ambientes marinos se debe a la naturaleza fluida del océano, donde es casi imposible identificar límites absolutos; los límites tienden a ser zonas de transición que involucran el movimiento de los organismos y gradientes de variables ambientales, cuya relación es pobremente entendida a la fecha (Stevens y Connolly, 2004). Debido al asocio observado con algunos gradientes naturales del sustrato, las comunidades bentónicas se constituyen en uno de los sustitutos de biodiversidad más empleados. Estos gradientes pueden ser asociados con la profundidad y la naturaleza del sustrato (ej. textura, tamaño de grano); con las características del agua adyacente (ej. turbidez, salinidad, temperatura, incidencia lumínica o nutrientes) o con el ambiente local (ej. exposición y velocidad de las corrientes, proximidad a desembocaduras y entradas de nutrientes) (Probert y Anderson, 1986; Bonsdorff et al., 1996; Zettler et al. 2007; Glockzin y Zettler, 2008; Glockzin et al., 2009).
Uno de los descriptores de las comunidades bentónicas más usados, hace referencia a su diversidad, medida a partir de su composición numérica y del número de especies (Flach y de Bruin, 1999). Dependiendo de la escala y región, la profundidad y la salinidad, junto con la concentración de oxígeno en el fondo y el tipo de fondo, son considerados los factores determinantes en la riqueza de especies y composición de comunidades bentónicas (Guzmán-Alvis y Díaz, 1993; Laine, 2003; Guzmán y Ardila, 2004). La exploración de patrones de agrupación de ensamblajes a parámetros ambientales mediante estadística descriptiva basada en la observación, se constituye como uno de los puntos de partida para la selección de sustitutos de biodiversidad, que soportan los ejercicios de selección de sitios en ejercicios de planificación para la conservación.
Una serie de trabajos previos han investigado la estructura de los factores ambientales que determinan la distribución de las comunidades bentónicas a lo largo del Caribe colombiano (Guzmán-Alvis y Díaz, 1993; Córdoba-Tejada, 1997; Navas et al., 2002; Díaz-Pulido et al., 2004; Guzmán y Ardila, 2004; Criales-Hernández et al., 2006). El presente trabajo describe cómo incorporar un complemento espacial que contribuye al análisis ecológico tradicional, como un potencial estimador de las respuestas de la biota a cambios de hábitat, mediante la extracción de patrones de distribución de especies en respuesta a la selección de variables ambientales (profundidad, salinidad y concentración de oxígeno del fondo), con el fin de generar mapas continuos de distribución de especies macrobentónicas dentro de la Provincia Mar Caribe (IDEAM et al., 2007). De igual forma se discuten los resultados como insumo a la creación de una herramienta para la modelación de los cambios de la comunidad bentónica, con miras al desarrollo de herramientas de conservación y manejo.
ÁREA DE ESTUDIO
La Cuenca Colombia se constituye como el rasgo geomorfológico más extenso de la Provincia Mar Caribe. El talud, relativamente homogéneo, es interrumpido por el abanico sedimentario del Magdalena con cañones y canales asociados (Ercilla et al., 2002). El sistema turbídico del Magdalena, una gruesa acumulación sedimentaria sobre el margen continental (con una extensión cercana a 53000 km2), se extiende más allá de 4000 m de profundidad y aporta grandes cantidades de material terrfgeno directamente sobre el talud, dado que la plataforma continental en este sector es muy angosta (2 km de ancho). La presencia de cañones y canales crean una rápida actividad sedimentaria (Vernette et al., 1992) que puede ser considerada como un factor que influye en la permanencia de la composición de comunidades bentónicas en el sector. La plataforma continental es altamente variable, con puntos de máxima (95 km al norte de La Guajira) y mínima amplitud (800 m en el sector de las estribaciones de la Sierra Nevada de Santa Marta), cortada por una serie de cañones (i.e. Cañón de la Aguja) que se extienden perpendiculares a la línea de costa y guardan cierta relación con las principales fallas continentales (IDEAM et al., 2007).
Las aguas marinas costeras del sector norte, frente a la Ecorregión Guajira (Díaz y Acero, 2003), tienden a ser turbias, debido a la continua resuspensión de los sedimentos por el fuerte oleaje. La sedimentación limosa y lodosa predominante es aportada posiblemente por la cuenca de Maracaibo, cubriendo la plataforma desde este sector hasta Bocas de Ceniza (Javelaud, 1986). La influencia de descargas de la Ciénaga Grande de Santa Marta, de los ríos Manzanares y Gaira y de las aguas servidas de la ciudad de Santa Marta, en el sector de la Ecorregión Tayrona, crean un gradiente de salinidad que se incrementa hacia el suroeste; el sustrato es predominantemente arenoso en las partes someras y lodoso en las profundas (Molina, 1993). El sector comprendido entre Bocas de Ceniza, incluso hasta la bahía de Cartagena, y entre la costa y el límite exterior de la plataforma continental, está dominado por fondos lodosos y se caracteriza por la marcada influencia que ejercen las descargas continentales provenientes del río Magdalena y del sistema de ciénagas y caños asociados. No se observa una transición marcada entre la plataforma y el talud, considerando que existe un descenso gradual a partir de los 20 m de profundidad.
Frente a la Ecorregión Archipiélagos Coralinos las aguas marinas se caracterizan por una baja influencia de los aportes continentales, siendo aguas relativamente transparentes, permitiendo la formación de áreas coralinas sobre amplios mosaicos de bajos y bancos. Los sedimentos de la plataforma tienen un componente bioclástico significativo (Leble y Cuignon, 1987). Las descargas del río Atrato al sur del sector influencian fuertemente las aguas marinas, reduciendo su salinidad y penetración lumínica. Su carga sedimentaria forma una plataforma predominantemente lodo-arenosa con franjas arenosas cercanas al litoral (Javelaud, 1986).
Las condiciones climáticas en el Caribe colombiano, moduladas por la posición geográfica de la zona de convergencia intertropical y por el movimiento meridional del sistema de monzones americanos, se ven reguladas por la formación de grandes y energéticos remolinos embebidos en el patrón general del giro Colombia-Panamá, que se hacen más evidentes en los meses de julio a octubre (Andrade y Barton, 2000). Estos patrones de circulación, al interactuar con la topografía, dan indicios de ser un factor determinante en el mecanismo de retención y expulsión de larvas y huevos a lo largo de la provincia del mar Caribe (Richardson, 2005). La ocurrencia del régimen de surgencia de aguas subsuperficiales paralela a La Guajira, se manifiesta en un notorio descenso de la temperatura y un incremento de la salinidad y del contenido de nutrientes en las masas de agua superficial (ASC- agua superficial del Caribe). Esta característica determina en gran parte la elevada productividad biológica en esta región, la abundancia relativa de algunos recursos pesqueros y la inusual estructura y composición de ciertas comunidades asociadas al fondo (Andrade y Barton, 2005; Criales-Hernández et al., 2006).
El mar Caribe se encuentra bajo la influencia de casi el 20% de la descarga anual de los ríos del mundo, aportada por los ríos Amazonas y Orinoco (Müller-Karger et al., 1989). La pluma de agua dulce de estos ríos se extiende estacionalmente hacia el norte de la cuenca del Caribe, entre los meses de agosto y noviembre, luego de tres a cuatro meses del pico de lluvias estacionales en el noroeste de Suramérica. Esta pluma de agua dulce puede hacer variar los niveles de salinidad sobre los 50 m superficiales entre -37.0 al sur hasta -34.5 al norte. Estas variaciones han mostrado tener una influencia directa en la dispersión de larvas entre el oeste y este del Caribe, que logra inclusive ser interrumpida en el mes de agosto (Chérubin y Richardson, 2007).
Dentro de los límites de la Provincia Mar Caribe demarcados para el análisis se estima un área aproximada de 150000 km2, donde se alcanza una profundidad máxima de 4900 m Los sitios de colecta de muestras abarcan un ámbito batimétrico entre 16 y 930 m.
MATERIALES Y MÉTODOS
Origen de los datos
Son dos los criterios que se deben satisfacer al momento de realizar un análisis riguroso de la biodiversidad de la megafauna bentónica de cualquier sector: suficiencia en la cobertura y densidad de puntos de colecta de muestras, y homogeneidad en la nomenclatura taxonómica (Gogina y Zettler, 2010). Para satisfacer en lo posible estos requerimientos, diferentes fuentes de datos fueron consultadas para obtener datos de registros biológicos y estimaciones de parámetros físicos y químicos a partir de modelos globales.
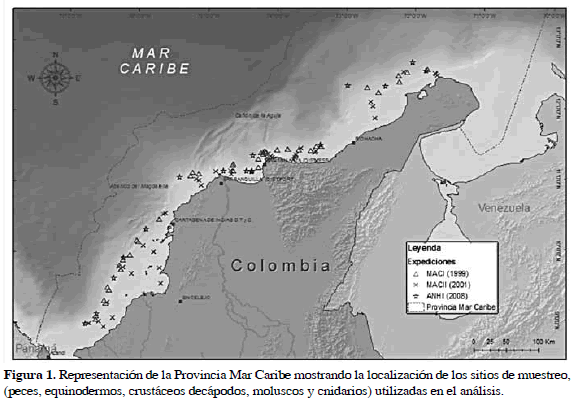
La información sobre la presencia y abundancia de especies de megafauna bentónica pertenecientes al grupo de peces, equinodermos, crustáceos decápodos, moluscos y cnidarios fueron obtenidas a partir de los registros de las expediciones Macrofauna I (1999), Macrofauna II (2001) y ANH I (2008) a bordo del buque B/I Ancón que compartieron un protocolo estandarizado de colecta (dos arrastres con red demersal, de 10 min cada uno) (INVEMAR-ANH, 2008); otros grupos, si bien presentes en las colectas, no fueron utilizados debido a la falta de identificación a la fecha. La identificación de los organismos de los grupos seleccionados, fue llevada a cabo por investigadores del Grupo de Taxonomía y Sistemática del Museo de Historia Natural Marina de Colombia. La Figura 1 muestra la localización de los sitios de arrastre sobre el fondo marino. La ocurrencia de organismos identificados a nivel de especie a lo largo de la Provincia Mar Caribe fue catalogada y analizada en un SIG (usando Access 2007 - Microsoft Office y ArcGIS 9.0 - ESRI) que incluye cerca de 7300 entradas (96 estaciones).
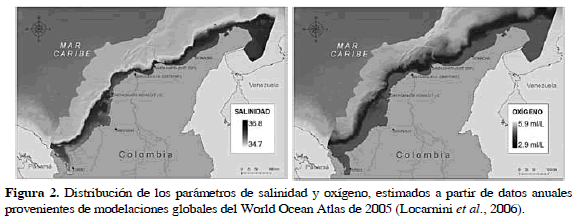
Para maximizar la aplicabilidad de la modelación propuesta sólo se seleccionaron variables ambientales que tuvieran una amplia cobertura. Los valores de las variables, salinidad, temperatura y concentración de oxígeno en el fondo, al igual que parámetros de rugosidad y pendiente derivados del modelo digital de profundidad, fueron evaluados como descriptores de ladistribución de los ensamblajes de la megafauna bentónica. La profundidad se presenta como una variable indirecta de representación de gradientes ambientales asociados (i.e. penetración de luz o temperatura). Esta variable se obtuvo del modelo digital de terreno producido por el Laboratorio de Sistemas de Información-INVEMAR a partir de la Carta Batimétrica General del Océano-GEBCO por sus siglas en inglés (General Bathymetric Chart of the Oceans) (IOC et al., 2003; GEBCO, 2009).
La estimación de variables cercanas al fondo, fue obtenida a partir del promedio de datos anuales (1970-2001) del Atlas Mundial del Océano (Locarnini et al, 2006) compilado por el National Oceanographic Data Center-NODC de la NOAA (National Oceanic and Atmospheric Administration) y disponible en formato visible con el software Ocean Data View ODV (http://odv.awi.de/). Estos descriptores fueron representados a través de grillas estandarizadas de 960 m2de tamaño de pixel (Figura 2). Si bien, la incertidumbre en la interpretación de relaciones empíricas con la distribución de las especies, aumenta al utilizar este tipo de modelaciones generales, su utilización fue forzada por la ausencia de alternativas.
Análisis y tratamiento de los datos
Diferentes expresiones de los elementos de la megafauna bentónica del margen continental fueron resumidas en índices de diversidad y de identidad taxonómica, al igual que con base en mediciones no paramétricas de sus ensamblajes. Estas expresiones fueron representadas a través de puntos o superficies que dan indicio de su estimación potencial.
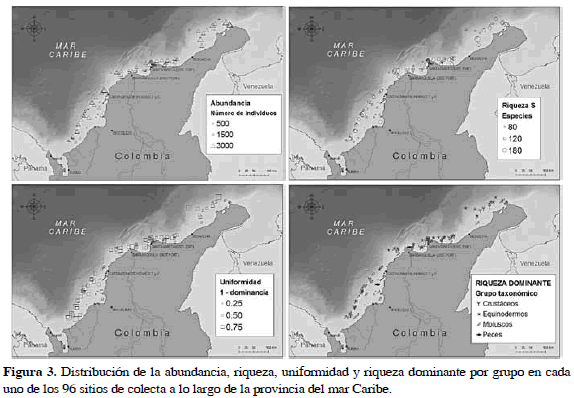
La comunidad fue examinada mediante el cálculo de la riqueza (número de especies), abundancia (número de individuos) y uniformidad (1-dominancia). Estos índices fueron representados espacialmente mediante mapas de puntos proporcionales mediante la ayuda de ArcGIS 9.0 (ESRI).
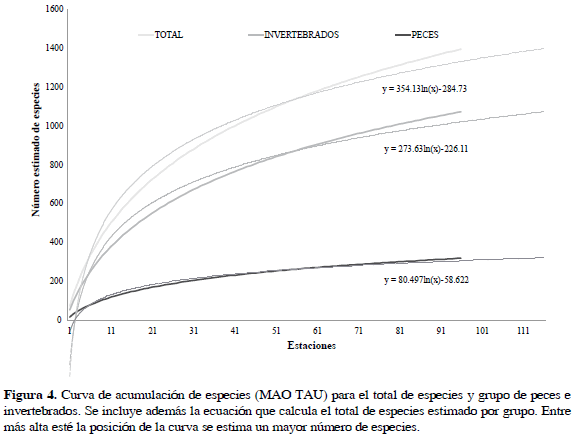
La riqueza total estimada de peces e invertebrados (equinodermos, crustáceos decápodos, moluscos y cnidarios) se obtuvo mediante la construcción de curvas de rarefacción de especies haciendo uso del software libre EstimateS 8.2 (Colwell, 2009). EstimateS usa un algoritmo de aleatorización para obtener el promedio aproximado de las especies colectadas (Sobs) que, mediante la comparación de los valores estimados de los índices, permite conocer qué porcentaje de la diversidad estimada del medio de estudio ha sido recogida en el muestreo realizado. Los estimadores Mao Tau (poco sensible a especies con individuos únicos) y Chao (sensible a especies con individuos únicos) permiten comparar visualmente la riqueza entre dos o más sitios, a través de curvas de acumulación de especies, ofreciendo intervalos de confianza de hasta un 95% (Chao, 1984); entre más elevada se encuentre la curva, mayor será la riqueza.
Con el fin de observar si las asociaciones de especies colectadas obedecían a gradientes posicionales norte/sur (latitud), se generaron perfiles del fondo mediante la ayuda de ArcGIS y se asociaron los sitios de colecta más cercanos. De cada perfil se calculó la riqueza de especies, además del número de géneros y familias encontradas.
La comparación de la distribución de ensamblajes de especies se realizó mediante un análisis de correspondencias (AC), otro método de ordenación, algo similar al de componentes principales (CP), que resulta más adecuado para datos de conteo de sitios (columnas) que contienen recuentos de taxones (filas). Las especies típicas de los ensamblajes se representan en forma de puntos en las inmediaciones de la asociación a la cual se presume su pertenencia. Estas rutinas fueron llevadas a cabo en el software PAST (Hammer, 2009). Posteriormente, los valores propios (eigenvalues) que indican la importancia relativa de la explicación en la dispersión de los datos sobre los ejes (1 y 2), se dibujaron mediante puntos sobre la representación en un mapa de los gradientes ambientales seleccionados.
Con el fin de evaluar las interacciones medioambientales, la abundancia de especies fue asumida como una variable biótica. Dado que los patrones de distribución espacial de las especies se ven influenciados por procesos biológicos estructurados por la fisiografía, la localización de los puntos de colecta se analizó espacialmente mediante la auto-correlación con valores de variables aleatorias en el espacio. Se calculó así la cantidad de auto-correlación espacial de las variables salinidad, temperatura y concentración de oxígeno en el fondo (datos abióticos) y 95 sitios de muestreo (datos de la abundancia de especies) a través del índice de Moran I utilizando el software ArcGIS 9.0 (ESRI). Para analizar la correlación entre abundancia de las especies y los correspondientes datos ambientales, se utilizó el coeficiente de correlación de Spearman en la rutina de PAST.
Para fines de representación espacial de los resultados se utilizó la ordenación como un método que contribuye a la detección de patrones sistemáticos y puede revelar zonas de transición. Por lo tanto, el análisis multivariado se llevó a cabo mediante la superposición de los resultados de agrupamiento jerárquico promedio basado en la similitud Bray-Curtis, sobre la transformación a raíz cuarta de los datos de abundancia. Las especies responsables de la clasificación se determinaron aplicando el análisis exploratorio SIMPER (rutina de PAST). Se asumió como escala temporal el periodo de tiempo comprendido entre 1998 y 2005 y como escala espacial el margen continental dentro área designada como Provincia Mar Caribe (IDEAM et al, 2007).
RESULTADOS
Estimación de la riqueza
Una matriz compuesta por 1347 especies, provenientes de 96 sitios de colecta (Figura 1), fue usada como punto de partida para los análisis propuestos. Los moluscos fueron el grupo más representativo con 474 especies, seguido por 318 especies de peces, 237 crustáceos, 190 equinodermos y 128 cnidarios. 277 especies estuvieron representadas por una única colecta, siendo en su mayoría moluscos (40%).
En términos relativos se observó una mayor abundancia (N> 1500) en el sector norte de la Provincia. Un 73% de las estaciones que contribuyeron a esta alta abundancia (23 en total) se encontraron a profundidades mayores a 150 m. Un 30% de las estaciones que concentraron la mayor riqueza (18 estaciones, S> 100), también tuvieron una alta abundancia. Esta riqueza estuvo representada principalmente en su orden por moluscos, crustáceos y equinodermos. La riqueza de peces no resultó significativa en términos relativos en estas estaciones. Los mayores valores de riqueza y diversidad fueron consistentes con aquellas estaciones donde se han colectado especies asociadas a "corales de agua fría" con capacidad de formar estructuras arrecifales (Cordes et al., 2008). Los mayores valores de riqueza específica se concentraron en el sector sur de La Guajira a casi 400 m de profundidad.
La distribución de cada uno de los grupos mayores a lo largo del Caribe puede ser observada en la Figura 3. El icono utilizado representa el grupo con mayor riqueza en cada uno de los sitios de colecta. La curva de acumulación de especies (Figura 4), tanto para el grupo de peces como de invertebrados, no alcanzó un punto de saturación como era de esperarse para ambientes marinos de aguas tropicales (Díaz y Acero, 2003).
Perfiles de distribución
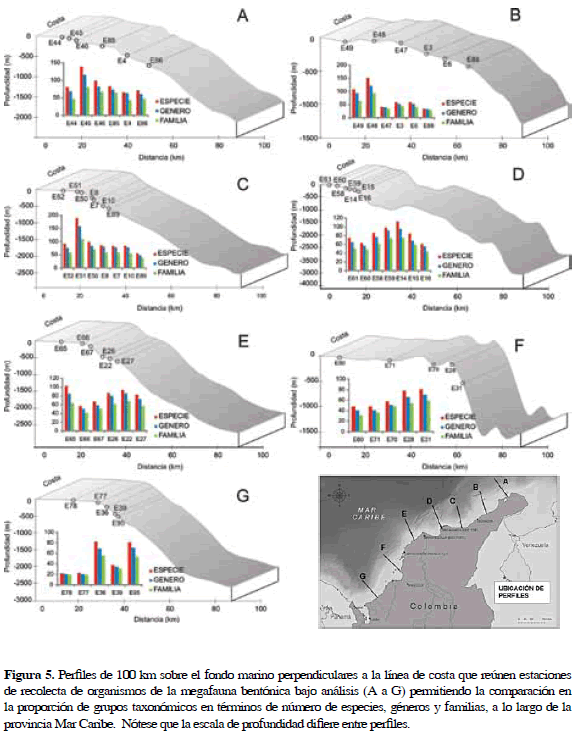
La distribución general por phylum, géneros y especies a lo largo del gradiente de profundidad, puede verse graficada en los perfiles de 1000 m de longitud, perpendiculares a la línea de costa (Figura 5). Al comparar los diagramas de barras que representan la riqueza de especies, géneros y familias en cada perfil (Figura 6), se observa que, a excepción del perfil E, los menores valores de riqueza se ubicaron cercanos a la costa. En cada uno de ellos pudo encontrarse cierta correspondencia con valores altos y el cambio en la pendiente correspondiente al cambio entre la plataforma continental y el talud continental.
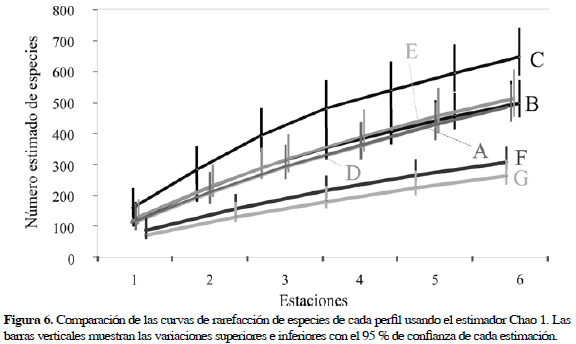
Las curvas de rarefacción de los perfiles G (201 especies) y F (249 especies) al sur se muestran más bajas. Las curvas de los perfiles A, B, C, D y E tuvieron un comportamiento muy similar, superado únicamente por la curva del perfil C al sur de La Guajira, siendo la que se mostró más pronunciada. En este perfil se contaron 9253 individuos pertenecientes a 477 especies de las cuales 148 estuvieron representadas por un único individuo.
Autocorrelación espacial
Con el fin de utilizar las técnicas de estadística espacial, se removieron del análisis ocho especies con distribución en parche (Madracis myriaster, Analcidometra armata, Astropecten antillensis, Limopsis sulcata, Ophiocamax fasciculata, Parvamussium pourtalesianum, Deltocyathus calcar y Ophiernus adspersus adspersus); se excluyeron además todas las especies con una frecuencia menor al 6% en todos los sitios de colecta (686 especies) y aquellas especies con una abundancia menor al 0.3% del total de todas las estaciones (304 especies). Usando este criterio se redujo la matriz de datos a 72 especies en 95 estaciones (una estación no contiene ninguna especie que cumpla los criterios anteriores).
Para las variables abióticas definidas en cada uno de los 95 sitios de colecta se observó una autocorrelación positiva y se asume que la hipótesis de una distribución aleatoria debe ser rechazada. Los valores del índice oscilaron entre 0.06 y 0.4, con valores de Z superiores al intervalo de confianza (2.78-14.8). El índice de valores calculados para la mayoría de las 79 especies estudiadas en el ámbito de 95 sitios de colecta osciló entre -0.04 y 0.04 con correspondientes valores de Z entre -1.14 y 2.15. Estos datos sugieren que las abundancias de las especies obedecen a un patrón general al azar. El análisis tampoco permitió encontrar un patrón de dispersión o agrupamiento en la riqueza de especies o la abundancia entre sitios de colecta.
Debido al resultado del anterior análisis, no fue posible establecer procesos subyacentes a las interacciones abióticas que puedan explicar la distribución de las especies bentónicas. Sin embargo se encontró una correlación particularmente fuerte y negativa entre la abundancia de algunas especies y la profundidad del agua.
Análisis de ensamblajes y especies discriminantes
Los datos de abundancia de las especies seleccionadas (72 especies en 95 estaciones) fueron transformados mediante raíz cuarta. En el nivel de similitud del 30% del análisis de agrupamiento jerárquico se obtuvo una división en tres grupos de sitios de colecta y un único sitio a 300 m de profundidad.
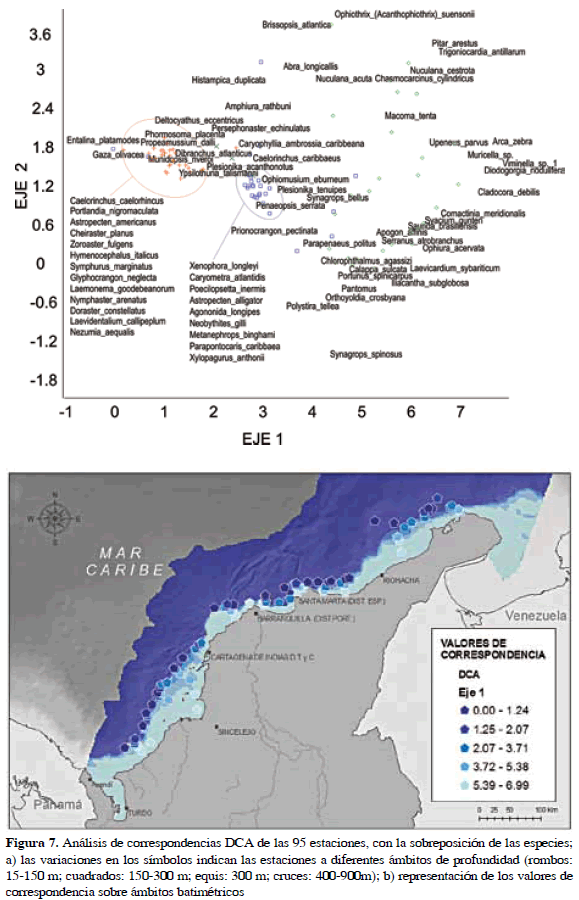
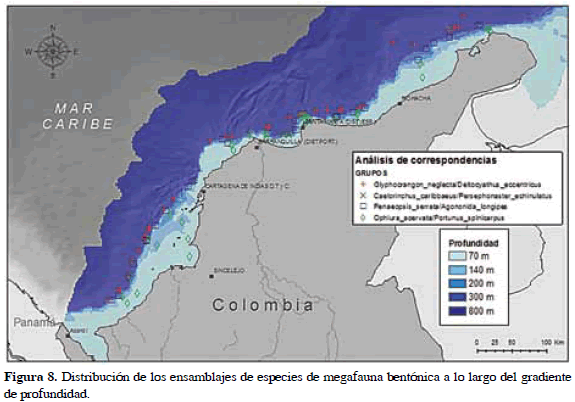
Sobre la matriz reducida se realizó el análisis de correspondencia y luego de su normalización se obtuvo el resultado mostrado en la Figura 7. Los valores explicados por el primer eje corresponden a 0.88 del total. Las especies utilizadas en el análisis fueron superpuestas al arreglo del plano; la diferencia en distancia entre las mismas indica que tan disímil es su correspondencia. Del resultado de este análisis y mediante comprobación a través del análisis de agrupamiento jerárquico, se obtuvieron tres grupos de especies o ensamblajes divididos mediante ámbito batimétricos (Figura 8).
Grupo A. Glyphocrangon neglecta/Deltocyathus eccentricus. Las especies pertenecientes a este ensamblaje fueron las colectadas en los sitios más alejados de la costa. La profundidad de los sitios de colecta varió entre 400 y 900 m de profundidad. Otras especies numéricamente dominantes incluyeron al erizo batial Phormosoma placenta, la estrella de mar Astropecten americanus y el gasterópodo Gaza olivacea. El número total de especies observadas en los sitios que componen el grupo fue de 52.
Grupo B. Penaeopsis serrata/Agononida longipes. Es el ensamblaje que agrupó los sitios de colecta entre 150 y 400 m de profundidad. Se caracteriza por ser una zona de transición fisiográfica sobre el margen continental donde las variaciones de salinidad (36±0.5) y temperatura (10±5 °C) sufren mayores cambios. Incluyó un recuento de 66 especies dentro de las cuales el pez Neobythites gilli se destacó por su abundancia.
Grupo C. Ophiura acervata/Portunus spinicarpus. Agrupó a los sitios de colecta más cercanos a la costa, sobre la plataforma continental. Comparte un número muy cercano de especies con el grupo A, (54 especies) aunque se encontraron más uniformemente distribuidas en términos de ocurrencia.
DISCUSIÓN
En general, los mayores valores de riqueza de especies encontrados con base en los sitios de colecta usados en el análisis correspondieron al sector sur de La Guajira. Si bien los análisis no permiten diferenciar una variación latitudinal (norte/sur), si se observa una disminución en el número de especies hacia el sur (Ardila, 2003). El análisis no permitió probar o desmentir la propuesta de que el sistema turbídico del Magdalena actúe como una barrera fisiográfica en la composición de las comunidades norte y sur de este fenómeno, si bien se han comprobado fuertes flujos de corrientes, depositación de sedimentos y cascajos y alta viscosidad (Bouma y Treadwell, 1975; Ercilla et al., 2002) que cambian constantemente la estabilidad de los fondos blandos de este sector.
Estos resultados, sin embargo, deben ser leídos con precaución debido a que se sabe que los ensamblajes de comunidades bentónicas son uno de los más dinámicos en términos temporales (Laine, 2003; O'Brien et al., 2003; Bonsdorff, 2006; Gogina y Zettler, 2010). A pesar de que son pocos los estudios que cuentan con un set de datos biológicos tan extenso en cobertura y en rigurosidad en la identificación de especies para la Provincia del Mar Caribe, el analizado carece de variables ambientales tomadas a escalas comparables que permitan identificar ámbitos, donde ciertas especies tengan una mayor probabilidad de ocurrencia. Un conocimiento previo de la ecología de las especies que conforman los ensamblajes, sin duda alguna, permitiría el reconocimiento de condiciones óptimas o inclusive pésimas para su establecimiento y distribución.
Los resultados del análisis sugieren que al menos algunas de las variables ambientales consideradas, tales como la profundidad, son importantes determinantes en la distribución de la riqueza y la abundancia de las especies de la megafauna bentónica. Esta distribución se comporta en concordancia con uno de los gradientes de diversidad en el mar resumidos por Levinton (1995) en el cual "la diversidad de especies de macroinvertebrados y peces aumenta con la profundidad, hasta un máximo regulado por el límite de la orla continental y luego disminuye con el aumento de distancia hacia la llanura abisal" (Gray et al., 1997). El uso del análisis de correspondencia resultó de gran ayuda en la identificación de la profundidad como factor regulador en la distribución de los ensamblajes. De la misma forma que la altitud es una fuerza reguladora de la ecología de las plantas terrestres, la profundidad puede considerarse como el factor principal en la ecología bentónica (Probert y Anderson, 1986; Engle y Summers, 1998; Bonsdorff, 2006). Esta influencia se ve claramente establecida en la comparación de riquezas por perfiles perpendiculares a la línea de costa y en la separación por similitudes entre ensamblajes. Si bien otros factores considerados como la concentración de oxígeno en el fondo (Glockzin y Zettler, 2008) y la salinidad (Zettler et al., 2007), han sido evaluados como determinantes en la distribución de comunidades macrozoobénticas, el gradiente encontrado a la escala estudiada no resulta ser significativo para regular la distribución de los ensamblajes, como lo demuestran las pruebas de autocorrelación.
Al tratar de encontrar evidencias acerca de la interacción entre variables ambientales, se hizo notoria la ocurrencia de especies muy abundantes, tales como Limopsis sulcata, Ophiocamax fasciculata y Deltocyathus calcar que, junto con cinco especies, promedian el 76% del número total de individuos en los muestreos cuantitativos que cubren un área aproximada de 40 km2 (0.5 km2 por sitio). Estas especies constituyen el punto de partida para identificar especies representativas o "especies núcleo" dentro de los ensamblajes de megafauna de este sector de la provincia. La importancia que tiene la identificación de estas especies radica en que pueden convertirse en indicadores de la estabilidad de los elementos que integran los ensamblajes de aguas profundas. Se asume que las especies representativas son elementos constantes de los ensamblajes y por lo tanto son suficientemente abundantes para encontrarse y mantener su población (Gage, 2004).
Por su parte, las especies consideradas como enigma o "raras" son responsables de la alta estimación del número de especies por unidad de área en comparación con los sistemas costeros. En la matriz de datos analizada, 280 especies fueron colectadas en una única estación y 683 especies se encontraron distribuidas con una frecuencia menor al 6% (71% del total de 1347 especies). El papel ecológico que estas especies juegan en los ensamblajes resulta incierto. Sin embargo, autores como Gage (2004) ponen en duda la teoría de que estas especies representen inmigrantes transitorios que cambian constantemente el núcleo de los ensamblajes, para ganar ventaja sólo cuando las condiciones ambientales les son favorables (Magurran y Henderson, 2003) ya que, de ser así, un crecimiento súbito en la población estaría limitado por la calidad de los recursos, forzando a una extinción local de las especies.
El presente estudio se muestra como el primero que realiza un análisis de las interacciones bentónicas-abióticas utilizando un robusto conjunto de datos biológicos en la región de la Provincia del Mar Caribe. Fue llevado a cabo con la intención de ser la base hacia el desarrollo del diseño de modelos capaces de predecir la distribución de especies de megafauna bentónica con interacciones medioambientales, proyectadas hacia el futuro. Es evidente que sólo un fragmento de la red de factores que son responsables de la distribución de las especies pudo ser cubierta con los datos disponibles. Otros descriptores ambientales, tales como la estructura de la red trófica, interacciones de depredación, corrientes, turbidez, composición química de los substratos, no se consideraron en este estudio debido a su total ausencia en la escala de análisis. La incorporación de variables adicionales y a diferentes escalas de aproximación, sin duda alguna podría entregar un mejor resultado (Engle y Summers, 1998; O'Brien et al., 2003; Stevens y Connolly, 2004). La composición sedimentológica del suelo, se espera sea uno de los factores dominantes en la escala local y responsable de las fluctuaciones de la abundancia dentro de la comunidad (Etter y Grassle, 1992).
CONCLUSIONES Y RECOMENDACIONES
Si bien el análisis realizado es capaz de representar sólo el estado momentáneo de los ensamblajes de la megafauna bentónica, se han logrado adquirir nuevos conocimientos sobre su distribución a través del análisis de diferentes factores ambientales. El análisis realizado sugiere la interpretación de profundidad, como un factor complejo que determina la distribución de los ensamblajes de megafauna bentónicos. Investigaciones futuras deberán poner a prueba el potencial de este factor para estimar, a partir de rasgos derivados, la correlación entre variables biológicas y morfológicas (depresiones, crestas, valles y pendientes), ya que es una de las técnicas más empleadas en la definición habitas (índice de posición batimétrica) en los procesos de planificación para la conservación de biodiversidad marina.
Un siguiente nivel de entendimiento, podría ser el análisis individual de la distribución de las especies responsables de las distintas asociaciones, es decir Glyphocrangon neglecta, Deltocyathus eccentricus, Penaeopsis serrata, Agononida longipes, Ophiura acervata y Portunus spinicarpus. Estas estimaciones pueden involucrar la búsqueda de características ambientales que representen o determinen la idoneidad de hábitats para estas taxa.
Si bien se está muy lejos de lograr entender los patrones de diversidad que rigen los ambientes profundos, los estudios en biodiversidad sobre estos sistemas, proveen evidencias de procesos que ocurren a gran escala, cuyas consecuencias repercuten tanto a nivel regional, como local y a menores escalas. Estas evidencias son elementos valiosos en el entendimiento de variables relacionadas con cambios en el clima, con la productividad de los sistemas que soportan actividades de extracción y de soporte como manejo a áreas con potencialidad de uso de exploración y explotación de hidrocarburos por parte de la industria.
AGRADECIMIENTOS
La autora agradece al Instituto de Investigaciones Marinas y Costeras "José Benito Vives De Andréis"- INVEMAR por el apoyo brindado en la realización de esta publicación. Asimismo, al equipo técnico y científico partícipe del proyecto "Especies, ensamblajes y paisajes de los bloques marinos sujetos a exploración de hidrocarburos Fase ANH I- Caribe" (Convenio específico de cooperación No. 008 de 2008), de la Agencia Nacional de Hidrocarburos e INVEMAR, en el cual se enmarcan los resultados. De igual forma se agradece a los revisores externos de este manuscrito, cuyos aportes y recomendaciones fueron de invaluable ayuda.
BIBLIOGRAFÍA
1 Alonso, D., L. Ramírez, C. Segura-Quintero, P. Castillo-Torres, J. M. Díaz y T. Walschburger. 2008. Prioridades de conservación in situ para la biodiversidad marina y costera de la plataforma continental del Caribe y Pacífico colombiano. Instituto de Investigaciones Marinas y Costeras-INVEMAR, The Nature Conservancy-TNC y Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales-UAESPNN, Santa Marta. 20 p. [ Links ]
2 Andrade, C. y E. D. Barton. 2000. Eddy development and motion in the Caribbean Sea. J. Geophys. Res. C: Oceans, 105 (C11): 26,191-26,201. [ Links ]
3 Andrade, C. A. y E. D. Barton. 2005. The Guajira upwelling system. Cont. Shelf Res., 25 (9): 1003-1022. [ Links ]
4 Ardila, N. E. 2003. Macrofauna marina de Colombia: Un recurso por descubrir y explorar. Col. Cien. Tecn., 21 (3): 24-31. [ Links ]
5 Bonsdorff, E. 2006. Zoobenthic diversity-gradients in the Baltic Sea: Continuous post-glacial succession in a stressed ecosystem. J. Exp. Mar. Biol. Ecol., 330: 383-391. [ Links ]
6 Bonsdorff, E. R., J. Díaz, R. Rosenberg, A. Norkko y G. R. Cutter. 1996. Characterization of soft-bottom benthic habitats of the Aland Islands, northern Baltic Sea. Mar. Ecol. Prog. Ser. 142: 235-245. [ Links ]
7 Bouma, A. H. y T. K. Treadwell. 1975. Deep-sea dune-like features. Mar. Geol., 19: M53-M59. [ Links ]
8 Chao, A. 1984. Nonparametric estimation of the number of classes in a population. Scand. J. Statist., 11: 265-270. [ Links ]
9 Chérubin, L. M. y P. L. Richardson. 2007. Caribbean current variability and the influence of the Amazon and Orinoco freshwater plumes. Deep Sea Res. Part I. Oceanogr. Res. Pap., 54 (9): 1451-1473. [ Links ]
10 Colwell, R. K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. Guía de usuario y aplicación en: http://purl.oclc.org/estimates. 22/09/2010. [ Links ]
11 Cordes, E. E., M. P. McGinley, E. L. Podowski, E. L. Becker, S. Lessard-Pilon, S. T. Viada y C. R. Fisher. 2008. Coral communities of the deep Gulf of Mexico. Deep Sea Res. Part I Oceanogr. Res. Pap., 55 (6): 777-787. [ Links ]
12 Córdoba-Tejada, M. 1997. Macrofauna bentónica asociada a fondos blandos de la plataforma continental de Pozos Colorados y El Rodadero. Tesis de grado, Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 106 p. [ Links ]
13 Costello, M. J., M. Coll, R. Danovaro, P. Halpin, H. Ojaveer y P. Miloslavich. 2010. A census of marine biodiversity knowledge, resources, and future challenges. PLoS ONE, 5 (8): e12110. [ Links ]
14 Críales-Hernández, M. I., C. B. García y M. Wolff. 2006. Flujos debiomasa y estructura de un ecosistema de surgencia tropical en La Guajira, Caribe colombiano. Rev. Biol. Trop., 54 (4): 1257-1282. [ Links ]
15 Day, J. C. y J. C. Roff. 2000. Planning for representative marine protected areas. A framework for Canada's Oceans. Report prepared for World Wildlife Fund, Toronto. 147 p. [ Links ]
16 Diaz, J. M. y A. Acero P. 2003. Marine biodiversity in Colombia: Achievements, status of knowledge and challenges. Gayana, 67 (2): 261-274. [ Links ]
17 Diaz, J. M. y D. I. Gómez. 2000. Programa nacional de investigación en biodiversidad marina y costera (PNIBM). INVEMAR, FONADE y MMA, Santa Marta. 80 p. [ Links ]
18 Díaz-Pulido, G., J. A. Sánchez, S. Zea, J. M. Díaz y J. Garzón-Ferreira. 2004. Esquemas de distribución espacial en la comunidad bentónica de arrecifes coralinos continentales y oceánicos del Caribe colombiano. Rev. Acad. Col. Cien. Exac. Fis. Nat., 28 (108): 337-347. [ Links ]
19 Engle, V. y J. K. Summers. 1998. Determining the causes of benthic condition. Env. Mon. Assess., 51: 381-397. [ Links ]
20 Ercilla G., B. Alonso, F. Estrada, F. Chiocci, J. Baraza y M. Farran. 2002. The Magdalena turbidite system (Caribbean Sea): present-day morphology and architecture model. Mar. Geol., 185 (3-4): 303-318. [ Links ]
21 Etter, R. J. y J. F. Grassle. 1992. Patterns of species diversity in the deep sea as a function of sediment particle size diversity. Nature, 360: 576-578. [ Links ]
22 Flach, E. y W. de Bruin. 1999. Diversity patterns in macrobenthos across a continental slope in the NE Atlantic. J. Sea Res., 42 (4): 303-323. [ Links ]
23 Gage, J. D. 2004. Diversity in deep-sea benthic macrofauna: the importance of local ecology, the larger scale, history and the Antarctic. Deep Sea Res. Part II: Topical Stud. Oceanogr., 51 (14-16): 1689-1708. [ Links ]
24 GEBCO. 2009. General Bathymétrie Chart of the Oceans. GEBCO_08 Grid, http://www.gebco.net/about_us/. 10/08/2010. [ Links ]
25 Glockzin, M. y M. L. Zettler. 2008. Spatial macrozoobenthic distribution patterns in relation to major environmental factors- A case study from the Pomeranian Bay (southern Baltic Sea). J. Sea Res., 59 (3): 144-161. [ Links ]
26 Glockzin, M., M. Gogina y M. L. Zettler. 2009. Beyond salty reins-modeling benthic species' spatial response to their physical environment in the Pomeranian Bay (Southern Baltic Sea). Baltic Coast. Zone, 13 (3): 79-95. [ Links ]
27 Gogina M. y M. L. Zettler. 2010. Diversity and distribution of benthic macrofauna in the Baltic Sea: Data inventory and its use for species distribution modelling and prediction. J. Sea Res., 64 (3): 313-321. [ Links ]
28 Gray, J. S., G. C. B. Poore, K. I. Ugland, R. S. Wilson, F. Olsgard y O. Johannessen. 1997. Coastal and deep-sea benthic diversities compared. Mar. Ecol. Progr. Ser., 159: 97-103. [ Links ]
29 Guzmán, A. y N. E. Ardila. 2004. Estado de los fondos blandos en Colombia: 2003. 183-198. En: INVEMAR (Ed.). Informe del estado de los ambientes marinos y costeros en Colombia: Año 2003. Serie de Publicaciones Periódicas No. 8, Instituto de Investigaciones Marinas y Costeras- INVEMAR, Santa Marta. 329 p. [ Links ]
30 Guzmán-Alvis, A. y J. M. Díaz. 1993. Distribución espacial de la taxocenosis Annelida-Mollusca en la plataforma continental del golfo de Salamanca, Caribe colombiano. Bol. Invest. Mar. Cost., 22 (1): 45-59. [ Links ]
31 Hammer, O. 2009. PAST Paleontological Statistics. Reference manual. Versión 1.96, Natural History Museum, University of Oslo, Oslo. 191 p. [ Links ]
32 IDEAM, IGAC, IAvH, IIAP, INVEMAR y SINCHI. 2007. Ecosistemas continentales, costeros y marinos de Colombia. Instituto de Hidrología, Meteorología y Estudios Ambientales; Instituto Geográfico Agustín Codazzi; Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt; Instituto de Investigaciones Ambientales del Pacífico John von Neumann; Instituto de Investigaciones Marinas y Costeras-INVEMAR e Instituto Amazónico de Investigaciones Científicas Sinchi, Bogotá D.C. 276 p. [ Links ]
33 INVEMAR-ANH. 2008. Especies, ensamblajes y paisajes de los bloques marinos sujetos a exploración de hidrocarburos. Informe técnico final, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 461 p. [ Links ]
34 IOC, IHO y BODC. 2003. Centenary edition of the GEBCO digital atlas. General Bathymetric Chart of the Oceans, Intergovernmental Oceanographic Commission e International Hydrographic Organization, British Oceanographic Data Centre, Liverpool. CD-ROM. [ Links ]
35 Javelaud, O. 1986. Sedimentología de la plataforma continental del Caribe colombiano. Bol. Cient. CIOH, 6: 17-39. [ Links ]
36 Laine, A. O. 2003. Distribution of soft-bottom macrofauna in the deep open Baltic Sea in relation to environmental variability. Est. Coast. Shelf Sci., 57 (1-2): 87-97. [ Links ]
37 Leble, S. y R. Cuignon. 1987. El archipiélago de las islas del Rosario, estudio morfológico, hidrodinámico y sedimentológico. Bol. Cient. CIOH, 7: 37-52. [ Links ]
38 Levinton, J. S. 1995. Marine biology: function, biodiversity, ecology. Oxford Univ. Press, Nueva York. 420 p. [ Links ]
39 Locarnini, R. A., A. V. Mishonov, J. I. Antonov, T. P. Boyer y H. E. Garcia, 2006. World Ocean Atlas 2005. Ed. NOAA Atlas NESDIS 61, U.S. Government Printing Office, Washington D.C. 182 p. [ Links ]
40 Magurran, A. E. y P. A. Henderson. 2003. Explaining the excess of rare species in natural species abundance distributions. Nature, 422: 714-716. [ Links ]
41 Margules, C. R., R. L. Pressey y P. H. Williams. 2002. Representing biodiversity: data and procedures for identifying priority areas for conservation. J. Biosci., 27 (Suppl. 2): 309-326. [ Links ]
42 Miloslavich, P., J. M. Díaz, E. Klein, J. J. Alvarado, C. Diaz, J. Gobin, E. Escobar-Briones, J. J. Cruz-Motta, E. Weil, J. Cortés, A. C. Bastidas, R. Robertson, F. Zapata, A. Martín, J. Castillo, A. Kazandjian y M. Ortiz. 2010. Marine biodiversity in the Caribbean: Regional estimates and distribution patterns. PLoS ONE, 5 (8): e11916. [ Links ]
43 Molina, A. 1993. Estudio sedimentológico y morfológico de la plataforma continental Caribe entre el sector de Santa Marta y Punta Morro Hermoso. Bol. Cient. CIOH, 14: 67-78. [ Links ]
44 Müller-Karger, F. E., C. R. McClain, T. R. Fisher, W. E. Esaias y R. Varela. 1989. Pigment distribution in the Caribbean sea: Observations from space. Progr. Oceanogr., 23 (1): 23-64. [ Links ]
45 Navas, G., L. S. Mejía, N. Ardila y J. Reyes. 2002. Caracterización y catalogación de la macrofauna marina del Caribe colombiano, Fase 2. Informe técnico final, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 14 p. [ Links ]
46 O'Brien, K., J. Hanninen, T. Kanerva, L. Metsarinne e I. Vuorinen. 2003. Macrobenthic zonation in relation to major environmental factors across the Archipelago Sea, northern Baltic Sea. Boreal Environ. Res., 8: 159-170. [ Links ]
47 Probert, P. K. y P. W. Anderson. 1986. Quantitative distribution of benthic macrofauna off New Zealand, with particular reference to the west coast of the South Island. N. Z. J. Mar. Fresh. Res., 20 (2): 281-290. [ Links ]
48 Richardson, P. L. 2005. Caribbean current and eddies as observed by surface drifters. Deep Sea Res. Part II: Topical Stud. Oceanogr., 52 (3-4): 429-463. [ Links ]
49 Roff, J. C. y M. E. Taylor. 2000. National frameworks for marine conservation - a hierarchical geophysical approach. Aq. Conserv.: Mar. Freshw. Ecosyst, 10 (3): 209-223. [ Links ]
50 Sherman, K. y G. Hempel (Eds.). 2008. The UNEP Large Marine Ecosystem Report: A perspective on changing conditions in LMEs of the world's Regional Seas. UNEP Regional Seas Report and Studies No. 182, United Nations Environment Program, Nairobi, Kenya. 22 p. [ Links ]
51 Spalding, M. D., H. E. Fox, G. R. Allen, N. Davidson, Z. A. Ferdaña, M. Finlayson, B. S. Halpern, M. A. Jorge, A. Lombana, S. A. Lourie, K. D. Martin, E. McManus, J. Molnar, C. A. Recchia y J. Robertson. 2007. Marine ecoregions of the world: a bioregionalization of coastal and shelf areas. Bioscience, 57 (7): 573-583. [ Links ]
52 Stevens, T. y R. M. Connolly. 2004. Testing the utility of abiotic surrogates for marine habitat mapping at scales relevant to management. Biol. Conserv., 119 (3): 351-362. [ Links ]
53 Sullivan, K. y G. Bustamante. 1999. Setting geographic priorities for marine conservation in Latin America and the Caribbean. The Nature Conservancy, Arlington, Estados Unidos. 125 p. [ Links ]
54 Vernette, G., A. Mauffret, C. Bobier, L. Briceno y J. Gayet. 1992. Mud diapirism, fan sedimentation and strike-slip faulting, Caribbean Colombia Margin. Tectonophysics, 202: 335-349. [ Links ]
55 Zacharias, M. A. y J. C. Roff. 2000. A hierarchical ecological approach to conserving marine biodiversity. Cons. Biol., 14: 1327-1334. [ Links ]
56 Zettler, M. L., D. Schiedek y B. Bobertz. 2007. Benthic biodiversity indices versus salinity gradient in the southern Baltic Sea. Mar. Pollut. Bull., 55: 258-270. [ Links ]
FECHA DE RECEPCIÓN: 27/10/2010 FECHA DE ACEPTACIÓN: 07/07/2011
*Contribución No. 1084 del Instituto de Investigaciones Marinas y Costeras - INVEMAR.