Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.40 no.2 Santa Marta July/Dec. 2011
EVALUACIÓN DEL POTENCIAL ANTIDEPREDADOR DE LOS EXTRACTOS ORGÁNICOS CRUDOS DE QUINCE ESPONJAS MARINAS*
EVALUATION OF THE FEEDING DETERRENT POTENTIAL OF CRUDE ORGANIC EXTRACTS FROM FIFTEEN MARINE SPONGES
Jazmín Arias1, Marisol Santos-Acevedo2 y Federico Newmark-Umbreit3
1 Universidad Nacional de Colombia, Departamento de Biología, Ciudad Universitaria, Bogotá, Colombia, jariash@bt.unal.edu.co
2 Instituto de Investigaciones Marinas y Costeras-INVEMAR, Cerro Punta Betín, Santa Marta, Colombia, msantos@invemar.org.co
3 Centro de Investigación de la Acuiucultura en Colombia (CENIACUA), Bogotá, Colombia, fnewmark@ceniacua.org
RESUMEN
Todos los organismos han desarrollado evolutivamente mecanismos que les permiten defenderse de otros, garantizar su permanencia temporalmente y evitar el ataque de depredadores. Uno de estos mecanismos es la defensa química, mediante la cual los depredadores potenciales de los organismos son disuadidos de consumir su presa. En este estudio se evaluó la capacidad disuasora de los extractos orgánicos crudos de quince esponjas marinas del Caribe colombiano, sobre el pez arrecifal generalista Stegastes partitus. Se encontró que el extracto de Cribrochalina infundibulum actuó como un atrayente para estos depredadores potenciales, mientras que sólo los extractos de las esponjas Dragmacidon reticulata, Petromica cyocaliptoides, Neopetrosia proxima, Myrmekioderma gyroderma y Biemna cribaria fueron disuasores; además, se observó que esas tres últimas esponjas también cuentan con aparentes defensas físicas, indicando que la presencia de mecanismos de defensa químicos y físicos no son necesariamente excluyentes.
PALABRAS CLAVE: Ecología química, Disuasión alimentaria, Extracto orgánico crudo, Esponjas marinas.
ABSTRACT
Organisms have developed diverse mechanisms during their evolution, to defend themselves from predators and competitors, in order to ensure temporal permanence. One of these mechanisms is chemical defense. Chemical substances are used by some organisms to deter potential predators from devouring them. This paper evaluates the efficacy of the organic crude extracts of fifteen different marine sponges from the Colombian Caribbean to deter a potential predator, the generalist reef fish Stegastes partitas. It was found that Cribrochalina infundibulum extract acted as a feeding-attractant to this particular predator, while only the extracts from Dragmacidon reticulata, Petromica cyocaliptoides, Neopetrosia proxima, Myrmekioderma gyroderma and Biemna cribaria were feeding deterrents; it was also observed that the latter three also presented apparent physical defenses, showing that chemical and physical defenses are not necessarily excluding.
KEY WORDS: Chemical ecology, Feeding deterrence, Crude organic extract, Marine sponges.
INTRODUCCIÓN
Diversos estudios sugieren que la intensidad de herbivoría y depredación es mayor en el trópico en comparación con regiones de latitudes mayores. Por lo tanto, los niveles de defensa de las presas potenciales, deberían ser mayores en hábitats tropicales, especialmente en arrecifes coralinos, donde existe un alto grado de heterogeneidad ambiental y una gran diversidad de depredadores entre los cuales se destacan los peces (Green y Bakus, 1974; Hay, 1996; Cronin et al., 1997). Sin embargo, existe muy poca evidencia experimental directa que soporte la hipótesis de que las presas de zonas templadas son más susceptibles a consumidores, o que las presas de zonas tropicales han desarrollado defensas más fuertes (Hay, 1996). Al parecer, la intensidad de las defensas (químicas, físicas o una combinación de éstas) está directamente relacionada con variables ecológicas, como la presión que ejercen los depredadores (Duffy et al., 1992; McClintock et al., 1997; Bakker, 2000).
La abundancia de muchos organismos sésiles es determinada a menudo por las actividades de depredadores y forrajeros móviles vertebrados e invertebrados (Puyana, 2002). Al parecer, los peces son los consumidores más importantes en las comunidades bentónicas arrecifales tropicales (Pawlik, 1997) y son considerados como la mayor amenaza para los invertebrados que viven en los arrecifes, debido a su capacidad móvil, tasas de alimentación, tamaño y abundancia (Puyana, 2002). Entretanto, las esponjas parecen ser físicamente vulnerables a la depredación, ya que son organismos sésiles de cuerpo blando que se encuentran en una abundancia relativamente alta (carecen de un caparazón mineralizado o exoesqueleto rígido) (Chanas y Pawlik, 1995, 1996; Chanas et al., 1996; McClintock et al., 1997; Wilson et al., 1999; Bakker, 2000).
La baja cantidad de especies de peces esponjívoros (Randall y Hartman, 1968), indicaría que los caracteres disuasivos de las esponjas (escleritos mineralizados, sustancias químicas disuasoras y componentes fibrosos rígidos) son altamente efectivos en la disuasión de la alimentación, destacando la defensa química (Braekman y Daloze, 1986; Pawlik, 1993; Wilson et al., 1999), como la principal estrategia de las esponjas caribeñas contra peces arrecifales (Pawlik et al., 1995; Chanas y Pawlik, 1995; McClintock, 1997).
Se ha determinado que los depredadores generalistas son normalmente disuadidos por la química de las esponjas, pero no por elementos estructurales, rigidez, o calidad nutricional de los tejidos de esponja (McClintock, 1987; Chanas y Pawlik, 1996; Pawlik, 1997); los peces esponjívoros son consumidores selectivos que enfocan sus actividades depredadoras en especies crípticas preferidas y especies arrecifales paladeables, también tienden a escoger las especies químicamente indefensas (incluso a varios metros de distancia) y tienen gran impacto en la distribución y abundancia de las esponjas en los arrecifes caribeños, restringiendo algunas especies a refugios (Dunlap y Pawlik, 1996; Pawlik, 1997).
Actualmente, varios estudios indican que la calidad nutricional de las presas, el tamaño, la movilidad, la abundancia y sus defensas químicas, trabajan en concierto para afectar la susceptibilidad a consumidores (Duffy y Paul, 1992; Van Alstyne y Paul, 1992; Wulff, 1995, 1997; Hay, 1996; McClintock et al, 1997). Sin embargo, para la gran mayoría de compuestos que disuaden a los consumidores no se sabe si afectan la sobrevivencia, el crecimiento o fecundidad, o si simplemente tienen un mal sabor y se evitan a pesar de que no perjudiquen el éxito reproductivo de los consumidores (Hay, 1996).
Si los compuestos disuasores de la depredación se han originado de forma coyuntural sobre el tiempo evolutivo, se esperaría encontrar ejemplos de presencia de estos compuestos en grupos emparentados de especies crípticas y expuestas, con una mayor incidencia de toxicidad en especies expuestas, en donde la depredación de peces, y por lo tanto las presiones selectivas, son más intensas. Aunque hay un porcentaje relativamente alto de especies expuestas que exhiben defensas químicas, también hay algunas especies crípticas que las presentan (Bakus, 1981). Asimismo, la presencia o ausencia de ciertos depredadores potenciales, parece influir en las defensas químicas que producen las esponjas, es decir, en áreas donde la presión por depredadores es mayor la esponja tendería a producir más metabolitos disuasores que aquellas en donde la depredación es menor (McClintock et al., 1997; Wright et al, 1997).
Entre los estudios que se han realizado para evaluar el efecto del consumo de esponjas marinas sobre depredadores potenciales, se encuentran algunos que permiten un mayor entendimiento ecológico de las defensas químicas, ya que involucran características biológicas de los organismos en cuestión (Duffy y Paul, 1992; Van Alstyne y Paul, 1992; Pawlik et al., 1995; Uriz et al., 1996; Cronin et al., 1997; McClintock et al., 1997) y la variación en producción y concentración de las defensas químicas en las partes expuestas a los depredadores, lo que finalmente determinaría si un organismo es consumido o no (Becerro et al., 1998; Swearingen III y Pawlik, 1998).
Igualmente, se han evaluado las propiedades disuasoras de compuestos aislados de varias esponjas (Chanas y Pawlik, 1995; Chanas et al., 1996; Hassan et al., 2004). Sin embargo, a pesar de que probar compuestos individuales provee información interesante sobre la actividad de dicho compuesto, no brinda datos suficientes sobre los efectos ecológicos de todos los metabolitos presentes en el organismo (Wright et al., 1997); es decir que suministra información química relevante pero no ecológica. Por lo tanto, ese tipo de evaluaciones y pruebas son relevantes en estudios que buscan dilucidar las actividades y estructuras químicas de los compuestos, con miras a una aplicación biotecnológica o química; sin embargo, no son pertinentes para estudios que pretenden entender las relaciones ecológicas de los organismos con su entorno, pues aquellos se relacionan con este a través de una mezcla de compuestos.
En este trabajo se evaluó el efecto disuasor de los extractos orgánicos crudos de quince esponjas marinas (Spirastrella coccinea, Cinachyrella kuekenthali, Dragmacidon reticulata, Halichondria sp., Petromica ciocalyptoides, Oceanapia peltata, Iotochrota inminuta, Myrmekioderma rea, Neopetrosia proxima, Desmapsamma anchorata, M. gyroderma, Biemna cribaria, Oceanapia bartshi, Cribrochalina infundibulum y Cervicornia cuspidifera) sobre la alimentación del pez arrecifal generalista Stegastes partitus, obteniendo una aproximación clara a las implicaciones ecológicas de la interacción entre las esponjas y sus potenciales depredadores, pues hubo un acercamiento a las razones que justifican la ausencia o presencia de depredación sobre dichos organismos. Se han realizado algunos estudios ecológicos y de ecología química sobre algunas de estas especies de esponjas. Por ejemplo, de S. coccinea se han aislado algunos de sus macrólidos (Williams et al., 2003, 2007) con actividad antimitótica (que pueden evitar el asentamiento de otros organismos sobre la esponja o en sus cercanías), se han elucidado estructuralmente (Desjardine, 2007; Warabi et al., 2007) y se han sintetizado (Paterson et al., 2005a, 2005b, 2006, 2007; Fürstner et al., 2007; Smith III y Kim, 2007, 2010; Keaton y Phillips, 2008; Smith III et al., 2010), lo que permite realizar experimentos clínicos de inhibición mitótica. En O. bartschi se ha aislado e identificado el diterpeno Ambliol A con actividad antimicrobiana (logrando evitar procesos iniciales de epibiosis) (Cafieri et al., 1993). En P. ciocalyptoides se aisló el sulfato de halistatol A (Kossuga et al., 2007). En D. anchorata se determinó que la depredación y la competencia entre especies son parte de la dinámica poblacional (Wulff, 2005) y que la acción recíproca de factores físicos y biológicos juegan un papel clave en la estructuración y organización de comunidades (Mclean y Yoshioka, 2008), se detectó que presentan explotación de mutualismo de otras especies de esponjas (Wulff, 2008), además se han caracterizado varios ácidos grasos fosfolipídicos (Carballeira y Shalabi, 1994), alquilos gliceroles monoéteres libres (Quijano et al., 1994) y se ha elucidado la estructura de algunos ácidos grasos (Rod'kina, 2005). En C. cuspidifera y N. proxima se han realizado estudios poblacionales (Wulff, 2006) y en C. infundibulum se determinó que no hay un sinergismo entre defensas físicas y químicas y que sus espículas son disuasoras (Jones et al, 2005). Estos estudios han permitido una aproximación continua a las interacciones de estos organismos con su entorno biológico.
ÁREA DE ESTUDIO
Este estudio se llevó a cabo en el sector costero de Santa Marta, en las estribaciones de la Sierra Nevada de Santa Marta. El clima es marcadamente estacional y presenta contrastes en sus diferentes lugares, debido a un gradiente fuerte de precipitación y humedad en los extremos del sector. Se presenta una época seca y una época lluviosa. La primera va de diciembre a marzo y la segunda de abril a noviembre, con los mayores picos de pluviosidad en mayo y septiembre-octubre (Van der Hammen, 1984; Lozano, 1986).
Por el efecto de la brisa y de los vientos alisios, paralelos al litoral, en las estribaciones de la Sierra Nevada de Santa Marta se presenta un núcleo bien definido de afloramiento o surgencia de aguas subsuperficiales. Este núcleo, junto con el de la península de La Guajira, mantiene una variabilidad bastante significativa tanto en intensidad (21.8-25.5 °C) como en cobertura, produciéndose así un aporte de nutrientes a las aguas superficiales empobrecidas por el consumo biológico. Estas características tan particulares de la oceanografía y morfología del área de estudio, hacen que se encuentre una mayor diversidad de esponjas a profundidades menores que en otras regiones del Caribe, lo cual facilita los estudios de bioprospección (Parra-Velandia y Zea, 2003).
MATERIALES Y MÉTODOS
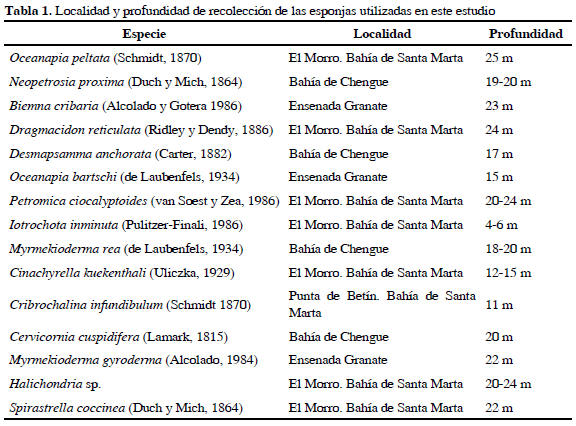
Las esponjas fueron recolectadas mediante buceo autónomo en la región de Santa Marta en diferentes sectores y a distintas profundidades (Tabla 1), tomando aproximadamente 600 g de cada especie de esponja (provenientes de cuatro especímenes en promedio), se introdujeron en bolsas plásticas (sellopack) y se marcaron con fecha, localidad y hora. Se registraron las características de los organismos en su ambiente natural, tales como forma, coloración, consistencia y características de superficie y aberturas. Las esponjas se trasladaron a temperatura ambiente al Instituto de Investigaciones Marinas y Costeras-INVEMAR; una vez allí, se conservó una muestra testigo en etanol, se realizó la identificación de los especímenes y se depositaron en el Museo de Historia Natural Marina de Colombia. El resto se congeló a -15 °C para evitar la degradación de los metabolitos.
Las esponjas fueron lavadas con agua destilada para retirar la arena presente y se limpiaron cuidadosamente para eliminar otros organismos; se fragmentaron con ayuda de cuchilla de disección número 10 y se realizaron mediciones volumétricas individuales de los fragmentos de esponja húmeda que serían sometidos a liofilización y extracción, en una probeta con agua de mar filtrada, con el fin de determinar la concentración de extracto en las esponjas. Posteriormente, los tejidos de las esponjas fueron sometidos a liofilización, tras lo cual se prepararon los extractos orgánicos crudos de cada esponja (filtrando la solución resultante con ayuda de un Kitasato) y se concentraron en rotavapor; primero se empleó como solvente (400 mL) metanol grado analítico y posteriormente, metanol:diclorometano (mismo volumen en proporción 2:1). Finalmente, se mezclaron los extractos en los diferentes solventes. Cabe anotar que los extractos no contenían escleritos ni arena.
Se seleccionó el pez damisela bicolor, Stegastes partitus (Pomacentridae) como depredador potencial para los ensayos de disuasión, ya que se presenta en abundancia en los sitios de recolección de las esponjas, y aunque se alimentan principalmente de algas, también consumen poliquetos, hidroides, copépodos (calanoides y harpacticoides), tanaidáceos, isópodos, anfípodos y ascidias (Cervigón, 1993; Aguilar, 2005), que pueden obtener del interior de algunas esponjas, o consumirlas ocasionalmente. De hecho, estudios previos han mostrado que especies herbívoras de peces se alimentan de algunas especies de esponjas crípticas (Wulff, 1997).
Se recolectaron 18 individuos del pez S. partitus (en Punta Betín) y después de someterlos a un periodo de aclimatación de aproximadamente 30 minutos, se ubicaron en acuarios independientes y se dejaron en ayuno durante 24 horas. Durante los siguientes siete días se alimentaron dos veces al día con el fin de habituar a los peces a la alimentación artificial.
Los pellets control se prepararon con harina de trigo y de manto de calamar liofilizado y macerado (Chaves, 2003). Se mezclaron 3 g de harina de trigo con 0.7 g de harina de manto de calamar y 1.5 mL de agua desionizada. Los pellets tratamiento se prepararon mezclando 1 g de harina de trigo con 0.15 g de manto de calamar macerado, 0.3 mL de agua desionizada y la cantidad de extracto volumétricamente equivalente a 1.2 mL de esponja (volumen total de alimento preparado para cada ensayo con extractos) (0.39 mL para C. infimdibulum, 0.43 mL para B. cribaria, 0.31 mL para C. kuekenthali, 0.37 mL para M. gyroderma, 0.20 mL para N. proxima, 0.66 mL para C. cuspidifera, 0.58 mL para M. rea, 0.16 mL para D. anchorata, 0.20 mL para P. ciocalyptoides, 0.19 mL para D. reticulata, 0.38 mL para O. bartschi, 0.29 mL para Halichondria sp., 0.14 mL para I. imminuta, 0.16 mL para O. peltata y 0.7 mL para S. coccinea). Una vez se tuvo la preparación, se fraccionó la mezcla manualmente en pellets de 3 mm de diámetro.
Para el experimento, los peces se alimentaron en el horario acostumbrado y una hora después de la comida, se hizo la prueba de disuasión. Se inició ofreciendo un pellet control a un pez, si no lo ingería, no se tenía en cuenta y se probaba con otro; si lo ingería, se esperaba un momento y se le ofrecía un pellet con extracto; si lo rechazaba, vomitaba o simplemente lo ignoraba, se le ofrecía otro pellet control; si lo consumía, se marcaba como disuasor, si no lo ingería, no se tenía en cuenta y se probaba con otro pez. Si ingería el pellet con extracto se marcaba como no disuasor (Daza y Vélez, 2003). La prueba se realizó hasta que diez peces aceptaron o rechazaron claramente los pellets con extracto.
Este experimento se repitió cuatro veces con cada extracto (en el mismo grupo de peces), con el fin de determinar un valor promedio de pellets consumidos. De acuerdo con la prueba estadística exacta de Fisher (Siegel y Castellan, 1988), hay un rechazo significativo si seis peces o menos consumen los pellets tratamiento. La metodología seguida en este estudio ha sido adaptada de Pawlik et al. (1995).
RESULTADOS
De acuerdo con la Figura 1, únicamente las esponjas D. reticulata, P. cyocaliptoides, N. proxima y B. cribaria fueron disuasoras de la alimentación por parte del pez arrecifal generalista S. partitus. Adicionalmente, en el último experimento con los extractos de N. proxima, C. cuspidifera, D. reticulata, O. peltata y B. cribaria se incrementó el número de pellets rechazados.
Así mismo, se detectó en los cuatro primeros tratamientos mencionados, que los peces comieron el pellet, luego lo escupieron, lo comieron de nuevo y finalmente lo escupieron; en el caso de O. peltata, S. coccinea, O. bartschi, I. inminuta, H. lutea, D. anchorata, M. rea, C. cuspidifera y C. kuekenthali los peces escupieron el pellet una vez antes de ingerirlo; mientras que en el caso de C. infundibulum los peces consumieron inmediatamente el pellet y en forma voraz.
DISCUSIÓN
Se seleccionó la adición volumétrica de los extractos al alimento, porque esta metodología tiene la ventaja de ser aparentemente más precisa que la gravimétrica, ya que tiene en cuenta la concentración de las sustancias disuasoras presentes en los tejidos frescos (con agua) de las esponjas (Pawlik, 1993). En el caso de N. proxima, C. cuspidifera, D. reticulata, O. peltata y B. cribaria se observó un efecto disuasor positivo sobre la alimentación de los peces S. partitus, además de un aparente inicio de un proceso de aprendizaje, ya que en el último ensayo, el número de pellets rechazados se incrementó en uno; sin embargo son necesarios estudios temporalmente más significativos para poder determinar si efectivamente hay un aprendizaje.
Parece que cuando un organismo presenta defensas físicas no requiere defensas químicas o por lo menos, no son tan fuertes. Por ejemplo, se considera que la arena incluida entre los tejidos y su rigidez, puede hacer que las esponjas sean impaladeables para los depredadores, actuando directamente como un disuasor de la alimentación o indirectamente, reduciendo la calidad nutricional de la esponja y la producción de metabolitos bioactivos (Bakus, 1981; Wright et al., 1997), por lo que podría esperarse que las esponjas que tienen estas características tendrán baja o nula actividad disuasora química. Sin embargo, en este estudio encontramos que los extractos de B. cribaria (especie que en la naturaleza incorpora mucha arena y restos de conchas), M. gyroderma (presenta sedimentos en la superficie) y N. proxima (posee tejidos bastante rígidos) disuadieron a los depredadores, lo que indica que a pesar de las aparentes defensas físicas, las defensas químicas pueden llegar a constituirse como un mecanismo más efectivo en la prevención de la depredación en ciertos casos (Chanas y Pawlik, 1995).
A pesar de que se ha propuesto que algunos invertebrados marinos que carecen de protección física pueden usar estrategias defensivas alternativas como la defensa química, y que a su vez los organismos con defensas físicas no necesitan invertir en la producción de metabolitos disuasores (Wilson et al., 1999; Puyana, 2002), las esponjas mencionadas podrían ser un ejemplo de la acción conjunta de estrategias físicas y químicas para disuadir a los depredadores. Esto podría ser un indicio de que las defensas físicas pueden disuadir a los depredadores, pero sólo efectivamente en combinación con otros mecanismos (Bakker, 2000; Burns e Han, 2003), lo que sugiere que la presencia de defensas químicas y físicas no son mutuamente excluyentes (Chanas y Pawlik, 1995). Sin embargo, sería necesario comprobar si las características físicas de las esponjas mencionadas son defensas físicas o simplemente características morfológicas y estructurales, pues en los pellets no había escleritos o arena presente. Sin embargo, los depredadores generalistas son normalmente disuadidos por la química de las esponjas, pero no por elementos estructurales, rigidez, o la calidad nutricional de los tejidos de la esponja (Chanas y Pawlik, 1995; Pawlik, 1997; Burns e Han, 2003), por lo que es necesario comprobar que la arena, la rigidez de los tejidos y/o las espículas, efectivamente podrían disuadir la depredación en dichas esponjas.
Un caso documentado al respecto, es el estudio de Uriz et al. (1996), en el que encontraron que la disuasión química contribuye a la no depredación en la esponja del Mediterráneo Crambe crambe, donde otros factores como la rigidez causada por las espículas y el colágeno también pueden influir en el efecto inhibitorio. Sin embargo, tanto los compuestos como las estructuras físicas, fueron considerados como suficientes por separado, para lograr la disuasión (Becerro et al., 1998).
Por otro lado, en este estudio se realizó una observación que podría hacer pensar en la posibilidad de aprendizaje de los peces en cuanto a paladeabilidad, dado el aumento en pellets rechazados al finalizar algunas pruebas de disuasión. Sin embargo, es necesario llevar a cabo ensayos de mayor duración y enfocados al aspecto de aprendizaje para obtener información concluyente, lo que permitiría relacionar la paladeabilidad con las dinámicas de depredadores-presas, siendo aquella un elemento de defensa más importante que la toxicidad (Schulte y Bakus, 1992). Ese aprendizaje surge del sabor del alimento, ya que los peces lo escupen si no les agrada. Esto conduce a un método de defensa sensorial, en el que los depredadores reconocen el alimento y lo rechazan sin consumirlo (Bakker, 2000).
Chaves (2003) realizó pruebas de disuasión de extractos de las esponjas excavadoras Cliona aprica, C. caribbaea+C. tenuis y C. delitrix sobre ejemplares de S. partitus obtenidos de la misma población que en este estudio. La autora encontró disuasión positiva de los extractos incorporados a una dieta artificial a base de harina, pero resultados negativos en dieta de manto de calamar liofilizado debido a sobreadición de proteína. Ya que los compuestos presentes en un extracto pueden ser más efectivos en alimentos de mayor calidad (Duffy y Paul, 1992; Pennings et al., 1994), lo que indica que los ensayos se deben realizar con alimento que sea nutricionalmente parecido a cada esponja, con el fin de obtener resultados ecológicamente relevantes.
Por otro lado, el hecho de que los extractos crudos de S. coccinea, O. peltata, I. inminuta, Halichondria sp., O. bartschi, M. rea, C. cuspidifera, C. kuekenthali y C. infundibulum no hayan mostrado un efecto disuasor sobre los peces tiene varias implicaciones. A pesar de que los extractos no tuvieron una respuesta antidepredadora positiva en S. partitus, es probable que se dé en depredadores en regiones donde las condiciones de depredación puedan inducir la producción de compuestos efectivos hacia los depredadores (Van Alstyne y Paul, 1988; Pennings et al., 1994).
En el caso particular de C. kuekenthali se ha registrado un efecto disuasor (León y Bjorndal, 2002), lo que aparentemente no coincidiría con los resultados obtenidos en la presente investigación. Sin embargo, los autores de dicho estudio discuten este efecto disuasor pues se ha comprobado que C. kuekenthali hace parte de la dieta del depredador; sostienen entonces que probablemente debido a la presencia de otras esponjas más nutritivas o con menos defensas químicas, el depredador "escogió" no consumir esta especie. Entretanto, los efectos no disuasores de D. anchorata son consistentes con resultados obtenidos en otras investigaciones (Wulff, 1995, 1997; Andréa et al., 2007; Pawlik et al., 2008; Leong y Pawlik, 2010), al igual que la disuasión negativa de S. coccinea (León y Bjorndal, 2002).
A pesar de que se ha registrado que C. infundibulum posee una disuasión química intermedia (Jones et al., 2005), se observó que a los peces parecía atraerles más los pellets tratamiento de C. infundibulum, que los controles. Esto puede deberse a que los peces capturados para desarrollar el experimento fueron recolectados en el mismo sitio donde había un gran individuo de esta esponja, del cual se obtuvo tejido para los extractos; estos peces aprovechan la esponja para emplearla como refugio (obs. pers.). De acuerdo con los resultados obtenidos, puede suponerse que además de emplear a esta esponja como "hogar", los peces podrían utilizar ocasionalmente los tejidos de la esponja como alimento y por lo tanto, estar habituados a ingerirla. Sin embargo, esto debe ser demostrado mediante observación detenida de los peces en campo y análisis de su contenido estomacal, ya que podría ser simplemente un caso de coexistencia.
Ya que la apariencia de los tratamientos era exactamente igual, se puede pensar en la posibilidad de que los peces se sintieran atraídos por el olor adicional que el extracto dio a los pellets. Se sabe que además de la visión, pueden existir otros mecanismos que permiten a los peces determinar la calidad del alimento (Puyana, 2002), haciendo posible que los olores característicos de ciertas esponjas los atraigan o disuadan. Entretanto, puede sugerirse que el rechazo de los peces hacia las diez esponjas que no los disuadieron, podría deberse inicialmente al sabor característico que el extracto de cada esponja imprimió en el alimento preparado, ya que el comportamiento de comer-escupir-comer-escupir, puede ser un indicio de que ese llegaría a ser uno de los factores probables causantes del rechazo.
Teniendo en cuenta que la depredación limita la distribución y abundancia de algunas esponjas (Pawlik, 1998) y que S. coccinea, I. inminuta, Halichondria sp., O. bartschi, D. anchorata, C. cuspidifera, C. kuekenthali y C. infundibulum son especies expuestas, debe existir algún tipo de mecanismo que les permita defenderse de los ataques por parte de los depredadores, para poder mantener sus poblaciones. Por lo tanto, es necesario continuar con estudios que permitan entender cómo se dan las interacciones entre estas esponjas y sus depredadores, y si las defensas químicas pueden efectivamente controlar las dinámicas poblacionales de los depredadores y las presas, pudiendo entonces también controlar potencialmente las dinámicas de comunidades (Pawlik, 1997); o por lo menos, tendrían un papel importante para determinar la distribución y abundancia a pequeña escala (metros) de estos depredadores (Wright et al., 1997).
Adicionalmente, se sabe que la presencia de defensas químicas en los organismos depende de diversos factores que influyen en la variación intraespecífica o intracolonial (Pawlik et al., 1995; Cronin et al., 1997; Swearingen III y Pawlik, 1998), por lo cual se necesitan estudios adicionales para determinar si diferentes tipos de consumidores responden en forma diferente a los extractos y si se presentan respuestas "inducidas" sobre las esponjas, si las respuestas varían en ambientes con diferentes características físicas, en diferentes épocas del año y en diferentes partes del organismo, especialmente en el caso de las esponjas que no mostraron un efecto disuasor positivo. Así mismo, resultaría interesante realizar ensayos ecológicamente relevantes, involucrando consumo a largo plazo de los extractos de las esponjas, lo que sería útil en la evaluación de las relaciones entre los efectos de un compuesto sobre el comportamiento del consumidor vs. el éxito reproductivo, la posibilidad de que los consumidores sean inducidos a generar resistencia a los efectos de metabolitos defensivos comunes y la susceptibilidad del consumidor a los efectos de estos compuestos (Hay, 1996).
Por otro lado, con el fin de obtener más información sobre los impactos ecológicos de los papeles que juegan los compuestos disuasores, es necesario entender su variación intraespecífica y los efectos sobre las interacciones depredador-presa, ya que esta variación es en la que la evolución actúa, con implicaciones importantes en la regulación de las poblaciones y en el entendimiento de los componentes genéticos vs. fenotípicos de la biodiversidad marina (Hay, 1996). Finalmente, si bien los ensayos de disuasión son ecológicamente más relevantes empleando los extractos crudos, la evaluación de los compuestos permite entender el mecanismo de defensa del organismo. Por lo tanto, ambos tipos de estudio son complementarios y esta investigación permitiría realizar una selección de los extractos más relevantes para el análisis de contraste entre la depredación y la composición química.
Debe tenerse en cuenta que no se puede generalizar sobre las propiedades disuasoras de los extractos de las esponjas, ya que la toxicidad o disuasión son el resultado de la interacción entre una molécula o moléculas y su consumidor (Van Alstyne y Paul, 1988), dado que los metabolitos no actúan en forma aislada de otras características del organismo o del ambiente físico y biológico en el que los organismos interactúan con sus enemigos naturales. Sin embargo, se tiene un primer acercamiento sobre el efecto de los extractos crudos en los depredadores.
CONCLUSIONES
Se observó la disuasión por parte de los extractos orgánicos crudos de las esponjas marinas D. reticulata, P. ciocalyptoides, X. proxima, M. gyroderma y B. cribaria.
El extracto orgánico de C. infundibulum no disuade la alimentación del depredador S. partitus. A pesar de la capacidad de aprendizaje de los peces arrecifales, éstos no mostraron indicios de rechazo de los pellets en las pruebas sucesivas, lo que refuerza la carencia de defensas químicas antidepredadoras en esta esponja para esta especie de pez en particular.
Las esponjas S. coccinea, I. inminuta, Halichondria sp., O. bartschi, D. anchorata, C. cuspidifera, C. kuekenthali y C. infundibulum no mostraron efectos disuasores positivos frente a S. partitus. Debido a que estas esponjas son especies expuestas se deben realizar estudios tendientes a demostrar la presencia de defensas químicas en otras poblaciones de esponjas y sus efectos sobre otros posibles depredadores.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Fondo Colombiano de Investigaciones Científicas y Proyectos Especiales 'Francisco José de Caldas"- Colciencias, por el apoyo financiero dado a este trabajo, enmarcado en el "Proyecto piloto de prospección de bioactividad de organismos marinos colombianos", código: 2105-09-12456. De igual forma, al Instituto de Investigaciones Marinas y Costeras "José Benito Vives De Andréis"-INVEMAR, por el apoyo logístico. Al profesor Sven Zea por su apoyo en la realización del proyecto y la determinación de las esponjas.
BIBLIOGRAFIA
1 Aguilar, C. 2005. La ictiofauna costera de ciudad de La Habana: Efectos acumulativos de agentes estresantes múltiples en varios niveles de organización biológica. Tesis Doctorado en Ciencias Biológicas, Univ. de la Habana, La Habana. 140 p. [ Links ]
2 Andréa, B. R., D. Batista, C. L. S. Sampaio y G. Muricy. 2007. Spongivory by juvenile angelfish (Pomacanthidae) in Salvador, Bahia State, Brazil. Porifera Research: Biodiversity, Innovation and Sustainability, Série Livros 28. Museu Nacional, Rio de Janeiro. Pág: 131-137. [ Links ]
3 Bakker, A. C. 2000. Comparing chemical defense in plants and marine sponges. Universidad de Vrije, Ámsterdam. 23 p. [ Links ]
4 Bakus, G. 1981. Chemical defense mechanisms on the Great Barrier Reef, Australia. Science, 211: 497-499. [ Links ]
5 Becerro, M. A., V. J. Paul y J. Starmer. 1998. Intracolonial variation in chemical defenses on the sponge Cacospongia sp. and its consequences on generalist fish predators and the specialist nudibranch predator Glossodoris pallida. Mar. Ecol. Prog. Ser., 168: 187-196. [ Links ]
6 Braekman, J. C. y D. Daloze. 1986. Chemical defence in sponges. Pure and Appl. Chem., 58 (3): 357-364. [ Links ]
7 Burns, E. y M. Ilan. 2003. Comparisons of antidepredatory defenses of Red Sea and Caribbean sponges. II Physical defense. Mar. Ecol. Prog. Ser., 112: 57-71. [ Links ]
8 Cafieri F., E. Fattorusso, Y. Mahajnah y A. Mangoni. 1993. 6-Bromo-5-hydroxy-3-indolecarboxyaldehyde from the Caribbean sponge Oceanapia bartschi. J. Chem. Sci., 48 (10): 1408-1410. [ Links ]
9 Carballeira, N. M. y F. Shalabi. 1994. Unusual lipids in the Caribbean sponges Amphimedon viridis and Desmapsamma anchorata. J. Nat. Prod., 57 (8): 1152-1159. [ Links ]
10 Cervigón, F. 1993. Los peces marinos de Venezuela. Volumen 2. Fundación Científica Los Roques, Caracas. 497 p. [ Links ]
11 Chanas, B. y J. R. Pawlik. 1995. Defenses of Caribbean sponges against predatory reef fish. II. Spicules, tissue toughness and nutritional quality. Mar. Ecol. Prog. Ser., 127: 195-211. [ Links ]
12 Chanas, B. y J. R. Pawlik. 1996. Does the skeleton of a sponge provide a defense against predatory reef fish? Oecologia, 107: 225-231. [ Links ]
13 Chanas, B., J. R. Pawlik, T. Lindel y W. Fenical. 1996. Chemical defense of the Caribbean sponge Agelas clathrodes (Schmidt) J. Exp. Mar. Biol. Ecol., 208: 185-196. [ Links ]
14 Chaves, A. 2003. Evaluación del posible papel ecológico de los extractos orgánicos crudos de las esponjas excavadoras Cliona aprica Pang, 1973, C. caribbaea Carter, 1882, C. delitrix Pang, 1973 y C. tenuis Zea y Weil, sp. nov. Trabajo de grado Biol. Mar., Univ. de Bogotá Jorge Tadeo Lozano, Santa Marta. 127 p. [ Links ]
15 Cronin, G., V. J. Paul, M. E. Hay y W. Fenical. 1997. Are tropical herbivores more resistant than temperate herbivores to seaweed chemical defenses? Diterpenoid metabolites from Dictyota acutiloba as feeding deterrents for tropical versus temperate fishes and urchins. J. Chem. Ecol., 23 (2): 289-302. [ Links ]
16 Daza, Z. E. y A. P. Vélez. 2003. Ensayos de disuasión alimentaria, alelopatía por contacto, toxicidad y citotoxicidad de los extractos orgánicos crudos de las esponjas Cliona varians (Duchassaing y Michelotti, 1864) y Scopalina ruetzleri (Wiedenmayer, 1977). Trabajo de grado Biol. Mar., Univ. de Bogotá Jorge Tadeo Lozano, Santa Marta. 46 p. [ Links ]
17 Desjardine, K. L. 2007. Bioactive marine natural products. Dissertation Abstracts International, 68 (10): 14. [ Links ]
18 Duffy, J. E. y V. J. Paul. 1992. Prey nutritional quality and the effectiveness of chemical defenses against tropical reef fishes. Oecologia, 90: 333-339. [ Links ]
19 Dunlap, M. y J. R. Pawlik. 1996. Video-monitoring predation by Caribbean reef fishes on an array of mangrove and reef sponges. Mar. Biol., 126: 117-123. [ Links ]
20 Fürstner, A., B. Fasching, G. W. O'Neil, M. D. B. Fenster, C. Godbout y J. Ceccon. 2007. Toward the total synthesis of spirastrellolide A. Part 3: Intelligence gathering and preparation of a ring-expanded analogue. Chem. Commun., 29: 3045-3047. [ Links ]
21 Green, G. y G. Bakus. 1974. Toxicity in sponges and holothurians. A geographic pattern. Science, 185: 951-953. [ Links ]
22 Hassan, W., R. Edrada, R. Ebel, V. Wray y P. Proksch. 2004. New alkaloids from the Mediterranean sponge Hamigera hamigera. Mar. Drugs, 2: 88-100. [ Links ]
23 Hay, M. E. 1996. Marine chemical ecology: What's known and what's next? J. Exp. Mar. Biol. Ecol., 200: 103-134. [ Links ]
24 Jones, A. C., J. E. Blum y J. R. Pawlik. 2005. Testing for defensive synergy in Caribbean sponges: Bad taste or glass spicules? J. Exp. Mar. Biol. Ecol., (322) 1: 67-81. [ Links ]
25 Keaton, K. A. y A. J. Phillips. 2008. Toward the synthesis of spirastrellolide B: A synthesis of the C1-C23 subunit. Org. Lett., 10 (6): 1083-1086. [ Links ]
26 Kossuga, M. H., S. P. de Lira, A. M. Nascimento, M. T. P. Gambardella, R. G. S. Berlinck, Y. R. Torres, G. G. F. Nascimento, E. F. Pimenta, M. Silva, O. H. Thiemann, G. Oliva, A. G. Tempone, M. S. C. Melhem, A. O. de Souza, F. C. S. Galetti, C. L. Silva, B. Cavalcanti, C. O. Pessoa, M. O. Moraes, E. Hajdu, S. Peixinho y R. M. Rocha. 2007. Isolamento e atividades biológicas de produtos naturais das esponjas Monanchora arbuscula, Aplysina sp., Petromica ciocalyptoides e Topsentia ophiraphidites, da ascídia Didemnum ligulum e do octocoral Carijoa riisei. Quim. Nova, 30 (5): 1194-1202. [ Links ]
27 León, Y. M. y K. A. Bjorndal. 2002. Selective feeding in the hawksbill turtle, an important predator in coral reef ecosystems. Mar. Ecol. Prog. Ser., 245: 249-258. [ Links ]
28 Leong, W. y J. R. Pawlik. 2010. Evidence of a resource trade-off between growth and chemical defenses among Caribbean coral reef sponges. Mar. Ecol. Prog. Ser., 406: 71-78. [ Links ]
29 Lozano, F. 1986. Determinación de biomasa y su variación espacio-temporal de la comunidad zooplanctónica nerítica de la bahía de Santa Marta; Caribe colombiano y contribución a la situación del zooplancton en las instituciones socio-educativas colombianas. Trabajo de grado, Biol., Pontificia Univ. Javeriana, Bogotá. 89 p. [ Links ]
30 McClintock, J. B. 1987. Investigation of the relationship between invertebrate predation and biochemical composition, energy content, spicule armament and toxicity of benthic sponges at McMurdo Sound, Antartica. Mar. Biol., 94: 479-487. [ Links ]
31 McClintock, B., D. Swenson, H. Trapido-Rosenthal y L. Banghart. 1997. Icthyodeterrent properties of lipophilic extracts from Bermudian sponges. J. Chem. Ecol., 23 (6): 1607-1620. [ Links ]
32 Mclean, E. L. y P. M. Yoshioka. 2008. Substratum effects on the growth and survivorship of the sponge Desmapsamma anchorata. Carib. J. Sci., 44 (1): 83-89. [ Links ]
33 Parra-Velandia, F. J. y S. Zea. 2003. Comparación de la abundancia y distribución de algunas características de las esponjas del genero Ircinia (porifera: demospongiae) en dos localidades contrastantes del área de Santa Marta, Caribe colombiano. Bol. Invest. Mar. Cost., 32: 75-91. [ Links ]
34 Paterson, I., E. A. Anderson, S. M. Dalby y O. Loiseleur. 2005a. Toward the synthesis of spirastrellolide A: construction of two C1-C25 diastereomers containing the BC-Spiroacetal. Org. Lett., 7 (19): 4125-4128. [ Links ]
35 Paterson, I., E. A. Anderson y S. M. Dalby. 2005b. Synthesis of the C1-C21 southern hemisphere of the originally proposed structure of spirastrellolide A. Synthesis, (19): 3225-3228. [ Links ]
36 Paterson, I., E. A. Anderson, S. M. Dalby, J. Ho Lim, P. Maltas y C. Moessner. 2006. Synthesis of the DEF-bis-spiroacetal of spirastrellolide A exploiting a double asymmetric dihydroxylation/spiroacetalisation strategy. Chem. Commun., 40: 4186-4188. [ Links ]
37 Paterson, I., E. A. Anderson, S. M. Dalby, J. Genovino, J. Ho Lim y C. Moessner. 2007. Synthesis of two diastereomeric C1-C22 fragments of spirastrellolide A. Chem. Commun., 18: 1852-1854. [ Links ]
38 Pawlik, J. R. 1993. Marine invertebrate chemical defenses. Chem. Rev., 93: 1911-1922. [ Links ]
39 Pawlik, J. R. 1997. Fish predation on Caribbean reef sponges: An emerging perspective of chemical defenses. Proc. 8th Int. Coral Reef Symp., 2: 1255-1258. [ Links ]
40 Pawlik, J. R. 1998. Coral reef sponges: do predatory fishes affect their distribution? Limnol. Oceanogr., 43 (6): 1396-1399. [ Links ]
41 Pawlik, J. R., B. Chanas, R. J. Toonen y W. Fenical. 1995. Defenses of Caribbean sponges against predatory reef fish. I. Chemical deterrency. Mar. Ecol. Prog. Ser., 127: 183-194. [ Links ]
42 Pawlik, J. R., T. P. Henkel, S. E. McMurray, S. López-Legentil, T. L. Loh y S. Rohde. 2008. Patterns of sponge recruitment and growth on a shipwreck corroborate chemical defense resource trade-off. Mar. Ecol. Prog. Ser., 368: 137-143. [ Links ]
43 Pennings, S. C, S. R. Pablo, V. J. Paul, y J. E. Duffy. 1994. Effects of sponge secondary metabolites in different diets on feeding by three groups of consumers. J. Exp. Mar. Biol. Ecol., 180: 137-149. [ Links ]
44 Puyana, M. 2002. Chemical signals in coral reef ecosystems. En: Hardege, J. (Ed.) Chemical ecology. Encyclopedia of life support systems (EOLSS) under the auspices of the UNESCO. Ed. Publishers Oxford. Londres. www.eolss.net/E6-52-toc.aspx. [ Links ]
45 Quijano, L., F. Cruz, I. Navarrete, P. Gómez y T. Rio. 1994. Alkyl glycerol monoethers in the marine sponge Desmapsamma anchorata. Lipids, 29 (10): 731-734. [ Links ]
46 Randall, J. E. y W. D. Hartman. 1968. Sponge-feeding fishes of the West Indies. Mar. Biol., 1 (3): 216-225. [ Links ]
47 Rod'kina, S. A. 2005. Fatty acids and other lipids of marine sponges. Rus. J. Mar. Biol., 31, supplement 1 (enero). [ Links ]
48 Schulte, B. A. y G. Bakus. 1992. Predation deterrence in marine sponges: laboratory versus field studies. Bull. Mar. Sci., 50 (1): 205-211. [ Links ]
49 Siegel, S. y N. J. Castellan. 1988. Nonparametric statistics for the behavioral sciences. Segunda edición, Mc Graw-Hill Book Company, Nueva York. 399 p. [ Links ]
50 Smith III, A. B. y D. S. Kim. 2007. The spirastrellolides: construction of the southern C(1)-C(25) fragment exploiting anion relay chemistry. Org. Lett., 9 (17): 3311-3314. [ Links ]
51 Smith III, A. B., H. Smits y D. S. Kim. 2010. Spirastrellolide studies. Synthesis of the C(1)-C(25) southern hemispheres of spirastrellolides A and B, exploiting anion relay chemistry. Tetrahedron, 66: 6597-6605. [ Links ]
52 Swearingen III, D. C. y J. R. Pawlik. 1998. Variability in the chemical defense of the sponge Chondrilla nucula against predatory reef fishes. Mar. Biol., 131: 619-627. [ Links ]
53 Uriz, M., X. Turón, M. A. Becerro y J. Galera. 1996. Feeding deterrence in sponges. The role of toxicity, physical defenses, energetic contents, and life-history stage. J. Exp. Mar. Biol. Ecol., 205: 187-204. [ Links ]
54 Van Alstyne, K. L. y V. J. Paul. 1988. The role of secondary metabolites in marine ecological interactions. Proc. of the 6th Int. Coral Reef Sym, Australia., 1: 175-186. [ Links ]
55 Van Alstyne, K. L. y V. J. Paul. 1992. Chemical and structural defenses in the sea fan Gorgonia ventolina: effects against generalist and specialist predators. Coral Reefs, 11: 155-159. [ Links ]
56 Van der Hammen, T. 1984. Datos sobre la historia de clima, vegetación y glaciación de la Sierra Nevada de Santa Marta. (Data on the history of climate, vegetation and glaciation of the Sierra Nevada de Santa Marta). 561-580. En: Van der Hammen, T. y P. M. Ruiz (Eds.). La Sierra Nevada de Santa Marta (Colombia), Transecto Buritaca-La Cumbre. Estudios de ecosistemas tropandinos. Vol. 2. J. Cramer (Borntraeger), Berlin-Stuttgart. 603 p. [ Links ]
57 Williams, D. E., M. Roberge, R. Van Soest y R. Andersen. 2003. Spirastrellolide A, an antimitotic macrolide isolated from the Caribbean marine sponge Spirastrella coccinea. J. Am. Chem. Soc., 125 (18): 5296-5297. [ Links ]
58 Williams, D. E., R. A. Keyzers, K. Warabi, K. Desjardine, J. L. Riffell, M. Roberge y R. J. Andersen. 2007. Spirastrellolides C to G: Macrolides obtained from the marine sponge Spirastrella coccinea. J. Org. Chem., 72 (25): 9842-9845. [ Links ]
59 Warabi, K., D. E. Williams, B. O. Patrick, M. Robeige y R. J. Andersen. 2007. Spirastrellolide B reveals the absolute configuration of the spirastrellolide macrolide core. J. Am. Chem. Soc., 129 (3): 508-509. [ Links ]
60 Wilson, D. M., M. Puyana, W. Fenical y J. Pawlik. 1999. Chemical defense of the Caribbean reef sponge Axinella corrugata against predatory fishes. J. Chem. Ecol., 25 (12): 2811-2823. [ Links ]
61 Wright, J. T, K. Benkendorff y A. R. Davis. 1997. Habitat associated differences in temperate sponge assemblages: the importance of chemical defense. J. Exp. Mar. Biol. Ecol., 213: 199-213. [ Links ]
62 Wulff, J. L. 1995. Sponge-feeding by the Caribbean starfish Oreaster reticulates. Mar. Biol., 123: 313-325. [ Links ]
63 Wulff, J. L. 1997. Parrotfish predation on cryptic sponges of Caribbean coral reefs. Mar. Biol., 129: 41-52. [ Links ]
64 Wulff, J. L. 2005. Trade-offs in resistance to competitors and predators, and their effects on the diversity of tropical marine sponges. J. Anim. Ecol., 74 (2): 313-321. [ Links ]
65 Wulff, J. L. 2006. Rapid diversity and abundance decline in a Caribbean coral reef sponge community. Biol. Cons., 127: 167-176. [ Links ]
66 Wulff, J. L. 2008. Life-history differences among coral reef sponges promote mutualism or exploitation of mutualism by influencing partner fidelity feedback. Am. Nat., 171: 597-609. [ Links ]
FECHA DE RECEPCIÓN: 25/05/2007 FECHA DE ACEPTACIÓN: 03/08/2011
*Contribución No. 1085 del Instituto de Investigaciones Marinas y Costeras - INVEMAR.