Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.40 no.2 Santa Marta July/Dec. 2011
ESTIMACIÓN POBLACIONAL, RUTAS MIGRATORIAS Y CARACTERÍSTICAS MORFOMÉTRICAS DE LA TORTUGA CARDÓN (DERMOCHELYS CORIACEA, VANDELLI 1761) EN LAS PLAYAS DE CIPARA Y QUEREPARE, PENÍNSULA DE PARIA, VENEZUELA, DURANTE LAS TEMPORADAS DE ANIDACIÓN 2000-2006
POPULATION ESTIMATE AND MIGRATION ROUTES OF THE LEATHERBACK TURTLE (DERMOCHELYS CORIACEA, VANDELLI) IN CIPARA AND QUEREPARE BEACHES, PARIA PENINSULA, VENEZUELA, BETWEEN THE YEARS 2000-2006
María Rondón Médicci1, Joaquín Buitrago2, Hedelvy J. Guada3, 4 y Karen L. Eckert4
1 Universidad Nacional Experimental Francisco de Miranda (UNEFM), Departamento de Producción Animal, Santa Ana de Coro, Falcón, Venezuela, mmedicci@gmail.com
2 Estación de Investigaciones Marinas de Margarita (EDIMAR), Fundación La Salle de Ciencias Naturales FLASA, Punta de Piedras, Nueva Esparta, Venezuela, jbuitrago@edimar.org
3 Centro de Investigación y Conservación de Tortugas Marinas (CICTMAR), Caracas, Venezuela, hjguada@gmail.com
4 Wider Caribbean Sea Turtle Conservation Network (WIDECAST). keckert@widecast.org
RESUMEN
Mediante análisis de captura-marcaje-recaptura y morfometría de las hembras anidadoras de la tortuga cardón (Dermochelys coriacea) en las playas de Cipara y Querepare, península de Paria, Venezuela entre los años 2000 y 2006, se presentan resultados de migraciones, localidades con recapturas, morfometría y crecimiento de las hembras adultas y se estima el tamaño de la población. De 502 hembras marcadas 41 han sido observadas reemigrando. El intervalo entre reemigraciones fue de 2.5 años. En Querepare las reclutas y las reemigrantes aumentaron de manera significativa y en Cipara las hembras nuevas no han aumentado, pero sí las recapturas. 3 8 hembras fueron observadas en más de una playa en la misma temporada. 73.6% entre Cipara y Querepare (30 km), 10.5% entre Paria y Trinidad (240 km), 7.9% entre Cipara o Querepare y Unare (10-30 km), 5.3% entre Paria y la isla de Margarita (130 km) y 2.6% entre Dominica y Cipara (550 km). Las 403 hembras medidas presentaron un largo curvo del caparazón (LCC) medio de 151.78±6.20 cm y un ancho curvo del caparazón (ACC) medio de 110.03±4.42 cm. En Cipara las tallas aumentaron con los años. En 46 hembras medidas en más de una temporada se encontró un crecimiento promedio de LCC de 0.85±1.10 cm*año-1 y de ACC 0.64±0.56 cm*año-1. No se encontró relación entre el crecimiento y la talla inicial, ni con el intervalo de reemigración. La población de hembras anidando en Paria se estimó para 2000 en 58 (ámbito 28-113) y para 2006 en 277 (ámbito 133-532). Lo que constituye cerca al 1% de la población mundial estimada de hembras. La tendencia al incremento de hembras es exponencial y significativa (r= 0.966, p= 0.0004).
PALABRAS CLAVE: Tortuga cardón, Paria, Marcaje-recaptura, Tallas, Crecimiento adultas.
ABSTRACT
Capture-mark-recapture data, individual morphometries (including size and growth), remigration data, and nesting population size (2000-2006) are presented for leatherback sea turtles (Dermochelys coriacea) in Cipara and Querepare, Paria Peninsula, Venezuela. From 502 tagged females, the average remigration interval for 41 individuals seen in subsequent years was 2.5 years. In Querepare, remigrants (previously tagged) and neophytes (untagged individuals) increased significantly; in Cipara, remigrants increased significantly but neophytes did not. Of 38 tagged females observed nesting at more than one beach during a nesting season, 73.6% traveled between Cipara and Querepare (30 km) and 10.5% the balance between Cipara or Querepare and Unare (10-30 km) and 7.9% between Paria and Margarita Island (130 km), as well as 5.3% internationally between Paria and Trinidad (240 km) and 2.6% between Cipara and Dominica (550 km). Mean curved carapace length (CCL) and width (CCW) of 403 measured females was 151.78±6.20 cm and 110.03±4.42 cm, respectively. Of 46 nesting females measured during more than one reproductive season, mean growth in CCL and CCW was 0.85±1.10 cm*yr-1 and 0.64±0.56 cm*yr-1, respectively. There was no significant relationship between growth rate and initial size or remigration interval. Estimates of population size between 2000 (58 adult females, range: 28-113) and 2006 (277 adult females, range: 133-532) increased both significantly and exponentially (r= 0.966, p= 0.0004), with the study sites representing 1% of estimated world adult female population.
KEY WORDS: Leatherback turtle, Paria, Mark-recapture, Sizes, Adult growth.
INTRODUCCIÓN
Marcar las hembras de tortugas marinas durante la anidación tiene varios beneficios; sirve para estudiar sus movimientos, identificar a los individuos y cuando se aplica durante varios años, para evaluar el tamaño y tendencias de la población, basados en los diferentes métodos de captura-recaptura, aspecto de importancia por tratarse de especies amenazadas. Sin embargo, las estimaciones de poblaciones basadas en recapturas se ven afectadas por la violación de varios supuestos inherentes a los métodos como son el carácter cerrado de las poblaciones, la pérdida de marcas y la heterogeneidad del comportamiento individual, que hace que las probabilidades de recaptura no sean iguales para todos los individuos (Baker, 2004).
La tortuga cardón (Dermochelys coriacea) es también denominada laúd, caná, baula, leatherback (en inglés), tortue luth (en francés), tartaruga de couro (en portugués) en otros países de su área de distribución en el hemisferio occidental (Eckert, 2001). En esta especie varias características de su comportamiento hacen que sea especialmente difícil estimar el tamaño de sus poblaciones basados en la frecuencia de reemigración en temporadas sucesivas, pues no parecen ajustarse a lo que ocurre en otras especies de tortugas marinas, ya que las hembras que se ven anidar por primera vez, rara vez regresan (Pritchard, 1971; Hughes, 1982), sugiriendo una alta mortalidad entre temporadas de anidación. Estimaciones en poblaciones anidando en el Caribe indican probabilidades de supervivencia anuales de 0.89 en las hembras adultas (Dutton et al., 2005). Se considera que las tortugas cardón presentan baja fidelidad de sitio de anidación (Hernández et al., 2005; Chacón y Eckert, 2007; Hilterman y Goverse, 2007). Sin embargo, se ha encontrado que esta afirmación se basa en que algunas hembras, consideradas primerizas o infieles, suelen anidar una sola vez en una playa (Girondot et al., 2007). Contar con información precisa sobre el tamaño poblacional se considera clave en el caso de esta especie considerada por la Unión para la Conservación de la Naturaleza (IUCN) y por el Libro Rojo de la Fauna Venezolana como "En Peligro Crítico de Extinción" (Guada y Buitrago, 2008; IUCN, 2009), aparte que a nivel nacional, la tortuga cardón se considera oficialmente en peligro de extinción y en situación de veda (Babarro, 2004).
En Venezuela desovan cuatro especies de tortugas marinas (Chelonia mydas, Carena carena, Eretmochelys imbricata y Dermochelys coriacea). El mareaje de tortugas marinas en áreas de desove se ha realizado desde los años ochenta en el Refugio de Fauna Silvestre Isla de Aves y a partir de finales de los noventa en Isla de Margarita (Estado Nueva Esparta) y en la península de Paria (Estado Sucre) (Gremone y Gómez, 1984; Pritchard y Trebbau, 1984; Guada y Solé, 2000; Quijada y Balladares, 2004). La información hasta el presente indica que el área de anidación continental más importante para la tortuga cardón se encuentra en la península de Paria (Guada y Solé, 2000; Rondón et al., 2009).
Desde 1999 se inició el seguimiento de la tortuga cardón mediante el mareaje con placas metálicas en Cipara y a partir de 2002 comenzó el trabajo en Querepare, lugares ubicados en la península de Paria (Estado Sucre), que se consideraron localidades índice para la especie en Venezuela (Guada y Solé, 2000). En este trabajo se describe la morfometría y crecimiento de las hembras adultas, se estima el tamaño de la población y se analiza la información sobre reemigraciones y movimientos entre playas entre los años 2000 y 2006.
ÁREA DE ESTUDIO
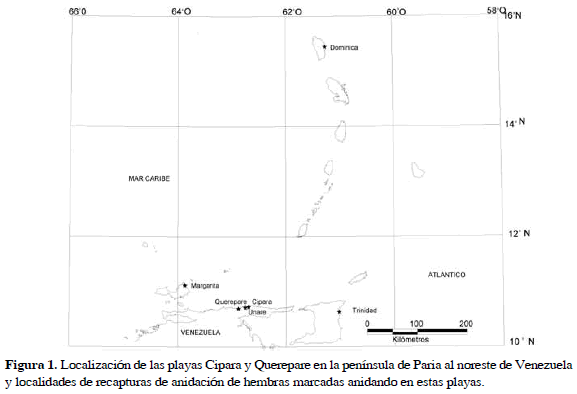
Las playas de Cipara (62°42' O, 10°45' N) y Querepare (62°52' O, 10°42' N) están ubicadas en la vertiente norte de la península de Paria, Estado Sucre, Venezuela (Guada et al., 2002). La playa de Cipara mide 2.06 km de largo y comprende cuatro sectores, conocidos localmente como Varadero (220 m), Cipara (740 m), La Peña (600 m) y La Remate (500 m). Las características de estos cuatro sectores son diferentes. Varadero y La Peña presentan arena gruesa y pendientes pronunciadas entre junio y septiembre. Los sectores de Cipara y La Remate tienen arena fina y pendientes suaves durante todo el año (Guada et al., 2002; Rondón et al., 2009). La playa de Querepare mide aproximadamente 1.8 km de largo (Guada y Rondón, 2003; Rondón et al., 2009), es una playa de alta energía con una amplia área de barrido (>12 m) (Velázquez et al., 2006) (Figura 1).
MATERIALES Y MÉTODOS
Se estudiaron las temporadas 2000 a 2006 en Cipara y 2002 a 2006 en Querepare. Para el análisis de las reemigraciones se incluyeron los datos de 2007. La fecha de inicio de los patrullajes de las playas varió entre el 15 de marzo y el 11 de abril para Cipara y entre el 15 de marzo y el 4 de mayo para Querepare. Típicamente se efectuaron recorridos nocturnos a lo largo de las playas, desde las 21:00 hasta las 5:00 h del día siguiente, a esa hora se realizaba un censo para registrar cualquier actividad o evento no observado durante la noche. El esfuerzo medio de muestreo (±desviación estándar) por temporada en Cipara fue de 132±23 d (906±141 h). Para Querepare el esfuerzo fue de 109±21 d (846±149 h). En cada tortuga cardón se registró: 1) presencia y localización de microchips internos (Transmisor Pasivo Integrado, PIT) y placas metálicas externas, 2) longitud y ancho curvo del caparazón, 3) tipo de salida: a) nido con huevos, b) nido sin huevos, c) nido sin identificar (cuando no se pudo determinar si hubo desove o no) y d) salidas sin nidos.
La presencia/ausencia de placas metálicas se verificó por observación directa de las cuatro aletas. En caso de no tener marca, se aplicaron placas tipo Monel 1005-49, seriadas de la Universidad de Florida y de la Universidad de West Indies, Barbados, en el pliegue de la aleta posterior izquierda hasta 2005 y a partir de 2006 se colocaron en los pliegues de ambas aletas posteriores. Se verificó la presencia/ausencia de PIT marca AVE), utilizando lectores AVID Power Track IV ® y Destrón ®. En caso de no presentar el microchip, éste se inyectó a nivel del hombro derecho.
Con base en las hembras observadas en más de una temporada se estimó el intervalo de reemigración. Se analizaron los datos de las hembras que en una misma temporada fueron observadas en más de una playa, la distancia y el tiempo transcurrido entre los eventos.
La longitud curva del caparazón (LCC), se tomó desde la muesca nucal hasta el extremo posterior de la proyección caudal pasando por el costado de la quilla central (Bolten, 2000). El ancho curvo del caparazón (ACC) se midió en el punto más amplio, tomándose como referencia las primeras proyecciones de las quillas axilares (Sarti y García, 1999). La longitud y el ancho curvo del caparazón se midieron con una cinta métrica flexible con una precisión de 0.1 cm.
Para estimar el número de hembras anidadoras en la población, es necesario partir del total de nidadas, conocer la frecuencia de puesta de las hembras en una misma temporada, el éxito de puesta y la efectividad del muestreo. Estos valores fueron estimados para las temporadas Cipara 2000-2006 y Querepare 2002-2006 por Rondón et al. (2010). Como los datos inferidos por Rondón et al. (2010) ya están corregidos respecto a posibles eventos no observados y al éxito de puesta, la fórmula propuesta por Gerrodette y Taylor (1999) se simplifica a:
Número de Hembras= Número de nidadas inferidas/proporción de hembras anidando cada año/frecuencia de puesta inferida.
En estas estimaciones se tuvo en cuenta la incógnita presentada por el alto número de hembras que sólo anidaron una vez (69 y 73% en Cipara y Querepare, respectivamente), que representan uno de los mayores desafíos para estimar el tamaño y la tendencia de la población en esta especie y no está claro qué representan estas hembras (Girondot et al., 2007; Hilterman y Goverse, 2007). Para este caso, a fin de estimar el tamaño de la población anidadora, se asumió que las hembras infieles anidaron, con la misma frecuencia que las fieles, pero en otras playas no monitoreadas.
Los análisis estadísticos realizados, t de Student, correlaciones, regresiones y análisis de varianza se efectuaron con el programa Statgraphic plus 5.1TM. En todos los casos se usó α= 0.05 y previamente se corroboró el cumplimiento de los requisitos necesarios. Para comprobar la homogeneidad de las varianzas se usó la prueba C de Crochan. La normalidad de los datos se evaluó con la prueba de bondad de ajuste de Chi2. Para las regresiones, la posibilidad de autocorrelación serial se buscó con la prueba Durbin-Watson y los residuales inusuales mayores de tres desviaciones estándar fueron revisados en los datos originales y eliminados de existir dudas, caso que sólo se presentó en tres datos de crecimiento.
RESULTADOS
Reemigraciones y movimientos entre playas
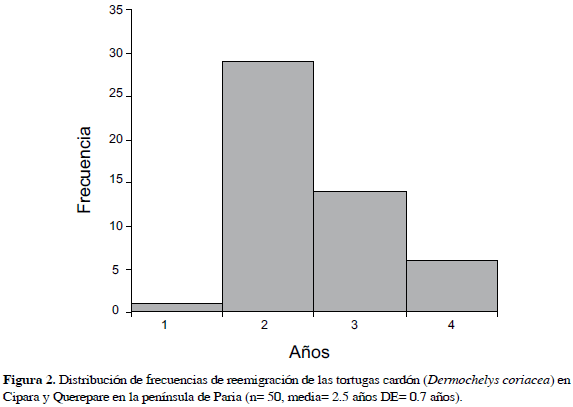
Se obtuvieron 50 datos de reemigraciones de 41 hembras diferentes (8.2%) de las 502 hembras marcadas. La Figura 2 muestra el intervalo entre reemigraciones (n= 50, 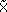 = 2.5 años, DE= 0.7 años). La mayoría de las hembras reemigrantes (80%) han sido observadas dos temporadas, 17% ha reemigrado tres veces y una sola hembra lo ha hecho cuatro veces en siete y cinco años de observaciones para Cipara y Querepare, respectivamente.
= 2.5 años, DE= 0.7 años). La mayoría de las hembras reemigrantes (80%) han sido observadas dos temporadas, 17% ha reemigrado tres veces y una sola hembra lo ha hecho cuatro veces en siete y cinco años de observaciones para Cipara y Querepare, respectivamente.
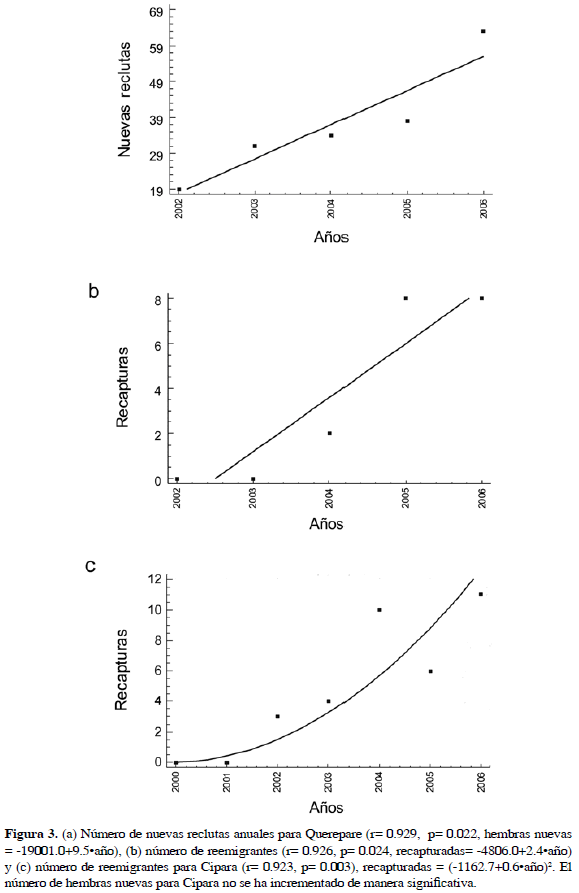
En Querepare (Figura 3a y b) tanto el número de nuevas reclutas, como el de reemigrantes, está aumentando de manera significativa (hembras nuevas r= 0.929, p= 0.022; hembras nuevas= -19001.0+9.5 año; recapturadas r= 0.926, p= 0.024; recapturadas= -4806.0+2.4
año; recapturadas r= 0.926, p= 0.024; recapturadas= -4806.0+2.4 año). La tasa de incremento en hembras nuevas es casi el cuádruple de la tasa de incremento en recapturas. En el caso de Cipara el número de hembras nuevas no ha aumentado significativamente (r= 0.618, p= 0.14) pero si las recapturas, que han aumentado siguiendo una relación cuadrática (r= 0.923, p= 0.003; recapturadas= -1162.73+0.581396
año). La tasa de incremento en hembras nuevas es casi el cuádruple de la tasa de incremento en recapturas. En el caso de Cipara el número de hembras nuevas no ha aumentado significativamente (r= 0.618, p= 0.14) pero si las recapturas, que han aumentado siguiendo una relación cuadrática (r= 0.923, p= 0.003; recapturadas= -1162.73+0.581396 año2).
año2).
De las hembras marcadas, 38 (7.6%) fueron observadas en más de una playa en la misma temporada. 73.6% de los movimientos observados fueron entre las playas de Cipara y Querepare (30 km) o viceversa. Cuatro hembras (10.5%) se desplazaron entre las playas de Paria y Trinidad (240 km), tres (7.9%) hembras entre Cipara o Querepare y Unare (10-30 km), dos (5.3%) hembras entre Paria y la isla de Margarita (130 km) y una (2.6%) entre Dominica y Cipara (550 km). El intervalo observado entre puestas en diferentes playas fue de 14.1±10.7 d (n= 33), el cual no difiere significativamente (t642= 0.382, p= 0.70) de los 13.6±7.1 d (n= 611) de intervalo de puesta global para las playas de Cipara y Querepare (Rondón et al., 2010). La distancia media entre eventos en diferentes playas fue de 70.3±106.0 km (Figura 1). Los datos no permitieron examinar relaciones entre la distancia y el intervalo entre puestas.
Morfometría
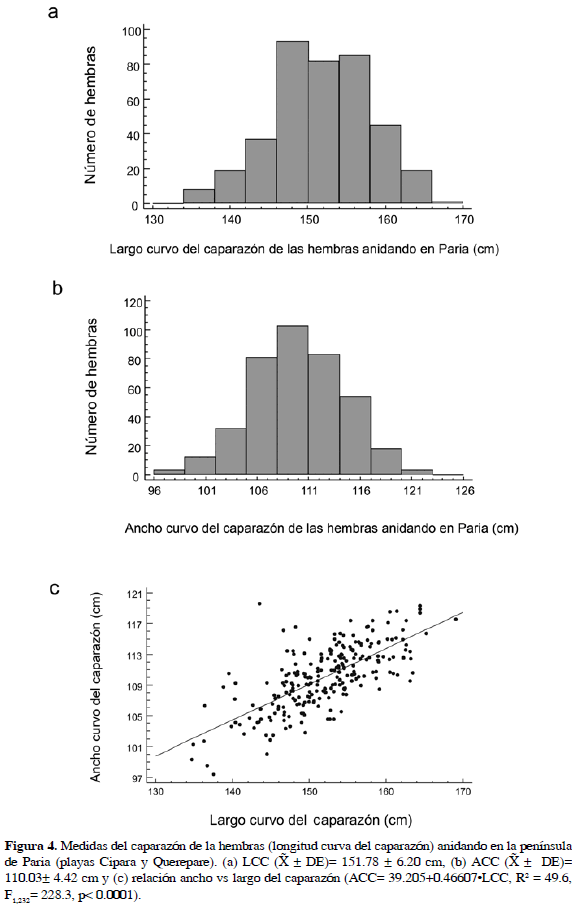
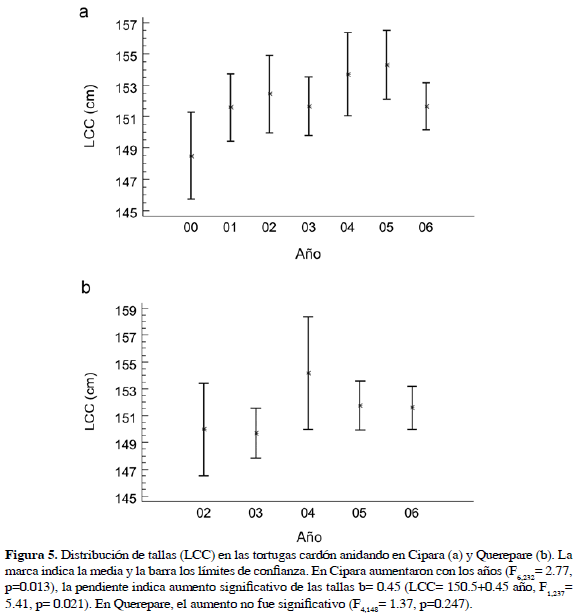
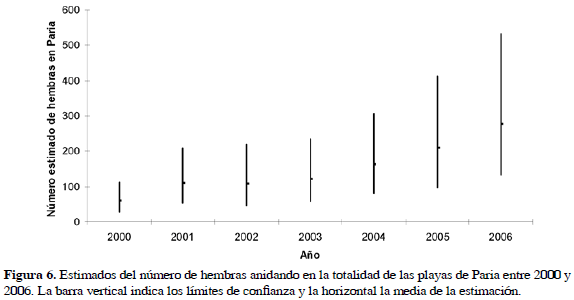
En la Figura 4 se muestra el histograma de tallas LCC (a) y ACC (b) para las 403 hembras medidas en las dos playas y la relación entre estas dos medidas (c) según la ecuación ACC= 39.2048+0.46607 LCC (R2= 49.6, F1,232= 228.3, p< 0.0001). Las tortugas cardón de Paria que anidaron entre 2000 y 2006 tienen una media de LCC de 151.78±6.2 cm y de ACC de 110.03±4.42 cm. Las tallas de las hembras no difieren significativamente (F1,389= 0.98, p= 0.323) entre las dos playas (Cipara n= 238,
LCC (R2= 49.6, F1,232= 228.3, p< 0.0001). Las tortugas cardón de Paria que anidaron entre 2000 y 2006 tienen una media de LCC de 151.78±6.2 cm y de ACC de 110.03±4.42 cm. Las tallas de las hembras no difieren significativamente (F1,389= 0.98, p= 0.323) entre las dos playas (Cipara n= 238,  = 152.04±6.30 cm; Querepare n= 153,
= 152.04±6.30 cm; Querepare n= 153, 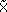 = 151.4±6.01 cm); sin embargo, se presentan diferencias entre años. En Cipara las tallas aumentaron significativamente con los años (F6,232= 2.77, p= 0.013) (Figura 5a), con pendiente b= 0.45 (LCC= 150.5+0.45 año, F(1,237) = 5.41, p= 0.021). En Querepare el aumento no fue significativo (F4,148= 1.37, p= 0.247) con una pendiente de b= 0.41 (LCC= 149.4+0.41 año, F1,151= 1.38, p= 0.24) (Figura 5b). Sin embargo, las dos ecuaciones de regresión no son significativamente diferentes (F3,387= 2.61, p= 0.51). No se encontró diferencia significativa entre las hembras que fueron observadas y medidas más de una vez en Paria con aquellas que se han visto sólo una vez (
= 151.4±6.01 cm); sin embargo, se presentan diferencias entre años. En Cipara las tallas aumentaron significativamente con los años (F6,232= 2.77, p= 0.013) (Figura 5a), con pendiente b= 0.45 (LCC= 150.5+0.45 año, F(1,237) = 5.41, p= 0.021). En Querepare el aumento no fue significativo (F4,148= 1.37, p= 0.247) con una pendiente de b= 0.41 (LCC= 149.4+0.41 año, F1,151= 1.38, p= 0.24) (Figura 5b). Sin embargo, las dos ecuaciones de regresión no son significativamente diferentes (F3,387= 2.61, p= 0.51). No se encontró diferencia significativa entre las hembras que fueron observadas y medidas más de una vez en Paria con aquellas que se han visto sólo una vez (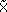 = 152.01 y 151.8, DE= 6.55 y 6.132, n= 57 y 338, t= 0.259, p= 0.795).
= 152.01 y 151.8, DE= 6.55 y 6.132, n= 57 y 338, t= 0.259, p= 0.795).
La relación del año de medida con la talla muestra una relación cuadrática significativa (LCC= 148.879+1.82409 año-0.220896
año-0.220896 año2, F2,388= 4.95, p= 0.0075) que indica una tendencia de crecimiento hasta el 2004 disminuyendo lentamente después. Para analizar la precisión de las medidas, se usaron 263 medidas múltiples (ámbito 2 a 16) de 61 hembras medidas en la misma temporada. La talla de las hembras de medición múltiple en una temporada (hembras medidas dos o más veces, n= 263,
año2, F2,388= 4.95, p= 0.0075) que indica una tendencia de crecimiento hasta el 2004 disminuyendo lentamente después. Para analizar la precisión de las medidas, se usaron 263 medidas múltiples (ámbito 2 a 16) de 61 hembras medidas en la misma temporada. La talla de las hembras de medición múltiple en una temporada (hembras medidas dos o más veces, n= 263, 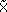 = 153.7 cm) con respecto a la de la totalidad de las tortugas que anidaron (total hembras n= 403,
= 153.7 cm) con respecto a la de la totalidad de las tortugas que anidaron (total hembras n= 403, 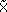 = 151.8 cm) fue significativamente mayor (t= -3.90912, p= 9
= 151.8 cm) fue significativamente mayor (t= -3.90912, p= 9 10-5).
10-5).
Analizando los datos de 46 hembras que fueron medidas en más de una temporada (dos temporadas n= 41; tres temporadas n= 5; con intervalos entre 1 y 4 años) se encontró un crecimiento promedio de LCC de 0.85±1.10 cm año-1 (rango - 1.73 a 5.50 cm
año-1 (rango - 1.73 a 5.50 cm año-1) y de ACC de 0.64±0.56 cm
año-1) y de ACC de 0.64±0.56 cm año-1 (rango - 0.65 a 2.30 cm
año-1 (rango - 0.65 a 2.30 cm año-1)- La relación entre la talla inicial (LCC) y el crecimiento anual presentó una relación negativa no significativa (r2= 6.4, p= 0.098) al igual que para ACC (r2= 0.97, p= 0.52).
año-1)- La relación entre la talla inicial (LCC) y el crecimiento anual presentó una relación negativa no significativa (r2= 6.4, p= 0.098) al igual que para ACC (r2= 0.97, p= 0.52).
Estimación del número de hembras de la población
Rondón et al. (2010) estimaron la frecuencia de puesta separando las hembras de una sola nidada, el resultado para las dos playas en las siete temporadas fue de 4.36±0.87 veces por temporada. Con base en este dato se estimó el número de nidadas en la región, asumiendo que las hembras de una sola puesta en las playas estudiadas tenían la misma frecuencia de puesta pero en otras playas de la región.
El número de nidadas inferidas varía de 102 en 2000 a 484 en 2006, la proporción de hembras anidando cada año es de 0.4 (reemigraciones cada 2.50±0.73 años) y la frecuencia de puesta de 4.36±0.87 veces por temporada. La Figura 6 muestra el estimado del número más probable de hembras en la población de Paria con estos supuestos. La población de hembras adultas se estimó para 2000 en 58 (ámbito 28-113) y para 2006 en 277 (ámbito 133-532). La tendencia al incremento de hembras es exponencial y significativa [r= 0.966, p= 0.0004, N. hembras= exp(-452.174+0.228194 año)].
año)].
DISCUSIÓN
Reemigraciones y movimientos entre playas
En Paria el intervalo de reemigración es de 2.5 años, que es el más comúnmente usado para las estimaciones poblacionales de tortuga cardón (Spotila et al., 1996), aunque menor que el encontrado en Playa Grande (3.7±0.2 años), Costa Rica (Reina et al., 2002). El porcentaje de reemigrantes en Guyana Francesa varía año tras año entre 1 y 18% de las hembras marcadas (Girondot y Fretey, 1996). En Gandoca, Costa Rica (Chacón, 1999), las hembras reemigrantes constituyen entre el 8 y el 23%, aunque con una serie de datos de 15 años, el mismo autor indica que debido a la movilidad de hembras entre las playas de anidación, no intentó definir el intervalo de reemigración (Chacón y Eckert, 2007) y en Playa Grande, en la costa del Pacífico de Costa Rica, observaron 15% de retornos en seis años (Reina et al., 2002). De igual forma, en seis años de estudio, en Cipara y Querepare, el 8.2% de las hembras está constituido por reemigrantes.
En conjunto, el 7.6% de hembras marcadas, en Cipara y Querepare, fueron observadas en más de una playa en la misma temporada. En Surinam el 10-18% de las hembras observadas tenían marcas de otra procedencia, indicando que habían anidado y sido marcadas en una playa de otro país. Entre playas del mismo Surinam el intercambio entre playas cercanas (10-15 km) es de hasta 82% y entre playas más lejanas (100 km) de hasta 18% de hembras, para un estimado global de 12% (Hilterman y Goverse, 2007).
En la costa del Pacífico de Costa Rica (Piedra et al., 2007), el 46% de las hembras (n = 79) cambiaron de playa en la misma temporada de anidación. En Gandoca, en el Caribe costarricense (Chacón y Eckert, 2007), se documentó que 408 hembras de tortuga cardón observadas entre 1990 y 2004, se habían movilizado entre Costa Rica, Panamá y Colombia.
Morfometría
La LCC y el ACC promedio de las tortugas de Paria están dentro de lo esperado para las poblaciones del Atlántico occidental (Pritchard, 1971). En algunas playas de anidación, como Tortuguero y Gandoca, Costa Rica, la talla media de las hembras calculada por Harrison y Troeng (2003) (n= 110, 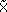 = 154.7±6.5 cm) al igual que la estimada por Chacón y Eckert (2007) (n= 2751,
= 154.7±6.5 cm) al igual que la estimada por Chacón y Eckert (2007) (n= 2751, 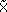 = 153.2 cm) son mayores. En Parguito, Isla Margarita, Venezuela, donde con cierta frecuencia anidan hembras marcadas en Paria, Hernández et al. (2005) encontraron tallas de 153.1±5.2 cm. En St. Croix, Islas Vírgenes, McDonnald et al. (1993) registran una talla media un centímetro mayor (
= 153.2 cm) son mayores. En Parguito, Isla Margarita, Venezuela, donde con cierta frecuencia anidan hembras marcadas en Paria, Hernández et al. (2005) encontraron tallas de 153.1±5.2 cm. En St. Croix, Islas Vírgenes, McDonnald et al. (1993) registran una talla media un centímetro mayor (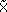 = 152.8 cm). Finalmente, en La Playona, Colombia, con cierto intercambio de hembras con Gandoca, Duque et al. (2000) encontraron tallas algo menores (n= 189,
= 152.8 cm). Finalmente, en La Playona, Colombia, con cierto intercambio de hembras con Gandoca, Duque et al. (2000) encontraron tallas algo menores (n= 189, 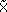 = 150.9).
= 150.9).
La razón por la que las hembras anidando en Cipara hayan aumentado de talla con los años, (aunque con disminuciones en 2003 y 2006) puede tener múltiples explicaciones, desde la posible variabilidad sistemática en las mediciones, las condiciones ambientales de las áreas de alimentación de las diferentes cohortes, la incorporación de hembras mayores provenientes de otras playas y la mayor edad de las hembras. El análisis del incremento en tallas indica que el LCC aumentó hasta 2004 y posteriormente se ha estabilizado. Una posible explicación es que las tallas crecientes de los cinco primeros años quizás se deben al crecimiento de las hembras dada una menor mortalidad, lo cual también explicaría el mayor número de hembras. Posterior a 2004, el incremento de hembras jóvenes pudo haber compensado la mayor talla de las hembras repitientes por lo que las tallas se estabilizaron. Sin embargo, hasta el momento, el análisis comparativo de las tallas de hembras reemigrantes con novatas no muestra evidencias de esto, posiblemente por el relativamente corto tiempo de la serie. Este aumento de talla en algunas temporadas ya ha sido registrado anteriormente, sin ofrecer explicación (Harrison y Troeng, 2003).
Las cardón están entre los reptiles vivientes más grandes (Price et al., 2004), con un crecimiento en longitud de 30 veces y un aumento en masa de cerca de cuatro órdenes de magnitud entre el nacimiento y la madurez sexual. Esta gran talla les permite realizar migraciones reproductivas de miles de kilómetros y varios meses, en las que pierden hasta un tercio de su masa corporal (James et al., 2005). En teoría, las tortugas son capaces de tener crecimiento indefinido, sin embargo, muchas especies no crecen significativamente después de la madurez sexual (Carr y Goodman, 1970), aunque la llegada a la madurez es un concepto que no puede ser ligado estrictamente a la talla (Limpus, 1998); en las tortugas, como en otros reptiles, la longevidad como adulto es proporcional a la edad de la madurez (Shine e Iverson, 1995).
Price et al. (2004) encontraron que las hembras anidando en Playa Grande, en el Pacífico de Costa Rica, crecen 0.2 empaño1 tanto en LCC como en ACC. En Paria se encontró un crecimiento en LCC de 0.85±1.1 cm año-1 y en ACC de 0.64±0.56 cm
año-1 y en ACC de 0.64±0.56 cm año-1. Este crecimiento es mayor que el observado en el Pacífico, donde la talla media de las hembras es de 147.0 cm. En otras especies el crecimiento de las hembras adultas se ha estimado en 0.11 cm
año-1. Este crecimiento es mayor que el observado en el Pacífico, donde la talla media de las hembras es de 147.0 cm. En otras especies el crecimiento de las hembras adultas se ha estimado en 0.11 cm año-1 de LCC y 0.27 cm
año-1 de LCC y 0.27 cm año-1 de ACC en tortugas verdes (Chelonia mydas) y 0.36 cm
año-1 de ACC en tortugas verdes (Chelonia mydas) y 0.36 cm año-1 de LCC y 0.51 cm
año-1 de LCC y 0.51 cm año-1 de ACC en tortugas cabezonas (Carena carena) en el Mediterráneo (Broderick et al., 2003).
año-1 de ACC en tortugas cabezonas (Carena carena) en el Mediterráneo (Broderick et al., 2003).
En teoría, las hembras más pequeñas crecen más rápido (Price et al., 2004); sin embargo, en Paria la relación entre la talla inicial (LCC) y el crecimiento anual presentó una relación negativa no significativa al igual que para ACC. Otra hipótesis relaciona el crecimiento de adultos y las reemigraciones reproductivas multianuales (Congdon et al., 2001). Sin embargo, al igual que en el Pacífico de Costa Rica (Price et al., 2004), en Paria tampoco se encontró relación entre el intervalo de reemigración y el crecimiento.
Estimación del número de hembras de la población
Las estimaciones del número de hembras que componen una población anidadora de tortugas marinas y su tendencia se basan en dos posibles enfoques; se modela la dinámica poblacional, o se siguen las tendencias en el número de animales o rastros observados (Girondot et al., 2007). En la mayoría de los estudios de playas de anidación se observan y cuantifican las nidadas, nidos o las huellas y donde hay trabajo de mareaje también las hembras. Sin embargo, los muéstreos suelen presentar incertidumbres en temporadas, horas y extensión cubiertas. Por esto, para estimar el número de hembras anidando los métodos se basan en la frecuencia de puesta inferida a partir de los eventos observados (Broderick et al., 2002). En el caso de la tortuga cardón, la existencia de un alto número de hembras que anidan en una playa solamente una vez (Briane et al., 2007), hace que las frecuencias de puesta inferidas, con base en las observadas, sean más bajas que las usuales para la especie. De la misma manera, la variabilidad interanual del número de hembras anidando (Hays, 2000) y los movimientos entre diferentes playas, de una misma hembra en una temporada, añaden incertidumbre al cálculo.
Chacón (1999), basado en el alto intercambio entre playas de hembras anidadoras, propone que para el Caribe sur se trata de una metapoblación y que su hábitat de anidación puede incluir playas en varios países. Por otro lado, los movimientos de las hembras entre playas de Trinidad y Paria-Margarita señalan que estas zonas pueden tener intercambio abierto de hembras.
El número de hembras de cardón anidando en el Atlántico occidental ha recibido mucha atención desde que, ante el colapso de las poblaciones del Pacífico, se buscaron las posibles explicaciones para este fenómeno. En 1996 se consideraba que la población de cardón mundial era del orden de 34529 hembras adultas, de las cuales el 54% anidaba en las Guayanas y el 11.6% en el Caribe (Spotila et al., 1996). Se ha observado una disminución del número de cardón anidando en varias zonas del Caribe. Sin embargo, evaluaciones recientes indican que la población de hembras anidadoras en Gabón es entre 15730 y 41373 (Witt et al., 2009). De la misma manera, ahora se estima que en Urabá, en la frontera entre Colombia y Panamá, se depositan entre 5700 y 7500 nidos anuales (Patiño-Martínez et al., 2008). En América Central Troeng et al. (2004) estiman entre 5759 y 12893 nidos anuales y una tendencia estable o una lenta disminución. Estos recientes estimados poblacionales mundiales modifican lo planteado por Troeng et al., (2004) y actualmente se considera que la población de hembras en edad reproductiva puede estar entre 24000 y 58000, de las cuales entre el 94 y el 98% son del Atlántico y entre el 26 y 30% del Gran Caribe. La de Trinidad sería considerada la tercera población anidadora de cardón (Lee, 2005). Las otras poblaciones importantes de tortuga cardón en el Caribe que han sido evaluadas [Costa Rica (Troëng et al., 2004), Urabá en Colombia (Patiño-Martínez et al., 2008), St. Croix en Islas Vírgenes (McDonnald et al., 1993) y Paria en Venezuela] representarían entre el 10 y el 12% de hembras totales.
De acuerdo a estos estimados, la población que usa a Paria como zona de reproducción, constituye cerca al 1% de la población mundial estimada de hembras, y entre el 2 y 4% de las hembras reproductoras del Gran Caribe. El aporte de hembras en el contexto mundial no se aprecia como importante, sin embargo, el intercambio geográfico evidenciado con Trinidad permitiría sugerir que las rutas migratorias post-anidación de esta especie probablemente están relacionadas con las de hembras que anidan en dicha isla, incluyendo movimientos hacia zonas de alimentación en el Atlántico norte y en el Atlántico este. La continuidad del seguimiento en Cipara y Querepare se considera indispensable para establecer si las inferencias son ciertas, aunque evidentemente el mareaje con placas metálicas y microchips debe ser complementado con estudios genéticos y satelitales.
AGRADECIMIENTOS
Los autores agradecen a las becas del BP Conservation Programme. Laura Sarti facilitó los estándares del Proyecto Laúd (México). Apoyo financiero y/o institucional de: Fundación Thomas Merle, Columbus Zoo, Gobernación del Estado Sucre, Alcaldía del Municipio Arismendi, Ministerio de Relaciones Exteriores, Universidad Simón Bolívar, Palm Beach Zoo, Cleveland Metroparks Zoo, Association of Zoos and Aquariums, Embajada de Nueva Zelandia, Embajada Británica, Embajada del Reino de los Países Bajos, Rufford Small Grants, Brookfield Zoo-Chicago Zoological Society, National Fish and Wildlife Foundation, Santa Ana Zoo, Roosevelt Zoo, Duke Center for Marine Conservation-Oak Foundation, Shell de Venezuela S.A., Fundación Neotrópico y la Asociación Venezolana de Zoológicos y Acuarios. Aportes en "especies" han sido recibidos del National Marine Fisheries Service, Caribbean Conservation Corporation, FUDENA, WIDECAST Costa Rica, Nature Seekers Incorporated y WIDECAST MTTC (Universidad de Barbados). El Fondo IEA de PROVITA apoyó la preparación del artículo. Las Licencias de Caza Científica para el período fueron: 1999:536-538; 2000:379-382; 2001:784,785; 2002:231-233; 2003:152-154; 2004:116, 240-241; 2005:540, 668- 670; 2006:1217-1218. A las comunidades de Cipara y Querepare y colaboradores en áreas adyacentes. A todo el destacamento militar del área. Los coordinadores de investigación, asistentes de investigación voluntarios y asistentes locales han sido indispensables. Han sido claves para el proyecto Alejandro Fallabrino y Ricardo Hernández, en su inicio; Vicente Vera, Beatriz Alcalá y Emma Doyle han sido baluartes en su desarrollo.
BIBLIOGRAFÍA
1 Babarro, R. 2004. Marco legal relativo a la conservación de las tortugas marinas en Venezuela. 27-45. En: Babarro, R., A. Sanz y B. Mora (Eds.). Tortugas marinas de Venezuela. Acciones para su conservación. Fondo Editorial Fundambiente, Caracas. 116 p. [ Links ]
2 Baker, J. D. 2004. Evaluation of closed capture-recapture methods to estímate abundance of Hawaiian monk seals. Ecol. Appl., 14 (4). 987-998. [ Links ]
3 Bolten, A. 2000. Técnicas para la medición de tortugas marinas. 126-131. En: Eckert, K., K. Bjorndal, F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de tortugas marinas. Grupo especialista en tortugas marinas UICN/CSE, México D.F. 278 p. [ Links ]
4 Briane, J. P., P. Rivalan y M. Girondot. 2007. The inverse problem applied to the observed clutch frequency of leatherback turtles from Yalimapo beach, French Guiana. Chel. Cons. Biol., 6 (1): 63-69. [ Links ]
5 Broderick, A., F. Glen, B. J. Godley y G. C. Hays. 2002. Estimating the number of green and loggerhead turtles nesting annually in the Mediterranean. Oryx, 36 (3): 227-236. [ Links ]
6 Broderick, A., F. Glen, B. J. Godley y G. C. Hays. 2003. Variation in reproductive output of marine turtles. J. Exp. Mar. Biol. Ecol., 288: 95-109. [ Links ]
7 Carr, A. y D. Goodman. 1970. Ecological implications of size and growth in Chelonia. Copeia, 1970: 783-786. [ Links ]
8 Chacón, D. 1999. Anidación de la tortuga Dermochelys coriacea (Testudines: Dermochelyidae) en playa Gandoca, Costa Rica (1990 a 1997). Rev. Biol. Trop., 47 (1-2): 225-236. [ Links ]
9 Chacón, D. y K. L. Eckert. 2007. Leatherback sea turtle nesting at Gandoca Beach in Caribbean Costa Rica: Management recommendations from fifteen years of conservation. Chel. Cons. Biol., 6 (1): 101-110. [ Links ]
10 Congdon, J. D., R. D. Nagle, O. M. Kinney y R. C. van Loben Sels. 2001. Hypotheses of aging in a long-lived vertebrate, Blanding's turtle (Emydoidea blandingii). Exp. Gerontol., 36: 813-827. [ Links ]
11 Duque, V. M., V. P. Páez y J. A. Patiño. 2000. Nesting ecology and conservation of the leatherback turtle, Dermochelys coriacea at La Playona, Chocoan Gulf of Uraba (Colombia), in 1998. Actual. Biol., 22 (72): 37-53. [ Links ]
12 Dutton, D. L., P. H. Dutton, M. Chaloupka y R. H. Boulon. 2005. Increase of a Caribbean leatherback turtle Dermochelys coriacea nesting population linked to long-term nest protection. Biol. Cons., 126 (2): 186-194. [ Links ]
13 Eckert, K. L. 2001. Estado de conservación y distribución de Dermochelys coriacea. 25-55. En: Eckert, K. L. y F. A. Abreu-Grobois (Eds.). Conservación de tortugas marinas en la Región del Gran Caribe - Un diálogo para el manejo regional efectivo. WIDECAST, IUCN/Species Survival Commission Marine Turtle Specialist Group, WWF y UNEP-Caribbean Environment Programme, Santo Domingo. 170 p. [ Links ]
14 Gerrodette, T. y B. L. Taylor. 1999. Estimating population size. 67-71. En: Eckert, K., K. Bjorndal, F. Abreu-Grobois y M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de tortugas marinas. Grupo especialista en tortugas marinas UICN/CSE, México D.F. 278 p. [ Links ]
15 Girondot, M. y J. Fretey. 1996. Leatherback turtles, Dermochelys coriacea, nesting in French Guiana, 1978-1995. Chel. Cons. Biol., 2 (2): 204-208. [ Links ]
16 Girondot, M., M. H. Godfrey, L. Ponge y P. Rivalan. 2007. Modeling approaches to quantify leatherback nesting trends in French Guiana and Suriname. Chel. Cons. Biol., 6 (1): 37-46. [ Links ]
17 Gremone, C. y J. L. Gómez. 1984. Isla de Aves como área de desove de la tortuga verde Chelonia mydas. FUDENA, Editorial Arte, Caracas. 57 p. [ Links ]
18 Guada, H. J. y J. Buitrago. 2008. Cardón. 170. En: Rodríguez, J. P. y F. Rojas-Suárez (Eds.). Libro rojo de la fauna venezolana. Tercera edición, Provita y Shell Venezuela, S. A., Caracas. 365 p. [ Links ]
19 Guada, H. J. y M. A. Rondón. 2003. Informe técnico del proyecto de investigación y conservación de tortugas marinas, Querepare, península de Paria, Estado Sucre, Año 2002. CICTMAR, Caracas. 12 p. [ Links ]
20 Guada, H. J. y G. Solé. 2000. WIDECAST Plan de acción para la recuperación de las tortugas marinas de Venezuela. Informe técnico del PAC No. 39, UNEP, Caribbean Environment Programe, Kingston. 112 p. [ Links ]
21 Guada, H. J., A. Fallabrino, A. C. Martínez, D. A. Muñoz, M. A. Rondón, S. Gómez, M. Morisson, L. Flórez, A. M. Santana, G. Idrobo, J. L. Di Paola, E. Carabelli, L. Veiga, A. Naveda, D. Urbano y C. Urbano. 2002 Proyecto de investigación y conservación de tortugas marinas en Cipara, península de Paria, Estado Sucre, Venezuela: Resultados preliminares de la temporada de anidación del 2000. Noticiero de Tortugas Marinas, 95: 17-18. [ Links ]
22 Harrison, E. y S. Troeng. 2003. Reporte programa de tortuga baula 2002 Tortuguero, Costa Rica. Caribbean Conservation Corporation, Ministerio del Ambiente y Energía de Costa Rica y Care For the Wild. International, San José. 33 p. [ Links ]
23 Hays, G. 2000. The implications of variable remigration intervals for the assessment of population size in marine turtles. J. Theor. Biol., 206: 221-227. [ Links ]
24 Hernández, R., J. Buitrago y H. Guada. 2005. Evaluación de la anidación de la tortuga cardón, Dermochelys coriacea (Vandelli, 1761) (Reptilia: Dermochelyidae), en playa Parguito, isla de Margarita, durante la temporada 2001. Mem. Fund. La Salle Cienc. Nat., 161-162: 77-89. [ Links ]
25 Hilterman, M. y E. Goverse. 2007. Nesting and nest success of the leatherback turtle (Dermochelys coriacea) in Suriname, 1999-2005. Chel. Cons. Biol., 6 (1): 87-100. [ Links ]
26 Hughes, G. R. 1982. Nesting cycles in sea turtles-typical or atypical? 81-89. En: Bjorndal, K. (Ed.). The biology and conservation of sea turtles. Smithsonian Institute Press, Washington, D.C. 583 p. [ Links ]
27 IUCN. 2009. The IUCN red list of threatened species, http://www.iucnredlist.org. 15/11/2009. [ Links ]
28 James, M. C, A. Ottensmeyer y R. A. Myers. 2005. Identification of high-use habitat and threats to leatherback sea turtles in northern waters: new directions for conservation. Ecol. Letters, 8: 195-201. [ Links ]
29 Lee, L. L. 2005. Beach dynamics and nest distribution of the leatherback turtle (Dermochelys coriacea) at Grande Riviere Beach, Trinidad and Tobago. Rev. Biol. Trop., 53 (suppl. 1): 239-248. [ Links ]
30 Limpus, C. J. 1998. Definition of "adult" for marine turtle growth models. 67. En: Epperly, P. y J. Braun (Eds.). Proceedings of the 17th Annual Sea Turtle Symposium. NOAA Technical Memorandum. N° NMFS-SEFSC-415. Department of Commerce, Tallahassee, Estados Unidos. 294 p. [ Links ]
31 McDonnald, D., P. Dutton y R. Boulon. 1993. Tagging and nesting research on leatherback sea turtles (Dermochelys coriacea) on Sandy Point, St. Croix, U.S. Virgin Islands. Annual report to the U.S. Fish and Wildlife Service. Contract No. PC-PyNR-287-93 to U.S. Virgin Islands Department of Planning and Natural Resources, Vero Beach, Estados Unidos. 26 p. [ Links ]
32 Patiño-Martínez, J., A. Marco, L. Quiñones y B. J. Godley. 2008. Globally significant nesting of the leatherback turtle (Dermochelys coriacea) on the Caribbean coast of Colombia and Panama. Biol. Cons., 141 (8): 1982-1988. [ Links ]
33 Piedra, R., E. Vélez, P. Dutton, E. Possardt y C. Padilla. 2007. Nesting of the leatherback turtle (Dermochelys coriacea) from 1999-2000 through 2003-2004 at Playa Langosta, Parque Nacional Marino Las Baulas de Guanacaste, Costa Rica. Chel. Cons. Biol., 6(1): 111-116. [ Links ]
34 Price, E. R, B. P. Wallace, R. D. Reina, J. R. Spotila, F. V. Paladino, R. Piedra y E. Vélez. 2004. Size, growth, and reproductive output of adult female leatherback turtles Dermochelys coriacea. Endang. Spec. Res., 5: 1-8. [ Links ]
35 Pritchard, P. C. H. 1971. The leatherback or leathery turtle Dermochelys coriacea. IUCN Monograph (1), International Union for Conservation of Nature and Natural Resources, Gland, Suiza. 39 p. [ Links ]
36 Pritchard, P. y P. Trebbau. 1984. The turtles of Venezuela. Society for the Study of Amphibians and Reptiles, Nueva York. 468 p. [ Links ]
37 Quijada, A. y C. Balladares. 2004. Actividades en pro de la conservación de las tortugas marinas en Venezuela. 47-53. En: Babarro, R., A. Sanz y B. Mora (Eds.). Tortugas marinas en Venezuela. Acciones para su conservación. Fondo Editorial Fundambiente, Caracas. 116 p. [ Links ]
38 Reina, R. D., P. A. Mayor, J. R. Spotila, R. Piedra y F. Paladino. 2002. Nesting ecology of the leatherback turtle, Dermochelys coriacea, at Parque Nacional Marino Las Baulas, Costa Rica: 1988-1989 to 1999-2000. Copeia, 3: 653-664. [ Links ]
39 Rondón, M. A, J. Buitrago y M. McCoy. 2009. Impacto de la luz artificial sobre la anidación de la tortuga marina Dermochelys coriacea (Testudines: Dermochelyidae), en playa Cipara, Venezuela. Rev. Biol. Trop., 57 (3): 515-528. [ Links ]
40 Rondón, M. A., J. Buitrago y H. J. Guada. 2010. Biología reproductiva de la tortuga cardón (Dermochelys coriacea) en las playas Cipara y Querepare, península de Paria, Venezuela, durante las temporadas de anidación 2000-2006. Interciencia, 35 (4): 263-270. [ Links ]
41. Sarti, L. y N. García. 1999. Estimación del tamaño de la población ani dadora de tortuga laúd Dermochelys coriacea y su distribución en el Pacífico mexicano. Manual para la toma de datos y organización de la información en los campamentos tortugueros del proyecto. Instituto Nacional de Pesca. México D.F. 24 p. [ Links ]
42 Shine, R. y J. B. Iverson. 1995. Patterns of survival, growth and maturation in turtles. Oikos, 72 (3): 343-348. [ Links ]
43 Spotila, J. R., A. Dunham, A. Leslie, A. C. Steyermark, P. Plotkin y F. Paladino. 1996. Worldwide population decline of Dermochelys coriacea: Are leatherback turtles going extinct? Chel. Cons. Biol., 2 (2): 209-222. [ Links ]
44 Troëng, S., D. Chacón y B. Dick. 2004. Possible decline in leatherback turtle Dermochelys coriacea nesting along the coast of Caribbean Central America. Oryx, 38 (4): 395-403. [ Links ]
45 Velázquez, F., A. Prieto, H. Guada, L. González y M. Rondón. 2006. Algunos aspectos de la biología reproductiva de la tortuga cardón Dermochelys coriacea (Vandelli, 1761) (Reptilia: Dermochelyidae) en playa Querepare, península de Paria, Estado Sucre. Saber, 8 (2): 123-132. [ Links ]
46 Witt, M. J, B. Baert, A. C. Broderick, A. Formia, J. Fretey, A. Gibudi, G. A. Mounguengui-Mounguengui, C. Moussounda, S. Ngouessono, R. J. Parnell, D. Roumet, G. P. Sounguet, B. Verhage, A. Zogo y B. J. Godley. 2009. Aerial surveying of the world's largest leatherback turtle rookery: A more effective methodology for large-scale monitoring. Biol. Cons., 142: 1719-1727. [ Links ]
FECHA DE RECEPCIÓN: 16/03/2010 FECHA DE ACEPTACIÓN: 01/08/2011