Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.40 no.2 Santa Marta July/Dec. 2011
ESTADO ACTUAL DE LAS POBLACIONES DEL ERIZO NEGRO DIADEMA ANTILLARUM PHILIPPI (ECHINOIDEA: DIADEMATIDAE) EN EL PARQUE NACIONAL NATURAL TAYRONA Y PLAYA BLANCA, SANTA MARTA, CARIBE COLOMBIANO
STATUS OF THE POPULATIONS OF THE BLACK SEA URCHIN DIADEMA ANTILLARUM PHILIPPI (ECHINOIDEA: DIADEMATIDAE) AT TAYRONA NATIONAL NATURAL PARK AND PLAYA BLANCA, SANTA MARTA, COLOMBIAN CARIBBEAN
Fanny Tatiana González-Gaviria y Rocío García-Urueña
Universidad del Magdalena, Programa de Biología, Instituto de Investigaciones Tropicales y Grupo de Investigación Sensores Remotos y Ecosistemas Marinos y Costeros. Santa Marta, Colombia, fannytgonzalez@gmail.com (F.T.G.G.), garciarociop@yahoo.com (R.G.U.)
RESUMEN
Diadema antillarum sufrió un evento de mortandad masiva entre 1983-1984 que redujo en un 93% sus densidades, fenómeno que conllevó a un dominio de macroalgas en muchos arrecifes. Para conocer el estado de las poblaciones del erizo se realizó este estudio en el Parque Nacional Natural Tayrona (PNNT) y en Playa Blanca (bahía de Gaira). En cada sitio se ubicaron cinco líneas detransectos de 10 m y en cada uno se estimó la densidad por medio de cuadrantes de 1 m2 y se registró mediante video la composición de la comunidad y la rugosidad. La estructura de talla se calculó colectando entre 31 y 52 individuos y midiendo el diámetro y altura de la testa. La mayor densidad promedio se encontró en Nenguange (1.16 ind/m2) y la menor en Chengue (0.04 ind/m2), ambas localizadas en el PNNT. El diámetro promedio de la testa estuvo entre 58.84 y 80.60 mm. No se encontró ninguna relación entre los principales componentes de los arrecifes (corales, macroalgas y coral muerto), ni entre la diversidad y la uniformidad con respecto a las densidades del erizo. Los resultados indican que las densidades están en el ámbito actual registrado en otras regiones del Caribe, e indican una lenta recuperación de las poblaciones.
PALABRAS CLAVE: Caribe colombiano, Diadema antillarum. Parque Nacional Natural Tayrona.
ABSTRACT
Diadema antillarum experienced a mass mortality event between 1983-1984 that dropped its densities about 93%, a phenomenon that led to a macroalgae dominance in most reefs. This study was performed in Tayrona National Natural Park (PNNT) and Playa Blanca (Bahía de Gaira) to determine the status of the black sea urchin populations. At each site, five 10 m line transects were located perpendicular to each other and the density was estimated by 1 m2 squares; coral community composition and roughness was recorded by video. Size structure was calculated by collecting between 31 and 52 individuals and measuring the diameter and height of the test. The highest mean density was found in Nenguange (1.16 ind/m2) and lowest ill Chengue (0.04 ind/m2), both located in the PNNT. Mean test diameter was between 58.84 and 80.60 mm. No relation was found between the main reef components (corals, macroalgae or dead coral) and the sea urchin densities, neither between diversity and uniformity and sea urchin densities. Our results show that the density is in the range of current abundance reported in other Caribbean regions, indicating a slow recovery of populations.
KEY WORDS: Colombian Caribbean, Diadema antillarum, Tayrona National Natural Park.
INTRODUCCIÓN
Diadema antillarum Philippi es un erizo de aguas someras que estuvo ampliamente distribuido a lo largo de los trópicos del mar Caribe y el océano Atlántico (Randall et al., 1964), con densidades de más de 20 ind/m2 en la mayoría de los arrecifes (Chiappone et al., 2002a; Noriega et al., 2006). Sin embargo, en 1983 el erizo sufrió una mortandad masiva que redujo en un 93% las densidades a lo largo del Atlántico tropical occidental; la más extensa y severa mortandad registrada para un organismo marino (Lessios et al., 1984b; Carpenter, 1988; Lessios, 1988a). Este evento despertó la preocupación de la comunidad científica debido a la magnitud y rapidez en la desaparición del erizo, que trajo consecuencias tanto ecológicas como económicas (Steiner y Williams, 2006), ya que básicamente muchos arrecifes coralinos pasaron de ser dominados por corales hermatípicos, a ser sustituidos por grandes extensiones de macroalgas (Edmunds y Carpenter, 2001; Lessios et al., 2001; Lessios, 2005; Steiner y Williams, 2006). Según Edmunds y Carpenter (2001), D. antillarum contribuye al establecimiento de reclutas de diferentes especies de coral, ya que el aumento en la densidad está asociada con una reducción de la cobertura de macroalgas y un aumento en la densidad de corales juveniles, razón por la cual se le atribuye a la reducción de las poblaciones del erizo el empobrecimiento en la estructura de la comunidad de los arrecifes coralinos (Steiner y Williams, 2006).
En los últimos 27 años esta especie ha sido objeto de numerosas investigaciones con el propósito de cuantificar las densidades actuales. La evidencia ha demostrado su drástica reducción y lenta recuperación en la mayoría de las localidades estudiadas (Lessios, 1988a, 1995, 2005; Edmunds y Carpenter, 2001; Chiappone et al., 2002a; Noriega et al., 2006; Steiner y Williams, 2006). El mayor inconveniente ha sido la inexistencia en la mayoría de los arrecifes de información previa a la mortandad (Lessios, 1988a). En Panamá, para 1982 se registraban densidades promedio de 10.98 ind/m2 (Lessios et al., 1984a), y luego de 10 años, se registró una densidad de sólo 0.3% de los niveles pre-mortandad (Lessios, 1988b, 1995). Veinte años después Lessios (2005) registró una densidad de solo el 6.5% de los valores pre-mortandad. En los cayos de la Florida en 1982 oscilaban entre 4 a 5 ind/m2, siendo estos valores más bajos en comparación con otros lugares del Caribe, y luego de la mortandad fueron de 0.05 ind/m2 para 1999 y mayor de 0.03 ind/m2 en el 2000 (Chiappone et al, 2002a).
Para otras regiones aunque no se conocían las densidades pre-mortandad, la problemática conllevó a conocer la posible recuperación de las poblaciones. En Costa Rica, Alvarado et al (2004) registraron 0.7 ind/m2 en 1999 y 0.3 ind/m2 en el año 2003. En las Antillas menores (Dominica) las densidades entre el 2001 y el 2004 fueron de 1.50 y 2.00 ind/m2, respectivamente (Steiner y Williams, 2006). Según Lugo (2004), para Puerto Rico se encontraron 0.08 ind/m2. En Venezuela, Noriega et al. (2006) registraron entre 0.28 y 4 ind/m2 en el 2005 y en Jamaica entre 5-12 ind/m2 en el 2000 (Edmunds y Carpenter, 2001). Lo que indica que en algunas poblaciones de D. antillarum del Caribe aún no se han restablecido las densidades anteriores a la mortandad (Edmunds y Carpenter, 2001; Chiappone et al., 2002a; Lessios, 2005; Noriega et al., 2006; Steiner y Williams, 2006).
En Colombia, para el Parque Nacional Natural Tayrona (PNNT) y la región de Santa Marta en general, se han adelantado trabajos de cuantificación de densidad y estado poblacional de otras especies como Echinometra lucunter (Monroy y Solano, 2005) y a pesar de que se ha evidenciado que D. antillarum es una especie clave en los arrecifes coralinos, los datos que se tienen de la densidad antes de la mortandad consisten sólo de observaciones de campo realizadas por algunos investigadores. Por lo tanto, este trabajo se constituye en el primer aporte al conocimiento de la densidad y el estado actual de la población de D. antillarum en lo referente a su estructura por tallas, a la preferencia del tipo de sustrato, y su afectación dependiendo del grado de intervención entre distintas áreas protegidas del PNNT y la zona turística del sector de Playa Blanca en El Rodadero.
ÁREA DE ESTUDIO
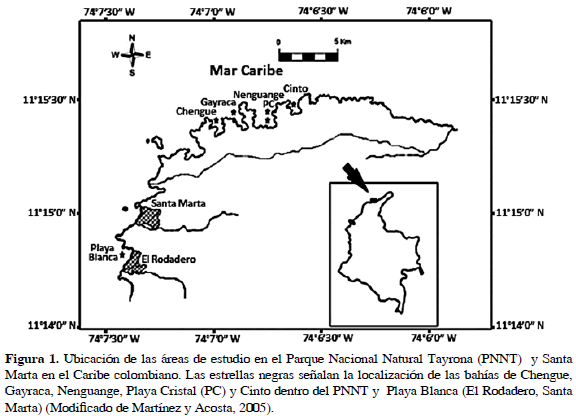
El área de Santa Marta y el Parque Nacional Natural Tayrona está ubicada sobre la costa del departamento del Magdalena (Figura 1). Su topografía está determinada por la entrada directa al mar de las estribaciones de la Sierra Nevada de Santa Marta. Sus costas generalmente rocosas y diversos acantilados, bahías, ensenadas, puntas e islotes, generan un alto grado de heterogeneidad ambiental (Manrique-Rodríguez et al., 2006).
En esta región el clima es tropical, con una temperatura que oscila entre 25 y 30 °C y una precipitación promedio anual de 500 mm (Martínez y Acosta, 2005). Entre las características oceanógraficas más sobresalientes de la región está un evento estacional de surgencia entre diciembre y abril (época seca), provocado por la interacción de los vientos alisios con la geomorfología costera (Gutiérrez-Salcedo et al, 2007). Este evento genera un descenso en la temperatura superficial del agua (34.5 °C en promedio) y aumento de la salinidad (30 en promedio). En el segundo periodo del año, de mayo a noviembre (época lluviosa), la influencia de la contracorriente del Caribe aporta aguas cálidas (36 °C en promedio), de menor salinidad (28 en promedio) y con alto contenido de material disuelto y en suspensión. Dicho régimen climático puede tener variaciones interanuales (Gutiérrez-Salcedo et al., 2007).
Dentro del PNNT se estudiaron las bahías de Chengue, Gayraca, Nenguange (incluyendo dos estaciones, Nenguange propiamente dicha y Playa Cristal) y Cinto, ubicadas entre 11°20' N y 74°08' W y 11°20'27" N 74°03'12" W. En adición se estudió la zona no protegida de El Rodadero, situada a 11°12' N y 74°14' W, la cual es una bahía de poca profundidad, inclinada en forma cóncava suavemente hacia el este, que tiene casi todo el año aguas tranquilas y en ocasiones un poco movidas. La estructura del sustrato está conformada tanto de sedimentos fluviales como sedimentos marinos (Mertins, 1972).
MATERIALES Y MÉTODOS
Fase de campo
Los muestreos fueron llevados a cabo mensualmente entre marzo y julio de 2009. En cada sitio muestreado se trazaron cinco transectos de 10 m cada uno ubicados paralelamente a la línea de costa (modificado de Lugo, 2004). Para observar la estructura de la comunidad se registró en video la densidad y diversidad de los corales y otros organismos en términos del porcentaje de cobertura de los tipos de substrato. Se analizaron 50 imágenes por arrecife capturadas con el programa Pinnacle StudioTM Ultímate, Versión 12 y se cuantificaron con el programa Coral Point Count 3.6. En Playa Blanca, debido a inconvenientes de logística, no fue posible realizar los video-transectos, por lo que la cuantificación de la cobertura coralina y los tipos de sustrato se realizó mediante el método de cuadrantes. Para cada arrecife se calcularon los índices de diversidad (H') y uniformidad (J').
La rugosidad se obtuvo extendiendo una cadena ajustada al perfil del fondo a lo largo de cada transecto. El índice de rugosidad se calculó dividiendo la longitud total del transecto (10 m) entre la longitud total de la cadena ajustada al perfil del fondo (m). Este índice es la estimación cruda de la complejidad estructural del área muestreada (Lugo, 2004).
Para estimar la densidad de D. antillarum sobre la línea de cada transecto se colocaron 10 cuadrantes de 1 m2 sin separación y se cuantificó el número de erizos. La estructura de tallas se calculó colectando al azar entre 31 y 52 individuos, esto debido a que en algunos de los arrecifes no se encontró el número propuesto de 50 individuos. Cabe resaltar que en las bahías de Chengue y Cinto estos individuos fueron colectados en raíces de manglar y en sustrato muerto de Acropora palmata, respectivamente. Los erizos fueron mantenidos sumergidos en el mar dentro de una canasta de plástico hueca, procurando que quedaran el menor tiempo posible expuestos a la desecación. De cada individuo se midió el diámetro y la altura de la testa utilizando un nonio. Al final de la medición los individuos fueron devueltos con vida al mar.
Análisis de datos
Para comparar la densidad, el diámetro y la altura de la testa de D. antillarum entre los arrecifes, inicialmente se comprobaron los supuestos de normalidad y homogeneidad de varianzas; debido a que en ninguno de los casos los datos ni aun trasformados cumplieron con los supuestos se aplicó el test no paramétrico de Kruskall-Wallis para cada caso. Se utilizó el test de comparaciones múltiples no paramétrico de Wilcoxon de rangos para observar las diferencias entre los arrecifes en cada uno de los análisis. Estos cálculos fueron realizados con los programas estadísticos Statgraphics® Plus, versión 5.1. y Systat, versión 10.2.
Así mismo, para comparar la rugosidad entre arrecifes se realizó un ANOVA a una vía, debido a que los datos cumplieron los supuestos antes mencionados. Por otra parte se realizó un análisis de correlación entre la densidad de corales, cantidad de macroalgas, cantidad de coral muerto, diversidad, uniformidad y densidades de D. antillarum. Finalmente, se realizó un análisis de regresión lineal entre la rugosidad del área total muestreada y las densidades del erizo. Los datos fueron analizados con el programa estadístico Statgraphics® Plus, versión 5.1.
RESULTADOS
Densidad
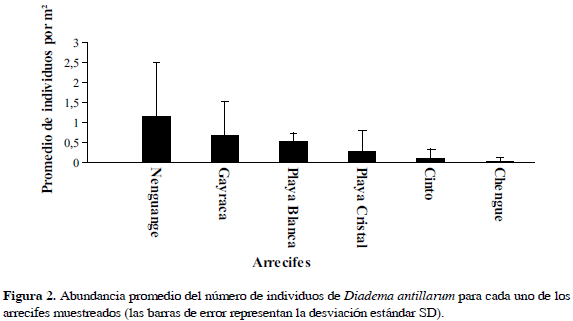
La densidad promedio varió entre 0.04 ind/m2 (SD=0.09) en la bahía de Chengue y 1.16 ind/m2 (SD=1.34) en la bahía de Nenguange (Figura 2). El test de Kruskall-Wallis arrojó diferencias significativas entre los arrecifes (P <0.05), por lo cual, al realizar el test de Wilcoxon de rangos, se separó a la bahía de Nenguange como el sitio con la mayor densidad de individuos, seguido por el grupo de las bahías de Gayraca, Playa Blanca y Playa Cristal como sitios intermedios y las bahías de Chengue y Cinto con las menores densidades.
Estructura de tallas
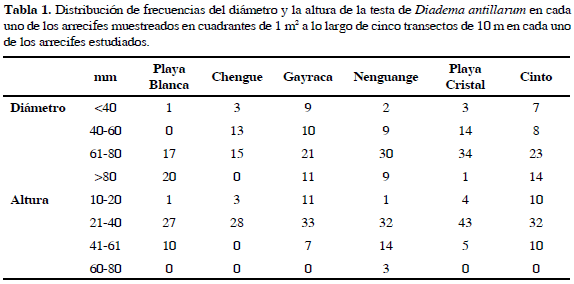
El diámetro promedio de la testa estuvo entre 58.84 (SD=10.46) y 80.60 mm (SD=10.88), estando los individuos más pequeños en la bahía de Chengue y los más grandes en Playa Blanca. El test de Kruskall-Wallis indicó diferencias significativas entre los arrecifes muestreados (P <0.05), por lo cual al realizar el test de Wilcoxon de rangos separó a Playa Blanca como la bahía con el mayor número de individuos con diámetro de la testa superior a 80 mm; Playa Cristal presentó la mayor cantidad de individuos con diámetro de la testa entre 40 y 60 mm y la bahía de Gayraca el mayor número de individuos con diámetro de la testa menor a 40 mm (Tabla 1).
En el caso de la altura los valores estuvieron entre 29.39 (SD=7.16) y 39.80 mm (SD=11.24) presentándose el menor valor en la bahía de Chengue y el mayor en la bahía de Nenguange. El test de Kruskall-Wallis mostró diferencias significativas entre los arrecifes estudiados (P <0.05) y mediante el test de Wilcoxon de rangos se encontró que las bahías de Nenguange y Playa Blanca fueron los sitos con los individuos de mayor altura de la testa respectivamente; Cinto, Playa Cristal y Gayraca como los sitios con alturas intermedias y Chengue con la menor altura.
Teniendo en cuenta la distribución de las frecuencias de tamaño de D. antillarum, ésta fue similar en todos los arrecifes. El mayor número de individuos se encontró en el ámbito promedio de 60 y 80 mm de diámetro, dentro de los cuales Playa Cristal obtuvo las mayores frecuencias. Los individuos más pequeños se encontraron en las bahías de Gayraca y Cinto (<40 mm) respectivamente y los más grandes en Playa Blanca (>80 mm). En cuanto a la altura de la testa, el mayor número de individuos se concentró en un ámbito entre 21 y 40 mmy de igual forma Playa Cristal presentó las mayores frecuencias en estas tallas. Igualmente, las bahías de Gayraca y Cinto presentaron la mayor cantidad de individuos con altura de la testa entre 10-20 mm y Nenguange presentó un mayor número de individuos con diámetro de la testa entre 41-80 mm (Tabla 1).
Estructura de la comunidad
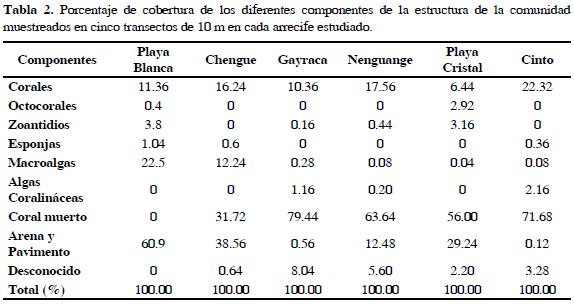
En términos de porcentaje de cobertura se evaluaron los siguientes componentes de la estructura de la comunidad: corales, octocorales, zoantidios, esponjas, macroalgas, algas coralináceas, coral muerto, arena y pavimento, siendo los más representativos los corales, las macroalgas y el coral muerto (Tabla 2). Para los corales se encontró el mayor valor en la bahía de Cinto (22.32%) y el menor en Playa Cristal (6.44%). Así mismo, la mayor cantidad de coral muerto se encontró en la bahía de Gayraca (79.44%) y el menor en Playa Blanca (0%). En cuanto a las macroalgas, Playa Blanca fue la más representativa con 22.5% y Playa Cristal la menor (0.04%). El componente abiótico (arena y pavimento) fue mayor para Playa Blanca (60.9%) y menor en la bahía de Cinto (0.12%) (Tabla 2).
Las especies de coral más representativas para cada arrecife fueron: Siderastrea siderea que en Playa Blanca, Nenguange y Playa Cristal presentó el mayor porcentaje de cobertura; Montastrea annularis, seguida por S. siderea en la bahía de Chengue; Acropora palmata en la bahía de Gayraca y M. faveolata en la bahía de Cinto. Así mismo, el coral de fuego Millepora complanata presentó el mayor porcentaje de cobertura en las bahías de Nenguange, Chengue, Playa Blanca y Playa Cristal respectivamente. La mayor diversidad de corales se encontró en Playa Blanca (H'=1.44) y la menor en la bahía de Nenguange (H'=0.09). De igual forma, el arrecife más uniforme fue el de bahía de Nenguange (J=0.83) y Playa Cristal (J=0.37) fue el menos uniforme. No se evidenció ninguna relación significativa entre las densidades de D. antillarum y la densidad de corales, la cantidad de macroalgas, la cantidad de coral muerto, la diversidad y la uniformidad.
Los valores de rugosidad variaron entre 0.43 en la bahía de Nenguange y 0.92 en Playa Cristal (Tabla 3). Los datos cumplieron con los supuestos de normalidad (test de Shapiro-Wilks P=0.4944) y homogeneidad de varianzas (test de Cochran P=0.3477) y, al realizar el análisis ANOVA, se encontraron diferencias significativas entre los arrecifes (F=23.90, P<0.0001). El test de comparaciones múltiples de Tukey separó a las bahías de Nenguange y Gayraca como los sitos con la mayor rugosidad y Playa Cristal como el sitio de menor rugosidad. No se encontró una relación significativa entre este parámetro y el diámetro promedio de la testa de D. antillarum (p=0.8033) ni con las densidades de la especie (p=0.0284), coeficientes de correlación=-0.1318 y -0.4002 respectivamente (Figura 3).
DISCUSIÓN
Las densidades actuales de D. antillarum en el PNNT y Playa Blanca son similares a las registradas en la mayoría de los trabajos para el Caribe, entre 0 y 2 ind/m2 (Cho y Woodley, 2000; Haley y Solandt, 2001; Moses y Bonem, 2001; Chiappone et al., 2002a; 2002b; Alvarado et al., 2004; Lugo, 2004; Weil et al., 2005; Forero, 2006; Noriega et al., 2006; Steiner y Williams, 2006), siendo importante anotar que trabajos como los de Cho y Woodley (2000), Edmunds y Carpenter (2001) y Noriega et al. (2006) registran densidades a partir de 2 ind/m2 hasta 12 ind/m2. Esto, en conjunto con estudios recientes, demuestra una lenta recuperación de las poblaciones después del evento de mortandad masiva de 1983-1984. Por lo cual, a pesar de que muchos de éstos han demostrado incrementos significativos en las densidades, en la mayoría de los arrecifes aún no se alcanzan los niveles pre-mortandad (>20 ind/m2) (Lessios, 1988a, 1995, 2005; Edmunds y Carpenter, 2001; Haley y Solandt, 2001; Miller et al., 2003; Alvarado et al., 2004; Noriega et al., 2006; Steiner y Williams, 2006).
Las mayores densidades en las bahías de Nenguange y Gayraca podrían explicarse por la complejidad de cada sitio, ya que estas bahías corresponden respectivamente a las áreas que presentaron la mayor rugosidad y un alto porcentaje de cobertura de coral muerto, así como de Acropora palmata y Millepora complanata. Estos sitios, debido a sus características irregulares, poseen una gran cantidad de hendiduras que pueden proveer de refugio y protección contra los depredadores tanto a juveniles como a adultos. Lugo (2004) sugiere que existe una tendencia general de altas densidades de D. antillarum habitando áreas con alta rugosidad. Así mismo, Weil et al. (2005) encontraron una alta densidad de D. antillarum en El Atravesado, Puerto Rico, área que según sus observaciones posee una estructura arrecifal conformada principalmente de A. palmata vivo y muerto, A. cerviconis y varias especies masivas entre las cuales se encuentra Montastrea sp., por lo que sugieren que la alta complejidad del sitio podría proveer mayor y/o mejor refugio y alimento para los erizos. En este estudio no se encontró una correlación significativa entre las densidades medias y la rugosidad de las áreas muestreadas, por lo que podría deducirse que no existe una preferencia de la especie por los hábitats más complejos. Sin embargo, las bahías de Nenguange y Gayraca, por separado, presentaron las mayores densidades, lo que de alguna manera podría explicar la preferencia de la especie por sitios de mayor complejidad. Cabe destacar que en las bahías de Chengue y Cinto, aunque presentaron las menores densidades, los individuos se encontraron asociados respectivamente a las raíces de manglar y a lo que se constituía en una cresta de Acropora palmata muerta.
En la composición arrecifal, los corales, las macroalgas y el coral muerto fueron los componentes más conspicuos. Al analizar cada sitio se encontró la mayor diversidad en Playa Blanca, con Siderastrea siderea, Porites astreoides, Diploria strigosa, Favia fragum y Montastrea cavernosa como las especies más representativas, distribuidas uniformemente dentro del arrecife; sin embargo, presentaron tamaños pequeños en forma masiva y adheridas al sustrato. Para las bahías de Playa Cristal, Chengue y Cinto se encontró una diversidad entre 0.26 y 0.89, con especies como M. faveolata, S. siderea, M. anularis, P. astreoides y Millepora complanata, pero éstas solo estuvieron formando colonias masivas o aisladas; o como en el caso de Playa Blanca con pequeñas colonias masivas, que al final aportaron poco a la complejidad de cada arrecife, por lo cual se podría explicar la baja densidad del erizo.
De otro lado, cuando los corales se distribuyen dentro de cada arrecife de tal manera que generan un sustrato con alta rugosidad, éstos permiten a los erizos encontrar una mayor cantidad de hendiduras, escondites y sitios de protección, lo cual podría explicar las altas densidades de D. antillarum (Hunte y Younglao, 1988; Lugo, 2004; Weil et al., 2005). Por ejemplo, la bahía de Nenguange presentó la menor diversidad, la mayor uniformidad y se destacaron especies como M. complanata y S. siderea, y Gayraca donde se presentó una alta diversidad, una baja uniformidad y las especies más representativas fueron Acropora palmara y M. complanata, por lo que en estos sitios el patrón de alta complejidad, permite albergar altas densidades del erizo. Esto concuerda con lo encontrado por Lugo (2004) quien describe como áreas dominadas por Millepora spp., Montastraea spp. y Acropora spp. presentan mayores densidades del erizo que sitios con colonias masivas de Montastraea spp., y Siderastrea spp., y en forma de plato como Meandrina spp. y Mycetophyllia spp. o ramificadas como Porites spp. Así mismo, Noriega et al. (2006) encontraron a D. antillarum formando agregaciones en un arrecife con predominio de especies como Millepora y Acropora palmata y afirman que ellas son de importancia para el abrigo y protección de los erizos.
Con respecto a las macroalgas, al relacionarlas con la densidad se podría explicar su bajo porcentaje de cobertura para las bahías de Nenguange y Gayraca. Levitan (1988b) encontró que desde el verano de 1984 a 1987 la biomasa de algas disminuyó de 3.0 a 0.5 g/m2 de peso seco, lo que coincidió con un aumento de la biomasa de D. antillarum de 1.0 a 42.0 g/m2 de peso vivo. Lo cual se consideró como una fuerte evidencia circunstancial de que la biomasa del erizo regula la densidad de algas. Así mismo, Tuya et al. (2004) encontraron una marcada disminución no lineal en la cobertura de las macroalgas con un incremento en la densidad de D. antillarum, en donde con una densidad promedio mayor a 10 ind/m2 pueden desaparecer en su totalidad las algas carnosas erectas viéndose un arrecife rocoso completamente desprovisto de éstas. Steiner y Williams (2006) igualmente encontraron una relación negativa entre la densidad del erizo y la cobertura de macroalgas (R2=0.25, P=0.0030), en donde aunque la densidad de los tapetes algales se relaciona positivamente con bajas densidades de D. antillarum, esta relación se vuelve negativa cuando aumenta la densidad entre 2.0 y 3.0 ind/m2 (R2=0.25, P =0.0075), lo que indica su importante papel en el control de las algas.
Teniendo en cuenta lo anterior, aunque no se encontró una relación entre la densidad del erizo y la cobertura de las macroalgas, la tendencia fue a un bajo porcentaje de macroalgas a causa de las mayores densidades del erizo (1.16+1.34 y 0.68±0.84 ind/m2, respectivamente). A pesar de estos argumentos, Playa Blanca presentó el mayor porcentaje de cobertura de algas con una densidad del erizo de 0.54 ind/m2, lo cual podría contradecir la relación, sin embargo, es importante tener en cuenta que la variabilidad encontrada en la bahía de Gayraca fue mayor a la de Playa Blanca (SD=0.84 y 0.21 respectivamente), lo que indica la mayor densidad del erizo para Gayraca. Por lo anterior, podría sugerirse que habría una mayor herbivoría, estando de acuerdo con lo propuesto por Steiner y Williams (2006), en donde esta relación es más clara cuando la densidad de los erizos aumenta entre 2.0 y 3.0 ind/m2.
Para el coral muerto, que fue el tercer componente en importancia dentro de la estructura del arrecife, éste al parecer brinda a la especie mayores posibilidades de refugio y alimentación. Un ejemplo a mencionar se observó en la bahía de Cinto, donde se encontró una baja densidad de D. antillarum y un predominio de mayor a menor cobertura de las especies Montastrea faveolata, Siderastrea siderea, M. anularis, S. radians, Millepora complanata, Colpophyllia natans y Diploria strigosa, donde la mayoría estuvo formando colonias compactas sin hendiduras que al parecer no proporcionan refugio ni protección para los erizos. A la vez, el porcentaje de coral muerto (71.68%) dentro y alrededor del arrecife se registró en forma de pavimento, que al ser un sustrato duro y sin escondites, no le provee protección al erizo. Por el contrario, en la inspección visual se observó una alta densidad de D. antillarum en sustrato conformado principalmente por restos de Acropora palmata muerta, por lo cual la medición de las tallas en esta bahía fue realizada de individuos colectados en este último sitio. Para la bahía de Gayraca, donde el porcentaje de coral muerto fue mayor al del resto de los arrecifes (79.44), éste correspondió a restos no identificables de coral que conformaban una estructura que al parecer le permite al erizo encontrar una mayor cantidad de refugios y que concuerda con la alta rugosidad del sitio.
En general la distribución de tallas estuvo dominada por individuos medianos y grandes (entre 40 y >80 mm de diámetro) y pocos individuos pequeños (<40 mm), lo cual coincide con la distribución encontrada en La Parguera, Puerto Rico, con predominio de individuos de tallas entre 60 y 80 mm (Lugo, 2004). Caso contrario a lo encontrado por Chiappone et al. (2002a) en los cayos de la Florida, en donde la población de D. antillarum estuvo dominada por individuos pequeños con <2 cm de diámetro de la testa. Entre las posibles explicaciones para esta distribución de tallas se encuentra lo mencionado por Randall et al (1964) y Lugo (2004), en donde la gran cantidad de individuos adultos (>40 mm) podría ser debida a un bajo y/o lento reclutamiento, o una baja supervivencia de juveniles, una alta mortalidad de juveniles y/o adultos pequeños, o incluso un rápido crecimiento de la especie. Así mismo, Levitan (1988a) encontró que existe una relación inversa entre el diámetro de la testa y la densidad de la población. Además este erizo tiene la habilidad de ajustar su tamaño por denso-dependencia y/o debido a la disponibilidad de alimento en el medio (Levitan, 1988a, 1988b, 1989). Por lo cual, la gran cantidad de individuos de tallas entre 40 y >80 mm podría estar relacionada con la baja densidad de la población y/o con una alta disponibilidad de alimento, resultados que igualmente estarían de acuerdo a lo sugerido por Levitan (1988a, 1988b, 1989) y Debrot y Nagelkerken (2006).
De acuerdo con el comportamiento característico de D. antillarum, más activo durante la noche y permanecer escondido durante el día, se podría explicar la baja cantidad de individuos pequeños (<40 mm), puesto que todos los muestreos se realizaron durante el día. De acuerdo con lo propuesto por Weil et al. (2005), las densidades más altas de juveniles se observan durante la noche, sugiriendo que estos erizos durante el día se esconden en la parte más profunda de la estructura del arrecife, por lo cual podrían ser fácilmente subestimados en cuantificaciones realizadas durante el día en los hábitats complejos. Cabe resaltar que para los adultos, los autores mencionan que la densidad de éstos fue similar en los censos realizados tanto durante el día como en la noche.
Para el PNNT, Garzón-Ferreira et al. (2004) registraron formaciones de Acropora palmata y A. cervicornis entre 0.2 m y 8 m de profundidad en la bahías de Chengue, Gayraca, Nenguange y Cinto, con predominio de especies como Diploria clivosa, Agaricia tenuifolia, Colpophyllia natans, Millepora complanata, Siderastrea siderea y D. strigosa asociadas a ambas formaciones de Acropora. Santodomingo et al. (2002) en las bahías de Chengue y Gayraca identificaron diferentes tipos de ensamblajes coralinos donde los hábitats conformados por A. palmara estuvieron entre 2 y 4 m de profundidad. Por su parte, Navas-Camacho et al. (2009) registraron densidades de D. antillarum de 0.05 ind/m2 en 2004 y de 0.01 ind/m2 en 2007 en el nivel somero de la bahía de Chengue, afirmando que estas densidades han sido muy bajas y sin cambios evidentes a través de los años. Lo anterior es similar a lo encontrado en la bahía de Chengue (0.04 ind/m2de D. antillarum) siendo importante destacar que la profundidad de todos los arrecifes muestreados estuvo entre 1 y 5 m aproximadamente, en donde de igual manera las especies más representativas fueron M. complanata, Montastrea faveolata, S. siderea, M. annularis, A. palmata, S. radians, D. strigosa, Porites astreoides, C. natans, P. porites, D. clivosa, Favia fragum, M. cavernosa y Agaricia sp. y que a la vez concuerdan con algunas de las especies de coral y los ámbitos de profundidad registrados en los trabajos de Santodomingo et al. (2002) y Garzón-Ferreira et al. (2004).
Al comparar las densidades de D. antillarum entre el área intervenida (Playa Blanca) y el área protegida (PNNT), se esperaría encontrar una mayor densidad del erizo en esta última área, sin embargo, no se observó un patrón claro. Esto puede deberse a que, a pesar de que los mayores valores dentro del PNNT estuvieron en las bahías de Nenguange, Gayraca y Playa Cristal, y que a la vez son los sitios con mayor confluencia de turismo, esto puede ser comparado con Playa Blanca, en donde esta actividad también es alta. Contrariamente, en las zonas del PNNT que se consideran más conservadas como las bahías de Chengue y Cinto al ser zonas de difícil acceso o acceso restringido, se hubiera esperado encontrar mayores densidades, pero este no fue el caso ya que precisamente allí fue menor.
CONCLUSIONES Y RECOMENDACIONES
En comparación con las densidades actuales de D. antillarum registradas en la mayoría de los arrecifes del Caribe, los resultados para Playa Blanca y el PNNT son similares, indicando una lenta recuperación de la especie. No se encontró relación entre la densidad de D. antillarum y la rugosidad, sin embargo, el erizo se encontró en hábitats con alta complejidad estructural. Así mismo, se encontró un predominio de individuos entre 40 y >80 mm de diámetro de la testa lo que puede deberse a la baja densidad de la población y/o una alta disponibilidad de alimento en el área. Por último, no se encontró un patrón claro en cuanto a la densidad entre el área intervenida y el área protegida dentro del PNNT. Por lo cual, es necesario realizar estudios complementarios de la especie en la región, incluyendo muestreos diurnos y nocturnos, y donde se evalúen aspectos como la profundidad, la biología reproductiva, la dispersión, asentamiento y posterior reclutamiento de las larvas, se determine el ciclo de vida, se establezcan los hábitos alimentarios del erizo y evaluar el posible impacto de la actividad turística sobre la especie en Playa Blanca y el PNNT. Lo anterior, permitirá obtener un conocimiento más amplio y actual sobre la biología y comportamiento de la especie, y a partir de dicha información se podrán generar a posteriori planes de manejo para el repoblamiento y conservación de D. antillarum en el Caribe colombiano.
AGRADECIMIENTOS
A la Vicerrectoría de Investigación y al Instituto de Investigaciones Tropicales-Intropic de la Universidad del Magdalena. A la Unidad de Parques Nacionales Naturales, permiso de investigación N° PIDB DTCA 021-09. A Dagoberto Venera-Pontón, Rosana Londoño-González, José Yacomelo, Arturo Acero y Ricardo Betancur, Milena Benavides, Ana Milena Lagos, Andrea Ramírez y Fabián Moreno por su colaboración y apoyo.
BIBLIOGRAFIA
1 Alvarado, J. J., J. Cortés y E. Salas. 2004. Population densities of Diadema antillarum Philippi at Calmita National Park (1977-2003) Costa Rica. Carib. J. Sci., 40: 257-259. [ Links ]
2 Carpenter, R. C. 1988. Mass mortality of a Caribbean sea urchin: Immediate effects on community metabolism and other herbivores. Proc. Nat. Acad. Sci. USA, 85: 511-514. [ Links ]
3 Chiappone, M., D. W. Swanson y S. L. Miller. 2002a. Density, spatial distribution and size structure of sea urchins in Florida Keys coral reef and hard-bottom habitats. Mar. Ecol. Prog. Series, 235: 117-126. [ Links ]
4 Chiappone, M., D. W. Swanson, S. L. Miller y S. G. Smith. 2002b. Large scale surveys on the Florida Reef Tract indicate poor recovery of the long-spine sea urchin Diadema antillarum. Coral Reefs, 21: 155-159. [ Links ]
5 Cho, L. L. y J. D. Woodley. 2000. Recovery of reefs at Discovery Bay, Jamaica and the role of Diadema antillarum. Proc. 9th Int. Coral Reef Symp., 1: 331-337. [ Links ]
6 Debrot, A. O. y I. Nagelkerken. 2006. Recovery of the long-spined sea urchin Diadema antillarum in Curaçao (Netherlands Antilles) linked to lagoonal and wave sheltered shallow rocky habitats. Bull. Mar. Sci., 79: 415-424. [ Links ]
7 Edmunds, P. J. y R. C. Carpenter. 2001. Recovery of Diadema antillarum reduces macroalgal cover and increases abundance of juvenile corals on a Caribbean reef. Proc. Nat. Acad. Sci. USA, 98: 5067-5071. [ Links ]
8 Forero, G. 2006. Estado, distribución espacial y uso de hábitat de la población del erizo negro Diadema antillarum (Philippi) en el archipiélago de Nuestra Señora del Rosario (Caribe colombiano). Tesis de Pregrado en Ecología, Pontificia Universidad Javeriana, Bogotá. 74 p. [ Links ]
9 Garzón-Ferreira, J., M. Moreno-Bonilla y J. M. Valderrama. 2004. Condición actual de las formaciones coralinas de Acropora palmata y A. cervicornis en el Parque Nacional Natural Tayrona (Colombia). Bol. Invest. Mar. Cost., 33: 117-136. [ Links ]
10 Gutiérrez-Salcedo, J. M., M. I. Aguilar-Pérez, A. Bermúdez, N. H. Campos y G. R. Navas. 2007. Estructura de la macrofauna de invertebrados presente en los nidos del pez Malacanthus plumieri (Bloch, 1786) (Perciformes: Malacanthidae) en la bahía de Nenguange, Parque Nacional Natural Tayrona, mar Caribe colombiano. Caldasia, 29: 309-320. [ Links ]
11 Haley, M. P. y J. L. Solandt. 2001. Population fluctuations of the sea urchins Diadema antillarum and Tripneustes ventricosus at Discovery Bay, Jamaica: a case of biological succession? Carib. J. Sci., 37: 239-245. [ Links ]
12 Hunte, W. y D. Younglao. 1988. Recruitment and population recovery of Diadema antillarum (Echinodermata; Echinoidea) in Barbados. Mar. Ecol. Prog. Ser., 45: 109-119. [ Links ]
13 Lessios, H. A. 1988a. Mass mortality of Diadema antillarum in the Caribbean: what have we learned? Ann. Rev. Ecol. Syst., 19: 371-393. [ Links ]
14 Lessios, H. A. 1988b. Population dynamics of Diadema antillarum (Echinodermata: Echinoidea) following mass mortality in Panama. Mar. Biol., 99: 515-526. [ Links ]
15 Lessios, H. A. 1995. Diadema antillarum 10 years after mass mortality: still rare, despite help from a competitor. Proc. R. Soc. Lond. B., 259: 331-337. [ Links ]
16 Lessios, H. A. 2005. Diadema antillarum populations in Panama twenty years following mass mortality. Coral Reefs, 24: 125-127. [ Links ]
17 Lessios, H. A., J. D. Cubit, D. R. Robertson, M. J. Shulman, M. R. Parker, S. D. Canity y S. C. Levings. 1984a. Mass mortality of Diadema antillarum on the Caribbean coast of Panama. Coral Reefs, 3: 173-182. [ Links ]
18 Lessios, H. A., D. R. Robertson y J. D. Cubit. 1984b. Spread of Diadema mass mortality through the Caribbean. Science New Series, 226: 335-337. [ Links ]
19 Lessios, H. A., M. J. Garrido y B. D. Kessing. 2001. Demographic history of Diadema antillarum a keystone herbivore on Caribbean reefs. Proc. R. Soc. Lond. B., 268: 1-7. [ Links ]
20 Levitan, D. R. 1988a. Density-dependent size regulation and negative growth in the sea urchin Diadema antillarum. Oecologia, 76: 627-629. [ Links ]
21 Levitan, D. R. 1988b. Algal-urchin biomass responses following mass mortality of Diadema antillarum Philippi at Saint John, U.S. Virgin Islands. J. Exp. Mar. Biol. Ecol., 119: 167-178. [ Links ]
22 Levitan, D. R. 1989. Density-dependent size regulation in Diadema antillarum: effects on fecundity and survivorship. Ecology, 70: 1414-1424. [ Links ]
23 Lugo, M. A. 2004. Population status of the black sea urchin Diadema antillarum (Philippi) in La Praguera, Puerto Rico, 20 years after the mass mortality event. Tesis de Maestría en Ciencias Marinas, Univ. de Puerto Rico, Mayagüez. 70 p. [ Links ]
24 Manrique-Rodríguez, N., S. Bejarano-Chavarro y J. Garzón-Ferreira. 2006. Crecimiento del abanico de mar Gorgonia ventolina (Linnaeus, 1758) (Cnidaria: Gorgoniidae) en el área de Santa Marta, Caribe colombiano. Bol. Invest. Mar. Cost., 35: 77-90. [ Links ]
25 Martínez, S. y A. Acosta. 2005. Cambio temporal en la estructura de la comunidad coralina del área de Santa Marta-Parque Nacional Natural Tayrona (Caribe colombiano). Bol. Invest. Mar. Cost., 34: 161-191. [ Links ]
26 Mertins, G. 1972. El Rodadero (Santa Marta), centro turístico o colonia de vacaciones? Mitt. Inst. Colombo-Alemán Invest. Cient., 6: 151-168. [ Links ]
27 Miller, R. J., A. J. Adams, N. B. Ogden, J. C. Ogden. y J. P. Ebersole. 2003. Diadema antillarum 17 years after mass mortality: is recovery beginning on St. Croix? Coral Reefs, 22: 181-187. [ Links ]
28 Monroy, M. y O. Solano. 2005. Estado poblacional de Echinometra lucunter (Echinoida: Echinometridae) y su fauna acompañante en el litoral rocoso del Caribe colombiano. Rev. Biol. Trop., 53: 291-297. [ Links ]
30 Moses, C. S. y R. M. Bonem. 2001. Recent population dynamics of Diadema antillarum and Tripneustes ventricosus along the north coast of Jamaica, W. I. Bull. Mar. Sci., 68: 327-336. [ Links ]
31 Navas-Camacho, R., K. Gómez-Campo, J. Vega-Sequeda y T. López-Londoño. 2009. Estado del conocimiento de los ecosistemas marinos y costeros, Estado de los arrecifes coralinos. 66-68. En: INVEMAR (Ed.). 2009. Informe del estado de los ambientes y recursos marinos y costeros en Colombia: Año 2008. Serie de Publicaciones Periódicas No. 8, Santa Marta. 244 p. [ Links ]
32 Noriega, N., S. Pauls y C. Del Monaco. 2006. Abundancia de Diadema antillarum (Echinodermata: Echinoidea) en las costas de Venezuela. Rev. Biol. Trop., 54: 793-802. [ Links ]
33 Randall, J. E., R. E. Schroeder y W. A. Starck. 1964. Notes on the biology of the echinoid Diadema antillarum. Carib. J. Sci., 4: 421-433. [ Links ]
34 Santodomingo, N., A. Rodríguez-Ramírez y J. Garzón-Ferreira. 2002. Territorios del pez Stegastes planifrons en formaciones coralinas de Parque Nacional Natural Tayrona, Caribe colombiano: un panorama general. Bol. Invest. Mar. Cost., 31: 65-84. [ Links ]
35 Steiner, S. C. C. y S. M. Williams. 2006. The density and size distribution of Diadema antillarum in Dominica (Lesser Antilles): 2001-2004. Mar. Biol., 149: 1071-1078. [ Links ]
36 Tuya, F., A. Boyra, P. Sánchez-Jerez, C. Barbera, y R. Haroun. 2004. Can one species determine the structure of the benthic community on a temperate rocky reef? The case of the long-spined sea-urchin Diadema antillarum (Echinodermata: Echinoidea) in the eastern Atlantic. Hydrobiologia, 519: 211-214. [ Links ]
37 Weil, E., J. L. Torres y M. Ashton. 2005. Population characteristics of the sea urchin Diadema antillarum in La Parguera, Puerto Rico, 17 years after the mass mortality event. Rev. Biol. Trop., 53: 219-231. [ Links ]
FECHA DE RECEPCIÓN: 11/04/2011 FECHA DE ACEPTACIÓN: 05/10/2011