Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.41 no.1 Santa Marta Jan./June 2012
HISTORIA NATURAL DE LA ESPONJA DISCODERMIA DISSOLUTA (PORIFERA: DEMOSPONGIAE: LITHISTIDA) EN SANTA MARTA, CARIBE COLOMBIANO*
NATURAL HISTORY OF THE SPONGE DISCODERMIA DISSOLUTA (PORIFERA: DEMOSPONGIAE: LITHISTIDA) IN SANTA MARTA, COLOMBIAN CARIBBEAN
César Augusto Ruiz1 y Sven Zea2
1 Instituto de Investigaciones Marinas y Costeras-INVEMAR, Cerro Punta de Betín, Santa Marta, Colombia. carp2112@natalesoft.com.
2 Universidad Nacional de Colombia, Centro de Estudios en Ciencias del Mar-CECIMAR (Sede Caribe), INVEMAR, Cerro Punta de Betín, Santa Marta, Colombia. sezeas@unal.edu.co, szea@invemar.org.co.
RESUMEN
La esponja marina Discodermia dissoluta es fuente del policétido discodermólido, un potente antitumoral que ha alcanzado fase clínica con pruebas en humanos. En Santa Marta esta especie se encuentra a menor profundidad en comparación con otras áreas del Caribe y por ello se pudieron estudiar por primera vez y por medio de buceo autónomo sus características ecológicas, abundancia y distribución. Haciendo recorridos por la base de los arrecifes (12-25 m de profundidad), se determinó que esta especie se restringe a sitios relativamente protegidos del oleaje y vive predominantemente en sustratos duros horizontales a inclinados, en general expuestos a la luz. Censos realizados a partir de círculos de 4 m de radio mostraron densidades moderadas de unos 2-5 ind/50 m2 que, aunque no son muy bajas, no podrían sustentar su extracción comercial. Por la ubicación de los individuos en el espacio y mediante funciones empíricas de distribución espacial de puntos (F, G y K), se determinó que D. dissoluta se encuentra agregada en parches a escala de decímetros a unos pocos metros, posiblemente atribuible a dispersión larval de corta distancia o fragmentación, ambas comunes en esponjas. La talla de los individuos se estimó como área proyectada en fotos digitales. Ésta se llevó a volumen mediante regresión calculada del volumen real de individuos recolectados. En la población predominan individuos pequeños (<50 mL) y persisten algunos muy grandes (hasta 2000 mL), indicando alta mortalidad en tallas pequeñas y medianas. Esta población es viable para estudios de marcaje, seguimiento de individuos, y la aplicación de técnicas de cultivo in situ y biotecnológicas, que permitan desarrollar técnicas de producción de discodermólido para suplir la demanda potencial.
PALABRAS CLAVE: Discodermia dissoluta, Caribe, Discodermólido, Distribución.
ABSTRACT
The marine sponge Discodermia dissoluta is a source of the polyketide discodermolide, a potent antitumoral agent that has reached clinical trials in humans. In Santa Marta, where this species occurs at shallower depths than in other Caribbean areas, for the first time it was possible to study by SCUBA its ecological characteristics, distribution and abundance. By searching the base of the reefs (12-25 m in depth) it was found that this species is restricted to sites or bays with relatively low wave-exposure, dwelling predominantly in hard, horizontal to inclined substrata, generally exposed to light. Censuses carried out in 4 m-radius circles in sectors where this sponge occurs showed moderate densities (about 2-5 ind/50 m2) that, although not very low, do not support its commercial exploitation to obtain discodermolide. By locating individuals in the sampling space and using the point pattern distribution functions F, G and K, it was determined that individuals of D. dissoluta are aggregated in patches at scales from decimeters to a few meters. This pattern possibly arises from short-distance larval dispersal or fragmentation, both common in sponges. Size of censused individuals was estimated as projected area from digital photos, and expressed in volume by a regression calculated from the real volume of 30 collected individuals. In the population, small individuals (<50 mL) predominate, while several very large ones (reaching 2000 mL) persist, indicating high mortality in small and medium sizes. This population is viable for individual marking and follow-up studies and application of in situ and biotechnological cultures techniques in order to develop sustainable methods for production and supply of discodermolide.
KEY WORDS: Discodermia dissoluta, Caribbean, Discodermolide, Distribution.
INTRODUCCIÓN
Las esponjas son un componente estructural y funcional en los arrecifes de coral. Su alta diversidad, abundancia y biomasa las hacen muy importantes en los ecosistemas costeros del Caribe. Así mismo, sus adaptaciones biológicas, químicas y físicas les permiten competir exitosamente por el espacio y defenderse de otros organismos, tanto sésiles como móviles (Díaz y Rützler, 2001).
En la mayoría de los casos, es difícil conocer la edad de las esponjas. Por esta razón, la mayoría de estudios demográficos se basan en el tamaño de los individuos (Hughes, 1984; McMurray et al., 2008, 2010). En estos modelos demográficos, el estado de una población está dado por la distribución de individuos en un conjunto de categorías (ver Bonilla, 2004), donde la distribución de frecuencias de tallas puede revelar características importantes de la historia de vida de la población y permite predecir el estado de la misma (Bak y Meesters, 1998).
La distribución y abundancia de esponjas arreciales está determinada por un conjunto de factores abióticos (e.g. inclinación y tipo del sustrato), en especial aquellos que varían con la profundidad, como la turbulencia, intensidad lumínica y perturbaciones; y bióticos como reclutamiento, competencia con organismos fotosintéticos de rápido crecimiento y depredación (Jackson, 1983; Zea, 1993a; Pawlik, 1997; 1998; Valderrama y Zea, 2003). También la dispersión larval, que en esponjas parece ser muy corta (con frecuencia <1 m), y la fragmentación tienden a concentrar localmente las poblaciones (Jackson, 1983, 1986; Zea, 1993b, 2001).
Las esponjas de la clase Demospongiae tienen una amplia distribución batimétrica, aunque la gran mayoría se encuentra asociada a sustratos duros de la plataforma continental (Sarà y Vacelet, 1973). La temperatura, la oferta de sustratos, así como las propiedades fisiológicas específicas, explican la distribución batimétrica en estos animales, habiendo casos de algunas especies que habitan tanto aguas superficiales como profundas (desde cerca de la superficie hasta 400-500 m) (Hartman, 1973; Maldonado y Young, 1996, 1998). Las esponjas del tipo Lithistida (grupo polifilético de la clase Demospongiae que tiene esqueleto sólido de espículas de silicio articuladas) presentan abundancias máximas en el talud continental (200- 700 m) en las regiones tropicales y templadas. Sin embargo, algunas especies del género Discodermia llegan a habitar ambientes someros (Vacelet, 1988; Pomponi et al., 2001; Díaz, 2005; Van Soest y Beglinger, 2008). Al igual que otras esponjas representantes de la fauna actual de las Lithistida, el género Discodermia ha sido reconocido como una fuente de potentes agentes biológicos, como el discodermólido, un policétido aislado de la esponja Discodermia dissoluta, de características inmunosupresoras y citotóxicas (Gunasekera et al., 1990; Kelly-Borges et al., 1994; Smith et al., 1995; Kowalski et al., 1997; Cooper, 2004), el cual se encuentra en fase clínica I en el tratamiento con humanos (Mita et al., 2004).
Discodermia dissoluta habita generalmente a profundidades mayores a 30 m (Kelly-Borges et al., 1994; Reed y Pomponi, 1997; Pomponi et al., 2001), que requieren de buceo especializado o de sumergibles para acceder a ella. Esto ha limitado en cierta medida su desarrollo como medicamento, requiriéndose de la síntesis total del discodermólido en el laboratorio para el suministro requerido en la investigación médica (e.g. Smith et al., 1999; Mickel et al., 2004). Interesantemente, D. dissoluta se encuentra en el área de Santa Marta a profundidades accesibles por buceo autónomo normal, entre los 12-25 m de profundidad, aspecto que llevó a proponer el presente estudio, con el objetivo de avanzar en el conocimiento de la historia natural de esta especie y así determinar la magnitud de la población local, para resolver el problema de suministro de discodermólido.
ÁREA DE ESTUDIO
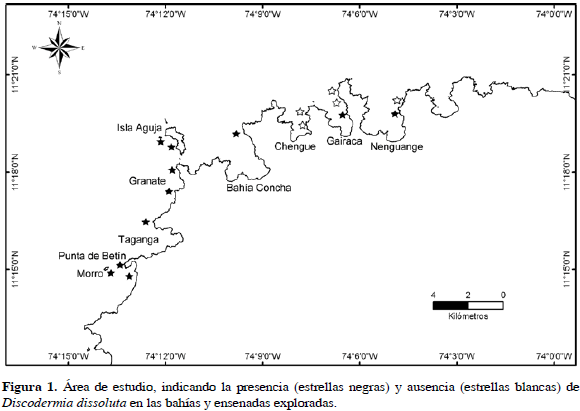
El presente trabajo se realizó en la costa Caribe de Colombia desde la parte norte de la bahía de Santa Marta hasta las ensenadas del Parque Nacional Natural Tayrona (PNNT) (Figura 1). En el área, las estribaciones de la Sierra Nevada de Santa Marta limitan directamente con el mar, formando bahías y acantilados de roca metamórfica, donde se desarrollan formaciones coralinas hasta aproximadamente 25 m de profundidad (Zea, 1987). Las condiciones oceanográficas en el área están determinadas por el afloramiento de aguas subsuperficiales frías durante la temporada seca (diciembre-abril) y una mayor descarga continental durante la temporada de lluvias (mayo-noviembre) (Cabrera y Donoso, 1992; Franco, 2005).
MATERIALES Y MÉTODOS
Los datos se tomaron en campo mediante buceo autónomo a partir de recorridos sistemáticos en la base del arrecife (15 a 25 m de profundidad). Inicialmente se recorrieron varios lugares del área para establecer la presencia de la esponja; posteriormente se realizó un estudio detallado de la población en donde se encontró la mayoría de los individuos, en la ensenada de Granate y en la bahía de Santa Marta. Para esto último, se realizaron 42 inmersiones entre agosto y diciembre de 2008. La cuantificación de la densidad se hizo usando como unidad muestral círculos de 4 m de radio. Durante el recorrido, al encontrar la primera esponja, se comenzaban los círculos, avanzando más o menos en línea recta o en un ligero zig-zag, interrumpiendo cuando no se encontraban más esponjas luego de dos o tres círculos. Posteriormente se continuaba el recorrido hasta encontrar otro grupo de esponjas e iniciar los círculos de nuevo. De esta manera se cuantificaron cuatro sectores más o menos adyacentes conteniendo esponjas en Granate. Se cuantificaron dos sectores más en la bahía de Santa Marta, uno en Punta de Betín y otro en El Morro. Tanto en Granate como en El Morro se interrumpió el recorrido al tener un número elevado de individuos ubicados. Cada círculo se realizó clavando una puntilla tipo vareta (o estaca, de sección cuadrada) de acero galvanizado de 12 cm de largo, a la cual se agarró una cinta métrica; se nadaba en círculos concéntricos sucesivos aumentando el radio 1 m cada vez.
Para determinar el tipo de distribución (agregada, azarosa o uniforme) a escala de sectores, las distancias entre círculos fueron medidas, así como la posición de cada individuo en el círculo, ubicada con base en la distancia desde el centro y el rumbo (ángulo entre un norte arbitrario, definido por la línea imaginaria paralela a la línea de costa por la que se hacían los recorridos, y el punto donde se encuentra la esponja, medido con un transportador plástico). Cada una de las esponjas encontradas (incluidas algunas fuera de los círculos) fue fotografiada con cámaras digitales equipadas para el agua. La fotografía se tomó en orientación perpendicular a la esponja ubicando a su lado como referencia una cuadrícula dividida en centímetros como escala para el tamaño. Cada individuo fue valorado según diferentes variables como el sustrato (duro, cascajo, otros), orientación (horizontal, inclinada, vertical), posición (expuesta, críptica), presencia de epibiosis, signos de depredación y signos de salud (coloración anormal y mortalidad parcial).
A partir de la distancia entre círculos y la ubicación de los individuos en los círculos, para cada sector se representó la posición de cada individuo en una banda rectangular con un sistema plano de coordenadas (x,y), asumiendo que los círculos estaban alineados. Usando el programa estadístico R (módulo SPATSTAT), se probó la hipótesis nula de aleatoriedad en la distribución de los organismos mediante el cálculo de las funciones G, F y K con 99 simulaciones y un nivel de significancia de 0.02 para el test de Monte-Carlo. Estas funciones gráficas permiten determinar si la distribución espacial de los individuos es azarosa, agregada o uniforme. La función G examina las distancias entre individuos, la función F examina las distancias entre puntos al azar y los individuos (espacio vacío) y la función K determina si hay patrones en las distancias que indiquen interacciones entre los individuos (Mateu et al., 1998; Bivand et al., 2008). Para determinar tendencias en la distribución de los individuos según las variables anotadas (sustrato y orientación, entre otras), se calcularon sus frecuencias y se construyeron tablas de contingencia, determinando su relación estadística mediante pruebas de independencia de χ2 (Sokal y Rohlf, 1981).
Para determinar la talla de cada individuo, se calculó el área proyectada a partir de las imágenes digitales. Para ello se delineó el perímetro de la esponja usando el programa CPCe 3.6, que permite calcular el área con base en la cuadrícula que se utilizó para la escala real (Kohler y Gill, 2006). Para evaluar la precisión de la medida de área, ésta se calculó por separado en tres fotos del mismo individuo, para 16 individuos, tomadas a diferentes ángulos y distancias. Se obtuvo un coeficiente de variación promedio del área de 11 %. Para llevar la talla a volumen, se recolectaron 30 individuos completos que se llevaron al laboratorio para medirles el volumen por desplazamiento, empleando una probeta graduada adherida a un recipiente rectangular de plástico con cierre hermético. Usando estos datos se calculó una regresión multiplicativa para, a partir de la medida del área, obtener un estimado del volumen de cada esponja. Con los datos de volumen se construyeron distribuciones de frecuencias por clases de talla, que permitieron inferir características poblacionales. Una buena parte de las esponjas encontradas fue marcada para su futura ubicación y medición de crecimiento y mortalidad.
RESULTADOS
Abundancia y densidad
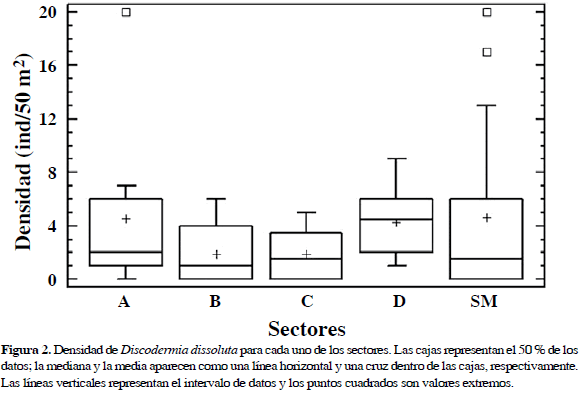
En los círculos se contaron 177 esponjas en un área total de 2359 m2. Los recorridos en la base del arrecife en Granate, desde Punta Aguja hacia el centro de la ensenada, llevaron a encontrar las esponjas agrupadas en cuatro sectores (denominados consecutivamente A-D). En la bahía de Santa Marta se encontró un grupo de esponjas en la parte sur de El Morro y otro en Punta de Betín. Dado que en Punta de Betín se encontraron muy pocas esponjas, estos datos no se usaron para estimar el tipo de distribución; para la densidad, atributos y tallas, se combinaron con los datos de El Morro como un solo sector (SM). La mínima densidad promedio por sector encontrada, en los círculos donde había esponjas, fue 1.9 ind/50 m2, mientras que la mayor fue de 4.6 ind/50 m2 (Figura 2). No se encontraron diferencias en la densidad entre los sectores analizados (Prueba de Kruskal-Wallis, H(4)=5.31, p=0.25, N=7-14 círculos por sitio).
Patrón espacial
A gran escala (área de estudio), D. dissoluta se ubica en las partes menos expuestas de las bahías que abren al norte y que enfrentan los vientos alisios del NE, mientras que de isla Aguja hacia el sur está usualmente presente en la banda de arrecifes franjeantes desde los 12 m de profundidad (Figura 1). A mediana escala (ensenada, bahía) se encuentra distribuida en parches o agregada, lo que en parte corresponde a los sectores definidos durante el muestreo. El análisis espacial dentro de los sectores (menor escala, bandas de hasta 94 m de largo), usando las funciones F, G y K, reveló igualmente agrupación a distancias menores a 2 m para todos los sectores, con algunas diferencias entre ellos. En general, hay agrupación en las distancias entre esponjas (funciones G y K) a escala de hasta 2 m en todos los sectores, o bien en todo este intervalo (sectores A y M, Figura 3) o bien en dos intervalos de distancia (menores a 1 m y entre 1.5 y 2 m, para los demás sectores (Figura 3B, C y D). La distribución de los espacios vacíos (función F) dentro de estos últimos sectores fue aleatoria, mientras que en los primeros fue agrupada. Las diferentes escalas de agrupación dentro de los sectores no parecen estar relacionadas con las características ambientales y geomorfológicas de cada uno.
Relación volumen-área
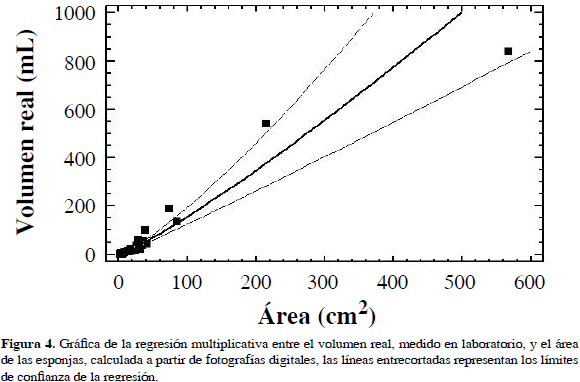
El análisis de regresión entre el volumen real medido en el laboratorio y el área calculada a partir de las fotos mostró que la mejor relación (R2= 94.82 %, n= 30) fue multiplicativa, es decir Vol= 0.76*Área1.15 (Figura 4). Se encontró que el volumen presenta un mayor aumento con relación al área a medida que los individuos son más grandes, indicando que después de cierto tamaño, las esponjas crecen más hacia arriba que hacia los costados. Con esta ecuación, todos los datos de área calculada a partir de fotografías (de 220 individuos) se convirtieron a volumen ajustado, para los análisis subsiguientes.
Variables asociadas y distribución de las tallas
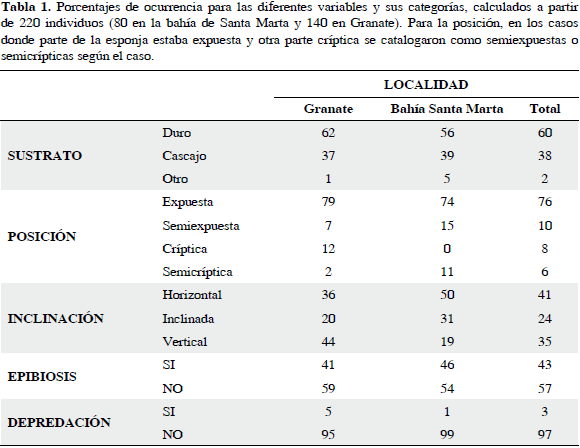
La Tabla 1 muestra la presencia de D. dissoluta según las variables bióticas y abióticas estudiadas. Las comparaciones se hicieron entre las dos localidades principales (Granate y bahía de Santa Marta) y no según los sectores por tener algunos de éstos un número bajo de individuos.
En general, D. dissoluta se encontró en mayor proporción en sustrato duro (60 %) que en cascajo (38 %) y otros sustratos (2 %). El sustrato duro comprendió roca metamórfica, roca coralina y coral muerto. Los otros sustratos fueron artificiales, octocorales y conchas de moluscos. La distribución entre sustratos ocurrió de manera similar en Granate y Santa Marta. La esponja nunca se encontró en arena, excepto algunos fragmentos sueltos, caídos de esponjas adyacentes fijas a cascajo o sustrato duro.
La mayoría de las esponjas se encontraron expuestas a la luz en proporciones similares para ambas localidades, con unas pocas totalmente crípticas. El grado de exposición no tuvo incidencia en la coloración superior de los individuos.
La distribución de D. dissoluta según la inclinación del sustrato dependió de las características geomorfológicas del lugar más que de una preferencia de la esponja. Se encontró dependencia estadística entre el lugar (Granate y bahía de Santa Marta) y la inclinación del sustrato (χ2(2)= 14.02 p= 0.0009), debido a que en la bahía de Santa Marta (especialmente en El Morro) el sustrato era en general mucho más inclinado que en Granate.
Fue común encontrar sedimento fino sobre las esponjas, pero dependió más de la mayor carga de sedimento en suspensión según el momento de observación. Los organismos epibiontes más comunes encontrados sobre D. dissoluta fueron esponjas, hidroides, briozoos, microalgas, algas costrosas y filamentos gruesos que posiblemente eran tubos blandos de gusanos poliquetos, visibles por retener sedimentos. A las esponjas recolectadas se les encontró fauna asociada, como bivalvos, gusanos, ofiuros y crustáceos. En general, alrededor de un 40 % de los individuos de D. dissoluta se encontraron con algún grado de epibiosis y un 60 % sin epibiontes (con independencia de tener sedimentos sobre el tejido). La presencia de epibiontes no varió significativamente entre Granate y Santa Marta (χ2(1)= 0.7 p= 0.4). Por otro lado, la prueba de independencia para determinar si las proporciones de individuos de D. dissoluta con epibiosis variaban con la posición de la esponja (expuesta a críptica), no mostró ninguna relación (χ2(3)= 0.84 p= 0.83), igual que al ser contrastada con la inclinación del sustrato (χ2(2)= 0.42 p= 0.8).
La depredación en general fue muy rara, observándose hasta en un 5 % de las esponjas. Los signos parecían ser mordiscos de peces que aparecieron como depresiones de color blancuzco de no más de 2 cm2. Cuando esto ocurrió, fueron casos de uno o máximo dos mordiscos, nada que comprometiera significativamente la supervivencia de la esponja. Los signos de depredación se manifestaron en proporción igual para las dos localidades.
Para relacionar las proporciones de individuos de diferentes tallas con las variables cuantificadas, las esponjas fueron clasificadas según su talla en muy pequeñas: esponjas menores a 10 mL; pequeñas: entre 11-100 mL; medianas: entre 101-450 mL; grandes: mayores a 451 mL. No hubo relación entre las proporciones de individuos de diferente talla respecto al sustrato ocupado (χ2(6)= 12.3 p= 0.11), entre inclinaciones del sustrato (χ2(6)= 8.39 p= 0.21) y según su exposición (χ2(9)=4.71 p= 0.85).
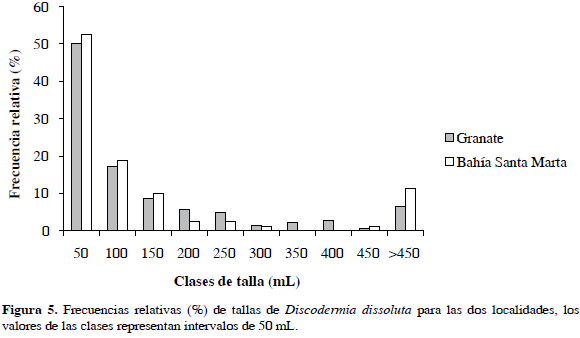
La distribución de frecuencias de tallas de D. dissoluta estuvo sesgada positivamente, mostrando que la mitad de las esponjas son muy pequeñas (<50 mL), pocas de talla media (24 %, 101-450 mL) y algunas grandes (>451 mL) (Figura 5). Según el test no paramétrico Kolmogorov-Smirnov, se concluyó que no existen diferencias en la distribución de las tallas entre las dos localidades del estudio (D(0.05)= 0.68, p= 0.73).
DISCUSIÓN
A partir del estudio de la población local de la esponja marina Discodermia dissoluta se genera por primera vez información base sobre la ecología y la historia natural de este organismo. Discodermia dissoluta habita en el área de Santa Marta en aguas someras (entre 12 y 25 m), mientras que en otras áreas del mar Caribe ha sido colectada mediante sumergibles a profundidades de hasta 200 m (Van Soest y Stentoft, 1988; Kelly-Borges et al., 1994; Reed y Pomponi, 1997). El afloramiento de aguas frías ricas en nutrientes puede ser la causante de la presencia de esta esponja en aguas someras de Santa Marta, al igual que ocurre con otros organismos. Como ejemplo de este fenómeno está el registro de la esponja Haliclona (Haliclona) epiphytica para el área; las esponjas del subgénero Haliclona están presentes principalmente en aguas templadas del Atlántico norte y rara vez en el cinturón tropical (Zea y De Weerdt, 1999). También está el caso de la esponja Aulospongus samariensis, que en Santa Marta habita en las bases de los arrecifes y en otras partes del Caribe se encuentra a mayor profundidad (Hooper et al., 1999).
La distribución agregada de D. dissoluta puede ser el resultado de diversos factores ecológicos y ambientales. A mayor escala, la esponja fue vista solamente en las áreas más protegidas pero a la vez profundas de los arrecifes y litoral duro de las bahías estudiadas. La exposición al oleaje puede ser un factor determinante en la distribución agregada a gran escala, ya que bajo las mismas condiciones de profundidad y características ambientales la esponja no se observó en los sectores más expuestos de las bahías (Figura 1). En general el grado de exposición al oleaje limita la presencia de esponjas en aguas someras de los arrecifes solo a algunas pocas especies, siendo la riqueza y la abundancia mayores en ambientes crípticos o en la base de los arrecifes, donde abunda D. dissoluta (ver revisión en Zea, 1993a).
Aunque no se conoce nada respecto al desarrollo o tipos larvales de las Lithistida (Maldonado, 2006), la dispersión y asentamiento larval en muchas esponjas es de corto tiempo y por ende la distancia entre individuos. Las larvas tienden a mantenerse cerca del fondo y con frecuencia reptan sobre éste (Berquist, 1978; Zea, 1993b; Uriz et al., 1998; Maldonado, 2006). Si este es el caso para D. dissoluta, se explicaría la agregación observada a escala de 1-2 m (ver Zea, 2001). Igualmente la propagación asexual por fragmentos es frecuente en las esponjas y muy efectiva debido a su rápida regeneración (Zilberberg et al., 2006a). Aspecto que también podría estar generando el esquema encontrado de agregación de D. dissoluta a pequeña escala. Aunque no se encontró evidencia de posibles eventos físicos causantes de fragmentación, la forma ramificada de muchos individuos y la relativa fragilidad de estas ramas puede ser un indicativo de posible fragmentación durante tormentas o por efecto de choque físico de peces grandes. También, como ocurre con las esponjas del género Chondrilla, podría presentarse fragmentación pasiva por ruptura de individuos como consecuencia de su crecimiento e incremento en peso (Zilberberg et al., 2006b). Experimentos realizados en paralelo a esta investigación han mostrado que fragmentos de D. dissoluta son capaces de sanar, sobrevivir y crecer. Evidencia que indica que la fragmentación puede ser también un mecanismo viable de propagación y agregación de la población a pequeña escala.
La abundancia de D. dissoluta en Santa Marta no es baja, como se suponía en un principio, pero tampoco es alta. Por ejemplo, en el Urabá chocoano, las esponjas menos abundantes al mismo intervalo de profundidad (19 de 40 especies) tienen densidades de hasta 1.5 ind/50 m2, mientras que para las más abundantes (16 de 40 especies) las densidades son mayores a 5 ind/50 m2 (Valderrama y Zea, 2003). Para D. dissoluta, densidades de 1.9-4.6 ind/50 m2 representan un valor intermedio. Si bien estas densidades no son suficientes para sostener una explotación para obtención de productos naturales (Osinga et al., 1999), la población se presta para posteriores estudios que evalúen técnicas de cultivo sostenibles para la producción de discodermólido.
Aunque es bien sabido que las esponjas Lithistida habitan principalmente el sustrato duro (Pomponi et al., 2001; Kelly-Borges, 2007), no se puede concluir que D. dissoluta tenga preferencias por algún tipo de sustrato, puesto que la oferta de los mismos no se cuantificó en campo. Sin embargo, sí se encontró en mayor proporción en sustrato duro con relación al cascajo; además, la esponja no fue vista creciendo en fondos arenosos o lodosos. La esponja prefiere desarrollarse en sustratos expuestos a la luz, donde posiblemente la iluminación juegue un papel importante. Discodermia dissoluta posee cianobacterias fotosintéticas en su dermis y se han encontrado diatomeas en el coanosoma (Schirmer et al., 2005; observaciones no publicadas de los autores), lo que explicaría en cierta medida este esquema de distribución. No hay información publicada sobre colores en poblaciones a profundidades mayores a la zona fótica, por lo que no se sabe si también tengan simbiontes fotosintéticos.
La sedimentación y la epibiosis parecen no comprometer la supervivencia de la esponja pero quizás puedan estar afectando su crecimiento. De igual manera, la poca depredación observada pareció no afectar significativamente la esponja. Esta característica puede indicar un papel antidepredatorio del discodermólido o de otros metabolitos bioactivos producidos por la esponja, como es el caso de muchas esponjas que tienen sustancias repelentes para evitar tanto depredadores generalistas como especialistas (Pawlik et al., 1995; Pawlik, 1998).
La regresión calculada en el presente trabajo permite estimar la talla en volumen de las esponjas a partir de medidas del área obtenidas de las fotos tomadas in situ, y así no tener que utilizar métodos destructivos durante los censos (Usó et al., 1997). Sin embargo, hay que resaltar que los individuos grandes tienden a crecer más verticalmente que hacia los costados por lo que en algunos casos se puede subestimar el volumen en los individuos muy grandes.
Una distribución de tallas sesgada positivamente indica una mayor proporción de individuos muy pequeños con relación a las tallas medianas y grandes. Esto puede entenderse como un alto reclutamiento dentro de la población, que puede ser explicado en términos de reproducción, fragmentación o mortalidad, o de una combinación de éstos. Para las esponjas, todos estos son procesos que influyen significativamente en el mantenimiento de la población, junto con la relativa rápida regeneración por ser estos organismos modulares (Hoppe, 1988). Sin embargo, para el caso de D. dissoluta, no puede concluirse en este momento cuales son más determinantes, debido a la escasa información que se tiene sobre la dinámica de reclutamiento, crecimiento y mortalidad de esta especie en particular. A partir de los individuos marcados se podrá esclarecer en un futuro los mecanismos más importantes en el mantenimiento y la dinámica de la población de D. dissoluta.
AGRADECIMIENTOS
Trabajo financiado por Colciencias dentro del proyecto "Evaluación de la oferta natural y potencial de producción de metabolitos bioactivos de la esponja marina Discodermia dissoluta" (CO-1101-405-20180). Es parte del trabajo de grado de César Ruiz para optar al título de Biólogo Marino, Universidad de Bogotá Jorge Tadeo Lozano, Santa Marta. Se agradece al Instituto de Investigaciones Marinas y Costeras-INVEMAR por el apoyo recibido a través del fondo de Becas Henry von Prahl, así como por la colaboración brindada durante esta investigación, especialmente a través del Programa de Valoración y Aprovechamiento de Recursos Marinos (VAR).
BIBLIOGRAFÍA
1 Bak, R. y E. Meesters. 1998. Coral population structure: the hidden information of colony size-frequency distributions. Mar. Ecol. Prog. Ser., 162: 301-306. [ Links ]
2 Berquist, P. 1978. Sponges. Hutchinson, Londres. 268 p. [ Links ]
3 Bivand R., E. Pebesma y V. Gómez-Rubio. 2008. Spatial point pattern analysis. 154-190. En: Bivand, R., E. Pebesma y V. Gómez-Rubio. Applied spatial data analysis with R. Springer, Nueva York. 378 p. [ Links ]
4 Bonilla, M. A. 2004. Ecología de poblaciones. Univ. Nacional de Colombia, Bogotá. 127 p. [ Links ]
5 Cabrera, E. y M. Donoso. 1992. Estudios de las características oceanográficas del Caribe colombiano, región III, zona I, PDCTM. Memorias del VIII Seminario Nacional de Ciencias del Mar y Congreso Centroamericano y del Caribe en Ciencias del Mar, Santa Marta. 543 p. [ Links ]
6 Cooper, E. 2004. Drug discovery, CAM and natural products. Evid. Based Complement. Alternat. Med., 1: 215-217. [ Links ]
7 Díaz, M. C. 2005. Common sponges from shallow marine habitats from Bocas del Toro region, Panama. Carib. J. Sci., 41: 465-475. [ Links ]
8 Díaz, M. C. y K. Rützler. 2001. Sponges: an essential component of Caribbean coral reefs. Bull. Mar. Sci., 69: 535-546. [ Links ]
9 Franco, A. 2005. Oceanografía de la ensenada de Gaira: El Rodadero, más que un centro turístico en el Caribe colombiano. Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 56 p. [ Links ]
10 Gunasekera, S., M. Gunasekera y R. Longley. 1990. Discodermolide: a new bioactive polyhydroxilated lactone from the marine sponge Discodermia dissoluta. J. Org. Chem., 55: 4912-4915. [ Links ]
11 Hartman, W. D. 1973. Beneath Caribbean reefs. Disc. Rep., 9: 13-26. [ Links ]
12 Hooper, J. N. A., H. Lehnert y S. Zea. 1999. Revision of Aulospongus Norman and review of Raspailiidae with rhabdostyles (Porifera: Demospongiae). Mem. Qld. Mus., 43: 649-708. [ Links ]
13 Hoppe, W. F. 1988. Growth, regeneration and predation in three species of large coral reefs sponges. Mar. Ecol. Prog. Ser., 50: 117-125. [ Links ]
14 Hughes, T. P. 1984. Population dynamics based on individual size rather than age: a general model with a reef coral example. Am. Nat., 123: 778-795. [ Links ]
15 Jackson, J. B. 1983. Biological determinants of present and past sessile animal distributions. 41-120. En: Tevesz, M. y P. McCall (Eds.). Biotic interactions in recent and fossil benthic communities. Plenum Publishing Corporation, Nueva York. 856 p. [ Links ]
16 Jackson, J. B. 1986. Modes of dispersal of clonal benthic invertebrates: consequences for species distributions and genetic structure of local populations. Bull. Mar. Sci., 39 (2): 588-606. [ Links ]
17 Kelly-Borges, M. 2007. The marine fauna of New Zealand: Porifera: Lithistid Demospongiae (rock sponges). NIWA Biodivers. Mem., 121, 100 p. [ Links ]
18 Kelly-Borges, M., E. V. Robinson, S. P. Gunasekera, M. Gunasekera, N. K. Gulavita y S. A. Pomponi. 1994. Species differentiation in the marine sponge genus Discodermia (Demospongiae: Lithistida): the utility of ethanol extract profiles as species-specific chemotaxonomic markers. Biochem. Syst. Ecol., 22: 353-365. [ Links ]
19 Kohler, K. y S. Gill. 2006. Coral Point Count with Excel extensions (CPCe): A visual basic program for the determination of coral and substrate coverage using random point count methodology. Comp. Geosci., 32 (9): 1259-1269. [ Links ]
20 Kowalski, R., P. Giannakakou, S. P. Gunasekera, R. E. Longley, B. W. Day y E. Hamel. 1997. The microtubule-stabilizing agent discodermolide competitively inhibits the binding of Paclitaxel (Taxol) to tubulin polymers, enchances tubulin nucleation reactions more potently than Paclitaxel, and inhibits the growth of Paclitaxel-resistant cells. Mol. Pharmacol., 52: 613-622. [ Links ]
21 Maldonado, M. 2006. The ecology of the sponge larva. Can. J. Zool., 84: 175-194. [ Links ]
22 Maldonado, M. y C. M. Young. 1996. Bathymetric patterns of sponge distribution on the Bahamian slope. Deep-sea. Res., 43: 897-915. [ Links ]
23 Maldonado, M. y C. M. Young. 1998. Limits on the bathymetric distribution of keratose sponges: a field test in deep water. Mar. Ecol. Prog. Ser., 174: 123-139. [ Links ]
24 Mateu, J., J. Usó y F. Montes. 1998. The spatial pattern of a forest ecosystem. Ecol. Model., 108: 163-174. [ Links ]
25 McMurray, S. E., J. E. Blum y J. Pawlik, 2008. Redwood of the reef: growth and age of the giant barrel sponge Xestospongia muta in the Florida Keys. Mar. Biol., 155: 159-171. [ Links ]
26 McMurray, S. E., T. P. Henkel y J. Pawlik, 2010. Demographics of increasing populations of the giant barrel sponge Xestospongia muta in the Florida Keys. Ecology, 91: 560-570. [ Links ]
27 Mickel, J. S., D. Niederer, R. Daeffler, A. Osmani, E. Kuesters, E. Schmid, K. Schaer y R. Gamboni. 2004. Large-scale synthesis of the anti-cancer marine natural product (+)-Discodermolide. Part 5: Linkage of fragments C1-6 and C7-24 and finale. Org. Process. Res. Dev., 8: 122-130. [ Links ]
28 Mita, A., C. Lockhart, T. L. Chen, K. Boshinski, J. Curtright, W. Cooper, L. Hammond, M. Rothenberg, E. Rowinsky y S. Sharma. 2004. A phase I pharmacokinetic (PK) trial of XAA296A (discodermolide) administered every 3 wks to adult patients with advanced solid malignancies. J. Clin. Oncol. (meeting abstracts), 10: 2025. [ Links ]
29 Osinga, R., J. Tramper y R. H. Wijffels. 1999. Cultivation of marine sponges. Mar. Biotechnol., 1: 509-532. [ Links ]
30 Pawlik, J. 1997. Fish predation on Caribbean reef sponges: an emerging perspective of chemical defenses. Proc. 8th. Int. Coral Reef Sym., 2: 1255-1528. [ Links ]
31 Pawlik, J. 1998. Coral reef sponges: Do predatory fish affect their distribution? Limnol. Oceanogr., 43: 1396-1399. [ Links ]
32 Pawlik, J., B. Chanas, R. J. Tooner y W. Fenical. 1995. Defenses of Caribbean sponges against predatory reef fish. I. Chemical deterrency. Mar. Ecol. Prog. Ser., 127: 183-194. [ Links ]
33 Pomponi, S., M. Kelly, J. K. Reed y A. E. Wright. 2001. Diversity and bathymetric distribution of lithistid sponges in the tropical Western Atlantic region. Bull. Biol. Soc. Wash., 10: 344-353. [ Links ]
34 Reed, J. K. y S. Pomponi. 1997. Biodiversity and distribution of deep and shallow water sponges in The Bahamas. Proc. 8th. Int. Coral Reef Symp., 2: 1387-1392. [ Links ]
35 Sarà, M. y J. Vacelet. 1973. Écologie des démosponges. 462-576. En: Grassé, P. P. (Ed.). Traité de zologie. Anatomie, systématique, biologie. Masson et Cie Eds, París. 716 p. [ Links ]
36 Schirmer, A., R. Gadkari, C. Reeves, F. Ibrahim, E. DeLong y R. Hutchinson. 2005. Metagenomic analysis reveals diverse polyketid synthase gene clusters in microorganism associated with the marine sponge Discodermia dissoluta. Appl. Environ. Microbiol., 71: 4840-4849. [ Links ]
37 Smith, A., Y. Qiu, D. R. Jones y K. Kobayashi. 1995. Total synthesis of discodermolide. J. Org. Chem., 117: 12011-12012. [ Links ]
38 Smith, A., M. D. Kaufman, T. J. Beauchamp, M. J. LaMarche y H Arimoto. 1999. Gram-Scale synthesis of (+)-Discodermolide. Org. Lett., 1: 1823-1826. [ Links ]
39 Sokal, R. y J. Rohlf. 1981. Biometry. W. H. Freeman, San Francisco. 859 p. [ Links ]
40 Uriz, M. J., M. Maldonado, X. Turon y R. Martí. 1998. How do reproductive output, larval behaviour, and recruitment contribute to adult spatial patterns in Mediterranean encrusting sponges. Mar. Ecol. Prog. Ser., 167: 137-148. [ Links ]
41 Usó, J. L., J. Mateu, T. Karjalainen y P. Salvador. 1997. Allometric regression equations to determine aerial biomasses of Mediterranean shrubs. Plant Ecol., 132: 59-69. [ Links ]
42 Vacelet, J. 1988. Indications de profondeur donées par le Spongiaires dans les milieux benthiques actuels. Geol. Mediterr., 15: 13-26. [ Links ]
43 Valderrama, D. y S. Zea. 2003. Esquemas de distribución de esponjas arrecifales (Porifera) del noroccidente del golfo de Urabá, Caribe sur, Colombia. Bol. Invest. Mar. Cost., 32: 37-56. [ Links ]
44 Van Soest, R. W y E. J. Beglinger. 2008. Tetractinellid and hadromerid sponges of the Sultanate of Oman. Zool. Med. Leiden, 82: 749-790. [ Links ]
45 Van Soest, R. W. M y N. Stentoft. 1988. Barbados deep-water sponges. Stud. Fauna Curaçao Caribb. Isl., 215: 175 p. [ Links ]
46 Zea, S. 1987. Esponjas del Caribe colombiano. Catálogo Científico, Bogotá. 286 p. [ Links ]
47 Zea, S. 1993a. Cover of sponges and other sessile organisms in rocky and coral reef habitats of Santa Marta, Colombian Caribbean Sea. Caribb. J. Sci., 29: 75-88. [ Links ]
48 Zea, S. 1993b. Recruitment of demosponges (Porifera, Demospongiae) in rocky and coral reef habitats of Santa Marta, Colombian Caribbean. PSZNI. Mar. Ecol., 14: 1-21. [ Links ]
49 Zea, S. 2001. Patterns of sponge (Porifera, Demospongiae) distribution in remote, oceanic reef complexes of the southwestern Caribbean. Rev. Acad. Colomb. Cienc., 25: 579-592. [ Links ]
50 Zea, S. y W. De Weerdt. 1999. Haliclona (Haliclona) epiphytica n. sp. (Porifera, Demospongiae, Haplosclerida), a seaweed-dwelling sponge from the Colombian Caribbean. Beaufortia, 49: 171-176. [ Links ]
51 Zilberberg, C., M. Maldonado y A. M. Solé-Cava. 2006a. Assesment of the relative contribution of asexual propagation in a population of the coral-excavating sponge Cliona delitrix from the Bahamas. Coral Reefs, 25: 297-301. [ Links ]
52 Zilberberg, C., A. M. Solé-Cava y M. Klautau. 2006b. The extent of asexual reproduction in sponges of the genus Chondrilla (Demospongiae: Chondrosida) from the Caribbean and the Brazilian coasts. J. Exp. Mar. Biol. Ecol., 336: 211-220. [ Links ]
FECHA DE RECEPCIÓN: 10/12/2009 FECHA DE ACEPTACIÓN: 13/02/2012
*Contribución No. 1102 del Instituto de Investigaciones Marinas y Costeras-INVEMAR y No. 367 del Centro de Estudios en Ciencias del Mar-CECIMAR, Universidad Nacional de Colombia sede Caribe.