Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.41 no.1 Santa Marta Jan./June 2012
CRECIMIENTO Y SUPERVIVENCIA DE LARVAS DE ARGOPECTEN NUCLEUS ALIMENTADAS CON DIFERENTES DIETAS MICROALGALES*
GROWTH AND SURVIVAL LARVAE OF ARGOPECTEN NUCLEUS FED WITH DIFFERENT MICROALGAE DIETS
Yenia Katerine Carreño Hernández, Ernesto Acosta Ortiz y Javier Gómez-León
Instituto de Investigaciones Marinas y Costeras-INVEMAR, Cerro Punta de Betín, Santa Marta, Colombia. katerine_carreno@invemar.org.co, yo_kate84@yahoo.es (YKCH); e_acosta@invemar.org. co (E.A.O.); jgomezleon@invemar.org.co (JGL).
RESUMEN
Se estudió la influencia que ejerce la dieta sobre el desarrollo larvario del pectínido Argopecten nucleus, probando seis dietas microalgales compuestas por dietas monoalgales y mezcla de las especies Isochrysis galbana, Chaetoceros calcitrans y Tetraselmis suecica en relación 1:1, manejando una concentración por mL equivalente al peso de 40000 células de I. galbana, midiendo la respuesta a través de las variables supervivencia, crecimiento, aparición de la mancha ocular y estado de condición (larvas llenas, semillenas y vacías). Las dietas que contenían I. galbana presentaron los mayores valores en cada una de las variables medidas, en comparación con aquellas que carecían de esta. Particularmente, la dieta mixta I. galbana + C. calcitrans presentó superioridad en todas las variables, aunque en la mayoría de los casos fue estadísticamente similar a I. galbana + C. calcitrans + T. suecica, I. galbana + T. suecica e I. galbana sola. Por el contrario, las dietas que arrojaron los resultados más bajos fueron C. calcitrans y C. calcitrans + T. suecica. Los resultados obtenidos se atribuyen principalmente a la composición nutricional, especialmente de ácidos grasos altamente insaturados (HUFA por sus siglas en inglés) de cada microalga y de cada mezcla suministrada, la cual se discute detalladamente.
PALABRAS CLAVE: Argopecten nucleus, Larvas, Microalgas, Isochrysis galbana, HUFA.
ABSTRACT
The influence of the diet on larval growth of the scallops Argopecten nucleus was studied, testing six microalgae diets composed by single-algae and mixed diets of the species Isochrysis galbana, Chaetoceros calcitrans y Tetraselmis suecica, handling a concentration per mL equivalent to 40000 cells of I. galbana and the response through the variables surviving, growth, appearance of the eye spot and state of condition (full, half-full and empty larvae) was measured. The diets containing I. galbana showed greater results over all the measured variables, with regard to those where it was not present. In particular, the mixed diet I. galbana + C. calcitrans presented superiority over all variables, although in the most cases was statistically similar to I. galbana + C. calcitrans + T. suecica, I. galbana + T. suecica and I. galbana alone. For the opposite, the diets with the lowest results were C. calcitrans and C. calcitrans + T. suecica. The results obtained are principally attributed to the nutritional composition mainly of high unsaturated fatty acids (HUFA) of each microalgae and each mixture supply, which is discussed in detail.
KEY WORDS: Argopecten nucleus, Larvae, Microalgae, Isochrysis galbana, HUFA.
INTRODUCCIÓN
Argopecten nucleus es un pectínido filtrador epibentónico que se encuentra desde 10 hasta 50 m de profundidad y habita los fondos rocosos del mar Caribe; es una especie libre, alcanza una talla de 5 cm y tiene una vida corta de aproximadamente dos años (Díaz y Puyana, 1994). Ha sido identificado como uno de los pectínidos nativos con potencial para el cultivo por su rápido crecimiento, alto contenido de carne, bajos costos de producción en su cultivo intermedio y final, buen precio en el mercado internacional de especies similares y por ser una valiosa fuente de alimento (Urban, 1999; Valero et al., 2000). Dado que su disponibilidad de semilla en el medio natural es baja, variable y poco predecible (Castellanos y Campos, 2007), la producción de esta en laboratorio se convertiría en la alternativa más eficiente para suplir su demanda en un cultivo a gran escala. A pesar de que en Colombia se ha logrado la producción de semilla en laboratorio de manera experimental (Velasco et al., 2007; Velasco y Barros, 2008), aún es necesario continuar investigando aspectos como el alimento y el tipo de dieta, sobre todo en la etapa larvaria, siendo estos unos de los factores más limitantes para el crecimiento y la supervivencia de larvas de moluscos pectínidos (Uriarte y Farías, 1999) y, de esta manera, lograr maximizar los volúmenes de producción obtenidos hasta ahora, al reducir las tasas de mortalidad en el cultivo larvario y, por ende, aumentar la posibilidad de obtener mayor número de semillas por ciclo de producción.
Las microalgas planctónicas son el alimento más importante para los pectínidos en condiciones de laboratorio, tanto en su fase larvaria como en la adulta (Farías-Molina, 2001; Velasco, 2008). De la misma manera, la concentración y el tipo de alimento son imprescindibles para el óptimo desarrollo larvario, el cual varía según la especie. En la literatura no se encuentra un consenso para la alimentación de larvas de pectínidos, la cual, según autores como Winkler y Estévez (2003) y Farías y Uriarte (2006), va desde 4000 hasta 50000 cel/mL, para especies como A. purpuratus, A. circularis y Nodipecten nodosus; las especies de microalgas más utilizadas son Isochrysis galbana, I. aff. galbana (T-ISO), Pavlova lutheri, Tetraselmis suecica, Chaetoceros gracilis y C. calcitrans (Farías-Molina, 2001; Velasco et al., 2007). Generalmente, se usa la mezcla de dos microalgas en las fases iniciales, una flagelada y una diatomea, y cuando las larvas alcanzan tallas mayores, se recomienda incluir también especies pequeñas de Tetraselmis (Helm et al., 2006).
Por tales motivos, en este trabajo se pretendió establecer el efecto de la dieta microalgal sobre la supervivencia y el crecimiento larvario de A. nucleus, utilizando seis dietas formuladas en función del peso seco, compuestas por las microalgas Isochrysis galbana (alga flagelada), Chaetoceros calcitrans (diatomea) y Tetraselmis suecica (alga flagelada), las cuales se escogieron por su amplia utilización en el cultivo de estos organismos y por el fácil acceso que se tuvo a las cepas. Con lo anterior se hará una contribución al mejoramiento de la producción de semilla de este bivalvo en laboratorio.
ÁREA DE ESTUDIO
El presente estudio se realizó en un laboratorio adaptado para tal fin, situado cerca a la costa, a 4 Km de Punta Canoa, corregimiento de Cartagena, Bolívar (10°23' N, 75°32' W). Allí, la temperatura del agua de mar se mantuvo controlada según se requería en cada proceso y la salinidad varió entre 34 y 37. A 100 m de este sector funcionan las instalaciones de un laboratorio productor de postlarvas de camarón, el cual proveyó agua de mar prefiltrada, agua dulce y energía eléctrica.
MATERIALES Y MÉTODOS
Colecta, maduración y desove de reproductores
Se colectaron entre 20 y 30 individuos de A. nucleus en estadio de madurez III en la escala modificada de Sastry (1963) y Cochard y Devauchelle (1993) de la estación experimental de cultivo de bivalvos de INVEMAR, en la bahía de Neguange (11°20' N, 74°05' W), Parque Nacional Natural Tayrona (PNNT), Santa Marta, en donde la temperatura del agua de mar oscila entre 22 y 30 °C según la época del año, la salinidad de 33 a 37, las concentraciones de seston entre 0.2 y 4.7 mg/L y el porcentaje orgánico en el agua entre 15 y 60 % (Urban, 1999). Los animales se transportaron en una cava térmica a 21 °C aproximadamente, hasta el laboratorio en Punta Canoa (Bolívar). Allí se aclimataron a 25 °C y se colocaron en una canaleta con 250 L de agua de mar filtrada (AMF) a 5 µm, aireación, alimentación constante de 40000 cel/mL de las microalgas Isochrysis galbana, Chaetoceros calcitrans y Tetraselmis suecica, en una relación 1:1:1, recambio diario del 200 %, temperatura de 23 a 26 °C, y salinidad entre 31.5 y 35.5, durante diez días. El día previo al desove se suspendió el alimento y el recambio de agua se incrementó a un 300 %. Una vez alcanzaron el estadio de madurez IV, 20 individuos se limpiaron con cepillo y cuchillo retirando los epibiontes adheridos a la concha, se colocaron en un acuario de fondo negro, con 20 L de agua AMF (1 µm) e irradiada con luz ultravioleta (UV) y aireación baja. Se inició la inducción al desove por choque térmico (de 23 a 28 °C, cada 30 min), y con exposición de los animales a desecación por 5 min cada 30 min, sumado a un proceso de irradiación constante con luz UV del agua utilizada. Al momento de expulsión de los gametos, cada animal se colocó por separado en un recipiente de 2 L de agua con las mismas características utilizadas en la inducción.
Obtención de larvas
Los gametos femeninos y masculinos se colectaron por separado, se tamizaron por una malla de 90 µm, los espermatozoides se colocaron en recipientes de 2 L y los ovocitos de cinco hembras se lavaron con abundante agua y se suspendieron en un balde con 10 L de agua. Se estimó la concentración de los productos gaméticos por medio de conteo de alícuotas en microscopio, utilizando una placa Sedgewik Rafter para los ovocitos y una Neubawer para los espermatozoides. Seguidamente, se realizó la fertilización a una relación 100:1 durante 30 min, luego los cigotos se tamizaron y lavaron en una malla de 23 µm. El desarrollo embrionario se llevó a cabo en tanques de fibra de vidrio de 500 L, con AMF a 1 µm, irradiada con luz UV, aireación muy suave, temperatura de 24.5 a 25.5 °C, salinidad de 36 y pH de 8. Las larvas D se obtuvieron a las 24 h de la fertilización.
Experimento de alimentación larvaria
Con el fin de determinar una dieta microalgal que favorezca el crecimiento y la supervivencia de larvas de A. nucleus, se probaron seis dietas: 1) Isochrysis galbana (ISO), 2) Chaetoceros calcitrans (CHA), 3) I. galbana + C. calcitrans en relación 1:1, (ISO+CHA) 4) I. galbana + Tetraselmis suecica en relación 1:1 (ISO+TETRA), 5) C. calcitrans + T. suecica en relación 1:1 (CHA+TETRA), 6) I. galbana + C. calcitrans + T. suecica en relación 1:1:1 (ISO+CHA+TETRA). Las relaciones microalgales de las especies utilizadas en este experimento se realizaron en función a la equivalencia en peso seco de la especie I. galbana, dado que así se tiene en cuenta el valor nutricional de cada especie, puesto que una célula de I. galbana tiene más de cuatro veces la concentración de ácidos grasos que posee una de C. calcitrans, lo cual se pasa por alto cuando se hace la relación en volumen o número de células. De este modo, al realizar la mezcla en la dieta ISO+CHA, se usaron 20000 cel/mL de I. galbana y 84800 cel/mL de C. calcitrans, y de la mezcla ISO+CHA+TETRA se utilizaron aproximadamente 13300 cel/mL de I. galbana, 56400 cel/mL de C. calcitrans y 5450 cel/mL de T. suecica (Tabla 1), manteniendo así las proporciones de los nutrientes de cada microalga.
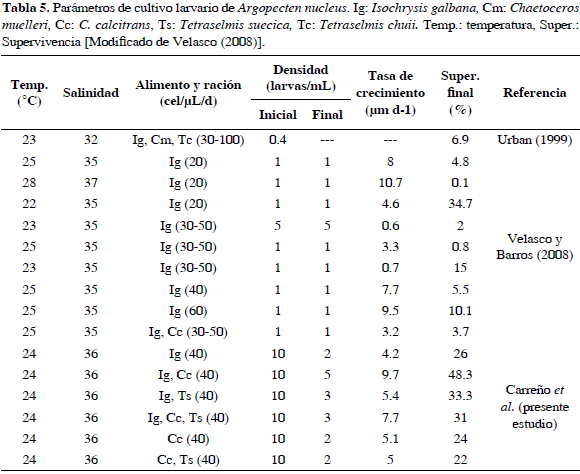
Las larvas D producidas fueron colectadas, contadas y distribuidas por triplicado en botellones aforados a 15 L, provistos de agua de mar filtrada a 1 µm e irradiada con luz UV, aireación suave, temperatura de 25±1 ºC, estableciéndose una densidad de siembra inicial de 10 larvas/mL y una concentración de alimento de 40000 cel/mL de las microalgas a utilizar. Cabe resaltar que estas dos últimas condiciones son mayores que las trabajadas por otros autores [Urban (1999) con 0.4 larvas/mL y Velasco y Barros (2008) con 1 larva/mL y 20000 cel/mL de microalgas] y se determinaron gracias a ensayos previos al presente. Este experimento concluyó al momento de alcanzar el estado de larva con mancha ocular.
Diariamente se recambió el agua drenando los botellones, reteniendo las larvas de cada uno en una malla de 40 µm, se suspendieron en recipientes de 1.5 L, de donde se tomaron tres muestras de 1 mL para su conteo y se seleccionaron 30 larvas al azar para determinar su longitud antero-posterior. Finalmente, se realizaron observaciones directas al microscopio sobre su estado de condición: glándula digestiva llena, semillena y vacía (Tabla 2); para lo anterior se utilizó una placa Sedgewick Rafter (SR). La temperatura y salinidad se tomaron diariamente, utilizando un equipo multiparámetros portátil marca YSI Model 30, con una precisión de 0.1 °C y 0.1 ppt, y una resolución de uno y dos decimales, respectivamente. Asimismo, el pH se midió con un pH-metro marca WTW 300i, con una precisión de < 0.005+1 dígito y una resolución de tres decimales.
Análisis estadístico
Se revisó la homogeneidad de varianzas para cada variable por medio del test de Cochran y la normalidad utilizando el estadístico Shapiro-Wilks. Posteriormente, los datos fueron sometidos al análisis de varianza de una vía (ANOVA) para establecer posibles diferencias entre los tratamientos. En donde se presentaron diferencias, se realizó una prueba de múltiples comparaciones para determinar cuáles tratamientos ejercían mayor influencia sobre la variable en estudio, por medio de la prueba de Tukey HSD. El análisis estadístico se llevó a cabo utilizando el programa Statgraphics Plus 4.0 y las decisiones se tomaron teniendo en cuenta un intervalo de confianza (α) de 0.05.
RESULTADOS
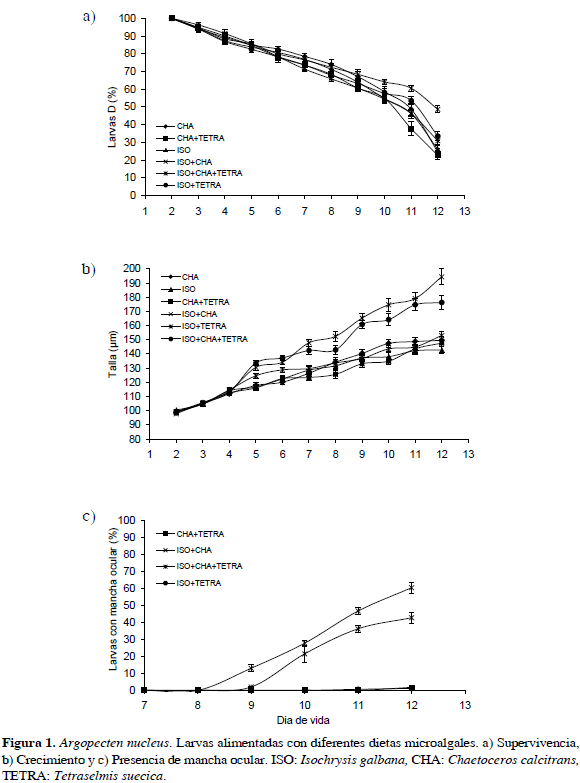
El experimento tuvo una duración de 12 días (d), tiempo en el cual se presentó el estadio de mancha ocular en por lo menos uno de los tratamientos. Al final, se observó una notable diferencia con respecto a las variables supervivencia, crecimiento, estado de condición y aparición de mancha ocular, entre las dietas monoalgales y mixtas que contenían I. galbana, siendo estas últimas las más favorables.
Supervivencia
La supervivencia larvaria para el final del cultivo fue mayor con las dietas I. galbana + C. calcitrans (ISO+CHA), I. galbana + T. suecica (ISO+TETRA) e I. galbana + C. calcitrans + T. suecica (ISO+CHA+TETRA) con 48.6, 30.8 y 30.6 % respectivamente (Figura 1a); por el contrario, los valores más bajos se registraron con C. calcitrans + T. suecica (CHA+TETRA); C. calcitrans (CHA) e I. galbana (ISO), con una supervivencia del 22, 24 y 26 %. Se encontraron diferencias estadísticas entre tratamientos (Gl= 5; F= 6.1; p= 0.0049), y los resultados obtenidos con las dietas ISO+CHA, ISO+TETRA e ISO+CHA+TETRA fueron estadísticamente homogéneos y superiores a los demás.
Crecimiento
La dieta con la que se obtuvo el mayor crecimiento larvario fue ISO+CHA con un incremento diario de 9.7 µm/día, alcanzando una talla de 195 µm para el último día de cultivo; en segundo lugar, la dieta ISO+CHA+TETRA presentó un incremento de 7.7 µm/día, y una talla final de 176 µm (Figura 1b).
No se observaron diferencias marcadas en el crecimiento entre los demás tratamientos, encontrándose que con ISO+TETRA se obtuvo una talla final de 153 µm, con un incremento de 5.4 µm/día. Los resultados de CHA y CHA+TETRA fueron similares estadísticamente entre sí, con un aumento de 5.1 y 5.0 µm/día y una talla final de 150 y 149 µm, respectivamente. Por último, con la monodieta ISO las larvas crecieron en total 143 µm, incrementándose este valor a razón de 4.2 µm/día, siendo la de menor talla al final del experimento. Se presentaron diferencias estadísticas altamente significativas entre tratamientos (Gl= 5; F= 32.6; p= 0.00) y la dieta ISO+CHA fue significativamente mayor que ISO+CHA+TETRA, y esta a su vez, mayor que las demás.
Presencia de mancha ocular
Esta fue evidente en las larvas alimentadas con las dietas ISO+CHA e ISO+CHA+TETRA a partir del noveno día, registrando un incremento diario de 15.1 y 10.6 %, presentando un total de 60.4 y 42.4 % de larvas con esta característica, respectivamente, al último día de cultivo (día 12) (Figura 1c). Contrario a este comportamiento, en ISO+TETRA, CHA+TETRA y CHA, la mancha ocular se observó el último día con un 1.2, 1.7 y 1.8 %, siendo ISO la única dieta en donde no se presentaron larvas con mancha ocular. Se encontraron diferencias estadísticamente significativas entre tratamientos (Gl= 3; F= 329.1 y p= 0.00), y las dietas ISO+CHA+TETRA e ISO+CHA fueron significativamente superiores a las demás.
Estado de condición diario
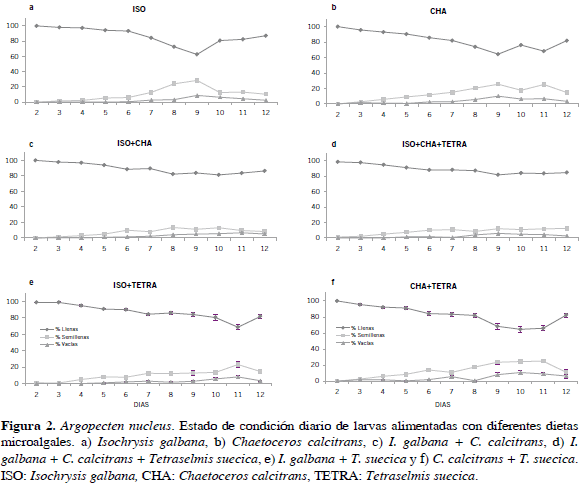
El comportamiento de esta variable se caracterizó por la predominancia del estado de condición de larvas llenas, seguido en menor medida por larvas semillenas y hacia el final del experimento, un pequeño porcentaje de larvas en estado de condición vacías (Figura 2).
Al realizar un promedio general de dicho comportamiento a lo largo del experimento en cada tratamiento, se logró distinguir que los mayores porcentajes promedio de larvas en estado de condición llenas se obtuvieron con ISO+CHA e ISO+CHA+TETRA con 89.3 y 89.1 % respectivamente; para ISO e ISO+TETRA los valores medios fueron 86.6 y 96.5 % y los menores se obtuvieron con CHA (82.8 %) y CHA+TETRA (82.7 %). Con respecto al estado de condición promedio de larvas semillenas, los porcentajes más bajos se lograron con las dietas ISO+CHA (7.6 %) e ISO+CHA+TETRA (8.5 %) y los más altos fueron CHA y CHA+TETRA con 13.4 y 13.1 %, respectivamente. Por su parte, la presencia de larvas vacías se determinó en menor medida con las dietas ISO+CHA+TETRA, ISO e ISO+TETRA con 2.4 y 2.7 % en promedio general para las dos últimas dietas, y en mayor medida en CHA con 3.7 % y CHA+TETRA con 4.2 %.
Cabe destacar que los tratamientos ISO+CHA e ISO+CHA+TETRA no registraron variaciones en la relación de larvas llenas, semillenas y vacías a lo largo del experimento (Figuras 4c y d), en comparación con ISO y CHA, en los cuales se produjo una fuerte oscilación entre todos los estados de condición en los días 8 y 9, observándose un descenso de larvas llenas y un incremento de larvas semillenas y vacías (Figuras 4a y b). Con ISO+TETRA y CHA+TETRA la oscilación se presentó entre los días 10 y 11 para el primero y entre los días 9 y 11 para el segundo.
Se encontraron diferencias estadísticamente significativas entre tratamientos con relación al estado de larvas llenas (Gl= 5; F= 2.3 y p= 0.0212) y semillenas (Gl= 5; F= 3.2 y p= 0.0079), presentándose un grupo homogéneo conformado por ISO+CHA, ISO+CHA+TETRA, ISO e ISO+TETRA, con la mayor presencia de larvas llenas, así mismo, los porcentajes más bajos de larvas semillenas. Sin embargo, todas las anteriores, excepto ISO+CHA, conforman el grupo homogéneo junto con CHA y CHA+TETRA con los porcentajes más altos de larvas semillenas. Para el estado de condición de larvas vacías no se encontraron diferencias estadísticas significativas (Gl= 5; F= 0.8 y p= 0.5623).
DISCUSIÓN
Supervivencia
Los valores más altos de supervivencia se obtuvieron con las dietas mixtas, en donde se incluyó la microalga I. galbana. Tales resultados se atribuyen principalmente a la mezcla de microalgas en sí, puesto que se ha encontrado que, generalmente, las larvas de pectínidos alimentadas con dos o más tipos de microalgas tienen mayor crecimiento y supervivencia que al suministrar un solo tipo, debido a la complementariedad de nutrientes que se logra al suministrar la mezcla (Narvarte y Pascual, 2001; Helm et al., 2006; Bayne, 2008; Velasco y Barros, 2008).
Por otro lado, se encuentran los requerimientos nutricionales de las larvas en desarrollo, en especial los ácidos grasos altamente insaturados (HUFA por sus siglas en inglés), que cumplen un rol generalizado en la estructuración e integridad funcional de las membranas y además sirven como precursores de compuestos que funcionan como reguladores de las funciones biológicas. Dentro de los HUFA, los ácidos grasos identificados como esenciales son el DHA (ácido docosahexanóico, 22:6n-3), el EPA (ácido eicosapentanóico, 20:5n-3) y en menor medida el AA (ácido araquidónico, 20:4n-6) (Farías-Molina, 2001; Helm et al., 2006).
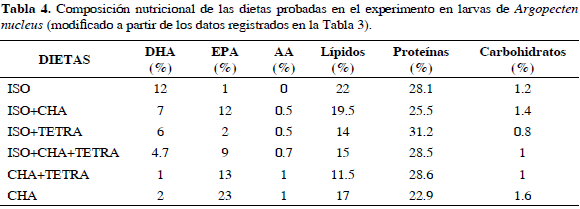
Según autores como Martínez (1991), Marty et al. (1992) y Delaunay et al. (1993), las larvas de los pectínidos tienen un alto requerimiento de EPA en las fases larvarias tempranas y una disminución hacia la fase tardía y posmetamórfica, mientras que los requerimientos de DHA parecen mantenerse altos durante toda la vida larvaria e incluso después de la metamorfosis. Según esto y teniendo en cuenta que la microalga I. galbana posee el porcentaje más alto de DHA con respecto a las otras microalgas utilizadas en este experimento (Tabla 3), es lógico pensar que las mezclas microalgales que posean esta microalga tengan una ventaja nutricional frente a las demás.
Así, el mayor valor de supervivencia fue logrado con la dieta ISO+CHA, resultado que concuerda con lo hallado por Velasco (1997), quien realizando el cultivo larvario de N. subnodosus encontró que las larvas alimentadas con una mezcla de I. galbana y C. calcitrans eran capaces de completar su desarrollo hasta la metamorfosis, mientras que alimentando sólo con C. calcitrans no lograron completar su desarrollo larvario. Este resultado, al igual que el obtenido en esta investigación, podría ser atribuido nuevamente a los requerimientos nutricionales de las larvas y su relación con el contenido de nutrientes de las microalgas utilizadas en este experimento, pues como se mencionó anteriormente el EPA y el DHA son dos de los ácidos grasos primordiales para la supervivencia y desarrollo de las larvas. Como se observa en la Tabla 3, la microalga I. galbana posee más alto contenido de DHA, pero baja presencia de EPA, mientras que C. calcitrans contiene el más alto contenido de EPA, pero baja concentración de DHA, por lo cual, con la combinación de estas microalgas se crea un efecto sinérgico, lo que permite complementar las deficiencias de nutrientes esenciales de cada microalga (Helm et al., 2006, Bayne, 2008), produciendo por ende una nutrición más completa, balanceada y eficiente para el desarrollo larvario.
Después de la dieta ISO+CHA, el segundo y tercer valor más alto de supervivencia se presentó con las dietas ISO+TETRA y con ISO+CHA+TETRA respectivamente, sin ser diferentes significativamente entre sí. La razón por la cual ISO+TETRA arrojó el segundo valor más alto de supervivencia, se podría explicar por el hecho que aunque T. suecica posee EPA en menor proporción que C. calcitrans e igual proporción de AA, esta microalga aporta mayor porcentaje de proteínas que todas las demás (Tabla 3). Según Uriarte et al. (2001), una dieta con alto contenido de proteína mejora la calidad de vida de las larvas; por otro lado, la dieta constituida por las tres microalgas evidencia que a pesar de los buenos resultados, la utilización de T. suecica reduce la eficiencia de la supervivencia, por no tener una fuente muy importante de ácidos grasos que complementen sustancialmente a las otras dos especies y además su participación en la dieta obliga a disminuir en una tercera parte los aportes de EPA y DHA aportados por las otras dos especies de microalgas.
La dieta ISO+CHA produjo una supervivencia larvaria del 48 %, la cual supera en gran medida a la registrada por Velasco y Barros (2008), quienes probando tres dietas microalgales, compuestas por 1) I. galbana, 2) I. galbana + C. calcitrans y 3) I. galbana + Emulsión de DHA, en larvas de esta misma especie, obtuvieron un máximo de supervivencia larvaria del 4 % con la dieta 2. La diferencia de la supervivencia entre estos dos trabajos posiblemente se deba a la manera en la que se maneja la relación microalgal, la cual es de 1:1 en ambos casos, puesto que los primeros autores se basan en el número de células, mientras que en el presente, se hizo con respecto al peso seco de las microalgas (Tabla 1). Con la primera, no se tiene en cuenta la cantidad de nutrientes aportados por cada microalga, por lo tanto, no se suministran de manera equivalente. Estas mismos autoras sugieren que las mezclas microalgales realizadas de esta manera proveen un bajo equivalente en peso seco de alimento, más que si se suministra una dieta monoalgal, y que un reemplazo del 50 % de las células de I. galbana por un número equivalente de células de C. calcitrans, podría causar que el peso seco total de la dieta decreciera en un 35 % aproximadamente.
Crecimiento
Walne (1970) sugirió que la mezcla microalgal tiene un efecto sinérgico que hace que se incremente la tasa de crecimiento. Helm et al. (2006) señalaron que una combinación de dos especies de microalgas de alto valor nutritivo que incluya un flagelado y una diatomea de tamaño adecuado invariablemente acelera el crecimiento y desarrollo larvario en los bivalvos, como es el caso de la dieta ISO+CHA, la cual presentó el mayor crecimiento, confirmando que con esta mezcla se asegura una nutrición más completa y balanceada, como se mencionó anteriormente.
El segundo mayor crecimiento fue conseguido con la dieta ISO+CHA+TETRA, aunque fue significativamente menor que el primero, al mismo tiempo fue significativamente más alto que con las cuatro dietas restantes. Esta superioridad en el crecimiento por parte de aquellas dietas que poseen las microalgas I. galbana y C. calcitrans, confirman lo expresado en el ítem anterior, al discutir el beneficio de utilizar microalgas con altos contenidos de ácidos grasos, debido al papel que éstos cumplen en la supervivencia y crecimiento de las larvas, encontrándose estas dos variables relacionadas entre sí y siendo las de mayor interés comercial (Manahan y Crisp, 1982).
Según Novoa (2007), la composición en compuestos esenciales (aminoácidos, ácidos grasos, vitaminas) más que la cantidad total de proteínas, lípidos totales o glúcidos puede ser la responsable de las diferencias en cuanto al valor nutricional de las microalgas. Esto es apoyado en parte por Webb y Chu (1982) quienes sugieren que el valor nutricional de las especies microalgales no está relacionado con su contenido total de lípidos y carbohidratos, sino que parece estar correlacionado con la composición total de proteínas y la composición cualitativa de ácidos grasos.
Teniendo en cuenta los resultados obtenidos se podría afirmar que entre mayores sean las concentraciones de ácidos grasos esenciales presentes en las microalgas que conforman la dieta, en especial EPA y DHA, mayor será el crecimiento alcanzado por las larvas; sin embargo, como se mencionó en el ítem anterior, Farías-Molina (2001) encontró que en la fase larvaria temprana los pectínidos podrían tener un alto requerimiento de EPA y una disminución hacia la fase tardía o postmetamórfica, mientras que los requerimientos de DHA parecen mantenerse altos durante toda la vida larvaria e incluso después de la metamorfosis. Esto explicaría el comportamiento del crecimiento de las larvas a lo largo del tiempo, en donde se mantuvo similar con todos los tratamientos hasta el quinto día de cultivo, a partir del cual se observa la predominancia de las dietas ISO+CHA+TETRA e ISO+CHA, las cuales tienen porcentajes balanceados de ambos compuestos, mientras que con ISO+TETRA, CHA+TETRA, CHA e ISO la tasa de crecimiento es menor, mostrando los valores más bajos al final del experimento, debido a que con estas dietas se presenta deuda de alguno de dichos compuestos (Tabla 4).
Los altos valores de crecimiento obtenidos con las dietas mixtas ISO+CHA e ISO+CHA+TETRA, concuerdan con lo observado en A. ventricosus, en donde se ha demostrado que las larvas presentan mayor crecimiento con la mezcla de I. galbana y C. gracilis que con cada microalga por separado, porque con la mezcla se incrementan los valores de depósito diario de proteína y utilización aparente de la misma (Millán-Tovar, 1997). Del mismo modo, Urban (1999) registró un crecimiento mayor de larvas de Pinctada imbricata alimentándolas con una mezcla de I. galbana + C. calcitrans que administrándolas por separado. Finalmente, Helm et al. (2006) afirman que las larvas de C. gigas, C. rhizophorae y Tapes philippinarum alimentadas con una mezcla de C. calcitrans e I. galbana (Clon T-ISO) presentaron un mayor crecimiento que suministrando estas microalgas por aparte. Por último, la tasa de crecimiento encontrada en este experimento fue considerablemente mayor a la registrada por Velasco y Barros (2008) y Urban (1999) para larvas de esta misma especie al probar diferentes dietas (Tabla 5).
Mancha ocular
Esta es la última fase del desarrollo larvario, marcando el comienzo de la fijación y posterior metamorfosis que, según Helm et al. (2006), es una etapa crítica en el desarrollo de las larvas, la que puede generar altas mortalidades y durante la cual se producen grandes cambios anatómicos. Según estos mismos autores y Velasco (2008), el éxito de la transformación hacia la forma juvenil y la supervivencia en esta etapa dependen de una serie de factores, entre ellos la acumulación de suficientes reservas energéticas durante la fase larvaria. Teniendo en cuenta lo anterior, es apropiado pensar que la aparición de la mancha ocular (una a cada lado de la larva, entre la glándula digestiva y las valvas) se presente mayormente con ISO+CHA e ISO+CHA+TETRA, pues éstas han demostrado ser dietas altamente nutritivas, que mejoran la supervivencia, el crecimiento y el estado de condición de las larvas.
En lo concerniente a las demás dietas, es posible que la falencia, escasez o desequilibrio nutricional que presentaron impidieran la acumulación de cantidades adecuadas de energía, retrasando o impidiendo la formación de la mancha ocular y por ende el proceso de fijación y posterior metamorfosis (Farías-Molina, 2001; Velasco, 2008; Velasco y Barros, 2008). Con respecto a esto, Soudant et al. (1995) señalan que la composición de ácidos grasos puede llegar a modificarse por dietas microalgales monoespecíficas bajas en DHA o EPA, lo cual conduce a perturbaciones en la metamorfosis y crecimiento durante el desarrollo larvario en Pecten maximus. Así, Soudant et al. (1998) afirman que, aunque C. calcitrans provoca buenas tasas de crecimiento, no soporta la metamorfosis; también Velasco (1997), realizando el cultivo larvario de Nodipecten subnodosus, encontró que las larvas alimentadas con una mezcla de I. galbana (T-Iso) y C. calcitrans o con T-Iso eran capaces de completar su desarrollo hasta metamorfosis, mientras que no lo logró alimentando solo con C. calcitrans.
Estado de condición
La mayor parte del tiempo, la tendencia de las larvas fue a mantenerse en el estado de condición llenas en todos los tratamientos, lo cual indica que éstas realizaron la ingestión de la dieta independientemente de las microalgas que la conformaran, lo cual concuerda con los datos obtenidos por Lora-Vilchis y Maeda-Martínez (1997), quienes registraron que al menos el 70 % de las larvas de A. ventricosus circularis presentaron ingestión microalgal al probar 10 especies de microalgas. Sin embargo, los resultados también indican que en aquellos tratamientos en los que se utilizó I. galbana se presentó un significativo aumento en el porcentaje de larvas llenas, a la vez que se redujeron los porcentajes de larvas semillenas y vacías. Esto confirma, una vez más, la alta calidad de esta especie microalgal gracias al alto valor nutricional y a sus características biológicas que la hace más digerible (cuerpo desnudo, móvil, de tamaño pequeño, forma ovoide), lo cual la acredita como una de las más apropiadas para la alimentación de los pectínidos en su fases larvaria, juvenil y/o adulta (Velasco, 2008), sobre todo cuando se utiliza con la microalga C. calcitrans cuya mezcla, como se evidencia en estos resultados, crea una sinergia que produce resultados sobresalientes. La razón por la cual las dietas que integraron en su composición a I. galbana presentaron mayor cantidad de larvas llenas, podría deberse a la digestibilidad de esta microalga, pues, según Bayne (2008), en el interior del tracto digestivo de las larvas de los bivalvos las partículas de alimento que son más digeribles tardan más tiempo dentro del mismo (10-11 h) y las menos digeribles son expulsadas más rápidamente.
Por otra parte, el hecho que en todos los tratamientos se hubiese presentado una reducción en los porcentajes de larvas llenas entre los días 8 y 11, se debe posiblemente a que durante esos días las larvas desarrollan el umbo y posteriormente se da la secreción de la prodisoconcha II, la glándula de la concha se transforma en el manto, el cual originará la cavidad paleal, y se forma el músculo aductor posterior (Velasco, 2008); todo esto podría causar cierto grado de estrés en el proceso de alimentación e implicar un mayor gasto de energía, debido a la segregación de una concha más gruesa, lo que genera, en consecuencia, un peso adicional y por lo tanto un esfuerzo mayor para mantenerse nadando en la columna de agua (Cragg y Crisp, 1991). Teniendo en cuenta que dicha disminución en el porcentaje de larvas llenas se produjo levemente con las dietas ISO+CHA e ISO+CHA+TETRA, se podría suponer que, gracias a la cantidad de nutrientes y la equilibrada relación entre ellos, estas ayudarían a soportar más eficazmente dicho proceso; lo contrario ocurrió con las dietas ISO, CHA, ISO+TETRA y CHA+TETRA, en donde este descenso fue más evidente y se presentó mayor retraso y menor homogeneidad en la formación de la larva umbonada, lo que indica que estas últimas dietas no satisfacen enteramente los requerimientos nutricionales para ayudar a las larvas a llevar a cabo este paso.
En conclusión, la dieta mixta I. galbana + C. calcitrans fue la más apropiada para alimentar las larvas de A. nucleus, gracias a que suple de manera equilibrada las necesidades de ácidos grasos DHA, EPA y AA, esenciales para su correcto desarrollo. A pesar que se encontraron resultados similares con esta dieta e I. galbana + C. calcitrans + T. suecica, el aporte de T. suecica no genera un beneficio significativo y, por el contrario, incrementaría los costos en la producción de alimento vivo en laboratorio. Por su parte, el pobre desarrollo larvario obtenido alimentando con las monodietas I. galbana y C. calcitrans confirma la deficiencia nutricional que se genera utilizando estas microalgas por separado, lo mismo ocurre al mezclar esta última con T. suecica, dado que ambas especies poseen valores nutricionales semejantes, por lo que no hay complementariedad de nutrientes entre ellas.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos al Departamento Administrativo de Ciencia Tecnología e Innovación-COLCIENCIAS, por la financiación de este estudio, que hizo parte del trabajo de grado de la primera autora, y que estuvo enmarcado en el proyecto "Optimización de la producción de postlarvas del ostión Nodipecten nodosus y la conchuela Argopecten nucleus en el Caribe colombiano", código 2105-09-17982. De igual manera, al Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" -INVEMAR, por el apoyo prestado a lo largo de esta investigación. También a María Fernanda Virgüez y Edgard Arias, propietarios de Hidrocultivos de la Costa Ltda, a Fabián Cortes y Adolfo Sanjuán.
BIBLIOGRAFÍA
1 Barbosa, W. A. 2005. Efecto de la calidad de la dieta sobre la fisiología energética de los bivalvos Argopecten nucleus y Nodipecten nodosus en condiciones de laboratorio. Tesis Biología, Univ. del Magdalena, Santa Marta. 59 p. [ Links ]
2 Bayne, B. L. 2008. Physiological ecology of marine molluscan larvae. 299-343. En: Verdonk, N. H. van den, J. A. M. Biggelaar y A. Tompa (Eds.). The Mollusca, Vol III. Development. Academic Press, Nueva York. 258 p. [ Links ]
3 Brown, M. R., S. W. Jeffrey, J. K. Volkman y G. A. Dunstan. 1997. Nutritional properties of microalgae for mariculture. Aquaculture, 151: 315-331. [ Links ]
4 Castellanos, C. y N. Campos. 2007. Variación espacial y temporal de juveniles de Pinctada imbricata (Röding, 1798) y Argopecten nucleus (Born, 1778) en la región norte del Caribe colombiano. Bol. Inv. Mar Cost., 36: 209-22. [ Links ]
5 Cochard, J. C. y N. Devauchelle. 1993. Spawning, fecundity and larval survival and growth in relation to controlled conditioning in native and transplanted populations of Pecten maximus (L): evidence for the existence of separate stocks. J Exp. Mar. Biol. Ecol., 169: 41-56. [ Links ]
6 Cragg, S. M. y D. J. Crisp. 1991. The biology of scallop larvae. 75-132. En: Shumway, S. E. (Ed.). Scallops: biology, ecology and aquaculture. Elsevier Science, Ámsterdam. 1096 p. [ Links ]
7 Delaunay, F., Y. Marty, J. Moal y J. F. Samain. 1993. The effect of monoespecific algal diets on growth and fatty acid composition of Pecten maximus (L.) larvae. J. Exp. Mar. Biol. Ecol., 173: 163-179. [ Links ]
8 Díaz, J. M. y M. Puyana. 1994. Moluscos del Caribe colombiano. Un catálogo ilustrado. Colciencias, Fundación Natura e INVEMAR. Editorial Presencia, Bogotá. 291 p. [ Links ]
9 Farías, A. e I. Uriarte. 2006. Nutrition in pectinids. 521-542. En: Shumway, S. E. y G. J. Parsons (Eds.). Scallops: biology, ecology and aquaculture. Segunda edición, Elsevier B. V., Ámsterdam. 1460 p. [ Links ]
10 Farías-Molina, A. 2001. Nutrición en moluscos pectínidos. 89-104. En: Maeda-Martínez, A. N. (Ed.). Los moluscos pectínidos de Iberoamérica: ciencia y acuicultura. McGraw-Hill Interamericana Editores, S. A. México D.F. 201 p. [ Links ]
11 Helm, M. M., N. Bourne y A. Lovatelli. 2006. Cultivo de bivalvos en criadero. Un manual práctico. Doc. Téc. Pesca FAO, 471, Roma. 182 p. [ Links ]
12 Lora-Vilchis, M. C. y A. N. Maeda-Martínez. 1997. Ingestion and digestion index of catarina scallop Argopecten ventricosus-circularis, Sowerby, 1842, veliger larvae with ten microalgae species. Aquacult. Res., 28: 905-910. [ Links ]
13 Manahan, D. T. y D. J. Crisp. 1982. The role of dissolved organic material in the nutrition of pelagic larvae: amino acid uptake by bivalve veligers. Amer. Zool., 22: 635-646. [ Links ]
14 Martínez, G. 1991. Estudios nutricionales en larvas de ostión Argopecten purpuratus. Informe técnico, Fondo Desarrollo Productivo, Corporación de Fomento de la Producción-CORFO, Coquimbo, Chile. 40 p. [ Links ]
15 Marty, Y., Y. F. Delauna, J. Moal y F. J. Samain. 1992. Changes in the fatty acid composition of the scallop Pecten maximus (L.) during larval development. J. Exp. Mar. Biol. Ecol., 163: 221-234. [ Links ]
16 Millán-Tovar, M. M. 2008. Experimentos de inducción a la maduración gonádica de Argopecten ventricosus (Sowerby, 1842) y estudio del valor nutricional de Isochrysis galbana y Chaetoceros gracilis, durante su crianza larvaria. 115. En: Velasco, L. A. (Ed.). Biología y cultivo de los pectínidos de interés comercial de Colombia. Editorial Universidad del Magdalena, Santa Marta. 258 p. [ Links ]
17 Narvarte, M. A. y M. S. Pascual. 2001. Diet trial on tehuelche scallop Aequipecten tehuelchus (d'Orb) larvae. Aquacult. Internat., 9:127-131. [ Links ]
18 Novoa, S. 2007. Metabolismo lipídico, ácidos grasos en el cultivo larvario de almeja babosa, Venerupis pullastra (Montagu, 1803). Calidad ovocitaria, larvaria y nutricional con una aproximación al uso de la microencapsulación lipídica. Trabajo de Doctorado en Biología, Univ. Santiago de Compostela, Santiago de Compostela, España. 244 p. [ Links ]
19 Sastry, A. N. 1963. Reproduction of the bay scallop, Aequipecten irradians Lamarck. Influence of temperature on maturation and spawning. Biol. Bull., 125: 146-153. [ Links ]
20 Soudant, P., Y. Marty, J. Moal y J. F. Samain. 1995. Fatty acids composition of major polar lipids in gonads of Pecten maximus. 125. En: Aquaculture Development Centre, University College Cork (Ed.). Book of abstracts: 10th International Pectinid Workshop. University College Cork, Cork, Irlanda. 155 p. [ Links ]
21 Soudant, P., J. R. LeCoz, Y. Marty, J. Moal, R. Robert y J. F. Samain. 1998. Incorporation of microalgae sterols by scallop Pecten maximus (L.) larvae. Comp. Biochem. Physiol., 119A (2): 451-457. [ Links ]
22 Urban, H. J. 1999. Cultivo de bivalvos en el Caribe colombiano. Diagnóstico y evaluación de la factibilidad biológica, técnica y económica del cultivo experimental de bivalvos de interés comercial en el Caribe colombiano. Informe técnico final, Instituto de Investigaciones Marinas y Costeras-INVEMAR, Santa Marta. 212 p. [ Links ]
23 Uriarte, I. y A. Farías. 1999. The effect of dietary protein content on growth and biochemical composition of Chilean scallop Argopecten purpuratus (L) postlarvae and spat. Aquaculture, 180: 119-127. [ Links ]
24 Uriarte, I., G. Rupp y A. Abarca. 2001. Producción de juveniles de pectínidos iberoamericanos bajo condiciones controladas. 147-171. En: Maeda-Martínez, A. N. (Ed.). 2001. Los moluscos pectínidos de Iberoamérica: ciencia y acuicultura. McGraw-Hill Interamericana Editores, S. A. México D.F. 501 p. [ Links ]
25 Valero, A. P., S. Sánchez, S. García, C. Córdoba, A. J. De La Roche, J. P. Gómez, J. Castellanos, C. Torres, C. Rueda, M. E. Hernández, R. Bautista, J. P. Assmus e Y. Caballero. 2000. Cultivo de bivalvos marinos del Caribe colombiano. Col. Cienc. Tecnol., 18 (13): 10-16. [ Links ]
26 Velasco, G. 1997. Cultivo larvario a nivel piloto del callo de hacha Atrina maura Sowerby y de la almeja mano de león Nodipecten subnodosus Sowerby, con dos especies de microalgas. Tesis de Maestría en Ciencias, Centro de Investigación Científica y Educación Superior de Ensenada, Baja California, México. 59 p. [ Links ]
27 Velasco, L. A. 2008. Biología y cultivo de los pectínidos de interés comercial de Colombia. Editorial Unimagdalena, Santa Marta. 258 p. [ Links ]
28 Velasco, L. A. y J. Barros. 2008. Experimental larval culture of the Caribbean scallops Argopecten nucleus and Nodipecten nodosus. Aquaculture Res., 39: 603-618. [ Links ]
29 Velasco, L. A., J. Barros y E. Acosta. 2007. Spawning induction and early development of the Caribbean scallops Argopecten nucleus and Nodipecten nodosus. Aquaculture, 272: 767-773. [ Links ]
30 Walne, P. R. 1970. Present problems in the culture of the larvae of Ostrea edulis. Helgoländer wiss. Meeresunters., 20: 514-525. [ Links ]
31 Webb, K. I. y F. E. Chu 1982. Phytoplankton as a food source for bivalve larvae. 272-290. En: Pruder, G.D., C. Langdon y D. Conklin (Eds.). Proceedings of the second international conference on aquaculture nutrition; biochemical and physiological approaches to shellfish nutrition. Louisiana State University, Baton Rouge, Estados Unidos. 444 p. [ Links ]
32 Winkler, F. M. y B. F. Estévez, 2003. Effects of self-fertilization on growth and survival of larvae and juveniles of the scallop Argopecten purpuratus L. J. Exp. Mar. Biol. Ecol., 292: 93-102. [ Links ]
FECHA DE RECEPCIÓN: 28/05/2010 FECHA DE ACEPTACIÓN: 03/03/2012
*Contribución No. 1103 del Instituto de Investigaciones Marinas y Costeras-INVEMAR.