Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.41 no.1 Santa Marta Jan./June 2012
CONOCIMIENTO DE LA FAUNA DE CLADOCERA (CRUSTACEA: BRANCHIOPODA) DE LA CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIA
CONTRIBUTION TO THE KNOWLEDGE OF THE CLADOCERA FAUNA (CRUSTACEA: BRANCHIOPODA) IN THE CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIA
Juan M. Fuentes-Reines1, Evelyn Zoppi de Roa2, Eliana Morón1, Dáninso Gámez1 y Carlos López3
1 Universidad del Magdalena, Grupo de investigación en Limnología, Santa Marta, Colombia. AA 731. juanmanuelfuentesreines@yahoo.com (JFR); daninso@gmail.com (DGB); elianamariamorongranados@gmail.com (EMG).
2 Universidad Central de Venezuela, Instituto de Zoología y Ecología Tropical, Facultad de Ciencias, Laboratorio de Plancton. Caracas 1041. AA 47058, Venezuela. evelyn.zoppi@ciens.ucv.ve.
3 Universidad del Zulia, Facultad Experimental de Ciencias, Departamento de Biología, Laboratorio de Zooplancton, Maracaibo, Venezuela. AA 526. clopez@luz.edu.ve.
RESUMEN
Se analizaron 108 muestras recolectadas entre marzo y noviembre de 2009 provenientes de macrófitas y aguas abiertas de la costa oriental de la Ciénaga Grande de Santa Marta, adyacente a la desembocadura del río Sevilla, departamento del Magdalena. El mayor número de especies se registró en la zona de macrófitas. Este es el primer registro acerca de la existencia de cladóceros en esta región. Se encontró un total de 36 especies, de las cuales, ocho (Guernella raphaelis, Ilyocryptus plumosus, Moina eugeniae, Kurzia polyspina, K. media, Oxyruella longicaudis y O. tenuicaudis) son nuevos registros para Colombia. Además se hace una breve descripción de todas las especies y su distribución geográfica.
PALABRAS CLAVE: Cladóceros, Composición taxonómica, Ciénaga Grande de Santa Marta.
ABSTRACT
108 samples collected between March, and November 2009 from macrophytes and open waters of the east coast of Ciénaga Grande de Santa Marta, adjacent to Sevilla river, Magdalena Department were analyzed. A greater number of individuals and species were found in macrophytes rather than in open water. This is the first report on the Cladocera from this region. In total 36 species were recorded; eight of them are new records to Colombian fauna (Guernella raphaelis, Ilyocryptus plumosus, Moina eugeniae, Kurzia polyspina, K. media, Oxyruella longicaudis and O. tenuicaudis). A brief description of all species and their geographical distribution is included.
KEY WORDS: Cladocerans, Taxonomic composition, Ciénaga Grande de Santa Marta.
INTRODUCCIÓN
Los cladóceros son crustáceos de tamaño pequeño que han evolucionado principalmente en agua dulce, aunque algunos han invadido ambientes marinos de manera secundaria (Elías-Gutiérrez et al., 2008). Estos microcrustáceos conforman un grupo monofilético y son un importante componente de la comunidad zooplanctónica de los sistemas acuáticos epicontinentales. Se conocen aproximadamente 620 especies y se considera que alrededor de 200 se encuentran en la región Neotropical (Forró et al., 2008). Estos organismos se encuentran en todos los sistemas continentales, desde latitudes tropicales hasta las regiones boreales.
En Colombia los estudios de cladóceros son incipientes, con trabajos esporádicos, entre los que se destacan Stingelin (1913), Pearse (1915), Andrade (2001), Jaramillo y Gaviria (2003), Monroy et al. (2004), Barón-Rodríguez et al. (2006), Barón-Rodríguez y Díaz (2007), Gallo et al. (2009), Guevara et al. (2009), Álvarez (2010), Aranguren et al. (2010), Jaramillo y Pinto (2010) y Rivera et al. (2010). Sin embargo, el conocimiento de la ocurrencia y distribución geográfica en Colombia de estos organismos es incompleto. Este estudio da a conocer la composición de especies de cladóceros de la zona oriental de la Ciénaga Grande de Santa Marta, y contribuye al incremento en la información de las especies y su distribución en Colombia.
MATERIALES Y MÉTODOS
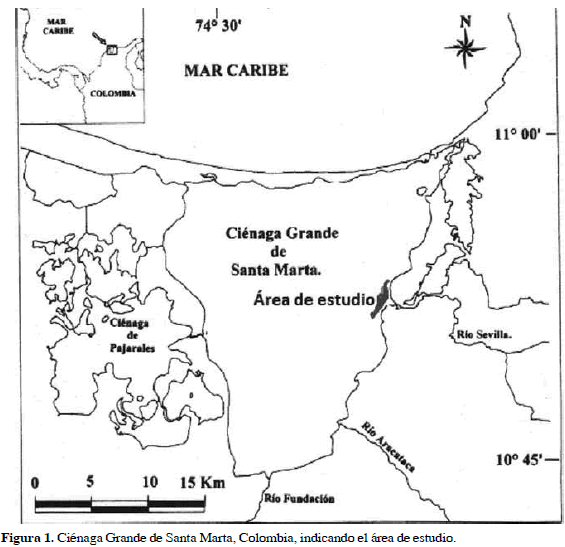
Las muestras se tomaron en la zona litoral con vegetación flotante y sumergida (macrófitas) y la región limnética de la costa oriental de la Ciénaga Grande de Santa Marta, adyacente a la desembocadura del río Sevilla, departamento del Magdalena, Colombia (10º52'11.25" N y 74º19'31.64" W), entre los meses de marzo a noviembre de 2009 (Figura 1). Se filtró un total de 20 L con una red de zooplancton de 45 µm de la columna de agua procedente de la zona litoral con vegetación y de la zona limnética. Las muestras se fijaron con formalina al 4 %, con adición previa de dióxido de carbono proveniente de agua de soda como narcótico. Los especímenes fueron medidos en posición lateral, desde la cabeza hasta la parte posterior de las valvas. Las especies se identificaron con las claves de Elmoor-Loureiro (1997) y Elías-Gutiérrez et al. (2008). Las muestras originales de este trabajo fueron depositadas en la sección de invertebrados acuáticos del Museo de Biología de la Universidad del Zulia a cargo del Doctor Carlos López. Los ejemplares de las especies fueron depositados en la colección de artrópodos del Museo de Colecciones Biológicas de la Universidad del Atlántico (UARC) y en el Museo de Biología de la Universidad Central de Venezuela (MBUCV-XI-5506). La totalidad de especímenes de Simocephalus latirostris, Ilyocriptus plumosus, Moina eugeniae, M. micrura y M. minuta fueron empleados para la disección e identificación por lo cual no fueron preservados en colecciones biológicas.
RESULTADOS
En total se identificaron 36 especies distribuidas en seis familias y 25 géneros. La familia Chydoridae presentó el mayor número de géneros (12), seguida por Sididae (cuatro), Macrothricidae (cuatro), Moinidae (dos), Daphnidae (dos) e Ilyocryptidae (uno), siendo Moina el género con el número mayor de especies (cinco). Chydoridae representó el 50.0 % (18) de todas las especies registradas, seguida por Moinidae 13.9 % (cinco), Macrothricidae 13.9 % (cinco), Sididae 11.1 %, (cuatro), Ilyocriptidae 5.6 % (dos) y Daphnidae 5.6 % (dos). La mayoría de las especies se encuentran en la zona de macrófitas y son neotropicales, sólo cuatro son relativamente holárticas.
El total de cladóceros registrados en la Ciénaga Grande de Santa Marta representa 44.4 % de las 81 especies descritas para los órdenes Ctenopoda y Anomopoda en Colombia (Gaviria et al., 2010). En la Tabla 1 se muestra la presencia de las especies en ambas zonas [limnética y litoral con macrófitas (flotantes y sumergidas)], así como su distribución en categorías geográficas y los nuevos registros para el país.
Familia Sididae
Grupo Australis Korovchinsky, 1992
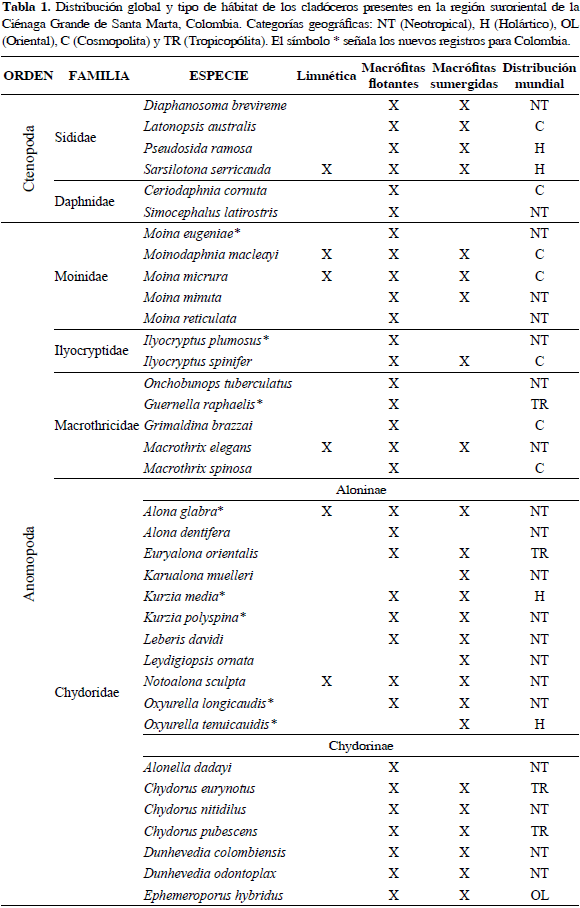
Latonopsis australis Sars, 1888
Sinónimos: L. occidentalis Birge 1892; L. breviremis Daday 1905. Número de catálogo: UARC58M.
Cuerpo ovoide, margen ventral de las valvas con setas largas y plumosas, postabdomen corto y con espinas anales solitarias, garra del postabdomen con dos espinas (Figura 2). Longitud del cuerpo 0.70 mm y de la garra 0.04 mm.
Distribución: Según Korovchinsky (1992), fue considerada como un grupo de especies, ya que la identidad del género Latonopsis no ha sido definida. Se conoce de la región tropical (Australia, Asia, África, América), pero también se ha encontrado en regiones templadas como el norte de Italia, Yugoslavia y en el estado de Wisconsin de Estados Unidos, por lo que puede ser considerada cosmopolita (FADA, 2010). En Colombia esta especie se ha registrado en el departamento de Córdoba (Álvarez, 2010).
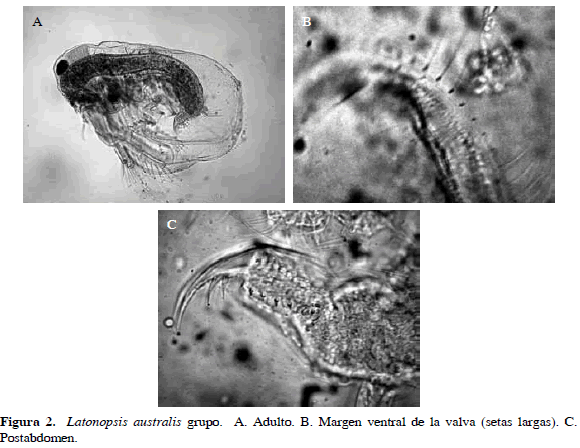
Pseudosida ramosa (Daday, 1904)
Sinónimos: Parasida ramosa Daday, 1904; Pseudosida ramosa Korovchinsky, 1992. Número de catálogo: UARC60M.
Organismos generalmente grandes, superiores a 1 mm. Presentan el margen posterior de las valvas con setas cortas, algunas de ellas plumosas. Su característica principal es presentar anténulas largas con las papilas sensoriales insertas en una proyección lateral. Postabdomen con dos espinas en la parte distal y al inicio de la garra con dos espinas (Figura 3). Longitud del cuerpo 1.05 mm y de la garra 0.09 mm.
Distribución: Según FADA (2010), se encuentra en la región Neártica y había sido mencionada para la región Neotropical (Korovchinsky, 1992). En Colombia esta especie se ha registrado en el departamento de Córdoba (Álvarez, 2010).
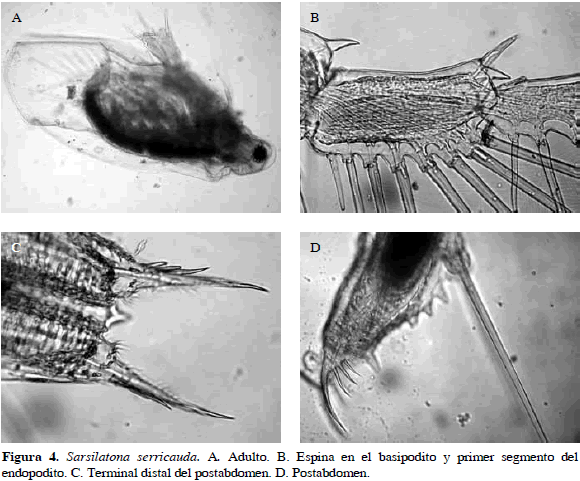
Sarsilatona serricauda (Sars, 1901)
Sinónimos: Laptonosis fasciculata Daday, 1905; Birge, 1910; Sarsilatona serricauda, Korovchinsky, 1985. Número de catálogo: UARC57M.
Cuerpo ovalado, con una espina delgada, curvada y puntiaguda sobre el lado dorsal final del basipodito de la antena, dos espinas en el primer segmento del endopodito de la antena, una espina (la externa) más grande que la otra. Garra terminal del postabdomen con tres espinas largas (Figura 4). Longitud del cuerpo 1.26 mm y de la garra 0.17 mm.
Distribución: Según Korovchinsky (1992), es una especie neártica (sur de Estados Unidos), también ha sido encontrada en el Neotrópico. En Colombia se ha registrado en los departamentos de Santander, Córdoba y Magdalena (Barón- Rodríguez et al., 2006; Álvarez, 2010; Gaviria et al., 2010).
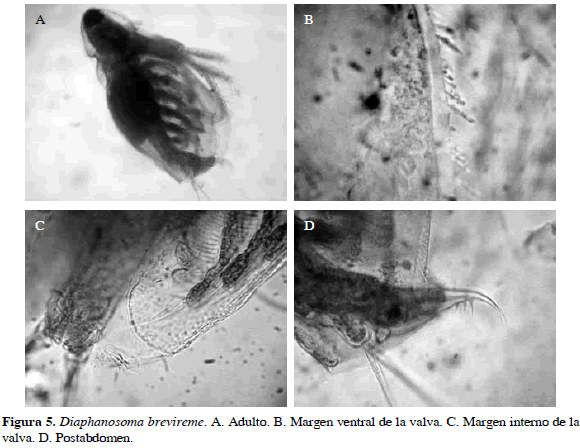
Diaphanosoma brevireme Sars, 1901
Sinónimos: D. neotropicum Brehm y Thomsen, 1936; D. sarsi Van de Velde et al., 1978. Número de catálogo: UARC59M.
Margen ventral de la valva con seis grupos de espículas delgadas creciendo distalmente; anténula aplanada. Postabdomen con tres espinas en la garra, la interior más pequeña (Figura 5). Longitud del cuerpo 0.63 mm y de la garra 0.07 mm.
Distribución: Según Korovchinsky (1992), se considera una especie de la región del Neotrópico (Brasil, Paraguay, Venezuela, Colombia, norte de Argentina, Guatemala, Nicaragua y Cuba). En Colombia esta especie se ha registrado en los departamentos de Amazonas, Santander, Córdoba y Magdalena (Barón-Rodríguez et al., 2006; Álvarez, 2010; Aranguren, 2010).
Familia Daphnidae
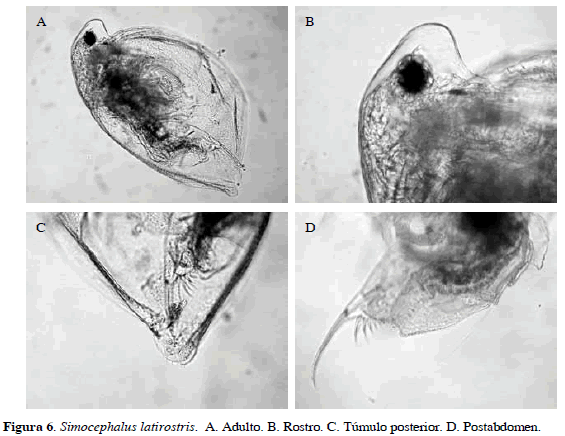
Simocephalus latirostris Stingelin, 1906
Cuerpo en forma oval; rostro muy pronunciado y ojo muy grande; anténulas largas y abultadas en la base y un poco estrechas en la parte distal en la cual presentan setas sensoriales; túmulo posterior de la valva puntiagudo, postabdomen con siete dientes anales sobre cada lado (cinco visibles y dos poco visibles), primer diente distal del postabdomen con una longitud de 5.25 µm, el segundo diente 4.9 µm, el tercer diente 3.15 µm, el cuarto diente 1.75 µm, el quinto 1.05 µm, y el sexto y séptimo dientes menores de 1.05 µm (Figura 6). Longitud del cuerpo 1.13 mm y de la garra 0.19 mm.
Distribución: Según Elmoor-Lourerio (1998) y Orlova-Bienkowskaja (2001), es una especie neotropical, ha sido encontrada en Australia, sur y este de Asia, archipiélago malayo y África. En Colombia se ha registrado en los departamentos de Santander y Córdoba (Barón-Rodríguez et al., 2006; Álvarez, 2010).
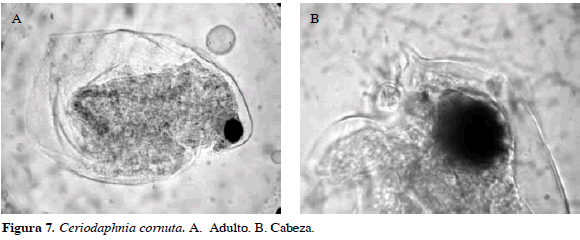
Ceriodaphnia cornuta Sars, 1885
Sinónimos: C. cornigera Jiang Xiezhi, 1977; C. cornuta, Montú y Gloeden, 1986; Elmoor-Loureiro, 1998. Número de catálogo: UARC56M.
Presencia de una proyección cefálica y de un rostro, anténula corta con setas sensoriales; fórmula de setas de la antena 0-0-1-3/1-1-3 (Figura 7). Longitud del cuerpo 0.29 mm. Además de esta especie, Richard (1894) describió otra con el nombre de C. rigaudi. Según Berner (1985), ambas especies tenían en común la proyección del rostro, mientras que C. cornuta sólo presenta estructuras espinosas como un proceso cefálico, espinas en el pliegue del fórnix y una proyección postero-dorsal. Sars (1901) argumentó que las dos especies (C. cornuta y C. rigaudi) poseían formas variables. La incertidumbre taxonómica de esta especie ha contribuido a que algunos investigadores sustituyan a C. rigaudi por C. cornuta (Rzóska, 1956), otros solo hacen referencia a Ceriodaphnia cornuta cornuta o Ceriodaphnia cornuta tipica como el morfotipo identificado por Sars y Ceriodaphnia cornuta rigaudi como el identificado por Richard (1897). Recientemente Elías-Gutiérrez et al. (2001) y Sampaio et al. (2002) han adoptado el criterio de Berner (1985), al denominar "complejo" Ceriodaphnia cornuta cuando las especies C. cornuta, C. rigaudi y C. cf. cornuta se presentan simultáneamente en el ambiente. Todo lo anterior conlleva a considerar actualmente a C. cornuta como un complejo de especies el cual necesita un estudio más detallado.
Distribución: Según Fernando (1980), es una especie tropicopólita. En Colombia esta especie se ha registrado en los departamentos de Atlántico, Huila, Córdoba, Chocó y Santander (Camargo, 1994; Herrera-Martínez y Guillot, 1999; Barón-Rodríguez et al., 2006; Álvarez, 2010; Aranguren, 2010).
Familia Macrothricidae
Guernella raphaelis Richard 1892
Número de catálogo: UARC52M.
Su cuerpo es redondo, la fórmula de la seta de la antena es 0-1-1-3/1-1-3. La anténula es amplia en la parte distal y presenta pelos laterales (Figura 8). La longitud del cuerpo es de 0.12 mm.
Distribución: Esta especie es considerada tropicopólita (Thomas, 1961; Smirnov, 1992). En Sudamérica ha sido registrada en Argentina (Paggi, 1976); Venezuela (Zoppi de Roa y Vázquez, 1991), Brasil (Hollwedel et al., 2003; Serafim et al., 2003). Esta especie no se ha registrado en Colombia previamente, razón por la cual se propone como adición al inventario de cladóceros actual (Gaviria et al., 2010).
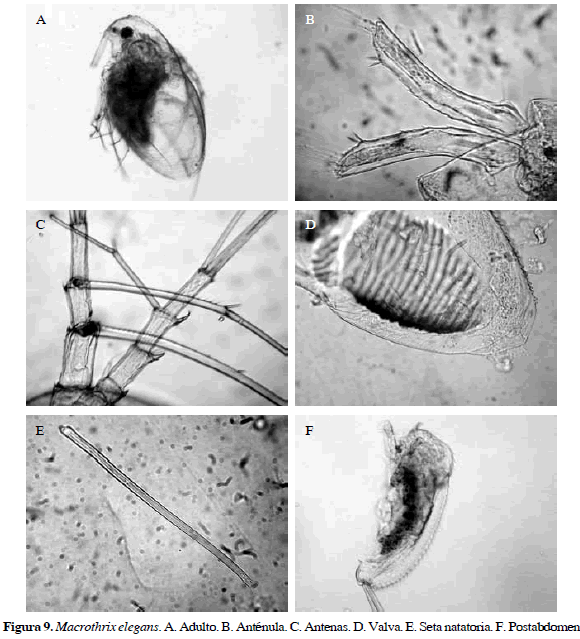
Macrothrix elegans Sars, 1901
Número de catálogo: UARC49M.
Anténula larga con forma tubular con espinas en la parte distal, en el segundo segmento de la rama tetrasegmentada de la antena presenta dos espinas, una más grande que la otra. Postabdomen bilobulado con dentículos preanales robustos. Algunas características que la diferencian de Macrothirx superaculeata es la carencia de sétulas en el segmento proximal de la seta natatoria, valvas con estrías verticales y ángulo posterior dorsal ligeramente agudo (Figura 9). Longitud del cuerpo de 0.54 mm.
Distribución: Según Kotov y Hollwedel (2004), Elías-Gutiérrez et al. (2008) y Van Damme y Dumont (2010) es una de las especies más comunes en el Neotrópico. En Colombia esta especie se ha registrado previamente en el departamento de Córdoba (Álvarez, 2010).
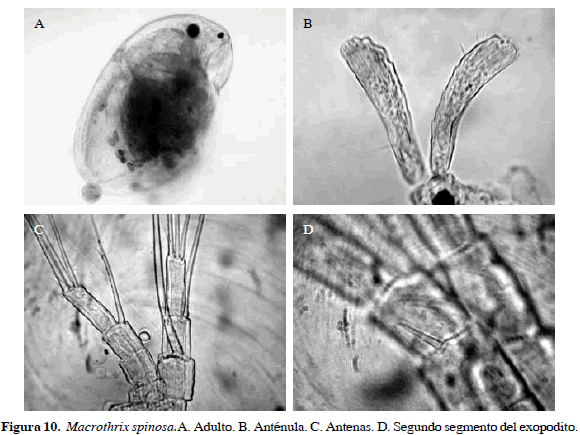
Macrothrix spinosa King, 1853
Sinónimos: M. goeldi Richard, 1897; M. squamosa Sars, 1901; M. affinis Brady, 1904. Número de catálogo: UARC51M.
Una característica conspicua es presencia de sierras en la parte dorsal del cuerpo. Además, anténula dilatada en la parte distal con pequeñas sétulas, fórmula de setas de las antenas 0-0-1-3/1-1-3, segundo segmento del exopodito con una espina. Postabdomen con numerosas espínulas pequeñas en la región preanal, seta natatoria con un segmento distal muy corto con setas largas (Figura 10). Longitud del cuerpo 0.44 mm y de la garra 0.01 mm.
Distribución: Según Smirnov (1992), esta especie es tropicopólita. En Colombia se ha registrado en el departamento de Córdoba (Álvarez, 2010).
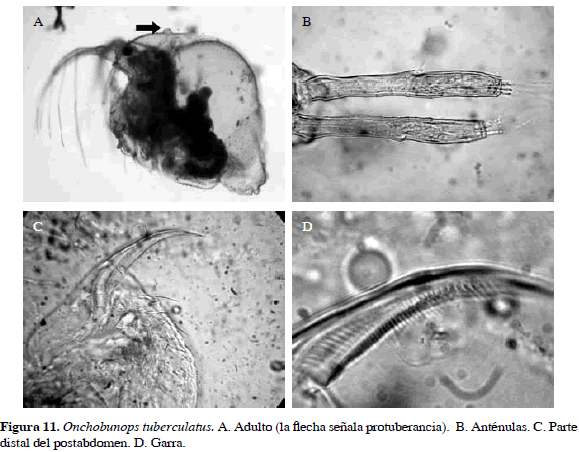
Onchobunops tuberculatus Fryer y Paggi, 1972
Sinónimos: Bunops scutifrons Smirnov, 1988; Bunops tuberculatus Silva-Briano y Dumont, 2001; O. tuberculatus Elías-Gutiérrez et al. 2001; Hollwedel et al. 2003. Número de catálogo: UARC50M.
Esta especie se caracteriza por la presencia de una protuberancia en la parte dorsal de la cabeza. La anténula es tubular y presenta una seta casi en la mitad de esta, el postabdomen presenta espinas en la parte distal. La garra tiene peines finos (Figura 11).
Distribución: Esta especie se distribuye en el Neotrópico. En Colombia se tiene registro para el departamento de Córdoba (Álvarez, 2010).
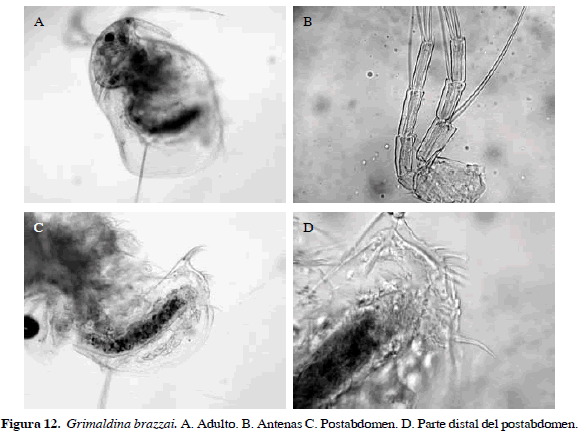
Grimaldina brazzai Richard, 1892
Número de catálogo: UARC48M.
La característica más notoria de esta especie es el postabdomen, bastante ancho y con cinco grupos de espinas en la parte distal en orden creciente a la parte proximal, y una espina larga, garra con peines y sobre la base una espina larga de 9.8 µm. Parte proximal del postabdomen bilobulado muy angosta, con dos líneas de pequeñas espinas anales que le dan aspecto de sierra (Figura 12). Longitud total del cuerpo 0.75 mm y de la garra 46.20 µm.
Distribución: Según Smirnov (1992) y Elmoor-Loureriro (1998), esta especie es tropicopólita. En Colombia se ha registrado en el departamento de Santander (Barón-Rodríguez et al., 2006).
Familia Ilyocryptidae
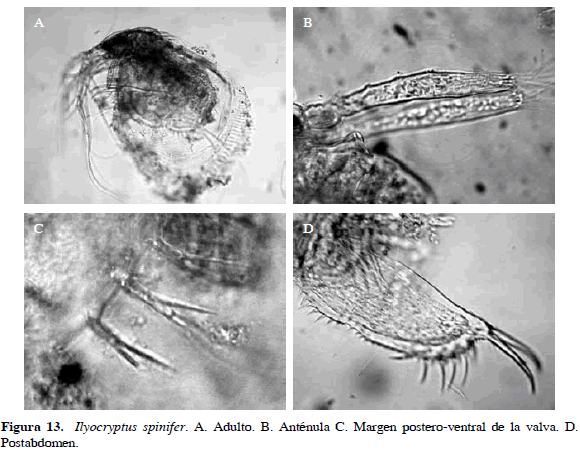
Ilyocryptus spinifer Herrick, 1882
Sinónimos: I. halyi Brady, 1886; I. longiremis Sars 1888; I. verrucosus Daday 1905; I. tetraspinatus Bergamin, 1939. Número de catálogo: UARC55M.
Cuerpo comprimido lateralmente, anténulas largas y tubulares. Sétulas del margen posteroventral de las valvas grandes con una espínula en el borde, muda de las valvas incompleta y con borde espinoso. Primer apéndice torácico sin setas cerca de los ganchos eyectores. Postabdomen bilobulado con cinco a seis espinas muy largas laterales localizadas exclusivamente sobre el margen post anal y de cinco a siete más cortas en la preanal (Figura 13). Longitud del cuerpo 0.60 mm y de la garra 0.01 mm.
Distribución: Se considera una especie cosmopolita (Kotov y Stifter, 2006), se ha encontrado en el trópico y subtrópico de América del Sur y Central (Elmoor-Loureiro, 1998), pero no en la región Paleártica (Kotov y Stifter, 2006). En Colombia se ha registrado en los departamentos de Antioquia, Cundinamarca y Santander (Gaviria, 2001; Barón-Rodríguez et al., 2006).
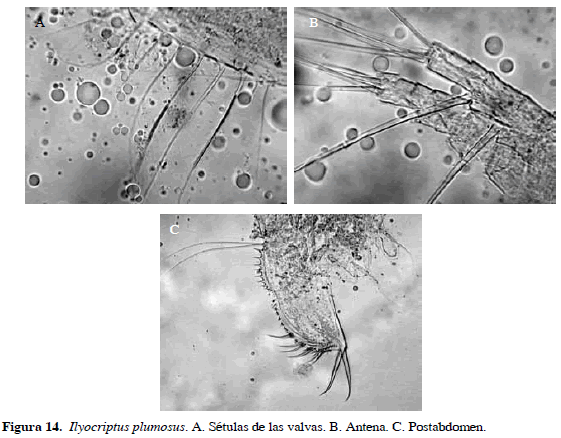
Ilyocryptus plumosus Kotov y Stifter, 2004
Muy similar a I. spinifer; como diferencia más notoria las sétulas de las valvas sin una espina en el margen lateral. Antena con fórmula de seta 0-0-0-3/1-1-3, postabdomen similar a I. spinifer (Figura 14). Longitud total del cuerpo 0.51 mm y de la garra 0.01 mm.
Distribución: Según Kotov y Stifter (2006), esta especie se encuentra en Venezuela, Nicaragua y en la parte norte y central de Suramérica. No se ha registrado en Colombia previamente, razón por la cual se propone como adición al inventario de cladóceros actual (Gaviria et al., 2010).
Familia Moinidae
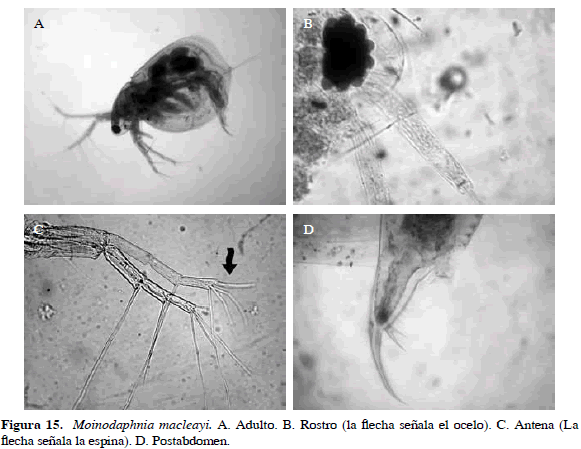
Moinodaphnia macleayi (King, 1853)
Sinónimos: Moina macleayi King, 1853; Moina submucronata Brady, 1886; Moinodaphnia alabamensis Herrick, 1887; M. mocquerysi Richard, 1892; M. macleayi Brehm, 1953. Número de catálogo: UARC54M.
Única especie conocida de Moinodaphnia. Fácil de distinguir por su cuerpo lateralmente aplanado, con un ocelo y cuatro setas en vez de tres sobre el segmento terminal del exopodito de la segunda antena. Postabdomen con ocho a nueve dientes cónicos, terminado en espina bidentada de diferente tamaño, como aparece generalmente en Moina. Uña caudal larga con espina pequeña en parte superior de la base (Figura 15). Longitud del cuerpo es de 0.65 mm y de la garra de 0.01 mm.
Distribución: Es considerada una especie tropicopólita (Elmoor-Loureiro, 1998). En Colombia se ha registrado en los departamentos de Santander, Córdoba, Atlántico y Magdalena (Pearse, 1915; Barón-Rodríguez et al., 2006; Álvarez, 2010; Aranguren, 2010; Gaviria et al., 2010).
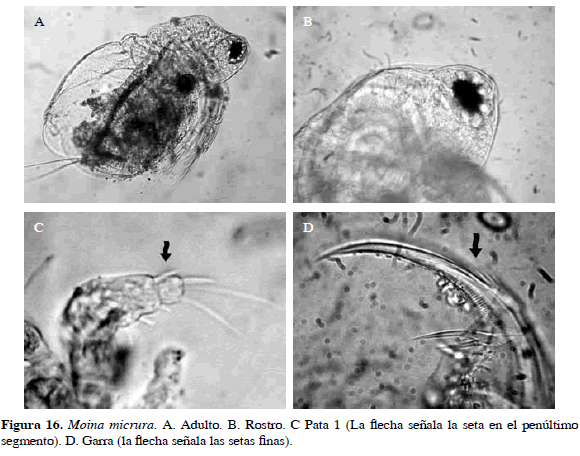
Moina micrura Kurz, 1874
Sinónimos: Moina propinqua Sars, 1885; Moina weberi Richard, 1891; Moina dubia De Guerne y Richard, 1892; Moina paradoxa Stingelin, 1900; Moina ciliata Daday, 1905; Moina makrophthalma Stingelin, 1913; Moina weismanni Tsi Chung y Clement, 1954; Moina micrura Srámek-Husek, Straskraba, and Brtek, 1962; Goulden, 1968.
Postabdomen con espina bidentada desigual. Característica diagnostica es la presencia de seta anterior en el penúltimo segmento del primer par de patas, pelos ausentes en la cabeza y la valva. Uña caudal larga, curvada hacia la parte distal con una serie de setas finas en la parte superior de la base (Figura 16). Una de las especies más frecuentes, se encontró en los tres sitios de muestreo. Longitud del cuerpo 0.37 mm y garra 0.01 mm.
Distribución: Es considerada una especie cosmopolita (Zoppi de Roa y López, 2008). En Colombia se ha registrado en los departamentos de Cundinamarca, Amazonas, Santander, Antioquia, Córdoba, Boyacá, Caldas, Chocó, Tolima, Magdalena y Vichada (Gaviria, 2001; Barón-Rodríguez et al., 2006; Gallo, 2007; Álvarez, 2010; Aranguren, 2010; Gaviria et al., 2010).
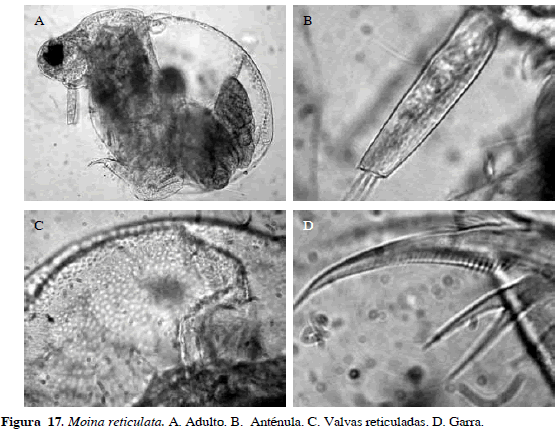
Moina reticulata Daday, 1905
Número de catálogo: UARC53M.
Sin rostro desarrollado, domo supraocular muy proyectado, con ocelo y cabeza deprimida. Superficie del caparazón y cabeza reticuladas, sin pelos. Anténulas frecuentemente dobladas hacia atrás. Ojo compuesto grande, anténula tubular, fórmula de la seta de la antena 0-0-1-3/1-1-3. Postabdomen semejante al de Moinodaphnia, con diente bífido pero del mismo tamaño, con pecten en la garra. Uña caudal larga con diente pequeño en la parte superior basal (Figura 17).
Distribución: Esta especie se encuentra en la región Neotropical con un registro en el continente africano (Elmoor-Loureiro, 1998). En Colombia se ha registrado en los departamentos de Amazonas, Córdoba y Magdalena (Álvarez, 2010; Aranguren, 2010).
Moina minuta Hansen, 1899
Sinónimos: Moinodaphnia brasiliensis Stingelin, 1904; M. minima Spandl, 1926; M. minuta Goulden, 1968.
Sin rostro desarrollado, domo supraocular fuertemente proyectado, con ocelo, ojo compuesto grande, anténula corta con seta sensorial bastante larga. Una característica conspicua es garra con pecten fuerte y en primer apéndice torácico, sin seta anterior en penúltimo segmento. Con cuatro a cinco dientes cónicos en postabdomen. Longitud del cuerpo 0.81 mm y de la garra 0.01 mm.
Distribución: Es considerada una especie cosmopolita (Zoppi de Roa y López, 2008). Según FADA (2010), es Neotropical. En Colombia se ha registrado en los departamentos de Córdoba, Santander, Amazonas y Vichada (Barón-Rodríguez et al., 2006; Gallo, 2007; Álvarez, 2010; Gaviria et al., 2010).
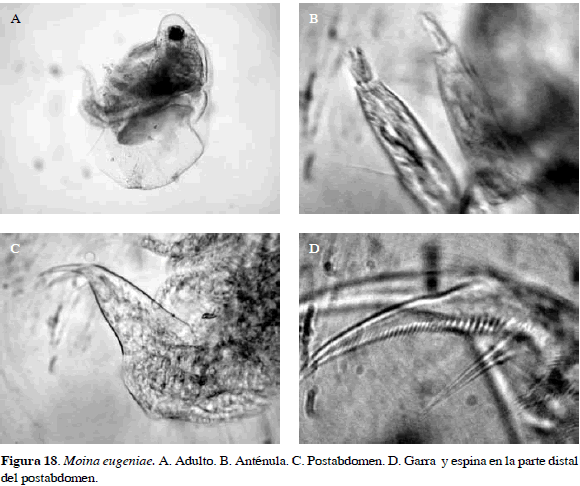
Moina eugeniae Olivier, 1954
Característica más notoria es una depresión supraocular en la cabeza y ausencia de una espina bidentada en parte distal del postabdomen, anténula con una seta sensitiva casi en parte media; postabdomen similar al de Moinodaphnia macleayi (Figura 18). Longitud de la garra 0.04 mm y espina 0.02 mm.
Distribución: Según Goulden (1968), se ha encontrado en Argentina y según FADA (2010) es del Neotrópico. Esta especie no se ha registrado en Colombia razón por la cual se propone como adición al inventario de cladóceros actual (Gaviria et al., 2010).
Familia Chydoridae
Subfamilia Aloninae
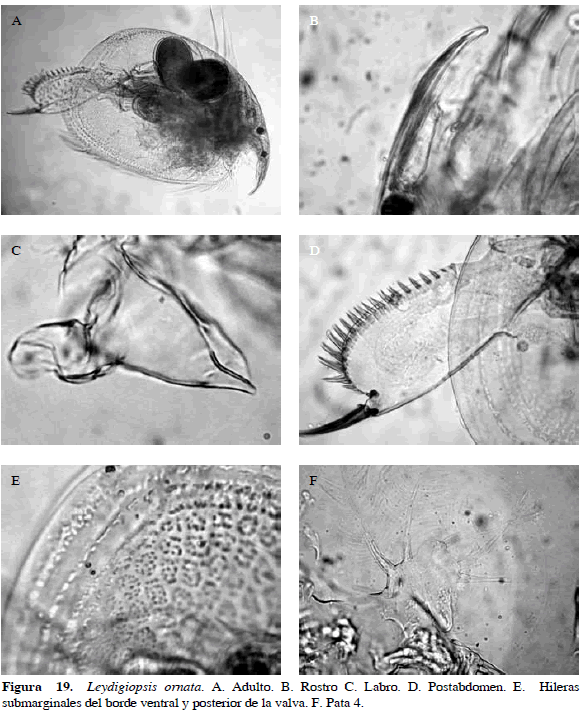
Leydigiopsis ornata Daday, 1905
Número de catálogo: UARC29M.
Cuerpo oval, con tres hileras submarginales de granulaciones en borde ventral y superior de la valva. Rostro largo, labro triangular fuertemente rasgado o carenado hacia la punta; postabdomen tres veces más ancho que largo, redondeado en la parte anterior, con espinas grandes en orden creciente hacia la parte distal. Uña caudal larga y fuerte, posee una espina basal pequeña (Figura 19). Longitud del cuerpo 0.56 mm y garra 0.01 mm.
Distribución: Según Rey y Vásquez (1986), esta especie se encuentra en Paraguay, Argentina, Brasil, México y Venezuela. De acuerdo con Paggi (1993), el género Leydigiopsis es del Neotrópico. En Colombia se ha registrado en los departamentos de Atlántico y Córdoba (Camargo, 1994; Álvarez, 2010).
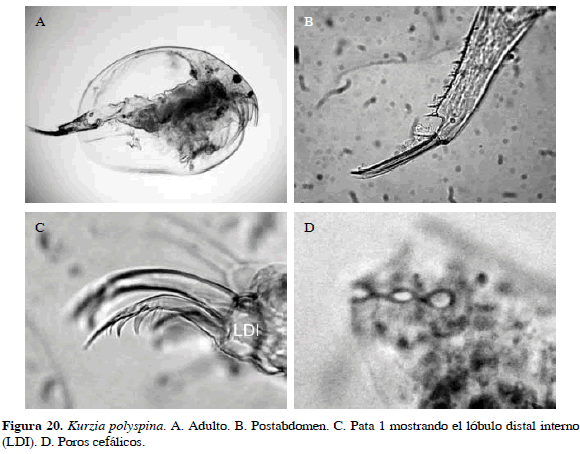
Kurzia polyspina Hudec, 2000
Número de catálogo: UARC28M.
Cuerpo subrectangular, rostro corto y con tres poros interconectados. Una característica conspicua es ausencia de lóbulo en la esquina distal del postabdomen y presencia de una espina sobre él. Además, sierras laterales de las dos setas más largas del lóbulo distal interno (LDI) de la primera pata con espículas y sétulas finas (Figura 20). Longitud del cuerpo 0.49 mm y de la garra 0.01 mm.
Distribución: De acuerdo con Hudec (2000), esta especie se encuentra en la región del Neotrópico. No se ha registrado en Colombia, razón por actual se propone como adición al inventario de cladóceros (Gaviria et al., 2010).
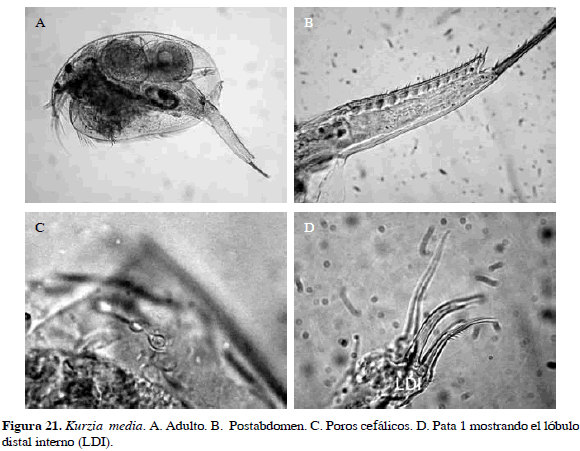
Kurzia media (Birge 1879)
Sinónimos: Alonopsis media Birge, 1879. Número de catálogo: UARC27M.
Cuerpo subrectangular con tres poros cefálicos desiguales interconectados, el del centro un poco más pequeño (5.6 µm) que los laterales (7 µm). Esquina distal del postabdomen con un lóbulo con tres espículas marginales. Sierras laterales de las dos setas más largas del LDI de la pata uno finamente uniformes. Garra postabdominal con peines grandes (Figura 21). Longitud del cuerpo 0.7 mm y de la garra 0.01 mm.
Distribución: De acuerdo con Hudec (2000), esta especie se encuentra en la región Neártica. No se ha registrado en Colombia, razón por la cual se propone como adición al inventario de cladóceros actual (Gaviria et al., 2010).
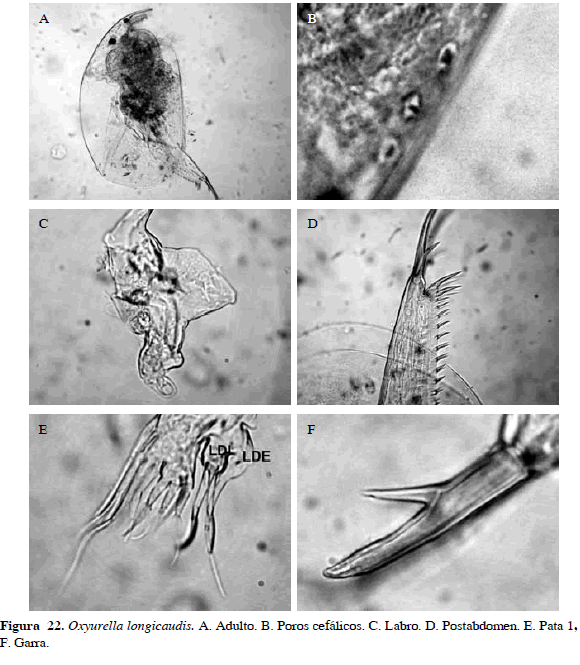
Oxyurella longicaudis (Birge, 1910)
Sinónimos: Euryalona tenuicaudis Daday, 1905; Odontalona longicaudis Birge, 1910; Oxyurella longicaudis Bergamin 1941. Número de catálogo: UARC36M.
Cuerpo ovalado, tres poros separados en la cabeza y labro con prolongación triangular; sin setas o cilios en el margen anterior, esta es la diferencia con Oxyruella cilliata. Anténula redondeada y lóbulo distal interno de la pata uno con dos setas del mismo tamaño y una rudimentaria, lóbulo distal externo con una seta más larga que las dos del LDI. Postabdomen cuatro veces más largo (157.5 µm) que ancho (38.5 µm), dos primeros dentículos mucho más grandes que los demás. Garra sin finos pecten, con una espina gruesa basal a 1/3 de la base (Figura 22). Estas características la diferencian de Oxyruella tenuicaudis.
Distribución: Según Elmoor-Loureiro (1998), esta especie se encuentra en la región Neotropical. No se ha registrado en Colombia razón por la cual se propone como adición al inventario de cladóceros actual (Gaviria et al., 2010).
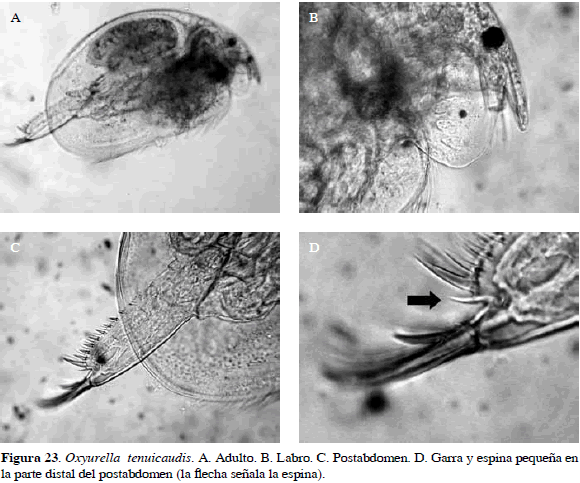
Oxyurella tenuicaudis (Sars, 1862)
Sinónimos: Camptocerus alonoides Schoedler, 1858; Alona tenuirostris Sars, 1862; Alona camptocercoides Schoedler, 1862; O. tenuicaudis, Dybowski y Grochowski, 1894; Euryalona tenuicaudis, Daday 1905; Odontalona tenuicaudis, Birge 1910; Michel y Frey, 1983. Número de catálogo: MBUCVIIXI-5506.
Tiene el cuerpo oval. Rostro moderadamente largo, anténula no alcanza punta del rostro; con setas y punta del labro con forma redondeada. Postabdomen seis veces más largo (227 µm) que ancho (38.5 µm) y su característica principal es una espina pequeña en parte distal del postabdomen, seguida de dos más grandes, que disminuyen en tamaño a lo largo del postabdomen hacia la parte proximal (Figura 23). Longitud del cuerpo 0.39 mm y de la garra 0.05 µm.
Distribución: Según Smirnov (1971), se encuentra al este de Europa, en Asia y Norte América. Esta especie no se ha registrado en Colombia razón por la cual se propone como adición al inventario de cladóceros actual (Gaviria et al., 2010).
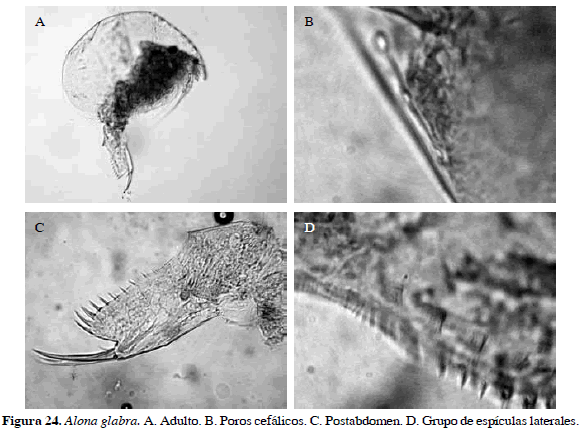
Alona glabra Sars, 1901
Número de catálogo: UARC32M.
Muy similar a Alona pulchella y A. cambouei. Según Sinev (2001a, 2001b), A. glabra se encuentra distribuida en Sur y Centro América, mientras que A. pulchella y A. cambouei no lo están. Cuerpo de A. glabra ovoide sin dentículos en ángulo postero-ventral, labro redondeado con ápex obtuso sin sétulas. Con tres poros cefálicos interconectados con una distancia total de 25.2 µm y un radio de 12.6 µm, anténula corta, más ancha proximalmente que distalmente. Postabdomen con espículas laterales y relativamente estrecho, con 7 a 8 dentículos marginales bien desarrollados hacia la parte distal, garra terminal larga, de 0.04 mm (Figura 24). Según Sinev (2001a), A. glabra comparte características del complejo pulchella, tales como morfología del abdomen y troncos de las patas, y puede ser fácilmente separada de la mayoría de las especies del género. Alona glabra se diferencia de A. cambouei por sus grandes poros cefálicos conectados y de A. pulchella por la distancia entre el poro posterior cefálico y la esquina posterior del escudo cefálico, la cual es más pequeña en A. glabra.
Distribución: Según Elmoor-Loureiro et al. (2004), esta especie es de Suramérica. No se ha registrado en Colombia razón por la cual se propone como adición al inventario de cladóceros actual (Gaviria et al., 2010).
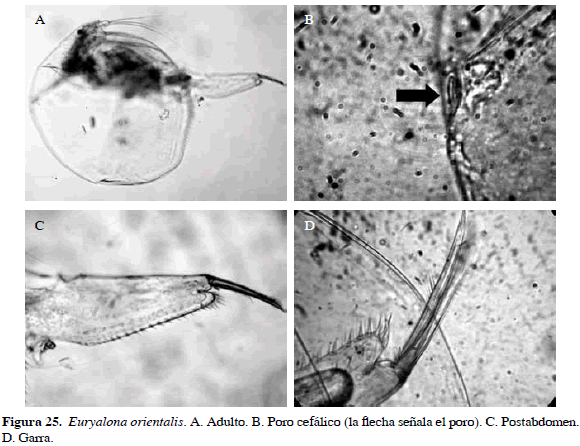
Euryalona orientalis (Daday, 1898)
Sinónimos: Alonopsis orientalis Daday, 1898; E. occidentalis Sars, 1901; E. orientalis, Rajapaksa y Fernando, 1987b. Número de catálogo: UARC30M.
Cuerpo más o menos redondo, rostro chato, postabdomen largo, estrecho, extremo distal del postabdomen con proceso redondeado y con cuatro dentículos grandes que decrecen proximalmente. Garra con espículas en la mitad de la parte cóncava, su principal característica es presencia de un solo poro en la cabeza (Figura 25).
Distribución: Se encuentra en la región Neotropical, en la de Etiopía, de Indonesia-Malasia y China (Elmoor-Loureiro, 1998). Esta especie se ha registrado en el departamento del Magdalena (Pearse, 1915; Gaviria et al., 2010).
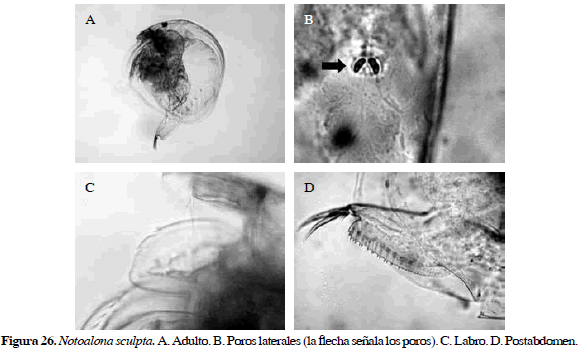
Notoalona sculpta (Sars, 1901)
Sinónimos: Alonella sculpta Sars 1901; N. sculpta, Rajapaksa y Fernando, 1987a. Número de catálogo: UARC31M.
Cuerpo ovalado, con dos poros cefálicos con forma de fríjoles, labro con dos incisiones anteriores, postabdomen corto y ligeramente estrecho distalmente, con 14 dentículos aproximadamente en la región postanal, ano bastante cóncavo (Figura 26). Longitud del cuerpo 0.44 mm y de la garra 0.07 mm.
Distribución: Según Elmoor-Loureiro (1998), esta especie se encuentra desde el sur de Estados Unidos hasta Paraguay. En Colombia se ha registrado en el departamento del Atlántico (Brehm, 1956).
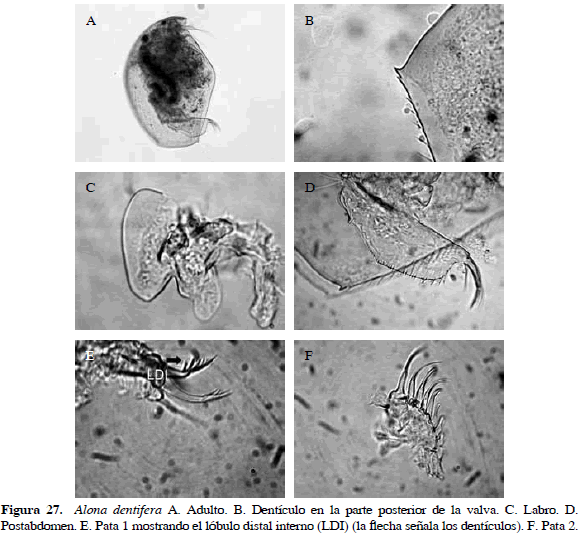
Alona dentifera (Sars, 1901)
Sinónimos: Alonella dentifera Sars, 1901; Alonella brasiliensis Bergamin, 1935; A. dentifera, Smirnov, 1996. Número de catálogo: UARC34M.
Cuerpo ovalado; una de las características principales son los dentículos en parte posterior de la valva; quilla del labro grande y redondeada, con ápice despuntado. Postabdomen ancho y espina de la garra grande; primera seta del lóbulo distal interno rudimentaria y segunda y tercera seta armadas con dentículos robustos en parte distal, pata dos subtriangular, exopodito subrectangular con una corta seta, endopodito con ocho "scrapers" o setas (Figura 27). Según Sinev et al. (2004), A. dentifera es la única especie del género sin poros mayores en el escudo cefálico ni laterales en el instar II o adultos.
Distribución: Esta especie se distribuye en el Neotrópico. En Colombia se ha registrado en el departamento de Córdoba (Álvarez, 2010).
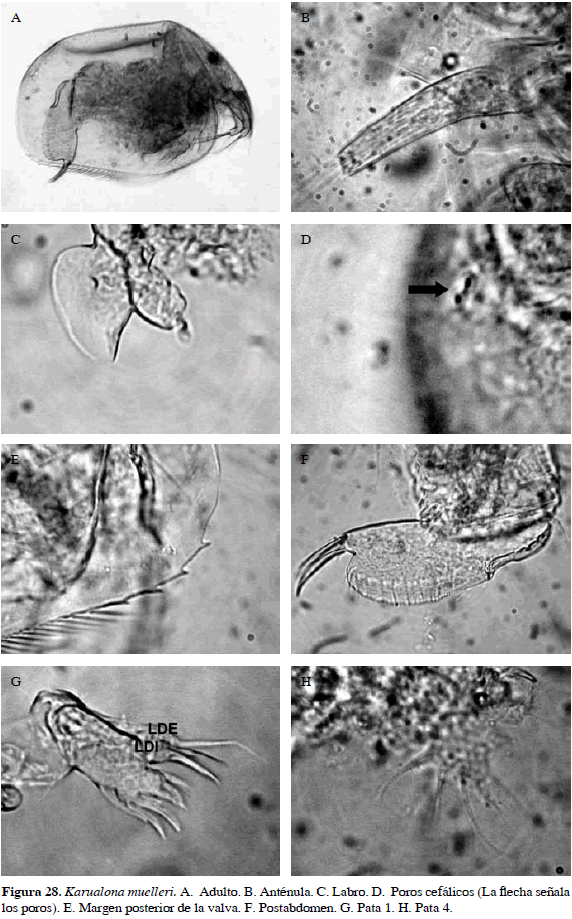
Karualona muelleri (Richard, 1897)
Sinónimos: Alona muelleri Richard, 1897; Alonella karua Sars, 1888; Biapertura karua, Smirnov, 1971; Karualona muelleri, Sinev y Hollwedel, 2005. Número de catálogo: UARC35M.
Cuerpo ovalado, rostro corto, labro obtuso y anténula un poco más angosta distal que basalmente. Postabdomen ancho distalmente y espina basal de la garra pequeña. Lóbulo distal interno con tres setas, dos de ellas casi del mismo tamaño y otra muy pequeña; lóbulo distal externo con seta mayor que las del lóbulo distal interno, seta tres de pata cuatro muy larga y la principal característica es presencia de cuatro dentículos en margen posteroventral de la valva (Figura 28). Longitud del cuerpo 0.34 mm y de la garra 0.03 mm.
Distribución: Según Van Damme y Dumont (2010), es una especie de la región Neotropical. En Colombia se ha registrado en los departamentos de Córdoba y Magdalena (Pearse, 1915; Álvarez, 2010).
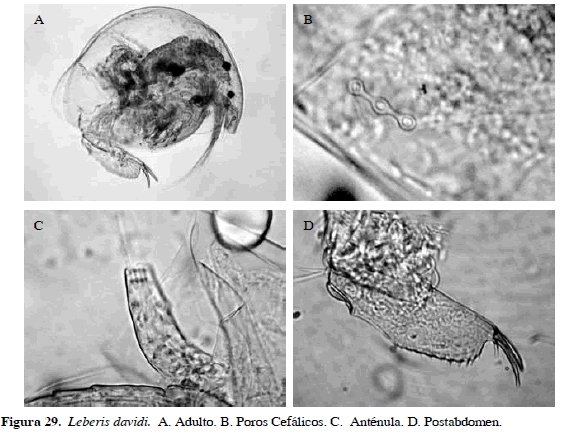
Leberis davidi (Richard, 1895)
Sinónimos: Alona davidi Richard, 1895; Alonella diaphana Sars, 1901; Alonella punctata Daday 1905; L. davidi, Sinev et al., 2005. Número de catálogo: UARC33M.
Rostro obtuso, margen posteroventral de las valvas sin dentículos. Anténula plana, ancha en la base, estrechándose distalmente, no alcanza el borde del rostro. Con tres poros cefálicos, el postabdomen un poco más ancho en el medio, estrechándose distalmente, margen anal cóncavo (Figura 29). Longitud del cuerpo 0.03 mm y garra 0.01 mm.
Distribución: Según Van Damme y Dumont (2010), es una especie de la región Neotropical. En Colombia se ha registrado en el departamento de Córdoba (Álvarez, 2010).
Subfamilia Chydorinae
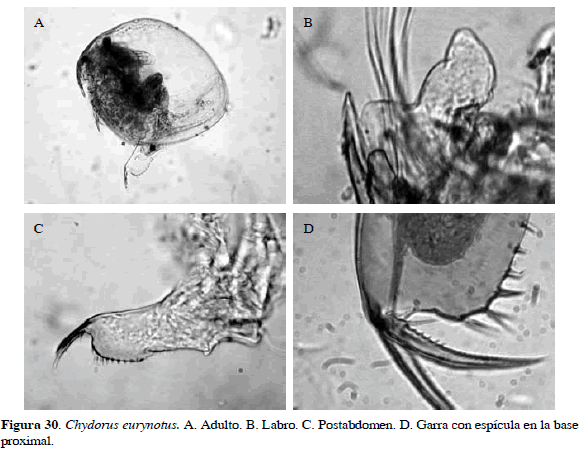
Chydorus eurynotus Sars, 1901
Sinónimo: C. flavescens Fryer, 1957; Número de catálogo: UARC39M.
Cuerpo subglobular. Fórmula de setas de antena es 1-1-3/0-0-3. Postabdomen largo y estrecho con espinas marginales en orden creciente distalmente. Márgenes dorsales y ventrales del postabdomen no paralelos, márgenes laterales posteroventrales de valvas rectos. Garra de postabdomen curva y grande (105 µm), con espículas en el lado cóncavo (cinco) bien desarrolladas. Un carácter conspicuo para identificarla es con dentículos cónicos en el pecten proximal (Van Damme y Dumont, 2010) (Figura 30). Longitud del cuerpo 0.25 mm.
Distribución: Según Smirnov (1996) y Elmoor-Loureiro (1998), es una especie tropicopolita. En Colombia se ha registrado en los departamentos de Córdoba y Atlántico (Stingelin, 1913; Álvarez, 2010).
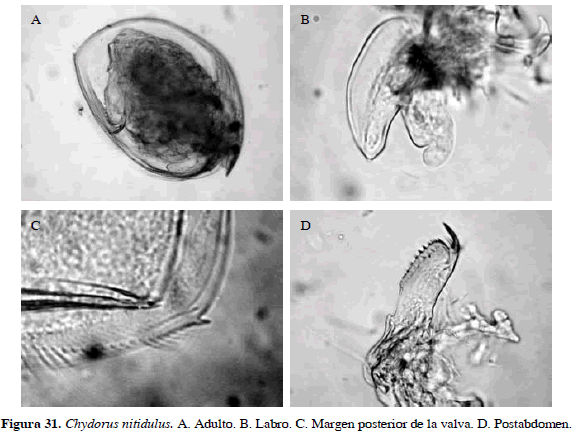
Chydorus nitidulus (Sars, 1901)
Sinónimos: Alonella nitidula Sars, 1901; C. nitidulus, Rey y Vásquez, 1986. Número de catálogo: UARC40M.
Cuerpo ovalado, labro aplanado y proyectado más allá del rostro. Postabdomen ancho con espínulas (12). Su característica notoria es ángulo posterior de la valva con un dentículo (Figura 31). Longitud del cuerpo 0.35 mm y la garra 0.04 mm.
Distribución: Según Smirnov (1996), se encuentra en América Central y del Sur y de acuerdo con Van Damme y Dumont (2010) es una especie tropicopolita. En Colombia se ha registrado en el departamento de Córdoba (Álvarez, 2010).
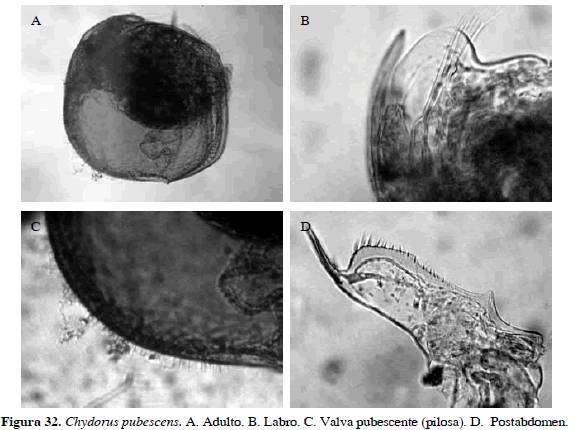
Chydorus pubescens Sars, 1901
Número de catálogo: UARC38M.
Cuerpo ovalado, valvas pilosas. Labro redondeado, alcanzando la punta del rostro. Postabdomen largo con espinas crecientes hacia la parte distal (Figura 32). Longitud corporal de 0.28 mm.
Distribución: Según Smirnov (1996), esta especie es tropicopólita; para Elmoor-Loureriro (1998) es de América del Sur. En Colombia se ha registrado en los departamentos de Antioquia, Cundinamarca y Córdoba (Stingelin, 1913; Álvarez, 2010).
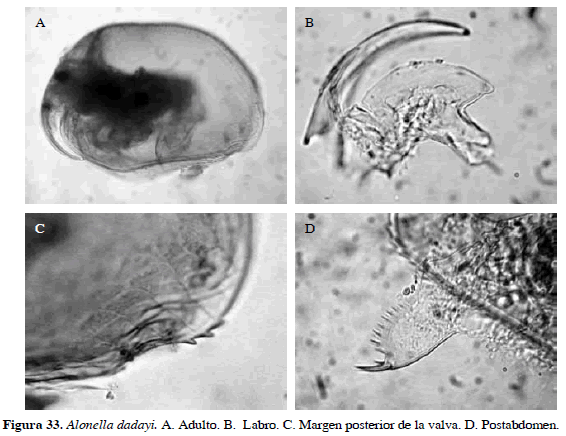
Alonella dadayi Birge, 1910
Sinónimos: Disparalona dadayi, Smirnov, 1971; Elmoor-Loureiro, 1998; A. dadayi, Smirnov, 1996. Número de catálogo: UARC41M.
Cuerpo ovalado, rostro largo y curvado, labro con margen ondulado externo, ángulo postero-ventral de valva con tres dentículos, postabdomen compacto, margen postanal con espínulas largas, ángulo preanal prominente (Figura 33). Difiere de Alonella nana por el margen anterior ondulado del labro y el patrón de escultura de la valva. Longitud del cuerpo 0.28 mm.
Distribución: Según Smirnov (1996) y Van Damme y Dumont (2010), se encuentra en América del Norte y Sur. En Colombia esta especie se ha registrado en los departamentos de Santander y Córdoba (Barón-Rodríguez et al., 2006; Álvarez, 2010).
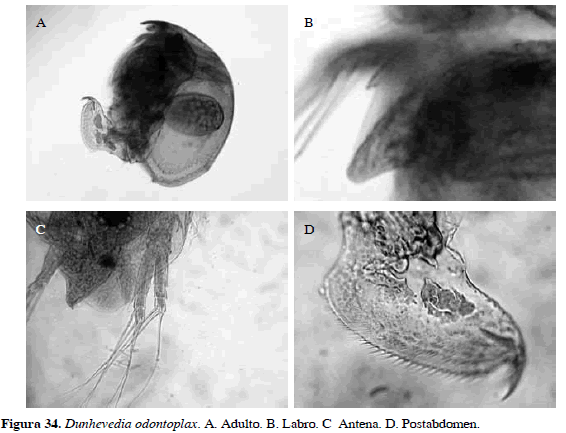
Dunhevedia odontoplax Sars, 1901
Número de catálogo: UARC44M.
Cuerpo ovalado, margen posteroventral de la valva con un dentículo grande. Fórmula setal de la antena 1-1-3/0-0-3. Postabdomen ovalado con dentículos anales pequeños y espículas laterales numerosas, garra con una espina basal, su característica principal es presencia de un dentículo en labro (Figura 34). Longitud del cuerpo 0.40 mm.
Distribución: Según Smirnov (1996), Elmoor-Loureriro (1998) y Van Damme y Dumont (2010), esta especie se distribuye en el Neotrópico. En Colombia se ha registrado en el departamento de Cundinamarca (Stingelin, 1913).
Dunhevedia colombiensis Stingelin, 1913
Número de catálogo: UARC45M.
Se diferencia de D. odontoplax por la presencia de tres dentículos en el labro (Figura 35). Longitud del cuerpo 0.50 mm.
Distribución: Según Smirnov (1996), se encuentra en la región del Neotrópico y según Lopes et al. (2006), en Colombia, Argentina y Brasil. En Colombia se ha registrado en el departamento de Cundinamarca (Stingelin, 1913).
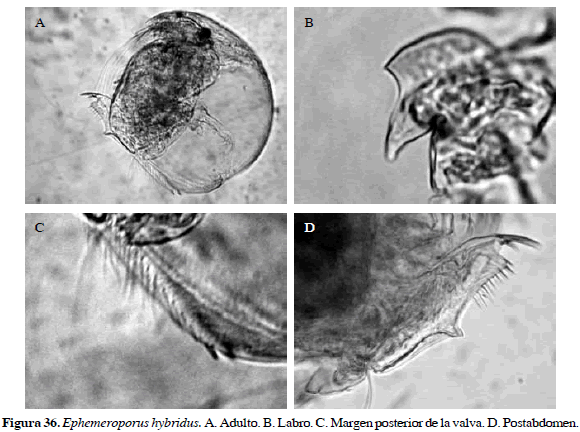
Ephemeroporus hybridus Daday, 1905
Sinónimos: Chydorus hybridus Daday, 1905; Stingelin, 1913; Ephemeroporus hybridus, Frey, 1982. Número de catálogo: UARC46M.
Rostro corto, postabdomen ancho con ángulo anal prominente, garra terminal ligeramente curvada. Sus características más notorias son presencia de un dentículo en margen posterior de valva y un solo diente en margen posterior de labro (Figura 36). Longitud del cuerpo 0.20 mm.
Distribución: De acuerdo con Smirnov (1996), Elmoor-Loureriro (1998) y Van Damme y Dumont (2010), se encuentra en América del Sur y sur de Estados Unidos. En Colombia esta especie se ha registrado en los departamentos de Cundinamarca y Córdoba (Stingelin, 1913; Álvarez, 2010).
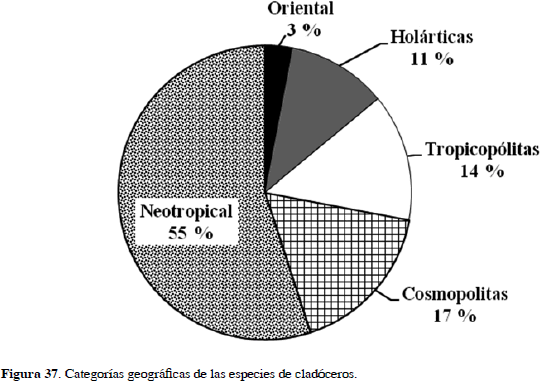
En total, de las 36 especies de cladóceros registradas el 55 % son de la región Neotropical, el 17 % cosmopolitas, el 14 % tropicopólitas, el 6 % holárticas y el 3 % de la región Oriental (Figura 37). El criterio para designar estas categorías es similar al de Forró et al. (2008).
DISCUSIÓN
En este estudio se incrementa el número de cladóceros registrados en Colombia (Gaviria et al., 2010) a 89 especies, con nuevos totales en las familias Chydoridae (36), Macrothricidae (ocho), Ilyiocriptidae (cuatro) y Moinidae (seis). Sin embargo, este número es aún bajo en comparación con las 113 registradas para Brasil (Elmoor-Loureriro, 1997) y las 112 para Venezuela (Zoppi de Roa y López, 2008). Al considerar la posición geográfica de Colombia, las diferentes cuencas hidrográficas, la mezcla de especies de las regiones Holártica y Neotropical y la influencia de la fauna de Venezuela y Brasil, se esperaría un mayor número potencial de cladóceros en Colombia. La mayoría de los cladóceros encontrados en este trabajo son comunes en áreas neotropicales, resultados semejantes fueron registrados en Sur y Centro América (Hutchinson, 1967; Collado et al., 1984; Cisneros et al., 1991; Ramírez y Díaz, 1996-1997).
Adicional a las especies con distribución neotropical, algunas aparecen también en la región Neártica (e.g. Pseudosida ramosa y Notoalona sculpta) y en la región Oriental (Ephemeroporus hybridus). Entre las especies ampliamente distribuidas en todo el continente, se tiene a Moina micrura, Latonopsis australis, Ilyocryptus spinifer y Moinodaphnia macleayi. Especies como Alona glabra y Dunhevedia colombiensis sólo se han registrado en Suramérica (Elmoor-Loureiro et al., 2004; Lopes et al., 2006). Mientras, especies como Moina micrura, Ilyocryptus spinifer, Latonopsis australis y Moinodaphnia macleayi son cosmopolitas (Elmoor- Loureiro, 1998; Zoppi de Roa y López, 2008; FADA, 2010).
Las especies Sarsilotona serricauda, Moinodaphnia macleayi, Moina micrura, Macrothrix elegans, Notoalona sculpta y Alona glabra fueron encontrados tanto en macrófitas como en aguas abiertas; su presencia en estas últimas podría explicarse por la influencia de las corrientes del rio que pudieron arrastrar vegetación a esta área. La riqueza y abundancia mayores observadas en la zona litoral con macrófitas se debe a que numerosas especies muestran preferencias por este hábitat (Rossa et al., 2001; Lima et al., 2003). Kotov (2006) señala que miembros de las familias Macrothricidae, Chydoridae e Ilyocryptidae viven en asociación con plantas acuáticas. Además, tienen especializaciones que les permiten usar los recursos en la zona litoral, particularmente entre las macrófitas, los cuales incluyen apéndices especializados para raspar y manejar el alimento (Fryer, 1995). Los bancos de macrófitas ofrecen refugio y un número mayor de microhábitats disponibles para el zooplancton, como una oferta alta de recursos alimentarios como detritos y biomasa bacteriana asociadas a los procesos de descomposición de la vegetación acuática (Rossa et al., 2001). Aunado a esto, la heterogeneidad microambiental de la ciénaga incrementa con la vegetación, razón por la cual constituye el sitio con mayor riqueza de cladóceros, en especial en casi todos los ambientes con macrofitas flotantes. Las macrófitas proveen al zooplancton recursos y refugios contra la depredación (Pieczynska, 1990).
En este estudio, la riqueza de especies (36 especies) superó la riqueza de la Ciénaga de Paredes (19 especies y 12 morfotipos), registrada por Barón-Rodríguez et al. (2006). Posiblemente uno de los factores importantes ha sido la heterogeneidad de vegetación, incluyendo macrófitas en sus diferentes hábitos y a su vez el beneficio que ellas representan.
De acuerdo con el patrón distribucional de Kurzia latissima presentado por Hudec (2000), se sugiere la necesidad de una revisión de esta especie en Colombia, por lo que los especímenes reportados para los departamentos de Cundinamarca, Magdalena y Santander (Stingelin, 1913; Barón-Rodríguez, et al., 2006; Gaviria et al., 2010) probablemente pertenezcan a Kurzia polyspina.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a los profesores Lourdes María A. Elmoor-Loureiro (Universidade Católica de Brasilia) y a Manuel Elías Gutiérrez (El Colegio de la Frontera Sur, México) por confirmar las especies encontradas.
BIBLIOGRAFÍA
1 Álvarez, J. 2010. Caracterización de las ciénagas de Arcial, Porro y Cintura (río San Jorge) y de Bañó Charco Pescao y Pantano Bonito (Río Sinú), departamento de Córdoba. 509-558. En: Rangel, J. O. (Ed.). Colombia, diversidad biótica IX, Ciénaga de Córdoba: Biodiversidad, ecología y manejo ambiental. Univ. Nacional de Colombia, Bogotá. 619 p. [ Links ]
2 Andrade, C. 2001. Efectos de la fluctuación del nivel del agua sobre la estructura de la comunidad de rotíferos planctónicos en el lago Yahuarcaca (Río Amazonas-Colombia). Tesis de Maestría, Univ. Andes, Bogotá. 41 p. [ Links ]
3 Aranguren, N. 2010. Diversidad taxonómica de cladóceros y copépodos planctónicos de Colombia: Análisis local y regional. Tesis doctoral, Univ. Nacional de Colombia, Bogotá. 110 p. [ Links ]
4 Aranguren, N., D. Monroy y S. Gaviria. 2010. Eurycercus (Bullatifrons) norandinus (Crustacea: Branchiopoda: Eurycercidae), a new species of Cladocera in the neotropical region. Zootaxa, 2550: 58-68. [ Links ]
5 Barón-Rodríguez, M. y G. Díaz. 2007. New record of Ephemeroporus tridentatus Bergamin, 1939 (Crustacea; Anomopoda; Chydoridae) from Colombia. Braz. J. Biol., 67 (2): 381-382. [ Links ]
6 Barón-Rodríguez, M., R. Gavilán y J. J. Ramírez. 2006. Variabilidad espacial y temporal en la comunidad de cladóceros de la Ciénaga de Paredes (Santander, Colombia) a lo largo de un ciclo anual. Limnética, 25 (3): 624-635. [ Links ]
7 Bergamin, F. 1935. Uma nova espécie de Cladocera encontrada na Diretoria de Indústria Animal. Rev. Indústr. An., 2 (3): 284-285. [ Links ]
8 Bergamin, F. 1939. Os Cladocera. (Descrição sistemática das espécies encontradas no município de São Paulo). Rev. Indústr. An., N. S., 2: 80-86. [ Links ]
9 Bergamin, F. 1941. Os Cladocera. 6. Rev. Indústr. An., 4 (1): 162-166. [ Links ]
10 Berner, D. 1985. Morphological differentiation among species in the Ceriodaphnia cornuta complex (Crustacea, Cladocera). Verh. Int. Verein. Limnol., 22: 3099-3103. [ Links ]
11 Birge, E. A. 1879. Notes on Cladocera. Trans. Wisconsin Acad. Sci., Arts Let., 4: 77-110. [ Links ]
12 Birge, E. A. 1892. Notes on Cladocera. II. List of Cladocera from Madison, Wisc. Trans. Wisconsin Acad. Sci., 8: 379-398. [ Links ]
13 Birge, E. A. 1910. Notes on Cladocera. Trans. Wisconsin Acad. Sci., 16: 1017-1066. [ Links ]
14 Brady, G. S. 1886. Notes on Entomostraca collected by Mr. Haly in Ceylon. Linn. J. Zool., 19: 293-317. [ Links ]
15 Brady, G. S. 1904. On Entomostraca collected in Natal by Mr. James Gibson. Proc. Zool. Soc. London, 2: 121-128. [ Links ]
16 Brehm, V. 1953. Bericht über Cladoceren und Copepoden to Australia in 1951-1952. Report. 2. Acta Univ. Lund. n. s., 49 (7): 1-11. [ Links ]
17 Brehm, V., 1956. Cladocera aus Venezuela. Ergebn. der Deutschem limnol. Venezuela-Expedition 1952. 1: 217-232. [ Links ]
18 Brehm, V. y R. Thomsen. 1936. Brasilianiche Phyllopoden und Arguliden gesammelt von Herrn Dr. O. Schubart. Zool. Anz., 116: 211-218. [ Links ]
19 Camargo, F. 1994. Estudio cualitativo y semicuantitativo del zooplancton superficial en el Embalse El Guájaro (Atlántico), Colombia. Trianea, 5: 235-253. [ Links ]
20 Cisneros, R., E. I. Manga y M. Van Maren. 1991. Qualitative and quantitative structure, diversity and fluctuations in abundance of zooplankton in a lake Xolotlán (Managua). Hydrobiol. Bull., 25 (2): 151-156. [ Links ]
21 Collado, C., C. H. Fernando y D. Sephton. 1984. The freshwater zooplankton of Central America and the Caribbean. Hydrobiologia, 113: 105-119. [ Links ]
22 Daday, E. 1898. Mikroskopische Susswasserthiere aus Ceylon. Termes. Fuzetek, 21: 1-123. [ Links ]
23 Daday, E. 1904. Ein neues Cladoceren-Genus der Familie Sididae. Rovartani Lapok., 11: 111-112. [ Links ]
24 Daday, E. 1905. Untersuchungen über die Süsswasser-Mikrofauna Paraguays. Zoologica, Stuttgart, 18 (44): 1-374. [ Links ]
25 Dybowski, B. y M. Grochowski. 1894. O Lynceidach czyli Tonewkach fanny krajowej. Kosmos, 19: 376-383. [ Links ]
26 Elías-Gutiérrez, M., N. Smirnov, E. Suárez-Morales y N. Dimas-Flores. 2001. New and little known cladocerans (Crustacea: Anomopoda) from Southeastern Mexico. Hydrobiologia, 442: 41-54. [ Links ]
27 Elías-Gutiérrez, M., E. Suárez, M. Gutiérrez, M. Silva, J. Granados y T. Garfia. 2008. Cladócera y Copépoda de las aguas continentales de México. UNAM, México D.F. 323 p. [ Links ]
28 Elmoor-Loureiro, L. M. A. 1997. Manual de identificação de cladóceros límnicos do Brasil. Universida de Católica de Brasília, Editora Universa, Brasilia. 156 p. [ Links ]
29 Elmoor-Loureiro, L. M. A. 1998. Branchiopoda fresh water. 15-41. En: Younf, P. S. (Ed.). Catalogue of Crustacea of Brazil. Museu Nacional, Rio de Janeiro. 717 p. [ Links ]
30 Elmoor-Loureiro, L. M. A., I. Mendonça-Galvão y C. Padovesi-Fonseca. 2004. New cladoceran records from Lake Paranoá, Central Brazil. Braz. J. Biol., 64 (3a): 415-422. [ Links ]
31 FADA. 2010. Crustacea-Cladocera Checklist. http://fada.biodiversity.be/CheckLists/Crustacea-Cladocera.pdf. 05/01/2011. [ Links ]
32 Fernando, C. H. 1980. The freshwater zooplankton of Sri Lanka with a discussion of tropical freshwater zooplankton composition. Int. Rev. Ges. Hydrobiol., 65: 85-125. [ Links ]
33 Forró, I., M. M. Korovchinsky, A. A., Kotov y A. Petrusek. 2008. Global diversity of cladocerans (Cladocera; Crustacea) in freshwater. Hydrobiologia, 595: 177-184. [ Links ]
34 Fryer, G. 1957. Freeliving freshwater Crustacea from Lake Nyasa and adjoining waters. Part. II. Cladocera and Conchostraca. Arch. Hydrobiol., 53: 223-239. [ Links ]
35 Fryer, G. 1995. Phylogeny and adaptive radiation within the Anomopoda: a preliminary exploration. Hydrobiologia, 307: 57-68. [ Links ]
36 Frey, D. G. 1982. Relocation of Chydorus barroisi and related species (Cladocera, Chydoridae) to a new genus and description of two new species. Hydrobiologia, 86: 231-269. [ Links ]
37 Gallo, L. 2007. Agremiación zooplanctónica (Rotifera y Microcrustacea) y su relación con los cambios del nivel del agua en la Ciénaga de Ayapel, Córdoba, Colombia. Tesis de Maestría, Univ. Antioquia, Medellín. 97 p. [ Links ]
38 Gallo, L., N. Aguirre, J. Palacio y J. Ramírez. 2009. Zooplancton (Rotífera y Microcrustacea) y su relación con los cambios del nivel del agua en la ciénaga de Ayapel, Córdoba, Colombia. Caldasia, 31 (2): 339-353. [ Links ]
39 Gaviria, S. 2001. Estado actual del conocimiento de la biodiversidad y biogeografía de los cladóceros y copépodos de las aguas epicontinentales de Colombia. 71-73. En: Muñoz, P. (Ed.). Memorias Primer Congreso Colombiano de Zoología Año 2000. Instituto de Ciencias Naturales, Univ. Nacional de Colombia, Bogotá. 371 p. [ Links ]
40 Gaviria, S., N. Aranguren y E. Realpe. 2010. Branchiopods (Arthropoda, Crustacea) of Colombia: Checklist with biogeographical and autoecological notes of selected species. 4-5. En: Biology Center of the Academy of Sciences of the Czec Republic, Cesce Budejovice y Crop Research Institute, Prague (Eds.). International Conference on Invertebrate Reproduction and Development in the Age of Genetics Modifications (ICIRD). Praga. 5 p. [ Links ]
41 Goulden, C. E. 1968. The systematics and evolution of the Moinidae. Trans. Am. Phil. Soc., 58: 1-101. [ Links ]
42 Guevara, G., P. Lozano, G. Reinoso y F. Villa. 2009. Horizontal and seasonal patterns of tropical zooplankton from the eutrophic Prado Reservoir (Colombia). Limnologica, 39: 128-139. [ Links ]
43 Guerne, J. De y J. Richard. 1892. Cladocères et Copépodes d'eau douce des environs de Rufisque. Mém. Soc. Zoll. France, 5: 526-538. [ Links ]
44 Herrera-Martínez, Y. y G. Guillot. 1999. Composición taxonómica del zooplancton del Embalse de Betania, departamento del Huila. Acta Biol. Col., 4 (1): 5-21. [ Links ]
45 Herrick, C. L. 1887. Contribution to the funa of the Gulf of Mexico and the South. Mem. Deni Sci. Assoc., 1: 1-56. [ Links ]
46 Hollwedel, W., A. A. Kotov y G. O. Brandorff. 2003. Cladocera (Crustacea: Branchiopoda) from the Pantanal (Brazil). Arthropoda Selecta, 12 (2): 67-93. [ Links ]
47 Hudec, I. 2000. Subgeneric differentiation within Kurzia (Crustacea: Anomopoda: Chydoridae) and a new species from Central America. Hydrobiologia, 421: 165-178. [ Links ]
48 Hutchinson, G. E. 1967. A treatise on Limnology. Vol. II. Introduction to lake biology and the limnoplankton. John Wiley and Sons, Inc., Nueva York. 1115 p. [ Links ]
49 Jaramillo, J. y S. Gaviria. 2003. Caracterización físicoquímica y estructura de la comunidad zooplanctónica de un pequeño lago tropical, lago Santander (Río Negro, Antioquia, Colombia). Caldasia, 25 (2): 355-380. [ Links ]
50 Jaramillo, J. y R. Pinto. 2010. Interaction between Hexarthra intermedia (Rotifera) and Bosmina longirostris (Cladocera): a case of opportunistic nutrition or interference competition. J. Plankton Res., 32 (36): 961-966. [ Links ]
51 Jiang Xiezhi. 1977. On one new species and four new records of Chinese freshwater Cladocera. Acta Zool. Sin., 23: 286-289. [ Links ]
52 King, R. 1853. On Australian Entomostraca, Pap. Proc. Roy. Soc. Tasmania, 2: 253-263. [ Links ]
53 Korovchinsky, N. M., 1985. Sarsilatona, a new genus of the family Sididae (Crustacea,Cladocera) with two redescribed species and one new species. Int. Revue ges. Hydrobiol., 70: 397-425. [ Links ]
54 Korovchinsky, N. M. 1992. Sididae and Holopedidae. SPB Academic Publishing, Amsterdam. 82 p. [ Links ]
55 Kotov, A. A. 2006. Adaptations of Anomopoda Crustaceans (Cladocera) to the benthic mode of life. Entomological Review, 86 (Suppl. 2): 210-225. [ Links ]
56 Kotov, A. A. y W. Hollwedel. 2004. Revision of the Macrothrix paulensis species group (Anomopoda, Cladocera, Branchiopoda) in Neotropics, with description of M. brandorffi n. sp. Archiv für Hydrobiologie. Monographic Studies, 151 (1-2): 125-159. [ Links ]
57 Kotov, A. y P. Stifter. 2006. Guide to identification of microinvertebrates of the continental water of the world. Cladocera: Family Ilyocriptidae (Branchiopoda: Cladocera: Anomopoda). Kenobi productions y Backhuys Publishers, Leide. Países Bajos. 172 p. [ Links ]
58 Lima, A., F. Lansac-Toha, L. Machado, L. Bini y A. Takeda. 2003. Composition and abundance of cladocera (Crustacean) assemblages associated with Eichornia azurea (Swartz) Kunth stands in the upper Parana River floodplain. Acta Scientiarum, 25 (1): 41-48. [ Links ]
59 Lopes, P. M., L. M. Elmoor-Loureiro y R. L. Bozelli. 2006. First record of Dunhevedia colombiensis Stingelin, 1913 (Cladocera, Anomopoda, Chydoridae) from Brazil. Braz. J. Biol., 66 (4): 1141-1142. [ Links ]
60 Monroy, J., N. Aranguren y S. Gaviria. 2004. Los crustáceos plantónicos del lago de Tota. Ciencia en Desarrollo, 1 (2): 64-81. [ Links ]
61 Montú, M. y I. M. Gloeden. 1986. Atlas dos Cladocera and Copepoda (Crustacea) do estuário da Lagoa dos Patos (Rio Grande, Brasil). Nerítica, Pontal do Sul, 1 (2): 1-134. [ Links ]
62 Michel. G. y D. Frey. 1983. Assumed Amphi-Atlantic distribution of Oxyurella tenuicaudis (Cladocera, Chydoridae) denied by a new species from North America. Hydrobiologia, 106: 3-35. [ Links ]
63 Orlova-Bienkowskaja, M. 2001. Guide to identification of macroinvertebrates of the continental waters of the world. Cladocera: Anomopoda. Daphnidae. Genus Simocephalus. Backhuys Publishers, Leiden, Países Bajos. 130 p. [ Links ]
64 Paggi, J. C. 1976. Cladóceros Macrothricidae nuevos para la fauna Argentina. Physis, 35 (91): 103-112. [ Links ]
65 Paggi, J. C. 1993. Análisis preliminar de la distribución geográfica de los cladóceros suramericanos. 107-113. En: Boltovskoy, A. y L. López (Eds.). Conferencias de Limnología. Instituto Nacional de Limnología, La Plata. 249 p. [ Links ]
66 Pearse, A. S. 1915. An account of the Crustacea collected by the Walker Expedition to Santa Marta Colombia. Proc. U.S. National Mus., 49 (2123): 530-556. [ Links ]
67 Pieczynska, P. 1990. Littoral habitats and communities. 39-72. En: Jorgensen, S. E. y H. Löffler. (Eds.). Guidelines of lake management. Lake shore management. International Lake Environment Committee. United Nations Environment Programme, Shiga, Japón. 174 p. [ Links ]
68 Rajapaksa, R. y C. H. Fernando. 1987a. Redescription and assignment of Alona globulosa Daday, 1898 to a new genus Notoalona and a description of Notoalona freyi sp. nov. Hydrobiologia, 144 (2): 131-153. [ Links ]
69 Rajapaksa, R. y C. H. Fernando. 1987b. A redescription of Euryalona orientalis (Daday, 1898) with a consideration of the other species in the genus Euryalona (Cladocera: Chydoridae). Hydrobiologia, 150: 75-90. [ Links ]
70 Ramírez, J. J. y A. Díaz. 1996-1997. Fluctuación estacional del zooplancton en la laguna del Parque Norte, Medellín, Colombia. Rev. Biol. Trop., 44/45: 549-563. [ Links ]
71 Rey, J. y E. Vásquez. 1986. Contribution à la connaissance des Cladocères néotropicaux: redescription de Leydigiopsis ornata Daday, 1905 (Crustacea, Cladocera). Annales de Limnologie, 22 (2): 169-176. [ Links ]
72 Richard, J. 1891. Entomaostracés deau douce de Sumatra et de Celebes. Zool. Ergbn. Reise Niederl. Ost-Indien, 2: 118-128. [ Links ]
73 Richard, J. 1892. Grimaldina brazzai, Guernella raphaelis, Moinodaphnia mocquerysi, cladocères nouveaux du Congo. Mémoires de la Société Zoologique de France, 5: 1-4. [ Links ]
74 Richard, J. 1894. Cladocères recueillis par le Dr. Théod. Barrois en Palestine, en Syrie et en Égypte. Rev. Biol. Nord Français, 6 (9): 360-378. [ Links ]
75 Richard, J. 1895. Sur quelques Entomostracès d'eau douce d'Haiti. Mem. Soc. Zool. France, 8: 189-190. [ Links ]
76 Richard, J. 1897. Entomostracés de L'Amérique du Sud. Mémoires de la Société Zoologique de France, 10: 263-301. [ Links ]
77 Rivera, C., A. M. Zapata, D. Pérez, Y. Morales, H. Ovalle y J. P. Álvarez. 2010. Caracterización limnológica de humedales de la planicie de inundación del río Orinoco (Orinoquía, Colombia). Acta Biol. Colomb., 15 (1): 145-166. [ Links ]
78 Rossa, D., F. Lansac-Toha, C. Bonecher y F. M. Velho. 2001. Abundance of cladocerans in the littoral regions of two environments of the upper Parana River flood plain, Mato Grosso de Sul, Brazil. Rev. Bras. Biol., 61 (1): 45-53. [ Links ]
79 Rzóska, J. 1956. On the variability and status of the Cladocera Ceriodaphnia cornuta and C. rigaudi. Ann. Mag. Nat. Hist., 12: 505-512. [ Links ]
80 Sars, G. O. 1862. Hr. Studios. medic . G. O. Sars meddeelte en af talrige Afbildninger ledsaget Oversigt af de af ham i Omegnen af Christiania iagttagne Crustacea Cladocera. Forh. VidenskSelsk. Krist., 1861: 144-16. [ Links ]
81 Sars, G. O. 1885. On some Australian Cladocera, raised from dried mud, Norske. Vidensk, Selsk, Forhandt. Christiania, 8: 1-46. [ Links ]
82 Sars, G. O. 1888. Additional notes on Australian Cladocera, raised from dried mud. Vidensk, Selsk. Forhandt. Christiania 1886, 7: 1-74. [ Links ]
83 Sars, G. O. 1901. Contributions to the knowledge of the freshwater Entomostraca of South America, as shown by artificial hatching from dried material. Parte I. Cladocera. Archiv for. Mathematik og. Naturvidenskab, 23 (3): 1-102. [ Links ]
84 Sampaio, E., O. Rocha., T. Matsumura-Tundisi y J. Tundisi. 2002. Composition and abundance of zooplankton in the limnetic zone of seven reservoirs of the Paranapanema River, Brazil. Braz. J. Biol., 62: 525-545. [ Links ]
85 Schoedler, E. 1858. Die Branchiopoden der Umgegend von Berlin. Jahresber. Louisenstädt. Realschule, Berlín. 28 p. [ Links ]
86 Schoedler, E. 1862. Ueber die Lynceiden and Polyphemiden der Umgegend von Berlin. Jahresber. Dorotheenstadtische Realschule, Berlín. 56 p. [ Links ]
87 Serafim Jr., F. Lansac-Töha., J. C. Paggi., L. Velho y B. Robertson. 2003. Cladocera fauna composition in a river-lagoon system of the upper Paraná River floodplain, with a new record for Brazil. Braz. J. Biol., 63 (2): 349-356. [ Links ]
88 Silva-Briano, M. y H. J. Dumont. 2001. Wlassicsia, Bunops and Onchobunops (Anomopoda), three related genera. Hydrobiologia, 442 (1): 1-28. [ Links ]
89 Sinev, A. Y. 2001a. Separation of Alona cambouei Guerne and Richard, 1893 from Alona pulchella King. 1853 (Branchiopoda: Anomopoda: Chydoridae). Arthropoda Selecta, 10 (1): 5-18. [ Links ]
90 Sinev, A. Y. 2001b. Redescription of Alona glabra Sars, 1901, a South American species of the pulchella-group (Branchiopoda: Anomopoda: Chydoridae). Arthropoda Selecta, 10 (4): 273-280. [ Links ]
91 Sinev, A. Y. y W. Hollwedel. 2005. Translocation of Alona muelleri Richard, 1897 into the genus Karualona Dumont and Silva-Briano, 2000 (Branchiopoda: Anomopoda: Chydoridae). Arthropoda Selecta, 14 (2): 93-101. [ Links ]
92 Sinev, A. Y., A. Kotov y K. Van Damme. 2004. Morphology of a Neotropical cladoceran Alona dentifiera (Sars, 1901), and its position within the Chydoridae Stebbing, 1902 (Branchiopoda: Anomopoda). Arthropoda Selecta, 13 (3): 99-107. [ Links ]
93 Sinev, A.Y., K. Van Damme y A. A. Kotov. 2005. Redescription of tropical-temperate cladocerans Alona diaphana King, 1853 and Alona davidi Richard, 1895 and translocation to Leberis Smirnov, 1989 (Branchiopoda: Anomopoda: Chydoridae). Arthropoda Selecta, 14 (3): 183-205. [ Links ]
94 Smirnov, N. N. 1971. Chydoridae of the World: USSR Fauna N 101. Nauka, Leningrado, 531 p. [ Links ]
95 Smirnov, N. N. 1988. Cladocera (Crustacea) from Nicaragua. Hydrobiologia, 160: 63-77. [ Links ]
96 Smirnov, N. N. 1992. The Macrothricidae of the world. SPB Academic Publishing, Ámsterdam. 143 p. [ Links ]
97 Smirnov, N. N. 1996. Guides to the identification of the microinvertebrates of the continental waters of the world. Cladocera: the Chydorinae and Sayciinae (Chydoridae) of the world. SPB Academic Publishing, Ámsterdam. 197 p. [ Links ]
98 Spandl, H. 1926. Das Zooplankton des Paranaguasees (Brazil). Denkschr. Österreich. Akad. Wiss., Math. -Naturwiss. Klasse, 76: 101-105. [ Links ]
99 Srámek-Husek, R., M. Straskraba y J. Brtek. 1962. Branquiopoda. Fauna CSSR, 16: 1-470. [ Links ]
100 Stingelin, T. 1900. Beitrag zur Kenntnis der Süsswasserfauna von Celebes. Rev. Suisee Zool., 8: 193-207. [ Links ]
101 Stingelin, T. 1904. Untersuchungen über die Cladocerenfauna von Hinterindien Sumatra und Java. Zool. Jb. (Systemat.), 21 (3): 327-370. [ Links ]
102 Stingelin, T. 1913. Cladoceren aus den Gebirgen von Kolumbien. Mem. Soc. Neuchateloise. Scienc. Nat., 5: 600-638. [ Links ]
103 Thomas, I. F. 1961. The Cladocera of the swamps of Uganda. Crustaceana, 2 (2): 108-125. [ Links ]
104 Tsi-Chung, C. y L. S. Clement. 1954. The classification and distribution of fresh water cladocerans around Manila. Nat. Appl. Sci. Bull., 14: 85-150. [ Links ]
105 Van Damme, V. K. y H. Dumont. 2010. Cladocera of the Lençóis Maranhenses (NE - Brazil): faunal composition and a reappraisal of Sars' Method. Braz. J. Biol., 70 (3): 755-779. [ Links ]
106 Van de Velde, I., H. J. Dumont y P. Grootaert. 1978. Report on a collection of Cladocera from Mexico and Guatemala. Archiv für Hydrobiol., 83 (3): 391-404. [ Links ]
107 Zoppi de Roa, E. y C. López. 2008. An updated checklist of inland Cladocera (Crustacea: Orders Ctenopoda and Ano mopoda) from Venezuela. Zootaxa, 1919: 45-57. [ Links ]
108 Zoppi de Roa, E. y W. Vásquez. 1991. Additional cladoceran records for Mantecal and new for Venezuela. Hydrobiologia, 225 (1): 45-62. [ Links ]
FECHA DE RECEPCIÓN: 12/04/2011 FECHA DE ACEPTACIÓN: 11/03/2012