Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.41 no.1 Santa Marta Jan./June 2012
ASPECTOS BIOLÓGICOS DE RHIZOPRIONODON LALANDII Y RHIZOPRIONODON POROSUS (CARCHARHINIDAE-CARCHARHINIFORMES) CAPTURADOS MEDIANTE LA PESCA ARTESANAL EN ISLA FUERTE, CARIBE COLOMBIANO*
BIOLOGICAL ASPECTS OF THE SHARKS RHIZOPRIONODON LALANDII AND RHIZOPRIONODON POROSUS (CARCHARHINIDAE-CARCHARHINIFORMES) CAPTURED BY ARTISAN FISHING IN ISLA FUERTE, COLOMBIAN CARIBBEAN
Iván Martínez Dallos1, Mayerly Neira Álvarez1 y Arturo Acero P.2
1 Universidad Pedagógica y Tecnológica de Colombia, Facultad de Ciencias. Av. Central del Norte, Tunja, Colombia. ivandallos@yahoo.es (IMD), mayeneira@gmail.com (MNA).
2 Universidad Nacional de Colombia sede Caribe, CECIMAR/INVEMAR, Cerro Punta Betín, Santa Marta, Colombia. aacero@invemar.org.co.
RESUMEN
Se analizaron algunos aspectos biológicos de los tiburones boca zapato Rhizoprionodon lalandii y R. porosus, tales como madurez y segregación sexual, índices biológicos (gonadosomático, hepatosomático y factor de condición) y contenidos estomacales. Entre los meses de septiembre y diciembre de 2007 se realizó un seguimiento de las capturas de estos tiburones a partir de los desembarcos de la pesca artesanal realizada en Isla Fuerte. Se registraron 49 individuos de R. porosus, de los cuales 55 % se clasificó como inmaduros o juveniles, y 39 de R. lalandii, de los cuales 59 % se consideró como individuos inmaduros; se observó una proporción de sexos (machos:hembras) de 9:1 en R. porosus y 1:9 en R. lalandii, dando indicios de una segregación sexual. Asimismo, se determinó una correlación entre el índice gonadosomático y el factor de condición (r= 0.93, p= 0.002, n= 7) para las hembras de R. lalandii estadio 4. Por otra parte, de acuerdo con el índice de importancia relativa, los peces óseos y los camarones son las presas principales dentro del espectro trófico de R. porosus y R. lalandii, respectivamente.
PALABRAS CLAVE: Aspectos biológicos, Rhizoprionodon, Tiburones boca zapato, Pesca artesanal, Caribe colombiano.
ABSTRACT
Some biological aspects of the sharks Rhizoprionodon lalandii (Brazilian sharpnose shark) and R. porosus (Caribbean sharpnose shark), such as maturity and sexual segregation, biological indexes (gonadosomatic index, hepatosomatic index, and condition factor), and stomach contents were studied. Between September and December 2007 a follow-up of the captures of those sharks by the artisan fishing carried on around Isla Fuerte was made. 49 individuals of the Caribbean sharpnose shark were analyzed, 55 % of them immature or juvenile; as well as 39 specimens of the Brazilian sharpnose shark, 59 % of them immature individuals. Rhizoprionondon porosus showed a sex ratio (male:female) 9:1 and R. lalandii 1:9, giving evidence of sexual segregation. A significant correlation exists between the gonadosomatic index and the condition factor (r= 0.93, p= 0.002, n= 7) for the females of the Brazilian sharpnose shark in stage 4 of maturity. On the other hand, in agreement with the index of relative importance, bony fishes and shrimps were the main prey items of R. porosus and R. lalandii, respectively.
KEY WORDS: Biological aspects, Rhizoprionodon, Sharpnose sharks, Artisan fishing, Colombian Caribbean.
INTRODUCCIÓN
El estudio de la biología de las diferentes poblaciones marinas utilizadas como recursos pesqueros es de vital importancia para el diseño de un manejo racional y sostenible de éstas (Pauly, 1983). Los tiburones son organismos muy sensibles al impacto de las pesquerías sobre sus poblaciones, debido a sus características de vida como crecimiento lento, madurez tardía, escasa fecundidad y productividad (Aguilar et al., 2005), lo cual se refleja en la baja sostenibilidad de las pesquerías de estas especies (Stevens et al., 2000).
Por esta razón la FAO en 1999, por solicitud de CITES, generó y adoptó el Plan Internacional de Acción para el Manejo y la Conservación de los Tiburones (IPOA-Sharks) con el objetivo de asegurar la sostenibilidad de estas pesquerías a través del tiempo (FAO, 1999). Igualmente, es compromiso de todos los países que hagan uso de este recurso, construir y ejecutar sus propios planes nacionales de manejo de acuerdo con sus requerimientos y sistemas pesqueros.
En Colombia solo hasta 2010 se terminó de elaborar el Plan de Acción Nacional para la conservación de tiburones rayas y quimeras (Caldas et al., 2010); una de las razones para este retraso es la existencia de grandes vacíos de información acerca de la biología, sistemática, comportamiento, distribución y dinámica pesquera de varias especies de elasmobranquios (Mejía et al., 2007). Para el caso de Isla Fuerte se cuenta con algunos trabajos biológico-pesqueros de tiburones: Orozco (2004), Vishnoff (2008) y Almanza (2009); sin embargo, es necesario continuar con más estudios detallados de cada una de las especies de elasmobranquios registradas para esta área. Dentro de los objetivos específicos del PAN Tiburones Colombia (Caldas et al., 2010) se plantea determinar áreas de reproducción, crianza, migraciones, refugio o zonas naturales que requieren protección especial para la sostenibilidad de las poblaciones de tiburones y rayas de Colombia; este estudio pretende contribuir con dicho objetivo y también con el conocimiento de la biología reproductiva y hábitos alimentarios de Rhizoprionodon porosus y R. lalandii en el Caribe sur colombiano.
ÁREA DE ESTUDIO
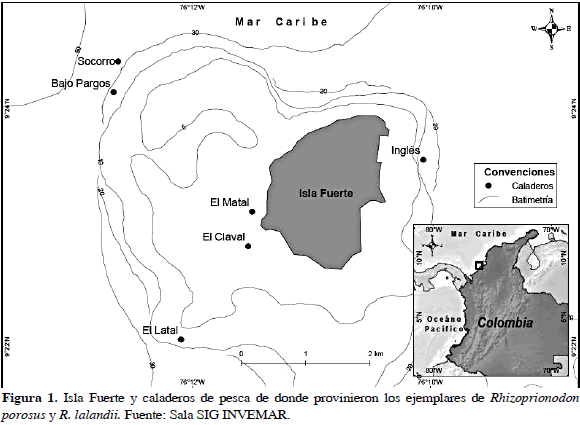
Isla Fuerte se encuentra localizada en el mar Caribe a 11 Km de la costa del departamento de Córdoba, en las coordenadas geográficas: 9º23'11" N y 76º11'51" W. Hace parte de la cadena de islas que conforman la porción sur del golfo de Morrosquillo (Figura 1); la naturaleza geológica de la isla corresponde a una plataforma calcárea levantada, con una superficie insular de 13 Km2, de los cuales sólo 20 % se encuentra emergido (Anderson, 1975).
El clima de la región es semiseco y cálido con un comportamiento pluviométrico anual bimodal de 1300 mm de precipitación total al año, una temperatura promedio anual de 27 °C y vientos predominantes del noreste. La corriente marina (contracorriente del Darién) tiene un componente dominante hacia el noreste, con velocidades de 1 a 3 Km/h. La marea, como a todo lo largo de la costa del Caribe colombiano, es semidiurna con fuerte desigualdad diurna y su amplitud máxima es de 50 cm. La temperatura superficial del mar oscila alrededor de 28 °C, al igual que la salinidad que se mantiene estable alrededor de 36, aunque es probable que el área de Isla Fuerte se vea influenciada durante la época lluviosa por aguas turbias y de salinidad reducida provenientes de las escorrentías continental e insular (Díaz et al., 1996).
MATERIALES Y MÉTODOS
La recolección de datos y muestras se efectuó entre septiembre y diciembre de 2007 a través de las capturas diarias realizadas por los pescadores artesanales de tiburón en la isla. Inicialmente se reconocieron los lugares de desembarco, siendo estos los puntos donde arribaron los pescadores con mayor frecuencia después de sus faenas de pesca. La unidad principal de análisis estuvo constituida por los productos de los desembarcos a partir de palangre y trasmallo. Para cada individuo se tomaron algunos datos morfométricos que usualmente se emplean en estudios de biología pesquera (Laevastu, 1971; Compagno, 1984): longitud total, longitud estándar, longitud del clásper en machos; además se observaron características externas relacionadas con la madurez sexual en los machos como la calcificación y la rotabilidad de los cláspers.
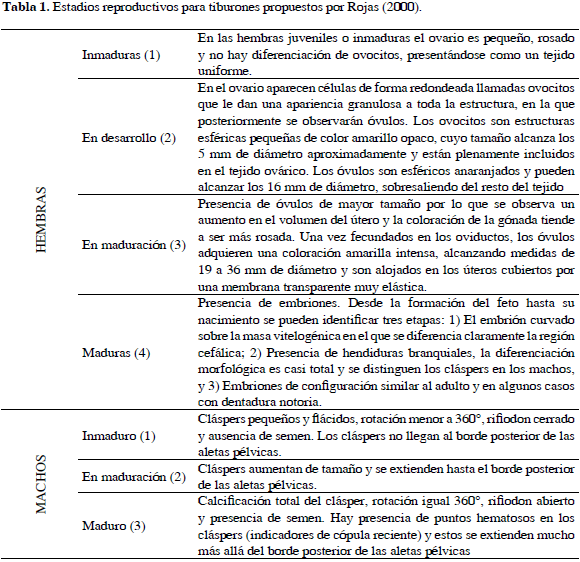
Los estadios reproductivos de los tiburones capturados se establecieron con base en la clasificación de condición reproductiva propuesta por Rojas (2000) (Tabla 1). Después de obtener el peso total y el eviscerado de cada individuo (mediante una balanza tipo reloj de 25 Kg), las vísceras fueron cuidadosamente separadas en bolsas plásticas y rotuladas con el número de cada individuo para posteriormente diseccionar y pesar por separado el estómago (y contenido estomacal), el hígado y las gónadas con la ayuda de una balanza Ohaus con capacidad para 500 g. El Índice Gonadosomático (IGS) (Holden y Raitt, 1975) se determinó a partir de la relación entre el peso de las gónadas respecto al peso total del individuo, de la misma forma el Índice Hepatosomático (IHS) (Maddock y Burton, 1998) relaciona el peso del hígado y el peso total del individuo, y el factor de condición (FK) se obtuvo a partir de la relación entre el peso total y la longitud total del individuo.
Para los contenidos estomacales se establecieron los grados de repleción (vacío, casi vacío, medio lleno y lleno) de acuerdo con Hyslop (1980). Los contenidos potencialmente identificables, es decir aquellos que presentaban aun estructuras diferenciables como piel, músculo y/o huesos, fueron fijados en una solución de formol al 10 %; 10 días después fueron lavados con agua destilada y preservados en etanol al 70 %, para ser identificados en el laboratorio.
Posteriormente en el laboratorio del Museo de Historia Natural de la Universidad Pedagógica y Tecnológica de Colombia, utilizando las claves taxonómicas de Compagno (1984), Cervigón (1992) y Carpenter (2002) se identificaron los contenidos estomacales hasta el menor nivel taxonómico posible. Cada ítem alimentario fue pesado y contado; la dieta se cuantificó usando métodos numéricos como Frecuencia de Ocurrencia (FO), Frecuencia Numérica (FN) y Gravimetría (G) (peso seco), revisados por Hyslop (1980), Pinkas et al. (1991) y Cortés (1997). Para la evaluación de hábitos alimentarios y aspectos tróficos de las dos especies se emplearon índices como el de categorización de presas (ICP), propuesto por Grossman (1995) y modificado por Atencio et al. (2005), el cual utiliza la raíz cuadrada del producto de la frecuencia de ocurrencia (FO) y la frecuencia numérica relativa (FNr) dividida entre el índice de diversidad Shannon-Wiener (H') (utilizando logaritmo base 2) de la dieta de cada especie.
Igualmente se utilizó el índice de importancia relativa (IIR) (Cortés, 1997), el cual relaciona el producto de la suma entre la gravimetría (G) y la frecuencia numérica por la frecuencia de ocurrencia.
Análisis estadístico
Para demostrar estadísticamente la segregación de sexos fue necesaria la utilización de una prueba de chi cuadrado (χ2) con la corrección de continuidad de Yates. Para determinar el grado de asociación entre los índices biológicos (IGS, IHS y FK) se utilizó el coeficiente de correlación de Pearson, que es un estadígrafo que permite establecer la relación entre las puntuaciones de cada variable (Guisande et al., 2005). Cabe aclarar que el coeficiente de correlación de Pearson es una prueba paramétrica que obliga a que la distribución de los datos sea de tipo normal (Steel y Torrie, 1985); en este caso se utilizó la prueba de Kolmogorov-Smirnov para confirmar este tipo de distribución. Por otra parte para establecer la asociación entre los índices biológicos hubo la necesidad de discriminar por sexo y estadio reproductivo. Para realizar estas pruebas estadísticas y las gráficas del manuscrito se utilizó el programa SPSS 10.
RESULTADOS
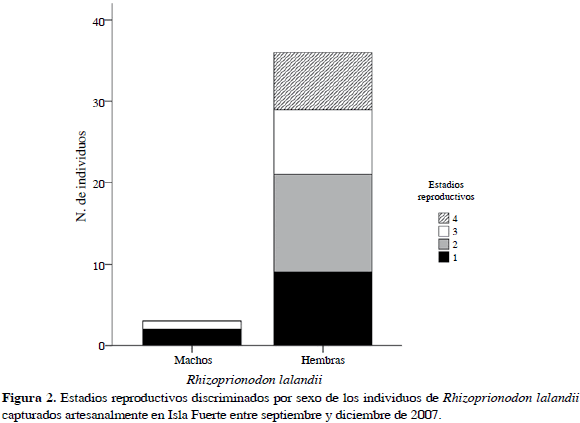
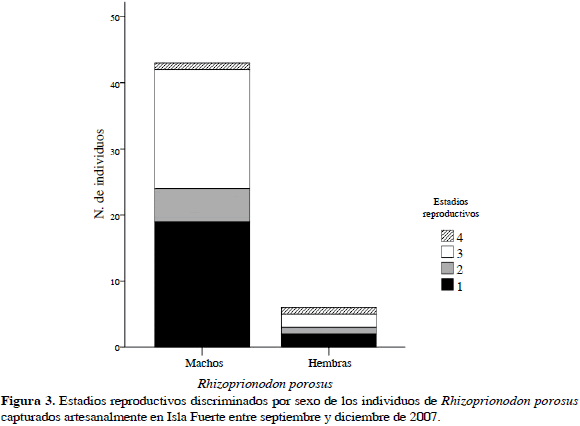
Se muestreó durante 85 días, registrándose 49 individuos de R. porosus (ocho capturados con palangre y 41 con trasmallo) y 39 de R. lalandii (todos capturados con trasmallo) en seis caladeros (Bajo Pargos, Claval, Inglés, Matal, Latal y Socorro) y llevados a cinco puntos de desembarco (Punta Arenas, La Playita, El Claval (Playa), El Matal (Playa) y Punta del Inglés). En la Tabla 2 se muestran las tallas máxima y mínima de los individuos capturados discriminados por sexo y madurez sexual, mostrando a su vez un solapamiento entre las tallas de los individuos maduros e inmaduros. El tiburón R. porosus presentó una proporción sexual machos:hembras de 9:1 que demostró que no existía una distribución homogénea de los sexos en esta especie (x2= 55.79; p< 0.05). El 55 % de los individuos de R. porosus se clasificó como inmaduros o juveniles por estar en estadios 1 y 2 (Rojas, 2000). En contraste, R. lalandii mostró una proporción sexual 1:9 (machos:hembras) con una clara segregación hacia los machos (x2= 55.79; p< 0.05), donde el 59 % se clasificó como individuos inmaduros o juveniles (Rojas, 2000) (Figuras 2 y 3).
Índices biológicos
Debido al corto tiempo de muestreo no se pudieron establecer variaciones temporales de los índices biológicos utilizados (IGS, IHS y FK), por tanto no fue posible tener un acercamiento a los períodos reproductivos; sin embargo se incluyen los valores promedio con fines comparativos para posteriores estudios (Tabla 3). A partir del índice de correlación de Pearson discriminando por sexo y estadio se establecieron niveles de asociación entre los índices. De esta forma las únicas correlaciones significativas fueron para las hembras de R. lalandii entre IGS y FK de estadio 2 (r= 0.89, p <0.001, n= 12) y estadio 4 (r= 0.93, p= 0.0023, n= 7).
Contenidos estomacales
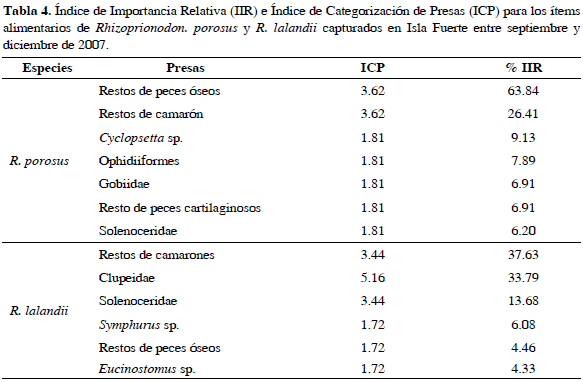
49 % del total de estómagos analizados de R. porosus mostró grado de repleción estomacal vacío, 14 % casi vacío, 22 % medio lleno y 14 % lleno, mientras que para R. lalandii 67 % presentó grado de repleción estomacal vacío, 8 % casi vacío, 20 % medio lleno y 5 % lleno. Se identificaron 10 ítems alimentarios, los contenidos que no se pudieron identificar completamente se agruparon en ítems como restos de peces óseos y restos de camarones. El ítem alimentario más importante para R. porosus fue restos de peces óseos y para R. lalandii fue camarones. Los resultados del ICP (Índice de Categorización de Presas) y el IIR (Índice de Importancia Relativa) se pueden ver en la Tabla 4.
DISCUSIÓN
La proporción machos:hembras en las especies de tiburón muestra un evidente sesgo hacia los machos en R. porosus y hacia las hembras en R. lalandii evidenciando una segregación que puede estar influenciada por fluctuaciones en la disponibilidad de recursos y estadios reproductivos. De acuerdo con Klimley (1987), la segregación de sexos en diferentes áreas geográficas es una característica general de las poblaciones de tiburones, que implica diferencias sexuales en las estrategias comportamentales y en la selección de hábitat. En el caso de R. lalandii, esta segregación está indicando una mayor utilización del área de Isla Fuerte por parte de las hembras, esto, sumado a la presencia de individuos juveniles (estadios 1 y 2) y también grávidos (estadio 3), muestra que posiblemente la isla está actuando como área de parto y guardería para esta especie, dentro del periodo específico en que se realizó el estudio. Andrade et al. (2008) registran una época similar para la presencia de juveniles y hembras grávidas, de la misma forma que Motta et al. (2007) para el Atlántico brasilero. Igualmente, la ausencia de individuos de R. lalandii en los dos primeros meses de muestreo podría sugerir desplazamiento o migración con fines reproductivos. Cabe anotar también, que otra de las características generales de la biología reproductiva de los tiburones es la existencia de áreas bien delimitadas que funcionan como localidades de alumbramiento y cría (Castro, 1993). Sin embargo, no se puede asegurar la funcionalidad de la isla como un área de guardería a menos que se cumplan los tres criterios propuestos por Heupel et al. (2007): 1) Que la abundancia relativa de estos tiburones sea mayor en esta área que en otras, 2) Que tengan tendencia a permanecer o regresar a estas áreas por largos períodos y, 3) Que esta área sea repetidamente utilizada a través de muchos años. Por tanto, es necesario adelantar estudios que abarquen periodos más largos que permitan conocer el papel que cumple la isla en los ciclos de vida de esta especie.
Por el contrario, R. porosus presentó un fuerte dominio de los machos en el área, los cuales podrían estar utilizando la isla, en especial algunos ecosistemas como los manglares, para dos propósitos, de acuerdo con Castro (1993), como área de reproducción de adultos o de alimentación. Aunque la baja frecuencia de hembras en la captura evidencia que posiblemente para esta época el uso dado a la isla fue principalmente con fines de alimentación. Orozco (2004) encontró una segregación similar para esta especie durante los meses de julio a octubre en esta misma área, lo que puede sugerir que este comportamiento se presenta en gran parte del año.
La asociación significativa entre los índices biológicos de las hembras de R. lalandii en el estadio 2 entre IGS y FK puede sugerir que durante este período el aumento del tamaño de las gónadas respecto al tamaño corporal es proporcional, de acuerdo con lo mencionado por Rojas (2000), quien describe que durante este período se inicia la formación de los ovocitos. A su vez, Montealegre (2001) afirma que, como la mayoría de los peces, la tasa de crecimiento de un tiburón es mayor en los estadios juveniles y decrece con el aumento de la edad. En el caso de las hembras grávidas (estadio 4) persiste la correlación positiva entre IGS y FK. En general, estos índices suelen asociarse en forma inversa al grado de madurez; aunque hay que tener cuidado en la interpretación de éstos debido a que para su utilización se hace necesario el cumplimiento de una serie de supuestos de tipo metabólico y fisiológico que no son considerados normalmente, eso sin olvidar además que los tamaños de muestra son bajos. Así mismo, el metabolismo de las especies puede responder de manera diferente a la utilización de la energía en procesos como la reproducción y la alimentación (Chellappa et al., 1995; Caselles y Acero, 1996; Schultz y Conover, 1999).
En relación con los aspectos tróficos, el ICP no mostró considerables diferencias en los valores referentes a la importancia de cada ítem para las dos especies, puesto que en varios casos se repiten valores que impiden el establecimiento de un orden de importancia en el espectro trófico de estos tiburones. Debido a esto fue necesaria la utilización del IIR de Pinkas et al. (1971). Teniendo en cuenta el IIR, RPO (restos de peces óseos) fue el ítem más importante dentro del espectro trófico de R. porosus. Asimismo, de los siete ítems alimentarios identificados para esta especie cuatro pertenecen al grupo de los peces óseos, lo cual contrasta con lo registrado por Gómez y Bashirulah (1984) quienes mencionan que la presa más importante dentro del espectro trófico de R. porosus son los crustáceos en el Atlántico de Venezuela, teniendo en cuenta las frecuencias de ocurrencia y en número. Sin embargo, al igual que para este trabajo, Compagno (1984) afirma que para esta especie la mayoría de ítems alimentarios son pequeños peces óseos, lo que se traduce en un nivel trófico de 3.8, que lo ubica como un consumidor de segundo orden conforme a las dietas estandarizadas para tiburones propuestas por Cortés (1999).
Actualmente existen pocos estudios realizados sobre la biología y hábitos tróficos de R. lalandii, siendo catalogada por IUCN como especie con datos deficientes (DD; Rosa et al., 2004), razón por la cual no fue posible establecer comparaciones con otros trabajos. No obstante, de acuerdo con Compagno (1984), esta especie se alimenta principalmente de peces óseos, camarones y cefalópodos, lo cual se ajusta a los valores encontrados en el presente trabajo.
AGRADECIMIENTOS
Agradecemos a la comunidad isleña por permitirnos llevar a cabo esta investigación, por su apoyo incondicional y eficiente. Así mismo expresamos gratitud a Dairon Gil por la asesoría del análisis de datos estadísticos y por las sugerencias.
BIBLIOGRAFÍA
1 Aguilar, F., X. Chalen y C. Villon. 2005. Plan de acción nacional de tiburones. Proceso de investigación recursos bioacuáticos y ambiente. Instituto Nacional de Pesca, Quito. 18 p. [ Links ]
2 Almanza, M. 2009. Caracterización de la pesca artesanal de peces cartilaginosos, con énfasis en sus aspectos tróficos y reproductivos en Isla Fuerte, Caribe Colombiano (Agosto 2007-Febrero 2008). Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Bogotá. 98 p. [ Links ]
3 Anderson, P. 1975. Isla Fuerte. Colombia Geográfica, 5 (2): 119-191. [ Links ]
4 Andrade, A. C., L. C. Silva-Junior y M. Vianna. 2008. Reproductive biology and population variables of the Brazilian sharpnose shark Rhizoprionodon lalandii (Müller and Henle, 1839) captured in coastal waters of south-eastern Brazil. J. Fish. Biol., 73: 473-484. [ Links ]
5 Atencio, V., E. Kerguelén., E. Cura., L. Rosado., A. Vallejo y M. Valderrama. 2005. Régimen alimentario de siete especies ícticas en el embalse de la hidroeléctrica Urrá (Córdoba, Colombia). Rev. Med. Veter. Zootec., 10: 614-622. [ Links ]
6 Caldas, J. P., E. Castro-González, V. Puentes, M. Rueda, C. Lasso, L. O. Duarte, M. Grijalba-Bendeck, F. Gómez, A. F. Navia, P. A. Mejía-Falla, S. Bessudo, M. C. Diazgranados y L. A. Zapata Padilla (Eds.). 2010. Plan de Acción Nacional para la conservación y manejo de tiburones, rayas y quimeras de Colombia (PAN-Tiburones Colombia). Instituto Colombiano Agropecuario, Secretaria Agricultura y Pesca San Andrés Isla, Ministerio de Ambiente, Vivienda y Desarrollo Territorial, Instituto de Investigaciones Marinas y Costeras, Instituto Alexander Von Humboldt, Universidad del Magdalena, Universidad Jorge Tadeo Lozano, Pontificia Universidad Javeriana, Fundación SQUALUS, Fundación Malpelo y otros Ecosistemas Marinos, Conservación Internacional, WWF Colombia. Editorial Produmedios, Bogotá. 60 p. [ Links ]
7 Carpenter, K. 2002. The living marine resources of the western central Atlantic. Bony fishes part 2 (Opistognathidae to Molidae), sea turtles and marine mammals. FAO species identification guide for fishery purposes. American Society of Ichthyologists and Herpetologists Special Publication No. 5., Vols 1-3. FAO, Roma. 2127 p. [ Links ]
8 Caselles, A. y A. Acero P. 1996. Reproducción de Anchovia clupeoides y Anchoa parva (Pisces: Engraulidae) en dos ciénagas del Caribe colombiano. Rev. Biol. Trop., 44 (2): 781-793. [ Links ]
9 Castro, J. 1993. The shark nursery of Bulls Bay, South Carolina, with a review of the shark nurseries of the southeastern coast of the United States. Environ. Biol. Fish., 38: 37-48. [ Links ]
10 Cervigón, F. 1992. Guía de campo de las especies marinas y de aguas salobres de la costa septentrional de sur América. FAO, Roma. 513 p. [ Links ]
11 Chellappa, S., F. A. Huntingford, R. H. C. Strang y R. Y. Thomson. 1995. Condition factor and hepatosomatic index as estimates of energy status in male three-spined stickleback. J. Fish Biol., 47: 775-787. [ Links ]
12 Compagno, L. J. V. 1984. FAO Species Catalogue. Sharks of the world. An annotated and illustrated catalogue of shark species known to date. Part 1 Bullhead, mackerel and carpet sharks Heterodontiformes, Lamniformes and Orectolobiformes. FAO Fish. Synop., 2: 269 p. [ Links ]
13 Cortés, E. 1997. A critical review of methods of studying fish feeding based on analysis of stomach contents: application to elasmobranch fishes. Can. J. Fish. Aquat. Sci., 54: 726-738. [ Links ]
14 Cortés, E. 1999. Standardized diet composition and trophic levels of sharks. ICES J. Mar. Sci., 56: 707-717. [ Links ]
15 Díaz, J. M., A. Sánchez y G. Díaz Pulido. 1996. Geomorfología y formaciones arrecifales recientes de Isla Fuerte y bajo Bushnell, plataforma continental del Caribe colombiano. Bol. Invest. Mar. Cost., 25: 87-105. [ Links ]
16 FAO. 1999. International Plan of Action for reducing incidental catch of seabirds in longline fisheries. International Plan of Action for the conservation and management of sharks. International Plan of Action for the management of fishing capacity. FAO, Roma. 26 p. [ Links ]
17 Gómez, F. E y A. K. M. Bashirulah. 1984. Relación longitud-peso y hábitos alimenticios de Rhizoprionodon porosus Poey 1861 (Fam. Carcharhinidae) en el oriente de Venezuela. Bol. Inst. Oceanogr. Univ. Oriente, 23: 49-54. [ Links ]
18 Grossman F. 1995. Variación estacional en la dieta del pejerrey (Odontesthes bonariensis). Rev. Asoc. Cienc. Nat. Litoral, 26: 9-18. [ Links ]
19 Guisande, C., A Barreiro, I. Maneiro, I. Riveiro y A. Vergara. 2005. Tratamiento de datos. Univ. Vigo, Vigo, España. 277 p. [ Links ]
20 Heupel, M., J. Carlson y C. Simpfendorfer. 2007. Shark nursery areas: concepts, definition, characterization and assumptions. Mar. Ecol. Prog. Ser., 337: 287-297. [ Links ]
21 Holden, M. y D. Raitt. 1975. Manual de ciencia pesquera. Parte 2. Métodos para investigar los recursos y su aplicación. Doc. Técn. FAO, 115: 214 p. [ Links ]
22 Hyslop, E. 1980. Stomach contents analysis: A review of methods and their application. J. Fish. Biol., 17: 411-429. [ Links ]
23 Klimley, A. 1987. The determinants of sexual segregation in the scalloped hammerhead shark, Sphyrna lewini. Environ. Biol. Fish., 18: 27-40. [ Links ]
24 Laevastu, T. 1971. Manual de métodos de biología pesquera. Acribia, Zaragoza, España. 243 p. [ Links ]
25 Maddock, D. y M. Burton. 1998. Gross and histological of ovarian development and related condition change in American plaice. J. Fish. Biol., 53: 928-944. [ Links ]
26 Mejía, P. A., A. F. Navia., L. M. Mejía, A. Acero P. y E. A. Rubio. 2007. Tiburones y rayas de Colombia (Pisces: Elasmobranchii): Lista actualizada, revisada y comentada. Bol. Invest. Mar. Cost., 36: 111-149. [ Links ]
27 Montealegre, S. 2001. Introducción al estudio de la biología y el comportamiento de los tiburones. Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 235 p. [ Links ]
28 Motta, F. S., R. C. Namora, O. B. F. Gadig y F. M. S. Braga. 2007. Reproductive biology of the Brazilian sharpnose shark (Rhizoprionodon lalandii) from southeastern Brazil. ICES J. Mar. Sci., 64: 1829-1835. [ Links ]
29 Orozco, D. 2004. Estudio biológico-pesquero de las especies de tiburones capturadas artesanalmente en Isla Fuerte, Caribe colombiano. Tesis Biol., Pontificia Univ. Javeriana, Bogotá. 93 p. [ Links ]
30 Pauly, D. 1983. Algunos métodos simples para la evaluación de recursos pesqueros tropicales. FAO. Doc. Técn. Pesca., 234: 49 p. [ Links ]
31 Pinkas, L. M., S. Oliphant y I. L. K. Iverson. 1971. Food habits of albacore, bluefin tuna and bonito in Californian waters. Calif. Fish Game., 152: 1-105. [ Links ]
32 Rojas, P. A. 2000. Contribución al conocimiento biológico de Mustelus lunulatus, un recurso pesquero potencial en el Pacífico colombiano. Trabajo de Grado Biol., Univ. Valle, Cali. 46 p. [ Links ]
33 Rosa, R. S., O. B. F. Gadig., F. S. Motta y R. C. Namora. 2004. Rhizoprionodon lalandii. http://www.iucnredlist.org/. 17/06/2008. [ Links ]
34 Schultz, E. y D. Conover. 1999. The allometry of energy reserve depletion: test of a mechanism for sizedependent winter mortality. Oecologia, 119: 474-483. [ Links ]
35 Steel, R. y J. Torrie. 1985. Bioestadística. Principios y procedimientos. MacGraw Hill, Bogotá. 622 p. [ Links ]
36 Stevens, J. D., R. Bonfil, N. K. Dulvy y P. A. Walker. 2000. The effects of fishing on sharks, rays, and chimaeras (Chondrichthyes), and the implications for marine ecosystems. J. Mar. Sci., 57: 476-494. [ Links ]
37 Vishnoff, I. 2008. Conocimiento de la biología reproductiva de algunos carcharhínidos a través de las actividades de la pesca artesanal en Isla Fuerte, Caribe colombiano (2006-2007). Trabajo grado Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 86 p. [ Links ]
FECHA DE RECEPCIÓN: 04/02/2009 FECHA DE ACEPTACIÓN: 29/03/2012
*Contribución No. 371 del Centro de Estudios en Ciencias del Mar-CECIMAR, Universidad Nacional de Colombia sede Caribe.